ГОСТ 34104-2017
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
КОРМА И КОРМОВЫЕ ДОБАВКИ
Метод идентификации генетически модифицированных линий сои, кукурузы и рапса с использованием ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени
Feed and feed additives. Method of identification of genetically modified events of soybean, maize and rapeseed using PCR with hybridization-fluorescence detection in real time
МКС 65.120
Дата введения 2018-07-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 1 июня 2017 г. N 51)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 28 июня 2017 г. N 593-ст межгосударственный стандарт ГОСТ 34104-2017 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2018 г.
5 ВВЕДЕН ВПЕРВЫЕ
6 ПЕРЕИЗДАНИЕ. Май 2020 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
1 Область применения
Настоящий стандарт распространяется на корма: фуражное зерно, продукты его переработки; растительные корма; комбикорма для продуктивных и непродуктивных животных и сырье для их производства; кормовые добавки и устанавливает метод идентификации генно-модифицированной сои (далее - ГМ сои), генно-модифицированной кукурузы (далее - ГМ кукурузы) и генно-модифицированного рапса (далее - ГМ рапса) методом полимеразной цепной реакции (далее - ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени (Real Time PCR).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.0.004 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ 12.4.009 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ ISO 6497 Корма. Отбор проб
ГОСТ ISO 7218 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ ISO/IEC 17025 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 24760 Халаты медицинские женские. Технические условия
ГОСТ 25194 Халаты медицинские мужские. Технические условия
ГОСТ 26678 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
ГОСТ 31719-2012 Продукты пищевые и корма. Экспресс-метод определения сырьевого состава (молекулярный)
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации (www.easc.by) или по указателям национальных стандартов, издаваемым в государствах, указанных в предисловии, или на официальных сайтах соответствующих национальных органов по стандартизации. Если на документ дана недатированная ссылка, то следует использовать документ, действующий на текущий момент, с учетом всех внесенных в него изменений. Если заменен ссылочный документ, на который дана датированная ссылка, то следует использовать указанную версию этого документа. Если после принятия настоящего стандарта в ссылочный документ, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение применяется без учета данного изменения. Если ссылочный документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 амплификация: Процесс, многократно увеличивающий число копий фрагмента генома какого-либо организма.
3.2 генно-модифицированные (генно-инженерные, трансгенные) организмы; ГМО: Организм или несколько организмов, любое неклеточное, одноклеточное или многоклеточное образование, способные к воспроизводству или передаче наследственного генетического материала, отличные от природных организмов, полученные с применением методов генной инженерии и/или содержащие генно-инженерный материал, в том числе гены, их фрагменты или комбинации генов.
3.3 линия генно-модифицированного растения (генетически модифицированная линия, ГМ линия): Потомство от одного определенного генно-инженерно-модифицированного организма.
3.4 нуклеиновые кислоты; НК: Макромолекулы, являющиеся носителями генетической информации или выступающие в качестве посредника при синтезе полипептидной цепи.
3.5 нуклеотидная последовательность: Порядок чередования нуклеотидных остатков в НК.
3.6 отрицательный контроль ПЦР; К-: Реакционная смесь для проведения ПЦР, заведомо не содержащая целевой нуклеиновый материал.
3.7 отрицательный контроль выделения (контроль чистоты выделения); КВ: Контроль, прошедший все этапы выделения ДНК, но в отсутствие анализируемой пробы.
3.8 отрицательный контрольный образец; ОКО: Реакционная смесь, используемая вместо анализируемой пробы для контроля чистоты выделения ДНК.
3.9 полимеразная цепная реакция; ПЦР: Циклический ферментативный процесс, результатом которого является получение многочисленных копий определенного участка молекулы ДНК.
3.10 положительный контроль ПЦР; К+: Реакционная смесь для проведения ПЦР, заведомо содержащая целевой нуклеиновый материал.
3.11 полимеразная цепная реакция в режиме реального времени: Полимеразная цепная реакция, проводимая по специальной технологии, которая позволяет регистрировать накопление ПЦР-продуктов в процессе амплификации.
3.12 ПЦР-продукт: Фрагмент ДНК, амплифицированный в ПЦР.
3.13 праймер: Искусственно синтезируемая короткая последовательность нуклеотидов, комплементарная определенному участку целевой ДНК, используемая в полимеразной цепной реакции.
3.14 промотор: Последовательность нуклеотидов в молекуле ДНК, ответственная за начало транскрипции.
3.15 пороговый цикл Ct: Цикл амплификации, в котором кривая флуоресценции исследуемого образца пересекает линию порога (Threshold).
3.16 терминатор: Последовательность нуклеотидов в молекуле ДНК, ответственная за прекращение транскрипции.
3.17 целевая ДНК: Выбранная для амплификации последовательность ДНК.
3.18 экстракция ДНК: Обработка анализируемой пробы, высвобождающая ДНК.
3.19 элюция: Извлечение вещества из твердого носителя вымыванием подходящим растворителем.
4 Условия выполнения исследований и требования безопасности
4.1 Условия выполнения исследований
4.1.1 Общие требования к помещениям - по ГОСТ ISO 7218, ГОСТ ISO/IEC 17025, ГОСТ 31719 (приложение А).
4.1.2 Требования к персоналу - по ГОСТ ISO 7218 и ГОСТ ISO/IEC 17025.
4.2 Требования безопасности
4.2.1 В лаборатории должно быть организовано обучение персонала безопасности труда в соответствии с ГОСТ 12.0.004.
4.2.2 При работе с химическими реактивами необходимо соблюдать общие требования безопасности обращения с вредными веществами, установленные ГОСТ 12.1.007.
4.2.3 Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
4.2.4 При работе с электроустановками следует соблюдать требования электробезопасности, установленные в ГОСТ 12.1.019.
4.2.5 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004, должно быть оснащено средствами пожаротушения по ГОСТ 12.4.009.
5 Оборудование, материалы, реагенты
5.1 Общие требования к оборудованию - по ISO/IEC 17025*.
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
5.2 При проведении испытаний применяют оборудование и материалы по ГОСТ 31719, с дополнением:
- бокс ламинарный, класс биологической безопасности II тип А2;
- термостат, обеспечивающий температуру нагрева до 100°C;
- отсасыватель вакуумный медицинский с колбой-ловушкой для удаления надосадочной жидкости;
- центрифуга для микропробирок вместимостью 1,5 см, со скоростью вращения не менее 12000 об/мин;
- миницентрифуги-встряхиватели с роторами для микропробирок вместимостью 0,2; 0,6 и 1,5 см, со скоростью вращения не менее 2400 об/мин;
- микропробирки одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся вместимостью 1,5 см;
- микропробирки одноразовые полипропиленовые вместимостью 0,2 см;
- одноразовые наконечники для дозаторов переменного объема с аэрозольным барьером объемом 10 мм, 100 мм
, 200 мм
, 1000 мм
;
- ПЦР-бокс;
- прибор для проведения полимеразной цепной реакции в режиме реального времени*;
________________
* Прибор для проведения ПЦР "Rotor-Gene" 2000/3000/6000 ("Corbett Research", Австралия), "Rotor Gene Q" ("Qiagen", Германия). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
- халаты медицинские по ГОСТ 24760 и ГОСТ 25194;
- холодильник бытовой электрический по ГОСТ 26678, обеспечивающий поддержание температуры от 2°C до 8°C, с морозильной камерой, обеспечивающей поддержание температуры не выше минус 16°C.
Допускается использование другого оборудования, материалов с техническими характеристиками не ниже указанных.
Допускается использование роботизированных станций для пробоподготовки, выделения дезоксирибонуклеиновой кислоты (ДНК) и раскапывания готовой многокомпонентной смеси для ПЦР.
5.3 При проведении испытаний применяют реагенты для экстракции ДНК, реагенты, праймеры и зонды для проведения ПЦР и амплификации. Для экстракции ДНК допускается использовать готовые наборы*.
________________
* Примером могут служить наборы "ДНК-СОРБ-С" (ФГБУН ЦНИИ Эпидемиологии Роспотребнадзора, форма 1 ref К1-6-50/ver. 05/08/16), "Сорб-ГМО-А" и "Сорб-ГМО-Б" (ЗАО "Синтол", каталожный номер GM-503). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
5.3.1 Реагенты:
а) набор реагентов для экстракции ДНК, включающий:
1) буфер для лизирующего реагента, содержащий хаотропный агент гуанидин хлорид;
2) лизирующий реагент, содержащий протеиназу К;
3) раствор для отмывки N 1 для очистки от клеточных белков, содержащий хаотропный агент гуанидин тиоцианат;
4) раствор для отмывки N 2 для очистки от солей, содержащий водный раствор изопропилового спирта;
5) сорбент (25%-ная взвесь частиц силикагеля SiO размером от 20 до 50 мкм в растворе Трис-HCI молярной концентрации 5 ммоль/дм
);
6) буфер для элюции ДНК (ТЕ-буфер) - Трис-HCI молярной концентрации 10 ммоль/дм; натриевая соль этилендиаминтетрауксусной кислоты молярной концентрации 1 ммоль/дм
;
б) вода деионизированная, класса чистоты I, свободная от рибонуклеаз, дезоксирибонуклеаз, неорганических и органических примесей с удельным сопротивлением не менее 18 Мом·см;
в) ПЦР-буферс MgCl;
г) смесь олигонуклеотидов (праймеры) по 5.3.2 или 5.3.3;
д) смесь олигонуклеотидов (зонды, меченные флуоресцентными красителями FAM и R6G) по 5.3.2 или 5.3.3;
е) раствор дезоксинуклеозидтрифосфатов (дНТФ), содержащий натриевые соли дНТФ со степенью очистки более 98% и концентрацией каждой 2 моль/дм;
ж) термостабильная Taq-полимераза;
и) сертифицированные стандартные образцы ГМ линий сои, ГМ линий кукурузы или ГМ линий рапса*.
________________
* Сертифицированные стандартные образцы производства IRMM, Бельгия; AOCS, США (материалы, состоящие из высушенной гомогенизированной муки соевых бобов, рапса или кукурузы, включающих смеси ГМ и не ГМ растений соответствующих видов, содержащие от 0,1% до 100% генетически модифицированных материалов). Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
Допускается использование других реагентов с техническими характеристиками не хуже указанных.
5.3.2 Для выявления фрагментов видоспецифичной ДНК растений допускается использование наборов реагентов (готовых тест-систем), содержащих праймеры, специфичные к ДНК определенного вида растений.
5.3.3 Допускается использование синтезированных олигонуклеотидных праймеров и зондов для идентификации ГМ линий сои, кукурузы и рапса. Список последовательностей всех используемых олигонуклеотидов приведен в таблицах 1-3, где указаны последовательности:
1) для прямых и обратных праймеров и зондов***, специфичных конкретной ГМ линии;
________________
*** Маркировки в наименовании: "F" - прямой праймер, "R" - обратный праймер, "P" - зонд.
2) прямых и обратных праймеров и зондов, специфичных фрагменту генома растения (ген лектина для сои, ген зеина для кукурузы, ген круциферина A для рапса).
Таблица 1 - Последовательности олигонуклеотидных праймеров и зондов для идентификации ГМ линий сои
Линия ГМ сои | Последова- | Наименование | 5'-3' последовательность |
40-3-2 | Целевая | 40-3-2F | GCCATGTTGTTAATTTGTGCCAT |
40-3-2R | GAAGTTCATTTCATTTGGAGAGGAC | ||
40-3-2P | FAM-CTTGAAAGATCTGCTAGAGTCAGCTTGTCAGCG-BHQ1 | ||
Растительная | Lec40-3-2F | TCCACCCCCATCCACATTT | |
Lec40-3-2R | GGCATAGAAGGTGAAGTTGAAGGA | ||
Lec40-3-2P | R6G-AACCGGTAGCGTTGCCAGCTTCG-BHQ1 | ||
А5547-127 | Целевая | A5547F | GCTATTTGGTGGCATTTTTCCA |
A5547R | CACTGCGGCCAACTTACTTCT | ||
А5547Р | FAM-CCGCAATGTCATACCGTCATCGTTGT-BHQ1 | ||
Растительная | LecA5547F | CTTTCTCGCACCAATTGACA | |
LecA5547R | TCAAACTCAACAGCGACGAC | ||
LecA5547P | R6G-CCACAAACACATGCAGGTTATCTTGG-BHQ1 | ||
А2704-12 | Целевая | A2704F | GCAAAAAAGCGGTTAGCTCCT |
A2704R | ATTCAGGCTGCGCAACTGTT | ||
А2704Р | FAM-CGGTCCTCCGATCGCCCTTCC-BHQ1 | ||
Растительная | LecA2704F | CACCTTTCTCGCACCAATTGACA | |
LecA2704R | TCAAACTCAACAGCGACGAC | ||
LecA2704P | R6G-CCACAAACACATGCAGGTTATCTTGG-BHQ1 | ||
MON89788 | Целевая | MON89788F | TCCCGCTCTAGCGCTTCAAT |
MON89788R | TCCCGCTCTAGCGCTTCAA | ||
MON89788P | FAM-CTGAAGGCGGGAAACGACAATCTG-BHQ1 | ||
Растительная | LecMON89788F | CCAGCTTCGCCGCTTCCTTC | |
LecMON89788R | GAAGGCAAGCCCATCTGCAAGCC | ||
LecMON89788P | R6G-CTTCACCTTCTATGCCCCTGACAC-BHQ1 | ||
MON87701 | Целевая | MON87701F | TGGTGATATGAAGATACATGCTTAGCAT |
MON87701R | CGTTTCCCGCCTTCAGTTTAAA | ||
MON87701P | FAM-TCAGTGTTTGACACACACACTAAGCGTGCC-BHQ1 | ||
Растительная | Lec87701F | CCAGCTTCGCCGCTTCCTTC | |
Lec87701R | GAAGGCAAGCCCATCTGCAAGCC | ||
Lec87701P | R6G-CTTCACCTTCTATGCCCCTGACAC-BHQ1 | ||
BPS-CV127-9 | Целевая | BPSF | AACAGAAGTTTCCGTTGAGCTTTAAGAC |
BPSR | CATTCGTAGCTCGGATCGTGTAC | ||
BPSP | FAM-TTTGGGGAAGCTGTCCCATGCCC-BHQ1 | ||
Растительная | LecBPSF | CCAGCTTCGCCGCTTCCTTC | |
LecBPSR | GAAGGCAAGCCCATCTGCAAGCC | ||
LecBPSP | R6G-CTTCACCTTCTATGCCCCTGACAC-BHQ1 | ||
SYHTOH2 | Целевая | SyhF | GGGAATTGGGTACCATGCC |
SyhR | TGTGTGCCATTGGTTTAGGGT | ||
SyhP | FAM-CCAGCATGGCCGTATCCGCAA-BHQ1 | ||
Растительная | LecSyhF | CCAGCTTCGCCGCTTCCTTC | |
LecSyhR | GAAGGCAAGCCCATCTGCAAGCC | ||
LecSyhP | R6G-CTTCACCTTCTATGCCCCTGACAC-BHQ1 | ||
FG72 | Целевая | FG72F | AGATTTGATCGGGCTGCAGG |
FG72R | GCACGTATTGATGACCGCATTA | ||
FG72P | FAM-AATGTGGTTCATCCGTCTTTTTTG-BHQ1 | ||
Растительная | LecFG72F | CTTTCTCGCACCAATTGACA | |
LecFG72R | TCAAACTCAACAGCGACGAC | ||
LecFG72P | R6G-CCACAAACACATGCAGGTTATCTTGG-BHQ1 | ||
DP-305423 | Целевая | 305423F | CGTGTTCTCTTTTTGGCTAGC |
305423R | GTGACCAATGAATACATAACACAAACTA | ||
305423P | FAM-TGACACAAATGATTTTCATACAAAAGTCGAGA-BHQ1 | ||
DP-305423 | Растительная | Lec305423F | CCAGCTTCGCCGCTTCCTTC |
Lec305423R | GAAGGCAAGCCCATCTGCAAGCC | ||
Lec305423P | R6G-CTTCACCTTCTATGCCCCTGACAC-BHQ1 | ||
DP-356043 | Целевая | 356043F | GTCGAATAGGCTAGGTTTACGAAAAA |
356043R | TTTGATATTCTTGGAGTAGACGAGAGTGT | ||
356043Р | FAM-CTCTAGAGATCCGTCAACATGGTGGAGCAC-BHQ1 | ||
Растительная | Lec356043F | CCAGCTTCGCCGCTTCCTTC | |
Lec356043R | GAAGGCAAGCCCATCTGCAAGCC | ||
Lec356043P | R6G-CTTCACCTTCTATGCCCCTGACAC-BHQ1 | ||
MON87705 | Целевая | Mon87705F | TTCCCGGACATGAAGCCATTTAC |
Mon87705R | ACAACGGTGCCTTGGCCCAAAG | ||
Mon87705P | FAM-AAGAGACTCAGGGTGTTGTTATCACTGCGG-BHQ1 | ||
Растительная | LecMon87705F | CCAGCTTCGCCGCTTCCTTC | |
LecMon87705R | GAAGGCAAGCCCATCTGCAAGCC | ||
LecMon87705P | R6G-CTTCACCTTCTATGCCCCTGACAC-BHQ1 | ||
MON87708 | Целевая | Mon87708F | TCATACTCATTGCTGATCCATGTAG |
Mon87708R | AGAACAAATTAACGAAAAGACAGAACG | ||
Mon87708P | FAM-TCCCGGACTTTAGCTCAAAATGCATGTA-BHQ1 | ||
Растительная | LecMon87708F | CCAGCTTCGCCGCTTCCTTC | |
LecMon87708R | GAAGGCAAGCCCATCTGCAAGCC | ||
LecMon87708P | R6G-CTTCACCTTCTATGCCCCTGACAC-BHQ1 | ||
MON87769 | Целевая | Mon87769F | CATACTCATTGCTGATCCATGTAGATT |
Mon87769R | GCAAGTTGCTCGTGAAGTTTTG | ||
Mon87769P | FAM-CCCGGACATGAAGCCATTTACAATTGAC-BHQ1 | ||
Растительная | LecMon87769F | CCAGCTTCGCCGCTTCCTTC | |
LecMon87769R | GAAGGCAAGCCCATCTGCAAGCC | ||
LecMon87769P | R6G-CTTCACCTTCTATGCCCCTGACAC-BHQ1 | ||
DAS-44406 | Целевая | DAS-44406F | TTA TTG TTC TTG TTG TTT CCT CTT TAG G |
DAS-44406R | CCT CAA TTG CGA GCT TTC TAA TTT | ||
DAS-44406P | FAM-ATT CGG ACC TCC ATG ATG ACC TTA CCG TT-BHQ1 | ||
Растительная | LecDAS-44406F | CCA GCT TCG CCG CTT CCT TC | |
LecDAS-44406R | GAA GGC AAG CCC АТС TGC AAG CC | ||
LecDAS-44406P | FAM-CTT CAC CTT СТА TGC CCC TGA CAC-BHQ1 | ||
DAS-81419 | Целевая | DAS 81419F | TCT AGC СТА TAT TTA GCA CTT GAT ATT CAT |
DAS 81419R | GCT TCA AGA TCC CAA CTT GCG | ||
DAS 81419P | FAM-ATC AAC AGG CAC CGA TGC GCA CCG-BHQ1 | ||
DAS-81419 | Растительная | Lec DAS81419F | CCA GCT TCG CCG CTT CCT TC |
LecDAS81419R | GAA GGC AAG CCC АТС TGC AAG CC | ||
LecDAS81419P | FAM-CTT CAC CTT СТА TGC CCC TGA CAC-BHQ1 | ||
DAS-68416 | Целевая | DAS 68416F | GTA CAT TAA AAA CGT CCG CAA TGT GT |
DAS 68416R | GTT TAA GAA TTA GTT CTT АСА GTT TAT TGT TAG | ||
DAS 68416P | FAM-TTA AGT TGTCTA AGC GTC AAT A-MGBNFQ | ||
Растительная | LecDAS68416F | CCA GCT TCG CCG CTT CCT TC | |
LecDAS68416R | GAA GGC AAG CCC АТС TGC AAG CC | ||
LecDAS68416P | FAM-CTT CAC CTT СТА TGC CCC TGA CAC- BHQ1 |
Таблица 2 - Последовательности олигонуклеотидных праймеров и зондов для идентификации ГМ линий кукурузы
Линия ГМ кукурузы | Последова- | Наименование | 5'-3' последовательность |
GA21 | Целевая | GA21 F | CTT ATC GTT ATG CTA TTT GCA ACT TTA GA |
GA21 R | TGG CTC GCG ATС СTС СT | ||
GA21 P | FAM-CAT ATA СTA ACT CAT ATС TСT TTС TСA AСA GCA GGT GGG T-BHQ1 | ||
Растительная | Adh GA21 F | CCA GCC TСA TGG CCA AAG | |
Adh GA21 R | CCT TCT TGG CGG CTT ATС TG | ||
Adh GA21 P | R6G-CTT AGG GGC AGA CTC CCG TGT TСС CT-BHQ1 | ||
MON810 | Целевая | Mon810 F | TCG AAG GAC GAA GGA CTC TAA CGT |
Mon810 R | GCC ACC TTС CTT TTC CAC TAT CTT | ||
Mon810 P | FAM-AAC ATС CTT TGC CAT TGC CCA GC-BHQ1 | ||
Растительная | Hmg Mon810 F | TTG GAC TAG AAA TCT CGT GCT GA | |
Hmg Mon810 R | GCT AСA TAG GGA GCC TTG TСС T | ||
Hmg Mon810 P | R6G- CAA TСС AСA CAA ACG CAC GCG TA-BHQ1 | ||
MON89034 | Целевая | Mon89034 F | TTC TCC ATA TTG ACC ATС ATA CTC ATT |
Mon89034 R | CGG TAT СTA TAA TAC CGT GGT TTT TAA A | ||
Mon89034 P | FAM-ATCCCCGGAAATTATGTT-MGBNFQ | ||
Растительная | Hmg Mon89034 F | TTG GAC TAG AAA TCT CGT GCT GA | |
Hmg Mon89034 R | GCT AСA TAG GGA GCC TTG TСС T | ||
Hmg Mon89034 P | R6G-CAA TСС AСA CAA ACG CAC GCG TA-BHQ1 | ||
NK603 | Целевая | NK603 F | ATG AAT GAC CTC GAG TAA GCT TGT TAA |
NK603 R | AAG AGA TAA CAG GAT CCA CTC AAA CAC T | ||
NK603 P | FAM-TGG TAC CAC GCG AСA CAC TTC CAC TC-BHQ1 | ||
Растительная | Agh NK603 F | CCA GCC TCA TGG CCA AAG | |
Agh NK603 R | CCT TCT TGG CGG CTT ATС TG | ||
Agh NK603 P | R6G-CTT AGG GGC AGA CTC CCG TGT TСС CT-BHQ1 | ||
Bt11 | Целевая | Bt11 F | GCG GAA CCC СTA TTT GTT TA |
Bt11 R | TCC AAG AAT CCC TCC ATG AG | ||
Bt11 P | FAM-AAA TAC ATT CAA ATA TGT ATС CGC TCA-BHQ1 | ||
Растительная | Adh Bt11 F | CGT CGT TTC CCA TCT CTT CCT CC | |
Adh Bt11 R | CCA CTC CGA GAC CCT CAG TC | ||
Adh Bt11 P | R6G-AAT CAG GGC TCA TTT TCT CGC TCC TCA -BHQ1 | ||
Т25 | Целевая | T25 F | AСA AGC GTG TCG TGC TCC AC |
T25 R | GAC ATG ATA CTC CTT CCA CCG | ||
T25 P | FAM-TCA TTG AGT CGT TCC GCC ATT GTC G-BHQ1 | ||
Растительная | Adh T25 F | CGT CGT TTC CCA TCT CTT CCT CCT | |
Adh T25 R | CCA CTC CGA GAC CCT CAG TC | ||
Adh T25 P | R6G-AAT CAG GGC TCA TTT TCT CGC TCC TCA-BHQ1 | ||
MIR604 | Целевая | MIR604 F | GCG CAC GCA ATT CAA CAG |
MIR604 R | GGT CAT AAC GTG ACT CCC TTA ATT CT | ||
MIR604 P | FAM-AGGCGGGAAACGACAATCTGATCATG-BHQ1 | ||
Растительная | Adh MIR604 F | CGT CGT TTC CCA TCT CTT CCT CC | |
Adh MIR604 R | CCA CTC CGA GAC CCT CAG TC | ||
Adh MIR604 P | R6G-AAT CAG GGC TCA TTT TCT CGC TCC TCA-BHQ1 | ||
MON 88017 | Целевая | MON 88017 F | GAG CAG GAC CTG CAG AAG CT |
MON 88017 R | TCC GGA GTT GAC CAT CCA | ||
MON 88017 P | FAM-TCC CGC CTT CAG TTT AAA CAG AGT CGG GT -BHQ1 | ||
Растительная | Hmg MON 88017 F | TTG GAC TAG AAA TCT CGT GCT GA | |
Hmg MON 88017 R | GCT AСA TAG GGA GCC TTG TCC T | ||
Hmg MON 88017 P | R6G-CAA TCC AСA CAA ACG CAC GCG TA -BHQ1 | ||
3272 | Целевая | 3272 F | TCA TCA GAC CAG ATT CTC TTT TAT GG |
3272 R | CGT TTC CCG CCT TCA GTT TA | ||
3272 P | FAM-ACT GCT GAC GCG GCC AAA CAC TG-BHQ1 | ||
Растительная | Adh 3272 F | CGT CGT TTC CCA TCT CTT CCT CC | |
Adh 3272 R | CCA CTC CGA GAC CCT CAG TC | ||
Adh 3272 P | R6G-AAT CAG GGC TCA TTT TCT CGC TCC TCA-BHQ1 | ||
MIR162 | Целевая | MIR162 F | GCG CGG TGT CAT СTA TGT TAC TAG |
MIR162 R | TGC CTT ATС TGT TGC CTT CAG A | ||
MIR162 P | FAM-TCT AGA CAA TTC AGT AСA TTA AAA ACG TCC GCC A-BHQ1 | ||
Растительная | Adh MIR162 F | CGT CGT TTC CCA TCT CTT CCT CC | |
Adh MIR162 R | CCA CTC CGA GAC CCT CAG TC | ||
Adh MIR162 P | R6G- AAT CAG GGC TCA TTT TCT CGC TCC TCA-BHQ1 | ||
5307 | Целевая | 5307 F | CAT GGC CGT ATС CGC AAT GTG |
5307 R | TGC ACC CTT TGC CAG TGG | ||
5307 P | FAM-ACC AСA ATA TAC CCT CTT CCC TGG GCC AG-BHQ1 | ||
Растительная | Adh 5307 F | CGT CGT TTC CCA TCT CTT CCT CC | |
Adh 5307 R | CCA CTC CGA GAC CCT CAG TC | ||
Adh 5307 P | R6G-AAT CAG GGC TCA TTT TCT CGC TCC TCA-BHQ1 | ||
Bt176 | Целевая | Bt176 F | GGC CGT GAA CGA GCT GTT |
Bt176 R | GGG AAG AAG CCT AСA TGT TTT СTA A | ||
Bt176 P | FAM-AGC AAC CAG ATС GGC CGA CAC C-BHQ1 | ||
Растительная | Adh Bt176 F | CGT CGT TTC CCA TCT CTT CCT CC | |
Adh Bt176 R | CCA CTC CGA GAC CCT CAG TC | ||
Adh Bt176 P | R6G-AAT CAG GGC TCA TTT TCT CGC TCC TCA-BHQ1 | ||
MON 98140 | Целевая | MON 98140 F | GTG TGT ATG TCT CTT TGC TTG GTC TT |
MON 98140 R | GAT TGT CGT TTC CCG CCT TC | ||
MON 98140 P | FAM-CTC TAT CGA TCC CCC TCT TTG ATA GTT TAA ACT-BHQ1 | ||
Растительная | Hmg 98140 F | TTG GAC TAG AAA TCT CGT GCT GA | |
Hmg 98140 R | GCT AСA TAG GGA GCC TTG TCC T | ||
Hmg 98140 P | R6G-CAA TCC AСA CAA ACG CAC GCG TA-BHQ1 | ||
MON87460 | Целевая | Mon87460 F | CAC GTT GAA GGA AAA TGG ATT G |
Mon87460 R | TCG CGA TCC TCC TCA AAG AC | ||
Mon87460 P | FAM-AGG GAG TAT GTA GAT AAA TTT TCA AAG CGT TAG ACG GC-BHQ1 | ||
Растительная | Hmg Mon87460 F | TTG GAC TAG AAA TCT CGT GCT GA | |
Hmg Mon87460 R | GCT AСA TAG GGA GCC TTG TCC T | ||
Hmg Mon87460 P | R6G-CAA TCC AСA CAA ACG CAC GCG TA-BHQ1 | ||
MON863 | Целевая | Mon863 F | GTA GGA TCG GAA AGC TTG GTA С |
Mon863 R | TGT TAC GGC СTA AAT GCT GAA CT | ||
Mon863 P | FAM-TGA AСA CCC ATС CGA AСA AGT AGG GTC A-BHQ1 | ||
Растительная | Adh Mon863 F | CCA GCC TCA TGG CCA AAG | |
Adh Mon863 R | CCT TCT TGG CGG CTT ATС TG | ||
Adh Mon863 P | R6G-CTT AGG GGC AGA CTC CCG TGT TCC CT-BHQ1 | ||
ТС1507 | Целевая | TC1507 F | TAG TCT TCG GCC AGA ATG G |
TC1507 R | CTT TGC CAA GAT CAA GCG | ||
TC1507 P | FAM-TAA CTC AAG GCC CTC ACT CCG-BHQ1 | ||
Растительная | Hmg TC1507 F | TTG GAC TAG AAA TCT CGT GCT GA | |
Hmg TC1507 R | GCT AСA TAG GGA GCC TTG TCC T | ||
Hmg TC1507 P | R6G-CAA TCC AСA CAA ACG CAC GCG TA-BHQ1 | ||
59122 | Целевая | 59122 F | GGGATAAGCAAGTAAAAGCGCTC |
59122 R | CCTTAATTCTCCGCTCATGATCAG | ||
59122 P | FAM-TTTAAACTGAAGGCGGGAAACGACAA-BHQ1 | ||
Растительная | Hmg 59122 F | GCT AСA TAG GGA GCC TTG TСС T | |
Hmg 59122 R | TTG GAC TAG AAA TCT CGT GCT GA | ||
Hmg 59122 P | R6G-CAA TСС AСA CAA ACG CAC GCG TA-BHQ1 | ||
LY038 | Целевая | LY038 F | TGG GTT CAG TCT GCG AAT GTT |
LY038 R | AGG AAT TCG ATA TCA AGC TTA TCG A | ||
LY038 P | FAM-CGA GCG GAG TTT ATG GGT CGA CGG-BHQ1 | ||
Растительная | Hmg LY038 F | TTG GAC TAG AAA TCT CGT GCT GA | |
Hmg LY038 R | GCT AСA TAG GGA GCC TTG TСС T | ||
Hmg LY038 P | R6G-CAA TСС AСA CAA ACG CAC GCG TA-BHQ1 | ||
DAS-40278-9 | Целевая | DAS40278 F | CAC GAA CCA TTG AGT TAC AAT С |
DAS40278 R | TGG TTC ATT GTA TTC TGG CTT TG | ||
DAS40278 P | FAM-CGT AGC TAA CCT TCA TTG TAT TCC G-BHQ1 | ||
Растительная | Hmg 40278 F | TTG GAC TAG AAA TCT CGT GCT GA | |
Hmg 40278 R | GCT AСA TAG GGA GCC TTG TСС T | ||
Hmg 40278 P | R6G-CAA TСС AСA CAA ACG CAC GCG TA-BHQ1 |
Таблица 3 - Последовательности олигонуклеотидных праймеров и зондов для идентификации ГМ линий рапса
Линия ГМ рапса | Последова- | Наименование | 5'-3' последовательность |
GT73 | Целевая | RT73-F | CCATATTGACCATCATACTCATTGCT |
RF3-R* | GCTTATACGAAGGCAAGAAAAGGA | ||
RT73-Z | FAM-TTCCCGGACATGAAGATCATCCTCCTT-BHQ1 | ||
Растительная | Rape-cruA-F | GGCCAGGGTTTCCGTGAT | |
Rape-cruA-R | CCGTCGTTGTAGAACCATTGG | ||
Rape-cruA-Z | R6G-AGTCCTTATGTGCTCCACTTTCTGGTGCA-BHQ1 | ||
MON88302 | Целевая | MON88302-F | TCCTTGAACCTTATTTTATAGTGCACA |
MON88302-R | TCAGATTGTCGTTTCCCGCCTTCA | ||
MON88302-Z | FAM-TAGTCATCATGTTGTACCACTTCAAACACT-BHQ1 | ||
Растительная | Rape-cruA-F | GGCCAGGGTTTCCGTGAT | |
Rape-cruA-R | CCGTCGTTGTAGAACCATTGG | ||
Rape-cruA-Z | R6G-AGTCCTTATGTGCTCCACTTTCTGGTGCA-BHQ1 | ||
MS1 | Целевая | Ms1-F* | ACGCTGCGGACATCTACATT |
_________________ * Текст документа соответствует оригиналу. - .
| |||
MS1-R | CTAGATCGGAAGCTGAAGATGG | ||
MS1-Z | FAM-CTCATTGCTGATCCACCTAGCCGACTT-BHQ1 | ||
MS1 | Растительная | Rape-cruA-F | GGCCAGGGTTTCCGTGAT |
Rape-cruA-R | TCAGATTGTCGTTTCCCGCCTTCA | ||
Rape-cruA-Z | R6G-AGTCCTTATGTGCTCCACTTTCTGGTGCA-BHQ1 | ||
MS8 | Целевая | MS8-F | GTTAGAAAAAGTAAACAATTAATATAGCCGG |
MS8-R | GGAGGGTGTTTTTGGTTATC | ||
MS8-Z | FAM-AATATAATCGACGGATCCCCGGGAATTC-BHQ1 | ||
Растительная | Rape-cruA-F | GGCCAGGGTTTCCGTGAT | |
Rape-cruA-R | TCAGATTGTCGTTTCCCGCCTTCA | ||
Rape-cruA-Z | R6G-AGTCCTTATGTGCTCCACTTTCTGGTGCA-BHQ1 | ||
Т45 | Целевая | T45-F | CAATGGACACATGAATTATGC |
T45-R | GACTCTGTATGAACTGTTCGC | ||
T45-Z | FAM-TAGAGGACCTAACAGAACTCGCCGT-BHQ1 | ||
Растительная | Rape-cruA-F | GGCCAGGGTTTCCGTGAT | |
Rape-cruA-R | TCAGATTGTCGTTTCCCGCCTTCA | ||
Rape-cruA-Z | R6G-AGTCCTTATGTGCTCCACTTTCTGGTGCA-BHQ1 | ||
RF1 | Целевая | RF1-F | CTAAGGGAGGTCAAGATGTAGC |
RF1-R | CGGGCCTAACTTTTGGTGTG | ||
RF1-Z | FAM-CTCATCATCCTCACCCAGTCAGCATCA-BHQ1 | ||
Растительная | Rape-cruA-F | GGCCAGGGTTTCCGTGAT | |
Rape-cruA-R | TCAGATTGTCGTTTCCCGCCTTCA | ||
Rape-cruA-Z | R6G-AGTCCTTATGTGCTCCACTTTCTGGTGCA-BHQ1 | ||
RF2 | Целевая | RF2-F | GGGTGAGACAATATATCGACG |
RF2-R | GGGCATCGCACCGGTGAG | ||
RF2-Z | FAM-CACCGGCCAAATTCGCTCTTAGCCGT-BHQ1 | ||
Растительная | Rape-cruA-F | GGCCAGGGTTTCCGTGAT | |
Rape-cruA-R | TCAGATTGTCGTTTCCCGCCTTCA | ||
Rape-cruA-Z | R6G-AGTCCTTATGTGCTCCACTTTCTGGTGCA-BHQ1 | ||
RF3 | Целевая | RF3-F | CATAAAGGAAGATGGAGACTTGAG |
RF3-R | AGCATTTAGCATGTACCATCAGACA | ||
RF3-Z | FAM-CGCACGCTTATCGACCATAAGCCCA-BHQ1 | ||
Растительная | Rape-cruA-F | GGCCAGGGTTTCCGTGAT | |
Rape-cruA-R | TCAGATTGTCGTTTCCCGCCTTCA | ||
Rape-cruA-Z | R6G-AGTCCTTATGTGCTCCACTTTCTGGTGCA-BHQ1 | ||
Topas 19/2 | Целевая | TOPAS19/2-F | GTTGCGGTTCTGTCAGTTCC |
TOPAS19/2-R | CGACCGGCGCTGATATATGA | ||
TOPAS19/2-Z | FAM-TCCCGCGTCATCGGCGG-BHQ1 | ||
Растительная | Rape-cruA-F | GGCCAGGGTTTCCGTGAT | |
Rape-cruA-R | TCAGATTGTCGTTTCCCGCCTTCA | ||
Rape-cruA-Z | R6G-AGTCCTTATGTGCTCCACTTTCTGGTGCA-BHQ1 | ||
6 Сущность метода
6.1 Сущность метода идентификации ГМ линий сои, кукурузы и рапса методом ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени (Real Time PCR) заключается в проведении двух независимых ПЦР в одной пробирке с использованием специфичных праймеров и зондов, меченных флуоресцентными красителями, с целью выявления участка видоспецифичной ДНК растений (сои, кукурузы или рапса) и части генно-инженерной конструкции, специфичной для генома тестируемой генетически модифицированной линии.
6.2 Метод состоит из следующих этапов:
- экстракция и очистка ДНК: на данном этапе осуществляется лизис клеток с последующей очисткой ДНК от балластных веществ (белков, полисахаридов и других соединений);
- ПЦР с использованием специфических праймеров и зондов, меченных флуоресцентным красителем. На данном этапе осуществляется накопление копий целевого участка ДНК и детекция ПЦР-продуктов в режиме "реального времени";
- анализ и интерпретация результатов происходит на основании наличия (или отсутствия) пересечения кривой флюоресценции с установленной на соответствующем уровне пороговой линией на графике зависимости интенсивности флюоресценции от количества циклов, что соответствует значениям порогового цикла "Ct".
7 Отбор проб
Общие правила отбора проб для испытаний должны соблюдаться в соответствии с требованиями ГОСТ ISO 6497.
8 Экстракция ДНК
8.1 Экстракцию ДНК из анализируемой пробы осуществляют с использованием набора реагентов для экстракции ДНК сорбционным методом по 5.3 или иным методом, позволяющим получить достаточный объем ДНК для последующих исследований. Объем ДНК, необходимый для проведения исследований, вычисляют по формулам:
![]() , (1)
, (1)
где V - объем ДНК, необходимый для проведения идентификации линий;
N - количество идентифицируемых линий;
![]() , (2)
, (2)
где V - объем ДНК, необходимый для проведения количественного анализа.
8.2 Буфер для лизирующего реагента и раствор для отмывки N 1 (если они хранились при температуре от 2°C до 8°C) прогревают на поверхности твердотельного термостата при температуре от 60°C до 64°C до полного растворения кристаллов.
8.3 Отбирают необходимое количество одноразовых пробирок объемом 1,5 см (включая отрицательный контроль выделения). В пробирки вносят анализируемые пробы. В пробирку отрицательного контроля выделения ДНК вносят 100 мм
ОКО.
8.4 Отдельными наконечниками с аэрозольным барьером вносят в каждую пробирку по 400 мм буфера для лизирующего реагента и по 17 мм
лизирующего реагента. Тщательно перемешивают содержимое пробирок на встряхивателе в течение 10 с.
8.5 Пробирки инкубируют в термостате при температуре 64°C в течение 1 ч, периодически встряхивая на встряхивателе (пять раз через каждые 10-12 мин).
8.6 Нерастворенные частицы анализируемой пробы осаждают центрифугированием при 12-14 тыс. об/мин в течение 5 мин.
8.7 Надосадочную жидкость в объеме 200-350 мм очень аккуратно (так, чтобы не попали взвешенные частицы и капли жира) отбирают отдельными наконечниками с аэрозольными барьерами и переносят в новые пробирки.
8.8 Пробирки с надосадочной жидкостью прогревают в течение 5 мин в термостате при температуре 64°C, перемешивают содержимое пробирок и центрифугируют в течение 5 с при 5 тыс. об/мин для сброса капель с крышки пробирки.
8.9 В каждую пробирку отдельным наконечником добавляют по 25 мм сорбента, предварительно помещенного во встряхиватель для получения однородной суспензии. Содержимое пробирок перемешивают на встряхивателе и инкубируют при комнатной температуре в течение 10-15 мин, перемешивая через каждые 2 мин. Сорбент осаждают центрифугированием при 5 тыс. об/мин в течение 30 с. Надосадочную жидкость удаляют, используя вакуумный отсасыватель с колбой-ловушкой и отдельный наконечник для каждой пробы.
8.10 В пробирки добавляют по 300 мм раствора для отмывки N 1. Перемешивают на встряхивателе до полного ресуспендирования сорбента. Сорбент осаждают центрифугированием при 5 тыс. об/мин в течение 30 с. Удаляют надосадочную жидкость, используя вакуумный отсасыватель с колбой-ловушкой и отдельный наконечник для каждой пробы.
8.11 Процедуру отмывки повторяют дважды, используя по 500 мм раствора для отмывки N 2, и центрифугируют в течение 30 с при 7 тыс. об/мин, удаляют надосадочную жидкость полностью.
8.12 Пробирки с отмытым сорбентом помещают в термостат при температуре 64°C на 10 мин для подсушивания сорбента. При этом крышки пробирок должны быть открыты.
8.13 В пробирки добавляют по 50 мм буфера для элюции ДНК и перемешивают на встряхивателе. Помещают в термостат при температуре 64°C на 5 мин и периодически (один раз в минуту) встряхивают на встряхивателе. Пробирки центрифугируют при 12 тыс. об/мин в течение 1 мин.
8.14 Надосадочная жидкость содержит очищенную ДНК, которую затем используют для постановки ПЦР и проведения амплификации. Очищенную ДНК можно хранить в течение одной недели при температуре от 2°C до 8°C и в течение года при температуре не выше минус 16°C. Для этого рекомендуется перенести надосадочную жидкость в чистую микропробирку.
9 Постановка ПЦР и проведение амплификации с гибридизационно-флуоресцентной детекцией в режиме реального времени (Real Time PCR)
9.1 Приготовление реакционной ПЦР-смеси
Для приготовления реакционной ПЦР-смеси для определения генетически модифицированной линии сои, кукурузы или рапса берут 1 мм деионизированной воды, по 1 мм
каждого соответствующего праймера с маркировкой "F" по 5.3.2 концентрацией 5·10
моль/дм
, по 1 мм
каждого праймера с маркировкой "R" по 5.3.2 концентрацией 5·10
моль/дм
, по 1 мм
каждого зонда с маркировкой "Р" по 5.3.2 концентрацией 3·10
моль/дм
, 3 мм
раствора дНТФ и смешивают в пробирке вместимостью 1,5 см
. Срок хранения готовой ПЦР-смеси при температуре не выше минус 18°C - не более 12 мес.
9.2 Постановка ПЦР
9.2.1 ДНК, экстрагированную из анализируемой пробы (включая стандартные образцы), испытывают не менее чем в двух повторностях.
9.2.2 Для проведения ПЦР в одной пробирке смешивают 10 мм ПЦР-смеси по 9.1, к которой добавляют 5 мм
ПЦР-буфера и 0,5 мм
термостабильной Taq полимеразы. Смесь перемешивают на встряхивателе, осаждая кратковременным центрифугированием.
9.2.3 Вносят по 15 мм смеси, полученной по 9.2.2, в микропробирку вместимостью 0,2 см
, затем, используя наконечник с аэрозольным барьером, добавляют в нее 10 мм
ДНК, полученной из анализируемой пробы (ДНК-проба) в соответствии с разделом 8. Общий объем реакционной смеси - 25 мм
.
Примечание - Необходимо избегать попадания сорбента в реакционную смесь.
9.3 Контрольные реакции амплификации:
- отрицательный контроль ПЦР (К-) - вместо ДНК-пробы в микропробирку с 15 мм смеси по 9.2.2 вносят 10 мм
ТЕ-буфера;
- положительный контроль ПЦР (К+) - вместо ДНК-пробы в микропробирку с 15 мм смеси по 9.2.2 вносят 10 мм
1%-ного стандартного образца состава ГМ сои, ГМ кукурузы или ГМ рапса.
9.4 Проведение амплификации и детекции флуоресцентного сигнала
Программируют прибор для проведения полимеразной цепной реакции в режиме реального времени в соответствии с инструкцией по эксплуатации.
Программы амплификации для идентификации линий ГМ сои, кукурузы и рапса различаются для разных ГМ линий и приведены в таблицах 4-11.
Программа амплификации для идентификации ГМ сои линий 40-3-2, А5547-127, А2704-12 приведена в таблице 4.
Таблица 4 - Программа амплификации для идентификации ГМ линий сои 40-3-2, А5547-127, А2704-12
Стадия | Температура | Время | Количество циклов | Детекция |
Удерживание | 95°C | 15 мин | 1 | - |
Циклирование | 95°C | 15 с | 45 | - |
60°C | 30 с | По каналам FAM/Green, JOE/Yellow | ||
72°C | 30 с | - | - |
Программа амплификации для идентификации ГМ сои линий MON87701, BPS-CV127-9, FG72 приведена в таблице 5.
Таблица 5 - Программа амплификации для идентификации ГМ линий сои MON87701, BPS-CV127-9, FG72
Стадия | Температура | Время | Количество циклов | Детекция |
Hold/Удержание температуры | 95°C | 15 мин | 1 | - |
Cycling 1/ | 95°C | 10 c | 10 | - |
60°C | 20 с | - | ||
72°C | 10 с | - | ||
Cycling 2/ | 95°C | 10 с | 35 | - |
55°C | 20 с | По каналам FAM/Green, JOE/Yellow | ||
72°C | 10 с | - |
Программа амплификации для идентификации ГМ сои линий MON89788, SYHTOH2, DP-305423, DP-356043, MON87705, MON87708, MON87769 приведена в таблице 6.
Таблица 6 - Программа амплификации для идентификации ГМ линий сои MON89788, SYHTOH2, DP-305423, DP-356043, MON87705, MON87708, MON87769
Стадия | Температура | Время | Количество циклов | Детекция |
Hold/Удержание температуры | 95°C | 15 мин | 1 | - |
Cycling/ | 95°C | 15 с | 45 | - |
60°C | 60 с | По каналам FAM/Green, JOE/Yellow |
Программа амплификации для идентификации ГМ сои линии DAS-44406, DAS-81419 приведена в таблице 7.
Таблица 7 - Программа амплификации для идентификации ГМ линий сои DAS-44406, DAS-81419
Стадия | Температура | Время | Количество циклов | Детекция |
Hold/Удержание температуры | 95°C | 10 мин | 1 | - |
Cycling/ | 95°C | 15 с | 40 | - |
60°C | 60 с | По каналам FAM/Green, JOE/Yellow |
Программа амплификации для идентификации ГМ сои линии DAS-68416 приведена в таблице 8.
Таблица 8 - Программа амплификации для идентификации ГМ линий сои DAS-68416
Стадия | Температура | Время | Количество циклов | Детекция |
Hold/Удержание температуры | 95°C | 10 мин | 1 | - |
Cycling/ | 95°C | 15 с | 45 | - |
60°C | 60 с | По каналам FAM/Green, JOE/Yellow |
Программа амплификации для идентификации ГМ кукурузы линий MON98140, MIR162, 5307, Bt176, MIR604, 3272 приведена в таблице 9.
Таблица 9 - Программа амплификации для идентификации ГМ линий кукурузы MON98140, MIR162, 5307, Bt176, MIR604, 3272
Стадия | Температура | Время | Количество циклов | Детекция |
Hold/Удержание температуры | 95°C | 10 мин | 1 | |
Cycling/ | 95°C | 15 с | 40 | - |
60°C | 60 с | По каналам FAM/Green, JOE/Yellow |
Программа амплификации для идентификации ГМ кукурузы линий ТС1507, MON87460, LY038, DAS40278-9, MON89034, MON810, NK603, Т25, GA21, MON863, MON88017 приведена в таблице 10.
Таблица 10 - Программа амплификации для идентификации ГМ линий кукурузы ТС1507, MON87460, LY038, DAS40278-9, MON89034, MON810, NK603, Т25, GA21, MON863, MON88017
Стадия | Температура | Время | Количество циклов | Детекция |
Hold/Удержание температуры | 95°C | 10 мин | 1 | - |
Cycling/ | 95°C | 15 с | 45 | - |
60°C | 60 с | По каналам FAM/Green, JOE/Yellow |
Программа амплификации для идентификации ГМ кукурузы линий 59122, Bt11 приведена в таблице 11.
Таблица 11 - Программа амплификации для идентификации ГМ линий кукурузы 59122, Bt11
Стадия | Температура | Время | Количество циклов | Детекция |
Hold/Удержание температуры | 95°C | 10 мин | 1 | - |
Cycling/ | 95°C | 15 с | 50 | - |
60°C | 60 с | По каналам FAM/Green, JOE/Yellow |
Программа амплификации для идентификации ГМ рапса линий GT73, MON88302, RF2, MS1, MS8, Т45, RF1, RF3, Topas19/2 приведена в таблице 12.
Таблица 12 - Программа амплификации для идентификации ГМ линий рапса линий GT73, MON88302, RF2, MS1, MS8, Т45, RF1, RF3, Topas19/2
Стадия | Температура | Время | Количество циклов | Детекция |
Hold/Удержание температуры | 95°C | 15 мин | 1 | - |
Cycling/ | 95°C | 15 с | 40 | - |
60°C | 60 с | По каналам FAM/Green, JOE/Yellow |
Детекцию флуоресцентного сигнала проводят на каналах FAM и JOE. По каналу FAM регистрируют уровень флуоресценции участка части генно-инженерной конструкции, специфичной для генома тестируемой генетически модифицированной линии, по каналу JOE - для эндогенной ДНК ГМ сои, ГМ кукурузы, ГМ рапса. Кривые накопления флуоресцентного сигнала анализируют с использованием программного обеспечения используемого прибора для проведения ПЦР в режиме реального времени (Real Time PCR).
9.5 Учет и интерпретация результатов
9.5.1 Полученные в ходе испытания данные (кривые накопления флуоресцентного сигнала) анализируют по нескольким каналам детекции с использованием программного обеспечения прибора.
9.5.2 Результаты интерпретируют на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией на графике зависимости интенсивности флуоресценции от количества циклов, что соответствует значению порогового цикла Ct.
9.5.3 Учет результатов испытания следует начинать с результатов амплификации ДНК контрольных образцов в соответствии с таблицами оценки результатов контрольных реакций (таблицы 8-11). Для положительного контроля ПЦР в таблицах результатов по каналам FAM/Green и JOE/Yellow должны присутствовать значения порогового цикла Ct соответствующих значений в зависимости от программы амплификации. Для отрицательного контроля экстракции и отрицательного контроля ПЦР значения порогового цикла Ct по всем каналам должны отсутствовать. Отсутствие положительного сигнала в пробе с положительным контролем ПЦР (К+) или превышение граничного значения Ct, указанного в таблице, может свидетельствовать об ошибках, допущенных на этапе постановки ПЦР. В таком случае необходимо провести этап ПЦР повторно.
Таблица 13 - Оценка результатов контролей для таблиц 4, 6, 8, 10
Контроли | Контролируемый этап испытаний | Значение Ct по каналу | |
FAM/Green | JOE/Yellow | ||
В- | Экстракция ДНК | Нет значений | Нет значений |
К- | ПЦР | Нет значений | Нет значений |
К+ | ПЦР |
|
|
Проба |
|
| |
В образце обнаружена ДНК сои/кукурузы, если для данной пробы в таблице результатов по каналу JOE/Yellow определено значение порогового цикла Ct35 (таблица 13). При получении значения Ct>35 по каналу JOE/Yellow для анализируемой пробы требуется повторное испытание данной пробы, начиная с первого этапа испытаний (экстракция ДНК). При повторном получении аналогичного результата образец считают не подлежащим испытанию из-за низкого содержания в нем ДНК кукурузы/сои.
ДНК ГМ линии считают обнаруженной, если для данной пробы в таблице результатов по каналу FAM/Green определено значение порогового цикла Ct37.
Таблица 14 - Оценка результатов контролем для таблиц 5, 7, 9
Контроли | Контролируемый этап испытаний | Значение Ct по каналу | |
FAM/Green | JOE/Yellow | ||
В- | Экстракция ДНК | Нет значений | Нет значений |
К- | ПЦР | Нет значений | Нет значений |
К+ | ПЦР |
|
|
Проба |
|
| |
В образце обнаружена ДНК сои/кукурузы, если для данной пробы в таблице результатов по каналу JOE/Yellow определено значение порогового цикла Ct25 (таблица 14). При получении значения Ct>25 по каналу JOE/Yellow для анализируемой пробы требуется повторное испытание данной пробы, начиная с первого этапа испытаний (экстракция ДНК). При повторном получении аналогичного результата образец считают не подлежащим анализу из-за низкого содержания в нем ДНК кукурузы/сои.
ДНК ГМ линии обнаружена, если для данной пробы в таблице результатов по каналу FAM/Green определено значение порогового цикла Ct27.
Таблица 15 - Оценка результатов контролей для таблицы 11
Контроли | Контролируемый этап испытаний | Значение Ct по каналу | |
FAM/Green | JOE/Yellow | ||
В- | Экстракция ДНК | Нет значений | Нет значений |
К- | ПЦР | Нет значений | Нет значений |
К+ | ПЦР |
|
|
Проба |
|
| |
В образце обнаружена ДНК кукурузы, если для данной пробы в таблице результатов по каналу JOE/Yellow определено значение порогового цикла Ct37 (таблица 15). При получении значения Ct>37 по каналу JOE/Yellow для анализируемой пробы требуется повторное испытание данной пробы, начиная с первого этапа испытаний (экстракция ДНК). При повторном получении аналогичного результата образец считают не подлежащим анализу из-за низкого содержания в нем ДНК кукурузы.
ДНК ГМ линии обнаружена, если для данной пробы в таблице результатов по каналу FAM/Green определено значение порогового цикла Ct40.
Таблица 16 - Оценка результатов контролей для таблицы 12
Контроли | Контролируемый этап испытаний | Значение Ct по каналу | |
FAM/Green | JOE/Yellow | ||
В- | Экстракция ДНК | Нет значений | Нет значений |
К- | ПЦР | Нет значений | Нет значений |
К+ | ПЦР |
|
|
Проба |
|
| |
В образце обнаружена ДНК рапса, если для данной пробы в таблице результатов по каналу JOE/Yellow определено значение порогового цикла Ct37 (таблица 16). При получении значения Ct>37 по каналу JOE/Yellow для анализируемой пробы требуется повторное испытание данной пробы, начиная с первого этапа испытаний (экстракция ДНК). При повторном получении аналогичного результата образец считают не подлежащим анализу из-за низкого содержания в нем ДНК рапса.
ДНК ГМ линии обнаружена, если для данной пробы в таблице результатов по каналу FAM/Green определено значение порогового цикла Ct37.
9.5.4 Проверка условий достоверности испытаний
9.5.4.1 Отсутствие положительного сигнала в пробе с положительным контролем ПЦР (К+) или превышение граничных значений Ct, указанных в таблицах 13-16, может свидетельствовать о неправильно выбранной программе амплификации и о других ошибках, допущенных на этапе постановки ПЦР. В таком случае необходимо провести этап ПЦР повторно.
9.5.4.2 Появление любого значения Ct в таблице результатов для отрицательного контроля экстракции (на любом из каналов) и для отрицательного контроля ПЦР (на любом из каналов) свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа по всем пробам считаются недействительными. Требуется повторить ПЦР-исследование всех проб, начиная с этапа экстракции ДНК, а также предпринять меры по выявлению и ликвидации источника контаминации.
9.5.4.3 При получении значения Ct в таблице результатов по каналам Yellow и/или Green для анализируемой пробы более указанных пороговых значений Ct требуется повторно провести ПЦР-исследование соответствующего образца, начиная с этапа экстракции ДНК. При повторном получении аналогичного результата образец считают не подлежащим анализу из-за низкого содержания в нем растительной ДНК и/или ДНК ГМ линии.
Приложение А
(справочное)
Требования к ПЦР-лаборатории
А.1 ПЦР-лаборатория должна быть разделена на зоны (отдельные комнаты или помещения) для каждой из стадий ПЦР-диагностики.
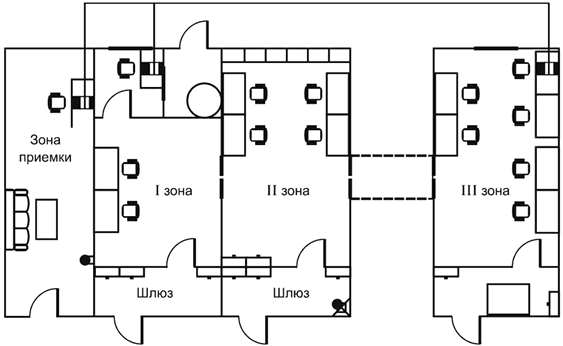
А.2 Рабочая зона ПЦР-лаборатории в соответствии с этапами ПЦР-исследования должна включать следующий минимальный набор изолированных помещений:
- приема и регистрации лабораторной пробы;
- первичной обработки лабораторной пробы, подготовки анализируемой пробы (I зона, отдельный ламинар);
- выделения НК из анализируемой пробы (I зона, отдельный ламинар).
Примечание - Помещения, где проводят работы по выделению и амплификации НК, располагают как можно дальше от помещения для детекции и учета результатов ПЦР с целью исключения движения воздушного потока и предотвращения контаминации продуктами амплификации (ампликонов), поскольку в процессе ПЦР фрагменты ДНК накапливаются в огромных количествах и являются идеальными продуктами для реамплификации;
- приготовления реакционных смесей, постановки ПЦР (II зона);
- гибридизационно-флюоресцентной детекции и учета результатов испытания методом Real Time PCR (III зона).
|
Рисунок А.1 - Схема ПЦР-лаборатории
А.3 Работа в ПЦР-лаборатории должна быть организована в одном направлении: от зон выделения и амплификации НК к зоне детекции и учета результатов ПЦР. В разных зонах лаборатории должны работать разные сотрудники.
А.4 Не допускается выполнение ПЦР-исследований в помещениях для проведения работ другими лабораторными и генно-инженерными методами (клонирование, секвенирование, рестрикционный анализ).
Все работы по подготовке испытуемых проб и выделению НК проводят в ламинарном боксе II, III классов защиты.
А.5 Каждая рабочая зона должна иметь свой набор лабораторной мебели, оборудования, реагентов, автоматических пипеток, расходных материалов, лабораторной посуды, защитной одежды, обуви, уборочного инвентаря и др. Имущество должно иметь маркировку, использование его в других помещениях или для проведения других работ запрещено.
А.6 Для проведения ПЦР-исследований необходимо использовать только одноразовые микропробирки и наконечники. Для предотвращения аэрозольного загрязнения автоматических пипеток используют наконечники с антиаэрозольным фильтром. Пробирки и наконечники для автоматических пипеток используют однократно. При переходе от одной пробы к другой обязательно меняют наконечники с целью предотвращения перекрестной контаминации в процессе выделения ДНК, РНК или при раскапывании реакционной смеси.
А.7 Работы по подготовке реакционной смеси для ПЦР, внесению выделенных НК в ПЦР-смесь проводят в ПЦР-боксах, оснащенных ультрафиолетовыми лампами.
Регулярно следует проводить мониторинг помещений, оборудования, рабочих поверхностей, дверных ручек на наличие продуктов амплификации.
УДК 636.086.15:636.086:006.354 | МКС 65 120 | |
Ключевые слова: корма и кормовые добавки, полимеразная цепная реакция, амплификация, праймеры, зонды, генно-модифицированная соя, генно-модифицированная кукуруза, генно-модифицированный рапс, экстракция ДНК, постановка ПЦР и проведение амплификации с гибридизационно-флуоресцентной детекцией в режиме реального времени (Real Time PCR) | ||
Электронный текст документа
и сверен по:
, 2020