ГОСТ 31674-2012
Группа С19
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
КОРМА, КОМБИКОРМА, КОМБИКОРМОВОЕ СЫРЬЕ
Методы определения общей токсичности
Feeds, compound feeds, material for compound feeds. Methods for the determination of common toxicity
МКС 65.120
Дата введения 2013-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным Государственным учреждением "Ленинградская межобластная ветеринарная лаборатория" (ФГУ "ЛМВЛ"); Санкт-Петербургской Государственной Академией ветеринарной медицины (СПб ГАВМ); Комитетом по сельскому хозяйству Ленинградской области; Федеральным Государственным учреждением "Всероссийский государственный НИИ контроля, стандартизации и сертификации ветеринарных препаратов Центр качества ветеринарных препаратов и кормов" (ФГУ "ВГНКИ"); ОАО "Всероссийский НИИ Комбикормовой промышленности" (ОАО "ВНИИКП"); Всероссийским НИИ Морского рыбного хозяйства и океанографии (ВНИРО); Санкт-Петербургским Государственным технологическим институтом (техническим университетом); Отделом ветеринарно-санитарной экспертизы и лабораторной диагностики Департамента ветеринарии МСХ РФ
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (ТК 335)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 1 октября 2012 г. N 51-2012)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 г. N 1477-ст межгосударственный стандарт ГОСТ 31674-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2013 г.
5 Настоящий стандарт подготовлен на основе применения ГОСТ Р 52337-2005
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ВНЕСЕНО Изменение N 1, утвержденное и введенное в действие Приказом Федерального агентства по техническому регулированию и метрологии от 15.11.2016 N 1690-ст c 01.07.2017
Изменение N 1 внесено изготовителем базы данных по тексту ИУС N 2, 2017 год
1 Область применения
Настоящий стандарт распространяется на фуражное зерно (пшеницу, кукурузу, овес, ячмень) и продукты его переработки (муку, крупу, отруби, лузгу, жмыхи, шроты); растительные корма (сено, солому, травяную муку); комбикорма для продуктивных и непродуктивных животных (в том числе консервы) и сырье для их производства (корма животного происхождения; продукты микробиологического синтеза; сухое молоко; концентрированные кормовые добавки).
Настоящий стандарт не распространяется на корма, имеющие в составе лекарственные препараты (антибиотики, кокцидиостатики и т.п.).
Стандарт устанавливает методы определения их общей токсичности: экспресс-методы и основные методы. Методы биотестирования являются качественными. Они дают возможность оценить общую токсичность корма.
Экспресс-методы (ускоренные и предварительные) позволяют в течение времени от 1,5 до 3 ч провести биотестирование кормов на инфузориях: стилонихиях, Paramecium caudatum (парамеции каудатум) и Tetrahymena pyriformis (тетрахимена пириформис), и колподах. Корма, отнесенные к нетоксичным, используют по назначению.
Основные методы (подтверждающие и окончательные) предусматривают исследования кожной биопробы на кроликах и биопробы на мышах, которые в течение времени от 3 до 5 сут позволяют дать окончательное заключение о токсичности корма. Эти методы применяют как для всех испытуемых кормов, так и для кормов, определенных экспресс-методами как токсичные, а также при возникших разногласиях (в качестве арбитражных методов).
Схемы биотестирования кормов представлены в приложении А (рисунки А.1 и А.2).
(Измененная редакция, Изм. N 1).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019-79* Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
______________
* На территории Российской Федерации действует ГОСТ Р 12.1.019-2009 "Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты".
ГОСТ 12.1.030-81 Система стандартов безопасности труда. Электробезопасность. Защитное заземление, зануление
ГОСТ 12.2.007.0-75 Система стандартов безопасности труда. Изделия электротехнические. Общие требования безопасности
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 166-89 (ИСО 3599-76) Штангенциркули. Технические условия
ГОСТ 171-81* Дрожжи хлебопекарные прессованные. Технические условия
______________
* На территории Российской Федерации действует ГОСТ Р 54731-2011 "Дрожжи хлебопекарные прессованные. Технические условия".
ГОСТ 975-88 Глюкоза кристаллическая гидратная. Технические условия
ГОСТ 1129-2013 Масло подсолнечное. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
ГОСТ 4165-78 Реактивы. Медь (II) сернокислая 5-водная. Технические условия
ГОСТ 4201-79 Реактивы. Натрий углекислый кислый. Технические условия
ГОСТ 4209-77 Реактивы. Магний хлористый 6-водный. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 4234-77 Реактивы. Калий хлористый. Технические условия
ГОСТ 4461-77 Реактивы. Кислота азотная. Технические условия
ГОСТ 5556-81 Вата медицинская гигроскопическая. Технические условия
ГОСТ 6038-79 Реактивы. -глюкоза. Технические условия
ГОСТ 6292-93 Крупа рисовая. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 8756.0-70 Продукты пищевые консервированные. Отбор проб и подготовка их к испытаниям
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9793-74 Продукты мясные. Методы определения влаги
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13496.0-2016 Комбикорма, комбикормовое сырье. Методы отбора проб
ГОСТ 13586.3-2015 Зерно. Правила приемки и методы отбора проб
ГОСТ 13805-76 Пептон сухой ферментативный для бактериологических целей. Технические условия
ГОСТ 13979.0-86 Жмыхи, шроты и горчичный порошок. Правила приемки и методы отбора проб
ГОСТ 17299-78 Спирт этиловый технический. Технические условия
ГОСТ 18300-87** Спирт этиловый ректификованный технический. Технические условия
______________
** На территории Российской Федерации действует ГОСТ Р 55878-2013 "Спирт этиловый технический гидролизный ректификованный. Технические условия".
ГОСТ 22967-90 Шприцы медицинские инъекционные многократного применения. Общие технические требования и методы испытаний
ГОСТ 23932-90 Посуда и оборудование лабораторные стеклянные. Общие технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26312.1-84 Крупа. Правила приемки и методы отбора проб
ГОСТ 26809.1-2014 Молоко и молочная продукция. Правила приемки, методы отбора и подготовка проб к анализу. Часть 1. Молоко, молочные, молочные составные и молокосодержащие продукты
ГОСТ 27668-88 Мука и отруби. Приемка и методы отбора проб
ГОСТ 28311-89 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
ГОСТ 29169-91 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ ISO 6497-2014 Корма. Отбор проб
ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов по указателю "Национальные стандарты", составленному по состоянию на 1 января текущего года, и по соответствующим информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
(Измененная редакция, Изм. N 1).
3 Отбор проб
Отбор проб проводят по ГОСТ 8756.0, ГОСТ 13496.0, ГОСТ ISO 6497, ГОСТ 13586.3, ГОСТ 13979.0, ГОСТ 26312.1, ГОСТ 26809.1, ГОСТ 27668.
Правила оформления и хранения проб кормов, направляемых на испытание, даны в приложении Б.
(Измененная редакция, Изм. N 1).
4 Экспресс-методы определения общей токсичности биотестированием кормов на стилонихиях, Paramecium caudatum (парамеции каудатум), Tetrahymena pyriformis (тетрахимена пириформис) и колподах*
________________
* Измененная редакция, Изм. N 1.
4.1 Биотестирование кормов на стилонихиях (Stylonychia mytilus)
Метод основан на извлечении из исследуемых кормов различных фракций токсических веществ параллельно ацетоном и водой с последующим воздействием этих экстрактов на стилонихий. Оценку результату биотеста дают по реакции гибели инфузорий. Безопасным в этом случае следует считать корм, определенный как нетоксичный при одновременном параллельном исследовании как ацетонового, так и водного экстракта.
С учетом времени подготовки пробы корма к биотесту определение общей токсичности одной пробы занимает от 1,5 до 2,0 ч; десяти проб - от 2,0 до 3,0 ч.
(Измененная редакция, Изм. N 1).
4.1.1 Средства измерений, вспомогательные устройства, материалы, реактивы
Шкаф вытяжной с электроснабжением 220В/50Гц/10А.
Весы лабораторные по ГОСТ OIML R 76-1, высокого класса точности, с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0,0001 г.
Штангенциркуль по ГОСТ 166.
Мельница лабораторная, обеспечивающая крупность помола 0,1 мм.
Микроскоп бинокулярный стереоскопический с увеличением от 3,6 до 100,1 марки МБС.
Шкаф сушильный, обеспечивающий поддержание заданного температурного режима при 220 °C с погрешностью ±2 °C.
Термостат суховоздушный с диапазоном измерения температур от 15 °C до 55 °C и погрешностью регулирования температуры ±0,5 °C.
Аппарат для встряхивания жидкостей АБУ-6с.
Аквадистиллятор с электропроводностью 1,6 или 2,3 мкСм/см, кроме моделей с медными или латунными испарителями или конденсаторами.
Центрифуга с частотой вращения 1000 об/мин.
Блок микроаквариумов луночных с размерами 15x8,5x1,3 см, изготовленный из оргстекла.
Стекла предметные 25x75 мм с полированной лункой объемом 0,2 см.
Колбы конические исполнения 2 (с пришлифованными пробками) вместимостью 50 или 100 см по ГОСТ 1770.
Стаканы химические вместимостью 100 см по ГОСТ 25336.
Пипетки по ГОСТ 29169 и по ГОСТ 29227.
Пробирки исполнения 2 (с пришлифованными пробками) вместимостью 25 см по ГОСТ 1770.
Дозаторы пипеточные (автодозаторы) на 20, 200 и 500 мкл.
Чашки Петри (биологические) по ГОСТ 23932.
Штатив для пробирок.
Часы песочные или таймер на 2 мин.
Бумага фильтровальная по ГОСТ 12026.
Карандаш по стеклу.
Сито лабораторное с отверстиями диаметром 1 мм.
Дрожжи хлебопекарные прессованные по ГОСТ 171.
Тест-культура стилонихии, идентифицированная по морфологическим признакам согласно определителю простейших и протестированная на активность с помощью модельного токсиканта.
Ацетон по ГОСТ 2603, ч.д.а., ос.ч.
Этиловый спирт по ГОСТ 17299.
Дистиллированная вода по ГОСТ 6709.
Соли для приготовления раствора Лозина-Лозинского:
- натрий хлористый по ГОСТ 4233;
- калий хлористый по ГОСТ 4234;
- кальций хлористый 2-водный;
- магний хлористый 6-водный по ГОСТ 4209;
- натрий углекислый кислый по ГОСТ 4201.
Все соли должны иметь квалификацию "химически чистый" или "чистый для анализа".
Медь сернокислая 5-водная (II) по ГОСТ 4165 для приготовления модельного токсиканта.
Допускается применение других средств измерения, оборудования и реактивов по метрологическим, техническим характеристикам и качеству не ниже указанных в настоящем стандарте.
(Измененная редакция, Изм. N 1).
4.1.2 Подготовка к проведению испытаний
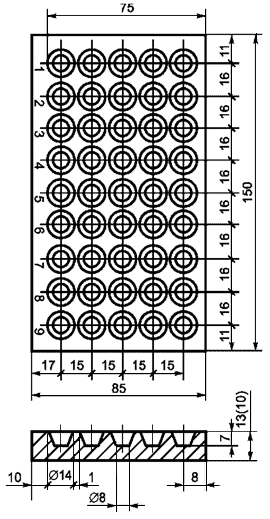
4.1.2.1 Для изготовления блока луночных микроаквариумов (рисунок 1) используют пластины органического стекла с размерами 15x8,5x1,3 см. В пластине высверливают с последующей полировкой 5 рядов по 9 лунок. Диаметр каждой лунки - 1,2 см верхний и 0,8 см нижний, глубина - 0,7 см. Рабочий объем каждой лунки - 0,4 см. Вместо блока микроаквариумов можно использовать микробиологические предметные стекла с отшлифованной лункой вместимостью 0,2 см
(по 5 шт. на пробу).
Рисунок 1 - Блок луночных микроаквариумов
4.1.2.2 Порядок обработки посуды для проведения испытаний должен быть следующим. Вся посуда и блоки микроаквариумов, необходимые для биотестирования, должны быть химически чистыми и использоваться только для данного анализа. В качестве моющего средства допускается к применению только хозяйственное мыло и мыльный раствор.
Чашки Петри и колбы для приготовления раствора Лозина-Лозинского прокаливают в сушильном шкафу в течение 2 ч при температуре от 120 °C до 150 °C. Блоки из органического стекла сушат только на воздухе. Дистилляцию воды для биотестирования необходимо проводить в химически чистом помещении.
4.1.2.3 Приготовление рабочего раствора питательной среды для культивирования стилонихий и разбавления ацетоновых экстрактов образцов кормов проводят в следующем порядке. Средой для культивирования инфузорий и разбавления ацетоновых экстрактов кормов служит раствор Лозина-Лозинского следующего состава: NaCl - 0,01%-ный; KCl - 0,001%-ный; CaCl 2-водный - 0,001%-ный; MgCl
6-водный - 0,001%-ный; NaHCO
- 0,002%-ный.
Для удобства сначала готовят десятикратный концентрированный раствор. Для этого в дистиллированной воде растворяют 1,0 г хлористого натрия; 0,1 г хлористого калия; 0,1 г 7-водного хлористого магния; 0,1 г 2-водного хлористого кальция; 0,2 г кислого углекислого натрия и доводят объем до 1 дм. Полученный раствор хранят не более 1 мес в холодильнике в стерильной колбе под ватно-марлевой пробкой.
Рабочий раствор Лозина-Лозинского готовят путем разбавления в 10 раз (1:9) концентрированной среды дистиллированной водой. Рабочий раствор хранят не более 14 сут при комнатной температуре.
4.1.2.4 Для приготовления модельного токсиканта берут 10 мг 5-водной сернокислой меди, растворяют ее в дистиллированной воде и доводят объем до 1 дм. Срок хранения раствора модельного токсиканта - не более 7 сут в холодильнике в стерильной колбе.
Рабочие концентрации модельного токсиканта готовят последовательным десятикратным его разбавлением в день проведения анализа. Сначала до концентрации 1 мг/дм раствор разбавляют дистиллированной водой, а затем до концентрации 0,1 мг/дм
- раствором Лозина-Лозинского.
Рабочая концентрация - 0,1 мг/дм. Рабочий раствор используют только свежеприготовленным.
4.1.2.5 Приготовление корма для стилонихий проводят в следующем порядке. Свежие хлебопекарные дрожжи предварительно тестируют на общую токсичность. Затем навеску массой 50 г измельчают и высушивают в сушильном шкафу при температуре от 50 °C до 55 °C в течение 2 сут.
Хранят готовые дрожжи в стерильной банке с притертой крышкой в сухом прохладном месте не более 12 мес, избегая попадания прямых солнечных лучей и насыщения дрожжей атмосферной влагой.
4.1.2.6 Культивирование стилонихий и тестирование кормов проводят в отдельном помещении, изолированном от химических токсичных реактивов (особенно от летучих соединений, хорошо растворимых в воде). В стерильную чашку Петри вносят 25 см рабочего раствора Лозина-Лозинского, затем пипеткой переносят в нее массу стилонихий. При этом кончик пипетки, заполненный культурой стилонихии, нужно предварительно погрузить в чашку Петри с рабочим раствором Лозина-Лозинского. Туда же в качестве корма для стилонихий на кончике иглы, продезинфицированной 70%-ным раствором этилового спирта, вносят 0,003 г высушенных дрожжей (2-3 крошки диаметром 1-2 мм). Чашку Петри помещают в термостат для культивирования стилонихий при температуре от 22 °C до 24 °C. Пересев культуры для хранения проводят 2 раза в неделю.
Допускается культивирование стилонихий вне термостата при температуре от 18 °C до 24 °C. В этом случае для поддержания постоянной температуры используют кондиционер или лампу дневного света, установленную на определенном расстоянии от чашек Петри, обеспечивающем заданную температуру. Лампу вместе с чашками накрывают полиэтиленовой пленкой, создав подобие теплички, где температура должна быть постоянной. Во избежание попадания прямых солнечных лучей чашки Петри накрывают бумагой.
Необходимо учитывать, что культура стилонихий не обладает генетической стабильностью. Приблизительно через год-полтора работы с культурой она стареет, теряет однородность, жизнеспособность, подвижность, неадекватно реагирует на токсиканты. В этом случае необходимо раз в год подсаживать свежий клон стилонихий к старой культуре или полностью заменять ее на новую. С целью замедления процесса вырождения культуры стилонихий при пересадке на свежую среду необходимо отбирать не только из предыдущей чашки Петри суточную культуру, но и из двух резервных чашек Петри с двух-, трехсуточными культурами, в которых инфузории имеют наибольшую подвижность и плотность.
(Измененная редакция, Изм. N 1).
4.1.2.7 Подготовку тест-организмов проводят в следующем порядке. Для биотестирования используют только суточную культуру стилонихий, находящуюся в фазе экспоненциального (активного) роста. С этой целью за сутки до анализа массу стилонихий пересаживают в новую питательную среду с кормом и помещают в термостат при оптимальной температуре от 22 °C до 24 °C. При этом стилонихии активно размножаются и концентрируются вокруг корма.
Не допускается использовать культуру стилонихий, зараженную другими видами простейших, микроскопическими грибами или бактериями, что может произойти при использовании нестерильной посуды, плохо подсушенных или просроченных дрожжей.
Для получения достоверных результатов биотестирования необходимо регулярно проверять состояние стилонихий, их подвижность, а один раз в месяц - реакцию культуры на действие модельного токсиканта (4.1.2.4), для чего каплю со стилонихиями помещают в лунку предметного стекла и после подсчета их количества заливают 0,2 см раствора модельного токсиканта рабочей концентрации 0,1 мг/дм
. Через 30 мин подсчитывают количество оставшихся живыми стилонихий. Результат считают удовлетворительным, если выживают не менее 50% стилонихий.
4.1.2.8 Подготовку исследуемого корма проводят в следующем порядке. Среднюю пробу исследуемого корма измельчают и просеивают через сито с отверстиями диаметром 1 мм.
4.1.2.9 Приготовление водного раствора ацетонового экстракта проводят в следующем порядке. Пробу исследуемого корма массой (10±0,1) г помещают в пробирку с пришлифованной пробкой вместимостью 25 см или в коническую колбу со шлифом вместимостью 50 или 100 см
и заливают определенным количеством ацетона в зависимости от вида исследуемого корма.
Для получения ацетонового экстракта пробирку или коническую колбу энергично встряхивают не менее 2 мин вручную или, при одновременной постановке нескольких проб, не менее 20 мин на аппарате для встряхивания жидкостей, а затем отстаивают в течение не менее 10 мин и не более 15 мин.
При высокой набухаемости (гигроскопичности) исследуемого корма допускается увеличивать количество ацетона на 5-10 см таким образом, чтобы толщина слоя ацетона над кормом была не менее 2 мм. Раствор вновь взбалтывают в течение 2 мин. После повторного отстаивания в течение 10 мин осторожно отбирают автоматической пипеткой или шприцем с длинной иглой 0,5 см
полученной надосадочной жидкости экстрактов и переносят ее в химический стакан или колбу с водным раствором Лозина-Лозинского.
Все параметры приготовления водного раствора ацетонового экстракта в зависимости от вида исследуемого корма представлены в таблице 1.
Таблица 1 - Приготовление водного раствора ацетонового экстракта
Вид испытуемого корма | Навеска корма, г | Количество ацетона, см | Приготовление водного раствора ацетонового экстракта | |
Ацетоновый экстракт, см | Рабочий раствор Лозина- | |||
Комбикорма для рыб | 10 | 14 | 0,5 | 50 |
Комбикорма для сельскохозяйственных животных, птиц и непродуктивных животных, в том числе консервы | 10 | 15 | 0,5 | 40 |
Зернофураж: | 10 | 15 | 0,5 | 40 |
Шроты, жмыхи | 10 | 15 | 0,5 | 40 |
Мука пшеничная, крупа | 10 | 15 | 0,5 | 40 |
Мука травяная | 10 | 20 | 0,5 | 40 |
Мука рыбная, крилевая | 10 | 10 | 0,5 | 80 |
Мука костная, мясокостная, мясная, перьевая | 10 | 10 | 0,5 | 80 |
Мука кровяная | 10 | 15 | 0,5 | 80 |
Молоко сухое | 10 | 15 | 0,5 | 80 |
Дрожжи кормовые, гидролизные | 10 | 15 | 0,5 | 50 |
Сено, солома | 10 | 20 | 0,5 | 50 |
Остальные концентрированные компоненты комбикормов и кормовые добавки (белково-витаминные комплексы, премиксы, минеральные и витаминные добавки) анализируют по схеме биотестирования комбикормов (приложение А). Предварительно такие добавки вносят согласно рецептам или зоотехническим нормам в размолотую пробу проверенного биотестированием нетоксичного на 100% зерна пшеницы (наполнитель). Пробу пшеницы размалывают и тестируют в день проведения анализа и не хранят.
(Измененная редакция, Изм. N 1).
4.1.2.10 Для приготовления водного экстракта испытуемого корма пробу массой (10±0,1) г вносят в колбу вместимостью 250 см и заливают 100 см
дистиллированной воды. Колбы с содержимым встряхивают на аппарате в течение 20 мин, после чего смесь фильтруют через бумажный фильтр или центрифугируют с частотой вращения 1000 оборотов/мин в течение 5 мин и отделяют надосадочную жидкость.
4.1.3 Проведение испытания
Каждую пробу корма исследуют пять раз. Пересадку и подсчет стилонихий проводят под микроскопом при увеличении 2x8 или 2x14.
Автоматической пипеткой с заменяемым наконечником отбирают по 20 мкл среды со стилонихиями и помещают в каждый из пяти микроаквариумов или лунок предметного стекла. Затем туда же автоматической пипеткой с чистым наконечником вносят по 20 мкл водного раствора ацетонового экстракта исследуемого корма, подготовленного для биотестирования (4.1.2.9), или водного экстракта исследуемого корма, подготовленного для биотестирования (4.1.2.10).
Через 2 мин в каждом микроаквариуме или лунке подсчитывают количество стилонихий. Оптимальное количество - от 10 до 20 шт., при этом травмированные клетки стилонихий (неподвижные, округлой формы) не учитывают. Полученные данные заносят в журнал.
После подсчета стилонихий в каждый микроаквариум или лунку другой автоматической пипеткой вносят по 200 мкл водного раствора ацетонового экстракта (4.1.2.9) или водного экстракта исследуемого корма (4.1.2.10) и отмечают время начала испытаний.
Перед каждым внесением раствора экстракта анализируемой пробы в микроаквариум или лунку наконечник пипетки следует вытирать ватой во избежание попадания в них жировых загрязнений с наружной стороны пипетки.
Через 1 ч экспозиции при анализе водного раствора ацетонового экстракта или водного экстракта анализируемого корма вторично подсчитывают численность стилонихий. В контрольных тестах все стилонихии должны оставаться живыми. Для того чтобы за время экспозиции растворы в лунках не подсохли, под блок микроаквариумов или предметные стекла подкладывают смоченную водой фильтровальную бумагу и накрывают их стеклянным колпаком.
Параллельно с биотестированием пробы корма, с целью определения качества ацетона и минерального раствора Лозина-Лозинского проводят контрольные тесты. Для этого в микроаквариумы или лунки (в трех повторностях) помещают вышеуказанным способом стилонихии и заливают их:
а) 200 мкл 1%-ного раствора ацетона в минеральном растворе Лозина-Лозинского (0,1 см (100 мкл) ацетона на 10 см
раствора Лозина-Лозинского);
б) 200 мкл минерального раствора Лозина-Лозинского.
Качество ацетона проверяют каждый раз в начале использования новой партии реактива, а качество раствора Лозина-Лозинского - при приготовлении новой порции. В случае токсичности исследуемого корма стилонихии:
а) изменяют свою обычную эллипсоидную форму на округлую, а движение - на беспорядочное с поворотом вокруг своей поперечной оси;
б) прекращают движение и (или) подвергаются распаду - лизису (количество лизированных клеток зависит от степени токсичности кормов). Токсичность исследуемого корма определяют по выживаемости стилонихий через 1 ч (при экстракции ацетоном) и через 3 ч (при экстракции водой) экспозиции.
(Измененная редакция, Изм. N 1).
4.1.4 Обработка результатов
Выживаемость стилонихий , %, вычисляют по формуле
![]() , (1)
, (1)
где - среднеарифметическое (из пяти испытаний) значение количества стилонихий в конце опыта через 1 ч экспозиции, шт.;
- среднеарифметическое (из пяти испытаний) значение количества стилонихий в начале опыта, шт.;
100 - коэффициент перевода результата в проценты.
Вычисления проводят с точностью до первого десятичного знака, а окончательный результат испытания регистрируют в протоколе с округлением до целого числа. Допускаемое расхождение между результатами двух параллельных определений при доверительной вероятности 0,95 не должно превышать 1%.
Токсичность испытуемого корма определяют из расчета:
а) комбикорма для свиней:
1) от 80% до 100% выживаемости стилонихий - корм нетоксичный;
2) от 40% до 79% выживаемости стилонихий - корм слаботоксичный;
3) от 0% до 39% выживаемости стилонихий - корм токсичный;
б) комбикорма для других видов продуктивных и непродуктивных животных, птиц и рыб; фуражное зерно и продукты его переработки, концентрированные компоненты комбикормов:
1) от 70% до 100% выживаемости стилонихий - корм нетоксичный;
2) от 40% до 69% выживаемости стилонихий - корм слаботоксичный;
3) от 0% до 39% выживаемости стилонихий - корм токсичный.
4.1.5 Оформление результатов
Результаты испытаний записывают в журнал и оформляют акт экспертизы или протокол испытаний, где указывают наличие или отсутствие токсичности корма и возможность его использования.
Нетоксичным следует считать корм, если при параллельном биотестировании как водного раствора ацетонового экстракта, так и водного раствора испытуемого корма определено, что он нетоксичный.
Нетоксичный корм дальнейшему исследованию не подлежит и используется по назначению без ограничений.
Слаботоксичные и токсичные корма (хотя бы по одному из испытанных экстрактов) направляют на биотестирование основными методами, а также на микологические, химико-токсикологические и бактериологические исследования.
4.2 Биотестирование кормов на колподах (Colpoda steinii)
4.2.1 Основные положения
Метод основан на извлечении из испытуемых кормов фракций токсичных веществ параллельно ацетоном и водой с последующим воздействием этих веществ на колподы. Время полного анализа одной пробы - от 3,5 до 4 ч, десяти проб - от 4,5 до 5 ч.
Данный метод предполагает использование сухой культуры колподы в лабораториях, не имеющих возможности постоянно поддерживать в активном физиологическом состоянии стилонихии.
Сухая культура колподы для эколого-токсикологических исследований по внешнему виду представляет собой округлые цисты покоя, прикрепленные к кусочку целлофановой пленки и стенке флакона, видимые при увеличении от 80 до 150 раз.
Культуру колподы выпускают во флаконах или ампулах. Каждый флакон (ампула) рассчитан на получение 2 см активной культуры с концентрацией не менее 5000 клеток в 1 см
. В качестве источника питания для колпод используют споры бактерий Bacillus subtilis, прикрепленные к кусочку целлофана вместе со спорами колпод. К каждым двум упаковкам культуры прилагается флакон (ампула) с питательной средой.
Срок годности культуры - 1 г от даты выпуска препарата. Препарат хранят при комнатной температуре в защищенном от света месте.
Средства измерений, вспомогательные устройства, материалы, реактивы для биотестирования на колподах - по 4.1.1.
4.2.2 Подготовка к проведению испытаний
4.2.2.1 Изготовление блока луночных микроаквариумов и порядок обработки посуды - по 4.1.2.1 и 4.1.2.2.
4.2.2.2 Приготовление модельного токсиканта - по 4.1.2.4.
4.2.2.3 Рабочим раствором питательной среды для разбавления ацетонового экстракта исследуемого корма является раствор Лозина-Лозинского (4.1.2.3).
4.2.2.4 Подготовку тест-организмов проводят в следующем порядке. Для проведения испытаний не позднее чем за 24 ч до использования вскрывают два флакона с культурой колподы и один флакон с питательной средой (один набор). В каждый флакон с культурой колподы наливают по 2 см питательной среды, затыкают ватно-марлевыми пробками и ставят в термостат при температуре от 26 °C до 28 °C на 24 ч. За это время происходит массовое эксцистирование спор. При этом полученная культура колподы находится в физиологически активном состоянии, оптимальном для постановки биотеста в течение 3 сут после эксцистирования.
Непосредственно перед применением необходимо убедиться в активности культуры колподы. Для этого каплю культуры исследуют под микроскопом (увеличение 2x14). Колподы в количестве не менее 50 клеток в поле зрения должны активно двигаться. Кроме этого необходимо проверять активность культуры (новой партии) на модельном токсиканте (4.1.2.4). Для этого следует смешать на предметном стекле каплю культуры с такой же по объему каплей рабочего раствора сульфата меди (0,1 мг/дм). В течение 30 мин должны оставаться живыми и подвижными не менее 50% колпод.
4.2.2.5 Для подготовки среднюю пробу испытуемого корма измельчают до прохода через сито с ячейками диаметром 1 мм. Полученный таким образом однородный корм готовят параллельно двумя способами: экстракцией токсичных соединений из корма ацетоном с последующим разведением ацетонового экстракта водным минеральным раствором Лозина-Лозинского или экстракцией токсических соединений из корма водным минеральным раствором Лозина-Лозинского для дополнительного обнаружения водорастворимых токсинов.
Концентрированные компоненты комбикормов и кормовые добавки анализируют по схеме биотестирования комбикормов, предварительно введя эти вещества в количестве, определенном рецептом или зоотехническими нормами, в размолотый образец проверенного биотестированием нетоксичного на 100% зерна пшеницы.
4.2.2.6 Приготовление водного раствора ацетонового экстракта испытуемого корма - по 4.1.2.9.
4.2.2.7 Приготовление водного экстракта испытуемого корма - по 4.1.2.10.
4.2.3 Проведение испытания
Из флакона отбирают 20 мкл питательной среды с колподами и помещают в микроаквариум или в лунку предметного стекла. Приливают либо 200 мкл водного раствора ацетонового экстракта, либо 200 мкл водного экстракта испытуемого корма.
В контрольных тестах (проводят трехкратно при смене партии свежеприготовленного раствора Лозина-Лозинского) к 20 мкл раствора с инфузориями приливают 200 мкл минерального раствора Лозина-Лозинского, а для проверки качества ацетона к 20 мкл раствора с инфузориями приливают 200 мкл 1%-ного раствора ацетона в минеральном растворе Лозина-Лозинского (0,1 см ацетона (100 мкл) на 10 см
раствора Лозина-Лозинского). Время анализа в случае испытания водного раствора ацетонового экстракта - 1 ч, в случае испытания водного экстракта - 3 ч (для того, чтобы в период экспозиции растворы в лунках не подсохли, под блок микроаквариумов или предметные стекла подкладывают смоченную водой фильтровальную бумагу и накрывают их стеклянным колпаком).
По истечении всего времени анализа просматривают весь объем микроаквариума или лунки и учитывают наличие живых колпод.
Если образец токсичен, то живых колпод не обнаруживают (поле зрения пусто) или находят единичные малоподвижные клетки.
4.2.4 Обработка результатов
Критерием определения токсичности служит время от начала воздействия испытуемого раствора до гибели большинства (более 90%) колпод, факт которой констатируют на основании полного прекращения ими движения и наличия лизиса клеток. В контрольном тесте все колподы должны оставаться подвижными.
Испытуемый корм нетоксичен, если по истечении всего времени экспозиции (1ч для анализа водного раствора ацетонового экстракта и 3 ч для анализа водного экстракта) большинство (около 90%) колпод остались подвижными.
Испытуемый корм слаботоксичный, если гибель колпод наступила в интервале до 1 ч при анализе водного раствора ацетонового экстракта корма или до 3 ч - при анализе водного экстракта.
Корм токсичен, если гибель колпод наступила в интервале до 10 мин экспозиции как в случае анализа водного раствора ацетонового экстракта, так и в случае анализа водного экстракта корма.
4.2.5 Оформление результатов
Результаты испытаний заносят в журнал и оформляют акт экспертизы или протокол испытания, где указывают наличие или отсутствие токсичности корма и возможность его использования.
Нетоксичным следует считать корм, если при параллельном биотестировании как водного раствора ацетонового экстракта, так и водного раствора испытуемого корма определено, что корм нетоксичный. Нетоксичный корм дальнейшим испытаниям не подлежит и используется по назначению без ограничений. Слаботоксичные и токсичные корма направляют на дополнительное биотестирование основными методами, а также на микробиологические и химико-токсикологические испытания.
4.3 Биотестирование кормов на инфузориях Tetrahymena pyriformis (тетрахимена пириформис)
4.3.1 Сущность метода
Метод основан на извлечении ацетоном из анализируемых кормов токсичных веществ, выпаривании ацетона, растворении остатка в пептонной среде, последующем воздействии полученных экстрактов на инфузории Tetrahymena pyriformis (тетрахимена пириформис) и подсчете живых и погибших инфузорий.
4.3.2 Средства измерений, вспомогательные устройства, материалы, реактивы
Весы неавтоматического действия по ГОСТ OIML R 76-1 или нормативному документу государства, принявшего настоящий стандарт, с пределами допускаемой абсолютной погрешности ±0,001 г.
Мельница лабораторная, обеспечивающая крупность помола 0,1 мм.
Микроскоп бинокулярный стереоскопический, обеспечивающий увеличение 7x10 марки МБС.
рН-метр, обеспечивающий измерение с точностью ±0,05 ед. рН, с разрешением 0,01 ед. рН.
Аппарат для встряхивания жидкостей.
Сито лабораторное с размером стороны ячеек 1 мм (с отверстиями диаметром 1 мм).
Термостат, обеспечивающий поддержание температуры от 20°С до 35°С.
Автоклав (паровой стерилизатор), обеспечивающий поддержание температуры 132°С.
Дистиллятор или бидистиллятор, или аппарат для перегонки воды (кварцевый или стеклянный).
Шкаф сушильный с рабочей температурой не ниже 160°С и точностью поддержания температуры не более ±2°С.
Баня водяная, обеспечивающая работу при температуре 50°С - 60°С.
Чашки фарфоровые выпарительные 5 по ГОСТ 9147.
Колбы конические Кн-1(2)-100(250)-24/29(29/32) ТХС по ГОСТ 25336.
Колбы мерные 2-100(250)-2 по ГОСТ 1770.
Цилиндры 1(3)-50(100)-2 по ГОСТ 1770.
Пробирки П2Т(П3)-10(25, 50) по ГОСТ 25336.
Петля микробиологическая.
Стекла предметные.
Пробирки однократного применения (типа Эппендорф) вместимостью 1,5 см.
Бумага фильтровальная лабораторная по ГОСТ 12026.
Марля.
Пептон сухой ферментативный для бактериологических целей по ГОСТ 13805.
Экстракт дрожжевой.
-глюкоза по ГОСТ 6038, ч.д.а.
Ацетон по ГОСТ 2603, ч.д.а.
Натрий хлористый по ГОСТ 4233.
Стандарт-титр гидроокиси натрия молярной концентрации 0,1 моль/дм или натрия гидроокись по ГОСТ 4328, ч.д.а.
Спирт этиловый технический марки Б по ГОСТ 17299 или спирт этиловый ректификованный технический по ГОСТ 18300.
Кислота азотная по ГОСТ 4461, ч.
Натрий углекислый кислый по ГОСТ 4201.
Вода дистиллированная по ГОСТ 6709.
Тест-организмы - инфузории Tetrahymena pyriformis (тетрахимена пириформис), идентифицированные по морфологическим признакам согласно определителю простейших и протестированные на активность с помощью модельного токсиканта.
Примечание - Допускается использование других реактивов аналогичной или более высокой квалификации.
4.3.3 Подготовка к проведению испытаний
4.3.3.1 Подготовка стеклянной посуды
Посуда из стекла для культивирования инфузорий и биотестирования должна быть химически чистой. Стенки стеклянной посуды осторожно смачивают 10%-ным раствором азотной кислоты, через 2-3 ч посуду тщательно промывают водопроводной водой, ополаскивают раствором пищевой соды и промывают три раза дистиллированной водой. При сильном загрязнении посуды, а также новую посуду промывают водой, заполняют 10%-ным раствором азотной кислоты и выдерживают не менее суток, промывают водопроводной водой, затем тщательно промывают раствором соды, водопроводной и не менее трех раз дистиллированной водой. Для мытья посуды не разрешается использовать хромовую смесь, синтетические поверхностно-активные вещества и органические растворители. Чистую посуду для отбора проб, культивирования инфузорий и биотестирования сушат в сушильном шкафу при температуре 160°С в течение 1 ч.
Чистую посуду хранят закрытой в защищенных от пыли ящиках лабораторного стола или на закрытых полках, стеллажах и т.п.
4.3.3.2 Культивирование инфузорий Tetrahymena pyriformis (тетрахимена пириформис)
Для приготовления рабочей среды в 100 см дистиллированной воды растворяют 0,5 г пептона, 0,5 г
-глюкозы, 0,1 г дрожжевого экстракта, 0,1 г хлористого натрия. Раствор разливают в пробирки по 3-5 см
, закрывают ватно-марлевыми пробками и автоклавируют при температуре 130°С в течение 30 мин. Пробирки с рабочей средой хранят в холодильнике при температуре 10±1°С в течение 6 мес.
Пробирки с рабочей средой засевают над горелкой микробиологической петлей из культивационной пробирки с инфузориями и устанавливают в термостат с температурой +25°С. Через 2 сут из засеянных пробирок инфузории используют при биотестировании в течение 5 сут.
Для хранения культуры Tetrahymena pyriformis (тетрахимена пириформис) пробирку с культурой на 7 день после пересадки переносят из термостата в холодильник с температурой (10±1)°С, где культура хранится в течение 3 мес.
При случайном заражении культуры Tetrahymena pyriformis (тетрахимена пириформис) посторонней микрофлорой культуру пересевают на рабочую среду с добавлением антибиотика амоксициклина - 0,01 г на 100 см среды. После двух-трех пересеваний на среду, содержащую антибиотик, при условии отсутствия бактериальной зараженности культуру пересевают на рабочую среду.
Признаками бактериального заражения среды с инфузориями может быть наличие в пробирках осадка в виде хлопьев, повышенной мутности среды или бактериального кольца на верхней границе среды.
4.3.3.3 Подготовка пробы
Подготовка проб по 4.1.2.8.
Белково-витаминно-минеральные концентраты, премиксы, другие компоненты комбикормов и кормовые добавки вносят в количестве, соответствующем рецепту комбикорма, в размолотую пробу зерна пшеницы (ячменя), проверенного биотестированием и нетоксичного на 100%. Пробу зерна размалывают и тестируют в день проведения анализа и не хранят.
Консервированные корма для животных измельчают до получения однородной массы, анализируют по схеме биотестирования комбикорма, но с учетом содержания в этих кормах влаги, определение которой осуществляют в соответствии с ГОСТ 9793.
4.3.4 Проведение испытаний
4.3.4.1 Экстрагирование токсичных веществ из проб корма
Навеску анализируемого корма массой около 50 г помещают в мерную колбу вместимостью 250 см, приливают 100 см
ацетона и экстрагируют на аппарате для встряхивания жидкостей в течение 1 ч. Затем раствор осторожно сливают через бумажный фильтр в колбу или выпарительную чашку. Повторное экстрагирование проводят 50 см
ацетона в течение 30 мин. Жидкость сливают через бумажный фильтр, промывают его от 10 до 20 см
ацетона. Экстракты объединяют и выпаривают на водяной бане при температуре от 50°С до 60°С в вытяжном шкафу до полного испарения ацетона.
После выпаривания в чашку вносят от 1 до 2 см ацетона, чтобы смыть маслянистый экстракт со стенок чашки, и приливают 10 см
пептонной среды. Перемешивают и выпаривают содержимое до полного удаления запаха растворителя, фильтруют в виалы и, используя рН-метр, доводят до 7-7,5 ед. рН раствором гидроокиси натрия молярной концентрации 0,1 или 0,01 моль/дм
.
Параллельно готовят контрольный экстракт с целью определения качества ацетона и рабочей среды. Для этого проводят выпаривание растворителя (без навески анализируемого корма), внесение среды, доведение значения рН вышеуказанным способом. Полученный контрольный экстракт должен быть нетоксичным. Качество ацетона проверяют каждый раз при использовании новой партии, а качество питательной среды - при приготовлении новой порции.
4.3.4.2 Проведение биотестирования
Для каждой пробы проводят три параллельных испытания.
В каждую из трех пробирок типа Эппендорф вносят по 0,11 см подготовленной по 4.3.3.2 культуры инфузорий Tetrahymena pyriformis (тетрахимена пириформис). Отбирают пипеточным дозатором из каждой пробирки 0,01 см
культуры, помещают на предметное стекло и подсчитывают количество инфузорий. Добавляют в каждую пробирку 0,1 см
экстракта, приготовленного по 4.3.4.1, и оставляют при комнатной температуре.
Через 60 мин подсчитывают количество живых инфузорий в 0,01 см на предметном стекле под микроскопом, просматривая весь объем капли и все ее слои.
4.3.5 Обработка результатов
Степень токсичности корма определяют по количеству живых и погибших инфузорий через 60 мин после начала биотестирования.
Для этого рассчитывают коэффициент выживаемости инфузорий , %, по формуле
![]() , (2)
, (2)
где - среднеарифметическое значение (трех испытаний) количества инфузорий в 0,01 см
среды культивирования через 60 мин после введения пробы;
- среднеарифметическое значение (трех испытаний) количества инфузорий в 0,01 см
среды культивирования до введения пробы;
100 - коэффициент перевода в проценты.
На основании вычисленного коэффициента выживаемости оценивают токсичность исследуемого корма:
- если значение не менее 90%, корм является нетоксичным,
- если значение от 50% до 90%, корм является слаботоксичным,
- если значение не более 50%, корм является токсичным.
4.3.6 Оформление результатов
4.3.6.1 Результаты испытаний записывают в журнал, оформляют акт экспертизы или протокол испытаний, где указывают наличие или отсутствие токсичности корма и возможность его использования.
4.3.6.2 Нетоксичный корм дальнейшему исследованию не подлежит и используется по назначению без ограничений.
4.3.6.3 Слаботоксичный и токсичный корма направляют на биотестирование основными методами, а также на микологические, химико-токсикологические и бактериологические исследования.
4.4 Биотестирование кормов автоматизированным методом на инфузориях Paramecium caudatum (парамеции каудатум) и Tetrahymena pyriformis (тетрахимена пириформис)
4.4.1 Сущность метода
Сущность метода заключается в приготовлении водных экстрактов и водных растворов ацетоновых экстрактов анализируемой пробы, воздействии полученных экстрактов на инфузории Paramecium caudatum (парамеции каудатум), Tetrahymena pyriformis (тетрахимена пириформис) и оценке выживаемости инфузорий Paramecium caudatum (парамеции каудатум) на первом этапе и относительного прироста инфузорий Tetrahymena pyriformis (тетрахимена пириформис) на втором этапе с использованием комплекса биотестирования.
Первый и второй этапы биотестирования проводят одновременно или последовательно. По результатам первого этапа допускается принимать решение об окончании биотестирования (см. таблицу 2).
Таблица 2 - Оценка токсичности пробы по выживаемости инфузорий Paramecium caudatum (парамеции каудатум)
Коэффициент выживаемости инфузорий Paramecium caudatum (парамеции каудатум), % | Оценка токсичности пробы | Решение об окончании или продолжении испытания | |
Водный экстракт | Водный раствор ацетонового экстракта | ||
Не менее 90 | Не менее 90 | Нетоксичная | Окончание |
Менее 50 | Менее 50 | Токсичная | Окончание |
Все остальные варианты выживаемости | Продолжение испытания на втором этапе | ||
4.4.2 Средства измерений, вспомогательные устройства, материалы, реактивы
Комплекс биотестирования программно-технический автоматизированный "БИОЛАТ" (далее - прибор) с программным обеспечением для подсчета количества инфузорий.
Тест-организмы, идентифицированные по морфологическим признакам согласно определителю простейших и протестированные на активность с помощью модельного токсиканта:
- инфузории Paramecium caudatum (парамеции каудатум), концентрация которых не менее 500±100 клеток/см;
- инфузории Tetrahymena pyriformis (тетрахимена пириформис), концентрация которых не менее 200000±1000 клеток/см.
Микроскоп, обеспечивающий 3,6-100-кратное увеличение.
Весы неавтоматического действия по ГОСТ OIML R 76-1 с пределами допускаемой абсолютной погрешности ±0,001 г.
Термостат, обеспечивающий поддержание температуры от 20°С до 35°С.
Автоклав (паровой стерилизатор), обеспечивающий поддержание температуры 132°С.
Дистиллятор или бидистиллятор, или аппарат для перегонки воды (кварцевый или стеклянный).
Шкаф сушильный с рабочей температурой не ниже 160°С и точностью поддержания температуры не более ±2°С.
Мельница лабораторная электрическая, обеспечивающая измельчение пробы до размеров частиц не более 0,1 мм.
Аппарат для встряхивания жидкостей.
Центрифуга лабораторная с частотой вращения не менее 1000 об/мин.
Дозаторы пипеточные одноканальные переменного объема 2-20 мм,100-1000 мм
, с метрологическими характеристиками по ГОСТ 28311.
Спиртовка стеклянная лабораторная по ГОСТ 25336.
Петля микробиологическая.
Пробирки стеклянные по ГОСТ 25336.
Стаканы стеклянные В-1 (2)-25(50, 100) ТХС по ГОСТ 25336.
Вата медицинская гигроскопическая по ГОСТ 5556.
Чашки биологические (Петри), с крышками низкие ЧБН-1(2)-100 по ГОСТ 25336 (далее - чашки Петри).
Колбы Кн-1- 50-29/32 ТХС по ГОСТ 25336.
Колбы Кн-2-100-34 ТХС по ГОСТ 25336.
Колбы мерные 2(2а)-1000-2 по ГОСТ 1770.
Цилиндры 1(3)-50(100)-2 по ГОСТ 1770.
Вода дистиллированная по ГОСТ 6709.
Ацетон по ГОСТ 2603.
Натрий хлористый по ГОСТ 4233.
Медь сернокислая 5-водная (II) по ГОСТ 4165.
Магний хлористый 6-водный по ГОСТ 4209.
Натрий углекислый кислый по ГОСТ 4201.
Кальций хлористый 2-водный.
Калий хлористый по ГОСТ 4234.
Пептон сухой ферментативный для бактериологических целей по ГОСТ 13805.
Экстракт дрожжевой.
Глюкоза кристаллическая гидратная по ГОСТ 975.
Рис длиннозерный по ГОСТ 6292.
Примечание - Все реактивы должны быть марок ч., х.ч. или о.с.ч. Допускается использование других реактивов аналогичной или более высокой квалификации.
4.4.3 Подготовка к проведению испытаний
4.4.3.1 Подготовка стеклянной посуды
Посуду из стекла для культивирования инфузорий и биотестирования готовят в соответствии с 4.3.3.1.
4.4.3.2 Культивирование инфузорий Paramecium caudatum (парамеции каудатум)
Приготовление и хранение среды Лозина-Лозинского по 4.1.2.3.
Приготовленную среду Лозина-Лозинского кипятят в течение 5 мин.
Качество среды Лозина-Лозинского проверяют при приготовлении новой порции. Для этого в лунку планшета прибора вносят дозатором 100 мм культуры Paramecium caudatum (парамеции каудатум) и добавляют 400 мм
рабочего раствора среды Лозина-Лозинского. Через 30 мин проверяют состояние инфузорий. Среда считается доброкачественной, если нет гибели инфузорий.
Кормом инфузорий Paramecium caudatum (парамеции каудатум) является длиннозерный рис, который необходимо тщательно промыть в теплой воде и стерилизовать в автоклаве в течение 30 мин при 0,5 атм в сухих пробирках с ватно-марлевыми пробками. Хранят пробирки с кормом 3 мес в холодильнике при температуре от 4°С до 10°С.
В чистую чашку Петри, используя дозаторы, вносят 10 см культуры инфузорий Paramecium caudatum (парамеции каудатум) и добавляют около 40 см
среды Лозина-Лозинского (до 2/3 объема чашки). Корм (10 зерен риса) вносят в середину чашки Петри. Чашку с вновь засеянной культурой устанавливают в термостат с температурой 25°С.
Через 2 сут после начала культивирования и в течение последующих 5 сут инфузории Paramecium caudatum (парамеции каудатум) используют для биотестирования.
Критерий готовности культуры - достаточная концентрация инфузорий (около 100 инфузорий в 500 см).
4.4.3.3 Культивирование инфузорий Tetrahymena pyriformis (тетрахимена пириформис)
Инфузории Tetrahymena pyriformis (тетрахимена пириформис) культивируют в соответствии с 4.3.3.2.
4.4.3.4 Контроль качества культур инфузорий Paramecium caudatum (парамеции каудатум) и Tetrahymena pyriformis (тетрахимена пириформис)
Контроль качества культур инфузорий осуществляют с помощью модельного токсиканта 5-водной сернокислой меди.
В мерную колбу вместимостью 100 см помещают 20 мг 5-водной сернокислой меди, растворяют в дистиллированной воде и доводят объем раствора в колбе до метки дистиллированной водой.
Раствор модельного токсиканта с концентрацией 0,02 мг/см готовят путем разведения в 10 раз раствора с концентрацией 0,2 мг/см
.
Контроль качества культур проводят 1 раз в месяц с помощью свежеприготовленного раствора модельного токсиканта.
Примечание - Конечная концентрация модельного токсиканта в лунках с инфузориями 0,1 и 0,01 мг/см, т.к. в соответствии с инструкцией проведения биотестирования с помощью прибора токсикант разбавляется в лунках в 2 раза.
При надлежащей чувствительности культур и правильно поставленном эксперименте выживаемость инфузорий Paramecium caudatum (парамеции каудатум) в растворе сульфата меди с концентрацией 0,01 мг/см через 2 ч не более 50%, а относительный прирост культуры Tetrahymena pyriformis (тетрахимена пириформис) в контрольной пробе с концентрацией сульфата меди 0,1 мг/см
составляет от 40% до 60% от соответствующего показателя в контрольной пробе без токсиканта. Контрольной пробой является среда культивирования, разбавленная в 20 раз.
4.4.3.5 Проверка качества дистиллированной воды
Перед анализом необходимо проверить качество дистиллированной воды в лаборатории.
Для этого в лунку планшета прибора вносят дозатором 100 мм культуры Paramecium caudatum (парамеции каудатум) и добавляют 400 мм
дистиллированной воды. Через 30 мин проверяют состояние инфузорий. Вода считается доброкачественной, если нет гибели инфузорий. Критерий гибели: инфузории перестают двигаться, форма клетки становится более широкой.
4.4.3.6 Подготовка пробы
Подготовка проб по 4.3.3.3.
4.4.4 Проведение испытаний
4.4.4.1 Приготовление водных экстрактов
Навеску подготовленной по 4.4.3.6 пробы массой около 10 г помещают в колбу вместимостью 100 см с притертой пробкой, приливают 50 см
дистиллированной воды и экстрагируют на аппарате для встряхивания в течение 20 мин. Центрифугируют в течение 15 мин при 3000 об/мин. В чистую посуду отбирают не менее 15 см
надосадочной жидкости (далее - водный экстракт), которую используют для биотестирования. Полученный водный экстракт используют для биотестирования на первом и втором этапах.
Примечание - Для консервированных кормов пересчитывают массу навески с учетом содержания влаги и объем дистиллированной воды для экстракции. Например, при содержании влаги 50% вносят в экстракционную колбу 20 г корма и 40 см дистиллированной воды.
4.4.4.2 Приготовление водных растворов ацетоновых экстрактов
Навеску подготовленной по 4.4.3.6 пробы массой около 10 г помещают в колбу вместимостью 50 см с притертой пробкой, приливают 15 см
ацетона и экстрагируют на аппарате для встряхивания в течение 20 мин. После отстаивания в течение 10 мин отбирают 0,5 см
водного экстракта и переносят в стакан с 20 см
дистиллированной воды, получая водный раствор ацетонового экстракта, который используют для биотестирования. Полученный водный раствор ацетонового экстракта используют для биотестирования на первом и втором этапах.
При биотестировании сена, соломы и травяной муки допускается объем ацетона для экстракции увеличить до 25 см.
Примечание - Для консервированных кормов пересчитывают массу навески с учетом содержания влаги и объемы растворов для экстракции. Например, для получения водного раствора ацетонового экстракта 20 г корма экстрагируют в 20 см ацетона и после экстракции разводят 1 см
ацетонового экстракта в 20 см
дистиллированной воды.
Параллельно готовят контрольный водный раствор ацетона с целью определения качества ацетона. Для этого в стакане смешивают 0,5 см ацетона с 20 см
дистиллированной воды. Полученный водный раствор ацетона должен быть нетоксичным при биотестировании. Качество ацетона проверяют каждый раз при использовании новой партии.
4.4.4.3 Проведение первого этапа биотестирования на инфузориях Paramecium caudatum (парамеции каудатум)
Готовят прибор и задают параметры испытаний в соответствии с инструкцией.
Первый этап проводят для проб, подготовленных в виде водного экстракта (см. 4.4.4.1) и водного раствора ацетонового экстракта (см. 4.4.4.2).
В лунки внутреннего круга планшета дозатором вносят по 300 мм культуры Paramecium caudatum (парамеции каудатум) (см. 4.4.3.2), включают процесс подсчета в режиме "Краткосрочное исследование - Parameciums". Далее вносят по 300 мм
экстрактов проб и через 2 ч повторяют подсчет.
Примечание - Если пробы представляют собой эмульсии или имеют взвесь тонкой фракции, не выпавшей в осадок при центрифугировании, то второй подсчет проводят после раститровки содержимого лунок (инфузорий с пробами). В зависимости от степени мутности проб раститровку осуществляют из одной лунки в пять (1-5), в десять (1-10) или двадцать (1-20) лунок.
После окончания первого этапа биотестирования на основании автоматического подсчета инфузорий Paramecium caudatum (парамеции каудатум) с помощью программы рассчитывают коэффициент выживаемости, %, по формуле
![]() , (3)
, (3)
где - количество инфузорий после экспозиции в пробе, шт.;
- количество инфузорий до начала экспозиции в пробе, шт.;
100 - коэффициент перевода результата в проценты.
Полученные результаты оценивают в соответствии с таблицей 2 и принимают решение об окончании или продолжении испытаний.
4.4.4.4 Проведение второго этапа биотестирования на инфузориях Tetrahymena pyriformis (тетрахимена пириформис)
Культуру инфузории Tetrahymena pyriformis (тетрахимена пириформис) (см. 4.4.3.3) разбавляют в 10 раз дистиллированной водой. В лунки внешнего круга планшета дозатором вносят по 10 мм разбавленной культуры, добавляют по 150 мм
дистиллированной воды, включают процесс подсчета в режиме "Краткосрочное исследование - Tetrahymena". Далее вносят по 150 мм
экстрактов проб и через 20-24 ч повторяют подсчет. При необходимости раститровку для второго подсчета осуществляют аналогично раститровке первого этапа.
После окончания второго этапа биотестирования оценивают увеличение количества инфузорий Tetrahymena pyriformis (тетрахимена пириформис) в лунках с экстрактом проб по сравнению с увеличением количества инфузорий в контрольном растворе, которым является разбавленная в 20 раз среда культивирования этих инфузорий. Все подсчеты количества инфузорий осуществляются автоматически и сохраняются.
На основании автоматического подсчета инфузорий Tetrahymena pyriformis (тетрахимена пириформис) с помощью программы рассчитывают коэффициент относительного прироста , %, по формуле
![]() , (4)
, (4)
где - количество инфузорий после экспозиции в пробе, шт.;
- количество инфузорий после экспозиции в контрольном растворе, шт.;
- количество инфузорий до начала экспозиции в пробе, шт.;
- количество инфузорий до начала экспозиции в контрольном растворе, шт.;
100 - коэффициент перевода результата в проценты.
Полученные результаты оценивают в соответствии с таблицей 3 и принимают решение об окончании или продолжении испытаний иными методами.
Таблица 3 - Оценка токсичности пробы по приросту инфузорий Tetrahymena pyriformis (тетрахимена пириформис)
Коэффициент относительного прироста инфузорий Tetrahymena pyriformis (тетрахимена пириформис), % | Оценка токсичности пробы | |
Водный экстракт | Водный раствор ацетонового экстракта | |
Не менее 90 | Не менее 90 | Нетоксичная |
Не менее 90 | Не менее 50 и менее 90 | Слаботоксичная |
Не менее 50 и менее 90 | Не менее 90 | То же |
Менее 50 | Не менее 90 | Токсичная |
Не менее 90 | Менее 50 | То же |
Не менее 50 и менее 90 | Не менее 50 и менее 90 | " |
Менее 50 | Менее 50 | " |
Слаботоксичные и токсичные корма направляют на биотестирование основными методами, а также на микологические, химико-токсикологические и бактериологические исследования.
4.4.4.5 Оформление результатов
Результаты биотестирования оформляют по 4.3.6.
Подразделы 4.3, 4.4 (Введены дополнительно, Изм. N 1).
5 Основные методы определения общей токсичности кормов биотестированием на кроликах и мышах
Методы основаны на испытании кормов растительного и животного происхождения, а также комбикормов для продуктивных и непродуктивных животных и кормовых добавок методом биотестирования параллельно на кроликах (кожная проба) и на мышах (острый опыт), что дает возможность учесть как дермонекротическое действие токсинов, так и их воздействие на пищеварительную систему теплокровных животных. Результат определяют по совокупности реакций в обоих методах: корм нетоксичный (нетоксичен в обоих тестах), корм токсичный (токсичен хотя бы в одном тесте).
При этом готовят и вводят мышам либо ацетоновый экстракт (если по результатам экспресс-биотеста токсичен был ацетоновый экстракт корма), либо водный экстракт (если по результатам экспресс-биотеста токсичен был водный экстракт). Такой анализ дает возможность учесть действие водорастворимых и растворимых в ацетоне токсинов.
Отдельные концентрированные компоненты комбикормов и кормовые добавки (премиксы, белково-витаминные комплексы, минеральные и витаминные добавки, заменители цельного молока) предварительно смешивают в требуемом количестве с образцом размолотого нетоксичного на 100% зерна пшеницы.
5.1 Определение общей токсичности кормов биопробой на кроликах
Метод основан на дермонекротическом воздействии на кожу кролика, токсичных веществ, в основном микогенного происхождения, извлекаемых из кормов ацетоном.
5.1.1 Средства измерений, вспомогательные устройства, материалы, реактивы
Шкаф вытяжной со следующими характеристиками: 220В/50Гц/10А.
Весы лабораторные по ГОСТ OIML R 76-1, среднего класса точности, с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0,01 г.
Мельница лабораторная, обеспечивающая крупность помола 0,1 мм.
Аппарат для встряхивания жидкостей.
Баня водяная с максимальной температурой нагрева 100 °С, обеспечивающая точность поддержания температуры ±0,5 °С.
Колбы мерные 2-100(500, 1000)-2 по ГОСТ 1770.
Чашка выпарительная 5 по ГОСТ 9147.
Воронки лабораторные по ГОСТ 25336.
Цилиндры 1(3)-250 по ГОСТ 1770.
Лопатки стеклянные или пластиковые для нанесения раствора.
Сито металлическое с отверстиями диаметром 1 мм.
Ножницы маникюрные с загнутыми кверху концами.
Бумага фильтровальная по ГОСТ 12026.
Кролик белый (живая масса от 2,0 до 2,5 кг) с неповрежденной кожей.
Воротник из фанеры или пластика с размерами 15x20 см.
Ацетон по ГОСТ 2603, ч.д.а., ос.ч.
Масло подсолнечное рафинированное по ГОСТ 1129.
(Измененная редакция, Изм. N 1).
5.1.2 Подготовка к проведению испытаний
5.1.2.1 Среднюю пробу корма измельчают и просеивают через сито с отверстиями диаметром 1 мм.
5.1.2.2 Для приготовления ацетонового экстракта испытуемого корма в колбу с пришлифованной пробкой вместимостью 500 см помещают 50 г измельченного корма, заливают его 150 см
ацетона и оставляют для экстракции на 24 ч или экстрагируют 3 ч на аппарате для встряхивания жидкостей. Слой экстрагента над пробой должен быть не менее 1 см.
После окончания экстракции жидкость фильтруют через бумажный фильтр и помещают в чашку для выпаривания. Оставшийся в колбе корм дополнительно промывают небольшой порцией экстрагента (не менее 20 см), эту промывную жидкость фильтруют через тот же фильтр в ту же чашку.
Экстракт концентрируют в вытяжном шкафу до полного удаления запаха растворителя и получения маслянистого остатка желтоватого или коричневого оттенка. Для ускорения процесса чашку для выпаривания с экстрактом помещают на водяную баню температурой от 45 °C до 50 °C.
Периодически оседающий на стенках чашки осадок смывают на дно чашки, покачивая ее и обмывая стенки растворителем. Экстракт, оставшийся на стенках чашки, смывают экстрагентом на дно, затем снова концентрируют. В чашку, при необходимости, добавляют растительного масла в таком количестве, чтобы общий объем пробы был не менее 1 см. Экстракт хранят в холодильнике.
При одновременном тестировании ацетонового экстракта данного образца на кроликах и мышах следует брать навеску массой 150 г, помещать ее в коническую колбу на 1000 см и заливать от 300 до 400 см
ацетона.
5.1.2.3 Приготовление тест-организма проводят в следующем порядке. У кролика на участке кожи с размерами 6x6 см в области бедра, лопатки или бока в день постановки испытания тщательно выстригают волосяной покров (до полного оголения). Не допускается для испытания кожа поврежденная, пигментированная, а также с признаками шелушения.
На одном кролике допускается ставить одновременно не более четырех проб. Повторное использование кролика для постановки биопробы допускается лишь при получении отрицательных результатов предыдущих испытаний и полного восстановления шерстного покрова.
Все корма для вивариумных животных, используемых в биотестировании, должны быть непременно проверены на общую токсичность и иметь отрицательные результаты. В противном случае в крови животных будет идти процесс накопления антигенов, который выражается в аллергической реакции кожи. Постановка биотеста на таком животном даст искаженные результаты испытания.
5.1.3 Проведение испытания
На выстриженный участок кожи кролика стеклянной или пластиковой лопаткой наносят, слегка втирая, половину экстракта, вторую половину экстракта оставляют в холодильнике для повторного нанесения на следующий день. В качестве контроля используют один оголенный участок кожи с размерами 6x6 см, на который не наносят экстракт. С целью предупреждения слизывания экстракта, нанесенного на кожу, на шею кролика надевают воротник, который снимают не ранее чем через 3 сут после первого нанесения экстракта.
Наблюдение за реакцией начинают на следующий день после повторного нанесения экстракта и продолжают в течение 3 сут.
Новую партию растительного масла, используемого для разбавления экстракта, необходимо предварительно проверить на токсичность. Для этого выстриженный участок кожи дважды (с интервалом в сутки) смазывают растительным маслом и учитывают кожную реакцию. Масло не должно вызывать покраснения кожи.
5.1.4 Обработка результатов
Токсичность исследуемых кормов определяют по наличию воспалительного процесса на участке кожи с нанесенным экстрактом.
Корм нетоксичный, если отсутствует воспалительная реакция кожи. Допускается наличие гиперемии, сохраняющейся не более 2 сут после повторного нанесения экстракта и не сопровождающейся шелушением кожи.
Корм токсичный, если наблюдаются гиперемия, сохраняющаяся 3 сут и более после повторного нанесения экстракта на кожу, шелушение, болезненность, уплотнение или отечность кожи, возможны точечные капиллярные кровоизлияния. В случае крайней степени токсичности корма по всей поверхности участка кожи появляются язвы, затем образуется сплошной струп.
5.1.5 Оформление результатов испытания
Результаты испытаний кормов записывают в журнал и оформляют акт экспертизы или протокол испытаний, где указывают наличие или отсутствие токсичности корма и возможность его применения. Нетоксичный корм используют по назначению без ограничений. Токсичные корма использованию не подлежат.
5.2 Определение общей токсичности кормов в опыте на мышах
5.2.1 Основные положения
Метод основан на извлечении токсичных веществ из кормов растительного и животного происхождения, комбикормов и кормовых добавок ацетоном или водой (в зависимости от результатов экспресс-биотеста) и введении экстракта однократно в желудок белым мышам.
5.2.2 Средства измерений, вспомогательные устройства, материалы, реактивы
Шкаф вытяжной со следующими характеристиками: 220В/50Гц/10А.
Весы лабораторные по ГОСТ OIML R 76-1, среднего класса точности, с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0,01 г.
Мельница лабораторная, обеспечивающая крупность помола 0,1 мм.
Аппарат для встряхивания жидкостей.
Баня водяная с максимальной температурой нагрева 100 °C, обеспечивающая точность поддержания температуры ±0,5 °C.
Колбы мерные 2-100(500, 1000)-2 по ГОСТ 1770.
Чашка выпарительная 5 по ГОСТ 9147.
Цилиндры 1(3)-250 по ГОСТ 1770.
Шприцы на 1 или 2 см по ГОСТ 22967 с тупыми изогнутыми иглами.
Сито металлическое с отверстиями диаметром 1 мм.
Бумага фильтровальная по ГОСТ 12026.
Мыши белые живой массой от 16 до 25 г.
Ацетон по ГОСТ 2603, ч.д.а., ос.ч.
Вода дистиллированная по ГОСТ 6709.
Масло растительное.
(Измененная редакция, Изм. N 1).
5.2.3 Подготовка к проведению испытаний
5.2.3.1 Для подготовки пробы для испытаний среднюю пробу испытуемого корма измельчают и просеивают через сито с отверстиями диаметром 1 мм.
Концентрированные компоненты комбикормов и кормовые добавки анализируют по схеме биотестирования комбикормов, предварительно введя эти вещества в количестве, определенном рецептом или зоотехническими нормами в размолотый образец проверенного биотестированием, нетоксичного на 100% зерна пшеницы.
5.2.3.2 Приготовление ацетонового экстракта испытуемого корма проводят в следующем порядке. В колбу с пришлифованной пробкой вместимостью 500 см помещают 100 г измельченного корма, наливают от 200 до 300 см
ацетона и экстрагируют 3 ч на аппарате для встряхивания жидкостей. Слой экстрагента над пробой должен быть не менее 1 см.
После окончания экстракции жидкость фильтруют через бумажный фильтр (белая лента) и помещают в чашку для выпаривания. Оставшийся в колбе корм дополнительно промывают небольшой порцией экстрагента (не менее 20 см), промывную порцию фильтруют через тот же фильтр. Экстракт концентрируют в вытяжном шкафу до полного удаления запаха растворителя и получения маслянистого остатка желтоватого или коричневого оттенка. Для ускорения процесса чашку для выпаривания с экстрактом помещают на водяную баню с температурой от 45 °C до 50 °C. Периодически оседающий на стенках чашки осадок смывают на дно чашки, покачивая ее и обмывая растворителем.
Экстракт, оставшийся на стенках чашки, смывают экстрагентом на дно, затем снова концентрируют. Добавляют в чашку 2,5 см растительного масла (кроме экстракта из жмыхов). При необходимости экстракт можно хранить в холодильнике не более 3 сут.
5.2.3.3 Для приготовления водного экстракта испытуемого корма пробу массой 50 г помещают в коническую колбу на 500 см и приливают 200 см
дистиллированной воды. Колбу помещают на аппарат для встряхивания жидкостей на 20 мин. По окончании экстракции содержимое колбы фильтруют через бумажный фильтр (белая лента). Полученный водный экстракт испытуемого корма можно хранить в холодильнике не более 2 сут.
5.2.3.4 Для подготовки тест-организмов в отдельную клетку отсаживают пять белых мышей весом от 16 до 25 г и выдерживают их без корма в течение 4-5 ч.
Все корма для кормления вивариумных животных, используемых в биотестировании, должны быть непременно проверены на общую токсичность и иметь отрицательные результаты.
5.2.4 Проведение испытания
Пяти мышам с помощью шприца с тупой изогнутой иглой длиной от 3 до 4 см вводят однократно через рот в желудок 0,5 см выпаренного остатка ацетонового экстракта корма или 0,5 см
водного экстракта корма. Наблюдают за мышами в течение 3 сут, не ограничивая их в кормах и воде. При отсутствии падежа мышей убивают (усыпляют медицинским эфиром) и вскрывают.
В качестве контрольного испытания пяти белым мышам вводят:
а) растительное масло (в случае ацетоновой экстракции), которым разводили экстракт корма;
б) дистиллированную воду (в случае водной экстракции).
Контрольное испытание на масло проводят каждый раз при смене партии масла. Необходимо соблюдать сроки хранения масла.
Контрольное испытание на дистиллированную воду ставят каждый раз перед испытанием водного экстракта корма.
5.2.5 Обработка результатов
Учет реакции ведут на основании анализа состояния внутренних органов (желудочно-кишечного тракта, печени, селезенки, почек) при вскрытии мышей.
Корм нетоксичный, если все мыши живы, а при вскрытии убитых мышей патологоанатомических изменений не обнаружено.
Корм токсичный, если мыши гибнут все или хотя бы одна мышь и при вскрытии павших и убитых животных устанавливают геморрагическое воспаление желудочно-кишечного тракта, часто сопровождающееся дегенерацией печени, почек, селезенки или кровоизлияниями в паренхиматозных органах.
При параллельном анализе на кроликах и мышах нетоксичным считают корм, который окажется нетоксичным в обоих вариантах анализа.
5.2.6 Оформление результатов испытания
Результаты испытаний кормов записывают в журнал и оформляют акт экспертизы или протокол испытания о наличии или отсутствии токсичности корма и возможности его применения. Нетоксичные корма используют по назначению без ограничений. Токсичные корма использованию не подлежат.
6 Требования безопасности
6.1 При выполнении испытаний необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007, требования электробезопасности при работе с электроприборами по ГОСТ 12.2.007.0 и ГОСТ 12.1.019, а также требования, изложенные в технической документации на используемые приборы.
6.2 Работа с химическими реактивами должна проводиться в вытяжном шкафу.
6.3 Помещение должно быть оснащено вентиляционными системами по ГОСТ 12.4.021, средствами пожаротушения по ГОСТ 12.4.009 и соответствовать требованиям пожаробезопасности по ГОСТ 12.1.004.
6.4 Содержание вредных веществ в воздухе не должно превышать допустимых значений по ГОСТ 12.1.005.
(Измененная редакция, Изм. N 1).
7 Требования к проведению испытаний
7.1 Условия проведения испытаний
Культивирование и биотестирование проводят в отдельном помещении с естественным или искусственным освещением, изолированном от химических токсичных реактивов (особенно от летучих соединений, хорошо растворимых в воде).
При подготовке и проведении испытаний должны быть соблюдены следующие условия:
- температура окружающей среды | от 17°С до 27°С; |
- относительная влажность | не более 80%. |
7.2 Требования к квалификации оператора
К выполнению испытаний и обработке их результатов допускают специалиста, имеющего высшее или среднее специальное образование и опыт работы в химической лаборатории, прошедшего соответствующий инструктаж, освоившего метод биотестирования в процессе обучения и нормативы оперативного контроля при выполнении процедур контроля точности испытаний.
Раздел 7 (Введен дополнительно, Изм. N 1).
Приложение А
(справочное)
Схемы биотестирования исследуемых кормов
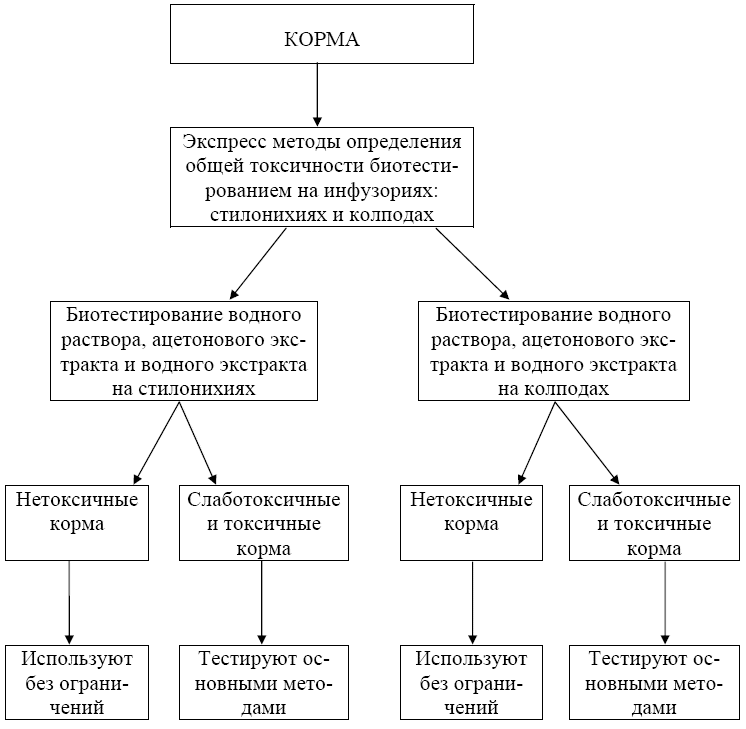
Рисунок А.1 - Биотестирование экспресс-методами
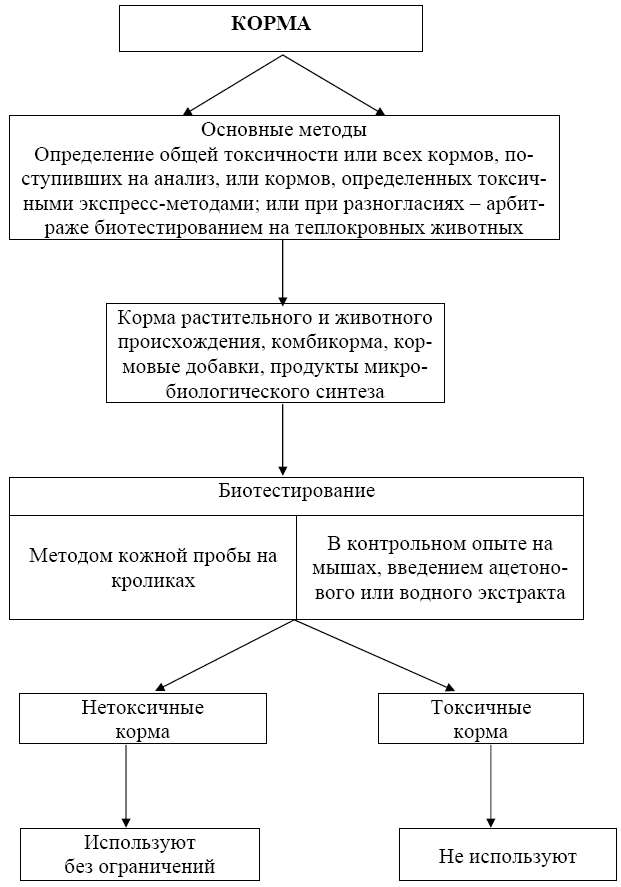
Рисунок А.2 - Биотестирование основными методами
Приложение Б
(обязательное)
Оформление и хранение проб исследуемых кормов
Б.1 Отбор проб проводят с участием ветеринарных и зоотехнических специалистов и представителей администрации предприятий, хозяйств, а в конфликтных случаях - с участием представителя организации-поставщика и уполномоченных органов в установленном порядке.
Б.2 При обнаружении у животного признаков токсикоза из рационов исключают корма, подозреваемые в недоброкачественности. Для исследования в ветеринарную лабораторию рекомендуется выслать пробы всех кормов, входивших в суточный рацион в течение 1 мес до проявления болезни, и остатки кормов в кормушках (грубые корма отбирают из пораженных участков партии).
Б.3 Отобранную среднюю пробу разделяют на две части массой не менее 1 кг каждая, упаковывают в чистые сухие банки или мешки и опечатывают. Одну часть пробы направляют для исследований с актом комиссии по отбору и с сопроводительным документом, вторую часть пробы хранят на предприятии или в хозяйстве в течение 1 мес в условиях, предотвращающих их порчу.
Б.4 В конфликтных случаях по требованию представителя-поставщика ему должна быть дополнительно выделена часть отобранной на предприятии или в хозяйстве пробы.
Б.5 При диагностических исследованиях дополнительно указывают дату возникновения заболевания, вид и количество заболевших животных, описывают основные клинические признаки заболевания. В случае падежа животных к сопроводительному документу прилагается копия акта вскрытия с подробным описанием установленных патологоанатомических изменений.
__________________________________________________________________________
УДК 633.1.001.4:006.354 МКС 65.120
Ключевые слова: корма, комбикорма, комбикормовое сырье, токсичность, биотестирование, парамеции, стилонихии. колподы, кролики, мыши, экспресс-методы. основные методы
_____________________________________________________________________________
Электронный текст документа
и сверен по:
, 2014
Редакция документа с учетом
изменений и дополнений подготовлена