ГОСТ Р 51198-98
(ИСО 4134-78)
Группа Н19
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
МЯСО И МЯСНЫЕ ПРОДУКТЫ
Метод определения -(+)-глутаминовой кислоты
Meat and meat products. Method for determination of -(+)-glytamic acid content
ОКС 67.120.10
ОКСТУ 9209
Дата введения 2000-01-01
Предисловие
1 РАЗРАБОТАН Московской государственной академией пищевых производств
ВНЕСЕН Техническим комитетом по стандартизации ТК 335 "Методы испытаний агропромышленной продукции на безопасность"
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 28 августа 1998 г. N 336
3 Настоящий стандарт представляет собой аутентичный текст международного стандарта ИСО 4134-78 "Мясо и мясные продукты. Определение содержания -(+)-глутаминовой кислоты" с дополнительными требованиями, отражающими потребности экономики страны (2, 4, 6.6, 6.8, 6.12, 6.13, 7.1 и 9.1)
4 ВВЕДЕН ВПЕРВЫЕ
5 ПЕРЕИЗДАНИЕ. Январь 2010 г.
1 Область применения
1 Область применения
Настоящий стандарт распространяется на мясо и мясные продукты и устанавливает метод определения -(+)-глутаминовой кислоты.
2 Нормативные ссылки
ГОСТ 9793-74 Продукты мясные. Методы определения влаги
ГОСТ Р 51447-99 (ИСО 3100-1-91) Мясо и мясные продукты. Методы отбора проб
3 Определение
Массовая доля -(+)-глутаминовой кислоты - массовая доля
-(+)-глутаминовой кислоты, определенная в соответствии с настоящим стандартом и выраженная в процентах.
4 Сущность метода
-(+)-глутаминовую кислоту экстрагируют из пробы продукта, взятой на испытание, ледяным раствором хлорной кислоты. Смесь центрифугируют, фильтруют и доводят активную кислотность фильтрата до требуемого значения. Проводят ферментативное преобразование
-(+)-глутамата в
-кетоглутарат в ходе реакции с никотинамидадениндинуклеотидом (НАД) в присутствии глутаматдегидрогеназы (ГДГ):
-(+)-глутамат + НАД
+ Н
О
-кетоглутарат + НАДН + NН
+ Н
.
Затем окисляют эквивалентное количество восстановленной формы НАДН хлоридом йодонитротетразолия (ИНТ) в присутствии липоаминдегидрогеназы (ЛАДГ):
НАДН + ИНТ-хлорид + Н
HAД
+ формазан.
Измеряют массовую долю образовавшегося формазана на спектрофотометре при длине волны 492 нм.
5 Реактивы
Все реактивы должны быть аналитического качества (не ниже х.ч.). Все растворы, кроме растворов неорганических соединений (5.1 и 5.2), должны храниться в закрытой посуде из темного стекла, тщательно вымытой и пропаренной или стерилизованной.
Вода, используемая для приготовления растворов ферментов, должна быть деминерализованной или бидистиллированной, полученной в стеклянном дистилляторе.
Вода, используемая для приготовления растворов химических реагентов и подготовки проб, должна быть дистиллированной или деминерализованной.
Примечание - Однократно дистиллированная вода может содержать ионы металлов, которые снижают активность ферментов, а деминерализованная вода может содержать микроорганизмы, увеличивающие неспецифическую фоновую ферментативную активность и искажающие результаты анализа.
Препарат НАД должен содержать не менее 90% основного вещества.-(+)-глутаминовая кислота должна содержать не менее 98% основного вещества.
Допускается использовать имеющиеся в продаже готовые наборы реактивов при условии соответствия качества реактивов требованиям настоящего стандарта.
5.1 Раствор хлорной кислоты (HClO
)=1,0 моль/дм
8,6 см раствора хлорной кислоты массовой доли 70% и плотности 1,67 г/см
помещают в мерную колбу вместимостью 100 см
и доводят объем раствора до метки водой.
Примечание - При использовании хлорной кислоты меньшей массовой доли проводят перерасчет объема кислоты, используемой для осаждения белков.
5.2 Раствор гидроксида калия (KOH)=2 моль/дм
Растворяют 56,1 г гидроксида калия (KOH) в воде, доводят объем раствора до 500 см.
5.3 Буферный раствор активной кислотности 8,6 рН
5.3.1 Растворяют 1,86 г гидрохлорида триэтаноламина в воде, доводят активную кислотность раствора до 8,6 рН раствором гидроксида калия (5.2), используя для измерений рН-метр. Затем добавляют 0,68 г октилфенолдекаэтиленгликолевого эфира (например, Тритон =100) и доводят объем раствора до 100 см
водой.
5.3.2 Растворяют 0,86 г двузамещенного фосфорнокислого калия (KНРO
) и 0,007 г однозамещенного фосфорнокислого калия (KН
РO
) в воде и доводят объем раствора до 100 см
.
5.3.3 Смешивают 20 см раствора по 5.3.1 и 5 см
раствора по 5.3.2.
Раствор хранят при температуре 4 °С.
5.4 Раствор НАД
Навеску НАД массой 0,025 г растворяют в 5,0 см воды в небольшой колбе со шлифом, колбу закрывают пробкой.
Раствор устойчив не менее 1 мес при температуре 4 °С.
5.5 Раствор йодонитротетразолия [2-(р-йодофенил)-3-(р-нитрофенил)-5-фенилтетразолия] хлорида (ИНТ-хлорида)
Растворяют 0,030 г ИНТ-хлорида в 50 см воды, колбу закрывают пробкой.
Раствор устойчив не менее 2 мес при температуре 4 °С в темноте.
5.6 Раствор ЛАДГ
Растворяют 0,003 г лиофильно высушенной липоаминдегидрогеназы в 1 см воды.
Раствор устойчив не менее трех недель при температуре 4 °С.
5.7 Раствор ГДГ
Используют раствор глютаматдегидрогеназы концентрации 10 мг/см, свободный от сульфата аммония, этилендиаминтетрауксусной кислоты и глутаминазы, поставляемый в готовом виде (например в расфасовке по 1,0 см
), удельной активностью не менее 900 Е/см
.
Раствор устойчив не менее 12 мес при температуре 4 °С.
5.8 Стандартный раствор -(+)-глутаминовой кислоты
Растворяют 0,050 г -(+)-глутаминовой кислоты в 25 см
воды. Активную кислотность раствора устанавливают 7,0 рН раствором гидроксида калия (5.2), после чего доводят объем раствора до 50 см
.
Раствор хранят при температуре 4 °С и непосредственно перед использованием разводят водой в соотношении объемов 1:49.
6 Средства контроля и вспомогательные устройства
Обычная лабораторная аппаратура, а также указанная в 6.1-6.11.
6.1 Мясорубка механическая лабораторная, снабженная перфорированной пластинкой с отверстиями диаметром не более 4 мм.
6.2 Миксер лабораторный.
6.3 Центрифуга лабораторная с пробирками вместимостью 50 или 100 см.
6.4 Иономер или рН-метр диапазоном измерений от 1 до 14 рН и допускаемой погрешностью ±0,05 рН.
6.5 Фильтры бумажные гофрированные диаметром 15 см.
6.6 Колбы мерные вместимостью 100 и 250 см и допускаемой относительной погрешностью ±0,2%.
6.7 Дозаторы пипеточные объемами доз 25, 50 и 100 см и относительной погрешностью дозирования ±1%.
6.8 Пипетки градуированные вместимостью 0,05; 0,2; 0,5 и 2,5 см и допускаемой относительной погрешностью ±1%.
6.9 Шпатели пластиковые или палочки стеклянные для перемешивания содержимого кюветы при проведении фотометрических измерений.
6.10 Спектрофотометр (фотометр) со следующими техническими характеристиками: спектральный интервал - не более 10 нм; интервал измерений оптической плотности - от 0,000 до 2,000; погрешность установки длины волны - ±3 нм; среднее квадратическое отклонение случайной составляющей погрешности измерений - не более 0,15%.
6.11 Кюветы фотометрические толщиной поглощающего слоя 10 мм.
6.12 Термометр жидкостный стеклянный с интервалом измерений от 0 до 100 °С, допускаемой погрешностью измерений ±2 °С.
6.13 Весы лабораторные общего назначения с наибольшим пределом взвешивания 200 г и допускаемой погрешностью ±0,001 г.
7 Порядок подготовки к проведению измерений
7.1 Отбор проб - по ГОСТ Р 51447.
7.2 Пробу массой не менее 200 г, полученную из репрезентативной выборки, хранят в условиях, предотвращающих порчу и изменение состава.
8 Порядок проведения измерений
8.1 Подготовка пробы к проведению измерений
Образец пробы гомогенизируют, дважды пропуская через мясорубку (6.1) и тщательно перемешивая.
Образец хранят не более 24 ч в заполненном доверху и герметически закрытом контейнере таким образом, чтобы предотвратить порчу или изменение состава.
8.2 Навеска для проведения анализа
Взвешивают приблизительно 50 г исследуемого образца с точностью до 10 мг и помещают навеску образца в лабораторный миксер (6.2).
8.3 Приготовление экстракта
8.3.1 К навеске образца в лабораторном миксере добавляют 100 см охлажденного льдом раствора хлорной кислоты (5.1) и гомогенизируют.
8.3.2 Часть гомогенизата помещают в центрифужную пробирку и центрифугируют 10 мин при угловой скорости 3000 мин, затем, осторожно отодвинув слой жира, отфильтровывают супернатант через гофрированный бумажный фильтр (6.5) в коническую колбу вместимостью 200 см
. Первые 10 см
фильтрата выбрасывают.
8.3.3 50 см подготовленного раствора, который может быть слегка мутным, переносят в стаканчик вместимостью 100 см
и доводят активную кислотность раствора до 10 рН раствором гидроксида калия (5.2).
8.3.4 Количественно переносят содержимое стаканчика в мерную колбу вместимостью 100 см и доводят объем раствора до метки водой.
8.3.5 Раствор охлаждают в ледяной бане 20 мин и фильтруют через гофрированный бумажный фильтр (6.5), отбросив первые 10 см фильтрата.
8.3.6 25 см фильтрата переносят в мерную колбу вместимостью 250 см
и доводят объем фильтрата до метки водой.
Примечание - Объем фильтрата выбирают так, чтобы концентрация -(+)-глутаминовой кислоты была приблизительно 0,030 г/дм
.
8.4 Определение
8.4.1 Температуру растворов по 5.3 и 8.3.6 доводят до 20-25 °С. Для проведения ферментативной реакции берут две фотометрические кюветы (6.11), в каждую из которых пипеточным дозатором (6.5) добавляют:
- 2,50 см буферного раствора (5.3);
- 0,20 см раствора НАД (5.4);
- 0,20 см раствора ИНТ (5.5) и
- 0,05 см раствора линоаминдегидрогеназа (5.6).
Затем в одну кювету вносят 0,50 см экстракта (8.3.6), получая исследуемый раствор, а во вторую - 0,50 см
воды, получая контрольный раствор.
Растворы в кюветах перемешивают пластиковыми шпателями или стеклянными палочками (6.9) и измеряют оптические плотности относительно воздуха при длине волны 492 нм: - оптическая плотность исследуемого раствора,
- оптическая плотность контрольного раствора.
Температура растворов должна быть от 20 до 25 °
С.
8.4.2 В каждую кювету вносят по 0,05 см раствора ГДГ (5.7) и тщательно смешивают с содержимым, используя шпатель или стеклянную палочку (6.9).
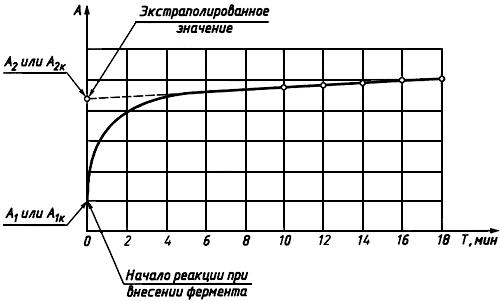
Растворы выдерживают 15 мин. Затем измеряют оптические плотности при длине волны 492 нм, повторяя измерения через каждые 2 мин до достижения постоянных значений.
Строят графики зависимости оптических плотностей растворов от времени и экстраполируют их на момент внесения фермента ГДГ (приложение А).
Получают экстраполированные значения оптических плотностей исследуемого () и контрольного (
) растворов.
8.4.3 Определяют микромолярный коэффициент оптической плотности формазана, повторяя операции по 8.4.1 и 8.4.2, но заменяя 0,5 см экстракта в первой фотометрической кювете на 0,5 см
стандартного раствора
-(+)-глутаминовой кислоты (5.8).
Получают следующие значения оптических плотностей:
- - стандартного раствора
-(+)-глутаминовой кислоты;
- - контрольного раствора;
- - стандартного раствора
-(+)-глутаминовой кислоты;
- - контрольного раство
ра.
8.5 Выполняют два параллельных определения в двух пробах из одного и того же образца (8.1).
9 Правила обработки результатов измерений
9.1 Метод расчета
Массовую долю -(+)-глутаминовой кислоты в пробе
, %, вычисляют по формуле
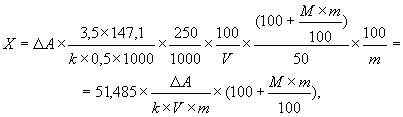
где ![]() ;
; - молярная масса
-(+)-глутаминовой кислоты;
- массовая доля влаги в пробе, определенная по ГОСТ 9793;
- масса навески (8.2), г;
- объем фильтрата, взятый на определение (8.3.6), см
;
- микромолярный коэффициент оптической плотности формазана при длине волны 492 нм, см
/мкмоль, рассчитанный по формуле
![]() ,
,
где ![]() .
.
За результат измерений принимают среднеарифметическое значение результатов двух параллельных определений при условии выполнения 9.2.
Результат определяют с точностью 0,01%.
9.2 Сходимость
Относительное расхождение результатов двух параллельных определений, выполненных в одной лаборатории, не должно превышать 10% среднеарифметического значения.
10 Оформление результатов измерений
В отчете об испытании должны быть указаны:
- используемый метод;
- полученные результаты;
- любые условия проведения испытаний, не установленные данным стандартом и касающиеся подробностей, которые могут повлиять на конечный результат.
В отчете должны быть все данные, необходимые для полной идентификации пробы.
Приложение А (справочное). Пример построения графика зависимости оптической плотности раствора от времени
ПРИЛОЖЕНИЕ А
(справочное)
Электронный текст документа подготовлен
и сверен по:
официальное издание
Продукты мясные.
Методы анализа: Сб. ГОСТов. -
М.: Стандартинформ, 2010
