ГОСТ EN 15652-2015
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Определение ниацина методом высокоэффективной жидкостной хроматографии
Foodstuffs. Determination of niacin by high performance liquid chromatography
МКС 67.050
Дата введения 2017-01-01
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом "Всероссийский научно-исследовательский институт сертификации" на основе аутентичного перевода на русский язык европейского регионального стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Госстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 29 мая 2015 г. N 77-П)
За принятие проголосовали:
Краткое наименование страны по | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 21 июля 2015 г. N 950-ст межгосударственный стандарт ГОСТ EN 15652-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2017 г.
5 Настоящий стандарт идентичен европейскому региональному стандарту EN 15652:2009* Foodstuffs - Determination of niacin by HPLC (Продукты пищевые. Определение ниацина высокоэффективной жидкостной хроматографией).
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт . - .
Европейский региональный стандарт разработан техническим комитетом CEN/TC 275 "Анализ пищевых продуктов. Горизонтальные методы", секретариатом которого является DIN (Германия).
Перевод с немецкого языка (de).
Официальные экземпляры европейского регионального стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, и европейского регионального стандарта, на который дана ссылка, имеются в Федеральном информационном фонде технических регламентов и стандартов.
Сведения о соответствии межгосударственных стандартов ссылочным европейским региональным стандартам приведены в дополнительном приложении ДА.
Степень соответствия - идентичная (IDT)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
1 Область применения
Настоящий стандарт устанавливает метод определения содержания ниацина в пищевых продуктах методом высокоэффективной жидкостной хроматографии (ВЭЖХ) после гидролиза пробы, который может быть проведен тремя способами: кислотный гидролиз (А), ферментативный гидролиз (В) и последовательный кислотный и щелочной гидролиз (С).
Метод был валидирован при межлабораторных сравнительных испытаниях на обогащенных и не обогащенных пищевых продуктах, а именно пробах концентратов типа сухого завтрака - мюсли и мюсли с шоколадом, вареном окороке, зеленом горошке, лиофилизированном зеленом горошке с ветчиной, лиофилизированном супе, обогащенном апельсиновом соке, сухом молоке и пшеничной муке в диапазоне значений содержания ниацина от 0,5 до 24мг/100 г. Дальнейшая информация приведена в Приложении В.
Способы А и В приводят к аналогичным результатам для ниацина. В этих случаях ниацин определяется как суммарное содержание никотинамида и никотиновой кислоты в пересчете на никотиновую кислоту [1]. Способ С приводит к более высоким значениям содержания ниацина в необогащенных злаках по сравнению со способами А и В, но в остальных пищевых продуктах дает сходные результаты. В способе С никотинамид превращается в никотиновую кислоту, и ниацин определяется в форме никотиновой кислоты [2].
Способ А является более производительным и экономичным, нежели способы В и С.
Способ В применяется, если требуется раздельное количественное определение никотинамида и никотиновой кислоты. Способ А для этих целей непригоден, поскольку при кислотном гидролизе никотинамид в небольшой степени превращается в никотиновую кислоту.
В способе С определяют общее содержание ниацина. Щелочной гидролиз может вызвать высвобождение никотиновой кислоты из других производных, как правило, не являющихся биологически активными, что приводит к завышенным значениям содержания ниацина в таких пищевых продуктах, как кукуруза или злаки ([3], [4], [5]).
Сравнение трех способов проведения гидролиза приведено в Приложении С.
2 Нормативные ссылки
Приведенные ниже ссылочные нормативные документы являются обязательными для применения настоящего стандарта*. Для датированных ссылок применимо только цитируемое издание. В случае недатированных ссылок используют последнее издание документа, включая все изменения.
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
EN ISO 3696 Water for analytical laboratory use - Specification and test methods (ISO 3696:1987 Вода для лабораторного анализа. Технические требования и методы испытаний)
3 Сущность метода
Витамеры ниацина извлекают из пищевых продуктов путем кислотного гидролиза (способ А), ферментативного гидролиза (способ В) или последовательного кислотного и щелочного гидролиза (способ С) и определяют методом ВЭЖХ с флуориметрическим детектированием в режиме послеколоночной дериватизации под действием ультрафиолетового излучения ([1], [2]). В способах А и В ниацин определяется как сумма содержаний никотинамида и никотиновой кислоты в пересчете на никотиновую кислоту после введение поправки на молекулярную массу. При щелочном гидролизе никотинамид полностью переходит в никотиновую кислоту.
4 Реактивы
4.1 Общие положения
При проведении анализа, если не оговорены другие условия, используют только реактивы установленной аналитической чистоты и воду не ниже первой степени чистоты по EN ISO 3696.
4.2 Требования к химическим реактивам и приготовление растворов
4.2.1 Ацетат натрия, массовая доля основного вещества w(CH
NaO
) не менее 99%.
4.2.2 Гидрофосфат калия, массовая доля основного вещества w(KHPO
) не менее 99,5%.
4.2.3 Дигидрофосфат калия, массовая доля основного вещества w(KHPO
) не менее 99,5%.
4.2.4 Раствор пероксида водорода, нестабилизированный, массовая доля пероксида водорода w(HO
)=30%.
4.2.5 Сульфат меди, массовая доля основного вещества w(CuSO·5H
O) не менее 99%.
4.2.6 Уксусная кислота, массовая доля основного вещества w(CHCOOH) не менее 99,8%.
4.2.7 Концентрированная соляная кислота (для способов А и С), w(НСl)=37,0%.
4.2.8 НАД+-гликогидролаза из Neurospora crassa (для способа В), активность 0,55 МЕ/мг белка.
Хранят при температуре ниже 0°С.
Примечание - При межлабораторных сравнительных испытаниях была использована лиофилизированная НАД+-гликогидролаза (NADase), выделенная из Neurospora crassa, производства компании "Сигма", номер по каталогу N9629, активностью от 0,5 до 3,0 МЕ/мг белка (биурет).
_______________ Эта информация приведена только для удобства пользователя настоящего стандарта и не означает поддержки данного продукта со стороны CEN. Допускается использование аналогичных продуктов, если доказано, что их использование приводит к аналогичному результату.
4.2.9 Раствор уксусной кислоты, молярная концентрация с(СНСООН)=5 моль/дм
.
4.2.10 Раствор ацетата натрия, молярная концентрация c(CH
NaO
)=2,5 моль/дм
.
4.2.11 Раствор сульфата меди, молярная концентрация c(Cu(ll)SO·5H
O)=0,005 моль/дм
.
4.2.12 Приготовление раствора ацетата натрия молярной концентрации c![]() моль/дм
моль/дм с pH 4,5
4,10 г ацетата натрия (4.2.1) растворяют в 900 см воды. Доводят значение pH раствора до 4,5 при помощи уксусной кислоты (4.2.6) и затем разбавляют водой до 1000 см
.
4.2.13 Приготовление фосфатного буферного раствора (для способа В) с pH 6,8
Одну объемную часть раствора гидрофосфата калия молярной концентрации 0,05 моль/дм смешивают с 1 объемной частью раствора дигидрофосфата калия молярной концентрации 0,05 моль/дм
. При необходимости доводят значение pH раствора до значения 6,8 при помощи раствора ацетата натрия (4.2.10).
4.2.14 Приготовление раствора НАД+-гликогидролазы (для способа В)
2,9 мг НАД+-гликогидролазы (4.2.8) растворяют в 5 см фосфатного буферного раствора (4.2.13). Срок хранения раствора - 7 дней при минус 18°С.
4.2.15 Раствор соляной кислоты (для способов А и С) молярной концентрации c(HCI)=0,1 моль/дм.
4.2.16 Подвижная фаза для ВЭЖХ
4,77 г дигидрофосфата калия (4.2.3) растворяют в 400 см воды, добавляют 3,8 см
раствора пероксида водорода (4.2.4) и 0,5 см
раствора сульфата меди (4.2.11) и разбавляют водой до 500 см
. Значение pH раствора составляет приблизительно 4,5. Раствор фильтруют через мембранный фильтр (5.7). Срок хранения - 1 день.
4.2.17 Гидроксид натрия (для способа С), массовая доля основного вещества w(NaOH) не менее 99%.
4.2.18 Раствор гидроксида натрия (для способа С), молярная концентрация c(NaOH)=5 моль/дм
20 г гидроксида натрия (4.2.17) растворяют в 80 см воды. После охлаждения доводят объем раствора до 100 см
.
4.2.19 Приготовление раствора соляной кислоты (для способа С), w(HCI)=3,7%
5 см концентрированной соляной кислоты (4.2.7) разбавляют водой до 50 см
.
4.3 Образцы сравнения
4.3.1 Общие положения
Никотиновая кислота и никотинамид разной степени чистоты могут быть приобретены у различных поставщиков. По этой причине необходимо устанавливать значение массовой концентрации градуировочного раствора спектрофотометрическим методом (см. 4.4.3).
4.3.2 Никотиновая кислота, массовая доля основного вещества w(CH
NO
) не менее 99,5%
4.3.3 Никотинамид (для способов А и В) массовая доля основного вещества, w(CH
N
O) не менее 99,5%
4.4 Исходные растворы
4.4.1 Приготовление исходного раствора никотиновой кислоты массовой концентрации (C
H
NO
)=1 мг/см
Приблизительно 100 мг образца сравнения никотиновой кислоты (4.3.2) взвешивают с точностью до 1 мг и растворяют в 100 см воды.
Срок хранения раствора - 7 дней при минус 18°С.
4.4.2 Приготовление исходного раствора никотинамида (для способов А и В) массовой концентрации (C
H
N
O)=1 мг/см
Приблизительно 100 мг образца сравнения никотинамида (4.3.3) взвешивают с точностью до 1 мг и растворяют в 100 см воды.
Срок хранения раствора - 7 дней при минус 18°С.
4.4.3 Установление массовой концентрации исходных растворов
4.4.3.1 Раствор никотиновой кислоты, (C
H
NO
)=1 мг/см
1 см исходного раствора никотиновой кислоты (4.4.1) разбавляют до 100 см
раствором соляной кислоты (4.2.15) и измеряют при помощи спектрофотометра (5.2) оптическую плотность полученного раствора при 260 нм в кювете с толщиной поглощающего слоя 1 см относительно раствора соляной кислоты (4.2.15). Массовую концентрацию исходного раствора,
, мг/см
, вычисляют по формуле (1):
![]() , (1)
, (1)
где - оптическая плотность раствора при 260 нм;
420 - значение экстинкции
для раствора никотиновой кислоты в растворе соляной кислоты молярной концентрации 0,1 моль/дм
[6].
_______________ Под экстинкцией в настоящем стандарте понимают величину условной оптической плотности раствора с массовой концентрацией 10 г/дм
в кювете с толщиной поглощающего слоя 1 см.
4.4.3.2 Раствор никотинамида, (C
H
N
O)=1 мг/см
1 см исходного раствора никотинамида (4.4.2) разбавляют до 100 см
раствором соляной кислоты (4.2.15) и измеряют при помощи спектрофотометра (5.2) оптическую плотность полученного раствора при 260 нм в кювете с толщиной поглощающего слоя 1 см относительно раствора соляной кислоты (4.2.15). Массовую концентрацию исходного раствора,
, мг/см
, вычисляют по формуле (2):
![]() , (2)
, (2)
где - оптическая плотность раствора при 260 нм;
410 - значение экстинкции для раствора никотинамида в растворе соляной кислоты молярной концентрации 0,1 моль/дм
[5].
4.5 Приготовление градуировочных растворов никотиновой кислоты и никотинамида массовой концентрации от 0,05 до 5 мкг/см
Вначале готовят рабочие растворы никотиновой кислоты и никотинамида, отбирая 1 см исходного раствора никотиновой кислоты (4.4.1) или никотинамида (4.4.2) и разбавляя водой до 100 см
. Из этих растворов готовят по четыре градуировочных раствора, разбавляя 0,5; 2,5; 10 и 50 см
соответствующего промежуточного раствора водой до 100 см
. Это растворы устойчивы при комнатной температуре в течение суток.
5 Оборудование
5.1 Общие положения
При проведении испытания используют обычное лабораторное оборудование, в частности, следующее.
5.2 Спектрофотометр, обеспечивающий измерения оптической плотности в диапазоне выбранных длин волн.
5.3 Термостат, поддерживающий температуру на уровне 37°С.
5.4 Автоклав, предназначенный для поддержания температуры на уровне 120°С.
5.5 Система для ВЭЖХ, состоящая из насоса, устройства для ввода проб, флуориметрического детектора, позволяющего проводить измерения при длине волны возбуждения 322 нм и длине волны регистрации 380 нм, и системы для сбора и обработки данных, например интегратора.
5.6 Обращенно-фазовые аналитические колонки, например LiChrosper 60 RP-18 Select В endcapped
.
_______________ LiChrospher
60 RP-18 Select В endcapped является примером коммерчески доступного продукта. Эта информация приведена для удобства пользователя и не является поддержкой данного продукта. Могут быть использованы аналогичные продукты, если доказано, что их применение приводит к идентичным результатам.
Приведенные ниже характеристики аналитической колонки обеспечивают разделение пиков аналитов до базовой линии:
a) длина колонки 250 мм;
b) внутренний диаметр 4,0 мм;
c) размер частиц 5 мкм.
Допускается использовать колонки иных размеров и с иным размером частиц. При этом следует проверить, что параметры разделения на таких колонках гарантируют получение сопоставимых результатов. Критерием эффективности подходящих аналитических колонок является разделение пиков аналитов до базовой линии.
При этом параметры разделения на таких колонках должны гарантировать получение сопоставимых результатов.
5.7 Мембранный фильтр с размером пор, например 0,45 мкм.
5.8 Послеколоночный реактор и лампа ультрафиолетового света
Послеколоночный реактор состоит из политетрафторэтиленовой трубки (длина 5 м, внутренний диаметр 0,5 мм, внешний диаметр 1,6 мм), намотанной вокруг лампы ультрафиолетового света низкого давления (VL-120 BLB, 20 Вт, 365 нм, интенсивность излучения 55 мкВт/см, изготовитель Vilber Lourmat
, см. также рисунки 1 и 2 и [7].
_______________
VL-120 BLB является примером коммерчески доступного продукта. Эта информация приведена для удобства пользователя и не является поддержкой данного продукта. Могут быть использованы аналогичные продукты, если доказано, что их применение приводит к идентичным результатам.
Рисунок 1 - Размеры и общий вид лампы, кожуха лампы (перевернут) и положение лампы во время проведения анализа
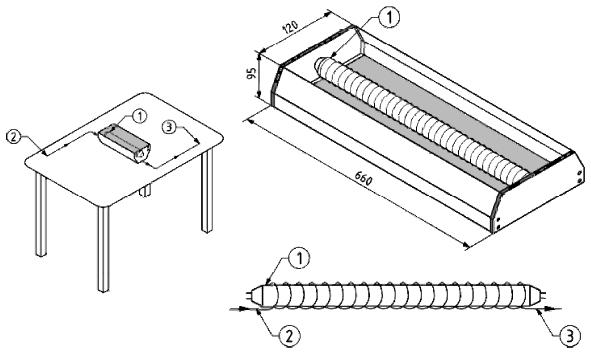
Размеры в миллиметрах
1 - трубчатый источник света; 2 - направление потока жидкости выходящего из колонки; 3 - к детектору
Рисунок 1 - Размеры и общий вид лампы, кожуха лампы (перевернут) и положение лампы во время проведения анализа
Рисунок 2 - Поперечный разрез кожуха для лампы (перевернут) с лампой
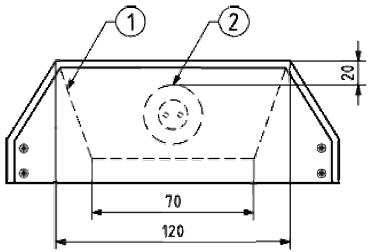
Размеры в миллиметрах
1 - рефлектор; 2 - трубчатый источник света
Рисунок 2 - Поперечный разрез кожуха для лампы (перевернут) с лампой
ПРЕДУПРЕЖДЕНИЕ - Опасное для здоровья ультрафиолетовое излучение может выходить из кожуха лампы.
ПРЕДУПРЕЖДЕНИЕ - Если в результате перегрева внутри трубки образуются пузыри, то лампу следует охлаждать путем циркуляции воздуха, например, приподнимая ее.
6 Проведение испытания
6.1 Подготовка испытуемой пробы
Испытуемую пробу гомогенизируют. Грубые материалы размалывают в подходящей мельнице и тщательно перемешивают. Чтобы исключить длительное воздействие высоких температур, пробу предварительно охлаждают.
6.2 Экстракция
6.2.1 Кислотный гидролиз (Способ А)
Получаемые результаты аналогичны получаемым по способу В, однако во время гидролиза никотинамид легко переходит в никотиновую кислоту.
Требуемое количество испытуемой пробы, например массой от 1 до 5 г взвешивают с погрешностью ±1 мг, помещают в коническую колбу и добавляют 50 см раствора соляной кислоты (4.2.15). Колбу выдерживают на кипящей водяной бане в течение 1 ч. После охлаждения добавляют раствор ацетата натрия (4.2.10) в объеме, необходимом для достижения значения pH, равного 4,5. Раствор переносят в мерную колбу вместимостью 100 см
, разбавляют до метки водой, перемешивают и фильтруют через бумажный фильтр. Перед инжектированием раствор фильтруют еще раз через мембранный фильтр с размером пор 0,45 мкм (5.7).
Примечание - Фильтрование подвижной фазы и растворов проб через мембранный фильтр с размером пор 0,45 мкм перед применением или инжектированием продлевает срок жизни колонок.
6.2.2 Ферментативный гидролиз (Способ В)
Получаемые результаты аналогичны получаемым по способу А. Способ В позволяет провести раздельное определение никотинамида и никотиновой кислоты.
Требуемое количество испытуемой пробы, например массой от 1 до 5 г взвешивают с погрешностью ±1 мг, помещают в коническую колбу, добавляют 50 см раствора ацетата натрия (4.2.12) и затем 200 мм
раствора НАД+-гликогидролазы (4.2.14). Колбу выдерживают в термостате (5.3) при температуре 37°С в течение 18 ч при постоянном перемешивании. После охлаждения раствор переносят в мерную колбу вместимостью 100 см
, разбавляют до метки водой, перемешивают и фильтруют через бумажный фильтр. Перед инжектированием его фильтруют еще раз через мембранный фильтр с размером пор 0,45 мкм (5.7).
6.2.3 Кислотный и щелочной гидролиз (Способ С)
В случае проб злаков с естественным содержанием ниацина способ С приводит к более высоким значениям содержания ниацина, чем способы А и В. В способе С ниацин определяют в форме никотиновой кислоты после превращения никотинамида в никотиновую кислоту при щелочном гидролизе.
Требуемое количество испытуемой пробы, например массой от 1 до 5 г взвешивают с погрешностью ±1 мг, помещают в коническую колбу и добавляют 70 см раствора соляной кислоты (4.2.15). Колбу выдерживают на кипящей водяной базе в течение 1 ч. После охлаждения добавляют от 1 до 2 см
раствора гидроксида натрия (4.2.18) до достижения значения pH раствора, равного 4,5. Раствор переносят в мерную колбу вместимостью 100 см
, разбавляют до метки водой, перемешивают и фильтруют через бумажный фильтр. 50 см
переносят в коническую колбу, добавляют 10 см
раствора гидроксида натрия (4.2.18) и автоклавируют при 120°С в течение 1 ч. После охлаждения доводят значение pH до 4,5 соляной кислотой, причем сначала приливают концентрированную соляную кислоту, а затем разбавленный раствор (4.2.19). Этот раствор переносят в мерную колбу вместимостью 100 см
, разбавляют до метки водой и фильтруют через бумажный фильтр. Перед вводом в хроматограф его фильтруют еще раз через мембранный фильтр (5.7).
6.3 Проведение хроматографического анализа
Инжектируют в ВЭЖХ-систему равные объемы градуировочных растворов и растворов проб. Аналиты идентифицируют путем сравнения времен удерживания пиков на хроматограммах раствора пробы и градуировочных растворов. Идентификацию пиков можно также осуществить при помощи добавки образца сравнения к раствору пробы.
Приведенные ниже условия обеспечивают разделение и количественное определение:
Хроматографическая колонка: LiChrospher® 60 RP Select В, размер частиц 5 мкм, диаметр 4,0 мм, длина 250 мм.
Подвижная фаза: фосфатный буферный раствор (с=0,07 моль/дм), пероксид водорода (с=0,075 моль/дм
), сульфат меди (с=5·10
моль/дм
);
Расход подвижной фазы: 1 см/мин;
Объем инжектирования: 30 мм;
Флуоресцентное детектирование: длина волны возбуждения 322 нм, длина волны регистрации 380 нм.
7 Обработка результатов
7.1 Общие требования
При использовании метода внешнего стандарта применяют градуировочные характеристики, предварительно проверив их линейность. Альтернативно определяют высоты и площади пиков и сравнивают с соответствующими значениями для градуировочного раствора, в котором массовая концентрация аналитов наиболее близка к значениям в пробе.
7.2 Обработка результатов для способов А и В
Содержание никотиновой кислоты в пробе w, мг/100 г пробы, вычисляют по формуле (3):
![]() , (3)
, (3)
где - площадь или высота пика никотиновой кислоты на хроматограмме раствора пробы после дериватизации, единицы площади или высоты пика;
- массовая концентрация никотиновой кислоты в градуировочном растворе (4.5), мг/дм
;
- объем раствора пробы (6.2.1 или 6.2.2), см
;
- площадь или высота пика никотиновой кислоты на хроматограмме градуировочного раствора после дериватизации, единицы площади или высоты пика;
- масса пробы, г.
Содержание никотинамида в пробе , мг/100 г пробы, вычисляют по формуле (4):
![]() , (4)
, (4)
где - площадь или высота пика никотинамида на хроматограмме раствора пробы после дериватизации, единицы площади или высоты пика;
- массовая концентрация никотинамида в градуировочном растворе (4.5), мг/дм
;
- объем раствора пробы (6.2.1 или 6.2.2), см
;
- площадь или высота пика никотинамида на хроматограмме градуировочного раствора после дериватизации, единицы площади или высоты пика;
- масса пробы, г.
Содержание ниацина в пересчете на никотиновую кислоту вычисляют как (w+1,008), мг/100 г пробы.
7.3 Обработка результатов для способа С
Содержание никотиновой кислоты в пробе w, мг/100 г пробы, вычисляют по формуле (5):
![]() , (5)
, (5)
где - площадь или высота пика никотиновой кислоты на хроматограмме раствора пробы после дериватизации, единицы площади или высоты пика;
- массовая концентрация никотиновой кислоты в градуировочном растворе (4.5), мг/дм
- объем раствора пробы (6.2.3), см
;
- площадь или высота пика никотиновой кислоты на хроматограмме градуировочного раствора после дериватизации, единицы площади или высоты пика;
- масса пробы, г.
8 Прецизионность
8.1 Общие положения
Полученные статистические данные приведены в Приложении В.
Данные по прецизионности хроматографического метода определения ниацина (способы А и В) были получены согласно [10] в 2002 г. в ходе межлабораторных сравнительных испытаний, организованных на международном уровне ![]() (Центр технологических ресурсов) и
(Центр технологических ресурсов) и ![]() (Генеральная комиссия по унификации методов анализа) [1]. Полученные статистические данные представлены в таблицах В.1 и В.2 Приложения В.
(Генеральная комиссия по унификации методов анализа) [1]. Полученные статистические данные представлены в таблицах В.1 и В.2 Приложения В.
Данные по прецизионности хроматографического метода определения ниацина (способ С) были получены согласно [10] в 1999 г. в ходе межлабораторных сравнительных испытаний, организованных ![]() (Генеральная комиссия по унификации методов анализа) во Франции [2]. Полученные статистические данные представлены в таблице В.3 Приложения В.
(Генеральная комиссия по унификации методов анализа) во Франции [2]. Полученные статистические данные представлены в таблице В.3 Приложения В.
8.2 Предел повторяемости
Абсолютная разность между двумя единичными результатами испытаний, полученными одним исполнителем на идентичном исследуемом материале на одном и том же оборудовании в течение возможно короткого промежутка времени, могут превышать предел повторяемости r не чаще, чем в 5% случаев.
Значения для ниацина (способ А - кислотный гидролиз) приведены ниже: | ||
Сухое молоко |
| r=1,31 мг/100 г |
Мюсли с шоколадом |
| r=0,68 мг/100 г |
Ветчина |
| r=0,53 мг/100 г |
Пшеничная мука |
| r=0,079 мг/100 г |
Зеленый горошек |
| r=0,93 мг/100 г |
Значения для ниацина (способ В - ферментативный гидролиз) приведены ниже: | ||
Сухое молоко |
| r=1,39 мг/100 г |
Мюсли с шоколадом |
| r=1,75 мг/100 г |
Ветчина |
| r=0,70 мг/100 г |
Пшеничная мука |
| r=0,040 мг/100 г |
Зеленый горошек |
| r=0,33 мг/100 г |
Значения для ниацина (способ С - кислотный и щелочной гидролиз) приведены ниже: | ||
Мюсли |
| r=2,29 мг/100 г |
Мюсли с шоколадом |
| r=2,24 мг/100 г |
Сухое молоко |
| r=0,92 мг/100 г |
Фруктовый сок |
| r=0,49 мг/100 г |
Зеленый горошек с ветчиной |
| r=1,78 мг/100 г |
Лиофилизированный суп |
| r=0,53 мг/100 г |
8.3 Предел воспроизводимости
Абсолютная разность между двумя единичными результатами, полученными в двух лабораториях на идентичном исследуемом материале, могут превышать предел воспроизводимости R не чаще, чем в 5% случаев.
Значения для ниацина (способ А - кислотный гидролиз) приведены ниже: | ||
Сухое молоко |
| R=2,04 мг/100 г |
Мюсли с шоколадом |
| R=2,55 мг/100 г |
Ветчина |
| R=1,75 мг/100 г |
Пшеничная мука |
| R=0,59 мг/100 г |
Зеленый горошек |
| R=3,68 мг/100 г |
Значения для ниацина (способ В - ферментативный гидролиз) приведены ниже: | ||
Сухое молоко |
| R=2,07 мг/100 г |
Мюсли с шоколадом |
| R=3,08 мг/100 г |
Ветчина |
| R=3,76 мг/100 г |
Пшеничная мука |
| R=0,91 мг/100 г |
Зеленый горошек |
| R=1,96 мг/100 г |
Значения для ниацина (способ С - кислотный и щелочной гидролиз) приведены ниже: | ||
Мюсли |
| R=11,65 мг/100 г |
Мюсли с шоколадом |
| R=7,02 мг/100 г |
Сухое молоко |
| R=5,66 мг/100 г |
Фруктовый сок |
| R=4,31 мг/100 г |
Зеленый горошек с ветчиной |
| R=6,61 мг/100 г |
Лиофилизированный суп |
| R=3,51 мг/100 г |
9 Протокол испытаний
Протокол испытаний должен содержать, по меньшей мере, следующие сведения:
a) всю информацию, необходимую для идентификации пробы (вид пробы, ее происхождение, обозначение);
b) ссылку на настоящий стандарт и используемый метод экстракции;
c) результаты испытаний с указанием единиц измерений;
d) дату и способ отбора проб (если он известен);
e) дату поступления пробы;
f) дату проведения испытаний;
g) все особенности, наблюдавшиеся при проведении испытаний;
h) любые применявшиеся операции, не оговоренные в методе или рассматриваемые как необязательные, которые могли повлиять на результат испытаний.
Приложение А (справочное). Пример хроматограммы
Приложение А
(справочное)
Рисунок А. 1 - Пример хроматографического разделения никотиновой кислоты и никотинамида в сухом молоке
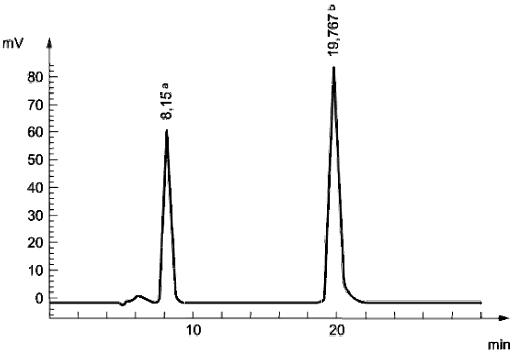
а - никотиновая кислота; b - никотинамид
Рисунок А. 1 - Пример хроматографического разделения никотиновой кислоты и никотинамида в сухом молоке
Условия анализа:
Хроматографическая колонка: LiChrospher 60 RP Select В, 5 мкм, 250 ммх4,0 мм
Подвижная фаза: Фосфатный буферный раствор (с=0,07 моль/дм), пероксид водорода (с=0,075 моль/дм
), сульфат меди (с=5х10
моль/дм
)
Расход подвижной фазы: 1 см/мин
Объем инжектирования: 30 мм
Флуоресцентное детектирование: возбуждение при 322 нм, регистрация при 380 нм
Приложение В (справочное). Данные по прецизионности
Приложение В
(справочное)
Данные по прецизионности для определения ниацина с использованием кислотного (способ А) и ферментативного гидролиза (способ В), приведенные в таблицах В.1 и В.2, были получены в 2002 году согласно [10] в ходе межлабораторных сравнительных испытаний, организованных на международном уровне Центром технологических ресурсов и Генеральной комиссией по унификации аналитических методов (![]() ) [1].
) [1].
Данные по прецизионности, касающиеся определения ниацина по способу С, приведенные в таблице В.3, были получены в 1999 г. согласно [10] в ходе межлабораторных сравнительных испытаний, организованных ![]() [2].
[2].
Таблица В.1 - Данные по прецизионности для кислотного гидролиза
Проба | Сухое молоко (обога- | Мюсли с шоколадом (обога- | Ветчина (необога- | Пшеничная мука (необога- | Зеленый горошек (необога- |
Год проведения испытаний | 2002 | 2002 | 2002 | 2002 | 2002 |
Число лабораторий | 12 | 12 | 12 | 12 | 12 |
Число параллельных проб | 2 | 2 | 2 | 2 | 2 |
Число лабораторий после исключения выбросов | 11 | 10 | 10 | 12 | 12 |
Число лабораторий, результаты которых признаны выбросами | 1 | 2 | 2 | 0 | 0 |
Число принятых результатов | 22 | 20 | 20 | 24 | 24 |
Общее среднее | 16,66 | 21,03 | 16,91 | 0,72 | 5,91 |
Стандартное отклонение повторяемости | 0,46 | 0,24 | 0,19 | 0,028 | 0,33 |
Относительное стандартное отклонение повторяемости RSD | 2,8 | 1,1 | 1,1 | 3,9 | 5,6 |
Предел повторяемости r (r=2,8 | 1,31 | 0,68 | 0,53 | 0,079 | 0,93 |
Стандартное отклонение воспроизводимости | 0,72 | 0,90 | 0,62 | 0,21 | 1,30 |
Относительное стандартное отклонение воспроизводимости RSD | 4,3 | 4,3 | 3,7 | 29,2 | 22,0 |
Предел воспроизводимости R (R=2,8 | 2,04 | 2,55 | 1,75 | 0,59 | 3,68 |
Индекс Горвица [8] | 0,6 | 0,6 | 0,5 | 2,5 | 2,5 |
Таблица В.2 - Данные по прецизионности для ферментативного гидролиза
Проба | Сухое молоко (обога- | Мюсли с шоколадом (обога- | Ветчина (необога- | Пшеничная мука (необога- | Зеленый горошек (необога- |
Год проведения испытаний | 2002 | 2002 | 2002 | 2002 | 2002 |
Число лабораторий | 12 | 12 | 12 | 12 | 12 |
Число параллельных проб | 2 | 2 | 2 | 2 | 2 |
Число лабораторий после исключения выбросов | 11 | 10 | 11 | 12 | 12 |
Число лабораторий, результаты которых признаны выбросами | 1 | 2 | 1 | 0 | 0 |
Число принятых результатов | 22 | 20 | 22 | 24 | 24 |
Общее среднее | 17,08 | 21,24 | 17,29 | 0,54 | 5,79 |
Стандартное отклонение повторяемости | 0,49 | 0,62 | 0,25 | 0,014 | 0,12 |
Относительное стандартное отклонение повторяемости RSD | 2,9 | 2,9 | 1,4 | 2,6 | 2,0 |
Предел повторяемости r (r=2,8 | 1,39 | 1,75 | 0,70 | 0,040 | 0,33 |
Стандартное отклонение воспроизводимости | 0,73 | 1,09 | 1,33 | 0,32 | 0,69 |
Относительное стандартное отклонение воспроизводимости RSD | 4,3 | 5,1 | 7,7 | 59,2 | 11,9 |
Предел воспроизводимости R (R=2,8 | 2,07 | 3,08 | 3,76 | 0,91 | 1,96 |
Индекс Горвица [8] | 0,6 | 0,7 | 1,0 | 4,8 | 1,4 |
Таблица В.3 - Данные по прецизионности для кислотного и щелочного гидролиза
Проба | 1 | 2 | 3 | 4 | 5 | 6 |
Год проведения испытаний | 1999 | 1999 | 1999 | 1999 | 1999 | 1999 |
Число лабораторий | 11 | 11 | 11 | 10 | 10 | 10 |
Число параллельных проб | 2 | 2 | 2 | 2 | 2 | 2 |
Число лабораторий после исключения выбросов | 10 | 11 | 9 | 8 | 10 | 10 |
Число лабораторий, результаты которых признаны выбросами | 1 | 0 | 2 | 3 | 0 | 0 |
Число принятых результатов | 20 | 22 | 18 | 16 | 20 | 20 |
Общее среднее | 23,92 | 16,98 | 5,66 | 4,31 | 12,89 | 11,06 |
Стандартное отклонение повторяемости | 0,81 | 0,79 | 0,32 | 0,17 | 0,63 | 0,19 |
Относительное стандартное отклонение повторяемости RSD | 3,4 | 4,7 | 5,7 | 4,0 | 4,9 | 1,7 |
Предел повторяемости r (r=2,8 | 2,29 | 2,24 | 0,92 | 0,49 | 1,78 | 0,53 |
Стандартное отклонение воспроизводимости | 4,11 | 2,48 | 0,99 | 0,19 | 2,34 | 1,24 |
Относительное стандартное отклонение воспроизводимости RSD | 17,2 | 14,6 | 17,6 | 4,5 | 18,1 | 11,2 |
Предел воспроизводимости R (R=2,8 | 11,65 | 7,02 | 2,82 | 0,54 | 6,61 | 3,51 |
Индекс Горвица [8] | 2,5 | 2,0 | 2,0 | 0,5 | 2,4 | 1,4 |
|
Приложение С (справочное). Сравнение трех способов гидролиза
Приложение С
(справочное)
В таблице С.1 показано сравнение содержания общего ниацина, полученных при различных способах гидролиза: кислотном (А), ферментативном (В) и кислотном/щелочном (С). Дальнейшая информация приведена в [9].
Таблица С.1 - Сравнение значений для ниацина для трех способов гидролиза
Проба | А, мг/100 г | В, мг/100 г | С, мг/100 г |
Необогащенные пищевые продукты | |||
Печень говяжья | 51,6 | 57,8 | 43,0 |
Ветчина | 16,9 | 17,1 | - |
Яичный порошок | 0,05 | 0,05 | 0,26 |
Зеленый горошек 1 | 7,2 | 6,4 | 8,7 |
Зеленый горошек 2 | 5,9 | 5,7 | - |
Пшеничная мука 1 | 0,8 | 0,5 | 2,4 |
Пшеничная мука 2 | 0,7 | 0,5 | - |
Пивные дрожжи порошкообразные | 13,9 | 13,4 | 17,7 |
Рис 1 | 1,3 | 1,3 | 3,6 |
Рис 2 | 0,4 | 0,3 | 3,2 |
Продукт с высоким содержанием балластных веществ | 1,1 | 1,1 | 3,7 |
Обогащенные пищевые продукты | |||
Порошок шоколада 1 | 2,1 | 2,7 | 1,2 |
Порошок шоколада 2 | 0,4 | 0,8 | 0,7 |
Сухое молоко 1 | 8,2 | 7,9 | 9,3 |
Сухое молоко 2 | 16,7 | 17,1 | - |
Сухое молоко 3 | 4,2 | 4,3 | 3,5 |
Фруктовый сок | 0,3 | 0,3 | 0,3 |
Мюсли 1 | 20,0 | 19,6 | 19,0 |
Мюсли 2 | 21,0 | 21,2 | - |
Мюсли 3 | 21,9 | 20,7 | 19,9 |
Мюсли 4 | 12,5 | 12,3 | 12,0 |
Мюсли 5 | 16,1 | 18,1 | 16,5 |
Мюсли 6 | 15,4 | 15,6 | 15,2 |
Мука для детского питания | 4,0 | 4,3 | 4,7 |
Диетический батон | 15,4 | 16,4 | 15,4 |
Порошок с высоким содержанием белка 1 | 9,4 | 11,4 | 9,7 |
Порошок с высоким содержанием белка 2 | 10,7 | 10,3 | 9,0 |
Порошок с высоким содержанием белка 3 | 10,5 | 10,0 | 10,8 |
Питание для похудения | 15,7 | 15,4 | 13,5 |
Биологически активная добавка 1 | 2004 | 2197 | 2203 |
Биологически активная добавка 2 | 487 | 505 | 493 |
Биологически активная добавка 3 | 2236 | 2498 | 2199 |
Биологически активная добавка 4 | 1044 | 1201 | 1112 |
Биологически активная добавка 5 | 47,5 | 47,4 | 45,7 |
Приложение ДА (справочное). Сведения о соответствии межгосударственных стандартов ссылочным европейским региональным стандартам
Приложение ДА
(справочное)
Таблица ДА.1
Обозначение и наименование ссылочного европейского регионального стандарта | Степень соответствия | Обозначение и наименование межгосударственного стандарта |
EN ISO 3696 Вода для лабораторного анализа. Технические требования и методы испытаний | - | * |
* Соответствующий межгосударственный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного европейского регионального стандарта. |
Библиография
[1] ![]() М.: Validation study on the determination of niacin by HPLC in several matrices (готовится к публикации)
М.: Validation study on the determination of niacin by HPLC in several matrices (готовится к публикации)
[2] ![]() , S.,
, S., ![]() , M., Hasselmann, C.: Fluorimetric determination of niacin in foods by high-performance liquid chromatography with post-column derivatization, Food chem., 65, 129-133 (1999)
, M., Hasselmann, C.: Fluorimetric determination of niacin in foods by high-performance liquid chromatography with post-column derivatization, Food chem., 65, 129-133 (1999)
[3] Carter, E.G.A. & Carpenter, K.J.: The available niacin values of foods for rats and their relation to analytical values, Journal of Nutrition, 112, 2091-2103 (1982)
[4] Carter, E.G.A. & Carpenter, K.J.: The bioavailability for humans of bound niacin from wheat bran, American Journal of Clinical Nutrition, 36, 855-861 (1982)
[5] Van Niekerk, P.J., Smit, С.C.S., Strydom, S.P., and Armbruster, G.: Comparison of a high-performance liquid chromatographic and microbiological method for the determination of niacin in foods, Journal of Agricultural and Food Chemistry, 32, 304-307 (1984)
[6] UV and IR Spektren wichtiger pharmazeutischer Wirkstoffe, Hans Werner Dibbern, Edition Cantor Aulendorf, 1978
[7] Mawatari, K., Linuma, F., Watanabe, M.: Determination of nicotinic acid and nicotinamide in human serum by high-performance liquid chromatography with post-column ultraviolet irradiation and fluorescence detection, Anal. Sci., 7, 733-736 (1991)
[8] Horwitz, W.: Evaluation of Analytical Methods used for Regulation of Foods and Drugs, Anal. Chem. 1982, 54 (1), 67A-76A
[9] http://www.minefi.gouv.fr/dgccrf/01_presentation/activites/labos/2003/vitab3.htm
[10] ISO 5725-2 Accuracy (trueness and precision) of measurement methods and results - Part 2: Basic method for the determination of repeatability and reproducibility of a standard measurement method
УДК 664:543.544.5.068.7:006.354 | МКС 67.050 | IDT | |
Ключевые слова: продукты пищевые, определение ниацина, никотиновая кислота, никотинамид, метод высокоэффективной жидкостной хроматографии, флуориметрическое детектирование, послеколоночный реактор |
Электронный текст документа
и сверен по:
официальное издание
М.: Стандартинформ, 2016
