ГОСТ EN 15607-2015
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Определение D-биотина методом высокоэффективной жидкостной хроматографии
Foodstuffs. Determination of D-biotin by high performance liquid chromatography
МКС 67.050
Дата введения 2017-01-01
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом "Всероссийский научно-исследовательский институт сертификации" на основе аутентичного перевода на русский язык европейского регионального стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 29 мая 2015 г. N 77)
За принятие проголосовали:
Краткое наименование страны | Код страны | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 21 июля 2015 г. N 949-ст межгосударственный стандарт ГОСТ EN 15607-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2017 г.
5 Настоящий стандарт идентичен европейскому региональному стандарту EN 15607:2009* Foodstuffs - Determination of D-biotin by HPLC (Продукты пищевые. Определение D-биотина высокоэффективной жидкостной хроматографией).
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт . - .
Европейский региональный стандарт разработан техническим комитетом CEN/TC 275 "Анализ пищевых продуктов. Горизонтальные методы", секретариатом которого является DIN (Германия).
Перевод с немецкого языка (de).
Официальные экземпляры европейского регионального стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, и европейского регионального стандарта, на который дана ссылка, имеются в Федеральном информационном фонде технических регламентов и стандартов.
Сведения о соответствии межгосударственных стандартов ссылочным европейским региональным стандартам приведены в дополнительном приложении ДА.
Степень соответствия - идентичная (IDT)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
1 Область применения
Настоящий стандарт устанавливает метод определения содержания D-биотина в пищевых продуктах методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Метод прошел валидацию при межлабораторных сравнительных испытаниях с использованием как обогащенных проб, так и проб с естественным содержанием D-биотина, а именно концентратов типа сухого завтрака - мюсли, сухого молока для грудных детей, лиофилизированных зеленых овощей с ветчиной, лиофилизированного куриного бульона и обогащенного апельсинового сока в диапазоне значений содержания D-биотина от 16 до 200 мкг/100 г (см. приложение В).
Примечания
1 Настоящим методом может также определяться D-биоцитин, хотя ни в одной из проб, использовавшихся при межлабораторных сравнительных испытаниях, D-биоцитин не содержался. Тем не менее открываемость как D-биотина, так и D-биоцитина превышает 90% (см. [2] и [3]).
2 При анализе проб, содержащих куриные яйца, метод приводит к заниженным значениям содержания D-биотина.
2 Нормативные ссылки
Приведенные ниже ссылочные нормативные документы* являются обязательными для применения настоящего стандарта. Для датированных ссылок применимо только цитируемое издание. В случае недатированных ссылок используют последнее издание документа, включая все изменения.
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
EN ISO 3696 Water for analytical laboratory use - Specification and test methods (ISO 3696:1987) (Вода для лабораторного анализа. Технические требования и методы испытаний)
3 Сущность метода
Метод основан на выделении D-биотина из проб пищевых продуктов обработкой ферментами и количественном определении методом ВЭЖХ с послеколоночной дериватизацией ([2], [3]).
Комплексообразование D-биотина с белком авидином является весьма специфическим. Поэтому авидин, ковалентно связанный с флуоресцентной меткой - флуоресцеин-5- изотиоцианитом, используется в качестве реагента для послеколоночной дериватизации D-биотина ([4], [5]).
4 Реактивы
4.1 Общие положения
Если не указано иное, то при анализе используют только реактивы гарантированной чистоты и воды, по крайней мере, степени чистоты 1 по EN ISO 3696 или повторно перегнанную дистиллированную воду.
4.2 Требования к химическим реактивам и приготовление растворов
4.2.1 Метанол для ВЭЖХ, массовая доля основного вещества w(CHOH) не менее 99,8%.
4.2.2 Раствор серной кислоты молярной концентрации c(HSO
)=1 моль/дм
.
4.2.3 Раствор серной кислоты молярной концентрации c(HSO
)=1,5 моль/дм
.
4.2.4 Лимонная кислота моногидрат, массовая доля основного вещества w(CH
O
·H
O) не менее 99,7%.
4.2.5 Гидрофосфат натрия 2-водный, массовая доля основного вещества w(NaHPO
·2 H
O) не менее 99,8%.
4.2.6 Глутатион, массовая доля основного вещества w(CH
N
O
S) не менее 98%.
4.2.7 Этилендиаминтетраацетат натрия (ЭДТА) 2-водный, массовая доля основного вещества w(CH
N
Na
O
·2H
O) не менее 99%.
4.2.8 Гидрофосфат калия, массовая доля основного вещества w(KHPO
) не менее 96%.
4.2.9 Дигидрофосфат калия, массовая доля основного вещества w(KHPO
) не менее 99,5%.
4.2.10 Приготовление цитратного буферного раствора
0,462 г моногидрата лимонной кислоты (4.2.4) и 1,05 г гидрофосфата натрия 2-водного (4.2.5) растворяют в 450 см дистиллированной воды. Устанавливают значение рН раствора, равное 5,7, при помощи раствора серной кислоты (4.2.3) и затем разбавляют раствор до объема 500 см
.
Срок хранения раствора - 1 день.
4.2.11 Приготовление раствора глутатиона массовой концентрации (C
H
N
O
S)=10 г/дм
30 мг глутатиона (4.2.6) растворяют в 3 см дистиллированной воды.
Срок хранения раствора - 1 день.
4.2.12 Приготовление раствора ЭДТА массовой концентрации (C
H
N
Na
O
·2H
O)=10 г/дм
0,1 г ЭДТА (4.2.7) растворяют в 10 см дистиллированной воды.
Срок хранения раствора - 1 день.
4.2.13 Приготовление раствора гидрофосфата калия молярной концентрации с(KHPO
)=0,1 моль/дм
17,4 г гидрофосфата калия (4.2.8) растворяют в 1000 см воды.
Срок хранения раствора - 2 дня.
4.2.14 Приготовление раствора дигидрофосфата калия молярной концентрации с(КНРO
)=0,1 моль/дм
13,6 г дигидрофосфата калия (4.2.9) растворяют в 1000 см воды.
Срок хранения раствора - 2 дня.
4.2.15 Приготовление фосфатного буферного раствора с рН 6,0
Растворы гидрофосфата калия (4.2.13) и дигидрофосфата калия (4.2.14) смешивают в такой пропорции, чтобы значение рН приготовленного раствора составляло 6,0 (например, 30 объемных частей раствора по 4.2.13 и 70 объемных частей раствора по 4.2.14).
Срок хранения раствора - 7 дней при комнатной температуре.
4.2.16 Приготовление фосфатного буферного раствора с рН 7,0
Растворы гидрофосфата калия (4.2.13) и дигидрофосфата калия (4.2.14) смешивают в такой пропорции, чтобы значение рН приготовленного раствора составляло 7,0 (например, 40 объемных частей раствора по 4.2.13 и 60 объемных частей раствора по 4.2.14).
Срок хранения раствора - 7 дней при комнатной температуре.
4.2.17 Папаин порошкообразный (CAS 9001-73-4) с удельной каталитической активностью 15 нкат/мг по отношению к этиловому эфиру N-бензоил-L-аргинина (ВАЕЕ) при рН 6,2 и 25°С. Удельная каталитическая активность 15 нкат/мг соответствует 1 МЕ/мг (ME - международная единица каталитической активности).
________________ Катал (кат) является производной единицей системы СИ для каталитической активности. 1 катал - это такая каталитическая активность, при которой скорость реакции при заданных условиях увеличивается на 1 моль/с.
4.2.18 Раствор папаина массовой концентрации 20 г/дм
4.2.18.1 Приготовление раствора
1 г порошкообразного папаина (4.2.17) растворяют в 50 см цитратного буферного раствора (4.2.10). Срок хранения раствора - 5 дней при 4°С.
4.2.18.2 Проверка активности папаина
Активность папаина может быть проверена путем приготовления второго экстракта (см. 6.2) с удвоенным количеством фермента. Найденное содержание биотина должно соответствовать расчетному значению и ни в коем случае не превышать его.
Примечание - При межлабораторных сравнительных испытаниях был использован порошкообразный папаин, поставщиком которого была компания VWR International GmbH, ![]() 20а, 64295 Darmstadt, Ref.-Nr 26.146.180t
20а, 64295 Darmstadt, Ref.-Nr 26.146.180t.
________________ Эта информация приведена исключительно для удобства пользователя настоящего стандарта и не является поддержкой указанного поставщика. Могут быть использованы аналогичные продукты, если доказано, что их применение приводит к идентичным результатам.
4.2.19 Конъюгат Авидин - флуоресцеинизотиоцианат (Avidin-FITC), содержащий 80% протеина (от 2 до 4 моль флуоресцеинизотиоцианата на каждый моль авидина).
4.2.20 Исходный раствор для послеколоночной дериватизации массовой концентрации (Avidin-FITC)=50 мг/см
2,5 мг конъюгата авидин - флуоресцеинизотиоцианат (4.2.19) растворяют в 50 см фосфатного буферного раствора с рН 7,0 (4.2.16). Срок хранения раствора - 14 дней при 4°С.
4.2.21 Рабочий раствор для послеколоночной дериватизации массовой концентрации (Avidin-FITC)=2 мг/см
25 см исходного раствора для послеколоночной дериватизации (4.2.20) смешивают с 600 см
фосфатного буферного раствора с рН 7,0 (4.2.16). Полученный раствор фильтруют через фильтр с размером пор 0,45 мкм (5.5). Раствор устойчив при хранении в темноте в течение 8 ч.
4.2.22 Подвижная фаза для ВЭЖХ
80 объемных частей фосфатного буферного раствора с рН 6,0 (4.2.15) смешивают с 20 объемными частями метанола (4.2.1) и фильтруют через фильтр с размером пор 0,45 мкм (5.5).
4.2.23 Така-диастаза, выделенная из Aspergillus Oryzae, удельная каталитическая активность 1500 нкат/мг (соответствует 100 МЕ/мг), для проб с высоким содержанием крахмала.
4.3 Образцы сравнения
4.3.1 Общие положения
D-биотин и D-биоцитин могут быть приобретены у разных поставщиков. Необходимо убедиться в том, что пики D-биотина и D-биоцитина разделяются до базовой линии на хроматограмме раствора их смеси. Массовая доля основного вещества в образце сравнения биотина может быть установлена в соответствии с методом Европейской Фармакопеи [6].
4.3.2 D-Биотин, массовая доля основного вещества w(CH
N
O
S) не менее 99%.
4.3.3 D-Биоцитин, массовая доля основного вещества w(CH
N
O
S) не менее 98%.
4.4 Исходные растворы
4.4.1 Приготовление исходного раствора D-биотина массовой концентрации (C
H
N
O
S)=100 мкг/см
Приблизительно 10 мг образца сравнения D-биотина (4.3.2), взвешенного с погрешностью ±0,1 мг, растворяют в 100 см дистиллированной воды. Растворение может продолжаться от 4 до 5 ч. Срок хранения раствора - 2 мес при минус 18°С.
4.4.2 Приготовление исходного раствора D-биоцитина массовой концентрации (C
H
N
O
S)=100 мкг/см
Приблизительно 10 мг образца сравнения D-биоцитина (4.3.3), взвешенного с погрешностью ±0,1 мг, растворяют в 100 см дистиллированной воды. Срок хранения раствора - 2 мес при минус 18°С.
4.5 Стандартные растворы
4.5.1 Стандартные растворы D-биотина массовой концентрации (C
H
N
O
S) от 0,05 до 0,30 мкг/см
Приготавливают промежуточный раствор D-биотина путем разбавления 1 см исходного раствора (4.4.1) до 10 см
дистиллированной водой. Затем готовят шесть градуировочных растворов, разбавляя 0,5; 1,0; 1,5; 2,0; 2,5 и 3,0 см
промежуточного раствора до 100 см
дистиллированной водой. Срок хранения растворов 1 день.
4.5.2 Стандартный раствор D-биоцитина массовой концентрации (C
H
N
O
S)=0,30 мкг/см
Приготавливают промежуточный раствор путем разбавления 1 см исходного раствора (4.4.2) до 10 см
дистиллированной водой. Затем 3,0 см
промежуточного раствора разбавляют до 100 см
дистиллированной воды. Срок хранения раствора 1 день.
5 Аппаратура
5.1 Общие положения
При проведении испытания используют обычное лабораторное оборудование, в частности, следующее.
5.2 Термостат, поддерживающий температуру на уровне (37±2)°С.
5.3 Система для ВЭЖХ, состоящая из насоса, устройства для ввода проб, флуориметрического детектора, позволяющего проводить измерения при длине волны возбуждения 490 нм и длине волны регистрации 520 нм, и системы для сбора и обработки данных, например интегратора.
5.4 Обращенно-фазовые аналитические колонки, например LiChrosper 100 RP-18 endcapped
________________ Эта информация приведена только для удобства пользователя настоящего стандарта и не означает поддержки этих продуктов. Допускается использование аналогичных продуктов, если доказано, что их использование приводит к аналогичному результату.
Приведенные ниже характеристики аналитической колонки обеспечивают разделение пиков аналитов до базовой линии:
a) длина колонки 250 мм;
b) внутренний диаметр 4,0 мм;
c) размер частиц 5 мкм.
Допускается использовать колонки иных размеров и с иным размером частиц. При этом параметры разделения на таких колонках должны быть проверены, с тем чтобы гарантировать получение сопоставимых результатов. Критерием эффективности подходящих аналитических колонок является разделение пиков аналитов до базовой линии.
5.5 Устройства для фильтрования
Устройства для фильтрования подвижной фазы большого и малого размера, снабженные, например, фильтрами с размером пор 0,45 мкм.
Примечание - Фильтрование подвижной фазы и растворов проб через мембранный фильтр с размером пор 0,45 мкм перед применением или инжектированием продлевает срок жизни колонок.
5.6 Послеколоночный реактор, состоящий из системы для ввода реагента, например Т-образного смесителя со следующим за ним капиллярным реактором длиной 10 м, выполненным из политетрафторэтиленовой трубки внутреннего диаметра 0,5 мм, смотанной по спирали диаметром 14 мм, изготовленной, например, по [7] (модель КОТ2). Капиллярные реакторы могут быть приобретены у компаний Супелко или MicroSolv Tech.
________________ Эта информация приведена только для удобства пользователя настоящего стандарта и не означает поддержки этих продуктов. Допускается использование аналогичных продуктов, если доказано, что их использование приводит к аналогичному результату.
6 Проведение испытаний
6.1 Подготовка испытуемой пробы
Испытуемую пробу гомогенизируют. Грубые материалы размалывают в подходящей мельнице и тщательно перемешивают. Чтобы исключить длительное воздействие высоких температур, пробу предварительно охлаждают.
6.2 Экстракция
Пробу массой от 0,5 до 10 г (что приблизительно соответствует содержанию D-биотина от 2 до 15 мкг) взвешивают с точностью до 1 мг и помещают в колбу Эрленмейера. К пробе добавляют 300 мм раствора глутатиона (4.2.11), 300 мм
раствора ЭДТА (4.2.12), 30 см
цитратного буферного раствора (4.2.10) и 3 см
раствора папаина (4.2.18). При высоком содержании крахмала добавляют 100 мг така-диатазы (4.2.23). Смесь выдерживают в течение ночи в термостате при 37°С при постоянном перемешивании. После охлаждения раствор переносят в мерную колбу вместимостью 50 см
и разбавляют дистиллированной водой до метки. Раствор перемешивают и фильтруют через бумажный фильтр. Перед вводом в хроматограф его фильтруют еще раз через фильтр с размером пор 0,45 мкм (5.5).
Примечание - Фильтрование как подвижной фазы, так и растворов проб через мембранный фильтр перед применением или вводом в хроматограф продлевает срок службы колонок.
6.3 Проведение хроматографического анализа
Дозируют в ВЭЖХ-систему равные объемы градуировочных растворов и растворов проб. D-биотин идентифицируют путем сравнения времен удерживания пика на хроматограмме раствора пробы и градуировочных растворов. Идентификацию пиков можно также осуществить при помощи добавки образца сравнения к раствору пробы.
Из-за ограниченной стабильности раствора для послеколоночной дериватизации (4.2.21) ее регулярно проверяют при проведении серии измерений путем ввода градуировочного раствора. Приведенные ниже условия обеспечивают разделение и количественное определение D-биотина:
Хроматографическая колонка: LiChrospher 100 RP-18 endcapped, 5 мкм, 250
4,0 мм;
Подвижная фаза: 80 объемных частей фосфатного буферного раствора с рН 6 (4.2.15) и 20 объемных частей метанола (4.2.1);
Расход подвижной фазы: 0,4 см/мин;
Объем инжектирования: 30 мм;
Флуоресцентное детектирование: длина волны возбуждения 490 нм, длина волны регистрации 520 нм;
Расход реагента для послеколоночной дериватизации: 1 см/мин.
Примечание - Этот метод может быть также использован для оценки содержания D-биоцитина.
7 Обработка результатов
При использовании метода внешнего стандарта определяют площади или высоты пиков и затем устанавливают градуировочную характеристику, аппроксимируемую уравнением второго порядка.
Содержание D-биотина, w, мкг/100 г пробы, вычисляют по формуле (1):
![]() , (1)
, (1)
где - массовая концентрация D-биотина в растворе пробы (6.2), мкг/см
, вычисленная при помощи градуировочной характеристики;
V - объем раствора пробы (6.2), см
;
m - масса пробы, г;
100 - множитель для пересчета содержания D-биотина к 100 г пробы.
8 Прецизионность
8.1 Общие положения
Данные по прецизионности хроматографического метода определения D-биотина были получены согласно ИСО 5725-2 [1] в 2000 году в ходе межлабораторных сравнительных испытаний, организованных Генеральной комиссией по унификации методов анализа, Франция [3]. Все участники межлабораторных испытаний использовали градуировочные характеристики, установленные по трем точкам.
Полученные статистические данные приведены в приложении В.
8.2 Предел повторяемости
Абсолютная разность между двумя единичными результатами испытаний, полученными одним исполнителем на идентичном исследуемом материале на одном и том же оборудовании в течение возможно короткого промежутка времени, может превышать предел повторяемости r не чаще, чем в 5% случаев. Значения для D-биотина приведены ниже:
Мюсли | х=197 мкг/100 г | r=25,1 мкг/100 г |
Питание для грудных детей (сухое молоко) |
| r=5,24 мкг/100 г |
Витаминизированный апельсиновый сок |
| r=2,51 мкг/100 г |
Лиофилизированное пюре, зеленые овощи с ветчиной |
| r=8,99 мкг/100 г |
Лиофилизированный куриный бульон |
| r=19,4 мкг/100 г |
8.3 Предел воспроизводимости
Абсолютная разность между двумя единичными результатами, полученными в двух лабораториях на идентичном исследуемом материале, может превышать предел воспроизводимости R не чаще, чем в 5% случаев. Значения приведены ниже:
Мюсли |
| R=96,7 мкг/100 г |
Питание для грудных детей (сухое молоко) |
| R=13,5 мкг/100 г |
Витаминизированный апельсиновый сок |
| R=22,8 мкг/100 г |
Лиофилизированное пюре, зеленые овощи с ветчиной |
| R=44,1 мкг/100 г |
Лиофилизированный куриный бульон |
| R=69,5 мкг/100 г |
9 Протокол испытаний
Протокол испытаний должен содержать, по меньшей мере, следующие сведения:
a) всю информацию, необходимую для идентификации пробы;
b) ссылку на настоящий стандарт или используемый метод;
c) результаты испытаний с указанием единиц измерений, в которых результат испытаний выражен;
d) дату и способ отбора проб (если он известен);
e) дату поступления пробы;
f) дату проведения испытаний;
g) все особенности, наблюдавшиеся при проведении испытаний;
h) любые применявшиеся операции, не оговоренные в методе или рассматриваемые как необязательные, которые могли повлиять на результат испытаний.
Приложение А (справочное). Примеры хроматограмм
Приложение А
(справочное)
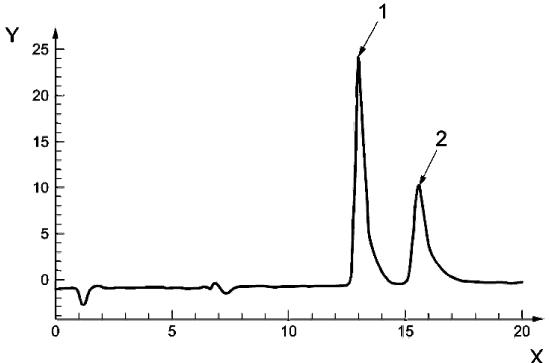
Обозначения:
X - время, мин
Y - интенсивность флуоресценции
1 - D-биотин
2 - D-биоцитин
Рисунок А.1 - Пример хроматографического разделения D-биотина и D-биоцитина в градуировочном растворе
Условия анализа:
Хроматографическая колонка: LiChrospher 100 RP-18 endcapped, 5 мкм, 250 мм·4,0 мм
Подвижная фаза: смесь восьми объемных частей фосфатного буферного раствора с рН 6 (4.2.15) и двух объемных частей метанола (4.2.1)
Расход подвижной фазы: 0,4 см/мин
Объем инжектирования: 30 мм
Флуоресцентное детектирование: возбуждение при 490 нм, регистрация при 520 нм
Расход реагента для послеколоночной дериватизации: 1,0 см/мин
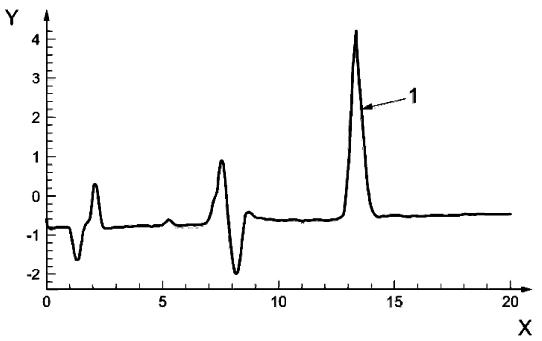
Обозначения:
X - время, мин
Y - интенсивность флуоресценции
1 - D-биотин
Рисунок А.2 - Пример хроматограммы D-биотина в пробе питания для грудных детей (сухое молоко)
Условия анализа:
Хроматографическая колонка: LiChrospher 100 RP-18 endcapped, 5 мкм, 250 мм·4,0 мм
Подвижная фаза: смесь восьми объемных частей фосфатного буферного раствора с рН 6 (4.2.15) и двух объемных частей метанола (4.2.1)
Расход подвижной фазы: 0,4 см/мин
Объем инжектирования: 30 мм
Флуоресцентное детектирование: возбуждение при 490 нм, регистрация при 520 нм
Расход реагента для послеколоночной дериватизации: 1,0 см/мин
Приложение B (справочное). Данные по прецизионности
Приложение B
(справочное)
Значения, приведенные в таблице В.1, были получены при межлабораторных сравнительных испытаниях, организованных в 2000 году Генеральной комиссией по унификации методов анализа, Франция [3], [8]. Эти испытания были проведены в соответствии со стандартом ИСО 5725-2 [1]. Все участники межлабораторных испытаний использовали градуировочные характеристики, установленные по трем точкам.
Таблица В.1 - Данные по прецизионности для проб мюсли, питания для грудных детей (сухое молоко), витаминизированного апельсинового сока, лиофилизированного пюре (зеленые овощи с ветчиной) и лиофилизированного куриного бульона
Проба | Мюсли | Питание для грудных детей (сухое молоко) | Витаминизи- | Лиофили- | Лиофили- |
Год проведения испытаний | 2000 | 2000 | 2000 | 2000 | 2000 |
Число лабораторий | 10 | 10 | 10 | 10 | 10 |
Число параллельных проб | 2 | 2 | 2 | 2 | 2 |
Число лабораторий после исключения выбросов | 10 | 9 | 10 | 10 | 10 |
Число лабораторий, результаты которых признаны выбросами | 0 | 1 | 0 | 0 | 0 |
Число принятых результатов | 20 | 18 | 20 | 20 | 20 |
Общее среднее | 197 | 16,0 | 40,7 | 88,9 | 168 |
Стандартное отклонение повторяемости s | 8,85 | 1,85 | 0,89 | 3,18 | 6,84 |
Относительное стандартное отклонение повторяемости RSD | 4,5 | 11,6 | 2,2 | 3,6 | 4,1 |
Предел повторяемости r | 25,1 | 5,24 | 2,51 | 8,99 | 19,4 |
Стандартное отклонение воспроизводимости s | 34,2 | 4,76 | 8,05 | 15,6 | 24,6 |
Относительное стандартное отклонение воспроизводимости RSD | 7,4 | 29,8 | 19,8 | 17,5 | 14,6 |
Предел воспроизводимости R (R=2,8 s | 96,7 | 13,5 | 22,8 | 44,1 | 69,5 |
Индекс Горвица [8] | 1,2 | 1,4 | 1,1 | 1,1 | 1,0 |
Приложение ДА (справочное). Сведения о соответствии межгосударственных стандартов ссылочным европейским региональным стандартам
Приложение ДА
(справочное)
Таблица ДА.1
Обозначение и наименование европейского регионального стандарта | Степень соответствия | Обозначение и наименование межгосударственного стандарта |
EN ISO 3696 Вода для лабораторного анализа. Технические требования и методы испытаний | - | * |
* Соответствующий межгосударственный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного европейского регионального стандарта. Перевод данного европейского регионального стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. |
Библиография
[1] ISO 5725-2, Accuracy (trueness and precision) of measurement methods and results - Part 2: Basic method for the determination of repeatability and reproducibility of a standard measurement method
[2] Lahely, S., Ndaw, S., Arella, F., Hasselmann, C: Determination of biotin in foods by high-performance liquid chromatography with post-column derivatization and fluorimetric detection, Food chem., 65, 253-258 (1999)
[3] Arella, F., Deborde, J.L., Bourguignon, J.В., Bergaentlze, M., Ndaw, S., Hasselmann, C: Liquid chromatographic determination of biotin in foods. A collaborative study, Ann. Fals. Exp. Chim., 93. 951, 193-200 (2000)
[4] Hentz. N.G., Bachas, L.G.: Class-selective detection systems for liquid chromatography based on the streptavidin-biotin interaction, Anal. Chem., 67, 1014-1018 (1995)
[5] Przyjazny, A., Hentz, N.G., Bachas, L.G.: Sensitive and selective liquid chromatographic post-column reaction detection system for biotin and biocytin using an homogeneous fluorophore-linked assay, J. chromatogr., 654, 79-86 (1993)
[6] European Pharmacopoeia 5.0, 01/2005:1073, Seite 110
[7] Selavska, С.M., Jino. K.S., Krull, I.S.: Construction and comparison of open tubular reactors for post-column reaction detection in liquid chromatography. Anal. Chem., 59, 2221-2224 (1987)
[8] Horwitz, W.: Evaluation of Analytical Methods used for Regulation of Foods and Drugs, Anal. Chem. 1982, 54 (1), 67A-76A
УДК 664:543.544.5.068.7:006.354 | МКС 67.050 | IDT |
|
Электронный текст документа
и сверен по:
официальное издание
М.: Стандартинформ, 2016
