ГОСТ Р ИСО 25539-1-2012
Группа Р23
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИМПЛАНТАТЫ СЕРДЕЧНО-СОСУДИСТЫЕ
Внутрисосудистые имплантаты
Часть 1
Эндоваскулярные протезы
Cardiovascular implants. Endovascular devices. Part 1. Endovascular prostheses
ОКС 11.040.40
Дата введения 2014-01-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Научный Центр сердечно-сосудистой хирургии им.А.Н.Бакулева" РАМН (ФГБУ "НЦССХ им.А.Н.Бакулева" РАМН) на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Управлением технического регулирования и стандартизации Федерального агентства по техническому регулированию и метрологии
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 30 августа 2012 года N 266-ст с 01 января 2014 года.
4 Настоящий стандарт идентичен международному стандарту ИСО 25539-1:2003* "Имплантаты сердечно-сосудистые. Внутрисосудистые имплантаты. Часть 1. Эндоваскулярные протезы" (ISO 25539-1:2003 "Cardiovascular implants - Endovascular devices - Part 1: Endovascular prostheses").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте национального органа Российской Федерации по стандартизации в сети Интернет (gost.ru)
1 Область применения
1.1 Настоящий стандарт устанавливает требования к эндоваскулярным протезам на основе современных знаний в области медицины. В нем приведены требования к предполагаемым рабочим характеристикам, особенностям конструкции, материалам, оценке конструкции, производству, стерилизации, упаковке и информации, предоставляемой изготовителем, исходя из аспектов безопасности. Его следует рассматривать как дополнение к ИСО 14630, в котором определены основные требования к рабочим характеристикам неактивных хирургических имплантатов.
1.2 Настоящий стандарт применим к эндоваскулярным протезам, используемым при лечении аневризм аорты, аортальных стенозов и других сосудистых аномалий.
1.3 Настоящий стандарт применим к системам доставки, если таковые являются составной частью системы раскрытия и размещения эндоваскулярного протеза.
1.4 Настоящий стандарт не применим к сосудистым окклюдерам, за исключением подвздошных окклюдеров, используемых как неотъемлемая часть аорто-подвздошных устройств. См. исключенные из рассмотрения устройства в ИСО 14630.
1.5 Настоящий стандарт не применим к тем процедурам и устройствам, которые применялись до внедрения внутрисосудистых устройств (см. 3.6), таких, например, как устройства для баллонной ангиопластики.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие международные стандарты*. Для датированных ссылок применяют только указанные издания. Для недатированных ссылок применяют самые последние издания (включая любые изменения и поправки).
____________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ИСО 7198:1998 Сердечно-сосудистые имплантаты. Трубчатые протезы сосудов (ISO 7198:1998, Cardiovascular implants - Tubular vascular prostheses)
ИСО 11134:1994 Стерилизация медицинских изделий. Требования к валидации и текущему контролю. Промышленная стерилизация паром (ISO 11134:1994, Sterilization of health care products - Requirements for validation and routine control - Industrial moist heat sterilization)
ИСО 11135:1994 Медицинские изделия. Валидация и текущий контроль стерилизации оксидом этилена (ISO 11135:1994, Medical devices - Validation and routine control of ethylene oxide sterilization)
ИСО 11137:1995 Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Радиационная стерилизация (ISO 11137:1995, Sterilization of health care products - Requirements for validation and routine control - Radiation sterilization)
ИСО 10993 (все части) Биологическая оценка медицинских изделий (ISO 10993 (all parts), Biological evaluation of medical devices)
ИСО 11607:1997 Упаковка для медицинских изделий, подлежащих финишной стерилизации (ISO 11607:1997, Packaging for terminally sterilized medical devices)
ИСО 13485 Медицинские изделия. Системы менеджмента качества. Требования для регулирующих целей (ISO 13485, Medical devices - Quality management systems - Requirements for regulatory purposes)
ИСО 13488:1996 Системы качества. Медицинские изделия. Специальные требования к применению ИСО 9002 (ISO 13488:1996, Quality systems - Medical devices - Particular requirements for the application of ISO 9002)
ГОСТ Р ИСО 14155 (все части) Клинические испытания медицинских изделий для людей (ISO 14155 (all parts), Clinical investigation of medical devices for human subjectse)
ИСО 14160 Стерилизация одноразовых медицинских изделий, содержащих материалы животного происхождения. Валидация и текущий контроль стерилизации с помощью жидких стерилизующих средств (ISO 14160, Sterilization of single-use medical devices incorporating materials of animal origin - Validation and routine control of sterilization by liquid chemical sterilants)
ИСО 14630:1997 Неактивные хирургические имплантаты. Общие требования (ISO 14630:1997, Non-active surgical implants - General requirements)
ИСО 14937 Стерилизация медицинской продукции. Общие требования для определения характеристик стерилизующего агента и разработки, валидации и текущего контроля процессов стерилизации медицинских изделий (ISO 14937, Sterilization of health care products - General requirements for characterization of a sterilizing agent and the development, validation and routine control of a sterilization process for medical devices)
ИСО 14971:2000 Изделия медицинские. Применение менеджмента риска к медицинским изделиям (ISO 14971:2000, Medical devices - Application of risk management to medical devices)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 7198 и ИСО 14630, а также следующие термины с соответствующими определениями:
3.1 система крепления: Система, встроенная в эндоваскулярный протез, разработанная для непосредственного соединения его со стенкой сосуда для предотвращения миграции протеза.
Примечание - Система крепления может также препятствовать потоку крови с внешней стороны протеза - со стороны креплений.
3.2 система доставки: Система или механизм, используемые для доставки эндоваскулярного протеза в предусмотренную позицию.
Примечание - Систему доставки удаляют после установки имплантата.
3.3 детерминировать: Количественно оценить или проанализировать.
3.4 эндопротезные утечки: Упорное сохранение тока крови вне просвета эндоваскулярного протеза, но в пределах аневризматического мешка или прилегающего сегмента сосуда, который корригирован с помощью графта.
Примечание - Эндопротезные утечки можно классифицировать на следующие типы:
- Тип I наблюдается около протеза в проксимальной или дистальной зонах крепления протеза;
- Тип II вызывается ретроградным обратным потоком из ответвлений артерии;
- Тип III возникает вследствие дефекта материала графта или недостаточной плотности соединений между компонентами графта;
- Тип IV обусловлен проницаемостью графта, часто определяемой с помощью контраста.
3.5 эндоваскулярный протез, эндоваскулярный графт, эндоваскулярный имплантат: Протез, расположенный транслюминально, находящийся частично или полностью в сосудистом русле для формирования внутреннего канала или шунта для прохождения крови между сегментами сосудистой системы.
3.6 эндоваскулярная система: Система, используемая для устранения, коррекции (восстановления) повреждений сосудов, состоящая из эндоваскулярного протеза и системы его доставки.
Примечание 1 - Примером патологии сосудов, которая может быть корригирована эндоваскулярным путем, является аневризма брюшной аорты.
Примечание 2 - В рамках настоящего стандарта система доставки, так же как и имплантат, входит в данное определение.
3.7 оценивать: Качественно оценить или проанализировать.
3.8 материал графта: Неметаллический компонент эндоваскулярного протеза.
3.9 клиническое событие, подлежащее регистрации: Осложнения или отказы, наблюдаемые при клиническом применении внутрисосудистых систем.
4 Предполагаемые рабочие характеристики
Требования ИСО 14630, раздел 4, подлежат обязательному выполнению.
5 Особенности конструкции
5.1 Общие положения
Следует применять требования ИСО 14630, раздел 5. Кроме того, необходимо учитывать следующие факторы:
a) возможность окисления: учет возможности контактной коррозии на соответствующих частях системы;
b) возможность износа: учет коррозионного разрушения;
c) относительно соединений имплантата с тканями следует учитывать:
1) возможность применения скоб для крепления, если таковые присутствуют;
2) возможность относительных перемещений между имплантатом и тканью;
3) усилия, передаваемые устройством на окружающие ткани;
4) усилия, необходимые для деформирования имплантата;
d) ожидаемое врастание в ткань, перфорацию ткани, смещение и перемещение;
e) системы введения и доставки.
Примечание - Все эти дополнительные пункты - выполнение соответствующих требований раздела 5 ЕН 12006-3.
5.2 Система доставки
При оценке соответствия особенностей дизайна системы доставки требованиям к ее назначению следует дополнительно учитывать следующее:
a) способность системы обеспечивать соответствующий, точный и безопасный доступ в предполагаемую область размещения;
b) способность системы обеспечивать последовательное, точное и безопасное раскрытие имплантата;
c) способность системы обеспечивать последовательное и безопасное удаление системы доставки;
d) соответствие системы требованиям ИСО 10993-1 и соответственно другим частям серии ИСО 10993;
e) способность системы минимизировать потери крови;
f) визуализацию системы при рентгеноскопии или с помощью других методов.
5.3 Имплантат
При оценке соответствия имплантата требованиям к его назначению следует учитывать, по крайней мере, следующее:
a) способность имплантата раскрываться соответствующим образом с необходимой точностью и безопасностью;
b) способность имплантата надежно крепиться в сосудистом русле;
c) способность имплантата сохранять адекватную целостность;
d) способность имплантата при надлежащем использовании препятствовать кровотоку через стенки имплантата;
Следует учитывать возможные изменения проницаемости стенки сосуда после имплантации.
e) соответствующее взаимодействие между модулями (компонентами) эндоваскулярной системы;
f) соответствие размеров имплантата и его формы с точки зрения совместимости при использовании в сосудах определенных диаметров;
g) способность имплантата поддерживать адекватный поток крови через просвет (проходимость);
h) совместимость имплантата с действием магнитных полей при магнитно-резонансной томографии (МРТ);
i) соответствие системы требованиям ИСО 10993-1 и другим частям серии ИСО 10993;
j) различимость имплантата при рентгеноскопии или с помощью других методов.
6 Материалы
Соблюдение требований ИСО 14630, раздел 6, подлежит обязательному выполнению. Следует проводить дополнительные испытания материалов определенных видов для оценки их пригодности для использования, например, материалы на основе нитинола, обладающие свойством памяти формы.
7 Оценка конструктивной формы
7.1 Общие положения
Применение требований ИСО 14630, раздел 7, обязательно. Анализ риска следует проводить в соответствии с требованиями ИСО 14971.
Примечание - Не все виды испытаний могут подходить для конструкции определенных видов.
Должно быть приведено обоснование того, что некоторые свойства не могут быть оценены при проведении испытаний.
Невозможно учесть развивающиеся сегодня технологии, как и технологии будущего. Важно, чтобы протезы соответствовали требованиям основных протоколов испытаний настоящего стандарта при оценке характеристик эндоваскулярных систем. При оценке характеристик протезов, разрабатываемых по новым технологиям, могут потребоваться испытания, выходящие за рамки настоящего стандарта. При испытаниях следует обращать внимание на отказы протезов и их влияние на эффективность функционирования имплантата. Для составных протезов, как указано в ИСО 7198, подраздел 3.9, может оказаться необходимым проведение ряда испытаний, приведенных в настоящем стандарте. Требуется также испытание эндоваскулярной системы в целом. Кроме того, если компоненты протеза частично выполнены из биодеградируемых материалов, следует оценить свойства небиодеградируемых частей имплантата, а также имплантата в целом.
Каждый сегмент составного протеза, как указано в ИСО 7198, должен быть испытан. Любой выполненный анастомоз при этом должен удовлетворять требованиям настоящего стандарта относительно наличия утечки.
При внесении существенных изменений в материалы, конструктивное решение, форму, методы обработки следует проводить повторные испытания.
Изготовитель должен внести в протокол полное описание валидированных методов испытания и порядка подготовки образцов, используемых для оценки требований настоящего стандарта. Обоснование выбора метода и объема выборки обязательно. Если критерии приемки специально не определены, изготовитель должен оценить приемлемость результатов на основании существующих критериев.
Для оценки некоторых особенностей конструктивной формы следует предусмотреть использование референтных образцов изделий.
Если можно показать, что стерилизация не влияет на характеристики оцениваемого устройства, то испытания могут быть проведены на нестерильных изделиях.
7.2 Система доставки эндоваскулярного протеза
7.2.1 Возможность доступа
7.2.1.1 Общие положения
Способность системы доставки обеспечивать безопасный, последовательный и точный доступ в предполагаемую область подлежит обязательной оценке.
Оценка возможных опасностей включает следующие факторы, но не ограничивается ими:
a) проволочный проводник не перекрывает область поражения;
b) интродьюсер и система доставки не соответствуют размерам области доступа (несовпадение размеров);
c) система доставки не в состоянии обеспечить достижение предполагаемой области позиционирования имплантата;
d) тромбоэмболические осложнения;
e) смещение имплантата.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие, но не ограничиваясь ими:
- ошибка доступа;
- травма сосуда;
- неврологический дефицит;
- ишемия;
- спинномозговой неврологический дефицит;
- эмболизация.
Испытания должны включать нижеследующие пункты 7.2.1.2-7.2.1.12, если таковые соответствуют конструктивному решению (дизайну) эндоваскулярной системы.
7.2.1.2 Прочность соединения
Определяют значение продольного усилия соединения между отдельными частями системы доставки. Все соединения должны оставаться целыми при соблюдении рекомендуемых условий эксплуатации. Сравнивают значение продольного усилия с усилием, необходимым для введения, раскрытия и удаления системы.
7.2.1.3 Совместимость размеров компонентов
Определяют размеры эндоваскулярной системы и проверяют их на соответствие размерам рекомендуемых принадлежностей. Все компоненты должны быть совместимы по размерам.
7.2.1.4 Проверка размеров
Проверяют размеры на соответствие значениям, приведенным в спецификации на конструкцию.
7.2.1.5 Изгиб/кручение
Оценивают способность эндоваскулярной системы к изгибу и определяют минимальное значение радиуса или угла изгиба, допустимого при выполнении доступа и доставки.
7.2.1.6 Профиль
Определяют значение максимального диаметра сегментов эндоваскулярной системы.
7.2.1.7 Возможность проталкивания
Определяют способность эндоваскулярной системы к проталкиванию без изгиба или деформирования при выполнении позиционирования.
7.2.1.8 Визуализация
Оценивают качество визуализации системы доставки во время проведения доступа, используя рентгеноскопию. Использование других методов визуализации должно быть обосновано.
7.2.1.9 Моделирование
Оценивают работу системы доставки с помощью какой-либо модели, воспроизводящей предполагаемые условия использования системы.
7.2.1.10 Оценка вращения
Оценивают способность эндоваскулярной системы обеспечивать достаточное вращение ее дистального отдела для того, чтобы обеспечить доставку имплантата к месту его размещения внутри анатомических пределов и в соответствии с конструктивными возможностями системы.
7.2.1.11 Прочность соединения при кручении
Определяют значение крутящего момента, необходимого для разрушения соединений и/или материалов в соответствующих компонентах системы доставки. Сравнивают значение момента с соответствующим усилием, необходимые для введения, раскрытия и удаления системы.
7.2.1.12 Возможность продвижения системы
Оценивают способность эндоваскулярной системы продвигаться по рекомендуемому проволочному проводнику и возможность поступательного движения дистального участка проводника по сосудам, включая узкие, извитые участки сосудистого русла.
7.2.2 Способность к раскрытию
7.2.2.1 Общие положения
Необходимо оценить способность системы обеспечивать безопасное, последовательное и точное развертывание имплантата.
Оценка возможных опасностей включает следующие их виды, но не ограничивается ими:
a) невозможность полного и надлежащего развертывания протеза;
b) несоответствие размеров и свойств;
c) сдвиг имплантата;
d) отказ баллона;
e) повреждение компонентов имплантата;
f) плохая визуализация;
g) образование эмбол.
Эти опасности могут привести к следующим, подлежащим регистрации, неблагоприятным клиническим событиям, включая следующие их виды, но не ограничиваясь таковыми:
- отказ системы доставки;
- спинномозговой неврологический дефицит;
- неврологический дефицит;
- травма сосуда;
- ишемия;
- эмболизация;
- повреждения имплантата.
Оценка нижеследующих пунктов, перечисленных под 7.2.2.2-7.2.2.14, обязательна, если таковые соответствуют дизайну конструкции эндоваскулярной системы.
7.2.2.2 Прочность соединения
Определяют значение продольной прочности соединения между частями системы доставки. Все соединения должны оставаться целыми при соблюдении рекомендуемых условий эксплуатации.
7.2.2.3 Время наполнения баллона
Определяют время, необходимое для наполнения баллона до максимально рекомендуемого объема.
7.2.2.4 Время спуска баллона
Определяют время, необходимое для спуска баллона, и оценивают возможность удаления спущенного баллона.
7.2.2.5 Среднее давление разрыва баллона
Определяют среднее значение давления разрыва баллона.
7.2.2.6 Номинальное давление разрыва баллона
Определяют значение давления разрыва баллона с соответствующим коэффициентом запаса, учитывая параметры надежности.
Обозначают максимальное рекомендуемое давление наполнения и рабочее давление (рабочие давления).
7.2.2.7 Предел усталости баллона
Определяют максимальное число циклов наполнения баллона до рекомендуемых значений давления с учетом параметров надежности.
Обозначают максимальное рекомендуемое число циклов наполнения.
7.2.2.8 Совместимость размеров компонентов
Определяют размеры эндоваскулярной системы и проверяют на соответствие размерам рекомендуемых принадлежностей. Все компоненты должны быть совместимы по размерам.
7.2.2.9 Проверка размеров
Проверяют размеры на соответствие их значениям, приведенным в спецификации конструкции.
7.2.2.10 Усилие, необходимое для раскрытия
Определяют значение усилия, необходимого для раскрытия имплантата.
7.2.2.11 Визуализация
Оценивают качество визуализации имплантата и системы доставки во время выполнения доставки и раскрытия, используя рентгеноскопию. Применение других методик должно быть обосновано.
7.2.2.12 Моделирование
Оценивают работу эндоваскулярной системы с помощью какой-либо модели, воспроизводящей предполагаемые условия использования системы.
7.2.2.13 Прочность соединения при кручении
Определяют значение крутящего момента, необходимое для разрушения соединений и/или материалов в соответствующих компонентах системы доставки.
7.2.2.14 Прочность трубок при растяжении
Определяют прочность трубчатых элементов системы доставки с учетом свойств материала.
7.2.3 Возможность удаления системы доставки
7.2.3.1 Общие положения
Способность эндоваскулярной системы обеспечивать безопасное и последовательное удаление системы доставки подлежит обязательной оценке.
Оцениваемые опасности включают следующие виды, но не ограничиваются ими:
a) недостаточно полный спуск баллона (для расширяемых баллонов);
b) искажение формы баллона - образование у баллона "крыльев";
c) нарушение конструктивной целостности;
d) образование эмбол;
e) несоответствие диаметра;
f) смещение, сдвиг имплантата;
g) повреждение компонентов эндоваскулярной системы другими компонентами;
h) зацепление системы доставки за имплантат;
i) плохая визуализация.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие виды, но не ограничиваясь ими:
- отказ системы доставки;
- неврологический дефицит;
- травма сосуда;
- ишемия;
- спинномозговой неврологический дефицит;
- эмболизация;
- повреждения имплантата.
Следующие пункты, перечисленные под 7.2.3.2-7.2.3.9, подлежат обязательной проверке, если таковые соответствуют дизайну эндоваскулярной системы.
7.2.3.2 Прочность соединения
Определяют продольную прочность соединения между частями системы доставки. Все соединения должны оставаться целыми при соблюдении рекомендуемых условий эксплуатации.
7.2.3.3 Совместимость размеров компонентов
Оценивают размеры эндоваскулярной системы на предмет их соответствия размерам рекомендуемых принадлежностей. Все компоненты должны быть совместимы.
7.2.3.4 Проверка размеров
Проверяют размеры на соответствие значениям, приведенным в спецификации конструкции.
7.2.3.5 Изгиб/кручение
Оценивают способность эндоваскулярной системы выдерживать изгиб и определяют значения минимального радиуса или угла изгиба, допустимого во время извлечения системы.
7.2.3.6 Визуализация
Оценивают качество визуализации эндоваскулярной системы во время удаления, используя рентгеноскопию. Применение других методов должно быть обосновано.
7.2.3.7 Моделирование функционирования системы
Оценивают работу эндоваскулярной системы, используя какую-либо модель, воспроизводящую предполагаемые условия использования.
7.2.3.8 Прочность соединения при кручении
Определяют значение крутящего момента, необходимое для разрушения соединений и/или материалов в соответствующих компонентах системы доставки.
7.2.3.9 Прочность трубчатых элементов при растяжении
Определяют прочность трубок, используемых в системе доставки, с учетом их материала.
7.2.4 Биосовместимость
Биосовместимость подлежит обязательной оценке в соответствии с требованиями ИСО 10993-1 и соответственно других частей серии ИСО 10993.
7.2.5 Гемостаз
7.2.5.1 Общие положения
Необходимо оценить способность системы минимизировать потери крови.
Оцениваемые опасности включают следующие, но не ограничиваются ими:
a) несоответствие размеров;
b) недостаточность уплотнений;
c) другие утечки.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие, но не ограничиваясь ими:
- кровотечения при выполнении процедуры;
- образование гематом.
Оценка требований нижеследующих пунктов, перечисленных под 7.2.5.2 и 7.2.5.3, обязательна, если они соответствуют дизайну испытуемой конструкции эндоваскулярной системы.
7.2.5.2 Проверка размеров
Проверяют размеры на соответствие значениям, приведенным в спецификации конструкции.
7.2.5.3 Оценка гемостаза
Оценивают способность какого-либо гемостатического средства/клапана системы доставки обеспечивать необходимую гемостатическую изоляцию при кровотечении.
7.3 Имплантируемое изделие
7.3.1 Способность к точному развертыванию
7.3.1.1 Общие положения
Способность системы обеспечивать последовательное, точное и безопасное развертывание собственно имплантата в предполагаемой области повреждения подлежит обязательной оценке.
Оцениваемые виды опасности включают следующие, но не ограничиваются ими:
a) неточное расположение или ориентация имплантата;
b) некорректная форма развертывания;
c) неполное развертывание;
d) плохая визуализация.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие, но не ограничиваясь ими:
- окклюзия сосудистых ответвлений;
- отказ системы доставки;
- утечка со стороны креплений;
- смещение или сдвиг протеза;
- обструкция просвета протеза;
- ишемия;
- увеличение объема аневризмы;
- разрыв аневризмы;
- травмы сосудистых стенок.
Оценка нижеследующих пунктов 7.3.1.2-7.3.1.4 обязательна, если таковые соответствуют дизайну конструкции эндоваскулярной системы.
7.3.1.2 Соотношение длины и диаметра имплантата
Определяют соотношение длины и диаметра развернутого имплантата.
7.3.1.3 Визуализация
Оценивают качество визуализации имплантата во время его раскрытия и после удаления системы доставки, используя рентгеноскопию. Применение других методик следует обосновать.
7.3.1.4 Моделирование функционирования системы
Оценивают работу эндоваскулярной системы в целом, используя какую-либо модель, воспроизводящую предполагаемые условия использования.
7.3.2 Эффективность фиксации имплантата
7.3.2.1 Общие положения
Необходимо оценить способность системы обеспечивать эффективную фиксацию имплантата в пределах данного сосудистого сегмента.
Оценка возможных опасностей включает следующие их виды, не ограничиваясь ими:
a) неполное примыкание имплантата к стенкам сосуда;
b) чрезмерное или некорректное значение радиального усилия раскрытия.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие, но не ограничиваясь ими:
- утечка со стороны креплений;
- смещение или сдвиг протеза;
- обструкция просвета имплантата;
- травма сосуда;
- травма прилежащих тканей;
- окклюзия сосудистых ответвлений;
- расширение аневризмы;
- разрыв аневризмы.
Оценка нижеследующих пунктов, перечисленных под 7.3.2.2-7.3.2.8, обязательна, если таковые соответствуют дизайну конструкции эндоваскулярной системы.
7.3.2.2 Примыкание к стенкам сосуда
Оценивают способность имплантата обеспечивать необходимое качество его примыкания к сосудистой стенке.
7.3.2.3 Сопротивление разрушению
Определяют минимальную силу, при которой возникает остаточная деформация или полное разрушение имплантата.
7.3.2.4 Локальное сжатие
Определяют упругую деформацию имплантата в ответ на локальное приложение усилия сжатия.
7.3.2.5 Сопротивление к перемещению
Определяют способность имплантата оставаться неподвижным при моделировании его развертывания.
7.3.2.6 Внешняя радиальная сила
Усилие, действующее на саморасширяющиеся имплантаты, определяют как функцию от диаметра имплантата.
7.3.2.7 Отдача
Определяют значение упругой отдачи устройства (в процентах от уменьшения диаметра устройства) после раскрытия имплантата. Корректируют значение отдачи с рекомендуемыми значениями.
7.3.2.8 Моделирование функционирования системы
Оценивают работу эндоваскулярной системы с помощью любой модели, воспроизводящей предполагаемые условия использования.
7.3.3 Целостность имплантата
7.3.3.1 Общие положения
Способность имплантата сохранять целостность конструктивной формы подлежит обязательной оценке.
Оценка возможных опасностей включает следующие их виды, не ограничиваясь ими:
a) конструктивный отказ имплантата;
b) нарушение полноты примыкания имплантата к стенкам сосуда;
c) превышение утечки.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие виды, но не ограничиваясь ими:
- разрушение стента/системы крепления;
- дилатация/разрыв графта;
- тромбоз имплантата;
- смещение или сдвиг протеза;
- утечка со стороны крепления;
- расширение аневризмы;
- разрыв аневризмы;
- утечка через графт;
- травма сосуда;
- преграда/стеноз просвета;
- ишемия;
- повреждение прилежащих структур.
Оценка нижеследующих пунктов, перечисленных под 7.3.3.2-7.3.3.9, обязательна, если таковые соответствуют дизайну конструкции эндоваскулярной системы.
7.3.3.2 Прочность на разрыв внутренним/внешним давлением
Определяют прочность на разрыв или прочность в окружном направлении соответствующих компонентов имплантата в соответствии с ИСО 7198, пункты 8.3.3 или 8.3.1 соответственно.
7.3.3.3 Коррозия
Оценивают подверженность материала(ов) коррозии в реальной или моделируемой среде.
7.3.3.4 Прочность выполнения анастомоза
Определяют прочность на разрыв любого из выполненных анастомозов в соответствии с ИСО 7198, подпункт 8.3.2.4.
7.3.3.5 Прочность (долговечность)
7.3.3.5.1 Общие положения
При оценке длительной прочности следует учитывать следующие факторы:
- вероятные виды отказа, такие как износ, разрушения креплений, нарушения плетения (расплетение) ткани, расслоения и разрывы швов;
- радиальная, осевая нагрузки и другие усилия, приложенные in vivo на имплантат.
Эти факторы необходимо обязательно учитывать в контексте анатомической вариабельности и морфологических изменений.
7.3.3.5.2 Оценка напряженно-деформированного состояния
Оценивают характеристики напряженно-деформированного состояния имплантата при воздействии наихудшей комбинации физиологической нагрузки, используя соответствующие методы, такие, например, как метод конечных элементов (Finite Element Analysis, FEA).
7.3.3.5.3 Усталостная прочность
Оценивают в долгосрочной перспективе размерную и конструктивную неизменность имплантата. Сюда входят неизменность всех компонентов имплантата, их соединений и площадей контактов каждого из них.
Испытания имплантата на усталостную прочность должны включать in vitro испытания, продолжительностью, по крайней мере, эквивалентной десяти годам непрерывной работы (по крайней мере 380 миллионам циклов нагружения) для каждого испытуемого изделия. Если предполагаемый срок работы имплантата составляет менее 10 лет, можно использовать меньшую по времени продолжительность испытания на усталость, что должно быть обосновано.
Условия испытания должны быть обоснованы и включать в себя следующие параметры: число образцов, размеры испытуемых имплантатов и частота нагружения при испытании.
Частоту нагружения образцов при испытании следует устанавливать таким образом, чтобы значение деформации испытуемого имплантата было не менее деформации имплантата при его физиологическом нагружении (частоте сердечных сокращений). Испытания на усталость следует проводить при физиологических значениях температуры, но не менее 37 °С.
7.3.3.6 Прочность на растяжение
Определяют значение продольной прочности имплантата при растяжении.
7.3.3.7 Прочность при многократном проколе (для артериовенозных шунтов при внутрисосудистом доступе)
Оценивают способность имплантата-графта выдерживать многократные проколы.
7.3.3.8 Прочность стента/системы крепления при креплении графта (например, креплении на клей, креплении с помощью шовных нитей)
Определяют прочность соединения графта со стентом/системой крепления.
7.3.3.9 Визуальный контроль
В протезе не должно быть разрывов и загрязнений, пятен, выцветания, потери частиц материала или других дефектов, которые делают протез непригодным для предполагаемого использования.
7.3.4 Проницаемость
7.3.4.1 Общие положения
Необходимо оценить способность имплантата быть непроницаемым к прохождению крови через стенки имплантата-графта.
Следует учитывать возможные изменения во времени проницаемости после имплантации.
Оценка опасности включает следующее, но не ограничивается этим:
а) утечки.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие их виды, но не ограничиваясь этим:
- утечка через графт;
- расширение аневризмы;
- разрыв аневризмы.
Оценка нижеследующих пунктов, перечисленных под 7.3.4.2 и 7.3.4.3, обязательна, если таковые соответствуют дизайну конструкции эндоваскулярной системы.
7.3.4.2 Пористость, проницаемость для воды и входное давление воды
Оценивают пористость, проницаемость для воды и значение входного давления воды в соответствии с ИСО 7198, пункты 8.2.1, 8.2.2, 8.2.4. Выбор параметров оценки должен быть обоснован.
7.3.4.3 Общая проницаемость для воды/утечка
Определяют общую проницаемость для воды/утечку имплантата в соответствии с ИСО 7198, пункт 8.2.3.
7.3.5 Модульность
7.3.5.1 Общие положения
Способность системы обеспечивать надлежащее взаимодействие между соответствующими модулями подлежит обязательной оценке.
Оценка опасностей включает следующие их виды, но не ограничивается этим:
a) несоответствие размеров;
b) неточное позиционирование или ориентирование;
c) разделение модулей;
d) повреждение или преграда со стороны других модулей;
e) перегиб или скручивание модулей.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие их виды, но не ограничиваясь ими:
- миграция протеза;
- утечка со стороны крепления/утечка внутри компонента;
- травма сосуда;
- окклюзия ответвлений сосуда;
- расширение аневризмы;
- разрыв аневризмы;
- обструкция просвета;
- ишемия.
Оценка нижеследующих пунктов, перечисленных под 7.3.5.2-7.3.3.5, обязательна, если таковые соответствуют дизайну конструкции эндоваскулярной системы.
7.3.5.2 Проверка размеров
Проверяют размеры на соответствие значениям, приведенным в спецификации конструкции.
7.3.5.3 Перегиб/скручивание
Определяют минимальный радиус изгиба, который может выдержать имплантат без образования излома.
7.3.5.4 Устойчивость к миграции
Определяют способность имплантата оставаться несмещаемым (несдвигаемым) путем моделирования.
7.3.5.5 Испытание на отрыв для модульных компонентов
Определяют силу, необходимую для рассоединения модульных компонентов при моделируемых условиях использования.
7.3.6 Определение размеров
7.3.6.1 Общие положения
Способность системы обеспечивать корректную фиксацию имплантата в пределах сосудистого сегмента путем оценки корректности размеров подлежит обязательной оценке.
Оценка опасности включает следующее, но не ограничивается этим:
а) некорректные размеры.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие их виды, но, не ограничиваясь ими:
- отказ стента/системы крепления;
- миграция протеза;
- тромбоз имплантата;
- утечка со стороны крепления;
- расширение аневризмы;
- разрыв аневризмы;
- окклюзия сосудистых ответвлений;
- травма сосуда;
- повреждение прилежащих тканей;
- обструкция просвета;
- ишемия.
Испытания и оценка нижеследующих пунктов, перечисленных под 7.3.6.2-7.3.6.6, обязательна, если таковые соответствуют дизайну конструкции эндоваскулярной системы.
7.3.6.2 Соотношение длины и диаметра имплантата
Определяют соотношение длины и диаметра развернутого имплантата.
7.3.6.3 Проверка размеров
Проверяют размеры на соответствие значениям, приведенным в спецификации конструкции.
7.3.6.4 Отдача
Определяют величину упругой отдачи устройства (в процентах от уменьшения диаметра устройства) после развертывания имплантата и коррелируют полученное значение с рекомендуемым.
7.3.6.5 Моделирование функционирования системы
Оценивают работу эндоваскулярной системы с помощью какого-либо модельного устройства, воспроизводящего предполагаемые условия применения.
7.3.6.6 Соотношение диаметра имплантата и давления наполнения баллона
Для имплантатов, раскрываемых баллоном, определяют соотношение между диаметром имплантата и давлением наполнения баллона.
7.3.7 Проходимость
7.3.7.1 Общие положения
Необходимо оценить способность имплантата сохранять просвет открытым.
Оценка опасностей включает следующие их виды, но не ограничивается ими:
a) перегиб;
b) скручивание;
c) неточное развертывание;
d) деформирование;
e) образование тромбов.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие их виды, но не ограничиваясь ими:
- тромбоз имплантата;
- обструкция просвета;
- рестеноз;
- внезапное закупоривание;
- стенокардия;
- рецидив портальной гипертензии;
- инфаркт миокарда;
- ишемия;
- легочная эмболия.
Оценка имплантата на соответствие пунктов, перечисленных под 7.3.7.2-7.3.7.7, обязательна, если таковые соответствуют дизайну конструкции эндоваскулярной системы.
7.3.7.2 Внешняя радиальная сила
Сила, воздействующая на саморасширяющиеся имплантаты, должна быть определена как функция от диаметра имплантата.
7.3.7.3 Сопротивление разрушению
Определяют минимальное значение усилия, при котором возникает остаточная деформация или полное разрушение.
7.3.7.4 Моделирование функционирования системы
Оценивают работу эндоваскулярной системы с помощью какой-либо модели, воспроизводящей предполагаемые условия ее использования.
7.3.7.5 Площадь свободной поверхности стента
Определяют в процентах изменение площади свободной или открытой поверхности стента в зависимости от диаметра стента.
7.3.7.6 Местное сжатие
Определяют значение упругой деформации имплантата в ответ на местное сжатие.
7.3.7.7 Изгиб
Определяют значение минимального радиуса изгиба, который может выдержать имплантат без образования излома.
7.3.8 Совместимость с магнитно-резонансной томографией (МРТ)
Оценивают безопасность и совместимость имплантата при использовании МРТ.
Оценка опасностей включает следующие их виды, но не ограничивается этим:
a) низкое качество изображения (наличие артефактов);
b) перемещение или нагрев имплантата.
Эти опасности могут привести к развитию негативных клинических событий, подлежащих регистрации, включая следующие их виды, но не ограничиваясь ими:
- травма сосуда;
- миграция имплантата;
Примечание - Артефакты, наблюдаемые при использовании МРТ у некоторых видов имплантатов, снижают эффективность и ограничивают возможности МРТ у пациентов с имплантатами этих видов.
7.4 Доклиническая in vivo* оценка
_______________
* Слова "in vivo" в наименовании пункта 7.4 в бумажном оригинале выделены курсивом. - .
7.4.1 Цель
Цель доклинических in vivo испытаний заключается в том, чтобы оценить эффективность развертывания эндоваскулярного графта и его пропускную способность, а также определить реакции, как организма, так и имплантата. Исследования призваны установить соответствие испытуемой эндоваскулярной системы ее клиническому назначению.
7.4.2 Специальные цели
Должны быть обозначены специальные цели исследования, которые заключаются в следующем:
a) оценка возможности доступа в определенное место с использованием данной системы доставки;
b) оценка удобства обращения и качество визуализации системы доставки и собственно имплантата;
c) проверка точности и эффективности развертывания и размещения имплантата;
d) оценка возможности удаления системы доставки;
e) оценка пригодности метода определения размеров имплантата;
f) оценка эффективности гемостаза системы доставки и оболочки интродьюсера;
g) оценка позиции размещения, целостности конструкции, материала и функциональной эффективности в данный момент, по прошествии периода времени и при эксплуатации;
h) оценка гистологии и патологии эксплантатов и соответствующих тканей/органов;
i) регистрация неблагоприятных клинических событий.
7.4.3 Протокол экспериментальных исследований
Протез каждого типа должен быть испытан путем его имплантации в предназначенную для коррекции или аналогичную область сосуда, по крайней мере, у шести лабораторных животных на срок до 26 недель для каждого животного, если нет обоснования для более краткого срока наблюдения. При этом виды и сроки проведения периодических наблюдений также должны быть обоснованы. Для оценки инновационных технологий допустимы условия проведения острого эксперимента и более длительные сроки наблюдения за животными.
С учетом ограничений, налагаемых на использование лабораторных животных, все используемые устройства должны иметь качество, размеры и форму, отвечающие клиническому назначению изделия.
Лабораторных животных, отобранных для исследования, следует регулярно обследовать, а заболевших особей умерщвлять и подвергать незамедлительному патологоанатомическому исследованию. Причины гибели или болезни животного, а также степень причастности к этому исследуемого изделия (имплантата) должны быть установлены и зафиксированы. Следует проводить гистологическую и патофизиологическую оценки эксплантатов и соответствующих тканей/органов. Может оказаться целесообразным проведение исследований на контрольной группе животных с целью получения сравнительных данных.
Порядок доклинических испытаний in vivo, включая ведение протоколов экспериментальных исследований, сбора, оценки и анализа данных, должен быть обоснован. Следует также обосновать выбор животной модели с учетом таких параметров, как вид животного, пол, возраст и возможность моделирования какой-либо патологии. Все это должно соответствовать целям исследования. Имплантация должна соответствовать требованиям инструкций по клиническому использованию изделия в той степени, которая достижима с учетом ограничений, обусловленных видом животного.
Примечание - См. требования ИСО/МЭК 17025 в качестве руководства по соответствующей лабораторной практике.
7.4.4 Сбор данных
Нижеследующий перечень минимального объема данных рекомендуется собрать по каждому из лабораторных животных с имплантированным протезом:
а) данные идентификации:
1) происхождение животного;
2) идентификация животного;
3) пол;
4) дата рождения;
5) масса тела;
b) предоперационные сведения:
1) оценка состояния здоровья, включая соответствующие исследования крови;
2) назначение лекарственных средств (например, антибиотиков с профилактической целью);
c) операционные сведения:
1) дата имплантации;
2) имя лица, выполнившего вмешательство;
3) описание процедуры имплантации, включая:
- идентификационный номер протеза;
- длину и диаметр протеза in situ;
- значение превышения номинального размера;
- использование системной антитромбоцитарной/антикоагулянтной терапии;
4) оценка точности и эффективности введения системы доставки и раскрытия эндоваскулярного имплантата;
5) оценка удобства обращения и визуализации системы доставки, оценка визуализации собственно имплантата;
6) оценка эффективности удаления системы доставки;
7) оценка методики определения размеров и порядка определения размеров;
8) объем и локализация потери крови;
9) оценка позиции размещения, сохранения формы конструкции и материалов, оценка функционирования имплантата;
10) неблагоприятные события во время выполнения операции;
d) послеоперационные данные и результаты наблюдений:
1) назначение медикаментозных средств, включая средства, влияющие на свертываемость крови;
2) оценка наличия утечек, неизменности формы конструкции, эффективности работы, позиции размещения имплантата, метода визуализации с указанием даты наблюдения;
3) неблагоприятные события, дата начала развития, терапия и последствия;
4) любые существенные отклонения от протокола;
e) данные на момент окончания исследования:
1) результаты наблюдений за утечками, конструктивной целостностью, функциональной эффективностью и позицией имплантата, метод визуализации и дата выведения животного из экспериментального исследования;
2) сведения о существенном изменении размеров, химических и физических свойств имплантата и его компонентов;
3) гистологическая и патофизиологическая оценки эксплантатов и соответствующих тканей/органов.
7.4.5 Отчет об испытаниях и дополнительная информация
Результаты исследований для всех животных, отобранных для экспериментального исследования, должны быть внесены в протокол, даже если они были исключены из заключительного анализа.
Отчет об испытаниях должен включать в себя следующее:
a) протокол исследования;
b) обоснование выбора следующих параметров:
1) виды животных;
2) область имплантации;
3) период имплантации;
4) методы оценки;
5) интервалы наблюдения;
6) объем выборки (с указанием числа животных и имплантатов);
c) краткое изложение результатов:
1) общее число животных, включая причины исключения последних из рассмотрения;
2) процентное содержание удачных исходов;
3) сводка осложнений;
4) сводка данных о случаях ранней гибели животных или преднамеренного их выведения из эксперимента;
5) заключение хирурга об удобстве развертывания, визуализации и обращения с эндоваскулярной системой;
6) существенные и прочие отклонения от протокола;
7) сводка данных о патофизиологии и гистологии эксплантатов и соответствующих тканей/органов, включая характерные фотографии и микроснимки с учетом динамики изменений по времени;
8) сводка данных о любых изменениях позиции, формы конструкции имплантатов и материалов и функциональной состоятельности имплантата;
9) выводы по результатам исследования;
10) сводка данных о процедурах обеспечения качества и аудита данных.
7.5 Клиническая оценка
7.5.1 Цель
Целью клинической оценки является оценка рабочих характеристик системы доставки и безопасности и эффективности собственно эндоваскулярного протеза. Эта оценка не предназначена для доказательства пригодности протеза к длительному функционированию. Исследование должно быть проведено для каждого нового вида протеза или новой области его клинического применения протеза до начала поступления протеза на рынок. Существенные изменения конструкции протеза, которые могут повлиять на безопасность и рабочие характеристики, подлежат обязательной клинической оценке. Дополнительные типоразмеры протеза, выходящие за рамки исследуемого диапазона размеров, также могут потребовать клинической оценки. Протезы должны удовлетворять всем требованиям настоящего стандарта, предъявляемым к доклиническим исследованиям, перед началом их клинических испытаний.
7.5.2 Специальные цели
Следует сформулировать специальные цели исследования, которые могут включать в себя оценку следующих параметров изделия:
a) возможность доступа в определенную область с помощью данной системы доставки;
b) удобство обращения и визуализации системы доставки и имплантата данного вида;
c) точность и эффективность развертывания;
d) возможность удаления системы доставки;
e) пригодность метода определения размеров имплантата;
f) функциональная эффективность гемостаза системы доставки и оболочки интродьюсера;
g) позиция, неизменность конструкции и материалов, функциональная эффективность на данный момент времени, а также по прошествии времени;
h) контроль за наличием повреждений и неизменности позиции размещения имплантата (во временном интервале);
i) отчет об изменениях в ранние и поздние сроки наблюдения и их причинах;
j) оценка гистологии и патофизиологии эксплантатов и соответствующих тканей/органов;
k) регистрация негативных клинических событий, подлежащих регистрации и оценке.
7.5.3 Протокол клинического исследования
Рекомендуется проводить многоцентровые исследования (как минимум в трех исследовательских центрах). Число исследовательских центров должно быть обосновано. Также должно быть приведено статистическое обоснование числа исследуемых пациентов.
Клинические исследования следует продолжать как минимум 12 месяцев для каждого пациента, если нет какого-либо обоснования для изменения продолжительности наблюдения. Продолжительность наблюдения должна соответствовать стандартам ухода. Все пациенты, которым имплантированы испытуемый или контрольный вид протеза, включая пациентов, исключенных из заключительного анализа, должны быть зарегистрированы. Заключительный отчет должен содержать результаты наблюдений за всеми пациентами, включая результаты последних 12 месяцев наблюдений для последнего из зарегистрированных пациентов. Сроки периодических наблюдений должны включать, как минимум сроки, соответствующие выписке пациента и 12 месяцу после хирургического вмешательства. Определение продолжительности интервалов наблюдения требует обоснования. Наблюдения пациентов рекомендуется проводить, как минимум, в течение пяти лет после имплантации последнего протеза.
Если подходящий метод контроля пациентов не установлен или не может быть установлен, а параллельный контроль необязателен, то заранее следует выбрать и обосновать метод оценки клинических данных. Контроль пациентов должен соответствовать задачам исследования.
Какую-либо одну специальную задачу или ряд задач следует формулировать с перспективой дальнейших исследований. Эти задачи должны включать соответствующие параметры исследования и содержать критерии оценки каждого из параметров.
Следует также четко определить критерии включения и исключения пациентов. Эти критерии должны установить целевую категорию пациентов (тех пациентов, для кого прежде всего предназначен испытуемый имплантат) и доступную для исследований группу пациентов (тех, кто согласен принимать участие в исследованиях). При отборе пациентов для минимизации отклонений следует применять соответствующий эпидемиологический подход.
7.5.4 Регистрация данных
Нижеследующие данные, как минимум, должны быть получены для каждого пациента при проведении исследований:
Примечание - Исключения для контрольной группы приведены ниже.
a) данные идентификации:
1) идентификация пациента;
2) пол;
3) дата рождения;
4) имя исследователя;
5) фамилия, инициалы исследователя;
b) предоперационные сведения:
1) факторы риска, такие как гипертензия, диабет, гиперлипидемия, курение, ожирение, риски анестезии и любые другие сердечно-сосудистые факторы риска, с приблизительной оценкой степени их тяжести и указанием проводимого в настоящее время лечения;
2) сведения о предыдущих вмешательствах на сосудах, включая нехирургические вмешательства, и наличии имплантированных сосудистых протезов;
3) степень неотложности вмешательства (т.е. неотложное или плановое);
4) диагностические критерии:
- клиническая оценка;
- объективная оценка степени поврежденности сосудов и рекомендации по доступу к сосудам с учетом других факторов (размеры, степень кальциноза, извитости и пр.);
c) операционные сведения:
1) фамилия, инициалы хирурга, выполнявшего имплантацию;
2) дата вмешательства;
3) данные идентификации имплантата (имплантатов), включая номер модели, размер и конфигурация;
4) подробности выполнения процедуры, включая любые дополнительные процедуры с сосудами;
5) соответствующая медикаментозная терапия;
6) оценка удобства обращения с системой доставки, визуализации, размещения и удаления;
7) оценка утечек;
8) оценка проходимости, раскрытия и сохранения неизменности формы протеза;
9) клинические осложнения, подлежащие регистрации (см. приложение С);
10) дата выписки из отделения;
11) длина части имплантата, контактирующей с тканями вне зоны аневризмы;
12) диаметр просвета имплантата;
13) соответствие размещенного имплантата сосуду;
d) послеоперационные данные:
1) дата каждого срока наблюдения;
2) сведения о сосудистых вмешательствах с момента последнего наблюдения;
3) клиническая оценка (протокол оценки может отличаться для контрольной и исследуемой групп):
- клиническая оценка;
- объективная оценка функционирования протеза (объем утечки, миграция, проходимость, процент сужения диаметра, целостность компонентов);
- объективная оценка характеристик пораженного сосудистого сегмента и позиционирования в нем имплантата;
4) проводимая медикаментозная терапия: антикоагулянты или антибиотики;
5) клинические события, подлежащие регистрации:
- вид осложнения, дата образования, тяжесть, предпринятые действия, последствия;
- документированные сведения о причастности протеза (обусловлено ли осложнение протезом?)! Оценка усталостной и длительной прочности (в условиях пульсирующего потока): аналитический подход;
- документированные сведения о возможных факторах, послуживших причиной осложнения (вызвано ли осложнение конструкцией протеза, факторами, связанными с пациентом, техническими причинами или чем-либо иным?);
е) выведение пациента из исследования:
1) дата;
2) всего месяцев от начала исследований;
3) причины выведения (потерян для наблюдения, летальный исход).
7.5.5 Заключительный отчет
Заключительный клинический отчет должен содержать следующее:
a) протокол исследования;
b) определения неблагоприятных клинических событий, подлежащих регистрации;
c) обоснование выбора следующих параметров:
1) объем исследования;
2) выбор способа контроля;
3) методы измерения;
4) используемый метод статистического анализа;
5) интервалы наблюдения за пациентами;
d) послеоперационные данные и результаты наблюдений:
1) учет пациентов, включая обоснование исключения данных;
2) существенные и/или обусловленные ходом исследования отклонения от протокола;
3) сведения о пациентах, не завершивших исследование (т.е. потерянных для наблюдения или умерших);
4) сведения о ранних (при сроках, менее или равных 30 суток, либо до срока выписки, если больной находился в стационаре более 30 суток) и отдаленных клинических событиях, подлежащих регистрации:
- по типу события;
- детали каких-либо событий, ассоциирующих с другими событиями у отдельных пациентов;
5) сведения о функционировании системы доставки;
6) сведения о функционировании протеза (например, наличие утечек, миграции, проходимость, целостность компонентов, изменений в геометрии формы);
7) сведения о характере поражения сосуда (например, об изменении размеров аневризмы);
8) сведения о характере поражений, обусловленных наличием и работой имплантата (например, изменение размера аневризмы, наличие утечек);
9) сведения о вмешательствах на сосудах;
10) сведения о необходимости обращения в отдаленные сроки к открытому хирургическому вмешательству;
11) сведения о процедурной и отдаленной летальности;
12) сведения о патологоанатомическом исследовании;
13) сравнение результатов испытуемой и контрольной групп пациентов;
14) выводы по результатам исследования.
8 Изготовление
Требования ИСО 13485 и ИСО 13488, а также ИСО 14630, раздел 8, подлежат обязательному применению.
9 Стерилизация
9.1 Изделия, поставляемые в стерильном виде
9.1.1 Имплантаты с надписью "Стерильно" должны соответствовать требованиям национальных или региональных стандартов. При этом имплантаты с надписью "Стерильно" должны иметь уровень обеспечения стерильности 10.
Примечание - В качестве примера см. ЕН 556 [17] и ANSI/AMI ST67 [20].
9.1.2 Процессы стерилизации должны быть валидированы и контролироваться в текущем режиме следующим образом:
а) Если эндоваскулярные системы стерилизуют этиленоксидом, применяют требования ИСО 11135.
b) Если эндоваскулярные системы стерилизуют паром, применяют требования ИСО 11134.
с) Если эндоваскулярные системы стерилизуют радиационным методом, применяют требования ИСО 11137.
d) Если одноразовые эндоваскулярные системы содержат материалы животного происхождения, то применяют жидкие химические стерилизующие среды по ИСО 14160.
е) Если эндоваскулярные системы стерилизуют любым другим методом стерилизации, применяют требования ИСО 14937.
Примечание - Ранее были разработаны отдельные международные и европейские стандарты, касающиеся валидации и текущего контроля некоторых процессов стерилизации. В Европе применяется ЕН 550 при стерилизации этиленоксидом, ЕН 554 - при стерилизации паром, ЕН 552 - при стерилизации радиационными методами. На момент публикации настоящего стандарта была проведена работа по гармонизации отдельных стандартов по валидации и текущему контролю над процессами стерилизации.
9.2 Изделия, поставляемые в нестерильном виде
Применяют требования ИСО 14630, подраздел 9.2.
9.3 Остаточные продукты стерилизации
Применяют требования ИСО 14630, подраздел 9.3.
10 Упаковка
10.1 Защита от повреждений при хранении и транспортировании
10.1.1 Общие положения
Применяют требования ИСО 14630, подраздел 10.1.
10.1.2 Индивидуальный контейнер
Каждый протез должен быть упакован в индивидуальный контейнер. Признаки нарушения упаковки должны быть отчетливо различимы в случае, если индивидуальный контейнер был вскрыт.
10.1.3 Внешний контейнер
Каждый индивидуальный контейнер должен быть упакован во внешний контейнер. Этот внешний контейнер должен быть разработан таким образом, чтобы защищать индивидуальный контейнер от повреждений, связанных с хранением.
10.1.4 Транспортный контейнер
Каждый внешний контейнер или несколько внешних контейнеров необязательно одного типа могут быть упакованы в транспортный контейнер, разработанный таким образом, чтобы защищать содержимое при нормальных условиях обращения, транспортирования и хранения.
10.1.5 Поддержание стерильности при перевозке
Для протезов, поставляемых в стерильном виде, индивидуальный контейнер должен быть разработан таким образом, чтобы обеспечивать стерильность протеза при должных условиях обращения, транспортирования и хранения и обеспечивать асептическое использование содержимого асептическим путем.
Упаковка должна соответствовать требованиям ИСО 11607.
Примечание - Были разработаны отдельные международные и европейские стандарты, касающиеся упаковки стерилизованных медицинских изделий. В Европе применяется ЕН 868-1 для упаковки медицинских изделий при стерилизации.
10.2 Маркировка
10.2.1 Этикетка контейнера
Каждая эндоваскулярная система должна быть снабжена этикеткой(ами) на соответствующем контейнере(ах). По крайней мере нижеследующая информация должна быть представлена на этикетке(ах):
a) наименование, адрес и/или торговое наименование изготовителя;
b) материал конструкции и тип конструкции;
c) конфигурация. Для описания протезов могут быть применены символы;
d) номинальная длина (длины);
e) номинальный диаметр(ы);
f) при необходимости, пористость, средняя проницаемость для воды, общая проницаемость для воды утечка, и/или давление входа для воды;
g) выделенные прописными буквами фразы "СТЕРИЛЬНО - НЕ СТЕРИЛИЗОВАТЬ ПОВТОРНО - ТОЛЬКО ОДНОРАЗОВОЕ ИСПОЛЬЗОВАНИЕ" или эквивалентные им фразы или символы;
h) номер партии или лота при изготовлении;
i) номер лота при стерилизации;
j) дата стерилизации и/или срок годности/дата окончания срока годности;
k) для протезов, поставляемых в стерильном виде, предупреждение о невозможности использования протеза, если упаковка вскрыта или повреждена;
I) рекомендации изготовителя по хранению, при необходимости;
m) химическая природа любых консервантов в индивидуальном контейнере, с любыми соответствующими предупреждениями об опасности.
Примечание - Если номер партии или лота при изготовлении [перечисление h)] и номер лота при стерилизации [перечисление i)] могут быть отслежены по одной и той же информации, можно ограничиться номером лота.
10.2.2 Этикетки учета (стикеры)
Каждый протез должен быть снабжен по крайней мере тремя стикерами - клейкими этикетками учета для прикрепления к истории болезни пациента, получающего имплантат. Стикер должен содержать следующую информацию:
a) идентификацию изготовителя (торговая марка и т.п.);
b) наименование изделия;
c) серийный номер партии изготовления и/или лота при стерилизации;
d) номер модели (по каталогу изготовителя).
10.3 Информация, предоставляемая изготовителем
10.3.1 Общие положения
Применяют требования ИСО 14630, раздел 11. Более подробная информация приведена в таблице А.2 приложения А.
10.3.2 Информация и инструкция по эксплуатации
Каждый индивидуальный контейнер или внешний контейнер с идентичным содержимым должен быть снабжен инструкцией по применению протеза. Инструкция должна содержать следующие сведения:
а) показания к использованию;
b) противопоказания, меры предосторожности и предупреждения;
c) рекомендуемые методы асептического подхода при подготовке протеза, предимплантационную подготовку и методы имплантации;
d) выделенные прописными буквами фразы "СТЕРИЛЬНО - НЕ СТЕРИЛИЗОВАТЬ ПОВТОРНО - ТОЛЬКО ОДНОРАЗОВОЕ ИСПОЛЬЗОВАНИЕ";
е) информацию по повторной стерилизации, при необходимости;
f) уведомление о добавках и/или вымываемых компонентах, при необходимости;
g) рекомендации по хранению, при необходимости;
h) дату публикации или ссылку на публикацию текста инструкции с приведением сведений об изменениях содержания, если таковые имели место;
i) рекомендации по методам визуализации протеза;
j) информацию по МРТ совместимости.
Приложение А
(справочное)
Свойства эндоваскулярных устройств. Технические и клинические вопросы
В таблицах А.1-А.3 приведена в логической последовательности идентификация серии испытаний на биосовместимость, стендовых испытаний, испытаний на лабораторных животных и клинических испытаний с целью оценки испытуемого изделия. Приложение В содержит перечень стендовых испытаний, идентифицированных в табличной форме, с указанием цели каждого из испытаний. В приложении С приведены определения видов осложнений и отказов, подлежащих регистрации.
Наименования таблиц с пояснениями приведены ниже в таблице А.1. Также приведена форма, помогающая обеспечить соответствующий контекст для информации, содержащейся в таблице.
Таблица А.1 - Наименования таблиц и пояснения
Номер колонки | Заголовок | Пояснение | Контекст |
1 | Свойство имплантата/ | Отдельные цели разработки дизайна | Имплантат должен иметь адекватный _______(колонка 1) |
2 | Проблема (проблемы) | Сложности, с которыми можно столкнуться и которые могут не привести к достижению отдельных целей разработки | Если имплантат не обладает адекватным _______ (колонка 1), причиной могут быть проблемы с _______ (колонка 2) |
3 | Клинические события, подлежащие регистрации | Осложнения или отказы, которые могут наблюдаться при клиническом использовании устройства | Если проблема с _______ (колонка 2), _______ (колонка 3) может возникнуть и должен быть зафиксирован |
4 | Стендовые и аналитические испытания | Перечень видов испытаний, за исключением испытаний на животных и клинических испытаний, которые могут быть проведены для валидации отдельных целей разработки конструктивного решения | Следующие испытания могут быть проведены для оценки адекватности _______ (колонка 1): _______ (колонка 4) |
5 | Исследования на лабораторных животных | Специальным назначением исследований на животных являются валидация и верификация отдельных целей разработки конструктивного решения | Для того чтобы оценить адекватность _______ (колонка 1) в среде in vivo, должны быть проведены исследования на животных _______ (колонка 5) |
6 | Клинические исследования | Специальным назначением клинических исследований является верификация отдельных целей разработки конструктивного решения | Для того чтобы оценить адекватность _______ (колонка 1) в клинической среде, должны быть проведены клинические исследования _______ (колонка 6) |
7 | Информация, предоставляемая изготовителем | Информация, предоставляемая изготовителем, служит для минимизации вероятности отказов | Для минимизации риска _______(колонка 2) или _______(колонка 3) изготовителем должен быть предоставлен _______(колонка 7) |
Таблица А.2 - Свойства эндоваскулярных устройств. Технические и клинические факторы оценки функционирования системы доставки
Система доставки | ||||||
Свойство устройства/ | Проблема(ы) | Клинические события, подлежащие регистрации | Стендовые испытания и аналитические расчеты | Доклинические исследования in vivo | Клинические исследования | Информация, предостав- |
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Возможность доступа | Проволочный проводник не перекрывает область поражения. | Ошибка доступа. | Совместимость размеров компонентов. | Оценка возможности доступа. | Оценка возможности доступа. | Профиль имплантата, размеры проволочного проводника, совместимые с системой доставки. |
Возможность раскрытия: устройства, расширяемые баллоном | Невозможность активации механизма раскрытия. | Отказ системы раскрытия. | Совместимость размеров компонентов. | Проверка эффективности раскрытия. | Проверка эффективности раскрытия. | Для имплантатов, устанавливаемых пользователем, информация, предоставляемая изготовителем, должна включать рекомендации или спецификацию компонентов доставки. |
Возможность раскрытия: саморасши- | Невозможность активации механизма раскрытия. | Отказ системы раскрытия. | Совместимость размеров компонентов. | Проверка эффективности раскрытия. | Проверка эффективности раскрытия. | Для имплантатов, устанавливаемых пользователем, информация, предоставляемая изготовителем, должна включать рекомендации или спецификацию компонентов доставки. |
Смещение имплантата (например, стента) | ||||||
Возможность удаления: устройства, расширяемые баллоном | Некорректный спуск баллона. | Отказ системы раскрытия. | Прочность трубок при растяжении. | Проверка эффективности удаления. | Проверка эффективности удаления. | Информация должна включать рекомендации или спецификации вспомогательных устройств |
Возможность удаления: саморасши- | Ошибка в диаметре. | Отказ системы раскрытия. | Прочность трубок при растяжении. | Проверка эффективности удаления. | Проверка эффективности удаления. | Информация должна включать рекомендации или спецификации вспомогательных устройств |
Зацепление системы доставки об имплантат. | Повреждение имплантата | Проверка размеров Перегиб/перекручивание. | ||||
Биосов- | Нарушение соответствующей биосовместимости | Осложнения, приводящие к нарушению биосовместимости | ИСО 10993 | ИСО 10993. | Оценка клинических событий, подлежащих регистрации | Неприменимо |
Стерильность | Нестерильный продукт | Инфекция | Надежность стерилизации | Неприменимо | Оценка клинических событий, подлежащих регистрации | Соответствующие инструкции по обслуживанию. |
Гемостаз | Ошибка в размерах. | Процедурные кровотечения. | Оценка гемостаза. | Оценка соответствия размеров. | Оценка соответствия размеров. | Рекомендации по выбору размеров. |
Таблица А.3 - Свойства эндоваскулярных устройств. Технические и клинические факторы оценки имплантатов
Свойство устройства/ | Проблема(ы) | Клинические события, подлежащие регистрации | Стендовые испытания | Исследования на животных | Клинические исследования | Информация, предоставляемая изготовителем |
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Возможность точного раскрытия | Неточное расположение или ориентация. | Окклюзия ответвлений сосуда. | Моделирование использования. | Оценка визуализации. | Оценка визуализации. | Расположение и описание отметок контрастным веществом при их наличии |
Эффек- | Неполное прилегание к стенкам сосуда. | Утечка со стороны крепления. | Радиальная сила. | Оценка положения, целостности и функциональности. | Оценка положения, целостности и функциональности. | Указания, касающиеся ограничений и требований к оценке соответствия фиксации |
Целостность имплантата | Структурный отказ имплантата. | Разлом стента/системы крепления. | Усталость и прочность. | Оценка положения, целостности и функциональности. | Оценка положения, целостности и функциональности. | Неприменимо |
Прони- | Неадекватное заживление. | Утечка через графт. | Пористость, проницаемость для воды, общая проницаемость для воды/утечка и давление прохода воды | Оценка неблагоприятных событий с особенным вниманием к событиям, перечисленным в колонке 3 | Контроль морфологии повреждения. | Неприменимо |
Модульность | Ошибка в размерах. | Смещение протеза. | Испытание на отрыв для модульных компонентов. | Оценка положения, целостности и функциональной состоятельности. | Оценка положения, целостности и функциональной состоятельности. | Расположение и описание отметок контрастным веществом при их наличии. |
Соответст- | Некорректные размеры | Отказ стента/системы крепления. | Моделирование использования. | Проверка схемы определения размеров. | Оценка клинических событий, подлежащих регистрации | Рекомендации по определению размеров |
Прохо- | Перегиб. | Тромбоз имплантата. | Радиальная сила. | Оценка положения, целостности и функциональности. | Оценка положения, целостности и функциональности. | Неприменимо |
Совмес- | Недостаточное качество изображения. | Травма сосуда. | Совместимость с МРТ | Неприменимо | Оценка клинических событий, подлежащих регистрации | Описание безопасности при МРТ и совместимости устройства |
Биосов- | Утрата соответствующей биосовмес- | Осложнения, приводящие к утрате соответствующей биосовмес- | ИСО 10993 | ИСО 10993. | Оценка клинических событий, подлежащих регистрации | Список используемых материалов |
Стериль- | Нестерильный продукт | Инфекция | Обеспечение стерильности | Неприменимо | Оценка клинических событий, подлежащих регистрации | Соответствующие инструкции по обслуживанию. |
Приложение В
(справочное)
Стендовые испытания и аналитические расчеты
Таблица В.1 - Стендовые испытания и аналитические расчеты
Испытания | Описание испытания и требований | Вид оценки конструкции |
Оценка гемостаза | Оценивают способность системы поддерживать достаточную гемостатическую изоляцию | 7.2.5 Гемостаз |
Время спуска баллона | Определяют время, необходимое для спуска баллона, и оценивают возможность удаления баллона после спуска | 7.2.2 Способность к раскрытию |
Время наполнения баллона | Определяют время, необходимое для наполнения баллона до максимально рекомендуемого давления наполнения | 7.2.2 Способность к раскрытию |
Среднее давление разрыва баллона | Определяют среднее давление разрыва | 7.2.2 Способность к раскрытию |
Номинальное давление разрыва баллона | Определяют давление разрыва с соответствующим коэффициентом запаса, учитывая параметры надежности | 7.2.2 Способность к раскрытию |
Номинальный износ баллона | Определяют максимальное число рекомендуемых циклов наполнения до рекомендуемого значения давления наполнения, учитывая параметры надежности | 7.2.2 Способность к раскрытию |
Прочность соединения | Определяют продольное усилие соединения между частями системы доставки. Все соединения должны оставаться неповрежденными при рекомендуемых условиях эксплуатации | 7.2.3 Возможность удаления |
Прочность на разрыв внутренним/внешним давлением | Определяют прочность на разрыв внутренним давлением и/или прочность при воздействии внешнего давления соответствующих компонентов имплантата (ИСО 7198, пункт 7.3.3) | 7.3.3 Целостность имплантата |
Совместимость размеров компонентов | Определяют размеры имплантата и проверяют на соответствие размерам рекомендуемых принадлежностей. Все компоненты должны быть совместимы по размерам | 7.2.1 Возможность доступа |
Контакт с сосудистой стенкой | Оценивают способность имплантата обеспечивать достаточный контакт со стенками сосуда | 7.3.2 Эффективность фиксации |
Коррозия | Оценивают подверженность материала(ов) коррозии в реальной или моделируемой среде | 7.3.3 Целостность имплантата |
Устойчивость к разрушению | Определяют минимальное усилие, при котором возникает остаточная деформация или полное разрушение | 7.3.7 Проходимость |
Соответствие диаметра имплантата давлению наполнения баллона | Для имплантатов, раскрываемых баллоном, определяют соотношение между диаметром имплантата и значением давления наполнения баллона | 7.3.6 Контроль размеров |
Соотношение длины и диаметра имплантата | Для имплантатов, раскрываемых баллоном, и самораскрывающихся баллонов определяют соотношение длины имплантата и диаметра раскрытого имплантата | 7.3.6 Способность к точному развертыванию |
Проверка размеров | Проверяют соответствие размеров данным спецификации конструкции | 7.2.1 Возможность доступа |
Прочность выполненного анастомоза | Определяют прочность на разрыв всех выполненных анастомозов (ИСО 7198, подпункт 8.3.2.4) | 7.3.3 Целостность имплантата |
Усталость и устойчивость | Оценивают долгосрочную стабильность размеров и целостность материала имплантата | 7.3.3 Целостность имплантата |
Перегиб/скручивание | Оценивают способность имплантата и эндоваскулярной системы к изгибу для определения минимального радиуса изгиба или угла, допустимого во время доступа и доставки. | 7.2.1 Возможность доступа |
Усилие, необходимое для раскрытия | Определяют усилие, необходимое для раскрытия имплантата из системы доставки | 7.2.2 Способность к раскрытию |
Общая проницаемость для воды | Определяют объем чистой, отфильтрованной жидкости (с вязкостью, примерно равной вязкости воды), которая проходит через стенки протеза за определенное время при определенном давлении (ИСО 7198, пункт 8.2.3) | 7.3.4 Проницаемость |
Локальное сжатие | Определяют упругую деформацию имплантата в ответ на локальное сжатие | 7.3.2 Эффективность фиксации |
Продольная прочность на разрыв | Определяют продольную прочность протеза на разрыв (ИСО 7198, пункт 8.3.2) | ИСО 7198, пункт 8.3.2 |
Устойчивость к миграции | Определяют способность имплантата оставаться неподвижным при моделировании его работы | 7.3.2 Эффективность фиксации |
Совместимость с МРТ | Оценивают безопасность путем оценки совместимости с МРТ | 7.3.8 Совместимость с МРТ |
Пористость | Оценивают пористость материала имплантата с помощью оценки соотношения пустот в материале к общему объему, занимаемому материалом, включая пустоты (ИСО 7198, пункт 8.2.1) | 7.3.4 Проницаемость |
Профилирование | Определяют максимальный диаметр отдельных сегментов эндоваскулярной системы | 7.2.1 Возможность доступа |
Испытание на отрыв для модульных компонентов | Определяют усилие, необходимое для разъединения модульных компонентов при моделировании работы | 7.3.5 Модульность |
Возможность проталкивания | Определяют способность проталкивания эндоваскулярной системы или ее размещения оператором без перегибов и излома | 7.2.1 Возможность доступа |
Внешняя радиальная сила (окружная прочность) | Сила, воздействующая на саморасширяющиеся имплантаты, должна быть измерена как функция от диаметра имплантата | 7.3.2 Эффективность фиксации |
Отдача | Определяют значение упругой отдачи устройства после раскрытия имплантата. Соотносят эту отдачу с рекомендуемыми размерами | 7.3.6 Определение размеров |
Моделирование работы | Оценивают рабочие характеристики имплантата с помощью модели, воспроизводящей предполагаемые условия его работы | 7.2.1 Возможность доступа |
Площадь свободной поверхности стента | Определяют в процентах изменение свободной или открытой площади стента как функцию от его диаметра | 7.3.7 Проходимость |
Прочность при многократном проколе | Оценивают способность имплантата выдерживать многократные проколы | 7.3.3 Целостность имплантата |
Прочность креплений стента/системы и графта | Оценивают прочность соединения графта со стентом | 7.3.3 Целостность имплантата |
Исследование напряженно-деформированного состояния | Оценивают характеристики напряженно-деформированного состояния имплантата при воздействии худшего случая его физиологического нагружения, используя соответствующие методы, например метод конечных элементов (Finite Element Analysis, FEA) | 7.3.3 Целостность имплантата |
Возможность вращения | Оценивают способность эндоваскулярной системы обеспечивать достаточную свободу поворота дистального отдела имплантата | 7.2.1 Возможность доступа |
Прочность соединения при кручении | Определяют значение крутящего момента, при котором имеет место разрушение соединений и/или материалов в соответствующих компонентах системы доставки | 7.2.1 Возможность доступа |
Возможность следования | Оценивают возможность эндоваскулярной системы следовать по проволочному проводнику вслед за его кончиком по руслу сосуда, включая узкие, извитые участки сосуда | 7.2.1 Возможность доступа |
Прочность трубок при растяжении | Определяют прочность трубок, используемых в системе доставки, с учетом их материала | 7.2.2 Способность к раскрытию |
Визуализация | Оценивают возможность визуализации имплантата при моделировании его работы | 7.2.1 Возможность доступа |
Визуальный осмотр | Проверяют отсутствие на протезе дефектов, которые делают его непригодным для предназначенного использования (ИСО 7198, подраздел 8.1) | 7.3.3 Целостность имплантата |
Давление проникания воды | Определяют давление, при котором вода проникает через стенку протеза, в соответствии с требованиями ИСО 7198, пункт 8.2.4 | 7.3.4 Проницаемость |
Проницаемость для воды | Определяют объем воды, проникающей через материалы соответствующих компонентов имплантата (ИСО 7198, пункт 8.2.2) | 7.3.4 Проницаемость |
Приложение С
(справочное)
Определения видов осложнений и отказов, подлежащих регистрации
Таблица С.1 - Определения видов осложнений и отказов, подлежащих регистрации
Осложнение | Определение |
Повторный тромбоз (ретромбоз) | Обструкция ранее проходимого отверстия |
Ошибка доступа | Сбой при достижении имплантатом предполагаемой области размещения, связанный с механическим сбоем или спецификой анатомии пациента. Не произошло успешной фиксации в предполагаемом месте размещения или не произошло раскрытия имплантата |
Отказ вспомогательного устройства | Невозможность использования вспомогательного устройства по назначению из-за механического сбоя или особенностей анатомии пациента. Определяют, явились ли обстоятельства причиной неудачного раскрытия имплантата |
Расширение аневризмы | Любое расширение размеров аневризмы, выходящее за пределы погрешности метода КТ с контрастированием или при оценке другими методами |
Разрыв аневризмы | Нарушение целостности стенок аневризмы с развитием сбросовых потоков крови через возникшие дефекты |
Стенокардия | Боль, связанная с острым снижением коронарного кровотока и возникающая за грудиной или в областях иррадиации |
Аритмия | Развитие частых единичных и групповых предсердных и желудочковых экстрасистолий в течение 30 суток после процедуры, требующих лекарственной или электроимпульсной терапии |
Ателектаз/пневмония | Ателектаз или пневмония, подтвержденные исследованием с помощью рентгена, в течение 30 суток после процедуры и требующие лечения антибиотиками, ингаляциями, интубацией или отсасыванием. Следует зафиксировать вид необходимого лечения |
Несостоятельность крепления (Тип I утечки) | Сбросовый поток крови, возникающий в любое время после эндоваскулярной операции и диагностированный визуально хирургом во время операции (в том числе аутопсии) или методами неинвазивной диагностики (КТ с контрастированием, ультразвуком и ангиографией) |
Поток через боковые ответвления (Тип II утечки) | Ретроградный поток из просвета боковых артерий, например поясничной или межреберной, возникший в любое время после эндоваскулярной операции, определенный КТ-сканированием с контрастом, ультразвуком, ангиографией или прямым наблюдением при хирургической операции или аутопсии |
Окклюзия боковых ответвлений | Клинически значимое, незапланированное исключение основных боковых ответвлений |
Коагулопатия | Развитие неконтролируемого кровотечения, зафиксированное соответствующими лабораторными исследованиями в течение 30 суток после процедуры. Необходимо также фиксировать наличие специфических синдромов и лабораторных показателей крови |
Острая сердечная недостаточность | Развитие приступа острого снижения сердечного выброса или внезапное усугубление хронически сниженного сердечного выброса с развитием отека легких и дистальными отеками. Следует зафиксировать начало, вид лечения, продолжительность и эффективность |
Повреждение имплантата | Повреждение имплантата, вызванное вспомогательным оборудованием или системой доставки |
Отказ системы раскрытия | Невозможность раскрытия имплантата в предполагаемой области, связанная с механическим сбоем или анатомией пациента. Должны быть зафиксированы время, место и причина нераскрытия |
Инфицирование имплантата | Развитие инфекции на имплантате. Если подтверждено, то необходимо установить этиологию (т.е. стерильность устройства, эндокардиты и т.д.) |
Тромбоз имплантата | Гемодинамически значимое отложение тромбов в просвете эндоваскулярного имплантата. Необходимо оценить степень сужения |
Эмболизация | Перемещение в просвете сосудов инородных веществ, сопровождаемое клиническими проявлениями. Это категория, подлежащая регистрации, может охватывать диагностические и лечебные мероприятия, зафиксированные в других категориях |
Утечка | Наличие тока крови за пределами просвета эндоваскулярного протеза, но в пределах аневризматического мешка или прилегающего сегмента сосуда, к которому фиксирован графт. Утечки можно разделить на категории следующим образом: |
Расширения/разрыв графта | Расширение графта, превышающее 50% его диаметра, заявленного изготовителем, или любой другой разрыв графта |
Гематома | Развитие гематом, связанное с эндоваскулярными процедурами, требующее хирургического вмешательства, откачки и/или переливания. Если пациенту требуется переливание, необходимо зафиксировать объем замещенной крови. Если требуется хирургическое вмешательство, это также должно быть зафиксировано |
Печеночная энцефалопатия | Неврологические нарушения, связанные с неадекватным метаболизмом печени |
Гипотензия | Низкое кровяное давление |
Импотенция | Субъективные заявления о невозможности вернуться к уровню сексуальной активности, зафиксированной до операции, в течение шести месяцев после процедуры |
Ишемия | Развитие клинической картины острой или хронической ишемии в течение 30 суток после процедуры. Причина ишемии должна быть определена и зафиксирована (т.е. эмболизация, тромбоз или расслоение). Определяют тяжесть и лечение |
Обструкция просвета | Непредусмотренная обструкция потока через просвет сосуда из-за перегиба или перекручивания протеза, неправильного размера, нарушения полного открытия имплантата или другой причины |
Кистозная лимфангиома/ | Кистозное накопление лимфы или нарушение дренирования раны, возникающее в области разреза. Любые вмешательства с целью улучшения дренирования раны |
Инфаркт миокарда | Инфаркт миокарда, подтвержденный клинически, электрокардиографически и по содержанию ферментов в крови в течение 30 суток после процедуры. Необходимо зафиксировать клинические симптомы и данные ЭКГ |
Неврологические расстройства | Развитие преходящих или постоянных неврологических расстройств, возникающих и фиксируемых в течение 30 суток после процедуры. Нарушения диагностируют сканированием КТ и МРТ на фоне клинических проявлений |
Послеоперационное кровотечение | Кровотечение, связанное с хирургическим вмешательством, возникшее после вывоза больного из операционной и требующее переливания крови. Необходимо зафиксировать объем замещенной крови, источник кровотечения и потребность в хирургическом вмешательстве для остановки кровотечения |
Операционное кровотечение | Любая потери крови, связанная с хирургическим вмешательством. Необходимо определить объем кровопотери во время процедуры на основании отчета об операции. Необходимо зафиксировать необходимость переливания и источник (банк крови, аутологическая или аутотрансфузионная) переливаемой крови |
Смещение протеза | Продольное перемещение всего стента или его части или системы крепления на расстояние более 1 см относительно анатомических ориентиров, которые были определены до высвобождения стента |
Переориентация протеза | Клинические симптомы, связанные со смещением аорты относительно имплантата в результате морфологических изменений после имплантации. Клинические симптомы должны быть определены |
Легочная эмболия | Клинические свидетельства легочной эмболии, подтвержденные ВП сканированием или ангиографией, возникшие в течение 30 суток после процедуры |
Рецидив портальной гипертензии | Повторное появление высокого кровяного давления в системе портальных вен |
Отказ почек | Повышение уровня креатинина более чем на 50% выше дооперационного значения и верхней границы нормы, не восстанавливающееся самостоятельно. Необходимо также зафиксировать необходимость и продолжительность диализа |
Отказ легких | Необходимость искусственной вентиляции через сутки после процедуры и необходимость повторной интубации с искусственной вентиляцией легких в любое время от первых суток до 30 суток после операции (за исключением пациентов, зависимых от искусственной вентиляции легких, при включении в исследование). Необходимо зафиксировать продолжительность искусственной вентиляции легких |
Рестеноз | Снижение диаметра относительно эталонного диаметра |
Спинномозговые неврологические расстройства | Неврологические расстройства, связанные с ишемией спинного мозга, развившиеся в течение 30 суток после процедуры |
Разрушение стента/системы крепления | Разрушение любой части стента или системы крепления, включая разлом металла или разрушение любых шовных материалов, используемых для формирования стента или крепления стента или системы крепления к материалу графта |
Утечка через графт (Тип IV утечки) | Зафиксированная утечка крови через стенку графта |
Повреждение прилежащих структур | Повреждение прилежащих структур, связанное с травмой сосуда (см. определение ниже) |
Травма сосуда | Повреждение сосудов в результате эндоваскулярных процедур, включая отсечение или перфорацию, ложные и истинные аневризмы. Определенное место или источник повреждения, а также клинические осложнения должны быть зафиксированы. Необходимо также зафиксировать все необходимые хирургические или иные вмешательства, необходимые для восстановления повреждения |
Приложение D
(справочное)
Методы испытания
D.1 Общие положения
Информация, содержащаяся в настоящем приложении, предназначена в качестве руководства по доклиническим испытаниям in vitro, выполняемым для верификации конструкции эндоваскулярной системы, и в качестве рекомендаций по оформлению отчета. Общепризнано, что испытания, предназначенные для проверки того, что устройство соответствует требованиям настоящего стандарта при производстве, могут не соответствовать в полной мере деталям, приведенным в настоящем приложении.
Целью настоящего приложения является определение назначения и основных параметров испытаний, приведенных в тексте данного международного стандарта. Для обеспечения согласованности при испытании устройств и при разработке методик испытаний, требуемых настоящим стандартом, рекомендуется использовать настоящее приложение. Если разработанные методы не согласуются с руководствами, приведенными в настоящем приложении, различия должны быть обоснованы.
В ряде случаев в настоящем приложении один или более методов испытаний, указанных в тексте настоящего стандарта, объединены в один метод. Во время разработки данных методов испытания было установлено, что они должны быть объединены для отражения способа, которым обычно проводятся данные испытания. Также было установлено, что дополнительные методы могут быть объединены, если проводятся испытания специфичных устройств. Для испытаний, проводимых одновременно, отчет должен включать отдельные результаты испытания для каждого испытания, перечисленного в тексте настоящего стандарта.
Методы оценки свободной площади поверхности стента не включены в настоящее приложение. Во время разработки методов испытания было установлено, что данный метод обычно не применяется к эндоваскулярным протезам.
Методы, включенные в настоящее приложение, сгруппированы следующим образом:
- D.5.1 Испытание эндоваскулярной системы: размеры (D.5.1.1 и D.5.1.2); моделирование работы (D.5.1.3-D.5.1.5); прочность (D.5.1.6);
- D.5.2 Испытание системы доставки: время наполнения и спуска баллона; прочность (D.5.2.2-D.5.2.7);
- D.5.3 Имплантат (эндоваскулярный протез): размеры (D.5.3.1-D.5.3.4); проницаемость (D.5.3.5-D.5.3.7); прочность (D.5.3.8-D.5.3.17); стабильность (D.5.3.18-D.5.3.20).
D.2 Отбор образцов
Следует руководствоваться планом отбора образцов, гарантирующим, что для каждого измеряемого параметра будет получена корректная выборка данных. Конструктивные характеристики материала графта, стента, системы крепления, эндоваскулярного протеза, системы доставки должны быть проверены на предмет того, что они являются характерными для устройств, включенных в распределение, учитывая все размеры, конфигурации и компоненты.
Выборка должна представлять весь диапазон размеров устройства и не требует обязательного испытания каждого типоразмера. Надлежит приводить обоснование отбора образцов. Может потребоваться проведение анализа для идентификации размера(ов) устройств с наибольшей вероятностью отказа.
Выборка должна обеспечивать корректное представление ожидаемой вариабельности при изготовлении устройства.
Для испытаний с определенными параметрами достоверности и надежности объем выборки должен иметь статистическое обоснование. Для всех испытаний число образцов должно быть обосновано.
Дополнительные рекомендации по отбору образцов включены в каждый метод испытания, если это необходимо.
D.3 Воздействие определенных условий на испытательные образцы
Все образцы должны быть подвергнуты стерилизации, включая многократную стерилизацию при возможности, если не приведено обоснование использования нестерилизованных изделий.
Образцы должны быть подвергнуты условиям, которые встречаются при нормальном использовании и могут повлиять на результаты испытания. Воздействие условий может включать загрузку эндоваскулярного протеза на или в катетер для доставки, предварительное воздействие условий на эндоваскулярную систему в соответствии с рекомендациями в инструкции по применению.
Если необходимо, следует использовать искусственную физиологическую среду (например, водяную баню с температурным контролем).
D.4 Содержание отчета
В рамках настоящего приложения создание отчета связано с требованиями национальных контролирующих органов.
Отчет по испытаниям для доклинических испытаний in vitro должен включать протокол о выполнении всех испытаний. Этот отчет должен включать описание испытаний с обоснованием пропуска любого испытания, определенного в приложении В, или выбора альтернативных испытаний. Информация, представляемая в каждом отчете по испытаниям, должна быть основана на заранее разработанной форме протокола испытания.
Должна быть включена сводка результатов с критериями приемки и любыми вероятными клиническими значениями результатов; сводка может быть представлена в виде таблицы. При определении критериев приемки следует учитывать анатомические, физиологические и морфологические условия предполагаемого использования. Должны быть приведены обоснование и клиническая применимость критериев приемки для каждого испытания. Отчет должен содержать оглавление; страницы должны быть последовательно пронумерованы.
Отдельный отчет по испытанию должен включать следующую информацию:
a) цель: определение цели испытания в соответствии с настоящим стандартом;
b) материалы: перечень всех материалов, образцов и оборудования, использованных при проведении испытания, с применением рисунков и схем, если необходимо;
c) отбор образцов: определение плана отбора образцов, включая обоснование выбора и количества испытуемых образцов (выбор стендовых образцов может быть обоснован, например, размерами, состоянием и пр.);
d) критерии приемки: определение критериев приемки результатов испытания;
e) метод испытания: подробное описание метода испытания, используемого при проведении испытания, включая любые предварительно определенные процедуры; обоснование критических параметров испытания;
f) отклонения от протокола: описание любых отклонений и их вероятная значимость при интерпретации результатов;
g) представление результатов: описание результатов испытания, выраженных в единицах, получаемых при данном методе испытания;
h) заключение: заключение, основанное на сравнении результатов с критериями приемки, учитывая любую вероятную клиническую значимость этих результатов.
D.5 Методы испытания
Примечание 1 - Уровни допусков и точности, предписанные в изложенных ниже методах, установлены как номинальные приемлемые уровни. В зависимости от нормативных уровней для испытуемой конструкции может потребоваться оборудование с меньшим допуском или более высоким уровнем точности.
Примечание 2 - В контексте настоящего приложения глагольная форма "должен" применяется в требованиях, которые следует строго выполнять при проведении рекомендуемого метода испытания.
D.5.1 Эндоваскулярная система
D.5.1.1 Проверка размеров и совместимости компонентов по размерам
D.5.1.1.1 Цель
Целью данного испытания является определение размеров эндоваскулярной системы, включая внешний диаметр, диаметр просвета проволочного проводника и его полезную длину (но не ограничиваясь этим) для верификации спецификации конструкции и для оценки совместимости по размерам между эндоваскулярной системой и рекомендуемыми вспомогательными устройствами, перечисленными в инструкции по применению (ИПП) изделия. Соответствующие части ИСО 25539-1 по оценке конструкции включают положения 7.2.1, 7.2.2, 7.2.3.
D.5.1.1.2 Материалы
D.5.1.1.2.1 Эндоваскулярная система.
D.5.1.1.2.2 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с ИПП.
D.5.1.1.2.3 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью ±0,1 мм, или соответствующие калибры профиля, выполненные с точностью ±0,1 мм.
D.5.1.1.2.4 Оборудование для измерения длины, способное выполнять измерения с точностью ±1 мм.
D.5.1.1.2.5 Проволочный сердечник/концевой калибр (для измерения внутреннего просвета системы доставки), выполненный с точностью ±0,3 мм.
D.5.1.1.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.1.1.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.1.1.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) вставляют соответствующий проволочный проводник или соответствующий по размеру сердечник в просвет эндоваскулярной системы для проверки диаметра просвета и совместимости проволочного проводника;
b) измеряют максимальный внешний диаметр эндоваскулярной системы, используя соответствующие измерительные инструменты, или удостоверяются в том, что внешний диаметр соответствует калибру профиля соответствующего размера, - необходимо измерить только ту область эндоваскулярной системы, которая должна проходить через определенный диаметр оболочки интродьюсера;
c) измеряют длину эндоваскулярной системы, используя соответствующие измерительные инструменты, - необходимо измерить только ту область эндоваскулярной системы, которая должна проходить через определенный диаметр оболочки интродьюсера;
d) измеряют все другие необходимые размеры;
e) проверяют совместимость со всеми типами рекомендуемых вспомогательных компонентов.
D.5.1.1.6 Представление результатов
Длина должна быть выражена в сантиметрах (см). Другие размеры должны быть выражены в миллиметрах (мм). Должны быть зафиксированы результаты, касающиеся совместимости рекомендуемых вспомогательных устройств, и результаты проверки диаметра просвета и внешнего диаметра, если применимо.
D.5.1.1.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4. Отчет по испытанию должен включать максимум, минимум, среднее и стандартное отклонения всех измеренных значений, результаты любых проверок размеров и результаты оценки совместимости вспомогательных устройств.
Примечание - Для дополнительного руководства см. ASTM F2081-01[28].
D.5.1.2 Испытание профиля/диаметра
D.5.1.2.1 Цель
Целью данного испытания является определение максимального диаметра всех частей эндоваскулярной системы для оценки совместимости по размерам между эндоваскулярной системой и сосудами, включая непосредственно покрываемую изделием область сосудистого повреждения (см. соответствующие положения раздела 7.2.1).
D.5.1.2.2 Материалы
D.5.1.2.2.1 Эндоваскулярная система.
D.5.1.2.2.2 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью ±0,1 мм, или соответствующие калибры профиля, выполненные с точностью ±0,1 мм.
D.5.1.2.2.3 Рекомендуемый проволочный проводник или его эквивалент, если применимо.
D.5.1.2.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.1.2.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.1.2.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) Если применимо, вставляют соответствующий проволочный проводник в эндоваскулярную систему так, чтобы он выходил за окончание эндоваскулярной системы;
b) измеряют максимальный внешний диаметр эндоваскулярной системы; следует обратить внимание на возможность асимметрии, - необходимо измерить область, которая должна проходить по сосуду и/или через область повреждения, и область, содержащую имплантат.
D.5.1.2.6 Представление результатов
Измеренные диаметры должны быть выражены в миллиметрах (мм).
D.5.1.2.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и должен включать максимум, минимум, среднее и стандартное отклонения измеренного внешнего диаметра эндоваскулярной системы и диаметра области, содержащей имплантат каждого испытуемого размера.
Примечание - Для дополнительного руководства см. ASTM F2081-01[28].
D.5.1.3 Оценка гемостаза
D.5.1.3.1 Цель
Целью данного испытания является оценка способности любого вида изоляции или клапанов системы поддерживать адекватную гемостатическую изоляцию (см. соответствующие положения раздела 7.2.5).
D.5.1.3.2 Материалы
D.5.1.3.2.1 Эндоваскулярная система.
D.5.1.3.2.2 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с инструкцией по применению.
D.5.1.3.2.3 Модель, представляющая "наихудший случай" условий для утечки (например, при введении, прохождении участков извилистости, при удалении). Может потребоваться использование соответствующей анатомической модели, описанной в D.5.1.4.
D.5.1.3.2.4 Контур с возможностью подачи воды под давлением, способный подавать воду или соответствующую жидкость при физиологической температуре (37±2) °С с соответствующим давлением (например, 100 мм рт.ст.).
D.5.1.3.2.5 Средства сбора и измерения общей утечки воды из эндоваскулярной системы с точностью оценки ±5% общей утечки.
D.5.1.3.2.6 Таймер с точностью ±1 с.
D.5.1.3.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.1.3.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиями D.3.
D.5.1.3.5 Метод испытания
Должен быть разработан метод испытания на основе следующих действий:
a) подсоединяют модель к контуру с водой;
b) помещают резервуар(ы) в место(а) сбора утечки воды;
c) вставляют соответствующее вспомогательное оборудование (например, проволочный проводник, тело интродьюсера) в контур и запускают таймер;
d) используя ИПП, выполняют этапы раскрытия, включая все модульные компоненты; вводят, доставляют и раскрывают имплантат в контуре или модели;
e) воздействие воды под давлением должно представлять предполагаемые клинические условия, моделирующие потерю крови во время введения, раскрытия и удаления в клинических условиях;
f) удаляют систему доставки и останавливают таймер;
g) измеряют и записывают значение утечки воды и время, в течение которого произошла утечка; не следует учитывать утечку между моделью и телом интродьюсера.
D.5.1.3.6 Представление результатов
Описывают все критические случаи наблюдения. Утечка должна быть выражена в миллиметрах в минуту (мм/мин). Должны быть зафиксированы результаты, касающиеся совместимости рекомендуемых вспомогательных устройств, и результаты измерения диаметра просвета и внешнего диаметра, если применимо.
D.5.1.3.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения всех скоростей утечки. Должна быть определена испытательная жидкость с указанием плотности и/или вязкости. При интерпретации результатов следует учитывать типичное время воздействия давления в клинических условиях. Должны быть зафиксированы любые критические случаи наблюдения.
D.5.1.4 Модели для моделирования использования
D.5.1.4.1 Цель
Целью данного испытания является оценка рабочих характеристик эндоваскулярной системы, используя модель(и), которая(ые) моделирует(ют) условия предполагаемого использования. Испытание касается требований к качественной оценке моделирования использования, перегиба/перекручивания, возможности проталкивания и кручения эндоваскулярной системы. Также должна быть оценена совместимость раскрытого протеза со стенками сосуда (см. соответствующие положения 7.2.1, 7.2.2, 7.2.3, 7.3.1, 7.3.2).
D.5.1.4.2 Материалы
D.5.1.4.2.1 Эндоваскулярная система.
D.5.1.4.2.2 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с инструкцией по применению.
D.5.1.4.2.3 Анатомическая модель, которая включает пути доставки и место раскрытия. При разработке модели необходимо учитывать искривленность и извитость предполагаемой области размещения имплантата и путей доставки.
D.5.1.4.2.4 Контур с возможностью подачи воды под давлением, способный подавать воду или соответствующую жидкость при физиологической температуре (37±2) °С с пульсирующим давлением, с антеградным или ретроградным потоком, если применимо.
D.5.1.4.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.1.4.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.1.4.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) подсоединяют анатомическую модель к контуру с водой и позволяют испытательной системе стабилизировать температуру и давление;
b) вставляют соответствующие вспомогательные устройства (например, проволочный проводник, тело интродьюсера) в контур;
c) используя ИПП, выполняют этапы раскрытия, включая все модульные компоненты; вводят, доставляют и раскрывают имплантат в модели и удаляют систему доставки;
d) оценивают легкость продвижения системы доставки в модели (возможность проталкивания), возможность передачи поворота с проксимального конца на дистальный конец катетера (возможность поворота) и возможность системы доставки следовать по проволочному проводнику во время прохождения области изгибов модели (возможность следования);
е) отмечают любые отклонения от нормы, такие как перекручивание или перегиб системы, невозможность полного и точного раскрытия имплантата, смещение имплантата во время удаления системы доставки и любые другие соответствующие наблюдения;
f) осматривают раскрытый эндоваскулярный протез в анатомической модели; отмечают соответствие стенкам сосуда модели, точность размещения, перекручивание, перегиб, искривления, отделение компонентов, любые повреждения и любые другие критические наблюдения;
g) осматривают систему доставки, отмечают любые повреждения и другие критические наблюдения.
D.5.1.4.6 Представление результатов
Для каждого испытания должны быть зафиксированы все критические случаи наблюдения и параметры возможности доступа, раскрытия и удаления эндоваскулярной системы.
D.5.1.4.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать все критические наблюдения и параметры возможности доступа, раскрытия и удаления эндоваскулярной системы. Должна быть определена испытательная жидкость с указанием плотности и/или вязкости. Должны быть отдельно зафиксированы результаты для перегиба/перекручивания, возможности проталкивания, возможности кручения и возможности следования эндоваскулярной системы, а также соответствие имплантата стенкам сосуда. Отчет должен включать описание используемой анатомической модели, с учетом геометрии и материалов конструкции.
D.5.1.5 Визуализация
D.5.1.5.1 Цель
Целью данного испытания является оценка возможности визуализации эндоваскулярной системы и/или эндоваскулярного протеза, используя методы получения изображения, определенные в ИПП (см. соответствующие положения 7.2.1, 7.2.2, 7.2.3, 7.3.1).
D.5.1.5.2 Материалы
D.5.1.5.2.1 Эндоваскулярная система.
D.5.1.5.2.2 Радиологический фантом как метод моделирования живых тканей или эквивалент с соответствующими вспомогательными устройствами, такими как радиоизотопные маркеры и линейка.
D.5.1.5.2.3 Рентгеновская установка/установка для флюорографии, способная работать на уровнях энергии, допускающих клиническое использование.
Примечание - Визуализация существенно зависит от вида оборудования и параметров настройки. При выборе оборудования для данной оценки следует учитывать эту вариабельность.
D.5.1.5.2.4 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с ИПП.
D.5.1.5.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.1.5.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.1.5.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) располагают эндоваскулярную систему и фантом модели ткани таким образом, чтобы моделировать клинические условия;
b) используют рентген/флюорографию для визуализации эндоваскулярной системы и любых радиоизотопных маркеров;
c) качественно оценивают уровень видимости рентгеновского/флюорографического изображения; например, степень видимости можно оценить по расположению четких концов, ориентации критических точек и/или частей эндоваскулярной системы, альтернативно степень видимости можно сравнить с определенным контрольным устройством;
d) повторяют этапы а)-с) для протеза во время раскрытия и после удаления системы доставки.
D.5.1.5.6 Представление результатов
Это качественная оценка. Следует зафиксировать степень различимости всех используемых компонентов на различных этапах испытания и любые сравнения, проведенные при определенном контроле.
D.5.1.5.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать оценку видимости и визуальные результаты (например, характерные флюорографические изображения). Отчет по испытаниям должен также включать модель оборудования для визуализации, параметры настроек и подробное описание модельного фантома ткани.
D.5.1.6 Сила раскрытия
D.5.1.6.1 Цель
Целью данного испытания является определение усилия, необходимого для раскрытия эндоваскулярного протеза. Должны быть оценены все применимые этапы процесса раскрытия (см. соответствующие положения раздела 7.2.2).
D.5.1.6.2 Материалы
D.5.1.6.2.1 Эндоваскулярная система.
D.5.1.6.2.2 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с ИПП.
D.5.1.6.2.3 Анатомическая модель, которая включает пути доставки и место раскрытия. При разработке модели необходимо учитывать искривленность и извитость предполагаемой области размещения имплантата и путей доставки.
D.5.1.6.2.4 Механические устройства для измерения усилия (например, датчики силы, универсальная механическая испытательная система), способные измерять силу с точностью ±5% зафиксированного значения.
D.5.1.6.2.5 Зажимной фиксатор
D.5.1.6.2.6 Среда с контролируемой температурой (37±2) °С.
D.5.1.6.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2. Испытуемые устройства должны представлять "наихудший случай" условий для силы раскрытия (например, наибольший объем корпуса или оболочки, максимальное значение сжатия). При выборе устройства для испытания следует учитывать влияние диаметра и длины устройства.
D.5.1.6.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.1.6.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) подготавливают эндоваскулярную систему в соответствии с ИПП;
b) вставляют эндоваскулярную систему в анатомическую модель;
c) размещают эндоваскулярную систему таким образом, чтобы она оставалась стационарной во время испытания;
d) соединяют механизм раскрытия с оборудованием, измеряющим нагрузку;
e) дают устройству стабилизироваться при физиологических температурах;
f) начинают и завершают раскрытие в соответствии с ИПП со скоростью, моделирующей клиническое использование, измеряя силу, необходимую для раскрытия имплантата;
g) отмечают любые случаи наблюдения, отличающиеся от нормы (например, образование перегиба) для каждого испытуемого образца.
D.5.1.6.6 Представление результатов
Для каждого испытуемого образца должно быть зафиксировано в ньютонах (Н) максимальное усилие на каждом этапе, необходимое для раскрытия имплантата. Также должны быть отмечены все критические случаи наблюдения (например, образование перегиба) для каждого испытуемого образца.
D.5.1.6.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения величины усилия, необходимого для раскрытия, и любые критические случаи наблюдения.
D.5.2 Система доставки
D.5.2.1 Время наполнения и спуска баллона (изделия, раскрываемые баллоном или с помощью баллона)
D.5.2.1.1 Цель
Целью данного испытания является определение времени, необходимого для наполнения баллона до максимального рекомендуемого давления, объема или диаметра наполнения, и измерение времени, необходимого для спуска баллона. Это испытание предоставляет информацию, которая может быть клинически полезной при планировании лечения (например, вероятное время окклюзии). См. соответствующие положения 7.2.2.
D.5.2.1.2 Материалы
D.5.2.1.2.1 Система доставки или соответствующая досборка баллона.
D.5.2.1.2.2 Рекомендуемый проволочный проводник или эквивалент.
D.5.2.1.2.3 Водяная баня с контролем температуры (37±2) °С.
D.5.2.1.2.4 Контрастная среда в соответствии с инструкцией по эксплуатации (ИПЭ).
D.5.2.1.2.5 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления или объема с точностью ±5% зафиксированного значения и поддержания давления или объема наполнения.
D.5.2.1.2.6 Жесткая трубка, диаметр которой соответствует максимальному диаметру протеза или сосуда, рекомендуемому для соответствующего испытуемого баллона.
D.5.2.1.2.7 Таймер с точностью ±0,2 с.
D.5.2.1.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.2.1.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.2.1.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) вставляют соответствующий проволочный проводник в устройство;
b) погружают устройство в водяную баню и вставляют в жесткую трубку, если применимо;
c) дают ему достичь равновесия при температуре испытания;
d) наполняют баллон в соответствии с ИПП, моделируя клиническое использование;
е) определяют время наполнения баллона до максимального давления, объема или диаметра наполнения в соответствии с ИПП;
f) спускают баллон в соответствии с ИПП и определяют время спуска баллона.
D.5.2.1.6 Представление результатов
Время наполнения и спуска баллона должно быть выражены в секундах.
D.5.2.1.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения времени наполнения и спуска баллона. Также необходимо зафиксировать определение конечных точек наполнения и спуска.
D.5.2.2 Номинальное давление разрыва баллона для недеформируемых баллонов (изделия, раскрываемые баллоном или с помощью баллона)
D.5.2.2.1 Цель
Целью данного испытания является определение номинального давления разрыва баллона, которое определяется на основании давления разрыва, измеренного при испытаниях, и вычисления соответствующего коэффициента запаса с использованием среднего и стандартного отклонений (см. соответствующие положения 7.2.2).
D.5.2.2.2 Материалы
D.5.2.2.2.1 Система доставки или соответствующая досборка баллона.
D.5.2.2.2.2 Водяная баня с контролем температуры (37±2) °С.
D.5.2.2.2.3 Жидкость для наполнения (например, вода комнатной температуры).
D.5.2.2.2.4 Механизм определения утечки (например, краска в жидкости для испытания, устройство, контролирующее падение давления, устройство, контролирующее скорость потока).
D.5.2.2.2.5 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления или объема с точностью ± 5% зафиксированного значения и поддержания давления или объема наполнения.
D.5.2.2.2.6 Таймер с точностью ±1 с.
D.5.2.2.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.2.2.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.2.2.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) погружают устройство в водяную баню;
b) дают устройству достичь равновесия при температуре испытания;
c) наполняют баллон до значения менее, чем оцененное номинальное давление разрыва; выдерживают давление наполнения постоянным в течение 30 с и осматривают баллон на предмет утечек или разрыва;
d) если не отмечено утечек, увеличивают давление на шаг увеличения, соответствующий испытуемому баллону, и выдерживают давление в течение 30 с;
e) повторяют этап d), пока не возникнет утечка или разрыв баллона [любая "упорная" утечка или снижение давления, связанные с повреждением баллона, корпуса, проксимальной или дистальной изоляции, в рамках данного испытания считаются отказом ("разрывом")]; фиксируют давление разрыва и описывают положение и вид отказа (например, утечка через изоляцию, разрыв баллона, разделение на части).
D.5.2.2.6 Представление результатов
Давление разрыва должно быть выражено в килопаскалях (кПа). Вычисляют среднее и стандартное отклонения давления разрыва. Для определения номинального давления разрыва необходимо использовать соответствующие параметры достоверности и надежности.
D.5.2.2.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать среднее давление разрыва, вычисленное номинальное давление разрыва, максимум, минимум и стандартное отклонение давления разрыва и все наблюдаемые виды отказа.
D.5.2.3 Объем разрыва баллона для деформируемых баллонов (изделия, раскрываемые баллоном или с помощью баллона)
D.5.2.3.1 Цель
Целью данного испытания является определение объема, требуемого для разрыва недеформируемого баллона, и вычисление соответствующего коэффициента безопасности объема наполнения (см. соответствующие положения 7.2.2).
D.5.2.3.2 Материалы
D.5.2.3.2.1 Система доставки или соответствующая досборка баллона.
D.5.2.3.2.2 Водяная баня с контролем температуры (37±2) °С.
D.5.2.3.2.3 Жидкость для наполнения (например, вода комнатной температуры).
D.5.2.3.2.4 Механизм определения утечки (например, краска в жидкости для испытания, устройство, контролирующее падение давления, устройство, контролирующее скорость потока).
D.5.2.3.2.5 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения объема с точностью ±5% зафиксированного значения и поддержания объема наполнения.
D.5.2.3.2.6 Жесткая трубка, диаметр которой соответствует диаметру протеза или сосуда, рекомендуемым для соответствующего испытуемого баллона.
D.5.2.3.2.7 Таймер с точностью ±1 с.
D.5.2.3.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.2.3.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.2.3.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) погружают устройство в водяную баню и вставляют в жесткую трубку;
b) дают устройству достичь равновесия при температуре испытания;
c) используя скорость наполнения, моделирующую клиническое использование, наполняют баллон до диаметра трубки и выдерживают диаметр в течение 30 с; отмечают объем ;
d) если не отмечено утечек, увеличивают объем на шаг увеличения, соответствующий испытуемому баллону, и выдерживают давление в течение 30 с;
e) повторяют этап d) до тех пор, пока не возникнет утечка или разрыв баллона [любая "упорная" утечка или снижение давления, связанные с повреждением баллона, корпуса, проксимальной или дистальной изоляции, в рамках данного испытания считаются отказом ("разрывом")]; фиксируют объем разрыва и вид отказа (например, утечка через изоляцию, разрыв баллона, разделение на части);
f) вычисляют коэффициент безопасности следующим образом: ![]() .
.
D.5.2.3.6 Представление результатов
Объем должен быть выражен в миллилитрах (мл). Коэффициент безопасности выражают в безразмерном виде.
D.5.2.3.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения объема при необходимом диаметре, объем при отказе и коэффициент безопасности. Также необходимо включить наблюдаемые виды отказа.
D.5.2.4 Номинальный износ баллона (изделия, раскрываемые баллоном или с помощью баллона)
D.5.2.4.1 Цель
Целью данного испытания является оценка способности баллона выдерживать повторяющиеся циклы наполнения (см. соответствующие положения 7.2.2).
D.5.2.4.2 Материалы
D.5.2.4.2.1 Система доставки или соответствующая досборка баллона.
D.5.2.4.2.2 Водяная баня с контролем температуры (37±2) °С.
D.5.2.4.2.3 Жидкость для наполнения (например, вода комнатной температуры).
D.5.2.4.2.4 Механизм определения утечки (например, краска в жидкости для испытания, устройство, контролирующее падение давления, устройство, контролирующее скорость потока).
D.5.2.4.2.5 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления или объема с точностью ±5% зафиксированного значения, способное поддерживать давление или объем наполнения.
D.5.2.4.2.6 Жесткая трубка, диаметр которой соответствует максимальному диаметру протеза или сосуда, рекомендуемому для соответствующего испытуемого баллона. Для испытания недеформируемых протезов трубка не требуется.
D.5.2.4.2.7 Таймер с точностью ±1 с.
D.5.2.4.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.2.4.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.2.4.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) погружают устройство в водяную баню и вставляют в жесткую трубку, если применимо;
b) дают устройству достичь равновесия при температуре испытания;
c) используя скорость наполнения, соответствующую клиническому использованию, наполняют баллон до максимального давления, объема или диаметра, как указано в ИПП, как минимум, на 30 с или время, установленное в ИПП.
Примечание - Если в ИПП установлен более длительный промежуток времени, чем 30 с, для испытания следует использовать определенный промежуток времени, если не приведено адекватное обоснование меньшей продолжительности;
d) спускают баллон со скоростью, соответствующей клиническому использованию;
e) повторяют этапы с) и d) такое число циклов, которое необходимо для установления соответствующего коэффициента безопасности (например, как минимум, в два раза больше максимального числа циклов, ожидаемого при клиническом использовании);
f) если во время испытания возникает постоянная утечка или падение давления или объема, записывают число циклов и вид отказа; любая подобная утечка или падение давления, связанные с отказом баллона, повреждением корпуса, проксимальной или дистальной изоляции, в рамках данного испытания считаются отказом.
D.5.2.4.6 Представление результатов
Использованные максимальный диаметр, давление или объем наполнения должны быть выражены: диаметр в миллиметрах (мм), давление в килопаскалях (кПа) или миллиметрах ртутного столба (мм рт.ст.) и объем в миллилитрах (мл).
D.5.2.4.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать число успешно завершенных циклов, максимальное число циклов, ожидаемое при клиническом использовании, полученный коэффициент безопасности, любые наблюдаемые виды отказа и максимальный диаметр, давление или объем наполнения.
D.5.2.5 Прочность соединения
D.5.2.5.1 Цель
Целью данного испытания является определение прочности соединения шарнирных и/или неподвижных соединений системы доставки (см. соответствующие положения 7.2.1, 7.2.2, 7.2.3).
D.5.2.5.2 Материалы
D.5.2.5.2.1 Система доставки или соответствующие компоненты с шарнирными и/или неподвижными соединениями.
D.5.2.5.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять силу с точностью ±5% зафиксированного значения, с постоянной скоростью смещения и соответствующими зажимными фиксаторами.
D.5.2.5.2.3 Среда с контролируемой температурой (37±2) °С, если применимо.
D.5.2.5.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.2.5.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.2.5.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
Примечание - Для соединений, которые подвергаются воздействию физиологических температур, испытания следует проводить при температуре (37±2) °С.
a) используя механическую испытательную систему с соответствующей скоростью смещения (например, 200 мм/мин), прикладывают нагрузку к соединению до тех пор, пока не разрушится соединение или не нарушится функциональная целостность;
b) записывают пиковое усилие, при котором произошел отказ, и описывают тип и положение отказа.
D.5.2.5.6 Представление результатов
Сила соединения должна быть выражена в ньютонах (Н).
D.5.2.5.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать тип и положение отказа, и максимум, минимум, среднее и стандартное отклонения силы соединения.
Примечание - Для дополнительного руководства см. ИСО 10555-1[9].
D.5.2.6 Прочность соединения при кручении
D.5.2.6.1 Цель
Целью данного испытания является определение крутящего момента, необходимого для того, чтобы вызвать отказ соединений компонентов системы доставки (см. соответствующие положения 7.2.1, 7.2.2, 7.2.3).
D.5.2.6.2 Материалы
D.5.2.6.2.1 Система доставки или соответствующие компоненты с шарнирными и/или неподвижными соединениями.
D.5.2.6.2.2 Рекомендуемый проволочный проводник или эквивалент, если применимо.
D.5.2.6.2.3 Испытательная система на кручение, оборудованная соответствующим датчиком, способным проводить измерения с точностью ±5% зафиксированного значения.
D.5.2.6.2.4 Среда с контролируемой температурой (37±2) °С, если применимо.
D.5.2.6.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.2.6.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.2.6.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
Примечание - Для соединений, которые подвергаются воздействию физиологических температур, испытания следует проводить при температуре (37±2) °С.
a) вставляют проволочный проводник в систему доставки или ее компоненты, если применимо;
b) фиксируют один конец испытуемого образца в зажимах аппарата;
c) подсоединяют другой конец испытуемого образца к датчику крутящего момента;
d) прикладывают силу скручивания с характеристиками скорости, используемыми при типичном клиническом раскрытии, к одному концу образца до тех пор, пока не разрушится соединение или не нарушится функциональная целостность;
e) записывают значение крутящего момента, при котором произошел отказ, и тип и положение отказа.
D.5.2.6.6 Представление результатов
Сила соединения на кручение должна быть выражена в ньютонах на метр (Нм).
D.5.2.6.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать тип и положение отказа и максимум, минимум, среднее и стандартное отклонения силы соединения на кручение.
D.5.2.7 Прочность трубок при растяжении
D.5.2.7.1 Цель
Целью данного испытания является определение силы растяжения трубок, используемых в системе доставки (см. соответствующие положения 7.2.2 и 7.2.3).
D.5.2.7.2 Материалы
D.5.2.7.2.1 Образцы для испытания на растяжение системы доставки.
D.5.2.7.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять силу с точностью ±5% зафиксированного значения, с постоянной скоростью смещения и соответствующими зажимными фиксаторами.
D.5.2.7.2.3 Среда с контролируемой температурой (37±2) °С, если применимо.
D.5.2.7.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.2.7.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.2.7.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) используя механическую испытательную систему с соответствующей скоростью смещения и датчиками удлинения (обычно скорость деформации от 5 до 20 мм/мин/мм), прикладывают растягивающее усилие до тех пор, пока не будет порван образец, не будет достигнут предел текучести (0,2% граница удлинения), не будет достигнуто избыточное растяжение или другие предопределенные условия отказа;
b) фиксируют значение приложенной силы на растяжение, при которой произошел отказ.
Примечание 1 - На рисунке D.1 показана остаточная деформация 0,2% на кривой напряженно-деформированного состояния.
Примечание 2 - Методы определения остаточной деформации 0,2% описаны в ASTM D638-03[25].
D.5.2.7.6 Представление результатов
Прочность трубок на разрыв при растяжении должна быть выражена в ньютонах (Н).
Примечание - В рамках данного испытания прочность трубок при растяжении выражают в единицах силы (Н), а не в единицах механического напряжения (МПа).
D.5.2.7.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать определение отказа и максимум, минимум, среднее и стандартное отклонения прочности трубок при растяжении.
- деформация, %
- механическое напряжение, МПа
Рисунок D.1 - Остаточная деформация 0,2% границы удлинения на кривой напряженно-деформированного состояния
D.5.3 Имплантат (эндоваскулярный протез)
D.5.3.1 Проверка размеров
D.5.3.1.1 Цель
Целью данного испытания является определение внешнего диаметра(ов), длин(ы) и, если применимо, толщины стенки(ок) эндоваскулярного протеза в раскрытом состоянии для верификации спецификации конструкции (см. соответствующие положения 7.3.6).
Примечание 1 - Для полной верификации размеров некоторых имплантатов могут потребоваться другие измерения.
Примечание 2 - Испытание не предназначено для оценки всей системы; тем не менее система потребуется для раскрытия испытуемого протеза.
D.5.3.1.2 Материалы
D.5.3.1.2.1 Эндоваскулярная система.
D.5.3.1.2.2 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр, калиброванный штангенциркуль), способное выполнять измерения с точностью ±0,1 мм.
D.5.3.1.2.3 Оборудование для измерения толщин(ы) стенок (например, микроскоп с калиброванным зрительным стеклом, толщиномер, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью ±5% зафиксированного значения.
D.5.3.1.2.4 Оборудование для измерения длины, способное выполнять измерения с точностью ±1 мм.
D.5.3.1.2.5 Среда с контролируемой температурой (37±2) °С для протезов, чувствительных к разнице физиологической температуры и температуры окружающей среды.
D.5.3.1.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.1.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку, выдержку при определенных условиях и раскрытие.
D.5.3.1.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) внешний диаметр(ы) должен быть измерен в нескольких областях после раскрытия в соответствии с инструкцией по эксплуатации;
b) для длин(ы) и толщин(ы) стенок испытания проводят в соответствии с ИСО 7198, подразделы 8.4 и 8.7 соответственно.
Примечание - Для некруглых частей допустимо измерять и записывать максимальное и минимальное значения.
D.5.3.1.6 Представление результатов
Диаметры и толщина(ы) стенок должны быть выражены в миллиметрах (мм). Длина должна быть выражена в миллиметрах (мм) или сантиметрах (см).
D.5.3.1.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения всех измеренных и вычисленных размеров.
Примечание - Для дополнительного руководства см. ASTM F2081-01[28].
D.5.3.2 Соотношение диаметра имплантата и давления наполнения баллона
D.5.3.2.1 Цель
Целью данного испытания является определение соотношения между диаметром протеза и давлением наполнения баллона для устройств, расширяемых баллоном. Испытание обеспечивает получение данных, которые могут иметь клиническое значение при определении размеров устройства и планировании лечения (см. соответствующие положения 7.3.6).
D.5.3.2.2 Материалы
D.5.3.2.2.1 Эндоваскулярный протез.
D.5.3.2.2.2 Баллон для расширения протеза.
D.5.3.2.2.3 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления с точностью ±5% зафиксированного значения, способное поддерживать давление наполнения.
D.5.3.2.2.4 Жидкость для наполнения (например, вода комнатной температуры).
D.5.3.2.2.5 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью ±0,1 мм.
D.5.3.2.2.6 Среда с контролируемой температурой (37±2) °С, если применимо.
D.5.3.2.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.2.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку и выдержку при определенных условиях.
D.5.3.2.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) начинают раскрытие протеза, чтобы сделать возможным расширение устройства;
b) располагают баллон внутри протеза;
c) ступенчато наполняют баллон, позволяя системе стабилизироваться между этапами наполнения; давления должны быть выбраны таким образом, чтобы определить диаметр протеза через соответствующие интервалы (например, 1 атмосферу или 1 бар) во всем указанном диапазоне диаметров;
d) определяют средний внешний диаметр протеза при давлении на каждом этапе в соответствующих областях по всей длине протеза; эти измерения должны быть проведены непосредственно после стабилизации (учитывая, что ортогональные проекции одной области могут показывать разные результаты);
e) наполнение останавливают, когда диаметр протеза достигнет максимального внешнего диаметра, указанного на этикетке.
Примечание - Испытание должно быть проведено быстро для минимизации влияния вязкоупругих свойств и для лучшего моделирования метода наполнения, используемого клинически.
D.5.3.2.6 Представление результатов
Диаметр протеза должен быть выражен в миллиметрах (мм), связанное давление в килопаскалях (кПа) и/или атмосферах (атм).
D.5.3.2.7 Отчет по испытанию
Отчет по испытанию должен соответствовать положениям D.4 и включать максимум, минимум, среднее и стандартное отклонения измерений диаметра эндоваскулярного протеза и соответственно значений давлений. Эти данные могут быть представлены в виде таблицы или графика.
D.5.3.3 Соотношение длины и диаметра имплантата
D.5.3.3.1 Цель
Целью данного испытания является определение соотношения между длиной эндоваскулярного протеза и диаметром эндоваскулярного протеза после раскрытия для того, чтобы оценить вероятность укорочения (см. соответствующие положения 7.3.1 и 7.3.6).
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система необходима для раскрытия испытуемого протеза.
D.5.3.3.2 Материалы
D.5.3.3.2.1 Эндоваскулярная система.
D.5.3.3.2.2 Измерительное оборудование для определения длины, способное выполнять измерения с точностью ±1 мм.
D.5.3.3.2.3 Чистая жесткая трубка, внутренний диаметр которой соответствует минимальному и максимальному диаметрам сосуда (см. инструкцию по применению).
D.5.3.3.2.4 Вспомогательные устройства, необходимые для помощи при раскрытии в соответствии с ИПП.
D.5.3.3.2.5 Среда с контролируемой температурой (37±2) °С для протезов, чувствительных к разнице физиологической температуры и температуры окружающей среды.
D.5.3.3.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.3.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.3.3.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
Примечание 1 - Для стентов, расширение которых с помощью баллона сопровождается существенной упругой отдачей, может оказаться сложным обеспечить соответствующее прилегание протеза к стенкам трубки. Может потребоваться применение/разработка альтернативной методики для корректной оценки свойств подобных устройств.
a) раскрывают протез в соответствии с ИПП в жесткой трубке, имеющей минимальный предполагаемый диаметр;
b) измеряют длину протеза в пределах трубки;
c) повторяют этапы а) и b) при максимальном предполагаемом диаметре.
Примечание 2 - Устройство может быть использовано повторно, если это применимо и обосновано.
Примечание 3 - На соотношение длины и диаметра имплантата могут влиять угловые искривления. Необходимо учитывать дополнительные испытания и анализы для оценки влияния угловых искривлений на данный параметр, если применимо.
D.5.3.3.6 Представление результатов
Длина протеза должна быть выражена в сантиметрах (см) или миллиметрах (мм), диаметр должен быть выражен в миллиметрах (мм).
D.5.3.3.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения длины устройства при каждом соответствующем диаметре. Эти данные должны быть представлены в виде таблицы.
D.5.3.4 Отдача (для устройств, расширяемых баллоном)
D.5.3.4.1 Цель
Целью данного испытания является определение значения упругой отдачи после раскрытия протезов, расширяемых баллоном (см. соответствующие положения 7.3.6).
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система потребуется для раскрытия испытуемого протеза.
D.5.3.4.2 Материалы
D.5.3.4.2.1 Эндоваскулярная система.
D.5.3.4.2.2 Вспомогательные устройства, необходимые для обеспечения соответствующего расширения протеза.
D.5.3.4.2.3 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления с точностью ±5% зафиксированного значения, способное поддерживать давление наполнения.
D.5.3.4.2.4 Жидкость для наполнения (например, вода комнатной температуры).
D.5.3.4.2.5 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью ±0,1 мм.
D.5.3.4.2.6 Среда с контролируемой температурой (37±2) °С для протезов, чувствительных к разнице физиологической температуры и температуры окружающей среды.
D.5.3.4.2.7 Таймер с точностью ±1 с.
D.5.3.4.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.4.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку и выдержку при определенных условиях.
D.5.3.4.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) начинают раскрытие протеза, чтобы сделать возможным расширение устройства;
b) наполняют баллон для расширения протеза, используя рекомендуемое давление наполнения, и выдерживают давление, чтобы дать баллону и протезу стабилизироваться (приблизительно 30 с);
c) определяют средний внешний диаметр протеза в соответствующих областях по всей длине.
Примечание - Измерения одной продольной области при различных угловых положениях могут показывать различные результаты, и это должно быть учтено при определении среднего внешнего диаметра;
d) спускают баллон и удаляют баллонный катетер;
e) дают протезу стабилизироваться (примерно 30 с);
f) повторяют этап с) в тех же областях;
g) вычисляют средний процент отдачи в каждой продольной области и/или по всей длине протеза, если применимо; вычисляют отдачу протеза следующим образом:
![]() .
.
D.5.3.4.6 Представление результатов
Отдача протеза должна быть выражена в процентах (%).
D.5.3.4.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения измерений отдачи в каждой продольной области и/или по всей длине протеза, если применимо.
Примечание - Для дополнительного руководства см. ASTM F2079-02 [27].
D.5.3.5 Общая утечка/проницаемость для воды
D.5.3.5.1 Цель
Целью данного испытания является определение скорости утечки воды через весь эндоваскулярный протез, включая все модульные компоненты и расширяющие устройства (например, манжеты, подвздошные расширители), если применимо, и независимые модульные компоненты. Испытание собранного протеза необходимо для получения информации, характеризующей общую утечку. Независимые испытания предназначены для получения информации об утечках отдельно в областях соединения модульных компонентов и могут быть полезны при определении области максимальной утечки, например отверстий шва (см. соответствующие положения 7.3.4).
D.5.3.5.2 Материалы
D.5.3.5.2.1 Эндоваскулярный протез.
D.5.3.5.2.2 Материалы, перечисленные в ИСО 7198, подпункт 8.2.3.2, если применимо.
D.5.3.5.2.3 Средства сбора и измерения общей утечки воды через эндоваскулярный протез.
D.5.3.5.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.5.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.3.5.5 Метод испытания
Испытания следует проводить на протезах в раскрытом состоянии, включая все модульные компоненты и устройство расширения, и на каждом отдельном модульном компоненте в соответствии с методом, описанным в ИСО 7198, пункт 8.2.3.
D.5.3.5.6 Представление результатов
Должна быть вычислена площадь поверхности протеза или площадь испытуемой поверхности; общая проницаемость для воды должна быть выражена в миллилитрах на квадратный сантиметр в минуту (мл/см/мин).
D.5.3.5.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения общей утечки/проницаемости для воды испытуемого образца. Должна быть определена и зафиксирована область существенной утечки.
D.5.3.6 Давление прохождения воды
D.5.3.6.1 Цель
Целью данного испытания является определение давления воды при ее прохождении через эндоваскулярные протезы, выполненные из нетканых материалов (см. соответствующие положения 7.3.4).
D.5.3.6.2 Материалы
D.5.3.6.2.1 Эндоваскулярный протез.
D.5.3.6.2.2 Материалы, перечисленные в ИСО 7198, подпункт 8.4.4.2, если применимо.
D.5.3.6.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.6.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.3.6.5 Метод испытания
Испытания следует проводить в соответствии с методом, описанным в ИСО 7198, пункт 8.2.4.
D.5.3.6.6 Представление результатов
Давление воды должно быть выражено в килопаскалях (кПа).
D.5.3.6.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения давления воды.
D.5.3.7 Проницаемость для воды
D.5.3.7.1 Цель
Целью данного испытания является определение скорости проникания воды через стенки эндоваскулярного протеза (см. соответствующие положения 7.3.4).
D.5.3.7.2 Материалы
D.5.3.7.2.1 Эндоваскулярный протез.
D.5.3.7.2.2 Материалы, перечисленные в ИСО 7198, подпункт 8.2.2.2, если применимо.
D.5.3.7.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.7.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.3.7.5 Метод испытания
Испытания следует проводить в соответствии с методом, описанным в ИСО 7198, пункт 8.2.2.
D.5.3.7.6 Представление результатов
Должна быть вычислена площадь поверхности протеза или площадь испытуемой поверхности; проницаемость для воды должна быть выражена в миллилитрах на квадратный сантиметр в минуту (мл/см/мин).
D.5.3.7.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения измерений проницаемости для воды для каждого испытуемого образца.
D.5.3.8 Прочность на разрыв/прочность в окружном направлении
D.5.3.8.1 Цель
Целью данного испытания является определение прочности на разрыв при воздействии давления или прочности в окружном направлении соответствующих компонентов имплантата (например, материала графта). Может также потребоваться определить прочность на разрыв изделия в случае, когда обработка может снижать прочность (см. соответствующие положения 7.3.3).
D.5.3.8.2 Материалы
D.5.3.8.2.1 Эндоваскулярный протез.
D.5.3.8.2.2 Материалы, перечисленные в ИСО 7198, подпункт 8.3.3.3.2 или 8.3.1.2, если применимо.
D.5.3.8.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.8.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку, выдержку при определенных условиях и раскрытие.
D.5.3.8.5 Метод испытания
Испытания следует проводить в соответствии с методом, описанным в ИСО 7198, пункт 8.3.3.3 или пункт 8.3.1.
D.5.3.8.6 Представление результатов
Прочность на разрыв каждого образца выражают в килопаскалях (кПа). Прочность в окружном направлении должна быть выражена в килоньютонах на миллиметр (кН/мм).
D.5.3.8.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения прочности на разрыв или прочности в окружном направлении.
D.5.3.9 Устойчивость к разрушению
D.5.3.9.1 Цель
Целью данного испытания является определение усилия, измеренного перпендикулярно к продольной оси, вызывающего образование деформации постоянной величины или полного разрушения эндоваскулярного протеза (см. соответствующие положения 7.3.7).
Примечание - Несмотря на схожесть испытаний на воздействие разрушающей нагрузки, локальное сжатие и нагружение в радиальном направлении, они оценивают разные параметры эндопротеза:
- при испытании на устойчивость к разрушению измеряют способность протеза выдерживать возникновение постоянной по величине остаточной деформации по всей длине устройства;
- при испытании на локальное сжатие измеряют способность протеза противостоять образованию остаточной деформации при локальной (например, точечной) нагрузке;
- при испытании на радиально направленное усилие определяют нагрузку на сосуд от протеза в раскрытом состоянии.
D.5.3.9.2 Материалы
D.5.3.9.2.1 Эндоваскулярный протез.
D.5.3.9.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять силу с точностью ±5% зафиксированного значения с постоянной скоростью смещения.
D.5.3.9.2.3 Испытательные зажимы, способные обеспечить приложение нормальных сил тяжести, имеющие соответствующую длину, ширину и расстояние между фиксаторами для креплений соответствующего по размерам испытуемого образца.
D.5.3.9.2.4 Среда с контролируемой температурой (37±2) °С для протезов, чувствительных к разнице физиологической температуры и температуры окружающей среды.
D.5.3.9.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.9.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку, выдержку при определенных условиях и раскрытие.
D.5.3.9.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) помещают эндоваскулярный протез между фиксаторами;
b) измеряют длину испытуемого сегмента;
c) сжимают эндоваскулярный протез непрерывно или ступенчато, используя постоянную скорость сжатия (например, 200 мм/мин) до тех пор, пока не появится остаточная пластическая деформация или не произойдет полное разрушение;
d) записывают силу и соответствующую деформацию, при которых появляется пластическая (постоянная) деформация или происходит полное разрушение.
Примечание - Метод определения силы и деформации, при которых появляется пластическая деформация, не определен в настоящем стандарте, т.к. этот метод специфичен для конструкции оцениваемого устройства.
D.5.3.9.6 Представление результатов
Фиксируют устойчивость эндоваскулярного протеза к разрушению как величину усилия на единицу длины по оси в ньютонах на миллиметр (Н/мм) и соответствующую деформацию в миллиметрах (мм), при которой возникает остаточная пластическая деформация или происходит разрушение.
D.5.3.9.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать описание метода, используемого для определения усилия и деформации, при которой появляется пластическая деформация. Фиксируют максимум, минимум, среднее и стандартное отклонения устойчивости к разрушению.
D.5.3.10 Перекручивание/перегиб
D.5.3.10.1 Цель
Целью данного испытания является определение минимального радиуса, который может принимать эндоваскулярный протез без перегиба. Должны быть оценены как эндоваскулярный протез, включая все модульные компоненты и устройства расширения (например, манжеты, подвздошные расширители), так и отдельные модульные компоненты, если применимо (см. соответствующие положения 7.3.5 и 7.3.7).
D.5.3.10.2 Материалы
D.5.3.10.2.1 Эндоваскулярный протез.
D.5.3.10.2.2 Материалы, перечисленные в ИСО 7198, подраздел 8.9, если применимо.
D.5.3.10.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.10.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку, выдержку при определенных условиях и раскрытие.
D.5.3.10.5 Метод испытания
Испытания следует проводить на протезах в раскрытом состоянии, включая все модульные компоненты и устройство расширения, и на каждом отдельном модульном компоненте в соответствии с методом, описанным в ИСО 7198, подраздел 8.9.
Примечание - Сегменты устройства по всей длине могут показывать различную стойкость к перегибу. Поэтому может потребоваться выполнение нескольких измерений для полного описания характеристик устройства.
D.5.3.10.6 Представление результатов
Диаметр/радиус перегиба должен быть выражен в миллиметрах (мм).
D.5.3.10.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения диаметра/радиуса перегиба испытуемого образца.
D.5.3.11 Локальное сжатие
D.5.3.11.1 Цель
Целью данного испытания является определение деформации устройства в ответ на локальное усилие сжатия, приложенное перпендикулярно к продольной оси устройства (см. соответствующие положения 7.3.2 и 7.3.7).
Примечание 1 - Несмотря на схожесть испытаний на воздействие разрушающей нагрузки, локальное сжатие и нагружение в радиальном направлении, они оценивают разные параметры эндопротеза:
- при испытании на устойчивость к разрушению измеряют способность протеза выдерживать возникновение постоянной по величине остаточной деформации по всей длине устройства;
- при испытании на локальное сжатие измеряют способность протеза противостоять образованию остаточной деформации при локальной (например, точечной) нагрузке;
- при испытании на радиально направленное усилие определяют нагрузку на сосуд от протеза в раскрытом состоянии.
Примечание 2 - Испытание не предназначено для оценки всей системы; тем не менее система потребуется для раскрытия испытуемого протеза.
D.5.3.11.2 Материалы
D.5.3.11.2.1 Эндоваскулярная система.
D.5.3.11.2.2 Универсальная механическая испытательная система с возможностью приложения нагрузки сжатия, оборудованная соответствующим датчиком силы, способным измерять искомое усилие с точностью ±5% зафиксированного значения, с постоянной скоростью смещения и соответствующими зажимными фиксаторами.
D.5.3.11.2.3 Зонд для приложения сжимающей нагрузки. Конструкция зонда (например, форма, площадь поперечного сечения) должна соответствовать конструкции эндоваскулярного протеза и возможным локальным усилиям сжатия in vivo.
D.5.3.11.2.4 Фиксаторы, препятствующие полному раскрытию саморасширяющихся устройств, если при клиническом использовании требуется увеличение размеров.
D.5.3.11.2.5 Среда с контролируемой температурой (37±2) °С для протезов, чувствительных к разнице физиологической температуры и температуры окружающей среды.
D.5.3.11.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.11.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку и выдержку при определенных условиях.
D.5.3.11.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) раскрывают модульные компоненты эндоваскулярного протеза таким образом, чтобы конфигурация имитировала клиническое использование (например, если требуется увеличение размеров, могут потребоваться фиксаторы, предотвращающие полное раскрытие, для адекватного моделирования первоначальных условий сжатия) и позволяла приложить усилие сжатия непосредственно к эндоваскулярному протезу;
b) сжимают эндоваскулярный протез непрерывно или ступенчато, используя постоянную скорость сжатия (например, 200 мм/мин), до тех пор, пока не появится пластическая деформация или не произойдет полное разрушение; необходимо зафиксировать область приложения нагрузки на протезе;
c) записывают силу и соответствующую деформацию, при которых появляется пластическая (постоянная) деформация или происходит полное разрушение;
d) если структура эндоваскулярного протеза несимметрична, повторяют испытание для соответствующих областей устройства, используя новое устройство, если необходимо.
Примечание - Метод определения усилия и деформации, при которых появляется пластическая деформация, не определен в данном настоящем стандарте, т.к. этот метод специфичен для конструкции оцениваемого устройства.
D.5.3.11.6 Представление результатов
Усилие сжатия должно быть измерено в ньютонах (Н), деформация - в миллиметрах (мм), площадь зонда для сжатия - в квадратных миллиметрах (мм).
D.5.3.11.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4. Фиксируют максимум, минимум, среднее и стандартное отклонения усилия сжатия и деформации для каждой испытуемой области, область приложения нагрузки и конструкцию зонда (например, форму, площадь поперечного сечения). Следует обосновать количество и расположение зон приложения нагрузки.
D.5.3.12 Продольная прочность на растяжение
D.5.3.12.1 Цель
Целью данного испытания является определение продольной прочности на разрыв отдельных модульных компонентов эндоваскулярного протеза (см. соответствующие положения 7.3.3.6).
D.5.3.12.2 Материалы
D.5.3.12.2.1 Эндоваскулярный протез.
D.5.3.12.2.2 Материалы, перечисленные в ИСО 7198, подпункт 8.3.2.2, если применимо.
D.5.3.12.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.12.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку, выдержку при определенных условиях и раскрытие.
D.5.3.12.5 Метод испытания
Испытания следует проводить в соответствии с методом, описанным в ИСО 7198, пункт 8.3.2. Для данного испытания должна быть определена минимальная нагрузка, вызывающая повреждения, а не нагрузка при пластической деформации или разрушении.
D.5.3.12.6 Представление результатов
Продольная прочность на растяжение должна быть выражена в ньютонах (Н).
D.5.3.12.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения продольной прочности на растяжение для каждого модульного компонента, прошедшего испытание.
D.5.3.13 Устойчивость к смещению
D.5.3.13.1 Цель
Целью данного испытания является определение силы, необходимой для смещения протеза внутри модели артерии. Это испытание позволяет получить оценку устойчивости к смещению в сосудистом русле, обеспечиваемой механизмами фиксации протеза, например, наличием специальных фиксаторов, фиксацией радиальной силой (см. соответствующие положения 7.3.2).
Примечание - Данное испытание не предназначено для оценки всей системы; тем не менее система потребуется для раскрытия испытуемого протеза.
D.5.3.13.2 Материалы
D.5.3.13.2.1 Эндоваскулярная система.
D.5.3.13.2.2 Вспомогательные устройства, необходимые для помощи при раскрытии в соответствии с инструкцией по эксплуатации.
D.5.3.13.2.3 Модель артерии или модель сосуда диаметром, длиной и с механическими свойствами, соответствующими конструкции эндоваскулярного протеза (например, для соответствия шипам/зацепам).
D.5.3.13.2.4 Универсальная механическая испытательная система, оборудованная соответствующим датчиком нагрузки или силовым датчиком, способным измерять усилия с точностью ±5% зафиксированного значения.
D.5.3.13.2.5 Испытательные приспособления - фиксаторы, способные надежно фиксировать модель артерии и испытуемый протез.
D.5.3.13.2.6 Среда с контролируемой температурой (37±2) °С для протезов, чувствительных к разнице физиологической температуры и температуры окружающей среды.
D.5.3.13.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.13.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.3.13.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) раскрывают эндоваскулярный протез в модели артерии в соответствии с ИПП таким образом, чтобы длина протеза внутри артерии была примерно равна минимальной рекомендуемой в ИПП длине (например, как зона крепления, длина шеи);
b) закрепляют образец в испытательном приспособлении (фиксаторах);
c) используя постоянную скорость растяжения (обычно от 50 до 200 мм/мин), выдергивают эндоваскулярный протез из модели артерии и фиксируют значение максимального усилия.
Примечание - На устойчивость к смещению могут влиять извитость и заболевания сосудов. Для оценки влияния сосудистых факторов на устойчивость к смещению могут быть проведены дополнительные испытания и исследования.
D.5.3.13.6 Представление результатов
Усилие, характеризующее устойчивость протеза к смещению, следует измерять в ньютонах (Н). Длина протеза внутри модели артерии должна быть выражена в миллиметрах (мм).
D.5.3.13.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения силы, характеризующей устойчивость к смещению. Следует определить длину протеза внутри модели артерии.
D.5.3.14 Испытание на отрыв для модульных компонентов (или перекрывающихся эндопротезов)
D.5.3.14.1 Цель
Целью данного испытания является определение усилия, необходимого для отделения модульных компонентов от эндоваскулярного протеза или для разделения перекрывающих друг друга эндопротезов в раскрытом состоянии (см. соответствующие положения 7.3.5).
Примечание - Данное испытание не предназначено для оценки всей системы; тем не менее, система потребуется для раскрытия испытуемого протеза.
D.5.3.14.2 Материалы
D.5.3.14.2.1 Эндоваскулярная система.
D.5.3.14.2.2 Вспомогательные устройства, необходимые для помощи при раскрытии в соответствии с инструкцией по эксплуатации (ИПП).
D.5.3.14.2.3 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы для измерения усилий с точностью ±5% зафиксированного значения, постоянной скоростью смещения и соответствующими зажимными приспособлениями.
D.5.3.14.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.14.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3. Для протезов с материалами, свойства которых чувствительны к разнице физиологической температуры и температуры окружающей среды, следует использовать среды с контролируемой температурой. Испытания следует проводить в жидкой среде, если это может оказать влияние на усилие, необходимое для отделения модульных компонентов.
D.5.3.14.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) раскрывают/собирают модульные компоненты протеза или перекрывающиеся протезы в соответствии с ИПП; длина зоны перекрытия между модульными компонентами или протезами должна быть приблизительно равна минимальной рекомендуемой в ИПП.
Примечание - Необходимо учитывать использование внешних ограничителей вокруг или на модульных соединениях или зонах перекрытия протезов, если применимо (так, область перекрытия может находиться вне протезируемой зоны аневризмы). Ограничители не следует использовать, если соединения модульных компонентов или зона перекрытия протезов расположены в пределах области аневризмы;
b) используя постоянную скорость растяжения (обычно от 50 до 200 мм/мин), рассоединяют модульные компоненты и определяют значение максимального усилия;
c) повторяют испытание для всех соединений модульных компонентов, включая манжеты и расширители.
Примечание - На величину усилия разделения модульных компонентов или протезов могут влиять извитости сосудов между компонентами. Для оценки влияния извитостей на величину искомого усилия могут быть проведены дополнительные испытания или исследования.
D.5.3.14.6 Представление результатов
Усилие должно быть выражено в ньютонах (Н). Скорость разделения - в миллиметрах в минуту (мм/мин). Длина соединений или перекрытия - в миллиметрах (мм).
D.5.3.14.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения силы, характеризующей устойчивость к смещению. Длина протеза внутри модельной артерии должна быть измерена.
D.5.3.15 Радиальное усилие
D.5.3.15.1 Цель
Целью данного испытания является определение радиальных усилий, вызванных саморасширяющимися имплантатами, в виде функции от диаметра имплантата при расширении и сжатии последнего (см. соответствующие положения 7.3.2 и 7.3.7).
Примечание 1 - Несмотря на схожесть испытаний на воздействие разрушающей нагрузки, локальное сжатие и нагружение в радиальном направлении, они оценивают разные параметры эндопротеза:
- при испытании на устойчивость к разрушению измеряют способность протеза выдерживать возникновение постоянной по величине остаточной деформации по всей длине устройства;
- при испытании на локальное сжатие измеряют способность протеза противостоять образованию остаточной деформации при локальной (например, точечной) нагрузке;
- при испытании на радиально направленное усилие определяют нагрузку на сосуд от протеза в раскрытом состоянии.
Примечание 2 - Испытание не предназначено для оценки всей системы; тем не менее система потребуется для раскрытия испытуемого протеза.
D.5.3.15.2 Материалы
D.5.3.15.2.1 Эндоваскулярная система.
D.5.3.15.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять усилия с точностью ±5% зафиксированного значения, с постоянной скоростью смещения и соответствующими зажимными приспособлениями для фиксации.
D.5.3.15.2.3 Расширяющие и сжимающие хомуты/фиксаторы в виде двухстворчатых зажимных устройств, V-образные блоки или устройства для нагружения в окружном направлении, такие как хомуты или петли. Диаметр/размеры фиксирующих приспособлений должны соответствовать размерам и форме испытуемого имплантата.
D.5.3.15.2.4 Среда с контролируемой температурой (37±2) °С для протезов, чувствительных к разнице физиологической температуры и температуры окружающей среды.
D.5.3.15.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.15.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать выдержку при определенных условиях.
D.5.3.15.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) испытание должно проводиться в соответствующей области [например, зона(ы) фиксации] для каждого устройства;
b) раскрывают эндоваскулярный протез в фиксаторах таким образом, чтобы начальный диаметр был меньше или равен минимальному диаметру сосуда, указанному в инструкции по применению;
c) измеряют радиальное усилие как функцию диаметра при расширении имплантата до максимального указанного диаметра сосуда; число нагружений и скорость нагружения должны быть такими, чтобы результаты были статистически значимы;
d) измеряют радиальную силу как функцию диаметра при сжатии имплантата до минимального указанного диаметра сосуда; число нагружений и скорость нагружения должны быть такими, чтобы результаты были статистически значимы.
D.5.3.15.6 Представление результатов
Радиальное усилие должно быть выражено в ньютонах на единицу длины в миллиметрах (Н/мм). Должна быть определена длина протеза внутри фиксаторов.
D.5.3.15.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать описание испытанного положения (положений) протеза, минимум, максимум, среднее и стандартное отклонения радиальной силы при минимальном и максимальном диаметрах для каждого испытанного размера устройства.
D.5.3.16 Прочность при многократном проколе (для артериовенозного доступа)
D.5.3.16.1 Цель
Целью данного испытания является определение прочности эндоваскулярного протеза после многократных проколов иглой для диализа (см. соответствующие положения 7.3.3).
D.5.3.16.2 Материалы
D.5.3.16.2.1 Эндоваскулярный протез.
D.5.3.16.2.2 Материалы, перечисленные в ИСО 7198, подпункт 8.3.4.2, если применимо.
D.5.3.16.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.16.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3.
D.5.3.16.5 Метод испытания
Испытания следует проводить в соответствии с методом, описанным в ИСО 7198, пункт 8.3.4.
D.5.3.16.6 Представление результатов
Прочность до и после проколов должна быть выражена в единицах, определенных в ИСО 7198, пункт 8.3.4.
D.5.3.16.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать максимум, минимум, среднее и стандартное отклонения прочности до и после проколов образца имплантата.
D.5.3.17 Прочность стента/системы крепления при креплении графта
D.5.3.17.1 Цель
Целью данного испытания является определение прочности фиксации или соединения между материалом графта и стентом или системой крепления (см. соответствующие положения 7.3.3 настоящего стандарта).
D.5.3.17.2 Материалы
D.5.3.17.2.1 Эндоваскулярный протез или участок протеза, оснащенный системой крепления, используемой в испытуемом устройстве.
D.5.3.17.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять усилия с точностью ±5% зафиксированного значения, с постоянной скоростью смещения и соответствующими зажимными фиксаторами.
D.5.3.17.2.3 Механизм фиксации, соответствующий методу(ам) крепления и вероятным усилиям in vivo.
D.5.3.17.2.4 Среда с контролируемой температурой (37±2) °С для соединений, чувствительных к температуре.
D.5.3.17.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.17.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку, выдержку при определенных условиях и раскрытие.
D.5.3.17.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
a) фиксируют образец в испытательном фиксаторе(ах);
b) прикладывают нагрузку к соединению, используя постоянную скорость смещения (например, 200 мм/мин), и фиксируют усилие, необходимое для начала отделения компонентов, и значение максимального усилия, необходимого для полного отделения компонентов; если в конструкции устройства используется более одного метода или методики крепления, должны быть оценены все методы.
D.5.3.17.6 Представление результатов
Усилия должны быть выражены в ньютонах (Н). Может оказаться необходимым нормировать результат, например по площади, длине, числу точек фиксации.
Качественно оценивают и фиксируют вид отказа (например, разрыв покрытия, обрыв нити, разделение соединений).
D.5.3.17.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать вид отказа и минимум, максимум, среднее и стандартное отклонения силы, необходимой для начала отделения компонентов, и пикового усилия, необходимого для полного отделения компонентов. Отчет по испытанию должен также включать оценку важности результатов для целостности протеза.
D.5.3.18 Оценка коррозии
D.5.3.18.1 Цель
Целью данной оценки является оценка подверженности металлических компонентов протеза коррозии в моделируемой физиологической среде в течение предполагаемой продолжительности имплантации (см. соответствующие положения 7.3.3).
D.5.3.18.2 Материалы
D.5.3.18.2.1 Эндоваскулярный протез или соответствующие испытательные образцы протеза в виде, например, сегментов, узлов, компонентов и пр.).
Примечание - Испытательные образцы должны соответствовать виду оцениваемой коррозии (например, контактная, точечная, фреттинг-коррозия, электрохимическая).
D.5.3.18.2.2 Материалы, аппаратура и условия испытания, определенные в выбранном для данной оценки методе испытания.
D.5.3.18.2.3 Соответствующие контрольные образцы.
D.5.3.18.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2.
D.5.3.18.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3 и включать загрузку, выдержку при определенных условиях и раскрытие. Для испытательных образцов из металла оцениваемый вид металла должен подвергаться всем видам производственных и технологических воздействий, а также воздействиям на постпроизводственном этапе, таким как очистка, помывка, сушка и пр.
D.5.3.18.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
а) оценивают все металлические компоненты имплантата, используя соответствующие методы испытания и оценки коррозии; в случае если клинически возможен контакт различных металлов, они должны находиться в таком же контакте при оценке (например, металлический стент может быть размещен внутри эндоваскулярного протеза).
Примечание - Оценка коррозии включает, но не ограничивается, оценку результатов испытания, обзор литературы и учет исторически известных клинических характеристик оцениваемых материалов. Руководства по оценке коррозии можно найти в различных источниках (например, научной литературе, учебниках, стандартах, нормативных руководящих документах). Библиография включает также список ссылок, относящихся к терминологии, оборудованию, испытательным процедурам и методам оценки коррозии.
D.5.3.18.6 Представление результатов
Данные испытания должны быть выражены в единицах, соответствующих выбранному методу.
D.5.3.18.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать полную оценку коррозии, включая сводку всех данных испытания, анализ и ссылочную информацию, сравнение с применимыми уровнями контроля, любые соответствующие сравнения между рабочими характеристиками in vivo и in vitro и заключение, касающееся ожидаемого сопротивления коррозии эндоваскулярного протеза. При анализе количественных данных должны быть включены минимум, максимум, среднее и стандартное отклонения. Также следует учитывать применимые требования, указанные в руководящих документах, используемых при испытании.
D.5.3.19 Испытание на усталостную прочность и долговечность (при циклическом нагружении изделия)
D.5.3.19.1 Цель
Целью данного испытания является оценка параметров долгосрочной целостности эндоваскулярного протеза при воздействии циклической (пульсирующей) радиальной нагрузки (см. соответствующие положения 7.3.3).
Вероятные виды отказа, которые можно определить в данном испытании, включают, но не ограничиваются, следующие виды: разрушение стента, обусловленное усталостью, отсоединение стента от тканей, разрыв или другие виды отказа тканей, износ или абразивное истирание материала между отдельными компонентами устройства. Данное испытание не предназначено для полной оценки вероятных отказов, связанных с коррозией, абразивным истиранием между устройством и артерией или смещением устройства. Известно, что эти виды отказа могут возникнуть во время испытания, поэтому следует учитывать, что такие наблюдения могут указывать на повышенный риск проявления подобного вида отказа при клиническом использовании.
Это испытание может быть изменено с тем, чтобы выполнять оценку возможности отделения модульных частей или других видов отказа, вызванных изгибом, прогибом, поворотом, потерей поддержки (опоры) в аневризматическом мешке или развертыванием устройства в извитой артерии. Для полной оценки всех возможных видов отказа могут потребоваться другие виды испытания или оценки устройства или его отдельных компонентов.
При разработке данного метода испытания следует учитывать результаты испытаний компонентов и предварительных испытаний.
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система потребуется для раскрытия испытуемого протеза.
D.5.3.19.2 Материалы
D.5.3.19.2.1 Эндоваскулярная система.
D.5.3.19.2.2 Вспомогательные устройства, необходимые для помощи при раскрытии в соответствии с инструкцией по эксплуатации (ИПП).
D.5.3.19.2.3 Модель артерии с геометрией (например, бифуркацией), диаметрами и свойствами, подходящими для моделирования худшего случая распределения нагрузки и диаметров, ожидаемых для устройства в предполагаемом месте имплантации.
Примечание - Для обеспечения того, что модель артерии имеет соответствующий диаметр во время испытания, при определении диаметра модели артерии необходимо учитывать рабочие давления. Если применимо, податливость модели артерии должна быть определена и измерена методами, сходными с приведенными в ИСО 7198, подраздел 8.10. Податливость естественной артерии следует учитывать при разработке модели артерии (например, от 5% до 7% на 100 мм рт.ст. для податливости брюшной аорты).
D.5.3.19.2.4 Установка циклического нагружения для испытаний на усталость, способная обеспечить циклический характер деформирования модели артерии с раскрытым в ней эндоваскулярным протезом.
Примечание - Испытательное оборудование должно включать средства для любых прямых и непрямых измерений внутреннего диаметра модели артерии , частоты циклического нагружения при испытании, обеспечения постоянства физиологической температуры (37±2) °С и подсчета числа циклов нагружения.
D.5.3.19.2.5 Соответствующее оборудование для инспекции (например, оптический микроскоп, просветленное увеличительное стекло, сканирующий электронный микроскоп).
D.5.3.19.3 Отбор образцов
Отбор образцов следует проводить в соответствии с требованиями D.2. Размер(ы) устройства должен(ны) быть выбран(ы) таким образом, чтобы представлять наибольшую вероятность для усталостного отказа и других оцениваемых видов отказа, основываясь на инженерном подходе, таком как анализ напряженно-деформированного состояния.
D.5.3.19.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать требованиям D.3. Испытания следует проводить в соответствующем испытательном растворе, таком, например, как физиологический раствор с фосфатным буфером или эквивалентном, если не обосновано проведение испытаний в другой среде (например, дистиллированной воде). Протезы следует выдерживать при физиологической температуре (37±2) °С.
D.5.3.19.5 Метод испытания
Следует разработать метод испытания на основе следующих действий:
а) Определяют условия, при которых будут испытываться образцы. Эти условия включают выбор системы с моделью артерии для испытания, метода определения диаметра устройства и частоты нагружения.
Примечание - На диаметр модели артерии, толщину стенок и податливость может существенно влиять система крепления трубок.
1) Выбор системы с моделью артерии
- Испытания проводят с использованием модели артерии, которая обеспечивает физиологическую деформацию устройства во время испытания.
Примеры
1 Испытания могут быть проведены с использованием модели артерии, учитывающей податливость естественной артерии. Этот вид испытания может быть проведен при физиологических значениях давлений путем ускоренного нагружения изделия, обеспечивающего ожидаемое значение физиологической деформации. Если допустимо, то податливость модели артерии может быть измерена методами, сходными с приведенными в ИСО 7198, подраздел 8.10, до и после раскрытия;
2 Испытания устройства могут быть проведены на модели артерии с нефизиологической податливостью при контроле деформации устройства для воспроизведения условий in vivo. Давления и податливость в диапазоне испытательных частот корректируются для достижения этой деформации и не обязательно являются физиологическими. Для определения среднего диаметра и деформаций устройства могут быть использованы рабочие характеристики устройства в модели артерии с физиологической податливостью при физиологических условиях. Если применимо, податливость модели артерии должна быть измерена методами, сходными с приведенными в ИСО 7198, подраздел 8.10, до и после раскрытия.
2) Выбор метода определения диаметра устройства
Для определения деформации или податливости диаметр модели артерии не может быть вычислен простым вычитанием удвоенной толщины стенок из значения внешнего диаметра
модели артерии, т.к. толщина стенок меняется при изменении диаметра. Диаметр
может быть непосредственно измерен или вычислен путем измерения
с использованием соответствующих формул или взаимосвязей, указанных в приложении Е.
При подготовке к измерению диаметра аналитическим методом или путем непосредственных измерений следует учесть ряд дополнительных вопросов.
Для аналитического метода определения диаметра на основании измерения
эти вопросы могут включать, но не ограничиваться, следующее:
- может присутствовать ошибка в измерении из-за калибровки, разрешения, частоты и точности измерения измерительной системы;
- неравномерность расширения устройства и вариабельность конструкции устройства по его длине (например, при наличии стентированных и нестентированных участков) должны быть учтены при выборе области измерения;
- неоднозначность реакции устройства на условия испытания должна быть рассмотрена и учтена при выборе области измерения; например, концы устройства могут показывать большую деформацию, чем тело устройства, и деформация устройства может отличаться по его окружности;
- допущения, принимаемые при нагружении модели артерии, влияют на методы вычисления, используемые для определения диаметра на основании измерений
(например, продольное напряженно-деформированное состояние, граничные условия);
- точность определения начальных размеров модели артерии (т.е. и
) влияет на точность вычисления
;
- необходимо учитывать влияние геометрии модели артерии на методы вычисления, используемые для определения диаметров на основании измерений
(например, некруглое поперечное сечение, бифуркация и геометрия аневризмы, изменения толщины стенок);
- точность оценки свойств материала модели артерии может быть важна при вычислении на основании измерений
(например, коэффициент Пуассона и модуль упругости);
- имплантат должен контактировать с модели артерии во время испытания для того, чтобы вычисленный диаметр
модели артерии мог быть использован как
устройства.
Для прямых измерений модели артерии или диаметра устройства эти вопросы могут включать, но не ограничиваться, следующее:
- может присутствовать ошибка в измерении диаметра из-за калибровки, разрешения, частоты и точности измерения измерительной системы;
- неравномерность расширения устройства и вариабельность конструкции устройства по его длине (при наличии стентированных и нестентированных участков) должны быть учтены при выборе области измерения;
- неоднозначность реакции устройства на условия испытания должна быть рассмотрена и учтена при выборе области измерения; например, концевые участки устройства могут показывать большую деформацию, чем тело устройства, и деформация устройства может отличаться по его окружности;
- может присутствовать ошибка в измерении диаметра из-за оптических искажений, связанных с оптическими свойствами модели артерии (например, нелинейность, рефракция, дисперсия);
- может присутствовать ошибка в измерении диаметра из-за сложности определения границы модели артерии или диаметра устройства;
- при выборе метода, используемого для измерения модели артерии или
устройства, необходимо учитывать геометрию модели артерии (например, некруглое поперечное сечение, бифуркация и геометрия аневризмы, изменения толщины стенок);
- воздух внутри испытательной системы может влиять на точность измерения (например, на определение границы) и реакцию модели артерии на давление (например, на податливость);
- устройства крепления и расположение датчиков измерения диаметра на или в модели артерии могут влиять на деформацию модели артерии и/или точность измерений;
- имплантат должен контактировать с модели артерии во время испытания для того, чтобы вычисленный
модели артерии использовался как
устройства:
- Податливость, если она подлежит вычислению, должна быть выражена как процент изменения диаметра на 100 мм рт.ст. и определена в соответствии с ИСО 71988, пункт 8.10.5:
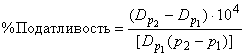 ,
,
где - внутренний диаметр при давлении
;
- внутренний диаметр при давлении
;
- максимальное значение давления (систолическое), в миллиметрах ртутного столба;
- минимальное значение давления (диастолическое), в миллиметрах ртутного столба.
3) Выбор частоты нагружения при испытании.
- Частота нагружения должна быть такой, чтобы средний диаметр и деформация устройства в диаметральном направлении оставались в необходимых пределах на протяжении всего испытания. Максимальная частота может быть ограничена влиянием скорости деформирования на механические свойства материалов; например, при высокой частоте устройство может не повторять деформацию модели артерии или модель артерии может не отвечать соответствующим образом на изменение давления. Наконец, частота нагружения может быть ограничена мощностью испытательного оборудования.
- При некоторых частотах могут возбуждаться вторичные гармоники. Вероятное влияние этих гармоник на условия испытания должно быть тщательно оценено.
b) Выбирают оборудование и проводят подготовку образцов к испытанию.
1) Раскрывают эндоваскулярный протез в модели артерии, следуя ИПП. Расположение устройства в модели артерии должно включать соответствующее совмещение всех модульных компонентов. Расположение по отношению к бифуркации или другим моделируемым в модели артерии анатомическим особенностям должно быть сравнимо с ожидаемым при клиническом использовании. Важно убедиться, что эндоваскулярный протез расположен в области, в которой требуемый средний диаметр и диаметральная деформация и/или податливость являются валидными (т.е. на них не влияют никакие краевые эффекты, характерные для испытания на усталость).
2) Осматривают раскрытое устройство, используя соответствующие средства визуализации, и отмечают расположение и тяжесть состояния любых отклонений (например, наличие складок на материале графта, неоднородное расширение устройства).
c) Начинают испытания:
1) Устанавливают частоту на определенное значение и регулируют испытательную систему для достижения предполагаемого значения среднего диаметра и деформации в диаметральном направлении эндоваскулярного протеза. По окончании регулировки запускают счетчик подсчета числа циклов пульсации.
2) Проверяют значения среднего диаметра и деформации через регулярные промежутки времени (например, еженедельно) для проверки того, что сохраняются определенные значения. Регулируют систему по мере необходимости для поддержания описанного режима работы; так, регулировка может заключаться в замене модели артерии, регулировке оборудования и повторном раскрытии устройства. Потенциальное влияние регулировки на результаты испытания должно быть рассмотрено в отчете по испытанию. Методы измерения диаметра и деформации должны быть определены и обоснованы.
3) Если применимо, то испытание останавливают через определенные интервалы времени для осмотра устройства.
Примечание - Если устройство удаляют из модели артерии, то следует принять меры по выполнению процедуры удаления и повторному раскрытию устройства таким образом, чтобы минимизировать их влияние на результаты испытания;
4) Продолжают испытание до тех пор, пока не будет достигнуто число циклов, эквивалентное 10 годам (по крайней мере не менее 380 млн циклов) для каждого устройства. Если предполагаемый срок службы устройства составляет меньше 10 лет, то возможна - при обосновании - более короткая продолжительность испытания на усталостную прочность.
5) Осматривают все компоненты устройства, как указано в протоколе испытания. Прежде всего необходимо осмотреть все устройство на наличие макроскопических повреждений. Более внимательный осмотр устройства может включать использование оптического микроскопа, сканирующего электронного микроскопа или рентгена с особым вниманием на области высоких напряжений, установленные путем расчета напряженно-деформированного состояния или другими видами анализа. Должны быть зафиксированы любые найденные отклонения, такие как трещины или надломы (изломы) материала, абразивные повреждения, эрозия, участки поверхности с отсутствием (оголением) покрытия, расслоения материала графта и стента/системы крепления, перфорации, отрывы нити и пр.
D.5.3.19.6 Представление результатов
Частота нагружения при испытании должна быть выражена в герцах (Гц).
Все значения давления должны быть выражены в килопаскалях (кПа) и миллиметрах ртутного столба (мм рт.ст.).
Все значения диаметров и деформации должны быть выражены в миллиметрах (мм).
Увеличение диаметра выше значений, предусмотренных режимом испытания, выражают как процентное изменение диаметра (%) и вычисляют по формуле: ![]() .
.
Податливость выражают в процентах от изменения диаметра на 100 миллиметров ртутного столба ![]() .
.
Должны быть зафиксированы такие результаты наблюдения, как трещины, надломы (изломы), абразивные повреждения, эрозия, участки поверхности с отсутствием покрытия, расслаивание материала графта и стента/системы крепления, перфорация, отрывы нити и пр. Должны быть зафиксированы все результаты осмотра, включая число циклов, при котором проводился осмотр, и точное месторасположение любых обнаруженных нарушений.
D.5.3.19.7 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4. Должны быть зафиксированы такие результаты наблюдения, как трещины или надломы (изломы), абразивные повреждения, эрозия, участки поверхности с отсутствием покрытия, расслаивание материала графта и стента/системы крепления, перфорация, отрывы нити и пр. Должны быть зафиксированы все результаты осмотра, включая число циклов, при котором проведен осмотр, и точное положение любых обнаруженных отклонений. Отчет по испытанию должен включать обоснование критериев отбора негативных находок среди артефактов испытания и/или снижения их клинической значимости. Результаты должны быть рассмотрены и интерпретированы в зависимости от данных in vivo.
D.5.3.20 Анализ напряженно-деформированного состояния (например, при использовании метода конечных элементов)
D.5.3.20.1 Цель
Целью данного анализа является определение участков расположения и значений максимальных напряжений и/или деформации на имплантате, обусловленных технологией изготовления, приведением его в раскрытое состояние и нагрузками in vivo. Эту информацию следует использовать для определения соответствующих коэффициентов запаса для конструкции, а также для определения соответствующих условий режима испытания на усталостную прочность и долговечность (см. соответствующие положения 7.3.3 настоящего стандарта).
D.5.3.20.2 Материалы
D.5.3.20.2.1 Конструктивная форма эндоваскулярного протеза.
D.5.3.20.2.2 Свойства всех исследуемых материалов протеза.
D.5.3.20.2.3 Информация, необходимая для определения граничных условий, характерных для технологии изготовления (например, приведение диаметра устройства в сжатое состояние для загрузки протеза в систему доставки) и при раскрытии (например, допустимое значение диаметра расширенного баллона).
D.5.3.20.2.4 Информация, необходимая для определения граничных условий, характерных для клинического использования (например, параметры гемодинамики, диаметр кровеносных сосудов, деформация, извитость, кривизна).
D.5.3.20.2.5 Соответствующие средства моделирования напряженно-деформированного состояния, такие как программное обеспечение, реализующее метод конечных элементов, и система автоматизированного проектирования для моделирования эндоваскулярного протеза.
D.5.3.20.3 Отбор образцов
Анализ следует проводить на всех размерах, конфигурациях и компонентах, для которых важно проверить диапазон характеристик напряжения и/или деформации.
D.5.3.20.4 Методика анализа
Следует разработать анализ на основе следующего алгоритма действий:
a) Определение свойств материалов.
- свойства материалов, используемые в данном анализе, должны быть получены путем механических испытаний материалов того же состава и такой же конечной формы (например, провод, трубка, пластина), что и материалы, используемые при изготовлении устройства. Образцы для испытаний должны быть подвергнуты всем воздействиям, характерным для процессов изготовления исследуемого устройства (например, тепловая обработка, механическое нагружение и пр.). Испытания материалов следует проводить при физиологической температуре (37±2) °С, если допустимо.
b) Определение граничных условий:
- определяют граничные условия для анализа этапа производства (например, сжатый диаметр для загрузки протеза в систему доставки) и при раскрытии (например, диаметр расширенного баллона);
- определяют граничные условия для анализа этапа in vivo (например, диаметр кровеносных сосудов, деформация, степень кривизны, физиологические значения давления).
c) Выполнение анализа:
- для каждого набора граничных условий должен быть проведен анализ для определения мест расположения(й) и значения максимального напряжения или деформации, если применимо;
- для каждого анализа in vivo также должны быть определены максимальное, среднее и циклическое напряжения и/или деформации.
d) Интерпретация анализа:
Анализ должен быть интерпретирован в свете усталостных свойств материала (например, видоизмененная диаграмма Гудмана). Могут потребоваться оценка усталостной прочности материала и/или устройства для определения усталостных характеристик материала и конструктивных коэффициентов запаса.
D.5.3.20.5 Представление результатов
Значение напряжения должно быть выражено в мегапаскалях (МПа), деформации - в процентах (%).
D.5.3.20.6 Отчет по испытанию
Отчет по испытанию должен соответствовать требованиям D.4 и включать свойства материалов, принятые допущения при анализе, методики и результаты испытаний, конструктивные коэффициенты запаса. Должны быть обоснованы и зафиксированы принятые допущения при анализе in vivo, модель материала, особенности методов определения свойств материала и вычисления конструктивных коэффициентов запаса. При использовании метода конечных элементов следует выбрать программное обеспечение и вид используемых элементов.
Значения максимального напряжения и/или деформации должны быть представлены для каждого анализируемого набора условий. Для условий in vivo следует отметить средние значения напряжений и деформаций и амплитуду колебаний их значений. Область(и) значений максимальных напряжений и/или деформаций на исследуемом устройстве должна(ы) быть представлена(ы) графически для каждого вида анализа.
Приложение Е
(справочное)
Дополнение к D.5.3.19. Оценка усталостной и длительной прочности (в условиях пульсирующего потока): аналитический подход
Е.1 Общие положения
В разделах Е.2 и Е.3 приведены примеры соотношений между внутренним и внешним диаметрами трубки, полученные на основе механики упругого линейного деформирования материалов.
Примечание - Могут быть использованы и другие альтернативные подходы представления данных соотношений.
Е.2 Условия нулевой продольной деформации (постоянной длины)
Примеры аналитических выражений для вычисления внутреннего диаметра (или радиуса) на основании внешнего диаметра (или радиуса) для условий нулевой продольной деформации (постоянной длины) приведены ниже.
Эти формулы отражают взаимосвязь между внутренним и внешним диаметрами трубки при различных состояниях ее расширения, например без давления и под давлением (систолическим и диастолическим), и получены с использованием стандартных инженерных выражений [21].
Так, если известны первоначальные значения внутреннего и внешнего радиусов модели артерии и необходимо определить изменение внутреннего радиуса, обусловленное изменением внешнего радиуса, то можно использовать формулу (Е.4).
Аналогично, если известны начальные внутренний и внешний радиусы модели артерии, и необходимо определить внешний радиус, связанный с необходимым внутренним радиусом, можно использовать формулу (Е.2).
Формула (Е.1) может быть использована для определения изменения , если известно изменение
. Формула (Е.3) может быть применена для определения изменения
, если известно изменение
.
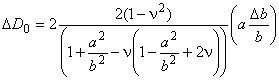 ; (Е.1)
; (Е.1)
 ; (Е.2)
; (Е.2)
 ; (Е.3)
; (Е.3)
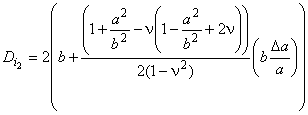 , (E.4)
, (E.4)
где - изменение внешнего диаметра, связанное с подачей давления;
- коэффициент Пуассона;
- начальный внешний радиус (например, при условиях отсутствия или нижнего значения давления);
- изменение внутреннего радиуса, вызванное изменением давления
![]() ;
;
- первоначальное значение внутреннего радиуса (например, при условиях отсутствия давления или при значении давления на нижней границе);
- значение внешнего диаметра под давлением;
- изменение внутреннего диаметра, вызванное подачей давления;
- изменение внешнего радиуса, вызванное изменением давления
![]() ;
;
- значение внутреннего диаметра под давлением.
Примечание - В формулах (Е.1)-(Е.4) и определениях переменных к ним символ не является операционным.
Е.3 Условия нулевого продольного напряжения (свободной длины)
Примеры аналитических выражений для вычисления внутреннего диаметра (или радиуса) на основании внешнего диаметра (или радиуса) для условий нулевого продольного напряжения по длине расчетного трубчатого элемента ("свободной" длине) приведены ниже.
Эти формулы отражают взаимосвязь между внутренним и внешним диаметрами трубки при различных состояниях ее расширения, например, без давления и под давлением (систолическим и диастолическим), и получены с использованием стандартных инженерных формул [22].
Так, если известны первоначальные значения внутреннего и внешнего радиусов модели артерии и необходимо определить изменение внутреннего радиуса, вызванное изменением внешнего радиуса, можно воспользоваться формулой (Е.8).
Аналогично, если известны первоначальные значения внутреннего и внешнего радиусов модели артерии и необходимо определить внешний радиус, связанный с необходимым внутренним радиусом, можно воспользоваться формулой (Е.6).
Формула (Е.5) может быть использована для определения изменения , если известно изменение
, формула (Е.7) - для определения изменения
, если известно изменение
.
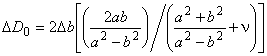 ; (Е.5)
; (Е.5)
 ; (Е.6)
; (Е.6)
 ; (Е.7)
; (Е.7)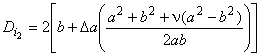 , (Е.8)
, (Е.8)
где символы соответствуют таковым в формулах (Е.1)-(Е.4).
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 7198:1998 | NEQ | ГОСТ Р 51566-2000 "Протезы кровеносных сосудов. Общие технические требования. Методы испытаний" |
ИСО 11134:1994 | IDT | ГОСТ Р ИСО 11134-2000 "Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Промышленная стерилизация влажным теплом" |
ИСО 11135:1994 | IDT | ГОСТ Р ИСО 11135-2000 "Медицинские изделия. Валидация и текущий контроль стерилизации оксидом этилена" |
ИСО 11137:1995 | IDT | ГОСТ Р ИСО 11137-2000 "Стерилизация медицинской продукции. Радиационная стерилизация" |
_______________
* На территории Российской Федерации документ не действует. Действует ГОСТ ISO 11137-1-2011; ** На территории Российской Федерации документ не действует. Действует ГОСТ ISO 11137-2-2011. - . | ||
ИСО 10993 | IDT | ГОСТ Р ИСО 10993 "Изделия медицинские. Оценка биологического действия медицинских изделий" |
ИСО 11607:1997 | IDT | ГОСТ Р ИСО 11607-2003* "Упаковка для медицинских изделий, подлежащих финишной стерилизации. Общие требования" |
________________ * На территории Российской Федерации документ не действует. Действует ГОСТ ISO 11607-2011. - . | ||
ИСО 13485 | IDT | ГОСТ Р ИСО 13485-2004* "Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования" |
________________ * На территории Российской Федерации документ не действует. Действует ГОСТ ISO 13485-2011. - . | ||
ИСО 13488:1996 | - | * |
ИСО 14155 | IDT | ГОСТ Р ИСО 14155-1-2008 "Руководство по проведению клинических испытаний медицинских изделий. Часть 1. Общие требования" |
ИСО 14160 | IDT | ГОСТ Р ИСО 14160-2003* "Стерилизация одноразовых медицинских изделий, содержащих материалы животного происхождения. Валидация и текущий контроль стерилизации с помощью жидких стерилизующих средств" |
________________ * На территории Российской Федерации документ не действует. Действует ГОСТ ISO 14160-2011. - . | ||
ИСО 14630:1997 | IDT | ГОСТ Р ИСО 14630-99 "Неактивные хирургические имплантаты. Общие технические требования" |
______________ | ||
ИСО 14937 | IDT | ГОСТ Р ИСО 14937-2012 "Стерилизация медицинской продукции. Общие требования к определению характеристик стерилизующего агента и к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий" |
ИСО 14971:2000 | IDT | ГОСТ Р ИСО 14971-2006 "Изделия медицинские. Применение менеджмента риска к медицинским изделиям" |
____________
| ||
* Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. | ||
Библиография
[1] | LOSSEF, S. V., LUTZ, R. J., MUNDORF, J. et al. Comparison of mechanical deformation properties of metallic stents with use of stress-strain analysis. JVIR, 5, 1994, p.341 |
[2] | VILLARS, G., |
[3] | EEBEE, H. et al. Leaks after endovascular therapy for aneurysm: Detection and classification. J. Endovasc. Surg., 3, 1996; pp.445-448 |
[4] | VEITH, F. J. et al. Guidelines for the development and use of transluminally placed endovascular prosthetic grafts in the arterial system. J. Vasc. Surg., 21, 1995, pp.670-685 |
[5] | WHITE, G., et al. Type III and Type IV Endoleak: Toward a complete definition of blood flow in the sac after endoluminal AAA Repair. J. Endovasc. Surg., 5, 1998, pp.305-309 |
[6] | ISO 11070, Sterile single-use intravascular catheter introducers |
[7] | ISO/TS 15539:2000, Cardiovascular implants - Endovascular prostheses |
[8] | ISO/IEC 17025:1999, General requirements for the competence of testing and calibration laboratories |
[9] | ISO 10555-1, Sterile, single-use intravascular catheters - Part 1: General requirements |
[10] | ISO 10555-1:1995/AMD 1, Sterile, single-use intravascular catheters - Part 1: General requirements, Amendment 1 |
[11] | ISO 10555-2:1996, Sterile, single-use intravascular catheters - Part 2: Angiographic catheters |
[12] | ISO 10555-3:1996, Sterile, single-use intravascular catheters - Part 3: Central venous catheters |
[13] | ISO 10555-4:1996, Sterile, single-use intravascular catheters - Part 4: Balloon dilatation catheters |
[14] | EN 550:1994, Sterilization of medical devices - Validation and routine control of ethylene oxide sterilization |
[15] | EN 552:1994, Sterilization of medical devices - Validation and routine control of sterilization by irradiation |
[16] | EN 554:1994, Sterilization of medical devices - Validation and routine control of sterilization by moist heat |
[17] | EN 556, Sterilization of medical devices - Requirements for medical devices to be labelled "sterile" |
[18] | EN 868-1:1997, Packaging materials and systems for medical devices which are to be sterilized - Part 1: General requirements and test methods |
[19] | EN 12006-3:1998, Non-active surgical implants - Particular requirements for cardiac and vascular implants - Part 3: Endovascular devices |
[20] | AAMI ST67, Sterilization of medical devices - Requirements for products labeled "sterile" (in preparation) |
[21] | Cook, R. and Young, W. C, Advanced mechanics of materials, 2nd Ed., 1999 |
[22] | Young, W. C., Roark's formulas for stress and strain. Case 1A, 6th edition, 1989 |
[23] | ISO 17475, Corrosion of metals and alloys - Electrochemical test methods - Guidelines for conducting potentiostatic and potentiodynamic polarization measurements |
[24] | ASTM B117-03, Standard practice for operating salt spray (fog) apparatus |
[25] | ASTM D638-03, Standard test method for tensile properties for plastics |
[26] | ASTM F746-04, Standard test method for pitting or crevice corrosion of metallic surgical implant materials |
[27] | ASTM F2079-02, Standard test method for measuring intrinsic elastic recoil of balloon-expandable stents |
[28] | ASTM F2081-01, Standard guide for characterization and presentation of the dimensional attributes of vascular stents |
[29] | ASTM F2129-04, Standard test method for conducting cyclic potentiodynamic polarization measurements to determine the corrosion susceptibility of small implant devices |
[30] | ASTM G5-94 (2004), Standard reference test method for making potentiostatic and potentiodynamic anodic polarization measurements |
[31] | ASTM G15-04, Standard terminology relating to corrosion and corrosion testing |
[32] | ASTM G61-86 (2003), Standard test method for conducting cyclic potentiodynamic polarization measurements for localized corrosion susceptibility of iron-, nickel-, or cobalt-based alloys |
[33] | ASTM G102-89 (2004), Standard practice for calculation of corrosion rates and related information from electrochemical measurements |
Электронный текст документа
и сверен по:
, 2014

