ГОСТ Р ИСО 14708-3-2016
Группа Р29
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИМПЛАНТАТЫ ДЛЯ ХИРУРГИИ
Активные имплантируемые медицинские изделия
Часть 3
Имплантируемые нейростимуляторы
Implants for surgery. Active implantable medical devices. Part 3. Implantable neurostimulators
ОКС 11.040.40
ОКП 944480
Дата введения 2017-10-01
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью "Научно-технический центр "МЕДИТЭКС" (ООО "НТЦ "МЕДИТЭКС") на основе собственного перевода англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 011 "Медицинские приборы, аппараты и оборудование"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 21 октября 2016 г. N 1487-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 14708-3:2008* "Имплантаты для хирургии. Активные имплантируемые медицинские изделия. Часть 3. Имплантируемые нейростимуляторы" (ISO 14708-3:2008 "Implants for surgery - Active implantable medical devices - Part 3: Implantable neurostimulators", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации и действующие в этом качестве межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в годовом (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Настоящий стандарт определяет частные требования к активным имплантируемым медицинским изделиям, предназначенным для электрической стимуляции центральной или периферической нервной системы в целях обеспечения безопасности использования как для пациентов, так и для специалистов. Настоящий стандарт вносит изменения и дополнения в ИСО 14708-1:2000, именуемый в дальнейшем ИСО 14708-1. Требования настоящего стандарта являются приоритетными по отношению к требованиям ИСО 14708-1.
Изделия, которые используют электричество для стимуляции нервной системы, называют нейростимуляторами. Они производят контролируемые электрические импульсы, которые передаются через электроды, зафиксированные в зоне предполагаемой стимуляции. В полностью или частично имплантируемых нейростимуляторах импульс стимуляции передается на электроды от генератора формы импульса. Для этого, как правило, требуется проводник или кабель-удлинитель, но при использовании новых видов изделий они необязательны. Для настройки параметров изделия может быть применено внешнее программирующее устройство.
В настоящее время существует несколько видов нейростимуляторов для лечения центральной или периферической нервной системы. Настоящий стандарт применим к нейростимуляторам различных видов терапии (см. раздел 3 в части определения типа изделия).
Действие настоящего стандарта распространяется на все части и принадлежности имплантируемых нейростимуляторов, в том числе на программатор, испытательный образец, программное обеспечение и техническую документацию. Не все детали и принадлежности предназначены для полной или частичной имплантации, но поскольку некоторые неимплантируемые части и принадлежности могут повлиять на безопасность или стабильность работы изделия, то к ним также необходимо определить ряд требований.
В настоящую редакцию стандарта не включены требования к функциям имплантируемых нейростимуляторов в части измерения физиологических параметров. Они могут быть рассмотрены в последующих редакциях.
В настоящем стандарте для внесения изменений и дополнений в ИСО 14708-1 используются следующие термины:
- "Замена" означает, что соответствующие пункты ИСО 14708-1 полностью заменены текстом настоящего стандарта;
- "Дополнение" означает, что текст настоящего стандарта является дополнительным к требованиям ИСО 14708-1;
- "Изменение" означает, что соответствующие пункты ИСО 14708-1 изменены в соответствии с текстом настоящего стандарта;
- "Не применяют" означает, что соответствующий раздел ИСО 14708-1 в настоящем стандарте не применяется.
Дополнительные подпункты, рисунки и таблицы к ИСО 14708-1 пронумерованы начиная с 101; дополнительные приложения обозначены буквами АА, ВВ и т.д.
1 Область применения
Настоящий стандарт распространяется на активные имплантируемые медицинские изделия, предназначенные для электрической стимуляции центральной или периферической нервной системы.
Настоящий стандарт также распространяется на все неимплантируемые части и принадлежности имплантируемых нейростимуляторов, как определено в разделе 3.
Методы испытаний, приведенные в настоящем стандарте, являются типовыми для оценки соответствия образцов изделий и не предназначены для регулярных испытаний выпускаемой продукции.
Примечание - Настоящий стандарт не распространяется на неимплантируемые нейростимуляторы. Тем не менее, он распространяется на испытательные образцы устройств из-за их тесного взаимодействия с имплантируемыми нейростимуляторами.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на стандарты и другие нормативные документы*, которые необходимо учитывать при его использовании. Для датированных ссылок применяют только указанные издания. Для недатированных ссылок применяют самые последние издания (включая любые изменения и поправки).
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 14708-1, Implants for surgery - Active implantable medical devices - Part 1: General requirements for safety, marking and for information to be provided by the manufacturer (Имплантаты хирургические - Активные имплантируемые медицинские изделия. Часть 1. Общие требования к безопасности, маркировке и информации, предоставляемой изготовителем)
IEC 60601-1:2005, Medical electrical equipment - Part 1: General requirements for basic safety and essential performance (Электроаппаратура медицинская. Часть 1. Общие требования к общей безопасности и существенные рабочие характеристики)
IEC 60601-1-2:2007, Medical electrical equipment - Part 1-2: General requirements for basic safety and essential performance - Collateral standard: Electromagnetic compatibility - Requirements and tests (Электроаппаратура медицинская. Часть 1-2. Общие требования к базовой безопасности и основной эксплуатационной характеристике. Дополняющий стандарт. Электромагнитная совместимость. Требования и испытания)
IEC 61000-4-3:2002, Electromagnetic compatibility (EMC) - Part 4-3: Testing and measurement techniques - Radiated, radio-frequency, electromagnetic field immunity test (Электромагнитная совместимость. Часть 4-3. Методики испытаний и измерений. Испытание на невосприимчивость к воздействию электромагнитного поля с излучением на радиочастотах)
ANSI/AAMI PC69:2000, Active implantable medical devices - Electromagnetic compatibility - EMC test protocols for implantable cardiac pacemakers and implantable cardioverter defibrillators (Активные имплантируемые медицинские устройства - Электромагнитная совместимость - Программа испытаний электромагнитной совместимости для имплантируемых кардиостимуляторов и имплантируемых карди-овертер-дефибрилляторов)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 14708-1, а также следующие термины с соответствующими определениями:
3.101 имплантируемый нейростимулятор; ИНС (implantable neurostimulator): Активное имплантируемое медицинское изделие, предназначенное для электрической стимуляции центральной или периферической нервной системы.
Примечание - Согласно настоящему стандарту имплантируемый нейростимулятор может являться как единым изделием, так и системой, состоящей из частей и принадлежностей, которые взаимодействуют друг с другом для обеспечения производительности изделия, заявленной изготовителем. Не все из этих компонентов или принадлежностей могут быть частично или полностью имплантированы, например, программатор, изделие пробных измерений и радиочастотные передатчики.
3.102 имплантируемый генератор импульсов; ИГИ (implantable pulse generator): Имплантируемая часть, применяемая в определенных типах нейростимуляторов, как правило, состоящая из источника питания и электронной схемы, которая генерирует стимулирующие импульсы напряжения или тока.
Примечание - Полный комплект нейростимулятора включает в себя средство передачи выходного импульса к участку стимуляции.
3.103 РЧ передатчик (RF transmitter): Неимплантируемая часть, применяемая в определенных типах нейростимуляторов, как правило, состоящая из источника питания и электронной схемы, которая генерирует выходные электрические импульсы, передаваемые через антенну к имплантированному РЧ-приемнику
_______________
РЧ - радиочастотный.
3.104 РЧ приемник (RF receiver): Имплантируемая часть, применяемая в определенных типах нейростимуляторов, которая преобразует электрический импульс, полученный от внешнего РЧ передатчика, в стимулирующие импульсы напряжения или тока.
3.105 испытательный образец (trial screener): Неимплантируемый нейростимулятор, который используется для стимуляции в течение испытательного периода. Как правило, состоит из источника питания и электронной схемы, генерирующей импульсы напряжения или тока передаваемые в область стимуляции посредством проводника или проводников.
Примечание - В рамках настоящего стандарта испытательный образец рассматривается в качестве принадлежности имплантируемого нейростимулятора.
3.106 расчетный срок службы (projected service life): Период после имплантации, в течение которого имплантируемый нейростимулятор соответствует заявленным техническим характеристикам.
3.107 ИУ (DUT): Испытуемое устройство (изделие), в том числе проводники.
3.108 требуемая производительность (essential performance): Производительность, необходимая для отсутствия недопустимого риска.
Примечание - Подробнее об основных требованиях производительности см. МЭК 60601-1.
4 Обозначения и сокращения
Применяют соответствующий раздел ИСО 14708-1.
5 Общие требования к неимплантируемым частям
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
Дополнение:
Примечание 3 - Этот пункт относится к радиочастотным передатчикам, испытательным образцам и программаторам. Подкожный провод может быть использован с испытательным образцом и считается имплантируемой частью.
6 Требования к активным имплантируемым медицинским изделиям определенных видов
Дополнительные подпункты:
6.101 Измерение характеристик импульса стимуляции
Настоящий подпункт описывает единый метод измерения для ряда характеристик импульса стимуляции (амплитуды, длительности импульса, частоты и формы импульса). Технические характеристики, указанные изготовителем в сопроводительной документации (см. подпункт 28.8), должны соответствовать результатам, полученным при испытаниях согласно настоящему методу.
Если нейростимулятор имеет несколько каналов или выходных режимов (например, биполярные или однополярные), необходимо определить характеристики каждого канала или режима. Испытания проводят для всех рабочих состояний изделия, т.е. для каждого канала (режима работы) отдельно или для всех одновременно.
В сопроводительных документах должны быть указаны условия испытаний и настройки изделия, применимые к характеристикам импульса стимуляции (см. подпункт 28.8).
Примечание 1 - К условиям испытаний относятся, например, температура окружающей среды и какие-либо особые условия, которые необходимо соблюдать во время измерений. К параметрам изделия относятся, например, значения частоты и длительности импульса, которые необходимо устанавливать во время измерения амплитуды.
Испытуемый образец должен быть репрезентативен по отношению к серийным изделиям, быть в нормальном рабочем состоянии и не иметь показаний для замены (см. подпункт 19.2).
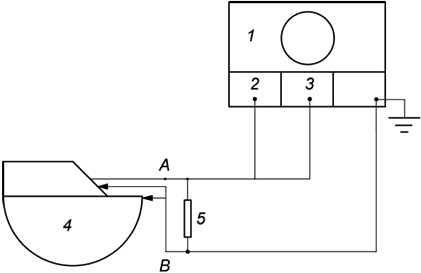
Метод испытания. Генератор импульсов (т.е. ГИ, РЧ приемник, устройство пробных измерений) подключается к нагрузке сопротивлением и измерительному оборудованию, как показано на рисунке 101. Значения сопротивления
определяются изготовителем, исходя из сопротивления стимулируемых тканей. В самом простом случае для определения характера работы измерения необходимо проводить на стандартном и максимальном сопротивлениях. Для имитации реальных условий эксплуатации может быть использовано комплексное сопротивление. Кроме того, измерения следует выполнять с использованием номинального сопротивления
, равного 499 Ом с погрешностью ±1%. Также обязательным является указание сопротивлений нагрузки, используемых для получения импульсов стимуляции с характеристиками, указанными в сопроводительных документах (см. подпункт 28.8).
Точки и
, как показано на рисунке 101, представляют собой прямой электрический выход генератора импульсов или электропроводники на дистальном конце проводника (или кабеля-удлинителя), в том случае если они применяются. Изготовитель должен однозначно указать точную конфигурацию, применимую для импульсов стимуляции с характеристиками, указанными в сопроводительной документации (см. подпункт 28.8).
Примечание 2 - Конфигурация зависит от точки измерения и сочетаний импульсов генератора, проводников и кабелей-удлинителей (если они применяются).
При выполнении этих измерений, формы импульсов каждого канала должны быть охарактеризованы и описаны в соответствующей документации (см. подпункт 28.8). Также необходимо описать все варианты формы импульсов между каналами, режимы вывода, режимы работы или условия нагрузки.
Допустимая погрешность измерения испытательной установки для измерения характеристик импульса стимуляции должна находиться в диапазоне ±5%. Испытательное оборудование и испытуемый образец должны находиться при комнатной температуре.
1 - осциллограф; 2 - канал 1; 3 - триггер; 4 - генератор импульсов; 5 - нагрузка (требуемая)
Рисунок 101 - Испытательная установка для измерения характеристик импульса стимуляции
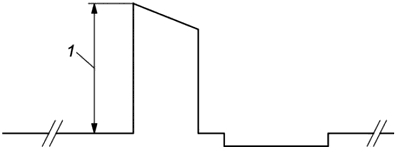
Амплитуду импульса измеряют от основания (перед началом импульса) до пика, как показано на рисунке 102. В зависимости от условий результат выражают в вольтах или миллиамперах. Возможно использование других единиц измерения по усмотрению изготовителя.
1 - амплитуда
Рисунок 102 - Измерение амплитуды импульса
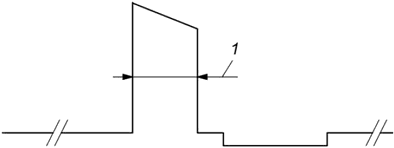
Ширину импульса измеряют между точками на уровне половинной пиковой амплитуды, как показано на рисунке 103. Результат выражают в микросекундах. Возможно использование других единиц измерения по усмотрению изготовителя.
1 - ширина импульса (в точке половинной пиковой амплитуды)
Рисунок 103 - Измерение ширины импульса
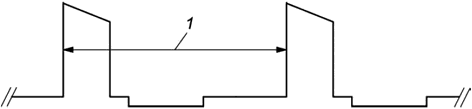
Частоту импульсов определяют путем измерения интервала от переднего фронта одного импульса до переднего фронта следующего импульса на том же уровне (рисунок 104). Фактическое значение частоты равно обратной величине измеренного интервала. Результат выражают в герцах (Гц). Возможно использование других единиц измерения по усмотрению изготовителя.
1 - интервал между импульсами (в точке половинной амплитуды)
Рисунок 104 - Измерение интервала импульса для расчета частоты
6.102 Измерение сопротивления проводника или кабеля-удлинителя при постоянном токе
Настоящий подпункт описывает единый метод измерения сопротивления проводника или кабеля-удлинителя при постоянном токе. Технические характеристики, указанные изготовителем в сопроводительной документации (см. 28.8), должны соответствовать результатам, полученным при испытаниях согласно настоящему методу.
Если проводник или кабель-удлинитель состоят из нескольких проводов, то для каждого провода необходимо определить сопротивление при постоянном токе.
Также в сопроводительной документации должны быть указаны условия испытаний проводника или кабеля-удлинителя для определения сопротивления при постоянном токе (см. 28.8).
Примечание - Под условиями испытания подразумевается, например, температура окружающей среды и прочие особые условия проведения измерений.
Испытуемый образец должен быть репрезентативен по отношению к серийным изделиям, быть в нормальном рабочем состоянии и не иметь показаний для замены.
Метод тестирования. Для проведения измерений используют четырехполюсный омметр (с компенсацией смещения). Сопротивление при постоянном токе проводника и кабеля-удлинителя измеряют между проксимальным и дистальным концами каждого проводящего элемента. Результаты выражают в омах. Возможно использование других единиц измерения по усмотрению изготовителя.
Допустимая погрешность измерения испытательной установки для измерения сопротивления проводника или кабеля-удлинителя при постоянном токе должна находиться в диапазоне ±5%. Испытательное оборудование и испытуемый образец должны находиться при комнатной температуре.
7 Общие требования к упаковке
Применяют соответствующий раздел ИСО 14708-1.
8 Общая маркировка активных имплантируемых медицинских изделий
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
8.2 Дополнение:
Примечание - Требования не распространяются на временные провода и провода, не предназначенные для имплантации.
Дополнительные подпункты:
8.101 В случае особых условий транспортирования изделия на упаковку должна быть нанесена соответствующая маркировка (см., например, ИСО 780 [1] или ИСО 15223 [2]).
Соответствие проверяют в ходе осмотра.
8.102 Допустимые условия окружающей среды транспортирования должны быть обозначены маркировкой на внешней стороне транспортной упаковки.
Соответствие проверяют в ходе осмотра.
9 Маркировка на товарной упаковке
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
9.4 Дополнение:
Для следующих компонентов должна быть указана дополнительная информация, приведенная ниже:
a) Имплантируемый генератор импульсов (ИГИ) и испытательный образец:
- число электропроводников и каналов;
- вид выходного сигнала: постоянный ток или постоянное напряжение;
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
b) Проводник:
- тип проводника (хирургический, подкожный, наручный, ЦНС, периферический и т.д.);
_______________
ЦНС - центральная нервная система.
- число электропроводников в проводнике;
- длина проводника (в сантиметрах);
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
c) Кабель-удлинитель:
- тип кабеля (низкопрофильный, раздвоенный и т.д.);
- число электропроводников в кабеле;
- длина кабеля-удлинителя (в сантиметрах);
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
d) РЧ приемник:
- число электропроводников и каналов;
- вид выходного сигнала: постоянный ток или постоянное напряжение;
- максимальная рекомендуемая глубина имплантации;
- средства идентификации соответствующего радиочастотного передатчика;
- средства идентификации соответствующего проводника, в случае если он является присоединяемым;
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
e) РЧ передатчик:
- число каналов;
- максимальная рекомендуемая глубина имплантации;
- средства идентификации соответствующего радиочастотного приемника;
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
Дополнительный подпункт:
9.101 Если изделие предназначено для однократного использования, это должно быть указано на упаковке.
10 Конструкция товарной упаковки
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
10.3 Изменение:
Испытание заменено подпунктом 7.1.3, перечисление b) МЭК 60601-1:2005.
Примечание - Предметом испытания не являются съемные наклейки (например, временные наклейки, используемые в процессе производства), которые содержат дополнительные данные, помимо информации, определенной в разделе 9.
11 Маркировка на стерильном пакете
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
Дополнительный подпункт:
11.101 Для приведенных ниже компонентов маркировка на стерильном пакете должна содержать следующую дополнительную информацию:
a) Имплантируемый генератор импульсов (ИГИ):
- число электропроводников и/или каналов;
- вид выходного сигнала: постоянный ток или постоянное напряжение;
- максимальная рекомендуемая глубина имплантации;
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
b) Проводник:
- тип проводника (хирургический, подкожный, наручный, ЦНС, периферический и т.д.);
- число электропроводников в проводнике;
- длина проводника (в сантиметрах);
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
c) Кабель-удлинитель:
- тип кабеля (низкопрофильный, раздвоенный и т.д.);
- число электропроводников в кабеле;
- длина кабеля-удлинителя (в сантиметрах);
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
d) РЧ приемник:
- максимальная рекомендуемая глубина имплантации;
- средства идентификации соответствующего радиочастотного передатчика;
- средства идентификации соответствующего проводника, если он является присоединяемым;
- любая дополнительная информация и соответствующие характеристики, необходимые для идентификации изделия.
Соответствие проверяют в ходе осмотра.
12 Конструкция одноразовой упаковки
Применяют соответствующий раздел ИСО 14708-1.
13 Маркировка активных имплантируемых медицинских изделий
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
13.1 Изменение:
Тест на влажное протирание, после которого маркировка должна оставаться читаемой, заменен пунктом 7.1.3, перечисление b) МЭК 60601-1:2005.
14 Защита от непреднамеренных биологических воздействий, вызванных активным имплантируемым медицинским изделием
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
14.2 Замена:
Любая часть активного имплантируемого медицинского изделия, которая при нормальном использовании контактирует с жидкими средами организма человека, должна быть оценена на отсутствие выделения опасного числа твердых частиц.
Методика тестирования. Активное имплантируемое медицинское изделие асептически извлекают из одноразовой упаковки. Имплантируемую часть погружают в пригодный для инъекций раствор соли 9 г/л, находящийся в нейтральном стеклянном контейнере. Объем соляного раствора должен примерно в (5±0,5) раз превышать объем испытуемой части. Контейнер накрывают стеклянной пластиной и выдерживают в течение временного промежутка от 8 до 18 ч при температуре (37±2)°С, периодически встряхивая. Затем готовят контрольный раствор аналогичного объема с той же концентрацией соли, поддерживают те же условия, что и в контейнере с образцом. Образец жидкости из контейнера сравнивают с образцом контрольного раствора с помощью аппаратуры для автоматического измерения размеров частиц, работающей по принципу оптического затенения (к примеру, метод 2.9.19 Европейской Фармакопеи, 3 издание, 1977 (Совет Европы) [3]). При тестировании применяют процедуру отбора образцов, рекомендованную изготовителем.
Отношение среднего числа частиц, выделяющихся из образца, к среднему числу частиц, выделяющихся из контрольного раствора, не должно превышать число, определенное изготовителем как небезопасное. Если изготовитель не определил это число, среднее число частиц не должно превышать 100 частиц/мл для частиц размерами более 5,0 мкм и 5 частиц/мл для частиц размерами более 25 мкм.
Соответствие должно быть подтверждено проверкой анализа конструкции, предоставленного изготовителем, при необходимости - дополнительно расчетами изготовителя и данными тестовых исследований.
14.3 Дополнение:
Биологическая совместимость может быть оценена в соответствии с частями ИСО 10993, например, ИСО 10993-1.
15 Защита пациента или пользователя от вреда, вызванного внешними физическими особенностями активного имплантируемого медицинского изделия
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
15.1 Изменение:
Пункт 23 МЭК 60601-1:1988 заменен на подраздел 9.3 МЭК 60601-1:2005 (см. раздел 5).
Соответствие должно быть проверено согласно МЭК 60601-1.
16 Защита пациента от вреда, вызванного электрическим током
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
16.1 Изменение:
Пункт 19 МЭК 60601-1:1988 заменен на подраздел 8.7 МЭК 60601-1:2005 (см. раздел 5).
16.2 Дополнение:
Если результаты оценки степени риска или другие данные (например, опубликованные данные исследований, тестовые исследования, расчеты) укажут, что для отдельных видов применения предел не должен превышать 1 мкА, для снижения риска допустимый предел должен быть изменен.
Примечание - Настоящий пункт предназначен для имплантируемых частей, которые зависят от источника электрической энергии, таких как РЧ приемники.
16.3 Замена:
Изолирующие части имплантируемых проводников или кабелей-удлинителей, включающие в себя электропроводники, должны быть сконструированы таким образом, чтобы выдерживать электрическое напряжение, приложенное к изоляции в нормальных условиях работы в течение запланированного срока службы изделия.
Соответствие должно быть подтверждено проверкой анализа конструкции, предоставленного изготовителем, при необходимости - дополнительно расчетами изготовителя и данными тестовых исследований.
Дополнительный подпункт:
16.101 Конструкция нейростимулятора должна включать в себя защиту электрических характеристик выходного импульса от случайных изменений.
Примечание 1 - Примеры случайных изменений: избыточная плотность заряда, избыточное напряжение, внезапные изменения амплитуды стимуляции и скорости распространения и т.д.
Соответствие должно быть подтверждено проверкой анализа конструкции, предоставленного изготовителем, при необходимости - дополнительно расчетами изготовителя и данными тестовых исследований.
Примечание 2 - Анализ может быть включен в результаты анализа рисков, который проводится в соответствии с 19.3.
17 Защита пациента от вреда, вызванного тепловыделениями
Замена:
Ни одна из наружных поверхностей имплантируемой части нейростимулятора не должна нагреваться более чем на 2°С выше нормальной температуры тела пациента как при стабильной работе, так и в условиях единичного отказа, если изготовитель не укажет, что более значительное повышение температуры целесообразно для применения в особых случаях.
Для подтверждения соответствия необходимо проанализировать документацию изготовителя, включая результаты моделирования, анализ конструкции или оценку степени риска, тестовые исследования или другие соответствующие документы.
Примечание - Современные исследования показывают, что в зависимости от местоположения определенной ткани в теле человека температурный предел 2°С накладывает излишние ограничения. Учитывая это обстоятельство, изготовитель может привести свое обоснование.
18 Защита от ионизирующего излучения, выделяемого или испускаемого активным имплантируемым медицинским изделием
Применяют соответствующий раздел ИСО 14708-1.
19 Защита от непреднамеренных воздействий, вызванных изделием
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
19.2 Замена:
Если срок службы (см. 3.106) имплантируемого нейростимулятора зависит от встроенного источника электроэнергии, такого как батарея, изготовитель должен предусмотреть в изделии индикатор, предупреждающий о низком заряде источника электроэнергии. Изготовитель также должен определить продолжительность срока службы источника электроэнергии после предупреждения о низком заряде.
Для подтверждения соответствия используется анализ конструкции, представленный изготовителем и подтвержденный результатами испытаний в соответствующей форме.
Примечание - Настоящий подпункт также применим к перезаряжающимся источникам энергии.
19.3 Замена:
Конструкция имплантируемого нейростимулятора должна исключать возможность возникновения недопустимого риска в случае отказа любого из компонентов, части изделия или программного обеспечения (если изделие имеет встроенную электронную систему программирования).
Метод оценки. Оценка рисков и менеджмент рисков осуществляются в соответствии с опубликованными стандартами, такими как ИСО 14971 [5].
Соответствие должно быть подтверждено отчетами менеджмента риска или эквивалентными документами изготовителя.
19.4 Изменение:
Система оценки изменена для возможности проведения клинических исследований в соответствии с опубликованными стандартами, такими как ИСО 14155-1 [6] или ИСО 14155-2 [7].
20 Защита изделия от повреждений, вызванных применением наружных дефибрилляторов
Применяют соответствующий раздел ИСО 14708-1.
21 Защита изделия от изменений, вызванных электрическими полями высокой энергии, приложенными непосредственно к пациенту
Применяют соответствующий раздел ИСО 14708-1.
22 Защита активного имплантируемого медицинского изделия от изменений, вызванных применением разнородных видов лечения
Дополнение:
Должно быть рассмотрено влияние других методов диагностики и лечения, таких как магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ), ультразвуковое исследование (УЗИ), литотрипсия и т.д. Соответствие подтверждается обзором документации изготовителя, в том числе результатов моделирования, проектирования или оценки рисков, результатами испытаний и другими соответствующими данными.
23 Защита активного имплантируемого медицинского изделия от воздействия механических сил
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
23.1 Замена:
Неимплантируемые части имплантируемого нейростимулятора должны соответствовать подразделу 15.3 МЭК 60601-1:2005 (см. раздел 5). Неимплантируемые части, переносимые пациентом, должны выдерживать по три удара в трех различных направлениях, которые могут случиться при нормальном использовании (см. подпункт 15.3.4.1 МЭК 60601-1:2005).
Соответствие должно быть проверено согласно МЭК 60601-1.
23.2 Изменение:
Конструкция имплантируемых частей нейростимулятора должна выдерживать механическое воздействие, которое может возникнуть при нормальных условиях использования:
a) рабочая полоса частот: от 5 до 500 Гц;
b) спектральная плотность мощности: 0,7 (м/с)
/Гц;
c) форма спектральной плотности мощности: плоская горизонтальная от 5 до 500 Гц;
d) продолжительность тестирования: 30 мин по каждой из трех взаимно перпендикулярных осей.
24 Защита активного имплантируемого медицинского изделия от повреждений, вызванных электростатическим разрядом
Замена:
Неимплантируемые части имплантируемого нейростимулятора должны соответствовать пункту 6.2.2 МЭК 60601-1-2:2007 (см. раздел 5).
Соответствие проверяют по МЭК 60601-1-2.
25 Защита активного имплантируемого медицинского изделия от повреждений, вызванных изменениями атмосферного давления
Применяют соответствующий раздел ИСО 14708-1.
26 Защита активного имплантируемого медицинского изделия от повреждений, вызванных изменениями температуры
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
26.1 Изменение:
Раздел 42 МЭК 60601-1:1998 заменен подразделом 11.1 МЭК 60601-1:2005 (см. раздел 5).
27 Защита активного имплантируемого медицинского изделия от электромагнитного неионизирующего излучения
Замена:
27.101 Помехоустойчивость
Имплантируемые части нейростимулятора не должны наносить вред или вызывать локальное увеличение плотности электрического тока в теле пациента вследствие восприимчивости к электрическим воздействиям внешних электромагнитных полей, неисправности, повреждения или нагрева изделия.
Соответствие должно быть подтверждено анализом результатов испытаний и документацией, подготовленной изготовителем, для испытаний согласно 27.103-27.106.
27.102 Общие условия испытаний
a) Режим работы
Во время испытания на помехоустойчивость все функции имплантируемого нейростимулятора, связанные с основными функциональными характеристиками, должны быть испытаны в режимах наиболее важных с точки зрения состояния пациента, определенных на основании анализа рисков. В испытательной документации должны быть перечислены функции и используемые режимы.
Примечание - Например, основные характеристики могут быть связаны с амплитудой импульса или другими выходными характеристиками, изменение которых может быть опасным.
b) Критерии эффективности
В условиях проведения испытаний, указанных в разделе 27, каждая функция имплантируемого нейростимулятора [см. подпункт 27.102, перечисление а)] должна быть оценена с точки зрения общей производительности с применением соответствующих критериев, указанных в таблице 101. Если производительность испытуемого изделия удовлетворяет требуемым критериям, регламент теста (тестов) выполнен. По критерию ухудшение характеристик, потеря функции или непредусмотренная реакция являются допустимыми, если это не приводит к недопустимому риску.
Примечание - Оценка степени риска может показать, что опасность, созданная в результате ухудшения характеристик, потери функции или непредвиденной реакции, не приводит к недопустимому риску.
Следующие отклонения не допустимы:
- отказ элементов;
- изменения программируемых параметров настроек;
- сброс к заводским настройкам;
- изменение режима работы;
- ложные тревоги;
- начало любой непреднамеренной работы.
Таблица 101 - Общие критерии качества испытуемого изделия для испытаний помехоустойчивости согласно разделу 27
Критерий | Во время теста | После теста | Результаты теста |
Работа в соответствии с назначением | Работа в соответствии с назначением | 27.103 - 1 мТл | |
Отсутствие потерь функции | Отсутствие потерь функции | 27.104 - | |
Отсутствие непредусмотренной реакции | Отсутствие ухудшений характеристик | 27.105 - 16 В/м | |
Допускается, если отсутствует неприемлемый риск: | Работа в соответствии с назначением | 27.103 - 50 мТл | |
Ухудшение характеристик | Отсутствие потерь функции | 27.104 - | |
Потеря функций | Отсутствие ухудшений характеристик | 27.105 - 140 В/м | |
Непредусмотренная реакция | Соответствует техническим характеристикам изделия | ||
Определяется изготовителем | Определяется изготовителем | 27.106 - дополнительные значения |
Тестовая документация должна включать в себя подробную информацию об используемых критериях качества, описание методов, используемых для проверки производительности, обоснование любых используемых допущений настоящего подпункта и отчет о результатах испытаний, в котором указаны характеристики ИУ относительно критериев,
или
.
В сопроводительной документации должны быть описаны выявленные в результате проверки помехоустойчивости ИУ электромагнитные помехи, о которых пациенту необходимо знать или избегать их (см. подпункт 28.22).
c) Конструкция ИУ
Конструкция ИУ включает ИГИ, проводник и любую другую имплантируемую часть, необходимую для работы изделия. Длина проводника и его расположение для каждого испытания приведены в описании испытательной установки.
Нейростимуляторы, которые имеют более одной допустимой конфигурации электродов для стимуляции, такие как биполярные или однополярные, необходимо испытывать с электродом, наиболее восприимчивым к электромагнитным помехам.
Примечание - Наиболее подвержены воздействию магнитного поля однополярные электроды. Восприимчивость электрических полей, как правило, зависит от конструктивного исполнения нейростимулятора.
Документация по тестированию должна содержать описание конфигурации ИУ и условий окружающей среды, в которых проводится испытание (например, температура и давление).
d) Проверка не наблюдаемых в норме функций
Необходимо предусмотреть методы проверки функций, которые не наблюдаются или не проверяется при нормальной работе [см. подпункт 27.102, перечисление а)]. Для этого может потребоваться использование специальных аппаратных или программных средств.
e) Имплантируемые нейростимуляторы, использующие беспроводную телеметрию
Критерий для проверки функции телеметрии применяется в виде исключения для удовлетворения требований подпункта 27.102, перечисление а). Все остальные функции должны соответствовать указанным требованиям.
Группа исключений не должна быть больше, чем это необходимо для работы в соответствии с назначением.
f) Имплантируемый РЧ приемник нейростимулятора
Для нейростимуляторов, конструкция которых основана на неимплантируемом РЧ передатчике и имплантируемом РЧ приемнике, испытания проводят в соответствии с МЭК 60601-1-2. За основу установки для испытаний имплантируемой части должна быть взята установка, описанная в 27.105.
Примечание - Испытание, описанное в разделе 27 настоящего стандарта, не применяется. Имплантируемый РЧ приемник работает совместно с неимплантируемым передатчиком, на который распространяется МЭК 60601-1-2. РЧ приемник можно подвергать только проверке на помехоустойчивость согласно МЭК 60601-1-2.
27.103 Защита от постоянного магнитного поля
Оценку работы имплантируемого нейростимулятора при постоянных магнитных полях проводят путем воздействия на ИУ двух уровней статических (не изменяющихся во времени) полей.
Метод тестирования. Общие условия испытаний описаны в 27.102.
Уровни испытания. Используют два уровня напряженности электромагнитного поля, к каждому применяют различные критерии качества. ИУ должно быть подвергнуто воздействию магнитного поля нижнего уровня индукции 1 мТл с применением критерия качества , как указано в 27.102, перечисление b). Второй уровень магнитной индукции, равный 50 мТл, должен быть использован с применением критерия качества
.
Схема измерения. Устройство генерирования магнитного поля должно воспроизводить поле с однородностью от 0 до 3 дБ на площади радиусом минимум 7,5 см, лежащей в параллельной к аппарату плоскости.
Эта плоскость будет называться центральной. Однородность магнитного поля задана только в центральной плоскости, содержащей мнимые оси и
. Однородность магнитного поля не сохраняется вдоль положительного и отрицательного направлений мнимой оси
, которая проходит через центр изделия перпендикулярно к центральной плоскости.
Для большинства схем испытаний (см. подпункт 27.102) площадь равномерного поля радиусом 7,5 см достаточна для покрытия ИУ. Иначе площадь равномерного поля следует увеличивать до удовлетворения требованиям настоящего подпункта.
ИУ размещают в центре центральной плоскости, в котором магнитное поле является наиболее равномерным. Плоскость поверхности ИУ должна быть расположена параллельно центральной плоскости (это обеспечивает размещение поверхности нейростимулятора в области наибольшей концентрации первичных линий магнитного потока, которые перпендикулярны к центральной плоскости). Такое расположение является обязательным для ИУ.
Структура проводника не важна. Необходимо только поместить его в положение, которое облегчает контроль за нейростимулятором во время испытания. Расположение любого дополнительного оборудования, необходимого для работы нейростимулятора или контроля его выходных параметров во время испытаний, должно быть выбрано таким образом, чтобы вносить минимальные изменения в однородность поля. Выходные параметры нейростимулятора контролируют с помощью осциллографа, подключенного к резистору, который последовательно соединен с проводником.
Методика испытаний. Контроль производительности ИУ следует проводить как минимум в течение 10 мин на каждом уровне испытаний.
Оценка результатов испытаний. Необходимо использовать критерий качества (при 1 мТл) и критерий качества
(при 50 мТл) согласно 27.102, перечисление b).
27.104 Защита от магнитных полей в диапазоне от 10 Гц до 30 МГц
Оценку имплантируемого нейростимулятора в диапазоне частот от 10 Гц до 30 МГц проводят путем воздействия постоянных и переменных магнитных полей на ИУ.
Методика испытаний. Общие условия испытаний описаны в 27.102.
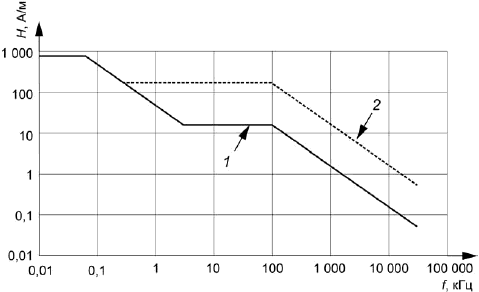
Уровни испытания. Тестовые уровни магнитного поля показаны графически на рисунке 105 (среднеквадратичное значение в А/м). Уровни испытаний варьируются в зависимости от частоты и критериев качества [см. 27.102, перечисление b)]. Сплошной линией на рисунке 105 обозначены уровни воздействия на ИУ с использованием критерия качества , как указано в 27.102, перечисление b). Пунктирной - уровни воздействия с использованием критерия качества
. В рамках этого подпункта линии именуются как
-линия и
-линия соответственно. К ИУ применяют оба набора тестовых уровней.
1 - -линия (тестовые уровни по критерию качества
); 2 -
-линия (тестовые уровни по критерию качества
)
Рисунок 105 - Тестовые уровни магнитного поля (среднеквадратичное значение)
Численные значения тестовых уровней магнитного поля в зависимости от частоты приведены в таблице 102.
Таблица 102 - Тестовые уровни магнитного поля
Диапазон частот, кГц | Уровень магнитного поля для линии | Уровень магнитного поля для линии | ||
Напряженность магнитного поля | Магнитная индукция | Напряженность магнитного поля | Магнитная индукция | |
0,01-0,06 | 795 | 1000 | - | - |
0,06-0,3 | 47,7/ | 60/ | - | - |
0,3-3,0 | 47,7/ | 60/ | 159 | 200 |
3,0-100 | 15,9 | 20 | 159 | 200 |
100-30000 | 1590/ | 2000/ | 15900/ | 20000/ |
Примечание - | ||||
Схема измерения. Однородность магнитного поля, генерируемого испытательной катушкой (катушками), должна соответствовать данным таблицы 103. Однородное поле должно существовать на площади радиусом минимум 7,5 см параллельно катушке. Эта плоскость будет называться центральной. Однородность магнитного поля задана только в центральной плоскости, содержащей мнимые оси и
. Она не сохраняется вдоль положительного и отрицательного направлений мнимой оси
, которая проходит через центр катушки перпендикулярно к центральной плоскости.
Для большинства схем испытания площадь радиусом 7,5 см равномерного поля достаточна для покрытия ИУ. Иначе площадь следует увеличить до удовлетворения требованиям настоящего подпункта.
Таблица 103 - Требование к однородности магнитного поля
|
|
| 300 Гц |
Примечание - | |
ИУ помещают в солевую ванну проводимостью 0,27 См/м (эквивалентной объемному сопротивлению 370 Ом·см) в центре центральной плоскости, где магнитное поле наиболее равномерно. Плоскость большей поверхности ИУ располагается параллельно центральной (это обеспечивает размещение поверхности насоса в области наибольшей концентрации первичных линий магнитного потока, которые перпендикулярны к центральной плоскости). Такое расположение является обязательным для ИУ.
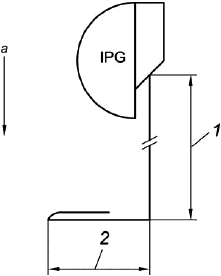
Проводник оборачивают по спирали вокруг ИГИ (см. рисунок 106), так что ИУ полностью помещается внутри однородной области магнитного поля. Общая площадь, ограниченная проводником длиной , должна составлять:
![]() . (101)
. (101)
Например, если длина проводника равна 85 см, то для удовлетворения приведенного выше требования площадь, ограниченная этим проводником, должна составлять 650 см. Это может потребовать присоединения к проводнику кабеля-удлинителя.
Также следует рассчитать площадь, ограниченную тестовым проводником. Для приблизительных расчетов можно использовать формулу (102):
![]() , (102)
, (102)
где - длина тестового провода;
- средний радиус спирали, образованной тестовым проводником.
Формула справедлива для полуокружности и применима только в данном случае. Даже если изготовитель не требует использовать эту формулу, метод можно использовать для подтверждения измерений или расчетов изготовителя и контроля соответствия допустимым значениям.
- магнитная индукция В
Рисунок 106 - ИГИ и проводник на центральной плоскости
Дополнительное оборудование, необходимое для работы и контроля выходных характеристик нейростимулятора, следует выбирать и располагать таким образом, чтобы оно вносило минимальные изменения в однородность поля. Выходные характеристики нейростимулятора можно контролировать с помощью осциллографа, подключенного к резистору, который последовательно соединен с проводником, или с помощью проводника, помещенного в солевой раствор, в качестве выводного датчика.
Методика испытания. Диапазон частот тестовых сигналов от 10 Гц до 30 МГц может меняться непрерывно либо пошагово. Если используется непрерывная развертка по частоте, то скорость развертки должна быть не более чем 0,0003 декада/с. Если пошаговая - размер шага в декаде не должен превышать , где
- начальная частота каждой декады. Начальная частота каждой декады равна: 10 Гц, 100 Гц, 1 кГц, 10 кГц, 100 кГц, 1 МГц, 10 МГц. Время задержки на каждом шаге должно быть достаточно велико, чтобы ИУ адекватно реагировало на тест-сигнал, но не менее чем 15 с.
Испытательные частоты, полученные с использованием метода пошаговой частотной развертки и удовлетворяющие минимальным требованиям, приведены в таблице 104.
Таблица 104 - Тестовые частоты, с учетом требования минимального шага развертки, кГц
0,01 | 0,02 | 0,03 | 0,04 | 0,05 | 0,06 | 0,07 | 0,08 | 0,09 |
0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | 900 |
1000 | 2000 | 3000 | 4000 | 5000 | 6000 | 7000 | 8000 | 9000 |
10000 | 20000 | 30000 | ||||||
Примечание - Частоты выражены в кГц. Таблица основана на методе использования минимального шага развертки по частоте. Использование непрерывной развертки или малого шага развертки приведет к большему числу тестовых частот. Перечисленные частоты находятся в следующей зависимости: | ||||||||
Тестовые сигналы, соответствующие линии (см. тестовые уровни), должны применяться в виде непрерывной синусоидальной волны (НСВ) сигнала во всем диапазоне частот. Тестовые сигналы, соответствующие
-линии, должны применяться в виде НСВ на частотах
3 кГц и как сигнал с импульсной модуляцией на частотах
3 кГц. Частота модуляции должна соответствовать 200 Гц, в течение 32% рабочего цикла. (Время нарастания синусной составляющей - 1,6 мс, время затухания - 3,4 мс в каждом цикле модуляции.)
Если во время тестирования частот 3 кГц на уровнях
-линии (на которых используется импульсная модуляция) ухудшаются характеристики, или происходит утрата функционирования, чего не было при начальном тестировании сигнала на уровнях
-линии (использующих тестовые сигналы НСВ), необходимо повторить тестирование импульсной модуляции сигнала (200 Гц, в течение 32% рабочего цикла) на частотах, при которых проявлялись ухудшение или потеря функций.
Испытания проводят при одной ориентации ИУ согласно описанию схемы измерения.
Оценка результатов испытаний. Критерий качества (
-линия) и критерий качества
(
-линия) применяются согласно 27.102, перечисление b).
27.105 Защита от электромагнитных полей в диапазоне от 30 до 450 МГц
Оценку имплантируемого нейростимулятора в диапазоне частот от 30 до 450 МГц проводят посредством воздействия электромагнитных полей с использованием методов испытаний и оборудования, указанных в МЭК 61000-4-3. Для целей настоящего стандарта некоторые части МЭК 61000-4-3 были изменены.
Методика испытаний. Общие условия испытаний описаны в 27.102. Применяются требования МЭК 61000-4-3, за исключением изменений, перечисленных ниже.
Уровни испытания (МЭК 61000-4-3, раздел 5). Используют два тестовых уровня поля с учетом соответствующего критерия качества. Низкий уровень поля со среднеквадратичным значением напряженности 16 В/м должен воздействовать на ИУ в диапазоне тестовых частот с учетом критерия качества согласно 27.102, перечисление b). Второй уровень поля со среднеквадратичным значением напряженности 140 В/м должен быть использован на определенных частотах таких как 30 МГц, 50 МГц, 75 МГц, 150 МГц и 450 МГц с учетом критерия качества
. Оба уровня поля представляют собой немодулированный тестовый сигнал. Ниже приведены требования к модуляции в тестовых процедурах (МЭК 61000-4-3, раздел 8).
Схема измерения (МЭК 61000-4-3, раздел 7). ИУ помещают в солевую ванну проводимостью 0,27 См/м (эквивалентной объемному сопротивлению 370 Ом·см).
Проводник размещают согласно рисунку 107. Необходимо согнуть проводник под прямым углом со сторонами и
. Длина боковой стороны
равна общей протяженности проводника (с округлением до ближайшего целого числа), умноженной на 0,62, но не более 53 см. Например, если длина проводника 85 см, длина стороны
будет равна 53 см. Остальную часть проводника размещают вдоль боковой стороны
. Длинные проводники необходимо сложить с обязательным сохранением излишка длины параллельно боковой стороне
. Сторона
должна быть ориентирована в направлении электрического поля.
Для проведения испытания размещение ИГИ должно соответствовать рисунку 107, т.к. для обеспечения воздействия электрического поля возможен только один способ расположения.
Дополнительное оборудование, необходимое для работы и контроля работы нейростимулятора, следует выбирать и располагать таким образом, чтобы устройства вносили минимальные изменения в однородность поля. Выходные характеристики нейростимулятора можно контролировать с помощью осциллографа, подключенного к резистору, который последовательно соединен с проводником, или с помощью проводника, помещенного в солевой раствор, в качестве выводного датчика.
1 - сторона ; 2 - сторона
;
- вектор
электромагнитного поля
Рисунок 107 - ИГИ и макет проводника
Методика испытания (МЭК 61000-4-3, раздел 8). Испытание должно быть проведено в поляризованном поле, которое генерирует антенна, выставленная параллельно стороне макета проводника (см. рисунок 107). Например, вертикальная поляризация поля требует расположения ИУ согласно рисунку 107. Горизонтальная поляризация поля требует, чтобы ИУ было развернуто на 90°. Если наибольшая сторона соединительного блока ИГИ выровнена со стороной проводника , то для испытания достаточно одной ориентации ИУ. Если соединительный блок ИГИ перпендикулярен к проводнику, то для испытания необходима вторая ориентация, в которой ИГИ будет выровнен с поляризацией электрического поля. В типичной безэховой камере с поляризованной антенной антенну, как правило, можно поворачивать для приведения ИУ к необходимой ориентации. Если используется гигагерцовая поперечная электромагнитная испытательная камера, необходимо тщательно ориентировать ИУ.
Для тестового уровня, равного среднеквадратичному значению 16 В/м в диапазоне необходимых тестовых частот от 30 до 450 МГц, можно применять непрерывную или пошаговую развертку. Если используется непрерывная частота развертки, то скорость развертки не должна превышать 0,0003 декады/с. Если развертка пошаговая, то размер шага должен быть не более, чем 5% предыдущей частоты, и время пребывания на каждом этапе должно быть достаточным для адекватной реакции ИУ на тест-сигнал, но не менее 15 с. Амплитудная модуляция тестовых сигналов должна составлять 80% с частотой модуляции 2 Гц. На рисунке 1 МЭК 61000-4-3:2008 определены уровень сигнала тестирования и форма волны.
Тестовый уровень со среднеквадратичным значением 140 В/м, применяется на определенных частотных участках, таких как 30 МГц, 50 МГц, 75 МГц, 150 МГц и 450 МГц. Чтобы ИУ адекватно реагировало на тест-сигнал, время задержки на каждом этапе должно быть достаточно большим (не менее 15 с). Форма немодулированного сигнала НСВ синусоидальна и показана на рисунке 1а) МЭК 61000-4-3:2002. Тестовые сигналы должны сопровождаться импульсной модуляцией с частотой 200 Гц в течение 20% времени рабочего цикла. Длительность переднего фронта синусоидальной несущей при этом составляет 1 мс, а заднего - 4 мс каждый цикл модуляции.
Оценка результатов испытаний (МЭК 61000-4-3, раздел 9). Критерий качества (16 В/м) и критерий качества
(140 В/м) применяются согласно 27.102, перечисление b).
27.106 Защита от электромагнитных полей в диапазоне от 450 МГц до 3 ГГц
Проверку имплантируемого нейростимулятора в диапазоне частот от 450 МГц до 3 ГГц проводят путем воздействия излучаемых электромагнитных полей с использованием методов испытаний и оборудования, указанных в ANSI/AAMI РС69. РС69 предназначен для имплантируемых кардиологических устройств; часть установок и процедур испытаний не применяются и были изменены.
Метод тестирования. Общие условия испытаний описаны в 27.102. Применяются требования раздела 6 ANSI/AAMI РС69:2000, кроме изменений, перечисленных ниже. Требования, связанные с подачей сигнала и программированием параметров, используемые в ANSI/AAMI РС69, не используются.
Объем выборки (ANSI/AAMI РС69:2000, подраздел 6.2). Объем выборки неприменим.
Схема испытания (ANSI/AAMI РС69:2000, подраздел 6.3). ИГИ устанавливают таким образом, чтобы он находился приблизительно в центре пересечения осей и
, как показано на рисунке В.1 РС69:2000. Такое положение ИГИ необходимо соблюдать для всех тестов.
Методика испытания (ANSI/AAMI РС69:2000, подраздел 6.4). Выполняют испытания, требуемые для тестирования по оси X (ANSI/AAMI РС69:2000, подпункт 6.4.1.1). Продолжительность воздействия должна быть не менее 15 с для того, чтобы ИУ адекватно реагировало на тест-сигнал. Повторяют с антенной, параллельной оси . Повторяют испытания по осям
и
для всех частот, перечисленных в (ANSI/AAMI РС69:2000, подпункт 6.3.4.2), используя соответствующую дипольную антенну.
Дополнительная характеристика испытания (ANSI/AAMI РС69:2000, пункт 6.4.2). Дополнительно, по усмотрению изготовителя, могут быть проверены более высокие уровни мощности.
Критерии качества (ANSI/AAMI РС69:2000, подраздел 6.5). Должен применяться критерий качества , как указано в 27.102, перечисление b). Критерии качества для дополнительной характеристики испытаний (ANSI/AAMI РС69:2000, пункт 6.4.2) определяются изготовителем.
28 Сопровождающая документация
Применяют соответствующий раздел ИСО 14708-1, за исключением следующего.
28.1 Дополнение:
В документации должна быть предоставлена дополнительная контактная информация, например, номер телефона или адрес электронной почты, на случай если изделие требует немедленного обслуживания, или пользователю понадобятся дополнительные инструкции для правильного использования.
28.12 Дополнение:
- предупреждение о возможной опасности, связанной с магнитно-резонансной томографией, если такое применение допускается.
28.19 Изменение:
Это требование относится к любой части с исчерпаемым источником энергии, не только к имплантируемым частям.
28.22 Дополнение:
- предупреждение о возможной опасности, связанной с барокамерами, если изделие можно использовать для этих целей;
- предупреждение о возможной опасности, связанной с электронным наблюдением, металлодетектором и другими системами безопасности, если такое применение допускается;
- информация о возможной опасности, связанной с электромагнитными помехами (см. раздел 27).
Дополнительные подпункты:
28.101 Сопроводительная документация должна включать в себя рекомендуемые методы для определения нормальной работы имплантируемого нейростимулятора.
Соответствие проверяют в ходе осмотра.
28.102 Сопроводительная документация должна включать в себя описание комбинаций настройки изделия и параметров, которые оказывают влияние на безопасность нейростимулятора.
Соответствие проверяют в ходе осмотра.
28.103 На каждой отдельной части сопроводительной документации должен быть указан год выпуска.
Соответствие проверяют в ходе осмотра.
28.104 Сопроводительная документация для ИГИ или РЧ приемника должна включать в себя карту пациента со следующим:
a) инструкция, разрешающая сохранение карты пациентом;
b) место для размещения следующей информации:
- модель и наименование изделия;
- серийный номер или номер партии изделия;
- идентификационные данные пациента;
- дата имплантации;
- наименование и адрес центра имплантации;
- запись о наличии у пациента имплантированного медицинского изделия.
Примечание - Карту можно предъявить представителю службы безопасности или медперсонала. Если сотрудники будут проинформированы о том, что пациент имеет имплантированное медицинское изделие, то они смогут предотвратить воздействие электромагнитных помех и полей высокой мощности.
Соответствие проверяют осмотром.
Приложение АА
(справочное)
Соответствие между фундаментальными принципами ИСО/ТО 14283 [8] и разделами настоящего стандарта
Таблица АА.1
Фундаментальные принципы ИСО/ТО 14283 | Разделы ИСО 14708-1 | Разделы настоящего стандарта и охватываемые аспекты |
3 Общие принципы | ||
3.1 Имплантаты должны быть разработаны и сконструированы таким образом, чтобы при использовании в условиях и с целью, для которых они созданы, не возникало угрозы безопасности пациентов или безопасности и жизни пользователей, а также других лиц, гарантируя тем самым, что любой риск, который может быть связан с их использованием, является приемлемым наряду с пользой для пациента или сопоставим с высоким уровнем защиты его здоровья и безопасности | 8.1 | Действует |
3.2 Решения, принятые изготовителем для разработки и конструирования имплантатов, должны соответствовать принципам безопасности с учетом общего уровня знаний и технического развития. При выборе наиболее подходящего решения изготовитель должен руководствоваться перечисленными ниже принципами в следующем порядке: | Примечание 1 | - |
3.3 Имплантаты должны достигать рабочих характеристик, предусмотренных изготовителем, и должны быть разработаны, изготовлены и упакованы таким образом, чтобы они были пригодны для выполнения одной или более функций, приведенных в подразделе 3.1 (ИСО/ТО 14283:2004), как указано изготовителем | 10.4 | Действует. |
3.4 На характеристики и изделия, приведенные в подразделах 3.1, 3.2 и 3.3 (ИСО/ТО 14283:2004), не должно быть негативного влияния в такой степени, чтобы нарушались клинические условия и безопасность пациентов и, где применимо, других лиц, в течение срока служба имплантата, указанного изготовителем, при воздействии на имплантат нагрузок, возникающих при нормальном использовании имплантата | 19.2 | Заменен. |
19.3 | Заменен. | |
23.1 | Заменен. | |
23.2 | Заменен. | |
23.3 | Действует. | |
23.4 | Действует. | |
23.5 | Действует. | |
23.6 | Действует. | |
26.1 | Изменение. | |
28.4 | Действует. | |
28.23 | Действует | |
3.5 Имплантаты должны быть разработаны, изготовлены и упакованы таким образом, чтобы на их характеристиках и работе в течение периода предполагаемого использования отрицательно не сказывались транспортирование и хранение, принимая во внимание инструкции и информацию, указанную изготовителем | 7.2 | Действует. |
10.1 | Действует. | |
10.2 | Действует. | |
10.3 | Изменение. | |
12.3 | Действует. | |
26.2 | Действует. | |
8.101 Маркировка упаковки для специального обращения во время транспортирования. | ||
3.6 В отношении любого нежелательного побочного эффекта необходимо оценить приемлемость риска относительно предполагаемых рабочих характеристик | 19.3 | Заменен. |
19.4 | Изменение | |
4 Специальные принципы, касающиеся дизайна конструкции | ||
4.1 Химические, физические и биологические свойства | ||
4.1.1 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы гарантировать характеристики и производительность, требуемые разделом 3 "Основные принципы". Особое внимание необходимо уделить: | ||
а) выбору используемых материалов, в частности оценке токсичности и, где применимо, свойствах возгораемости; | 14.3 | Дополнение. |
b) совместимости используемых материалов и биологических тканей, клеток и тканевых жидкостей, принимая во внимание предполагаемое назначение имплантата | 14.3 | Дополнение |
4.1.2 Имплантаты должны быть разработаны, изготовлены и упакованы таким образом, чтобы минимизировать риск, вызванный загрязнением и наличием остаточных веществ, для лиц, занятых транспортированием, хранением и использованием имплантатов, и пациентов, принимая во внимание предполагаемое назначение изделия. Особое внимание необходимо уделить незащищенным тканям, продолжительности и частоте воздействия | 14.2 | Заменен. |
14.3 | Дополнение | |
4.1.3 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы они могли быть использованы безопасно с материалами, веществами и газами, с которыми они контактируют при нормальном использовании или при рутинных процедурах; если предполагается использование имплантатов для доставки лекарственных веществ, то они должны быть разработаны и изготовлены таким образом, чтобы быть совместимыми с лекарственным веществом в соответствии с положениями и ограничениями для этих веществ и чтобы их рабочие характеристики поддерживались в соответствии с предполагаемым использованием | 19.5 | Действует |
4.1.4 В случае если в имплантаты включено как неотъемлемая часть вещество, которое, если применяется отдельно, может быть рассмотрено как лекарственное вещество согласно определению 2.7 (ИСО/ТО 14283:2004) и которое может воздействовать на организм дополнительно к влиянию, оказываемому изделием, его безопасность должна быть подтверждена, принимая во внимание предполагаемое использование имплантированного изделия | 14.4 | Действует |
4.1.5 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы свести к минимуму риск, вызванный утечкой вещества из имплантата | 25 | Действует |
4.1.6 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы уменьшить, насколько возможно, риски, вызванные случайным проникновением вещества в имплантат, принимая во внимание имплантат и характер окружающей среды, в которой предполагается его использовать | 25 | Действует |
4.1.7 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы минимизировать риски пациента или пользователя системы, включая программное обеспечение | 19.3 | Заменен |
4.2 Инфекция и микробное заражение | ||
4.2.1 Имплантаты и процесс их изготовления должны быть разработаны таким образом, чтобы уменьшить или устранить, насколько возможно, риск инфекции для пациента, пользователя или третьего лица. Конструкция должна позволять легкость манипулирования и, если необходимо, минимизировать инфицирование имплантата пациентом или, наоборот, во время использования | 14.1 | Действует |
4.2.2 Ткани животного происхождения должны быть поставлены от животных, подвергнутых ветеринарным контролю и надзору, адаптированным к предполагаемому применению ткани. | Примечание 2 | - |
4.2.3 Имплантаты, поставляемые стерильными, должны быть разработаны, изготовлены и упакованы в защитную упаковку, которая создает антимикробный барьер, для обеспечения их стерильности при поступлении на рынок и при условиях хранения и транспортирования, оговоренных изготовителем, до тех пор, пока упаковка не будет вскрыта или повреждена | 7.1 | Действует. |
7.2 | Действует. | |
10.1 | Действует. | |
10.2 | Действует. | |
11.7 | Действует. | |
11.9 | Действует. | |
12.1 | Действует. | |
12.2 | Действует. | |
14.1 | Действует | |
4.2.4 Имплантаты, поставляемые стерильными, должны быть изготовлены и стерилизованы, если применимо, валидированным методом | 14.1 | Действует |
4.2.5 Имплантаты, для которых предполагается стерилизация, должны быть изготовлены в соответствующих контролируемых условиях (например, окружающей среды) | 14.1 | Действует. |
14.2 | Заменен | |
4.2.6 Система упаковки нестерильных имплантатов должна поддерживать на оговоренном уровне чистоты изделие без ухудшения и, если имплантаты стерилизуют перед использованием, минимизировать риск микробного заражения; система упаковки должна соответствовать методу стерилизации, указанному изготовителем | Примечание 3 | - |
4.2.7 Упаковка и/или этикетка имплантата должны устанавливать различие между идентичными или похожими изделиями в стерильном и нестерильном состояниях | Примечание 3 | - |
4.3 Свойства конструкции и окружающей среды | ||
4.3.1 Если имплантат предназначен для использования совместно с другим изделием или оборудованием, вся комбинация, включая систему соединений, должна быть безопасной и не должна ухудшать специфических свойств изделия. Любые ограничения по использованию должны быть указаны на этикетке или в инструкции по применению | 9.9 | Действует. |
11.8 | Действует. | |
23.6 | Действует. | |
28.4 | Действует. | |
28.5 | Действует | |
4.3.2 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы устранить или минимизировать, насколько это возможно: | ||
а) риск травмы с учетом их физических особенностей, таких как соотношение объем/давление, размерами и, если применимо, эргономическими особенностями; | 15.1 | Дополнение. |
15.2 | Действует. | |
b) риски, связанные с разумными, предсказуемыми условиями окружающей среды, такими как магнитные поля, воздействиями внешнего электричества, электростатического разряда, давления, температуры или изменений давления и ускорения; | 23.1 | Заменен. |
23.2 | Заменен. | |
24 | Заменен. | |
25 | Действует. | |
26.2 | Действует. | |
27 | Заменен. | |
27.101 Требование к помехоустойчивости от электромагнитных полей. | ||
27.102 Общие условия испытаний. | ||
27.103 Защита от постоянного магнитного поля. | ||
27.104 Защита от магнитных полей в диапазоне от 10 Гц до 30 МГц. | ||
27.105 Защита от электромагнитных полей в диапазоне от 30 до 450 МГц. | ||
27.106 Защита от электромагнитных полей в диапазоне от 450 МГц до 3 ГГц. | ||
28.104 Требование к идентификационной карте пациента, имеющего имплантат. | ||
с) риски обоюдных помех при использовании с другими изделиями (такими как дефибрилляторы или высокочастотные хирургические инструменты), обычно используемыми для исследований или при данном виде лечения; | 20.1 | Действует. |
20.2 | Действует. | |
21 | Действует. | |
22 | Дополнение. | |
28.12 | Дополнение. | |
28.13 | Действует. | |
28.14 | Действует. | |
28.15 | Действует. | |
d) риски, которые могут возникнуть при условии, что обслуживание и калибровка невозможны, включая (если применимо): чрезмерное увеличение тока утечки, старение материалов, усиление нагрева, генерируемого имплантатом, снижение точности любого измерительного или контрольного механизма | 17 | Заменен. |
19.1 | Действует. | |
19.2 | Заменен | |
4.3.3 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы минимизировать риски возгорания или взрыва при нормальных условиях эксплуатации или в случае единичного отказа. Риски "при нормальных условиях или в случае единичного отказа" означают риски, которые могут быть оценены путем анализа рисков. Особое внимание следует обратить на имплантаты, предполагаемое использование которых включает воздействие огнеопасных веществ или веществ, которые могут вызвать возгорание | 5 | Дополнение |
4.4 Имплантаты с функцией измерения | ||
4.4.1 Имплантаты с функцией измерения должны быть разработаны и изготовлены таким образом, чтобы обеспечить установленную точность и стабильность в заданных пределах точности с учетом предполагаемого использования имплантата. Пределы точности должны быть установлены изготовителем | 5 | Дополнение |
4.4.1.1 Методы выполнения измерений с помощью шкалы на дисплее или в режиме наблюдения должны быть разработаны в соответствии с принципами эргономики с учетом предполагаемого использования имплантата | 5 | Дополнение |
4.4.1.2 Если на имплантате или его принадлежностях приведены инструкции по работе с имплантатом или работе индикации, или параметрам настройки с помощью визуальной системы, эта информация должна быть понятна пользователю и, если необходимо, пациенту | 13.4 | Действует. |
5 | Дополнение | |
4.4.2 Измерения, осуществляемые с помощью имплантатов, снабженных функцией измерения, должны быть выражены в единицах, соответствующих положениям серии ИСО 31 | 5 | Дополнение |
4.5 Защита от излучения | ||
4.5.1 Общие положения | (См. более подробную информацию ниже) | |
4.5.2 Предусмотренное излучение | Примечание 2 | - |
4.5.3 Непредусмотренное излучение | 9.1 | Действует. |
18.1 | Действует. | |
18.2 | Действует. | |
18.3 | Действует. | |
28.2 | Действует | |
4.5.4 Инструкции | Примечание 2 | - |
4.6 Ионизирующее излучение | Примечание 2 | - |
4.7 Принципы, касающиеся имплантатов, подсоединенных или оборудованных источником энергии | ||
4.7.1 Общие положения | ||
4.7.1.1 Имплантаты со встроенными электронными программируемыми системами должны быть разработаны таким образом, чтобы обеспечивать воспроизводимость, надежность и эффективность этих систем в соответствии с предполагаемым использованием. При возникновении рисков (рисков системы), установленных при анализе рисков для данного изделия/системы, должны быть приняты соответствующие меры по уменьшению или устранению риска, насколько возможно | 19.3 | Заменен |
4.7.1.2 Имплантаты, в которых безопасность пациента зависит от внутреннего источника энергии, должны быть оснащены средствами индикации состояния источника питания | 19.2 | Заменен |
4.7.1.3 На имплантатах, насколько возможно, должен быть нанесен код, с помощью которого тип имплантата или изготовители могут быть идентифицированы (в частности, в соответствии с типом имплантата); при необходимости код должен быть читаем без хирургического вмешательства | 13.3 | Действует. |
28.6 | Действует | |
4.7.1.4 Для имплантатов, в которых безопасность пациента зависит от внешнего источника энергии, внешний источник энергии должен включать в себя систему сигнализации для подачи сигнала в случае отказа питания | 5 | Дополнение |
4.7.1.5 Внешние изделия, предназначенные для мониторинга одного или более клинических параметров имплантата, должны быть оснащены системой сигнализации для подачи сигнала пользователю в ситуации, которая может привести к смерти или серьезному ухудшению состояния пациента | 5 | Дополнение |
4.7.2 Защита от электрических рисков | ||
4.7.2.1 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы избежать, насколько возможно, риска случайного поражения электрическим током при нормальных условиях и в случаях отказа, которые могут возникнуть, несмотря на правильную установку имплантата. В понятие "риски при нормальных условиях и в случаях отказа" входят риски, которые определяются анализом рисков для данного вида изделия | 5 | Дополнение. |
16.1 | Изменение | |
4.7.2.2 Активные имплантаты должны быть разработаны и изготовлены таким образом, чтобы минимизировать риски, связанные с использованием источников энергии, в первую очередь при использовании электроэнергии, уделяя особое внимание изоляции, токам утечки и перегреву изделия | 16.2 | Дополнение. |
16.3 | Заменен. | |
17 | Заменен. | |
26.1 | Изменение | |
4.7.3 Защита от механических рисков | ||
4.7.3.1 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы защитить пользователя и пациента от механических рисков, связанных, например, с сопротивлением, устойчивостью, движущимися частями изделий | 5 | Дополнение |
4.7.3.2 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы минимизировать риски, возникающие от вибрации, генерируемой изделием, принимая во внимание технический прогресс и средства, доступные для снижения вибрации, особенно источника энергии, если только вибрация не является частью специальных рабочих характеристик изделий | 5 | Дополнение |
4.7.3.3 Имплантаты должны быть разработаны и изготовлены таким образом, чтобы минимизировать риски, возникающие из-за шумов, принимая во внимание технический прогресс и средства, доступные для снижения шумов, особенно от источника энергии, если только шумы не являются частью специальных рабочих характеристик изделий | 5 | Дополнение |
4.7.3.4 Терминалы и коннекторы для источников электрической, газовой или гидравлической и пневматической энергии, с которыми приходится работать пользователю, должны быть разработаны и сконструированы таким образом, чтобы минимизировать все возможные риски | 5 | Дополнение |
4.7.4 Защита пациента от рисков, вызванных источником энергии или веществами | ||
4.7.4.1 Имплантаты должны быть разработаны и сконструированы таким образом, чтобы собственно функционирование программируемых и контрольных систем, включая программное обеспечение, не ухудшало безопасность пациента и пользователя, принимая во внимание предусмотренные назначением изделия условия применения | 19.3 | Заменен |
4.7.4.2 Имплантаты, разработанные для подачи энергии или введения лекарственных веществ, должны быть разработаны и сконструированы таким образом, чтобы параметры потока могли устанавливаться и поддерживаться достаточно точно для минимизации риска для пациента | 5 | Дополнение. |
6.101 Измерение характеристик импульса стимуляции | ||
4.7.4.3 Имплантаты, разработанные для введения лекарственных веществ, должны включать в себя соответствующие средства предотвращения и/или индикации любой некорректной скорости потока, которая может привести к опасности | 5 | Дополнение |
4.7.4.4 Имплантаты, разработанные для подачи энергии или введения лекарственных веществ, должны быть разработаны и сконструированы со встроенными средствами минимизации рисков случайного превышения опасного уровня энергии или лекарственного вещества | 5 | Дополнение. |
16.101 Защита электрических характеристик выходного импульса от случайных изменений | ||
4.8 Информация, предоставляемая изготовителем | ||
4.8.1 Каждый имплантат должен поставляться с сопровождающей информацией, необходимой для его безопасного использования и идентификации изготовителя, с учетом уровня подготовки и знаний потенциального пользователя. | 10.4 | Действует. |
12.3 | Действует | |
4.8.2 Если применимо, информацию следует представлять в виде символов. Любой символ или цветовая индикация должны соответствовать национальным стандартам. Если стандарта не существует, символ должен быть описан в документации, поставляемой с имплантатом | 4 | Действует |
4.8.3 Этикетка должна содержать следующие сведения: | 5 | Дополнение. |
а) наименование или фирменный знак и адрес изготовителя; | 9.2 | Действует. |
11.1 | Действует. | |
b) подробные сведения, необходимые пользователю для идентификации имплантата и содержимого упаковки; | 9.3 | Действует. |
9.4 | Дополнение. | |
9.8 | Действует. | |
9.10 | Действует. | |
11.6 | Действует. | |
11.7 | Действует. | |
11.101 Нанесение дополнительной информации на стерильном пакете. | ||
28.104 Требования к карте пациента с обозначением модели имплантата и информацией о центре имплантации. | ||
с) если применимо, индикацию, что содержимое упаковки стерильно (например, "СТЕРИЛЬНО"); | 9.5 | Действует. |
11.2 | Действует. | |
11.3 | Действует. | |
d) если применимо, номер партии или серийный номер, которому предшествует соответствующая идентификация (например, "LOT" или "SN"); | 9.3 | Действует. |
11.6 | Действует. | |
28.104 Требования к карте пациента с указанием серии и номера имплантата | ||
е) если применимо, дата, до которой имплантат может быть использован; | 9.7 | Действует. |
11.5 | Действует. | |
f) индикацию, что имплантаты предназначены для одноразового использования; | 28.18 | Действует. |
9.101 Указание на упаковке, что содержимое предназначено для однократного использования | ||
g) если применимо, указание на специальное назначение (например, "изделие, сделанное на заказ" или "только для клинических исследований"); | 9.12 | Действует. |
11.10 | Действует. | |
h) любые специальные условия хранения и/или транспортирования; | 9.11 | Действует. |
i) любые специальные рабочие инструкции; | Примечание 4 | - |
j) любые предупреждения или меры предосторожности, которые следует предпринять; | Примечание 5 | - |
k) для активных имплантатов - месяц и год производства; | 9.6 | Действует. |
11.4 | Действует. | |
28.103 Требование к указанию на каждой части документации года выпуска. | ||
i) если применимо, метод стерилизации | 11.2 | Действует |
4.8.4 Если предполагаемое использование имплантата не очевидно для пользователя, изготовитель должен четко указать назначение изделия на этикетке и в инструкции по применению | 9.10 | Действует |
4.8.5 Если это разумно и применимо, имплантаты и съемные компоненты должны быть идентифицированы по возможности в терминах серийного номера или номера партии для обеспечения возможности проведения всех надлежащих действий после установления любых потенциальных рисков, обусловленных применением как имплантата, так и съемных компонентов | 8.2 | Дополнение. |
13.1 | Изменение. | |
13.2 | Действует | |
4.8.6 Если применимо, инструкция по применению должна содержать следующие сведения: | ||
а) детали, упомянутые в 4.8.3, за исключением перечислений d), е) и k); | 28.1 | Дополнение. |
28.3 | Действует. | |
28.16 | Действует. | |
28.18 | Действует. | |
28.21 | Действует. | |
b) рабочие характеристики, приведенные в ИСО/ТО 14283:2004, подраздел 3.3, и любые нежелательные побочные эффекты; | 28.8 | Действует. |
с) если имплантат используется в сочетании с другими медицинскими изделиями или оборудованием, как требует его предполагаемое использование, необходимые подробности о его характеристиках для определения корректных используемых имплантатов или оборудования для получения безопасной комбинации; | 28.4 | Действует. |
28.5 | Действует. | |
28.9 | Действует. | |
d) всю информацию, необходимую для подтверждения того, что имплантат используется надлежащим образом и может работать правильно и безопасно, а также, где применимо, сведения, позволяющие оценить срок службы источника энергии; | 28.10 | Действует. |
28.101 Требуемые методы для определения нормальной работы нейростимулятора. | ||
28.102 Требуемая информация о настройках и параметрах изделия для безопасной эксплуатации. | ||
е) если применимо, информацию, необходимую для предотвращения специальных рисков, связанных с имплантацией имплантата; | 28.11 | Действует. |
f) информацию, относящуюся к рискам перекрестного влияния, вызванного присутствием имплантата во время проведения специфического лечения или обследований; | 28.12 | Дополнение. |
g) необходимые инструкции на случай повреждения стерильной упаковки и, если применимо, подробные сведения о допустимом методе повторной стерилизации; | 28.17 | Действует. |
h) если имплантаты поставляются с условием, что они будут стерилизованы перед использованием, инструкция по очистке и стерилизации должна быть такой, что при ее соблюдении имплантат будет соответствовать требованиям ИСО/ТО 14283:2004, раздел 3; | 28.17 | Действует. |
i) детали последующей обработки или обслуживания, требуемые до использования имплантата (например, стерилизация, окончательная сборка и т.д.); | Примечание 3 | - |
j) в случае если имплантат испускает радиоактивное излучение с лечебными целями, сведения о характере, типе, интенсивности и распространении этого излучения. | Примечание 2 | - |
В инструкцию по применению также должны быть включены подробные сведения, позволяющие медицинскому персоналу оповестить пациента о любых противопоказаниях и любых необходимых мерах предосторожности. | ||
Эти сведения должны, в частности, охватывать: | ||
k) меры предосторожности, соблюдаемые в случае изменения рабочих характеристик имплантата; | 28.19 | Изменение. |
28.20 | Действует. | |
l) меры предосторожности в ответ на воздействие в разумно предсказуемых условиях окружающей среды, например, магнитного поля, внешних источников электроэнергии, электростатических разрядов, давления или перепада давлений, ускорения, источников тепла и т.д.; | 28.22 | Дополнение. |
m) достаточный объем касающейся информации лекарственных веществ или веществ, которые должны доставляться с помощью данного имплантата, включая любые ограничения при выборе веществ, которые необходимо доставлять; | 28.7 | Действует. |
n) меры предосторожности, предпринимаемые против особых, необычных рисков, связанных с удалением имплантата; | 28.24 | Действует. |
о) лекарственные вещества, включенные в имплантат как неотъемлемая часть в соответствии с ИСО/ТО 14283:2004, пункт 4.1.4; | 28.8 | Действует. |
р) уровень точности измерений, заявленный для имплантатов, снабженных функцией измерения | 5 | Дополнение |
4.9 Клиническая оценка | ||
Если соответствие фундаментальным принципам для имплантатов основывается на клинических данных, такие данные должны быть установлены либо за счет: | ||
а) сбора данных из соответствующей научной литературы, доступной в настоящее время, по назначению изделия, предусмотренного изготовителем, либо | 19.4 | Изменение. |
b) результатов всех клинических исследований, проводимых таким образом, чтобы защищать пациентов и обеспечивать при этом научный характер исследования | 19.4 | Изменение |
Примечание 1 - Этот принцип является основополагающим для всех аспектов активного имплантируемого медицинского изделия, адресованного к ИСО 14708. | ||
Приложение ВВ
(справочное)
Связь между разделами настоящего стандарта и фундаментальными принципами, перечисленными в приложении АА
Таблица ВВ.1
Подраздел ИСО 14708-3 | Соответствующий фундаментальный принцип ИСО/ТО 14283 |
4 | 4.8.2 |
5 | 4.4.1, 4.4.1.1, 4.4.1.2, 4.4.2, 4.7.1.4, 4.7.1.5, 4.7.3.1, 4.7.3.2, 4.7.3.3, 4.7.3.4, 4.7.4.2, 4.7.4.3, 4.7.4.4, 4.8.3, 4.8.6 р) |
6.101 | 3.3, 4.7.4.2 |
6.102 | 3.3 |
7.1 | 4.2.3 |
7.2 | 3.5, 4.2.3 |
8.1 | 3.1 |
8.2 | 4.8.5 |
8.101 | 3.5 |
8.102 | 3.5 |
9.1 | 4.5.3 |
9.2 | 4.8.3 а) |
9.3 | 4.8.3 b), 4.8.3 d) |
9.4 | 4.8.3 b) |
9.5 | 4.8.3 с) |
9.6 | 4.8.3 k) |
9.7 | 4.8.3 е) |
9.8 | 4.8.3 b) |
9.9 | 4.3.1 |
9.10 | 4.8.3 b), 4.8.4 |
9.11 | 4.8.3 h) |
9.12 | 4.8.3 g) |
9.101 | 4.8.3 f) |
10.1 | 3.5, 4.2.3 |
10.2 | 3.5, 4.2.3 |
10.3 | 3.5 |
10.4 | 3.3, 4.8.1 |
11.1 | 4.8.3 а) |
11.2 | 4.8.3 с), 4.8.3 I) |
11.3 | 4.8.3 с) |
11.4 | 4.8.3 k) |
11.5 | 4.8.3 е) |
11.6 | 4.8.3 b), 4.8.3 d) |
11.7 | 4.8.3 b), 4.2.3 |
11.8 | 4.3.1 |
11.9 | 4.2.3 |
11.10 | 4.8.3 g) |
11.101 | 4.8.3 b) |
12.1 | 4.2.3 |
12.2 | 4.2.3 |
12.3 | 3.5 |
13.1 | 4.8.5 |
13.2 | 4.8.5 |
13.3 | 4.7.1.3 |
13.4 | 4.4.1.2 |
14.1 | 4.2.1, 4.2.3, 4.2.4, 4.2.5 |
14.2 | 4.1.2, 4.2.5 |
14.3 | 4.1.1 a), 4.1.1 b), 4.1.2 |
14.4 | 4.1.4 |
15.1 | 4.3.2 a) |
15.2 | 4.3.2 a) |
16.1 | 4.7.2.1 |
16.2 | 4.7.2.2 |
16.3 | 4.7.2.2 |
16.101 | 4.7.4.4 |
17 | 4.7.2.2, 4.3.2 d) |
18.1 | 4.5.3 |
18.2 | 4.5.3 |
18.3 | 4.5.3 |
19.1 | 4.3.2 d) |
19.2 | 3.4, 4.3.2 d), 4.7.1.2 |
19.3 | 3.4, 3.6, 4.1.7, 4.7.1.1, 4.7.4.1 |
19.4 | 3.6, 4.9 a), 4.9 b) |
19.5 | 4.1.3 |
20.1 | 4.3.2 c) |
20.2 | 4.3.2 c) |
21 | 4.3.2 c) |
22 | 4.3.2 c) |
23.1 | 3.4, 4.3.2 b) |
23.2 | 3.4, 4.3.2 b) |
23.3 | 3.4 |
23.4 | 3.4 |
23.5 | 3.4 |
23.6 | 3.4, 4.3.1 |
24 | 4.3.2 b) |
25 | 4.3.2 b) |
26.1 | 3.4, 4.7.2.2 |
26.2 | 3.5, 4.3.2 b) |
27.101 | 4.3.2 b) |
27.102 | 4.3.2 b) |
27.103 | 4.3.2 b) |
27.104 | 4.3.2 b) |
27.105 | 4.3.2 b) |
27.106 | 4.3.2 b) |
28.1 | 4.8.6 a) [4.8.3 a)] |
28.2 | 4.5.3 |
28.3 | 4.8.6 a) [4.8.3 b)] |
28.4 | 3.4, 4.3.1, 4.8.6 c) |
28.5 | 4.3.1, 4.8.6 c) |
28.6 | 4.7.1.3 |
28.7 | 4.8.6 m) |
28.8 | 4.8.6 b), 4.8.6 o) |
28.9 | 4.8.6 c) |
28.10 | 4.8.6 d) |
28.11 | 4.8.6 e) |
28.12 | 4.3.2 c), 4.8.6 f) |
28.13 | 4.3.2 c) |
28.14 | 4.3.2 c) |
28.15 | 4.3.2 c) |
28.16 | 4.8.6 a) [4.8.3 c)] |
28.17 | 4.8.6 g), 4.8.6 h) |
28.18 | 4.8.6 a) [4.8.3 f)] |
28.19 | 4.8.6 k) |
28.20 | 4.8.6 k) |
28.21 | 4.8.6 a) [4.8.3 h)] |
28.22 | 4.8.6 I) |
28.23 | 3.4 |
28.24 | 4.8.6 n) |
28.101 | 4.8.6 d) |
28.102 | 4.8.6 d) |
28.103 | 4.8.3 k) |
28.104 | 4.8.3 b), 4.8.3 d) |
Приложение СС
(справочное)
Обоснование
СС.1 Общие положения
Изложенные ниже замечания к некоторым положениям настоящего стандарта призваны облегчить его понимание. Содержание настоящего приложения относится не ко всем разделам настоящего стандарта; именно поэтому нумерация параграфов в приложении не является последовательной.
СС.2 Замечания по специальным разделам и подразделам
1 Испытательные образцы включены в область применения из-за обычной практики использования их в течение испытательного срока стимуляции до принятия решения об имплантации. Необходимо, чтобы рабочие параметры и характеристики испытательного образца и нейростимулятора были идентичны. Неимплантируемые нейростимуляторы, которые используются для других целей и не могут рассматриваться в качестве аксессуаров для имплантируемого нейростимулятора, в настоящем стандарте не рассматриваются.
6.101 В настоящем подпункте представлен унифицированный метод измерения характеристик импульса стимуляции, таким образом информацию о технических параметрах и характеристиках, предусмотренных изготовителем в сопроводительной документации, получают последовательно.
Важно, чтобы пользователь имел правильное представление о форме импульса стимуляции и параметрах измерения, таких, как нагрузка. В частности, если формы импульсов или другие характеристики различны в зависимости от режима вывода, установки или конфигурации, эти особенности работы изделия необходимо довести до сведения пользователя.
Единицы измерения, такие как вольт или миллиампер, указаны для единообразия. Кроме того, могут применяться другие единицы измерения по усмотрению изготовителя.
Сопротивление нагрузки указывается изготовителем для учета изменения сопротивления в ткани в зависимости от условий применения. Кроме того, равномерное сопротивление нагрузки задается для сравнительных целей.
Температура в помещении указывается для испытательного оборудования и испытуемого образца как комфортная. Это не означает, что необходимо использовать современные технологии, чтобы получить значимые различия между результатами измерений комнатной температуры и 37°С.
В частности, при стимуляции чувствительных нервов, важно, чтобы импульсы стимуляции были стабильными для предотвращения случайных изменений интенсивности стимулирования, которые могут быть восприняты пациентом как шок, прерывистая стимуляция или прекращение терапии.
8.2 Настоящий стандарт распространяется только на имплантированные части из-за риска и неудобства их замены. Под действие настоящего стандарта не попадают временные провода, которые используются в испытательном образце.
8.101 Настоящее требование распространяется на маркировку во время транспортировки ко всем частям, в том числе имплантируемым. К электрическим неимплантируемым частям применяются требования раздела 5.
8.102 Настоящее требование распространяется на маркировку с указанием требований окружающей среды во время транспортировки ко всем частям, включая имплантируемые части. К электрическим неимплантируемым частям применяются требования раздела 5.
10.3 Испытание в настоящем стандарте согласовано с испытанием МЭК 60601-1. В примечании разъясняется, что сменные наклейки не должны подвергаться испытаниям, если они содержат информацию, не предусмотренную требованиями настоящего стандарта.
13.1 Испытание влажным протиранием приведено в соответствие с 10.3.
14.2 Требования ИСО 14708-1 были первоначально сформулированы в отношении передающихся через кровь частиц. Настоящий стандарт позволяет изготовителю определять требования для твердых частиц, которые могут отличаться в зависимости от предполагаемого применения нейростимулятора. При этом изготовитель должен провести анализ рисков, анализ проекта, испытания или использовать другие подходящие методы.
15.1 Применяется действующая редакция ссылочного стандарта.
16.1 Применяется действующая редакция ссылочного стандарта.
16.2 Требует, чтобы изготовитель определил, являются ли пределы утечки приемлемыми для конкретного применения изделия.
16.3 Требование подтверждает, что в зависимости от условий применения могут использоваться различные пороговые значения стимуляции и энергии; значение 10 В не является единственно возможным.
16.101 В процессе нейростимуляции профилактика внезапных изменений в выходных характеристиках, даже если они находятся в нормальных программируемых диапазонах, является важным фактором безопасности пациента. Чрезмерная плотность тока и восприятие шока являются примерами потенциальных опасностей, которые могут возникнуть в результате неожиданных изменений выходной стимуляции.
17 Основываясь в целом на распределении температуры тела человека, ограничение повышения температуры на 2°С можно считать чрезмерно строгим. При перфузии может возникнуть большее локальное увеличение температуры. См. [9].
19.2 Пункт изменен в соответствии с используемыми терминами в настоящем стандарте (т. е. срок службы) и уточнено, что понимается под источником энергии.
19.3 Пункт изменен, чтобы отразить текущую методику оценки степени риска согласно ИСО 14971. Заменяет старый и менее общий метод, такой как FMEA (Failure Mode Effects Analysis - анализ видов и последствий отказов).
19.4 Изменение требования для разрешения проведения клинических исследований в соответствии с опубликованными стандартами, помимо ИСО 14155.
21 Имплантируемые нейростимуляторы могут быть подвержены воздействию мощных электрических полей, направленных непосредственно на пациента. Частные требования могут быть определены в будущих редакциях настоящего стандарта.
22 Утверждается, что должны быть оценены новые методы лечения и процедуры. Частные требования могут быть определены в будущих выпусках настоящего стандарта.
23.1 Согласовано с МЭК 60601-1:2005, но увеличено число падений для ручных приспособлений для учета механического воздействия.
23.2 Изменен ИСО 14708-1, чтобы отразить обычные условия использования только для имплантируемых частей. Неимплантируемые части подвергаются механическому воздействию согласно 23.1 и разделу 10, в которых требуется учесть возможность вибрации во время хранения и использования.
24 Испытательные уровни электростатического разряда, указанные в ИСО 14708-1, являются устаревшими. Новое требование, указанное в МЭК 60601-1-2, будет гарантировать, что изделия проверены на уровнях, которые в настоящее время считаются подходящими. Раздел 24 также согласован с разделом 5.
26.1 Применяется действующая редакция ссылочного стандарта.
27.102 Наиболее важные функции имплантируемого нейростимулятора, с точки зрения безопасности, должны быть подвергнуты испытаниям на помехоустойчивость. Функции, не связанные с основными функциональными характеристиками, не должны подвергаться испытаниям. Как правило, функции можно рассматривать как клинически существенные свойства, для обеспечения которых предназначено изделие. Раздел 3 настоящего стандарта не определяет понятие "функция", т.к. функция, которая не является клинически значимой, может быть каким-либо образом связана с основными функциональными характеристиками и, следовательно, должна подвергаться испытаниям на помехоустойчивость.
Большинство тестов на помехоустойчивость включают два набора испытательных уровней. Следовательно, существует также два определенных набора критериев эффективности (третий уровень критерия определяется изготовителем).
Испытательные уровни облучения, выбранные для всех тестов, основаны на обычных условиях воздействия на основную часть населения и в ряде случаев связаны с нормами биологического воздействия. Испытательные уровни не наносят необратимого вреда и не вызывают долгосрочного эффекта. В связи с этим разработаны соответствующие критерии качества.
Критерии качества во время испытания устанавливаются в соответствии с испытательным уровнем. Нижние уровни испытаний основаны на общих повседневных условиях жизни населения. Эти уровни характерны для бытовых условий, в том числе линий электропередач, транспорта, мест общего пользования (школы, магазины, офисы и больницы) и офисного оборудования, и мест, где изделие находится под влиянием других устройств длительное время. Таким образом, в этой среде следует ожидать, что имплантируемый нейростимулятор будет работать согласно назначению без потери функции и без каких-либо непредвиденных ответных реакций.
Верхние уровни испытаний представляют собой среды, в которых пациент оказывается редко, обычно в течение короткого времени, и которых, как правило, возможно избежать. Источниками для этой категории являются системы досмотра и мобильное оборудование с высоким уровнем излучения. Для магнитных полей, более высокие уровни испытаний помехоустойчивости равны десяти нижним уровням. Общий уровень для электрических полей составляет пять нижних уровней. Существует три уровня систем аварийной сигнализации и пять уровней мобильных приемопередатчиков. В этой среде изделие, как ожидается, не будет повреждено или подвергнуто неприемлемому риску. Так как невозможно предусмотреть все ситуации, установлены нормы временного ухудшения характеристик и непреднамеренной работы до того момента, пока пациент находится в безопасности. Таким образом, использование нейростимулятора может быть допущено в том случае, если пациент может ощутить клинический эффект от применения изделия. Допуск должен зависеть от мнения изготовителя и врачей.
Некоторые примеры непреднамеренных реакций: изменение ширины импульса, выход амплитуды за пределы нормальных рабочих условий, незапланированный импульс или всплеск. Работа изделия не должна нарушаться, как правило, в 10 тестовых уровнях, это должно быть подтверждено экспериментально.
Некоторые нарушения не допустимы из соображений безопасности, а также не оправданы тяжестью уровня испытаний.
Индуцированное напряжение от изменяющихся во времени магнитных полей связано с проводящей областью петли провода, которая является наибольшей для устройств, работающих с однополярной конфигурацией электродов по сравнению с биполярной конфигурацией электродов. Для электрических полей напряжение, которое индуцируется в проводе, как правило, зависит от ориентации провода по отношению к электрическому полю, а не от конфигурации электродов. Если изготовитель не устанавливает это в ходе предварительного тестирования, возможно, необходимо проверить все конфигурации электродов, чтобы обнаружить наименьшую чувствительность.
27.103 Нижний уровень, равный 1 мТл (10 Гс), был выбран на основании обычно встречающихся напряженностей поля. На практике, многие имплантируемые изделия имели внутренние переключатели, которые активировались магнитным полем. Эти переключатели обычно активировались магнитным полем около 1 мТл. Таким образом, можно ожидать, что все изделия будут функционировать нормально в присутствии поля 1 мТл.
Высокий уровень 50 мТл (500 Гс), редко, но может встречаться. Индукция постоянного магнитного поля, образованного на поверхности обычных бытовых магнитов (например, магниты на холодильнике) и от магнитов в медицинских изделиях, необходимых для активации переключателя, обычно составляет 50 мТл (магнитные поля резко сжимаются, поэтому сила поля в нескольких сантиметрах, как правило, незначительна). Таким образом, изделия не будут подвержены необратимым повреждениям или изменениям состояния после воздействия этих уровней. Поскольку некоторые имплантируемые медицинские изделия также зависят от активации переключателей для некоторых функций управления, изменение режима работы может произойти от постоянного магнитного поля индукцией больше, чем 1 мТл.
Требование к однородности поля 3 дБ оправдано известными техническими возможностями.
Существует одна обязательная ориентация ИУ, при которой наибольшая поверхность подвергается воздействию вектора магнитного поля. Другой ориентации не требуется.
Для получения ответа достаточно 10 мин.
27.104 Общее облучение населения электромагнитной энергией в диапазоне частот от 10 Гц до 30 МГц состоит из электрического и магнитного полей. Считается, что только магнитные поля способны нарушить работу имплантируемых нейростимуляторов.
Электрические поля в данном диапазоне частот оказывают незначительное влияние на изделия, размером с нейростимулятор, имея очень короткую электрическую длину величиной 1/20 длины волны. Учитывая следующее соотношение:
![]() (CC.101)
(CC.101)
ткани с диэлектрической проницаемостью 80 и максимальным размером 6 см (типичным для нейростимулятора), при частоте менее, чем 27 МГц должны незначительно влиять на нейростимулятор. При частоте свыше 27 МГц электрическое поле в корпусе ослабляется более, чем на 35 дБ, за исключением области разъема блока. Помехи от излучателей в этом диапазоне частот, такие, как любительское радио, АМ-радио, время и частота вещания, ISM, личные и частные услуги радио, морской радионавигации не были зафиксированы.
Воздействие магнитных полей, способных вызвать нарушения, в первую очередь происходят от источника частоты оборудования и приборов. Большинство воздействий происходит в доме, но также вблизи линий электропередач, транспортных средств, оргтехники, и в местах общего пользования, таких как школы, магазины, офисы и больницы.
Рисунок иллюстрирует СС.101 вывод -линии и
-линии от исходных данных окружающей среды (см. [10], [18]), наряду с Международной комиссией по защите от неионизирующих излучений (ICNIRP) общего уровня государственных справочных [19], IEEE С95.1 [20] и IEEE С95.6 [21] неконтролируемые уровни, MIL 461E [22] уровней RS101, МЭК 61000-2-5 [23] (таблица 6, нарушение степень 4), и ИСО 14708-3 уровней испытаний линии.
-линия показывает ежедневное общее воздействие магнитных полей.
-линия совпадает с MIL 461 в полосе частот от 30 Гц до 3 кГц. Начиная с 3 кГц, она практически повторяет траекторию ICNIRP базового уровня за исключением того, что проходит на 3,2 выше в полосе до 100 кГц и приблизительно на 2,2 выше в полосе до 30 МГц. Это может быть использовано для расчета пульсации. Данные, представленные на рисунке, уже рассчитаны для локализованных эффектов, основанных на однородности источника поля (включая размер и близость) в соответствии с IEC 62226-2-1 [24]. Общее воздействие магнитных полей, представленное
-линией, считается вероятным, обычным и неизбежным. Функционирование имплантируемого изделия в этих условиях воздействия, как ожидается, будет нормальной.
-линия используется для дополнительной гарантии защиты от воздействия превышающего
-линию. Это не представляет собой частный случай влияния окружающей среды как таковой, но соответствует рекомендациям IEEE С95.1 [20] для максимально допустимого уровня воздействия на человека. Запас прочности, обеспечиваемый
-линией, в 10 раз превышает
-линию в полосе
3 кГц. Потенциальные источники такого уровня воздействия достаточно редки и для достижения таких уровней воздействия необходима близость к подобному источнику. Таким образом, общее воздействие магнитных полей, представленных
-линией, считается возможным, относительно редким и, в случае возникновения, краткосрочным, и в целом предотвратимым, если источники известны. Функционирование имплантируемого изделия в этих условиях воздействия, как ожидается, будет проходить без повреждений и недопустимого риска.
Рисунок СС.101 - Данные источника магнитного и ICNIRP общие уровни общественных полей, IEEE С95.1/С95.6 неконтролируемые уровни, уровни MIL 461Е RS101, МЭК 61000-2-5 данные (таблица 6, нарушение степени 4), и ИСО 14708-3 линии испытательных уровней
Поле должно быть однородным до 100 кГц, чтобы охватить нормальные условия окружающей среды. При таких низких частотах проще генерировать однородное поле в заданном диапазоне. Однородность на более высоких частотах и уровнях испытаний связана с ограничениями испытательного стенда.
Солевая ванна используется для имитации естественных условий окружающей среды нейростимулятора при нормальном использовании. Значение проводимости 0,27 См/м является компромиссным для различных тканей тела и консистенции во всем диапазоне тестовых частот всех испытаний.
Индуцированное напряжение нестационарных магнитных полей, в соответствии с законом Фарадея, зависит от области петли, образованной проводником. Формула (101) основана на максимальной практической длине проводника 85 см с эффективной электрической площадью контура 650 см. Длина кабеля была выбрана из антропометрических данных для 95-го перцентиля человека (см. [25] и [26]), это означает, что длинная часть проводника будет размещена абдоминально и направляться вверх по позвоночнику к С1, формируя с двух сторон прямоугольный треугольник с абдоминальной длиной 32 см и спинной - 53 см. Геометрическая площадь треугольника, ограниченная проводником, гипотенузой которого являются ткани тела, равна 850 см
(32x53/2). При этом, основываясь на работе [27] эффективная электрическая площадь петли меньше геометрической площади петли. Обнаружено, что коэффициент соотношения электрической и геометрической областей равен приблизительно 1,5, но для настоящего стандарта коэффициент равен 1,3, что основано на более консервативном подходе. В результате, эффективная площадь петли равна примерно 650 см
. Максимальная эффективная площадь 650 см
по-прежнему рассчитывается исходя из длины проводов 85 см что приводит к формуле (101) (0,09х85
=650 см
).
Размер шага, как указано, должен быть подходящим, чтобы покрыть частотный диапазон, не создавая обременительного числа тестовых измерений.
-линия использует тестовую СНВ для моделирования окружающей среды.
-линия - импульсная модуляция частотой не менее 3 кГц имитирует виды сигналов, присутствующих в окружающей среде и создает дополнительную нагрузку на ИУ. Ниже уровня 3 кГц
-линия - синусоидальная, т.к. импульсные поля частотой модуляции 200 Гц не распространены в практике, находится слишком близко к начальной тестовой частоте 300 Гц. Выбор частоты модуляции для имитации известных источников магнитного поля основан на том, чтобы не создавать помех на частоте питания или стандартной частоте стимуляции, которая, как правило, меньше, чем 200 Гц.
Повторное тестирование -линии на частотах, обладающих эффектом импульсной модуляции, обеспечивает дополнительную уверенность в безопасности.
Для проверки воздействия вектора магнитного поля на наибольшую поверхность тестируемого изделия достаточно лишь одной определенной ориентации в испытательной установке. Для других расположений профиль изделия слишком мал, чтобы наблюдать взаимодействия, не замеченные при обязательной ориентации. Максимальное вызванное напряжение будет наблюдаться при перпендикулярном расположении петли провода к магнитному полю.
27.105 Удаленные источники электромагнитной энергии воздействуют на население в диапазоне частот от 30 до 450 МГц. Первичные преобразователям в этом частотном диапазоне относят излучающие колебательные источники, которые, как правило, являются телерадиовещательными передатчиками, портативными и мобильными передатчиками и ISM оборудованием.
_______________
ISM диапазон (англ. Industrial, Scientific, Medical: индустриальный, научный и медицинский диапазон) занимает полосу частот от 5725 до 5875 МГц. ISM диапазон используют многие популярные системы, такие как беспроводные телефоны и другие системы.
Как правило, в населенных или посещаемых широкой общественностью местах напряженности поля от этих источников менее 10 В/м. Сравнительный стандартный тест помехоустойчивости МЭК 60601-1-2 используется для неимплантируемых медицинских изделий, определяя напряженности тестового поля 3 В/м для вспомогательного не жизненно-необходимого оборудования 10 В/м для питания оборудования. В зависимости от близости источника напряженность поля может быть выше.
Примечание - Для напряженности электрического поля приведены среднеквадратичные значения, если не указано иное.
Биологические стандарты безопасности могут быть использованы для целей сравнения, чтобы оценить потенциальную угрозу для безопасности человека. Пределы, представленные в этих стандартах, могут быть использованы в качестве ориентира для установки уровней испытаний помехоустойчивости, основанные на предположении, что воздействие электромагнитных полей должно быть ограниченно. Недавно некоторые страны предприняли шаги, чтобы принять законодательство по контролю выбросов для защиты общественности.
IEEE С95.1 [20] в диапазоне частот от 30 до 450 МГц устанавливает пределы риска электрических полей от 27,5 до 33,6 В/м (неконтролируемых) и от 61,4 до 75 В/м (управляемых). ICNIRP [19] в том же диапазоне частот ограничивает воздействие электрического поля от 28 до 29 В/м (широкой общественности) и от 61 до 63,6 В/м (профессиональной).
Пределы излучений от ISM оборудования установленные CISPR 11 [28], различаются в зависимости от группы, класса и расстояния, но могут быть сведены к 60 дБ·мкВ/м (1000 мкВ/м), в худшем случае, до 30 м, от 30 до 450 МГц. Пределы для бытовых приборов, электрических инструментов и аналогичных устройств, установленные CISPR 14 [29] приведены ниже. Пределы ITE (информационные технологии) оборудования, установленные CISPR 22 [30], не более 37 дБ мкВ/м (71 мкВ/м). Пределы класса цифровых устройств, установленные FCC [31], не более 46,5 дБ мкВ/м (210 мкВ/м).
Примеры напряженности поля авторизованных передатчиков приведены в таблице СС.102 (см. [15], таблица 1).
Таблица СС.102 - Примеры напряженности полей из утвержденных передатчиков
Служба | Частотный диапазон, МГц | Типовой диапазон пространственного разнесения, м | Расчетный диапазон значений напряженности поля на соответствующем расстоянии, В/м |
Низкочастотное и морское вещание | 0,014-0,5 | 1000-20000 | 5,5-0,55 |
Радиовещание с амплитудной модуляцией | 0,2-1,6 | 500-2000 | 12,5-0,78 |
Любительские высокие частоты | 1,8-30 | 10-100 | 22,1-2,21 |
Высокочастотные системы связи, включая коротковолновое | 1,6-30 | 1000-20000 | 0,7-0,04 |
Гражданский диапазон | 27-28 | 10-100 | 2,4-0,24 |
Любительские высокие частоты и сверхвысокие частоты | 50-52 | 10-500 | 63-0,44 |
144-146 | |||
434-438 | |||
1290-1300 | |||
Стационарная и мобильная связь | 29-40 | 2-200 | 40-0,25 |
68-87 | |||
146-174 | |||
422-432 | |||
438-470 | |||
860-990 | |||
Портативные телефоны, в том числе беспроводные | 1880-1990 | 1-100 | 15,6-1,56 |
ТВ-вещание очень высокой частоты | 48-68 | 500-2000 | 8-1,11 |
174-230 | |||
Радиовещание с частотной модуляцией | 88-108 | 250-1000 | 8,9-2,2 |
ТВ-вещание сверхвысокой частоты | 470-853 | 500-3000 | 10-1,6 |
МЭК 61000-2-5:1995 [23] (таблица В.1) содержит значения вероятности того, что напряженности электрического поля не будут превышать установленные значения на определенных расстояниях от общих передатчиков. В соответствии с этой таблицей вероятность незначительна (0,0001%), что напряженность поля 10 В/м будет превышать установленное значение для данного излучателя и расстояния, указанных в таблице СС.103.
Таблица СС.103 - Электрические расстояния напряженности поля для 10 В/м
AM вещание 150 кГц - 30 МГц | Переносной приемопередатчик 27 МГц - 1000 МГц | Персональная двусторонняя радиосвязь 27 МГц | ТВ-VHF |
495 м | 1,6 м | 2,4 м | 313 м |
Принципы установки уровней для испытания помехоустойчивости в настоящем стандарте принимают во внимание то, что имплантат неотделим от своего носителя без хирургического вмешательства. Требование, чтобы тестовый уровень помехоустойчивости был выше уровня, необходимого для неимплантируемых медицинских изделий, но, в то же время, соответствовал реальным встречающимся источникам, является обоснованным.
Уровень среднеквадратичного значения 16 В/м при амплитудной модуляции 80% в соответствии с приведенной выше информацией (28 В/м максимального среднеквадратичного значения) и обеспечивает повышение на пять уровней над не жизненно-необходимыми требованиями МЭК 60601-1-2 (на 1,6 уровней - над требованиями жизнеобеспечения).
Солевую ванну используют для имитации окружающей среды в естественных условиях нейростимулятора при нормальном использовании. Значение проводимости 0,27 См/м является компромисcным для различных тканей тела и для постоянства параметров теста во всем диапазоне тестовых частот среди всех испытаний.
Проводник помещают в туловище пациента параллельно электрической поляризации поля. Антропометрические данные для 95-го перцентиля человека (см. [25] и [26]) показывают, что длинная часть провода будет размещена в туловище абдоминально и направлена вверх по позвоночнику к 1, формируя с двух сторон прямоугольный треугольник с абдоминальной длиной 32 см и спинной - 53 см, для общей длины провода 85 см. Использование коэффициента 0,62 для стороны a на рисунке 107 определяет сторону, обращенную параллельно к электрическому полю, пропорционально общей длине проводника. Остальная часть проводника (сторона b) расположена перпендикулярно к электрическому полю, с тем, чтобы свести к минимуму напряжение противоположной полярности на другой стороне.
Длины тестовых проводников соответствуют среднестатистическому размеру туловища. Более длинные проводники, такие как для имплантата ноги, моделируются с использованием более высокого испытательного напряжения 140 В/м. (Проведение теста в солевом растворе определяется размером солевой ванны. Приведение требуемой длины провода к практическому минимуму помогает сохранить размер и массу управляемыми.)
Область разъема типового нейростимулятора с титановым корпусом является наиболее восприимчивой к коротковолновым электрическим полям. При проведении испытания данной области корпуса необходимо ее расположить параллельно электрической поляризации поля для максимального воздействия.
Амплитудная модуляция используется в соответствии с требованиями МЭК 60601-1-2 для неимплантируемых частей. Согласно обоснованиям в МЭК 61000-4-3 амплитудная модуляции имеет преимущества по сравнению с другими методами. Частота модуляции равна 200 Гц, что близко к физиологическим полосам пропускания и позволяет обойти частоты линий электропередачи и типичные частоты стимуляции.
Размер шага 5% обеспечивает рациональное покрытие диапазона частот, оптимизируя число тестовых измерений.
Пульсация и локализация воздействия электромагнитных полей учитываются в биологических стандартах безопасности, где нет фактора локализации для электрического поля. В теории коэффициент пульсации для электрического поля может быть таким же высоким как у людей без имплантатов: 32. На практике нет никаких известных источников в открытом доступе, которые используют такие уровни. Коэффициент пульсации 5 был выбран в качестве разумного предела, в результате чего верхний испытательный уровень равен среднеквадратичному значению 140 В/м (28 В/м х5).
Верхний уровень импульсной модуляции (вместо амплитудной), прежде всего, ограничивается возможностями оборудования. Шаги частоты были выбраны, чтобы получить показательную выборку источников, занимающих частотный диапазон.
Использование МЭК 61000-4-3 для обеспечения соответствия процедуры испытания требованиям для неимплантируемых частей является признанной нормой. Целесообразно использовать стандартную методологию МЭК из-за сходства электромагнитного воздействия окружающей среды, с которыми сталкиваются внешние и имплантируемые медицинские изделия.
27.106 Население подвергается воздействию электромагнитной энергии в диапазоне частот от 450 МГц до 3 ГГц, прежде всего, электрического поля. Источники с достаточно высокой напряженностью, чтобы вызвать возможные помехи у имплантированных медицинских изделий, состоят в основном из ручных беспроводных передатчиков (например, сотовые телефоны) на близком расстоянии.
Стандарт по электромагнитной совместимости американского института национальных стандартов/ассоциации по развитию медицинского приборостроения (ANSI/AAMI - The American National Standards Institute/The Association for the Advancement of Medical Instrumentation) ANSI/AAMI PC69, написанный рабочей группой Комитета по кардиостимулятору, затрагивает прежде всего этот тип оборудования. Настоящий стандарт включает требования и методы испытаний ANSI/AAMI РС69 из-за сходства между имплантируемыми кардиостимуляторами и имплантируемыми нейростимуляторами в части среды пациента, адекватных механических и электрических элементов конструкции и использования изделий в естественных условиях.
Несмотря на то, что ANSI/AAMI РС69 предназначен, прежде всего, для оценки воздействия беспроводных устройств на близком расстоянии, требования этого стандарта применимы для оценки воздействия и на отдаленном расстоянии в пределах 3 В/м или 10 В/м. Угроза от карманных беспроводных устройств выше, чем от других устройств, например, от телевидения или радио.
РС69 дает обоснование для выбора тестовых частот в этом диапазоне и для испытательных уровней. Стандартный уровень 40 мВт предназначен для имитации ручного беспроводного передатчика на расстоянии 15 см от имплантата, которое является общепринятым расстоянием. Дополнительные, более высокие уровни 8 Вт менее 1000 МГц и 2 Вт менее 1000 МГц имитаций на более близких расстояниях позволяют изготовителю делать выводы о повышенной работоспособности или помехоустойчивости. Так как это тестирование является дополнительным, изготовитель имеет право по своему усмотрению установить критерии эффективности, на основе которых их произвести.
28.1 В дополнительной информации изготовитель обязан предоставить пользователю альтернативные пути установления контакта, особенно в случае острой необходимости.
28.12 МРТ становится очень важной и широко применяемой процедурой диагностики. Очень важно, чтобы пациент и врач понимали риски, связанные с имплантируемым изделием. Если изготовитель не может обеспечить убедительного доказательства совместимости, необходимо предупреждение о возможности риска, до того момента, пока не будут разработаны стандартизированные процедуры и требования для оценки работы изделия и безопасности пациентов.
28.19 Имплантируемый нейростимулятор может иметь неимплантируемые части, которые содержат источник энергии. Требование не относится к неисчерпаемым источникам энергии, таким, как изделия с проводным питанием.
28.22 Электронные системы защиты от кражи и подобные им системы видеонаблюдения находятся повсюду в общественной среде, и их не всегда можно избежать или обнаружить. Также, существуют другие потенциальные источники электромагнитных помех, которые могут быть невидимыми для пациентов в повседневной жизни. По результатам испытаний в разделе 27, может быть необходимо включить предупреждения в документацию пользователя.
28.104 Текст в карте пациента, в котором говорится, что владелец карты имеет имплантированное медицинское изделие, будет служить напоминанием для пациента и персонала об обеспечении безопасности, принятии мер предосторожности и возможной необходимости избегать потенциально опасных электромагнитных помех или электромагнитного поля высокой мощности.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 10993-1:2003 | IDT | ГОСТ ISO 10993-1-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования" |
ISO 14708-1 | IDT | ГОСТ Р ИСО 14708-1-2012 "Имплантаты хирургические. Активные имплантируемые медицинские изделия. Часть 1. Общие требования к безопасности, маркировке и информации, предоставляемой изготовителем" |
ISO 14155-1:2003 | IDT | ГОСТ Р ИСО 14155-2014 "Клинические исследования. Надлежащая клиническая практика" |
ISO 14155-2:2003 | IDT | ГОСТ Р ИСО 14155-2014 "Клинические исследования. Надлежащая клиническая практика" |
ISO 14971:2007 | IDT | ГОСТ ISO 14971-2011 "Изделия медицинские. Применение менеджмента риска к медицинским изделиям" |
ISO 15223-1:2007 | IDT | ГОСТ Р ИСО 15223-1-2010 "Изделия медицинские. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации" |
ISO 780:2015 | - | * |
ISO/TR 14283:2004 | - | * |
IEC 60601-1:2005 | - | * |
IEC 60601-1-2:2007 | IDT | ГОСТ Р МЭК 60601-1-2-2014 "Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания" |
IEC 61000-2-5:1995 | IDT | ГОСТ Р 51317.2.5-2000 "Совместимость технических средств электромагнитная. Электромагнитная обстановка. Классификация электромагнитных помех в местах размещения технических средств" |
IEC 61000-4-3:2002 | - | * |
ANSI/AAMI PC69:2000 | - | * |
IEC/TR 61000-2-7:1998 | - | * |
IEC/TR 61000-2-3:1992 | - | * |
IEEE C95.1:1999 | - | * |
IEEE C95.6:2002 | - | * |
MIL-STD-461E:1999 | - | * |
IEC 62226-2-1 (2004) | - | * |
IEC/TS 61000-2-5:1995 | - | * |
CISPR 11:2004 | MOD | ГОСТ Р 51318.11-2006 "Совместимость технических средств электромагнитная. Промышленные, научные, медицинские и бытовые (ПНМБ) высокочастотные устройства. Радиопомехи индустриальные. Нормы и методы измерений" |
CISPR 14-1:2005 | - | ГОСТ 30805.14.1-2013 "Совместимость технических средств электромагнитная. Бытовые приборы, электрические инструменты и аналогичные устройства. Радиопомехи индустриальные. Нормы и методы измерений" |
CISPR 22:2006 | MOD | ГОСТ 30805.22-2013 "Совместимость технических средств электромагнитная. Оборудование информационных технологий. Радиопомехи индустриальные. Нормы и методы измерений" |
* Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. | ||
Библиография
[1] | ISO 780:1997, Packaging - Pictorial marking for handling of goods |
[2] | ISO 15223:2000, Medical devices - Symbols to be used with medical device labels, labelling and information to be supplied, Amendment 1:2002, Amendment 2:2004 |
[3] | European Pharmacopoeia, 3rd edition, 1977 (Council of Europe) |
[4] | ISO 10993-1:2003, Biological evaluation of medical devices - Part 1: Evaluation and testing |
[5] | ISO 14971:2007, Medical devices - Application of risk management to medical devices |
[6] | ISO 14155-1:2003, Clinical investigation of medical devices for human subjects - Part 1: General requirements |
[7] | ISO 14155-2:2003, Clinical investigation of medical devices for human subjects - Part 2: Clinical investigation plans |
[8] | ISO/TR 14283:2004, Implants for surgery - Fundamental principles |
[9] | WUST et al 1995, Int. J. Hyperthermia, 11, pp.151-167 |
[10] | Electric and magnetic fields associated with the use of electric power, NIEHS, June 2002 |
[11] | World Health Organization (WHO) web site (http://www.who.int/peh-emf/en/) |
[12] | National Grid Company (Warwick, UK) EMF web site (http://www.emfs.info/default.asp) |
[13] | Children's exposure to magnetic fields produced by U.S. television sets used for viewing programs and playing video games, Bioelectromagnetics, 21, pp.214-227, 2000, Tables 3 and 4 combined |
[14] | IEC/TR 61000-2-7:1998, Electromagnetic compatibility (EMC) - Part 2: Environment - Section 7: Low frequency magnetic fields in various environments |
[15] | IEC/TR 61000-2-3:1992, Electromagnetic compatibility (EMC) - Part 2: Environment - Section 3: Description of the environment - Radiated and non-network-frequency-related conducted phenomena |
[16] | RICKLI H, et al., Induction ovens and electromagnetic interference: What is the risk for patients with implanted pacemakers? PACE, 26, pp.1494-1497, 2002 |
[17] | BINGGELI, et al., Induction ovens and electromagnetic interference: What is the risk for patients with implanted cardioverter defibrillators? J. Cardio Electrophysiol.,16, pp.399-401, 2005 |
[18] | HIROSE, et al., Electromagnetic interference of implantable unipolar cardiac pacemakers by an induction oven. PACE, 28, pp.540-548, 2005 |
[19] | ICNIRP Guidelines: 1998, Guidelines for limiting exposure to time-varying electric, magnetic, and electromagnetic fields (up to 300 GHz), Health Physics Society |
[20] | IEEE C95.1:1999, Standard for Safety Levels with Respect to Human Exposure to Radio Frequency Electromagnetic Fields, 3 kHz to 300 GHz |
[21] | IEEE C95.6:2002, Standard for Safety Levels with Respect to Human Exposure to Electromagnetic Fields, 0-3 kHz |
[22] | MIL-STD-461E:1999, Test Specifications - Requirements for the Control of Electromagnetic Interference Characteristics of Subsystems and Equipment |
[23] | IEC/TS 61000-2-5:1995, Electromagnetic compatibility (EMC) - Part 2-5: Environment - Section 5: Classification of electromagnetic environments |
[24] | IEC 62226-2-1:2004, Exposure to electric or magnetic fields in the low and intermediate frequency range - Methods for calculating the current density and internal electric field induced in the human body - Part 2-1: Exposure to magnetic fields - 2D models |
[25] | TILLEY, A. R., Henry Dreyfuss Associates, The measure of man and woman, human factors in design, John Wiley & Sons, 2002 |
[26] | Additional anthropometric data: <http://www.roymech.co.uk/Useful_Tables/Human/Human_sizes.html> |
[27] | SCHOLTEN, A. and SILNY J., The interference threshold of unipolar cardiac pacemakers in extremely low frequency magnetic fields, J. Medical Engineering and Technology, 5, pp.185-194, 2001 |
[28] | CISPR 11:2004, Industrial, scientific and medical (ISM) radio-frequency equipment - Electromagnetic disturbance characteristics - Limits and methods of measurement |
[29] | CISPR 14-1:2005, Electromagnetic compatibility - Requirements for household appliances, electric tools and similar apparatus - Part 1: Emission |
[30] | CISPR 22:2006, Information technology equipment - Radio disturbance characteristics - Limits and methods of measurement |
[31] | FCC 47 CFR, Part 15, Telecommunication - Radio frequency devices |
[32] | ISO 31 (all parts), Quantities and units |
УДК 616.8-085.84:006.354 | ОКС 11.040.40 | Р29 | ОКП 944480 |
Ключевые слова: имплантируемое медицинское изделие, имплантаты хирургические, имплантируемый нейростимулятор | |||
Электронный текст документа
и сверен по:
, 2016