ГОСТ ISO 22119-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ
Полимеразная цепная реакция (ПЦР) в режиме реального времени для определения патогенных микроорганизмов в пищевых продуктах
Общие требования и определения
Microbiology of food and animal feeding stuffs. Real-time polymerase chain reaction (PCR) for the detection of food-borne pathogens. General requirements and definitions
МКС 07.100.30
65.120
67.050
Дата введения 2015-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением "Всероссийский научно-исследовательский институт консервной и овощесушильной промышленности" Российской академии сельскохозяйственных наук (ГНУ ВНИИКОП Россельхозакадемии)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (ТК 335)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 14 ноября 2013 г. N 44-2013)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
4 Настоящий стандарт идентичен международному стандарту ISO 22119:2011* Microbiology of food and animal feeding stuffs - Real-time polymerase chain reaction (PCR) for the detection of food-borne pathogens - General requirements and definitions (Микробиология пищевых продуктов и кормов для животных. Полимеразная цепная реакция (ПЦР) в режиме реального времени для определения патогенных микроорганизмов в пищевых продуктах. Общие требования и определения).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Перевод с английского языка (en).
Международный стандарт разработан техническим комитетом CEN/TC 275 "Продовольственные анализы - Горизонтальные методы" совместно с подкомитетом ISO TC 34/SC 9 "Микробиология" технического комитета по стандартизации ISO/TC 34 "Пищевые продукты" Международной организации по стандартизации (ISO).
Официальный экземпляр международного стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, имеется в Федеральном агентстве по техническому регулированию и метрологии.
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
Степень соответствия - идентичная (IDT)
5 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 2132-ст межгосударственный стандарт ГОСТ ISO 22119-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2015 года.
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Полимеразная цепная реакция (ПЦР) показала себя как быстрый, чувствительный и специфичный метод для обнаружения патогенных микроорганизмов в пищевой продукции и кормах для животных. Дальнейшее развитие технологии позволяет обнаруживать специфические ПЦР продукты, образующиеся в процессе амплификации. Принцип основан на возбуждении флуоресцентных маркеров в процессе ПЦР.
1 Область применения
Настоящий стандарт определяет условия для обнаружения патогенных микроорганизмов в пищевых продуктах и полученных из них изолятов с помощью полимеразной цепной реакции (ПЦР). Настоящий стандарт также определяет требования к амплификации и обнаружению последовательности нуклеиновых кислот (ДНК или РНК после обратной транскрипции) при проведении ПЦР в реальном времени.
Минимальные требования, изложенные в настоящем стандарте, являются основой для сопоставления и воспроизведения результатов в отдельных лабораториях и между различными лабораториями.
Настоящий стандарт также применим, например, для обнаружения пищевых патогенных микроорганизмов в пробах окружающей среды и кормов для животных.
Примечание - В связи с быстрым прогрессом в данной области приведенные примеры являются наиболее часто используемыми на момент разработки стандарта.
2 Нормативные ссылки
Следующие ссылочные документы* являются обязательными для применения настоящего стандарта. Для устаревших ссылок применяется только цитируемое издание. Для недатированных ссылок применяется самое последнее издание ссылочного документа (включая поправки).
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 20838 Microbiology of food and animal feeding stuffs - Polymerase chain reaction (PCR) for the detection of food-borne pathogens - Requirements for amplification and detection for qualitative methods (Микробиология пищевых продуктов и кормов для животных - Полимеразная цепная реакция (ПЦР) для обнаружения и количественного учета патогенных микроорганизмов в пищевых продуктах - Требования к амплификации и обнаружению для качественного анализа)
ISO 22174:2005 Microbiology of food and animal feeding stuffs - Polymerase chain reaction (PCR) for the detection of food-borne pathogens - General requirements and definitions (Микробиология пищевых продуктов и кормов для животных - Полимеразная цепная реакция (ПЦР) для обнаружения и количественного учета патогенных микроорганизмов в пищевых продуктах - Общие требования и определения)
3 Термины и определения
В настоящем стандарте применяются следующие термины с соответствующими определениями.
3.1 Полимеразная цепная реакция в режиме реального времени: Ферментативная реакция, сочетающая в себе амплификацию специфичных сегментов ДНК в процессе денатурации, отжиг специфичных праймеров и синтез ДНК с обнаружением специфичных ПЦР продуктов в течение процесса амплификации.
Примечания
1 Как правило, смесь для реакции амплификации содержит одну или несколько проб специфичной ДНК в сочетании с одним или несколькими флуоресцентными красителями. При использовании данной технологии сигнал генерируется после специфичной гибридизации проб с целевой последовательностью нуклеиновых кислот и возбуждения светом определенной длины волны.
2 При проверке положительных результатов в соответствии с ISO 20838 могут использоваться неспецифично связывающиеся с ДНК флуоресцентные красители.
3.2 ПЦР-продукт: Фрагмент ДНК, амплифицированный в ПЦР.
3.3 флуоресцентно-резонансный перенос энергии: (обнаружение патогенов в продуктах питания с помощью ПЦР) зависящая от расстояния передача энергии от молекулы донора к молекуле акцептора, приводящая к повышению флуоресценции молекулы акцептора при возбуждении электромагнитного излучения определенной длины волны.
Примечание - Источник: [2].
3.4 репортер: (обнаружение патогенов в продуктах питания с помощью ПЦР) Флуоресцентные молекулы, использующиеся для обнаружения гибридизации специфических зондов при возбуждении электромагнитного излучения определенной длины волны.
3.5 гаситель: (обнаружение патогенов в продуктах питания с помощью ПЦР) флуоресцентные молекулы, выступающие в качестве акцептора энергии и тем самым гасящие/выключающие флуоресцентный сигнал от репортерного гена (донора).
3.6 темный гаситель: Молекула, выступающая в качестве акцептора, не излучает энергию в спектральном диапазоне, который может быть обнаружен оптической системой обнаружения прибора ПЦР в реальном времени.
3.7 5'-3'-экзонуклеазная активность: Способность фермента, например, полимеразы нуклеиновых кислот, расщеплять гибридизованные молекулы нуклеиновой кислоты в направлении 5'-3'.
Примечание - Активность 5'-3'-экзонуклеазы направлена на двойную скрученную цепь ДНК. Она зависит от типа фермента и может быть представлена, например, Taq-, Tth и TFL-полимеразами.
3.8 флуоресцентный зонд: Олигонуклеотид или аналог олигонуклеотида определенной последовательности в сочетании с одной или несколькими флуоресцентными молекулами.
Примечание - Любая система, излучающая флуоресцирующий сигнал после специфической гибридизации с целевой последовательностью нуклеиновых кислот, может быть использована в качестве флуоресцентного зонда.
3.9 гидролизуемый зонд: Флуоресцентный зонд в сочетании с двумя флуоресцентными молекулами, которые пространственно отделены друг от друга 5'-3'-экзонуклеазной активностью фермента в процессе амплификации.
Примечание - Принцип гидролизуемого зонда изображен на рисунке 1.
а) Негибридизованный зонд в растворе

б) Расщепление гибридизованного зонда

с) Результат расщепления зонда после возбуждения флуоресценции репортера
Обозначение
1 - ДНК субстрат.
2 - Флуоресцентные молекулы (репортер).
3 - Гасящие молекулы.
4 - Фермент.
Рисунок 1 - Принцип гидролиза зонда
3.10 зонд гибридизации: Система из двух флуоресцентных зондов, каждый из которых связан с одной флуоресцентной молекулой, где одна молекула служит донором, другая акцептором.
Примечание - Принцип гибридизации зонда изображен на рисунке 2.
а) Негибридизованный зонд в растворе

б) Гибридизация зондов в результате флуоресценции акцептора
Обозначение
1 - ДНК субстрат.
2 - Молекула акцептора.
3 - Молекула донора.
Рисунок 2 - Принцип гибридизации зонда
3.11 молекулярный маяк: Флуоресцентный зонд. состоит из трех частей: центральная часть, комплементарная целевой последовательности нуклеиновой кислоты, а также 5'-части и 3'-части, комплементарные друг другу; репортерный ген прикреплен к одному концу молекулы, в то время как другой конец несет гаситель.
Примечание - Принцип молекулярного маяка изображен на рисунке 3.
а) Негибридизованный молекулярный маяк в растворе

б) Молекулярный маяк, гибридизованный в результате флуоресценции
Обозначение
1 - ДНК субстрат.
2 - Флуоресцентные молекулы (репортер).
3 - Гасящая молекула.
Рисунок 3 - Принцип молекулярного маяка
3.12 зонд для определения специфичной последовательности ДНК патогенна: Зонд с последовательностью, комплементарной ДНК патогенна, с репортерным геном, излучающим сигнал определенной длины волны, который может быть обнаружен с помощью оптической системы обнаружения.
3.13 зонд для определения внутреннего контроля последовательности нуклеиновых кислот: Зонд с репортерным геном, предназначенный для подтверждения эффективности амплификации.
Примечания
1 Зонд испускает сигнал, явно отличающийся от сигнала зонда, предназначенного для обнаружения специфичного возбудителя.
2 Применение системы внутреннего контроля требует использования приборов, способных регистрировать различные длины волн.
3.14 пассивные ссылки: Флуоресцентные молекулы, присутствующие в реакционной смеси, использующиеся для нормализации сигнала.
Примечание - Это могут быть двойные молекулы нуклеиновой кислоты или другие молекулы, не принимающие участия в реакции.
3.15 базовый уровень обнаружения флуоресценции, "базовая линия": Точка, в которой реакция достигает интенсивности флуоресценции выше фоновой.
3.16 фоновая флуоресценция, "фон": Внутренний уровень флуоресценции, достигающийся в результате использования реагентов и расходных материалов.
3.17 пороговый цикл пересечения точки: Точка кривой амплификации, в которой сигнал флуоресценции поднимается выше базового или пересекает предопределенные пороговые значения.
4 Принципы
4.1 Общие положения
ПЦР в режиме реального времени обычно состоит из:
a) амплификации специфической целевой последовательности с помощью ПЦР в присутствии флуоресцентных зондов;
b) связывания флуоресцентных зондов в каждом цикле амплификации;
c) генерации флуоресцентного сигнала при возбуждении во время каждого цикла;
d) контроля флуоресценции сигналов оптической системой обнаружения;
e) анализа данных.
Примечание - Для целей скрининга могут быть использованы флуоресцентные сигналы от красителей, связанных с двойной молекулой ДНК.
4.2 Зонды для ПЦР в режиме реального времени
4.2.1 Гидролизуемые зонды
Зонды гидролиза представляют собой специфические олигонуклеотиды, присутствующие в ПЦР вместе с праймерами для ПЦР. Один конец зонда несет флуоресцентную молекулу репортерного гена со спектром излучения, который гасится второй молекулой, находящейся на другом конце.
Зонд гибридизуется с целевой последовательностью нуклеиновой кислоты. На этапе элонгации цепи ДНК, 5'-3'-экзонуклеазная активность ДНК-полимеразы расщепляет гибридизованный зонд. После расщепления репортерный ген отделяется от гасителя, в результате чего интенсивность флуоресценции репортера увеличивается. Конечный сигнал флуоресценции пропорционален количеству специфичного ПЦР-продукта.
3'-конец зонда должен быть заблокирован, чтобы предотвратить его распространение в ПЦР.
4.2.2 Зонды гибридизации
Два гибридизационных зонда представлены в ПЦР как специфические олигонуклеотиды, связанные с праймерами ПЦР. Эти зонды, каждый из которых содержит флуоресцентные молекулы, одна из которых выступает в качестве донора, другая в качестве акцептора, гибридизуются с целевой последовательностью нуклеиновых кислот. После гибридизации красители оказываются в непосредственной близости так, что при возбуждении происходит флуоресцентно-резонансный перенос энергии, и молекула акцептора генерирует сигнал, который можно обнаружить, конечный сигнал флуоресценции пропорционален количеству специфичного ПЦР-продукта.
3'-конец зонда должен быть заблокирован, чтобы предотвратить его распространение в ПЦР.
4.2.3 Молекулярные маяки
Молекулярные маяки представляют собой специфические олигонуклеотиды, присутствующие в ПЦР вместе с праймерами для ПЦР.
Когда молекулярные маяки связываются с комлементарной целевой последовательностью при определенной температуре гибридизации, они подвергаются конформационной трансформации, которая приводит к разделению ствола. Это приводит к образованию гибрида зонда и мишени, который является более длинным и стабильным, чем ствол. Это в свою очередь приводит к разделению репортерного гена и гасителя, в результате чего репортер генерирует сигнал [3]. Конечный сигнал флуоресценции пропорционален количеству специфичного ПЦР-продукта.
5 Общие требования к лаборатории
Общелабораторные требования должны быть выполнены в соответствии с ISO 22174.
6 Реактивы и материалы
6.1 Общие положения
В ходе анализа, если не указано иное, используют только реагенты, признанные чистыми для анализа, и стерильную дистиллированную или деминерализованную воду или воду эквивалентной чистоты, свободную от нуклеиновых кислот и нуклеаз, подходящие для молекулярного биологического анализа.
Не допускается использование любых реагентов или расходных материалов, например, компонентов обогащенных бульонов, флуоресценция которых интерферирует с системой обнаружения.
Особые требования применяются к реагентам, указанным в пунктах 6.2-6.6.
6.2 ДНК-полимераза и реакционный буфер
6.2.1 ДНК-полимераза
Термостабильная полимераза (возможно, с активностью обратной транскриптазы), используемая для ПЦР. Она должна быть использована в соответствии с указаниями производителя.
Примечание - Она может быть очищенной, в виде нативного фермента, или очищенной, генетически модифицированной рекомбинантной формой фермента.
Если будут использоваться зонды гидролиза, ДНК-полимераза должна обладать 5'-3'-экзонуклеазной активностью. Для анализа РНК требуется смесь обратной транскриптазы и ферментов ДНК-полимеразы или ДНК-полимераза с активностью обратной транскриптазы.
Каждая ДНК-полимераза может требовать различных экспериментальных условий.
6.2.2 Реакционный буфер
Реакционный буфер должен соответствовать требованиям, изложенным в ISO 20838.
6.3 Дезоксирибонуклеотид трифосфаты (dNTPs) для ПЦР
dNTPs должны соответствовать требованиям, изложенным в ISO 20838.
6.4 Праймеры
Праймеры должны соответствовать требованиям, изложенным в ISO 20838.
6.5 Флуоресцентные зонды для обнаружения в режиме реального времени
Олигонуклеотиды должны быть надлежащего качества и должны быть предназначены для обнаружения последовательности, присущей специфическому ПЦР-продукту. Последовательность зонда должна быть высоко комплиментарна целевой последовательности ДНК.
6.6 Внутренний контроль амплификации
Эффективность амплификации тестового образца может быть проверена с помощью фрагмента ДНК контроля, добавленного в ту же реакционную емкость, что и эксрагированная ДНК из тестового образца. Также возможно использовать те же пары праймеров для амплификации фрагмента контрольной ДНК, как и для амплификации целевой ДНК (гомологичный внутренний контроль амплификации) или другую пару праймеров (гетерологичный внутренний контроль амплификации). Система с целевым геном и система с внутренним контролем амплификации должны в результате показать приблизительно равную эффективность амплификации. Концентрация добавленного фрагмента контрольной ДНК должна быть как можно более низкой, чтобы обнаружить даже небольшое ингибирование и в то же время дать статистически воспроизводимый положительный результат. Далее, должно быть установлено, что внутренний контроль амплификации не влияет на уровень обнаружения целевого гена.
Следующие положения снижают риск негативных влияний на уровень обнаружения:
- эффективность амплификации гомологичного внутреннего контроля амплификации несколько ниже, чем целевой ДНК;
- снижение концентрации праймеров для гетерологичного внутреннего контроля амплификации.
Контроль внутренней амплификации может добавляться в образцы на ранней стадии анализа, и, следовательно, в то же время выступать в качестве контроля процедуры экстракции.
6.7 Реагенты для предотвращения механической контаминации
Реагенты для предотвращения механической контаминации должны соответствовать требованиям, изложенным в ISO 20838.
7 Оборудование
7.1 Общие положения
Оборудование должно соответствовать требованиям, изложенным в ISO 22174.
В лаборатории используют оборудование, содержащееся в надлежащем состоянии и подходящее для методов исследования.
7.2 Специальные приборы и оборудование
В дополнение к обычному лабораторному оборудованию, а также оборудованию, указанному в ISO 22174, используют следующие аппараты.
7.2.1 Термоциклер, оснащенный:
a) источником энергии, подходящим для возбуждения флуоресцентных молекул;
b) оптической системой обнаружения для обнаружения флуоресцентных сигналов, генерируемых в процессе ПЦР.
Применение системы внутреннего контроля требует использования инструментов, способных обнаружить сигналы различных длин волн.
7.2.2 Реакционные емкости и крышки или затворы, которые могут многократно нагреваться до температуры 100 °С и охлаждаться до 4 °С без повреждений и не влияющие на сигнал флуоресценции, генерируемый в процессе амплификации.
8 Лабораторная проба
Экстракты, содержащие нуклеиновые кислоты из любой пробы, соответствующего области применения, могут использоваться в качестве лабораторных проб при условии отсутствия видимого ингибирования ПЦР и помех флуоресценции.
9 Процедура
9.1 Пробоподготовка
Экстракция нуклеиновых кислот и/или очистка тестового образца должны осуществляться в соответствии с методом, изложенным в ISO 20837 [1].
В результате, раствор нуклеиновых кислот должен содержать достаточное количество целевой нуклеиновой кислоты достаточно высокого качества так, чтобы для качественного анализа от одного до 10 целевых микроорганизмов или эквивалентов вирусных геномов были определены в тестовой пробе. Обогащение и/или концентрация целевого микроорганизма или вируса обычно требует для качественного анализа небольшое число целевых организмов в тестовой порции.
В результате раствор нуклеиновых кислот должен содержать вещества, которые не ингибируют ПЦР, не создают помех для флуоресценции.
Примечание - Флуоресценция зачастую происходит из окрашенных реакционных емкостей и некоторых ингредиентов обогащенных бульонов.
Количественный анализ требует процедуры подготовки образцов, гарантирующей, что количество нуклеиновых кислот целевых микроорганизмов или вирусов в конечном растворе нуклеиновых кислот высоко воспроизводимое.
9.2 Амплификация
9.2.1 Общие положения
Амплификация специфических нуклеиновых кислот осуществляется in vitro с помощью реакции, катализируемой ДНК-полимеразой в присутствии олигонуклеотидов, праймеров, дезоксинуклеозид трифосфатов и флуоресцентных зондов в определенном буфере реакции.
В дополнение к стандартной ПЦР, при постановке реакционной смеси необходимо избегать использования цветных наконечников и реакционных емкостей. Следует принять меры для предотвращения контаминации частицами пыли вне реакционных сосудов.
Сигнал флуоресцентного зонда контролируется на протяжении всего процесса амплификации.
РНК может быть обнаружена с помощью ПЦР в реальном времени, если последовательность была изначально транскрибирована в комплементарную последовательность ДНК с помощью обратной транскрипции.
9.2.2 Параметры циклеров
9.2.2.1 Зонды гидролиза
В целом, процесс амплификации использует протокол двухступенчатого цикла с денатурацией и комбинированными праймерами и зондами отжига и шагом элонгации. Флуоресцентный сигнал контролируется на протяжении отжига и шага элонгации.
9.2.2.2 Зонды гибридизации
Процесс амплификации использует протокол трехступенчатого цикла с денатурацией, праймерами и зондами отжига и шагом элонгации. Флуоресцентный сигнал контролируется во время отжига.
9.2.2.3 Молекулярные маяки
В целом, процесс амплификации использует протокол трехступенчатого цикла с денатруацией, праймерами и молекулярными маяками отжига и шагом элонгации. Флуоресцентный сигнал контролируется во время отжига.
9.3 Оценка результатов
Оценка результатов испытания - по ISO 22174.
ПЦР в реальном времени позволяет одновременно определить и разделить сигналы специфических патогенов и внутреннего контроля амплификации. Следовательно, рекомендуется использовать внутренний контроль амплификации.
9.4 Анализ данных флуоресценции
9.4.1 Участок амплификации
9.4.1.1 Общие положения
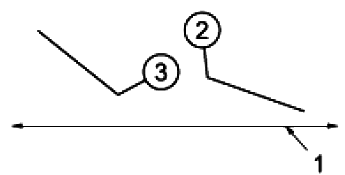
В процессе амплификации количество обнаруживаемых ПЦР-продуктов увеличивается. Увеличение флуоресцентного сигнала связано с увеличением количества ПЦР-продуктов. Это может быть графически изображено на кривой амплификации (см. рисунок 4).
Обозначение
* - число амплифицированных молекул.
___________________
* Обозначение соответствует оригиналу. - .
- число циклов амплификации.
1 - экспоненциальная фаза.
2 - линейная фаза.
3 - фаза плато.
Рисунок 4 - Кривая амплификации
Типичная кривая амплификации состоит из трех этапов, характеризующих процесс ПЦР.
9.4.1.2 Фаза 1: Экспоненциальная фаза
Экспоненциальная фаза представляет собой цикл диапазона высокой точности, который характеризуется высокой и постоянной эффективностью амплификации. Во время экспоненциальной фазы отношение ПЦР-продукта может быть описано уравнением (1):
![]() (1)
(1)
где - число амплифицированных молекул;
- начальное число целевых молекул;
- эффективность системы;
- число циклов амплификации.
9.4.1.3 Фаза 2: Линейная фаза
Линейная фаза характеризуется выравниванием эффекта, когда наклон кривой амплификации постоянно уменьшается. В этот момент один или несколько компонентов падают ниже критической концентрации и эффективность амплификации начинает уменьшаться. Фаза называется линейной, так как амплификация приближается к арифметической прогрессии в большей степени, чем к геометрической.
9.4.1.4 Фаза 3: Фаза плато
На плато амплификация ПЦР останавливается, и сигнал остается относительно постоянным [4].
9.4.2 Оценка данных флуоресценции
Положительные образцы генерируют возникновение участка амплификации, по крайней мере, первой фазы типичной кривой амплификации. Кривая амплификации этих образцов пересекает пороговое значение после определенного числа циклов. Образцы с флуоресцентным сигналом выше порогового считаются положительными.
9.4.3 Количественный анализ
9.4.3.1 Общие положения
Количественный анализ определяет флуоресценцию, соответствующую количеству нуклеиновых кислот целевой последовательности, сгенерированную в течение фазы амплификации ПЦР. Это может быть использовано для определения начального количества целевых нуклеиновых кислот в образце-мишени.
Целевые нуклеиновые кислоты количественно учитываются со ссылкой на стандартную кривую.
Другие методы могут быть применены, если была продемонстрирована их точность.
9.4.3.2 Метод стандартной кривой для количественного учета
Любая стабильная и чистая РНК или ДНК с известной концентрацией может быть использована для подготовки стандартной кривой для последовательного разведения. Эффективность амплификации стандартной кривой и целевой нуклеиновой кислоты должны находиться в строгом соответствии. Плазмидная ДНК и транскрибируемая in vitro РНК, как правило, используются для подготовки стандартов.
Целевая концентрация должна попадать в диапазон калибровочной кривой.
Должно быть применено соответствующее число точек калибровки и повторов, охватывающих диапазон количественного учета [например, по крайней мере четыре калибровочные точки с двумя повторами (в общей сложность 4 на 2 значения) или шесть калибровочных точек с одним значением в каждой точке (всего 6 точек)].
10 Оценка и документация
Оценка возможна при условии, что результаты, полученные с контрольной группой, указанной в 9.3, однозначны. Возможные результаты ПЦР приведены в ISO 22174, таблица 2.
Приложение ДА
(справочное)
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 20838:2006 | - | * |
ISO 22174:2005 | - | * |
* Соответствующий межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в национальном информационном фонде технических регламентов и стандартов. | ||
Библиография
[1] | ISO 20837 | Microbiology of food and animal feeding stuffs - Polymerase chain reaction (PCR) for the detection of food-borne pathogens - Requirements for sample preparation for qualitative detection |
[2] | Т. FORSTER Intermolecular energy migration and fluorescence. Ann. Phys. 1948, 2, p.55-75 | |
[3] | S.A. BUSTIN Quantification of mRNA using real-time RT-PCR: Trends and problems. J. Mol. Endocrinol. 2002, 29, p.23-39 | |
[4] | APPLIED BIOSYSTEMS. ABI Prism® 7900HТ | |
_______________
Пример продукта на коммерческой основе. Эта информация приведена для удобства пользователей данного документа и не является одобрением ISO данного продукта.
_______________________________________________________________________________
УДК 579.672:006.354 MКC 07.100.30 IDT
65.120
67.050
Ключевые слова: продукты пищевые, патогенные микроорганизмы, ПЦР в реальном времени, принцип, методика, внутренний контроль амплификации, реактивы, оборудование, чувствительность, флуоресцентный зонд
________________________________________________________________________________
Электронный текст документа
и сверен по:
, 2014