ГОСТ 30425-97
Группа Н59
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
КОНСЕРВЫ
Метод определения промышленной стерильности
Canned foods. Method for determination of commercial sterility
МКС 07.100.30
67.080.01
ОКСТУ 9109
Дата введения 1998-01-01
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским институтом консервной и овощесушильной промышленности (ВНИИКОП) и МТК 93 "Продукты переработки плодов и овощей"
ВНЕСЕН Госстандартом России
2 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол N 11 от 25 апреля 1997 г.)
За принятие проголосовали:
Наименование государства | Наименование национального органа по стандартизации |
Азербайджанская Республика | Азгосстандарт |
Республика Армения | Армгосстандарт |
Республика Белоруссия | Госстандарт Белоруссии |
Республика Казахстан | Госстандарт Республики Казахстан |
Киргизская Республика | Киргизстандарт |
Республика Молдова | Молдовастандарт |
Российская Федерация | Госстандарт России |
Республика Таджикистан | Таджикгосстандарт |
Республика Узбекистан | Узгосстандарт |
Украина | Госстандарт Украины |
3 Постановлением Государственного комитета Российской Федерации по стандартизации, метрологии и сертификации от 18 августа 1997 г. N 279 межгосударственный стандарт ГОСТ 30425-97 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1 января 1998 г.
5* ВЗАМЕН ГОСТ 10444.3-85, ГОСТ 10444.4-85, ГОСТ 10444.5-85, ГОСТ 10444.6-85
_________________
* Нумерация соответствует оригиналу. - .
6 ПЕРЕИЗДАНИЕ. Апрель 2010 г.
1 Область применения
Настоящий стандарт распространяется на все виды полных консервов и устанавливает метод определения их промышленной стерильности.
Термины, применяемые в стандарте, и пояснения к ним приведены в приложении А.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 10444.7-86 Продукты пищевые. Методы выявления ботулинических токсинов и Clostridium botulinum
ГОСТ 10444.8-88 Продукты пищевые. Метод определения Bacillus cereus
ГОСТ 10444.9-88 Продукты пищевые. Метод определения Clostridium perfringens
ГОСТ 10444.11-89 Продукты пищевые. Методы определения молочнокислых микроорганизмов
ГОСТ 10444.12-88 Продукты пищевые. Метод определения дрожжей и плесневых грибов
ГОСТ 10444.15-94 Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
ГОСТ 18963-73 Вода питьевая. Методы санитарно-бактериологического анализа
ГОСТ 21241-89 Пинцеты медицинские. Общие технические требования и методы испытаний
ГОСТ 24104-88* Весы лабораторные общего назначения и образцовые. Общие технические условия
________________
* С 1 июля 2002 г. введен в действие ГОСТ 24104-2001. На территории Российской Федерации действует ГОСТ Р 53228-2008.
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26188-84 Продукты переработки плодов и овощей, консервы мясные и мясорастительные. Метод определения рН
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 30518-97/ГОСТ Р 50474-97 Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)*
________________
* На территории Российской Федерации действует ГОСТ Р 52816-2007.
3 Сущность метода
Метод основан на определении внешнего вида и герметичности консервов, выявлении в продукте жизнеспособных микроорганизмов и, при необходимости, определении их количества, микроскопировании продукта, а в случаях, предусмотренных нормативным документом на конкретный вид консервов, определении рН продукта.
Схема проведения анализа консервов на промышленную стерильность приведена в приложении Б.
4 Отбор проб
Отбор проб по ГОСТ 26668.
5 Аппаратура, материалы, реактивы, краски, индикаторы и питательные среды
Для проведения анализа применяют:
баню водяную с терморегулятором, позволяющим поддерживать температуру от 20 до 100 °С и пределом допускаемой погрешности ±1 °С;
весы лабораторные общего назначения по ГОСТ 24104 с наибольшим пределом взвешивания до 1 кг и пределом допускаемой погрешности ±10 мг*;
________________
* Письмом Росстандарта от 31.05.2021 г. N 2025-ОГ/03 разъясняется, что "в ГОСТ 30425-97 допущены опечатки в части указанных метрологических характеристик весов. Для взвешивания реактивов и питательных сред могут быть использованы весы II высокого класса точности, (ГОСТ OIML R 76-1-2011 «Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания») с дискретностью 0,001 г, ценой поверочного деления 10 мг. Для взвешивания продукта могут быть использованы весы лабораторные с наибольшим пределом взвешивания 1 кг II высокого класса точности, (ГОСТ OIML R 76-1-2011) с дискретностью 0,01 г, ценой поверочного деления 100 мг.
Дополнительные технические и метрологические характеристики, в том числе пределы допускаемой погрешности таких весов указываются производителями в описании типа". - .
гомогенизатор лабораторный или размельчитель тканей;
горелку газовую или спиртовую;
колбы плоскодонные конические или круглые разной вместимости по ГОСТ 25336;
микроскоп биологический с приспособлением для фазово-контрастного микроскопирования, обеспечивающий увеличение 900-1000;
петлю бактериологическую;
пинцет по ГОСТ 21241;
пипетки градуированные вместимостью 1, 2, 5 и 10 см по ГОСТ 29227 исполнений 1 и 2;
пробирки бактериологические по ГОСТ 25336;
растворы реактивов, красок, индикаторов и питательные среды по ГОСТ 10444.1 и ГОСТ 30518-97/ГОСТ Р 50474-97, лактозо-пептонную среду по ГОСТ 18963;
реактивы, обеспечивающие анаэробные условия культивирования посевов по ГОСТ 10444.1 и (или) анаэростат;
рН-метр;
стекла предметные по ГОСТ 9284;
стекла покровные по ГОСТ 6672;
термостаты, обеспечивающие поддержание температур 55-62 °С, (37±1) °С, (30±1) °С и (24±1) °С;
трубки Beйона.
Допускается использование другой аппаратуры, материалов, реактивов, по техническим характеристикам не уступающих указанным выше.
6 Подготовка к анализу
6.1 Осмотр, регистрацию, санитарную обработку, контроль герметичности тары и термостатирование консервов проводят по ГОСТ 26669.
6.2 Если обнаружена негерметичность швов или укупорки тары или после термостатирования и охлаждения консервов до комнатной температуры обнаружены дефектные банки, то консервы не подлежат оценке на промышленную стерильность и не подвергаются дальнейшему анализу.
6.3 Перед анализом пастеризованных газированных фруктовых соков и напитков необходимое количество продукта отбирают в стерильную колбу с ватной пробкой. Отобранную пробу помещают в водяную баню температурой 30-35 °С и, встряхивая колбу, освобождают продукт от двуокиси углерода, конец освобождения определяют по отсутствию выделения пузырьков газа. Затем продукт нейтрализуют до рН (7,0±0,3) раствором гидроокиси натрия массовой концентрацией 100 г/дм, предварительно простерилизованным при температуре (120±1) °С в течение 15 мин. Значение рН контролируют по индикаторной бумаге или с помощью рН-метра, для чего небольшое количество продукта отбирают в отдельную посуду.
7 Проведение анализа
7.1 Навески консервов для высева в питательные среды отбирают по ГОСТ 26668. В подозрительных консервах при наличии кольца на границе продукта с тарой или осадка на дне банки навески отбирают без предварительного перемешивания продукта для того, чтобы в навеску попала часть осадка или кольца.
При ограниченном количестве единиц упаковок допускается отбирать навески консервов из упаковок, прошедших термостатирование при температуре 30-37 °С, для выявления не только мезофильных, но и термофильных микроорганизмов.
7.2 Навески консервов для определения рН отбирают по ГОСТ 26188 с соблюдением правил асептики непосредственно после отбора навесок по 7.1, одновременно отбирают навески для микроскопирования консервированного продукта.
7.3 Масса или объем навески продукта должны составлять:
для высева в две пробирки с жидкой питательной средой - (2,0±0,1) г или (2,0±0,1) см при выявлении аэробных, факультативно-анаэробных и анаэробных микроорганизмов;
для высева в две пробирки с питательной средой - (10,0±0,1) г или (10,0±0,1) см при выявлении анаэробных микроорганизмов в консервах детского и диетического питания;
для высева глубинным методом в чашку Петри - (1,0±0,1) г или (1,0±0,1) см;
для приготовления разведения не менее (10,0±0,1) г или (10,0±0,1) см;
для определения рН в количестве, необходимом для погружения электродов в анализируемый продукт.
7.4 После отбора навесок продукта консервы сохраняют до окончания анализа и оформления результатов при температуре (4±2) °С в условиях, исключающих их повторное заражение микроорганизмами. Если в посевах будут выявлены жизнеспособные микроорганизмы, то при необходимости, из соответствующей банки, хранящейся при температуре (4±2) °С, в соответствии с требованиями нормативного документа отбирают дополнительные навески продукта для высева в питательные среды с целью количественного подсчета обнаруженных микроорганизмов.
7.5 Для определения промышленной стерильности консервов в каждой единице упаковки консервов устанавливают отсутствие (присутствие) тех групп микроорганизмов, показатели и нормы по которым приведены в нормативном документе на анализируемый вид консервов.
В случаях, предусмотренных нормативным документом на конкретный вид консервированного продукта, а также при выяснении причин возникновения дефектов консервов проводят подсчет количества или наиболее вероятного числа (НВЧ) выявляемых микроорганизмов.
7.6 При отсутствии требований к микробиологическим показателям в зависимости от принадлежности консервов к определенной группе в них выявляют следующие микроорганизмы (деление консервов на группы приведено в приложении А):
В низкокислотных консервах (группы А), предназначенных к реализации при температуре ниже 40 °С, выявляют жизнеспособные мезофильные аэробные, факультативно-анаэробные и анаэробные микроорганизмы.
В низкокислотных консервах (группы А), которые могут при реализации подвергаться воздействию температуры 40 °С и выше, дополнительно выявляют термофильные аэробные, факультативно-анаэробные и анаэробные микроорганизмы, выделяя среди них кислотообразующие бациллы.
В консервах групп Б и В выявляют мезофильные анаэробные микроорганизмы, плесневые грибы, дрожжи и молочнокислые микроорганизмы.
В консервах группы Г выявляют плесневые грибы, дрожжи и молочнокислые микроорганизмы.
В концентрированных плодово-ягодных консервах группы Г (соках концентрированных, варенье, джеме, повидле, конфитюре и др.) выявляют плесневые грибы и дрожжи.
В пастеризованных газированных фруктовых соках и напитках (группы Е) определяют количество:
мезофильных аэробных и факультативно-анаэробных микроорганизмов;
бактерий группы кишечных палочек (колиформных бактерий);
плесневых грибов.
Кроме этого, в консервах группы Е выявляют дрожжи и молочнокислые микроорганизмы.
7.7 Выявление и определение количества аэробных, факультативно-анаэробных и анаэробных микроорганизмов
7.7.1 Для выявления жизнеспособных мезофильных аэробных и факультативно-анаэробных микроорганизмов в каждую из двух пробирок, содержащих по 5-6 см жидкой питательной среды, вносят по (1,0±0,1) г или (1,0±0,1) см
консервированного продукта.
Перечень используемых для выявления мезофильных аэробных и факультативно-анаэробных микроорганизмов питательных сред, их состав и приготовление по ГОСТ 10444.1.
7.7.2 Для выявления жизнеспособных мезофильных анаэробных микроорганизмов на дно каждой из двух пробирок с регенерированной питательной средой вносят по (1,0±0,1) г или (1,0±0,1) см консервированного продукта, при анализе консервов детского или диетического питания в каждую пробирку вносят по (5,0±0,1) г или (5,0±0,1) см
консервированного продукта.
Питательную среду регенерируют непосредственно перед использованием (приложение В, пункт В.2).
Перечень используемых для выявления мезофильных анаэробных микроорганизмов питательных сред, их состав и приготовление по ГОСТ 10444.1.
Высота слоя среды с внесенным продуктом в обычных пробирках должна быть 10-11 см, а в высоких, куда высевают (5,0±0,1) г или (5,0±0,1) см продукта, - 14-15 см. Количество питательной среды в высоких пробирках при этом должно составлять около 30 см
.
Сразу после посева на поверхность жидкой питательной среды, если она приготовлена без вазелинового масла, наслаивают голодный агар или вазелиновое масло, или парафиновую смесь, приготовленные по ГОСТ 10444.1, в таком количестве, чтобы образовался слой высотой около 2 см.
Допускается применение свежеприготовленных питательных сред без наслаивания голодного агара, вазелинового масла или парафиновой смеси (вазелиновое масло тормозит развитие анаэробных микроорганизмов при их пересеве с жидкой среды на агаризованную).
7.7.3 Посевы для выявления термофильных аэробных, факультативно-анаэробных и анаэробных микроорганизмов проводят по 7.7.1 и 7.7.2 (термофильные аэробные и факультативно-анаэробные микроорганизмы - по 7.7.1, термофильные анаэробные микроорганизмы - по 7.7.2) на питательные среды по ГОСТ 10444.1 для выявления этих групп микроорганизмов. Термофильные анаэробные микроорганизмы в консервах детского и диетического питания выявляют в (2,0±0,1) г или (2,0±0,1) см продукта.
7.7.4 При необходимости подсчета НВЧ аэробных, факультативно-анаэробных или анаэробных микроорганизмов посев продукта проводят с учетом требований ГОСТ 26670.
7.7.5 Посевы для выявления или подсчета количества мезофильных микроорганизмов термостатируют при температуре (30±1) °С, термофильных - при 55-62 °С до появления видимых признаков роста, но не менее 5 сут для мезофильных микроорганизмов и не менее 3 сут для термофильных микроорганизмов.
7.7.6 При необходимости подтверждения присутствия в консервах бацилл и (или) клостридий в споровой форме навески консервированного продукта дополнительно вносят параллельно в две пробирки со средами, указанными в 7.7.1, и (или) 7.7.2 и (или) 7.7.3. Посевы прогревают при температуре (80±1) °С в течение 20 мин при выявлении спор мезофильных микроорганизмов, при температуре (95±1) °С в течение 20 мин при выявлении спор термофильных микроорганизмов. Для прогрева пробирки с посевами помещают в предварительно нагретую до 50 °С водяную баню таким образом, чтобы уровень содержимого пробирок был на 2-3 см ниже, чем уровень воды в бане. Одновременно в водяную баню помещают контрольную пробирку с водой и термометром. Уровень воды в контрольной пробирке должен соответствовать уровню содержимого пробирок с посевами. Время термообработки начинают отсчитывать с того момента, когда температура воды в контрольной пробирке достигнет требуемой величины (80±1) °С или (95±1) °С. Период подогрева содержимого пробирок до требуемой температуры должен быть 2-3 мин. Посевы после 20 мин термообработки немедленно охлаждают в струе водопроводной воды и затем термостатируют по 7.7.5.
7.7.7 Во время термостатирования посевов проводят ежедневные наблюдения за появлением признаков развития микроорганизмов: помутнения среды, образования газа, пленки, осадка.
По мере необходимости из посевов отбирают культуральную жидкость для определения морфологии клеток, наличия спор, отношения к окраске по Граму, наличия глобул в бациллярных клетках и каталазной активности.
Тесты для определения принадлежности микроорганизмов к определенной группе приведены в приложении Г.
7.7.8 Принадлежность выделенных микроорганизмов к типичным группам мезофильных бацилл устанавливают по культуральным особенностям развития, способности к спорообразованию в аэробных условиях, положительной окраске по Граму, наличию каталазы, морфологическим особенностям протоплазмы клеток или спорангий.
Принадлежность микроорганизмов к мезофильным клостридиям устанавливают по культуральным особенностям развития, газообразованию, сульфитредуцирующей активности, способности к спорообразованию в анаэробных условиях, морфологии клеток, положительной окраске по Граму, отсутствию каталазы.
Принадлежность к термофильным аэробным и факультативно-анаэробным микроорганизмам устанавливают по изменению цвета среды, если она содержит индикатор - бромкрезоловый пурпурный, морфологии клеток, наличию спор, отношению к окраске по Граму, каталазной активности.
Принадлежность к термофильным анаэробным микроорганизмам устанавливают по культуральным особенностям развития, газообразованию, сульфатредуцирующей активности, способности к спорообразованию в анаэробных условиях, морфологии клеток, отношению к окраске по Граму, каталазной активности.
Отсутствие среди выявленных микроорганизмов устанавливают С. botulinum - по ГОСТ 10444.7, B.cereus - по ГОСТ 10444.8, С. perfringens - по ГОСТ 10444.9.
7.7.9 В случаях, когда присутствие продукта в культуральной жидкости затрудняет выявление жизнеспособных микроорганизмов, пересевают культуральную жидкость из посевов на чашки Петри. Для выявления анаэробных микроорганизмов проводят пересевы в пробирки или в трубки Вейона, или в чашки Петри под стекло или культивируют посевы в условиях, указанных в приложении В. Для получения отдельных колоний проводят посевы с использованием десятикратных разведений культуральной жидкости.
При подозрении на присутствие D. nigrificans в посевах на термофильные анаэробные микроорганизмы для пересевов используют молочно-сульфатную среду или среды, содержащие сульфиты. Посевы термостатируют при температуре 55-62 °С в течение 48 ч. Спорообразующие клостридии образуют большое количество газа на средах с глюкозой. D. nigrificans вызывает почернение сред, содержащих сульфиты или сульфаты.
7.7.10 Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов в пастеризованных газированных фруктовых соках и напитках проводят по ГОСТ 10444.15.
7.8 Выявление и определение количества плесневых грибов и дрожжей
Для выявления и определения количества плесневых грибов и дрожжей по (1,0±0,1) г или (1,0±0,1) см консервированного продукта вносят параллельно в две чашки Петри, которые заливают одной из агаризованных питательных сред, указанных в ГОСТ 10444.12.
Выявление плесневых грибов и дрожжей проводят путем посева продукта параллельно в две пробирки с 5-6 см жидкого солодового сусла или среды Сабуро. Посевы термостатируют при температуре (24±1) °С. Через 3 сут проводят предварительный учет типичных колоний или появления характерных признаков роста на жидких средах.
Если в посевах на агаризованных средах присутствуют мукоровые быстро растущие грибы, то при предварительном количественном подсчете типичных колоний необходимо чашки Петри переворачивать очень осторожно, не допуская того, чтобы споры этих грибов осыпались и дали рост вторичных колоний. Через 5 сут проводят окончательный учет результатов термостатирования посевов.
7.9 Выявление молочнокислых микроорганизмов
Для выявления молочнокислых микроорганизмов по (1,0±0,1) г или (1,0±0,1) см консервированного продукта вносят параллельно в две пробирки с жидкой питательной средой или в чашки Петри, которые заливают агаризованной средой.
Перечень используемых для выявления молочнокислых микроорганизмов питательных сред, их состав и приготовление приведены в ГОСТ 10444.11.
Посевы термостатируют при температуре (30±1) °С не более 5 сут или при температуре (37±1) °С не более 3 сут.
Принадлежность к молочнокислым микроорганизмам устанавливают по ГОСТ 10444.11 по культуральным признакам развития, морфологии клеток, по положительной окраске по Граму, отсутствию каталазы.
7.10 Выявление бактерий группы кишечных палочек (колиформных бактерий) в пастеризованных газированных фруктовых соках и напитках
Продукт, подготовленный по 6.3, для выявления колиформных бактерий высевают в количестве: трех объемов по 100 см, трех объемов по 10 см
и трех объемов по 1 см
. Каждый объем по 100 см
и 10 см
высевают соответственно в такое же количество одной из питательных сред двойной концентрации, а каждый объем по 1 см
- в 10 см
среды нормальной концентрации.
Перечень питательных сред для выявления колиформных бактерий, их состав и приготовление по ГОСТ 52816.
Объемы продукта 100 и 10 см можно высевать соответственно в 10 и 1 см
концентрированной лактозо-пептонной среды, а 1 см
- в 10 см
лактозо-пептонной среды нормальной концентрации. Лактозо-пептонную среду концентрированную и нормальной концентрации готовят по ГОСТ 18963.
Если продукта из одной упаковочной единицы недостаточно для определения микробиологических показателей, то объединяют две или более единицы в одну. Термостатирование посевов, пересевы на среду Эндо для выделения чистой культуры, подтверждение принадлежности выросших микроорганизмов к колиформным бактериям проводят по ГОСТ 30518/ГОСТ Р 50474.
7.11 Определение принадлежности выявленных микроорганизмов к определенной группе в соответствии с приложением А
7.12 Параллельно с посевом на питательные среды готовят препараты из продукта для фазово-контрастного микроскопирования и (или) для окраски по Граму. Если жировые включения продукта затрудняют микроскопирование, то на неостывшее после фиксации предметное стекло наносят каплю ксилола и удаляют его немедленно фильтровальной бумагой.
В препаратах выявляют жизнеспособные и нежизнеспособные микробные клетки, устанавливают их морфологию и присутствие спор, подсчитывают число обнаруженных микроорганизмов в поле зрения микроскопа при увеличении: окуляр 10 и объектив 90
. В препарате просматривают не менее 10 полей зрения.
7.13 В случаях, предусмотренных требованиями нормативного документа, в каждой исследуемой упаковочной единице консервов определяют значение рН для выявления возможного прокисания продукта.
8 Оценка результатов анализа
8.1 Промышленную стерильность оценивают по каждой упаковочной единице консервов отдельно.
По результатам определения герметичности тары, по внешнему виду консервов после термостатирования, по результатам микроскопирования консервированного продукта, значению рН и составу, а в случаях, указанных в нормативной документации, и по количеству обнаруженных в продукте микроорганизмов консервы оценивают как не подлежащие оценке на промышленную стерильность, отвечающие (или не отвечающие) требованиям промышленной стерильности.
8.2 Консервы не подлежат оценке на промышленную стерильность, если:
обнаружена негерметичность швов или укупорки тары;
после термостатирования и охлаждения консервов до комнатной температуры обнаружены дефектные банки;
при микроскопировании консервированного продукта, выработанного из продуктов, приготовленных без использования микробных культур, обнаружено большое число микроорганизмов (свыше 10 клеток в поле зрения);
рН консервированного продукта меньше на 0,5 и более допустимого значения, указанного в нормативном документе на конкретный вид консервов.
8.3 Если при анализе консервированного продукта в герметично укупоренной таре продукт сохранил после термостатирования нормальный внешний вид, значение его рН соответствует значению, указанному в нормативном документе, а при микроскопировании продукта обнаружены единичные клетки (не более 10), и в посевах не обнаружены жизнеспособные микроорганизмы, то консервы считают промышленно-стерильными.
8.4 Микроорганизмы, обнаруженные в посевах, классифицируют по группам.
8.4.1 Мезофильные аэробные и факультативно-анаэробные спорообразующие бациллы, выделяя среди них молочнокислые бациллы рода Sporolactobacillus и (или) бациллы рода Bacillus, включающие бациллы групп B.subtilis, и (или) B.cereus, и (или) B.polymyxa, и (или) другие неустановленные виды.
Классификация по группам в соответствии с приложением А.
8.4.2 Мезофильные анаэробные спорообразующие клостридии с указанием при необходимости их сульфитредуцирующей способности, и (или) другие анаэробные микроорганизмы с обязательным указанием отсутствия среди выявленных клостридий C.botulinum и C.perfringens.
8.4.3 Термофильные спорообразующие аэробные и факультативно-анаэробные микроорганизмы с указанием их кислотообразующей способности и (или) термофильные спорообразующие анаэробные микроорганизмы с указанием их сульфатредуцирующей способности.
8.4.4 Неспорообразующие бактерии и (или) кокки, и (или) дрожжи, и (или) плесневые грибы в чистой культуре или в смеси со спорообразующими видами.
8.5 Если в нормативном документе на конкретный вид консервированного продукта приведены требования к видовому составу и (или) количеству обнаруженных микроорганизмов, то консервы, отвечающие этим требованиям и требованиям 8.3 по внешнему виду, по результатам микроскопирования и по значению рН, считают промышленно-стерильными.
8.6 Если хотя бы в одном из посевов обнаружены микроорганизмы, указанные в 8.4.4, то такие консервы оценивают как не отвечающие требованиям промышленной стерильности.
Если нормативным документом на конкретный вид консервированного продукта предусматривается присутствие в консервах микроорганизмов, указанных в 8.4.4, то такие консервы оценивают как отвечающие требованиям промышленной стерильности.
8.7 Если хотя бы в одном из посевов обнаружены мезофильные клостридии C.botulinum и (или) C.perfringens, то консервы оценивают как не отвечающие требованиям промышленной стерильности.
8.8 Если в нормативном документе на определенные виды консервов не приведены требования к видовому составу и (или) количеству обнаруженных микроорганизмов, то при оценке промышленной стерильности руководствуются следующими указаниями.
Для групп А и Б:
из мезофильных аэробных и факультативно-анаэробных бацилл в консервах допускаются только бациллы группы B.subtilis. В нормальных по внешнему виду консервах их количество не должно превышать 11 клеток в 1 г или 1 см продукта;
из мезофильных клостридий в консервах не допускается присутствие C.botulinum и (или) C.perfringens. В нормальных по внешнему виду консервах количество мезофильных клостридий (исключая C.botulinum и (или) C.perfringens) не должно превышать одной клетки в 1 г или 1 смпродукта.
В консервах детского и диетического питания наличие мезофильных клостридий не допускается;
при обнаружении термофильных микроорганизмов консервы должны храниться при температуре не выше 20 °С.
В консервах детского и диетического питания наличие термофильных микроорганизмов не допускается;
наличие микроорганизмов, указанных в 8.4.4, в консервах не допускается.
Для группы В:
из мезофильных аэробных и факультативно-анаэробных бацилл в консервах допускаются негазообразующие виды, не более 90 КОЕ в 1 г или 1 см продукта;
наличие мезофильных клостридий и микроорганизмов, указанных в 8.4.4, оценивается как для групп А и Б.
Для группы Г:
микроорганизмы, указанные в 8.4.4, не допускаются.
Для группы Е:
микробиологические показатели, их характеристики и нормы устанавливаются в нормативных документах на конкретные продукты.
ПРИЛОЖЕНИЕ А
(рекомендуемое)
Термины, применяемые в стандарте, и пояснения к ним
Термин | Пояснение |
Мезофильные аэробные и факультативно-анаэробные микроорганизмы | Бактерии, дрожжи, плесневые грибы, развивающиеся в посевах в присутствии кислорода воздуха и имеющие температурный оптимум развития в пределах 25-37 °С |
Молочнокислые бациллы - типовой вид Sporolactobacillus inulinus | Мезофильные палочковидные спорообразующие клетки, микроаэрофилы, имеющие положительную реакцию по Граму, каталазоотрицательные, обладающие бродильным типом обмена, образующие только молочную кислоту |
Мезофильные бациллы | Мезофильные аэробные или факультативно-анаэробные палочковидные обычно подвижные клетки, образующие в аэробных условиях споры, каталазоположительные, обладающие дыхательным или бродильным типом обмена |
Группа B.subtilis (B.subtilis, B.pumilus, B.licheniformis) | Мезофильные бациллы, имеющие положительную реакцию по Граму, образующие невздувающиеся спорангии с эллипсоидальными или цилиндрическими спорами, расположенными центрально |
Группа B.cereus (B.cereus, B.anthracis, B.thuringiensis, B.megaterium) | Мезофильные бациллы, имеющие положительную реакцию по Граму, образующие невздувающиеся спорангии с эллипсоидальными или цилиндрическими спорами, расположенными центрально. |
Клетки, выращенные на глюкозном агаре, содержат внутриклеточные глобулы, не окрашиваемые фуксином | |
Группа B.polymyxa (B.polymyxa, B. macerans, B.circulans) | Мезофильные бациллы, имеющие положительную реакцию по Граму, вариабельную или отрицательную, образующие вздувающиеся спорангии с эллипсоидальными, центрально или терминально расположенными спорами. B.polymyxa и B.macerans в мясо-пептонном бульоне образуют кислоту и газ, B.circulans - только кислоту |
Мезофильные анаэробные микроорганизмы | Бактерии, дрожжи, развивающиеся в анаэробных условиях культивирования и имеющие оптимальную температуру развития от 25 до 37 °С |
Мезофильные клостридии | Мезофильные анаэробные палочковидные бактерии, образующие споры в анаэробных условиях |
Мезофильные сульфитредуцирующие клостридии | Мезофильные клостридии, восстанавливающие сульфиты |
Термофильные аэробные и факультативно-анаэробные бактерии | Бактерии, развивающиеся в посевах в присутствии кислорода воздуха при температуре 55-62 °С |
Термофильные кислотообразующие бактерии | Термофильные бактерии, вызывающие подкисление питательной среды и образующие споры |
Термофильные анаэробные спорообразующие бактерии | Бактерии, образующие споры в анаэробных условиях культивирования и развивающиеся при температуре 55-62 °С |
Термофильные клостридии - типовой вид Clostridium thermosaccharolyticum | Обычно длинные, тонкие, прямые или слегка искривленные палочки, каталазоотрицательные, в анаэробных условиях образующие эллипсоидальные или круглые терминальные споры, имеющие отрицательную реакцию по Граму; их развитие в питательных средах сопровождается газообразованием, плохо растут при пересевах, обычно не развиваются при 37 °С, сульфаты не редуцируют. Вызывают бомбаж консервов с образованием водорода |
Термофильные сульфатредуцирующие бактерии - типовой вид Desulfоtomaculum nigrificans | Прямые или изогнутые палочки с закругленными концами, споры овальные или круглые, терминальные или субтерминальные, вызывающие небольшое раздувание клеток. Грамотрицательные. Редуцируют сульфаты, образуя черные колонии в молочно-сульфатном агаре, содержащем соли двухвалентного железа. Строгие анаэробы. Интенсивно развиваются на средах с пептоном и дрожжевым экстрактом. Вызывают сероводородную порчу консервов; продукт имеет запах тухлых яиц и обычно несколько измененную окраску; бомбажа консервов, как правило, не наблюдается |
Полные консервы | Продукт, укупоренный в герметичную тару, подвергнутый тепловой обработке, обеспечивающей микробиологическую стабильность продукта при хранении и реализации в нормальных, вне холодильника, условиях |
Промышленная стерильность | Отсутствие в консервированном продукте микроорганизмов, способных развиваться при температуре хранения, установленной для конкретного вида консервов, а также микроорганизмов и микробиальных токсинов, опасных для здоровья человека |
Консервы группы А | Консервированные продукты, имеющие рН 4,2 и выше, а также овощные, мясные, мясорастительные, рыбные и рыборастительные консервированные продукты с нелимитируемой кислотностью, приготовленные без добавления кислоты; компоты, соки и пюре из абрикосов, персиков и груш с рН 3,8 и выше; сгущенные стерилизованные молочные консервы |
Консервы группы Б (неконцентрированные томатопродукты) | Цельноконсервированные томаты, томатные напитки, в том числе "Сок томатный", "Томаты натуральные", "Томаты консервированные с зеленью" и другие |
Консервы группы Б (концентрированные томатопродукты с содержанием сухих веществ 12% и более) | Томатная паста, томатные соусы и другие |
Консервы группы В | Консервированные слабокислые овощные маринады, салаты, винегреты и другие продукты, имеющие рН 3,7-4,2, в том числе огурцы консервированные, маринады овощные и другие консервы с регулируемой кислотностью |
Консервы группы Г | Консервированная квашеная капуста; овощные маринады с рН ниже 3,7; соки, компоты и пюре из абрикосов, персиков и груш с рН ниже 3,8; фруктовые и плодово-ягодные консервы (плоды и ягоды протертые с сахаром, маринады плодовые и ягодные, сок виноградный натуральный, компоты из плодов, ягод, ревеня и дыни, соусы фруктовые, соки плодовые и ягодные с сахаром, соки плодовые и ягодные натуральные, соки плодовые и ягодные с мякотью, соки плодовые и ягодные концентрированные, соки из цитрусовых плодов, варенье, джем, конфитюры плодово-ягодные и другие); консервы для общественного питания с сорбиновой кислотой и рН ниже 4,0 |
Консервы группы Е | Пастеризованные газированные фруктовые соки и пастеризованные газированные фруктовые напитки с рН 3,7 и ниже |
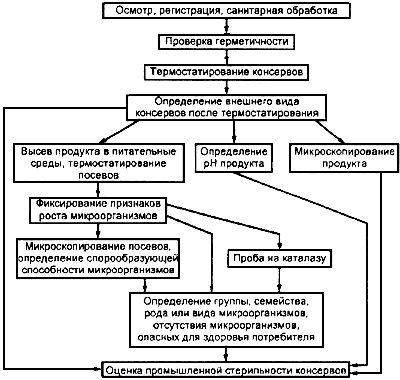
ПРИЛОЖЕНИЕ Б
(рекомендуемое)
Схема проведения анализа консервов на промышленную стерильность
ПРИЛОЖЕНИЕ В
(рекомендуемое)
Способы культивирования посевов в анаэробных условиях
B.1 При культивировании посевов для выявления анаэробных микроорганизмов в обычных климатических условиях заданное значение окислительно-восстановительного потенциала жидкой среды достигается и поддерживается путем добавления в среду редуцирующих веществ: кусочков печени или мяса, не содержащих ингибиторов микроорганизмов, тиогликолевой кислоты, цистина, глюкозы, аскорбиновой кислоты, путем повышения вязкости среды за счет добавления в нее 0,05-0,1% агара и путем наслаивания на поверхность среды парафиновазелиновой смеси, голодного агара и других веществ, защищающих среду от проникновения в нее кислорода окружающей среды.
В.2 Продукт или его разведения высевают в пробирки с жидкой (вязкой) средой непосредственно после удаления кислорода из среды путем прогрева пробирок в течение 10-15 мин в кипящей водяной бане или при помощи текучего пара с последующим быстрым охлаждением до температуры (40±1) °С - при выявлении мезофильных микроорганизмов или до 55-62 °С - при выявлении термофильных микроорганизмов.
В.3 Анаэробные условия в герметичных емкостях, предназначенных для термостатирования посевов, создают путем заполнения емкостей инертным газом (азотом, водородом или гелием) или смесью (азота - 80%, углекислого газа - 10% и водорода - 10%) или за счет химического поглощения кислорода. Отсутствие кислорода в емкости контролируют индикатором Eh среды (метиленовой синью, резазурином и др.).
В.4 Оптимальные условия для развития строгих анаэробов создают в анаэростатах, снабженных специальными препаратами, поглощающими кислород, за счет реагирования его с водородом, выделяющимся при увлажнении препарата водой в присутствии платины, палладия или других катализаторов.
В.5 Для создания анаэробных условий за счет химического поглощения кислорода воздуха в герметичных сосудах используют основной раствор пирогаллола. Для поглощения кислорода из 100 см воздуха применяют смесь 10 см
раствора гидроокиси натрия
(NaOH)=2,5 моль/дм
и 1 г пирогаллола, приготовленную после помещения посевов в сосуд непосредственно перед его герметизацией.
В.6 Для создания анаэробных условий непосредственно в посевах на чашках Петри на внутреннюю поверхность крышки с помощью липкой бумаги прикрепляют бумажный пакет 4х7 см, содержащий 2 г сухой смеси, состоящей из пирогаллола, карбоната калия и талька в соотношении 3:3:15. Затем чашку Петри герметизируют, смазывая края крышки пластилином или другими герметизирующими материалами.
В.7 Анаэробные условия создают с помощью бактерий, сильно поглощающих при росте кислород, например Serratia marcescens.
Одну половину чашки Петри с агаризованной средой засевают исследуемым материалом, а другую - бактериями, поглощающими кислород (способ Фортнера). Чашки Петри герметизируют, как указано в В.6.
При выборе условий анаэробного культивирования учитывают устойчивость определяемого микроорганизма к парциальному давлению кислорода и требуемое для его развития значение окислительно-восстановительного потенциала среды.
ПРИЛОЖЕНИЕ Г
(рекомендуемое)
Тесты для определения принадлежности микроорганизмов
к определенной группе
Г.1 Определение каталазной активности
Присутствие каталазы определяют в посевах на любой питательной среде, кроме приготовленной с добавлением крови, по способности каталазы разлагать перекись водорода с выделением пузырьков газа. Если в посевах на агаризованной среде обнаружено несколько типов колоний, то исследование на каталазу проводят с каждым типом колоний. Реакцию ставят с охлажденной до комнатной температуры культурой, содержащей микроорганизмы не старше 24-часового возраста (мертвые клетки искажают результаты), не допуская соприкосновения клеток с нагретой поверхностью и применяя обезжиренные стерильные пробирки, предметные стекла, пипетки одним из способов, указанных ниже.
На колонию микроорганизмов, взятую с поверхности питательной среды или извлеченную из нее и помещенную на предметное стекло, после 30 мин выдержки на воздухе пипеткой наносят каплю 3%-ного раствора перекиси водорода.
Из посевов отбирают 2-3 см культуральной жидкости, переносят ее в пробирку и нейтрализуют раствором гидроокиси натрия или соляной кислоты, приготовленных по ГОСТ 10444.1. 1-2 капли нейтрализованной культуральной жидкости пипеткой переносят на предметное стекло и после 30 мин выдержки на воздухе добавляют к ней каплю 3%-ного раствора перекиси водорода.
Если через 30-60 с на стекле появляются пузырьки газа, то считают, что они образовались в результате разложения перекиси водорода каталазой, образуемой микроорганизмами.
Если в посевах обнаружены газообразующие микроорганизмы, то при определении их каталазной активности ставят контрольную пробу аналогично пробе на каталазу, но без добавления перекиси водорода. Газообразующие микроорганизмы относят к каталазоположительным при отсутствии пузырьков газа в контрольной пробе или при явно повышенном газообразовании в пробе с перекисью водорода по сравнению с контрольной пробой.
Мезофильные и термофильные бациллы образуют каталазу, мезофильные и термофильные клостридии не образуют каталазу, молочнокислые микроорганизмы каталазу не образуют, но разложение перекиси водорода у молочнокислых микроорганизмов рода Pediococcus возможно за счет фермента псевдокаталазы. Определение псевдокаталазы у микроорганизмов неспорообразующих, грамположительных, неподвижных проводят по ГОСТ 10444.11.
Г.2 Микроскопирование посевов
Микроскопируют мазки, приготовленные из первичных посевов. Если при микроскопировании возникает сомнение в однотипности обнаруженных микроорганизмов, то микроскопируют мазки, приготовленные из каждого типа колоний, обнаруженных в посевах на агаризованные среды.
Г.2.1 Путем микроскопирования устанавливают морфологию клеток, наличие и тип спор, присутствие глобул в бациллярных клетках, способность бактерий окрашиваться по Граму. Микроскопируют мазки, окрашенные фуксином и (или) малахитовой зеленью и сафранином, и (или) окрашенные по Граму, и (или) препараты живых микроорганизмов способом фазового контраста. Для установления принадлежности к группе B.cereus определяют присутствие в бациллярных клетках глобул в препаратах, приготовленных из посевов на мясо-пептонном агаре, содержащем 0,1% глюкозы. Присутствие спорообразующих бактерий устанавливают в препаратах культур любого возраста, отсутствие - по результатам просмотра пятидневной культуры. Для окраски по Граму используют посевы микроорганизмов не старше 24-часового возраста.
Г.2.2 Для приготовления мазков суспензию микроорганизмов бактериологической петлей наносят на обезжиренное предметное стекло, распределяют тонким слоем на площади около 1 см, высушивают на воздухе и фиксируют. Для фиксации предметное стекло захватывают пинцетом и три раза проводят над верхней частью некоптящего пламени мазком вверх. На остывший мазок через полоску фильтровальной бумаги наносят красящий раствор.
Г.2.3 Для выявления глобул в бациллярных клетках мазки окрашивают раствором фуксина, приготовленным по ГОСТ 10444.1. Клетки бацилл группы B.cereus, выращенные на агаре с глюкозой, заполнены неокрашенными глобулами на фоне окрашенной протоплазмы.
Г.2.4 Для окраски по Граму в модификации Хукера мазки окрашивают раствором кристаллического фиолетового с щавелевокислым аммонием. Через 0,5-1,0 мин с окрашенного мазка удаляют бумагу и избыток красителей, мазок промывают проточной водой, наносят на него йодный раствор по Бурке. Спустя 0,5-1,0 мин мазок промывают 96%-ным этиловым спиртом, погружая его последовательно в несколько порций спирта до тех пор, пока с мазка не будут стекать окрашенные струйки. Затем с мазка удаляют остатки спирта, промывая его водой. Промытый мазок окрашивают красителем контрастного цвета, выдерживая 2-3 мин в растворе сафранина, затем промывают водой и высушивают. Грамположительные микроорганизмы образуют с основным красителем стойкое соединение, то есть окрашиваются в сине-фиолетовый цвет основного красителя. Грамотрицательные микроорганизмы теряют основной краситель и приобретают красный цвет контрастного красителя. Допускается окрашивать мазок 1%-ным водным раствором кристаллического фиолетового, метилового фиолетового или генцианвиолета и после закрепления краски йодным раствором по Бурке промывать препарат ацетоном и докрашивать 0,5%-ным водным раствором сафранина или спиртовым раствором фуксина. Растворы для окрашивания препаратов готовят по ГОСТ 10444.1.
При микроскопировании споры, которые не окрашиваются фуксином или по Граму, хорошо видны на фоне окрашенной протоплазмы.
Г.2.5 Для обнаружения бактериальных спор в мазках при микроскопировании с фазовоконтрастным устройством приготавливают препарат на голодном агаре. Горячий раствор голодного агара наносят пипеткой на чистое, хорошо обезжиренное предметное стекло, которое для получения на нем тонкой, равномерной пленки агара быстро поворачивают на ребро, давая стечь избытку раствора. На застывшую пленку голодного агара бактериологической петлей наносят каплю культуральной жидкости, накрывают ее покровным стеклом выпуклой стороной вверх и слегка прижимают его к поверхности предметного стекла. При микроскопировании бактериальные непроросшие споры выглядят как отдельно расположенные или внутриклеточные блестящие, хорошо преломляющие свет образования, проросшие споры выглядят тусклыми или темными образованиями.
Г.2.6 Для окраски спор на мазок наносят раствор малахитовой зелени, приготовленный по ГОСТ 10444.1, и нагревают его в течение 1 мин до появления паров жидкости, после охлаждения промывают водой, затем докрашивают в течение 30 с раствором сафранина или фуксина, вновь промывают водой и микроскопируют. Бактериальные споры окрашиваются в зеленый, вегетативные клетки - в красный цвет.
Г.2.7 Мазки, приготовленные по Г.2.3-Г.2.6, микроскопируют с использованием масляной иммерсии при увеличении 900-1000.
Г.3 Определение присутствия в посевах анаэробных микроорганизмов
Присутствие в посевах анаэробных микроорганизмов определяют путем высева одной-двух капель культуральной жидкости и (или) ее разведений одним из способов, указанных ниже.
Г.3.1 Культуральную жидкость и (или) ее разведения переносят в чашки Петри (отдельные для культуральной жидкости и каждого ее разведения). Посевы в чашках Петри заливают агаризованной питательной средой для аэробных, факультативно-анаэробных или анаэробных микроорганизмов, приготовленных по ГОСТ 10444.1. Посевной материал и среду тщательно перемешивают. Чашки помещают в анаэростат или герметичную камеру, удаляют из них кислород, создавая анаэробные условия культивирования. Рост микроорганизмов контролируют через 24-48 ч. Анаэробные микроорганизмы образуют в анаэробных условиях колонии, характерные для роста в использованной питательной среде.
Г.3.2 На застывшую поверхность питательной среды посевов, проведенных аналогично указаниям Г.3.1 и с учетом того, что слой посевного материала с питательной средой в чашках Петри должен быть не менее 0,8 см, пинцетом помещают стерильное предметное стекло так, чтобы под стеклом не было пузырьков воздуха. Чашки Петри в перевернутом виде термостатируют не в анаэробных условиях при температуре (30±1) °С. Рост микроорганизмов контролируют через 24-48 ч. Анаэробные микроорганизмы растут наиболее обильно под центральной частью предметного стекла (на расстоянии от края 1-3 мм) сплошной массой или в виде отдельных колоний, образуя пузырьки газа и (или) разрывы питательной среды.
Г.3.3 Посевы культуральной жидкости и (или) ее разведений в чашках Петри заливают средой Вильсон-Блера или другой агаризованной средой, содержащей реактивы для определения сульфитредуцирующей способности. Посевной материал и среду тщательно перемешивают. Посевы термостатируют в анаэробных условиях по Г.3.1 (или на застывшую поверхность питательной среды помещают предметное стекло по Г.3.2) при температуре (37±1) °С не более 72 ч. Сульфитредуцирующие микроорганизмы образуют на среде с сульфитами черные, коричневые колонии или колонии, вызывающие потемнение среды.
Г.3.4 Культуральную жидкость и (или) ее разведения переносят в стерильные пробирки (отдельную для культуральной жидкости и каждого ее разведения). Посевы в пробирках заливают агаризованной питательной средой так, чтобы образовался столбик высотой 10-11 см. Стерильной пипеткой перемешивают содержимое засеянных пробирок так, чтобы в среде не оставалось пузырьков воздуха.
Культуральную жидкость и (или) ее разведения, перенесенные в стерильные пробирки, можно высевать в трубки Вейона. Для этого в стерильную трубку Вейона набирают агаризованную питательную среду температурой 50-60 °С и переносят в пробирку с культуральной жидкостью или ее разведением. Той же трубкой Вейона тщательно перемешивают содержимое пробирки и засасывают это содержимое в трубку Вейона так, чтобы не оставалось пузырьков воздуха в трубке Вейона (за исключением острого конца и поверхности среды). Острый конец трубки Вейона запаивают в пламени горелки. Засеянные трубки Вейона оставляют в вертикальном положении для застывания среды.
Посевы в пробирках или трубках Вейона термостатируют не в анаэробных условиях при температуре (30±1) °С. Рост микроорганизмов контролируют через 24-48 ч.
Анаэробные микроорганизмы растут в высоких столбиках среды на некотором расстоянии от поверхности среды. Это расстояние зависит от окислительно-восстановительного потенциала питательной среды, необходимого для роста микроорганизмов.
Г.3.5 При определении присутствия в посевах термофильных микроорганизмов посевы по Г.3.1-Г.3.4 термостатируют при температуре 55-62 °С.
Г.4 Определение способности выделенных микроорганизмов к спорообразованию в анаэробных условиях
Пересевы культуральной жидкости из первичных посевов делают на жидкие (вязкие) или агаризованные питательные среды. Посев на жидкие (вязкие) среды проводят с учетом требований 7.7.2 стандарта, а на агаризованные - Г.3. При выборе сред учитывают, что некоторые сахаролитические виды клостридий не образуют спор при отсутствии ферментируемых cахаров, но для спорообразования большинства других видов среда не должна содержать ферментируемые сахара. Лучшими средами для спорообразования являются среды, приготовленные на основе мясного бульона с кусочками мяса или сердца. При сомнении в наличии спор их образование стимулируют прогревом вторичных посевов в течение 10 мин при температуре (80±1) °С для термоустойчивых клостридий и 10 мин при температуре (60±1) °С для нетермоустойчивых клостридий. Посевы для наблюдения за спорообразованием термостатируют не более 48 ч при температуре (30±1) °С и затем выдерживают не более 3 сут при 20-25 °С. При необходимости, в процессе термостатирования или выдержки из посевов приготавливают по Г.2 мазки для обнаружения спор.
Электронный текст документа
и сверен по:
Продукты пищевые, консервы.
Методы микробиологического анализа:
Сб. ГОСТов. - , 2010
