ГОСТ ISO 17604-2017
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МИКРОБИОЛОГИЯ ПИЩЕВОЙ ЦЕПИ
Отбор проб с туши для микробиологического анализа
Microbiology of the food chain. Carcass sampling for microbiological analysis
МКС 07.100.30
Дата введения*
Предисловие
Евразийский совет по стандартизации, метрологии и сертификации (ЕАСС) представляет собой региональное объединение национальных органов по стандартизации государств, входящих в Содружество Независимых Государств. В дальнейшем возможно вступление в ЕАСС национальных органов по стандартизации других государств.
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены".
Сведения о стандарте
1 ПОДГОТОВЛЕН научно-производственным республиканским унитарным предприятием "Белорусский государственный институт стандартизации и сертификации" (БелГИСС) на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Госстандартом Республики Беларусь
3 ПРИНЯТ Евразийским советом по стандартизации, метрологии и сертификации по результатам голосования в АИС МГС (протокол N 98-П от 20 апреля 2017 г.)
За принятие стандарта проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Кыргызстан | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Узбекистан | UZ | Узстандарт |
4 Настоящий стандарт идентичен международному стандарту ISO 17604:2015* "Микробиология пищевой цепи. Отбор проб с туши для микробиологического анализа" ("Microbiology of food chain - Carcass sampling for microbiological analysis", IDT).
Международный стандарт разработан подкомитетом SC 9 "Микробиология" технического комитета по стандартизации ISO/TC 34 "Пищевые продукты" Международной организации по стандартизации (ISO).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных (государственных) стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных (государственных) органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация также будет опубликована в сети Интернет на сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Зарегистрирован N 13247 20 апреля 2017 г.
1 Область применения
Настоящий стандарт устанавливает методы отбора проб для выявления и подсчета количества микроорганизмов на поверхности туш или частей туш убойных животных. Отбор проб для микробиологического исследования может проводиться с целью:
- гигиенического контроля (для валидации и/или верификации производственного контроля, например при определении общего количества микроорганизмов и бактерий семейства Enterobacteriaceae) на предприятиях, где проводится убой крупных млекопитающих, сельскохозяйственной птицы и диких животных;
- определения степени безопасности продукции;
- осуществления мониторинга или надзора за распространением и/или количеством патогенных микроорганизмов.
Настоящий стандарт предусматривает использование методов иссечения и свабирования, выбор которых зависит от конкретных условий. В настоящем стандарте также предусмотрено использование метода отбора проб путем ополаскивания туши для исследования тушек сельскохозяйственной птицы, мелких млекопитающих и других мелких животных. В приложении А представлены зоны отбора проб с туш различных видов животных.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ISO 6887-1, Microbiology of food and animal feeding stuffs. Preparation of test samples, initial suspension and decimal dilutions for microbiological examination. Part 1. General rules for the preparation of the initial suspension and decimal dilutions (Микробиология пищевых продуктов и кормов для животных. Подготовка образцов для испытания, исходной суспензии и десятикратных разведений для микробиологического исследования. Часть 1. Общие правила подготовки исходной суспензии и десятикратных разведений)
ISO 6887-2, Microbiology of food and animal feeding stuffs. Preparation of test samples, initial suspension and decimal dilutions for microbiological examination. Part 2: Specific rules for the preparation of meat and meat products (Микробиология пищевых продуктов и кормов для животных. Подготовка образцов для испытания, исходной суспензии и десятикратных разведений для микробиологического исследования. Часть 2. Специальные правила подготовки мяса и мясной продукции)
ISO 7218, Microbiology of food and animal feeding stuffs. General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 туша (carcass): Туловище убитого животного после разделки.
3.2 метод иссечения (excision technique): Метод, при котором удаляют определенный участок поверхностной ткани или шкуры (кожи) путем вырезания.
3.3 дикое животное (game): Дикое млекопитающее или дикая птица, которых убивают во время охоты для потребления человеком, а также выращенное человеком млекопитающее или птица, включая бескилевых (например, страус, эму), за исключением домашних копытных животных и сельскохозяйственной птицы.
3.4 крупное млекопитающее (large mammal): Крупный рогатый скот (включая буйволов, бизонов), овцы, свиньи (включая кабанов), различные виды оленя (включая северного оленя, антилоп), лошади (включая ослов и мулов).
3.5 сельскохозяйственная птица (poultry): Мелкая или средняя птица.
Пример - Курица, утка, гусь, индюк, голубь, фазан, куропатка, рябчик.
3.6 план выборочного контроля (sampling plan): План, который устанавливает посредством определенного аналитического метода количество единиц в выборке и необходимые критерии приемлемости партии.
3.7 точка отбора пробы (sampling point): Этап производства, на котором отбирается проба.
3.8 зона отбора проб (sampling site): Место на туше, с которого отбирается проба.
3.9 мелкие млекопитающие и другие мелкие животные (small mammal and other small animal): Зайцеобразные (например, заяц, кролик), грызуны, черепахи, лягушки.
3.10 метод свабирования (swabbing method): Метод, при котором взятие смывов с поверхности туши осуществляют с помощью абсорбирующего материала, прикрепленного к палочке или проволоке, губки или куска другого абсорбирующего материала.
4 Общие правила
Выбор метода отбора проб зависит главным образом от цели микробиологического исследования, требуемой чувствительности и конкретной ситуации. В соответствии с настоящим стандартом могут быть использованы методы иссечения, свабирования и отбора проб путем ополаскивания туши.
Метод иссечения, как правило, дает возможность собрать большее количество микроорганизмов по сравнению с другими методами. Не все собранные микроорганизмы вырастут на среде и в используемых инкубационных условиях. Данные по прецизионности при использовании методов иссечения и отбора проб путем ополаскивания туши более удовлетворительны, чем при использовании метода свабирования, что связанно с затруднениями, возникающими при стандартизации данного метода.
Однако только из незначительного количества туш отбирают пробы с использованием методов иссечения, что может привести к недостоверности полученного результата исследования при неравномерно распределенной невысокой общей контаминации или небольшом количестве исследуемых микроорганизмов. Методы иссечения относятся к разрушающим методам и в некоторых случаях могут нарушить товарный вид туши, тем не менее они являются предпочтительными при отборе проб с замороженных поверхностей.
Методы свабирования или отбора проб путем ополаскивания туши позволяют осуществить исследование больших площадей. Маленькие участки для исследования зон с наиболее высокой степенью контаминации микроорганизмами могут быть отобраны посредством метода иссечения или свабирования. Метод отбора проб путем ополаскивания туши является эффективным и целесообразным методом исследования тушек птицы (за исключением тушки крупных птиц) и туш некоторых мелких млекопитающих и других мелких животных.
5 Планы выборочного контроля
Планы выборочного контроля зависят от предполагаемых испытаний и в настоящем стандарте не рассматриваются во всех деталях.
При составлении планов выборочного контроля требуется учитывать конкретный этап процесса, время с момента начала процесса убоя, периодичность отбора проб, а также при необходимости:
- технологию убоя различных видов животного;
- программу управления рисками или гармонизированную программу мониторинга;
- объем выпускаемой продукции;
- прежние результаты мониторинга (анализ тенденций);
- распространенность патогенных микроорганизмов в регионе, из которого поступило животное;
- соответствующие национальные, региональные и/или международные требования.
При производственном контроле кратность и периодичность отбора проб зависят от санитарного состояния производства.
При выполнении мониторинга и надзора за распространением патогенных микроорганизмов время отбора проб, периодичность и выбор зоны отбора проб с туши должны определяться из расчета наибольшей степени вероятности их выявления и/или подсчета.
6 Точки отбора проб на производственной линии
Точки отбора проб должны быть выбраны в соответствии с принципами управления рисками и указывать на места на производстве, в определенных этапах процесса убоя или в процессе в целом, где более высокая вероятность выявления контаминации. Примерами точек отбора проб являются следующие:
- после полировочной машины (убой свиньей);
- после моечной машины (убой свиньей и птиц);
- после свежевания (съемка шкуры) (убой крупных млекопитающих, диких животных, убитых в убойном пункте (цехе), и других животных);
- после нутровки (убой любого животного);
- непосредственно перед охлаждением или замораживанием (убой любого животного);
- сразу же после охлаждения (убой птиц, мелких млекопитающих и других мелких животных);
- после охлаждения или замораживания (убой любого животного);
- в холодильной камере (убой любого животного).
Во время охлаждения, в зависимости от условий холодильной камеры, микроорганизмы могут погибнуть или получить сублетальные повреждения, могут обрасти психротрофными микроорганизмами или могут быть плотно прикреплены к туше, что может привести к неправильной оценке. Такой эффект может быть минимизирован, если отбор проб осуществляют в максимально короткие сроки после убоя.
7 Зоны отбора проб на туше
7.1 Крупные млекопитающие
Выбранные зоны отбора проб на туше зависят от технологий убоя в убойном пункте (цехе), которые могут меняться в зависимости от цеха и вида животных. Выбор зон проводят с целью выявления зон с наиболее высокой степенью контаминации (см. таблицу А.1). На рисунках А.1, А.2 и А.3 приведены зоны, чаще всего идентифицируемые как зоны с наибольшей степенью контаминации. Другие зоны отбора проб могут быть определены в регламентах, руководствах надлежащих практик или других документах, действующих для отрасли. Отбор проб при производственном контроле желательно осуществлять с одних и тех же зон туши в течение определенного периода времени (для анализа тенденций). Пробы рекомендуется отбирать с большего числа туш, а не с большего количества зон одной туши. Систематичность в зонах отбора проб в динамике является важным для выявления изменений в образце исследований в течение времени (анализ тенденций). Это, как правило, предпочтительнее для отбора проб на большем числе туш в тех зонах, которые вероятнее всего будут контаминированы, чем отбор проб в большем числе зон на одной туше. В рамках надзорных мероприятий предпочтительнее отбирать пробы с большей площади туши.
7.2 Сельскохозяйственная птица, мелкие млекопитающие и другие мелкие животные
Общепринятым методом является метод отбора проб путем ополаскивания туши. Выбор зон для отбора проб зависит от технологии убоя и используемого оборудования. Для птицы, как правило, пробы отбирают со шкуры шеи или, если таковой нет, со шкуры грудной части.
7.3 Дикие животные
Для более крупных диких животных зоны отбора проб могут быть такими же, как и для крупных млекопитающих (см. 7.1). Как правило, для каждого вида животного пробы должны быть отобраны с зон с наиболее высокой степенью контаминации.
8 Методы отбора проб
8.1 Общие требования
Для конкретного случая при отборе проб каждый раз следует использовать один и тот же метод, чтобы гарантировать сопоставимость результатов исследования. Как правило, используют три различных метода: метод иссечения (разрушающий метод), метод свабирования (неразрушающий метод) или метод отбора проб путем ополаскивания туши. Так как пробы отбирают с поверхности туши, то результаты выражают в колониеобразующих единицах (КОЕ) на квадратный сантиметр. При использовании метода отбора проб путем ополаскивания туши результаты, как правило, выражают как КОЕ на тушу. При отборе проб кожи тушек птицы результаты выражают в КОЕ на грамм.
Несколько проб с одной туши или с нескольких туш в одной и той же зоне отбора проб могут быть объединены для составления объединенной пробы, которая используется целиком для анализа в лаборатории. Допускается из нескольких проб, отобранных с одной туши, составлять объединенную пробу, из которой отбирают пробу для испытания (см. ISO 6887-1).
8.2 Методы иссечения
Как правило, используют два разных метода: метод с использованием полого пробоотборника и метод с использованием рамки-трафарета. При использовании обоих методов отбирают пробу с поверхности туши (так как внутренняя часть туши, как правило, стерильна). Метод с использованием полого пробоотборника, как правило, позволяет отбирать пробы с меньших по размеру площадей, в отличие от метода с использованием рамки-трафарета, но такой метод является более легким для использования при исследовании замороженного мяса.
8.2.1 Метод с использованием полого пробоотборника
8.2.1.1 Реактивы
8.2.1.1.1 Спирт этиловый 70%-ный (по объему).
8.2.1.2Инструменты и материалы
8.2.1.2.1 Стерильные скальпели.
8.2.1.2.2 Стерильные пинцеты.
8.2.1.2.4 Стерильные ножницы.
8.2.1.2.5 Переносная газовая горелка или горелка Бунзена (выборочно).
8.2.1.2.6 Салфетки или вата.
8.2.1.2.7 Стерильные полиэтиленовые пакеты для гомогенизатора перистальтического типа или звукового гомогенизатора, соответствующие размерам пробы и объему добавляемого раствора.
8.2.1.3 Отбор проб
Стерильным полым пробоотборником (см. 8.2.1.2.3) на поверхности туши в определенных зонах делают круглые разрезы. Полый пробоотборник убирают, а диски шкуры или мышечной ткани (толщиной около 2 мм) затем отделяют от туши стерильным скальпелем (см. 8.2.1.2.1) или ножницами (см. 8.2.1.2.4) и пинцетами (см. 8.2.1.2.2) и помещают в промаркированный стерильный полиэтиленовый пакет (см. 8.2.1.2.7).
8.2.1.4 Очистка и стерилизация инструментов
Каждую пробу отбирают с использованием чистых и стерильных инструментов (см. 8.2.1.2). Стерилизацию осуществляют путем автоклавирования инструментов, предварительно завернутых соответствующим образом. Инструменты могут быть повторно использованы во время отбора проб, при условии, что их тщательно очищают и дезинфицируют после каждого использования в следующем порядке:
a) очищают салфеткой или ватой (см. 8.2.1.2.6), смоченной в 70%-ном этиловом спирте (см. 8.2.1.1.1);
b) погружают во флакон с 70%-ным этиловым спиртом;
c) проводят фламбирование (см. 8.2.1.2.5) (если применение открытого пламени недопустимо, тогда просто дают этиловому спирту испариться);
d) охлаждают.
Так как для обработки инструментов требуется определенное время, лучше иметь несколько наборов заранее стерилизованных инструментов (полый пробоотборник, скальпели, пинцеты). Необходимо предотвратить возможность контаминации инструментов перед использованием. Допускается использование одноразовых стерильных инструментов.
Примечание - Если пробы будут использованы для составления объединенной пробы, тогда нет необходимости очищать и дезинфицировать инструменты между отборами проб.
8.2.2 Метод с использованием рамки-трафарета
8.2.3 Метод отбора проб кожи
8.2.3.1 Отбор проб кожи с шеи
Кожный покров шеи обычно удаляют с тушек птицы сразу, как они поступают на производственную линию, поэтому они должны быть отобраны заранее, но могут быть отделены позднее и взвешены (по отдельности или совместно с другими пробами при составлении объединенной пробы). Берут стерильные ножницы (см. 2*.1.2.4). Открывают стерильный полиэтиленовый пакет (см. 8.2.1.2.7), не касаясь его стерильной внутренней части. Полиэтиленовый пакет берут за нижний край и вдавливают его в глубь полиэтиленового пакета. Не следует брать для отбора проб тушки с очень коротким лоскутком кожи шеи. Нижней внутренней стороной полиэтиленового пакета захватывают кожу шеи и быстро отрезают ее. Такую процедуру обычно проводят с помощью ножниц. Взвешивают отобранную пробу (как правило, ее масса составляет около 10 г). При необходимости составляют объединенную пробу массой 25 или 50 г.
8.2.3.2 Отбор проб кожи с грудки
Кожа с грудки сельскохозяйственной птицы удаляется быстро и легко. Берут отобранную тушку и кладут ее на ровную поверхность, избегая любого контакта с поверхностью отбираемого участка кожи. Используя скальпель (см. 8.2.1.2.1) и пинцет (см. 8.2.1.2.2), отбирают столько кожи грудки, сколько возможно, и взвешивают ее. Результаты выражают по отношению к массе (в виде КОЕ на грамм или как присутствие/отсутствие в 25 г).
8.3 Методы свабирования
Метод свабирования является неразрушающим методом, особенно используемым для отбора проб с больших площадей. В зависимости от обстоятельств и исследуемой площади метод включает в себя использование тампонов с деревянными ручками, губки, тампонов, кусков ткани небольшого размера.
8.3.1 Метод с использованием влажного и сухого тампонов с деревянными ручками
8.3.1.1 Реактив
8.3.1.1.1 Стерильный общий разбавитель (см. ISO 6887-1), разлитый по 10,0 мл в пробирки или колбы.
8.3.1.2 Инструменты и материалы
8.3.1.2.1 Стерильные ватные тампоны с деревянными ручками
8.3.1.2.2 Стерильные рамки-трафареты (см. 8.2.2).
8.3.1.3 Отбор проб
Тампоны увлажняют (см. 8.3.1.2.1) в 10 мл разбавителя (см. 8.3.1.1.1). На каждую зону, выбранную для отбора проб, накладывают с усилием рамку-трафарет (см. 8.3.1.2.2). Всю площадь внутри рамки-трафарета протирают тампоном, надавливая и перемещая его по меньшей мере в двух направлениях (например, сначала горизонтально, а затем вертикально), не менее 10 раз в каждом направлении. Затем тампон помещают в разбавитель, использованный для увлажнения, надломив его деревянную ручку о внутреннюю поверхность колбы. Берут сухой тампон, протирают ту же площадь еще раз, как указано выше, чтобы абсорбировать жидкость, оставшуюся от влажного тампона, и помещают тампон в ту же колбу с разбавителем.
Рамки-трафареты могут быть очищены, продезинфицированы и повторно использованы, как описано в 8.2.1.4.
8.3.2 Метод с использованием губки, тампонов, кусков ткани небольшого размера
Губки и тампоны используют, в частности, для отбора проб больших по размеру площадей. Отбор проб с больших по размеру площадей без использования рамок-трафаретов увеличивает вероятность выявления патогенных микроорганизмов, которые присутствуют в незначительном количестве на туше. Отбор проб с разных зон может осуществляться с использованием одного и того же тампона.
8.3.2.1 Реактив
8.3.2.1.1 Стерильный общий разбавитель (см. ISO 6887-1).
8.3.2.2 Инструменты и материалы
8.3.2.2.2 Стерильные тампоны
Используют тампоны, изготовленные из нескольких слоев марли или ваты, обмотанной марлей. Обычно используют гигиенические салфетки или тампоны (свободные от ингибиторов), которые изготовлены таким же образом.
8.3.2.2.3 Стерильные куски ткани небольшого размера (свободные от ингибиторов).
8.3.2.2.4 Стерильные полиэтиленовые пакеты для гомогенизатора перистальтического или звукового типа.
8.3.2.2.6 Стерильные перчатки.
8.3.2.3 Отбор проб
В точке отбора проб открывают полиэтиленовый пакет (см. 8.3.2.2.4), содержащий стерильную губку (см. 8.3.2.2.1), стерильный тампон (см. 8.3.2.2.2) или стерильный кусок ткани небольшого размера (см. 8.3.2.2.3), и добавляют достаточное количество разбавителя (см. 8.3.2.1.1) из заранее известного объема (например, 25 или 100 мл), чтобы смочить губку, тампон или кусок ткани без образования избыточной жидкости. Губку, тампон или кусок ткани сжимают и разжимают с внешней стороны полиэтиленового пакета до полного их смачивания. Помещают рамку-трафарет (см. 8.3.2.2.5) на выбранную зону исследования. Используют полиэтиленовый пакет в качестве перчатки, выворачивая его наизнанку и захватывая губку, тампон или кусок ткани через полиэтиленовый пакет, как в случае с кожей шеи (см. 8.2.3.1), или используют свежую пару стерильных перчаток (см. 8.3.2.2.6), чтобы протереть губкой, тампоном или куском ткани исследуемую поверхность. Пробу отбирают путем протирания по меньшей мере в двух направлениях (например, сначала горизонтально, а затем вертикально), не менее 10 раз в каждом направлении. После протирания губку, тампон или кусок ткани помещают обратно в полиэтиленовый пакет и добавляют остаток разбавителя.
Рамка-трафарет может быть использована повторно, как описано в 8.2.1.4.
8.4 Метод отбора проб путем ополаскивания туши
8.4.1 Реактивы
8.4.1.1 Стерильный разбавитель объемом 300, 400 или 600 мл.
8.4.2 Материалы
8.4.2.1 Большие стерильные полиэтиленовые пакеты типа "Стомахер"
8.4.3 Отбор проб
8.4.3.1 Сельскохозяйственная птица
Тушки для исследования отбирают, как правило, с конвейера на производственной линии. При отборе проб открывают полиэтиленовый пакет (см. 8.4.2.1), не касаясь его стерильной внутренней поверхности. На тушку, находящуюся на конвейере, надевают полиэтиленовый пакет обеими руками и, удерживая с наружной стороны полиэтиленового пакета ноги птицы, снимают тушку с конвейера (т.е. освобождают лапки с подвесок). Следует избегать отбора тушек со значительным количеством стекающей с них воды. Если это произошло, удаляют тушку в асептических условиях на отдельные продезинфицированные подвески и дают возможность стечь воде с тушки, прежде чем помещают ее обратно в полиэтиленовый пакет.
Дно полиэтиленового пакета с тушкой фиксируют на ровной поверхности. Придерживая верх полиэтиленового пакета, приоткрывают его и добавляют стерильный разбавитель (см. 8.4.1.1), как правило, в количестве 400 мл (для курицы) или 600 мл (для индейки) во внутреннюю полость тушки и наружную ее часть. Удаляют избыток воздуха из полиэтиленового пакета и закрывают его, например, специальным замком. Аккуратно держа полиэтиленовый пакет одной рукой за дно, другой за верх, ополаскивают тушку внутри и снаружи путем встряхивания примерно в течение 1 мин. Далее аккуратно переворачивают полиэтиленовый пакет круговыми движениями туда и обратно для гарантированного ополаскивания всех поверхностей (внутренней и наружной) тушки. Полиэтиленовый пакет ставят на ровную поверхность и, поддерживая тушку, открывают его. Тушку достают из полиэтиленового пакета, прежде всего позволяя избыточной жидкости стечь обратно в него. Избегают касания рукой внутренней поверхности полиэтиленового пакета. Закрывают полиэтиленовый пакет, чтобы избежать вытекания смывной жидкости или ее контаминации. Можно также перенести смывную жидкость из полиэтиленового пакета в стерильный контейнер в асептических условиях (например, колбу, в которой находился стерильный разбавитель). Это возможно осуществить, не вынимая тушку из полиэтиленового пакета.
9 Хранение и транспортирование проб
Транспортирование проб проводят в герметичном термоконтейнере с охлаждающими блоками льда или блоками, содержащими дробленый лед, или в (переносном) холодильнике. Не допускается замораживание проб или их соприкосновение с охлаждающими блоками, если таковые используют. Температуру поддерживают между 1°С и 8°С.
Пробы исследуют в возможно короткие сроки после получения или помещают их на хранение при температуре (3±2)°С в течение не более 24 ч (см. ISO 7218).
10 Микробиологическое исследование проб
10.1 Общие требования
Общие правила микробиологических исследований установлены в ISO 7218.
10.2 Начальная подготовка проб
При отборе проб с использованием различных видов тампонов микроорганизмы удаляют с тампонов, добавляя соответствующий объем жидкости (разбавителя, бульона или питательной среды) и перемешивая и/или сжимая и разжимая через полиэтиленовый пакет.
10.2.1 Методы свабирования
Общие правила отбора проб и подсчета микроорганизмов установлены в ISO 18593.
10.2.1.1 Метод с использованием влажного и сухого тампонов с деревянными ручками
Влажный и сухой тампоны с разбавителем перемешивают в смесителе вихревого типа перед разведением и посевом в соответствии с ISO 6887-1. В процессе перемешивания могут использоваться стерильные стеклянные бусины.
10.2.1.2 Метод с использованием губки, тампонов, кусков ткани небольшого размера
Полиэтиленовый пакет, содержащий губку, тампоны или кусок ткани небольшого размера и разбавитель, помещают в перистальтический гомогенизатор на 1 мин или на гомогенизатор с горизонтальным встряхиванием на 30 с перед разведением и посевом в соответствии с ISO 6887-1.
10.2.2 Пробы, отобранные методом иссечения
Подготовку проб осуществляют в соответствии с ISO 6887-2. При низком содержании микроорганизмов целесообразно подготовить исходную суспензию с меньшим разведением (например, 1:1 (1 в 2) или 1:4 (1 в 5)) вместо установленного 1:9 (1 в 10).
10.2.3 Пробы, отобранные методом отбора проб путем ополаскивания туши
Пробы тщательно перемешивают путем встряхивания перед разведением и посевом в соответствии с ISO 6887-1.
10.3 Подсчет и выявление микроорганизмов
Подсчет и выявление микроорганизмов осуществляют стандартными методами. Количественные результаты для проб, отобранных методом иссечения или свабирования, должны быть выражены в КОЕ на квадратный сантиметр, а не в КОЕ на грамм или миллилитр, за исключением результатов исследования проб кожи сельскохозяйственной птицы, которые могут быть выражены как КОЕ на грамм. Для проб, отобранных методом отбора проб путем ополаскивания туши, результаты определения количества микроорганизмов выражают в виде КОЕ на миллилитр смыва с туши с указанием объема смывочной жидкости или в виде КОЕ на тушу. В случае использования методик обогащения в протоколе отмечают исследуемые микроорганизмы, как идентифицированные, так и не идентифицированные на площади смыва/навеске или в исследуемой туше.
Приложение А
(справочное)
Зоны отбора проб
Выбор зон для отбора проб на туше зависит от технологии убоя и первичной переработки различных видов животных. Целью выбора является определение зон с высокой степенью контаминации микроорганизмами (см. таблицу А.1). На рисунках А.1, А.2 и А.3 приведены примеры зон для отбора проб с поверхности туш свиней, крупного рогатого скота и овец соответственно. Для других крупных животных (например, лошадей, оленей и аналогичных животных) зоны отбора проб будут схожи с зонами отбора проб для крупного рогатого скота. Тем не менее это должно быть подтверждено. Используемая технология убоя и первичной переработки окажет влияние на те зоны, которые наиболее контаминированы.
Таблица А.1 - Зоны с наиболее высокой степенью контаминации
Свиная туша | Туша крупного рогатого скота | Овечья туша |
1 Внутренний тазовый канал | 1 Внутренний тазовый канал | 1 Наружная часть колена |
2 Наружный тазовый канал | 2 Наружный тазовый канал | 2 Внутренний тазовый канал |
3 Брюшина | 3 Наружная часть подколенка | 3 Наружная часть брюшины |
4 Наружная часть мечевидного отростка | 4 Внутренняя часть коленного сустава | 4 Передняя наружная часть грудины |
5 Внутренняя часть мечевидного отростка | 5 Внутренняя часть бедра | 5 Наружная часть передней ноги, локтевого сустава |
6 Столп диафрагмы | 6 Наружная часть грудины | 6 Шея, предлопаточная наружная часть |
7 Наружная подчелюстная часть | 7 Внутренняя часть грудины | |
8 Внутренняя подчелюстная часть | 8 Наружная часть мечевидного отростка | |
9 Наружная часть передней ноги | 9 Внутренняя часть мечевидного отростка | |
10 Внутренняя часть передней ноги | 10 Внутренняя часть передней ноги | |
11 Внутренняя атлантозатылочная часть | ||
12 Наружная атлантозатылочная часть | ||
Номера от 1 до 12 указывают на зоны отбора проб, представленные на рисунках А.1-А.3. | ||
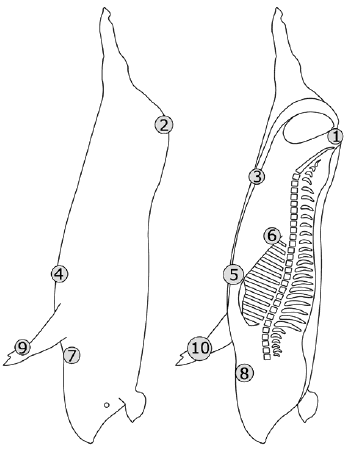 |
Рисунок А.1 - Свиная туша: примеры зон отбора проб
(слева - латеральная часть, справа - медиальная часть)
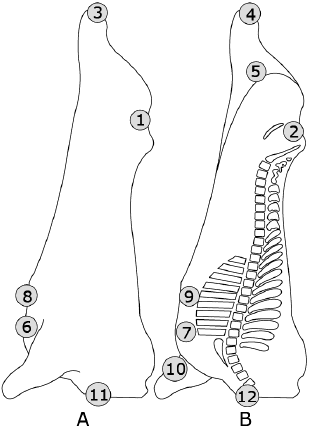 |
Рисунок А.2 - Туша крупного рогатого скота: примеры зон отбора проб
(слева - латеральная часть, справа - медиальная часть)
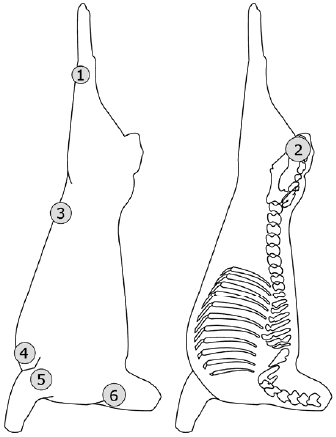 |
Рисунок А.3 - Овечья туша: примеры зон отбора проб
(слева - латеральная часть, справа - медиальная часть)
Библиография
[1] | ISO 18593:2004 | Microbiology of food and animal feed - Horizontal methods for sampling techniques from surfaces using contact plates and swabs (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод отбора проб с поверхности с использованием контактных чашек и тампонов) |
[2] | Dorsa W.J., Siragusa G.R., Cutter C.N., Berry E.D., Koohmairaie M. Efficacy of using a sponge sampling method to recover low levels of Escherichia coli O157:H7, Salmonella typhimurium and aerobic bacteria from beef carcass surface tissue. Food Microbiology, 1997, 14 pp.63-69 (Эффективность метода отбора проб с использованием губки для восстановления низких уровней кишечной палочки О157:Н7, палочки Бреслау и аэробных бактерий с поверхностной ткани говяжьей туши) | |
[3] | Gill C.O., Jones T. Microbiological sampling of carcasses by excision or swabbing. Journal of Food Protection, 2000, 63 pp.167-173 (Микробиологический отбор проб с туши при помощи метода иссечения или свабирования) | |
[4] | Hutchison M.L., Walters L.D., Avery S.M., Reid C.A., Wilson D., Howell M. et al. A comparison of wet-dry swabbing and excision sampling methods for microbiological testing of bovine, porcine, and ovine carcasses at red meat slaughterhouses. Journal of Food Protection, 2005, 68 pp.2155-2162 (Сравнение методов отбора проб с использованием влажного и сухого тампонов и метода иссечения для микробиологического исследования говяжьей, свиной и овечьей туш в убойном пункте (цехе) про производству красного мяса) | |
[5] | International Commission on Microbiological Specifications for Foods (ICMSF). Microorganisms in Foods 8. Use of data for assessing process control and product acceptance. 2011, 400 pp. Springer (Международная комиссия по микробиологическим требованиям к продуктам питания (ICMSF). Микроорганизмы в продуктах питания 8. Использование данных для получения доступа к процессу управления и приемке продуктов питания) | |
[6] | Pearce R.A., Bolton D.J. Excision versus sponge swabbing - A comparison of methods for the microbiological sampling of beef, pork and lamb carcasses. Journal of Applied Microbiology, 2005, 98 pp.896-900 (Метод иссечения в сравнении с методом свабирования с использованием губки. Сравнение методов для микробиологического отбора проб с говяжьей, свиной и овечьей туш) | |
[7] | Qiu Q in Zhang, Ke Ping Y.E., Xing Lian Xu, Guang Hong Zhou, Jin Xuan Cao Comparison of excision, swabbing and rinsing sampling methods to determine the microbiological quality of broiler carcasses. Journal of Food Safety, 2012, 32 pp.134-139 (Сравнение метода иссечения, метода свабирования и метода отбора проб путем ополаскивания туши для определения микробиологического качества тушек бройлера) | |
[8] | Seager T., Tamplin M.L., Lorimer M. Jenson, I., Sumner, J.L. How effective is sponge sampling for removing bacteria from beef carcasses? Food Protection Trends, 2010, 30 pp.336-339 (Насколько эффективен метод отбора проб с помощью губки для взятия смывов с говяжьих туш?) | |
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 6887-1 | IDT | ГОСТ ISO 6887-1-2015 Микробиология пищевой продукции и кормов. Подготовка образцов для испытания, исходной суспензии и десятикратных разведений для микробиологического исследования. Часть 1. Общие правила подготовки исходной суспензии и десятикратных разведений (ISO 6887-1:1999, IDT) |
ISO 6887-2 | IDT | ГОСТ ISO 6887-2-2017 Микробиология пищевой цепи. Подготовка образцов для испытания, исходной суспензии и десятикратных разведений для микробиологического исследования. Часть 2. Специальные правила подготовки мяса и мясной продукции (ISO 6887-2:2017, IDT) |
ISO 7218:2007 | IDT | ГОСТ ISO 7218-2015 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям (ISO 7218:2007, IDT) |
УДК 579.67.086.1 (083.74)(476) | МКС 07.100.30 | IDT |
Ключевые слова: микробиология пищевой цепи, отбор проб, туша, микробиологический анализ | ||
