ГОСТ ISO 11133-2016
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ, КОРМОВ ДЛЯ ЖИВОТНЫХ И ВОДЫ
Приготовление, производство, хранение и определение рабочих характеристик питательных сред
Microbiology of food, animal feed and water. Preparation, production, storage and performance testing of culture media
МКС 07.100.30
Дата введения 2017-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-2015 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2015 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом "Всероссийский научно-исследовательский институт сертификации" (ОАО "ВНИИС") на основе официального перевода на русский язык англоязычной версии указанного в пункте 5 стандарта, который выполнен ОАО "ВНИИС"
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 28 июня 2016 N 49)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 7 ноября 2016 г. N 1605-ст межгосударственный стандарт ГОСТ ISO 11133-2016 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2017 г.
5 Настоящий стандарт идентичен международному стандарту ISO 11133:2014* "Микробиология пищевых продуктов, кормов для животных и воды. Приготовление, производство, хранение и определение рабочих характеристик питательных сред" ("Microbiology of food, animal feed and water. Preparation, production, storage and performance testing of culture media", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный стандарт разработан Техническим комитетом по стандартизации ISO/TC 34 "Пищевые продукты" Международной организации по стандартизации (ISO).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВЗАМЕН ГОСТ ISO/TS 11133-1-2014 и ГОСТ ISO 11133-2-2011
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
В лабораториях, проводящих микробиологические исследования, основными целями являются поддержание жизнеспособности, восстановление жизнеспособности, выращивание и/или подсчет широкого спектра микроорганизмов. Во всех традиционных методах микробиологического культивирования, а также во многих альтернативных методах используют питательные среды. Многие составы питательных сред имеются в продаже, и гораздо большее количество сред, предназначенных для конкретных целей обеспечения роста, описано в литературе.
Многие испытания и методики зависят от способности питательных сред обеспечивать получение достоверных и воспроизводимых результатов. Требования к среде могут быть специфичными как к пробе, так и к выявляемым микроорганизмам. Таким образом, соответствие питательных сред установленным эксплуатационным критериям является предварительным условием надежности любой работы в области микробиологии. Необходимо проведение достаточного количества испытаний, чтобы установить:
a) приемлемость каждой партии среды;
b) пригодность данной среды для конкретной цели;
c) способность среды обеспечивать получение достоверных результатов.
Эти три критерия являются важной частью процедур управления внутренним качеством и наряду с соответствующей документацией позволяют осуществлять эффективный мониторинг питательных сред, что способствует получению прецизионных и надежных данных. Для проведения надежного микробиологического анализа важно использовать питательные среды признанного качества. Для всех сред, описанных в стандартных методах, важно установить минимальные критерии приемлемости, требуемые для гарантирования надежности. Рекомендуется, чтобы при проведении определения эксплуатационных характеристик питательной среды проводились испытания в соответствии с настоящим стандартом.
Установление повсеместно принятых минимальных эксплуатационных критериев для питательных сред позволит получать продукцию с более стабильным качеством, что будет способствовать снижению количества испытаний, которые необходимо проводить в лаборатории пользователя.
Более того, критерии приемлемости, измеренные в рамках методов, установленных в настоящем стандарте, допускается использовать во всех микробиологических лабораториях для оценивания таких свойств питательных сред, как производительность, селективность и/или элективность.
При проведении микробиологического анализа пищевых продуктов, кормов для животных и воды требования настоящего стандарта являются первоочередными при оценке качества питательных сред.
1 Область применения
Настоящий стандарт устанавливает условия, касающиеся обеспечения качества питательных сред, а также устанавливает требования к приготовлению питательных сред, предназначенных для микробиологического анализа пищевых продуктов, кормов для животных, проб окружающей среды из зоны производства пищевых продуктов и кормов для животных, а также всех видов воды, предназначенной для потребления или используемой при производстве пищевых продуктов.
Настоящие требования применимы ко всем видам питательных сред, которые приготовляют для использования в лабораториях, проводящих микробиологический анализ.
Настоящий стандарт также устанавливает критерии и описывает методы определения рабочих характеристик (эксплуатационных испытаний) питательных сред. Настоящий стандарт следует применять следующим поставщикам и изготовителям:
- торговым организациям, которые выпускают и/или распространяют готовые к использованию или частично готовые восстановленные или обезвоженные среды;
- некоммерческим организациям, которые поставляют среды третьей стороне;
- микробиологическим лабораториям, которые готовят питательные среды для собственного применения.
2 Нормативные ссылки
В настоящем стандарте приведены нормативные ссылки на нижеприведенные стандарты, которые являются обязательными при применении настоящего стандарта.* Для недатированных ссылок применяют последнее издание ссылочного документа (включая все изменения).
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 6887-1, Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 1: General rules for the preparation of the initial suspension and decimal dilutions (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений)
ISO 6887-2, Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 2: Specific rules for the preparation of meat and meat products (Микробиология пищевых продуктов и кормов для животных. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологических исследований. Часть 2. Специальные правила подготовки мяса и мясных продуктов)
ISO 6887-3, Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 3: Specific rules for the preparation of fish and fishery products (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 3. Специальные правила для приготовления рыбы и рыбных продуктов)
ISO 6887-4, Microbiology of food and animal feed - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 4: Specific rules for the preparation of miscellaneous products (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 4. Специальные правила для приготовления различных продуктов)
ISO 6887-5, Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 5: Specific rules for the preparation of milk and milk products (Микробиология пищевых продуктов и кормов для животных. Подготовка проб для анализа, исходной суспензии и десятичных разведений для микробиологического исследования. Часть 5. Специальные правила подготовки молока и молочных продуктов)
ISO 6887-6, Microbiology of food and animal feed - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 6: Specific rules for the preparation of samples taken at the primary production stage (Микробиология пищевых продуктов и кормов для животных. Подготовка проб для анализа, исходной суспензии и десятичных разведений для микробиологического исследования. Часть 6. Специальные правила приготовления проб, отобранных на начальной стадии производства)
ISO 7704, Water quality - Evaluation of membrane filters used for microbiological analyses (Качество воды. Оценка мембранных фильтров, используемых для микробиологических анализов)
ISO 7218, Microbiology of food and animal feeding stuffs - General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
ISO 8199, Water quality - General guidance on the enumeration of micro-organisms by culture (Качество воды. Общее руководство по подсчету микроорганизмов, выращенных методом посева на питательной среде)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
Примечания
1 В данном разделе приведены основные определения, касающиеся обеспечения качества питательных сред, а также терминология, касающаяся определения рабочих характеристик (эксплуатационных испытаний), питательных сред и тест-микроорганизмов.
2 В таблицах Е.2 и F.2 приведены пояснения к аббревиатурам наименований питательных сред.
3.1 Основные термины и определения
3.1.1 управление качеством (quality control): Область менеджмента качества, основным объектом которой является выполнение требований к качеству.
Примечание - См. ссылку [1].
3.1.2 партия питательной среды (batch of culture medium, lot of culture medium): Однородная и полностью прослеживаемая единица среды, связанная с определенным количеством бестарного продукта, полуфабриката или конечного продукта, которая соответствует одному типу и качеству, которая была произведена в течение определенного периода производства и которой был присвоен один и тот же номер партии.
3.1.3 хромогенный субстрат, флуорогенный субстрат (chromogenic substrate, fluorogenic substrate): Субстрат, содержащий хромофорную/флуорофорную группу, усваиваемый бактериями или грибами.
Примечание - После расщепления хромогенного/флуорогенного субстрата выделяется хромофор/флуорофор, и окрашенный/флуоресцирующий конечный продукт становится видимым либо может быть обнаружен при помощи ультрафиолетовой лампы.
3.2 Терминология, касающаяся определения рабочих характеристик (эксплуатационных испытаний)
3.2.1 эффективность питательной среды (performance of culture media): Реакция питательной среды на введение в нее (посев) тест-микроорганизмов в определенных условиях.
3.2.2 целевой микроорганизм (target microorganism): Микроорганизм или группа микроорганизмов, выявление и подсчет которых проводят.
3.2.3 нецелевой микроорганизм (non-target microorganism): Микроорганизм, который подавлен средой и/или условиями инкубирования или который не демонстрирует признаков, характерных для целевого микроорганизма.
3.2.4 производительность питательной среды (productivity of culture medium): Степень роста целевого микроорганизма на питательной среде при определенных условиях.
3.2.5 селективность питательной среды (selectivity of culture medium): Степень ингибирования нецелевого микроорганизма на или в селективной питательной среде при определенных условиях.
3.2.6 элективность (специфичность) питательной среды (electivity of culture medium, specificity of culture medium): Демонстрация при определенных условиях того, что нецелевые микроорганизмы не проявляют те же визуальные характеристики, что целевые микроорганизмы.
3.3 Терминология, касающаяся питательных сред
3.3.1 питательная среда (culture medium): Смесь веществ в жидком, полутвердом или твердом состоянии, в которую входят природные и/или синтетические ингредиенты, предназначенные для поддержания размножения (с ингибированием роста определенных микроорганизмов или без него), идентификации или сохранения жизнеспособности микроорганизмов.
Примечание - При использовании с дополнительными словами этот термин часто сокращают до слова "среда" (например, "обогатительная среда").
3.3.2 Питательные среды, классификация по составу
3.3.2.1 питательная среда с химически определенным составом (chemically defined medium): Питательная среда, состоящая только из ингредиентов с четко определенным химическим составом с известной молекулярной структурой и степенью чистоты.
3.3.2.2 питательная среда с химически неопределенным составом или с химически частично неопределенным составом (chemically undefined or partially undefined medium): Питательная среда, состоящая полностью или частично из природных веществ, переработанных или нет, химический состав которых определен не полностью.
Примечание - Гармонизированные обозначения для различных ингредиентов с химически неопределенным составом, используемых в питательных средах, приведены в приложении А.
3.3.2.3 хромогенная питательная среда, флуорогенная питательная среда (chromogenic culture medium, fluorogenic culture medium): Питательная среда, которая содержит один и несколько хромогенных/флуорогенных субстратов.
Примечание - Хромогенные питательные среды облегчают идентификацию бактерий или грибов посредством образования определенной окраски и определенных морфологических характеристик (типичный рост на питательной среде). Флуорогенная среда может быть визуализирована при помощи ультрафиолетовой лампы. Продукты биохимических реакций, которые необходимы для эффективности хромогенных/флуорогенных питательных сред, как правило, являются результатом ферментативной активности определенных микроорганизмов, которая в большой степени зависит от точного поддержания специальных условий (например, температуры, значения рН, концентрации субстрата).
3.3.3 Классификация питательных сред в соответствии с их физической консистенцией
3.3.3.1 жидкая питательная среда (liquid medium): Питательная среда, состоящая из водного раствора одного или нескольких компонентов (например, пептонная вода, питательный бульон).
Примечания
1 В некоторых случаях в жидкую питательную среду добавляют твердые частицы (например, среда с переработанным мясом).
2 Жидкие среды в пробирках, колбах или флаконах обычно называют термином "бульон".
3.3.3.2 плотная питательная среда, полужидкая питательная среда (solid medium, semi-solid medium): Жидкая питательная среда, содержащая затвердевающие материалы (например, агар-агар, желатин и т.д.) в различных концентрациях.
Примечания
1 Благодаря широкому использованию по всему миру питательных сред, затвердевающих с помощью агар-агара, в качестве синонима плотной питательной среды часто используют сокращенный термин "агар" и также в сочетании с существительными: например, "агар для подсчета микроорганизмов в чашках Петри".
2 Плотную питательную среду, разлитую по чашкам Петри, обычно называют plate ("чашка Петри"). Плотную питательную среду, разлитую по пробиркам или небольшим флаконам, которые держат в наклонном положении при застывании среды, часто называют slant или slope (скошенная плотная питательная среда, косой агар). Если среда заполняет дно емкости, образующийся слой называют столбиком.
3.3.4 Классификация питательных сред в соответствии со способом их применения
3.3.4.1 транспортная (питательная) среда (transport medium): Питательная среда, предназначенная для сохранения и поддержания жизнеспособности микроорганизмов без возможности существенного размножения в течение времени с момента отбора проб до момента обработки пробы в лаборатории.
Пример - Транспортная среда Стюарта или Эми (Stuart, Amies).
3.3.4.2 (питательная) среда для сохранения (preservation medium): Питательная среда, предназначенная для сохранения и поддержания жизнеспособности микроорганизмов в течение более продолжительного периода времени, чтобы защитить их от неблагоприятных воздействий, которые могут возникнуть при длительном хранении и способствовать восстановлению после этого периода.
Пример - Яичная питательная среда Дорсета (Dorset), скошенный питательный агар.
3.3.4.3 питательная среда суспензирования (diluent medium, suspension medium): Питательная среда, предназначенная для отделения микроорганизмов от плотного испытуемого продукта в жидкую фазу и/или для снижения их концентрации путем разбавления без размножения или ингибирования в течение времени контактирования.
Пример - Пептонный солевой раствор.
3.3.4.4 оживляющая (питательная) среда (resuscitation medium): Питательная среда, предназначенная для активации подверженных стрессу или поврежденных микроорганизмов и восстановления их способности к нормальному росту, но не обязательно способствующая их размножению.
Пример - Буферная пептонная вода.
Примечание - Данную среду можно также использовать как обогатительную среду (например, буферную пептонную воду).
3.3.4.5 обогатительная (питательная) среда (pre-enrichment medium, enrichment medium): Преимущественно жидкая питательная среда, которая благодаря составу обеспечивает особенно благоприятные условия для размножения микроорганизмов.
Пример - Триптон-соевый бульон.
3.3.4.5.1 селективная обогатительная (питательная) среда (selective enrichment medium): Обогатительная среда, которая поддерживает размножение конкретных микроорганизмов, частично или полностью подавляя рост других микроорганизмов.
Пример - Соевая пептонная среда Раппапорта-Василиадиса (Rappaport-Vasiliadis).
3.3.4.5.2 неселективная обогатительная (питательная) среда (non-selective enrichment medium): Обогатительная среда, которая поддерживает рост большинства микроорганизмов.
Пример - Питательный бульон из сердечно-мозговой настойки.
3.3.4.6 (питательная) среда для выделения (isolation medium): Плотная или полужидкая питательная среда, которая поддерживает рост микроорганизмов.
3.3.4.6.1 селективная (питательная) среда для выделения (selective isolation medium): Питательная среда для выделения, которая поддерживает рост конкретных микроорганизмов, частично или полностью подавляя рост других микроорганизмов.
Пример - Модифицированный агар с активированным углем, цефоперазоном и дезоксихолатом (агар mCCD).
3.3.4.6.2 неселективная (питательная) среда для выделения (non-selective isolation medium): Питательная среда для выделения, которая не приспособлена к избирательному подавлению роста микроорганизмов.
Пример - Питательный агар.
3.3.4.6.3 хромогенная селективная питательная среда, флуорогенная селективная питательная среда (chromogenic selective culture medium, fluorogenic selective culture medium): Хромогенная/флуорогенная питательная среда, которая также содержит селективные компоненты, которые частично или полностью ингибируют сопутствующую микрофлору, содержащуюся в испытуемом материале, тем самым способствуя точному выявлению целевых микроорганизмов.
Пример - Агар ТВХ, среда MUG/EC.
3.3.4.7 дифференциальная (питательная) среда (differential medium, characterization medium): Питательная среда, которая позволяет анализировать одну или несколько физиологических/биохимических характеристик микроорганизмов для их идентификации.
Пример - Агар ТВХ, лактозный агар с тергитолом 7, ТТС.
Примечание - Дифференциальные среды, которые можно использовать в качестве сред для выделения, называют средами для выделения/дифференциальными средами [например, агар на основе дезоксихолат-лизин-ксилозы (XLD), агар лактозный ТТС].
3.3.4.8 идентификационная (питательная) среда (identification medium): Питательная среда, предназначенная для получения специфической опознавательной реакции, которая обычно не требует последующего подтверждения.
Пример - агар с желчью, эскулином и азидом.
3.3.4.9 среда для подсчета (enumeration medium): Селективная или неселективная питательная среда, которая позволяет производить подсчет микроорганизмов.
Пример - Агар Baird-Parker, агар с дрожжевым экстрактом.
Примечание - Среда для подсчета может обладать свойствами оживляющей и/или обогатительной среды.
3.3.4.10 подтверждающая среда (confirmation medium): Питательная среда, которая способствует идентификации или определению характеристик микроорганизмов, которые проводят после предварительных стадий оживления, выделения и/или обогащения.
Пример - Агар Kligler с железом.
3.3.4.11 среда, содержащая нейтрализующие вещества (medium containing neutralizers): Транспортная среда, среда для суспензирования или питательная среда, которая содержит нейтрализующие ингредиенты, предназначенные для дезактивации моющих или дезинфицирующих средств, а также иных средств, вызывающих гибель микроорганизмов.
3.3.4.12 многоцелевая среда (medium having multiple uses): Питательная среда, относящаяся к нескольким категориям.
Пример - Кровяной агар является оживляющей средой согласно 3.3.4.4, средой для выделения согласно 3.4.4.6 и дифференциальной средой согласно 3.3.4.7, используемой для обнаружения гемолиза. Буферная пептонная вода является разбавителем согласно 3.3.4.3 и обогатительной средой согласно 3.3.4.5.
3.3.4.13 контрольная (эталонная) среда (reference medium): Питательная среда, как правило неселективная, используемая для сравнительной оценки эксплуатационных характеристик, применяемая независимо от испытуемой среды и пригодная для использования в качестве контрольной (эталлонной*).
________________
* Текст документа соответствует оригиналу. - .
Пример - Триптоновый соевый агар (TSA).
3.3.5 Классификация питательных сред в соответствии с методом их приготовления
3.3.5.1 среда, готовая к использованию (ready-to-use medium): Жидкая, плотная или полужидкая среда, которая поставляется в чашках Петри, бутылках, пробирках и прочих контейнерах в форме, готовой к использованию, готовой к использованию после переплавки или готовой к использованию после переплавки и внесения добавок.
3.3.5.1.1 готовая питательная среда (finished culture medium): Среда, готовая к инокуляции.
3.3.5.1.2 среда, готовая к использованию после переплавки (ready-to-use medium after remelting): Среда, которую необходимо переплавить, например, для использования при глубинном посеве в чашках Петри или для разлива в чашках Петри.
3.3.5.1.3 среда, готовая к использованию после переплавки и внесения добавок (ready-to-use medium after remelting and supplementing): Среда, которую необходимо переплавить, в которую необходимо внести добавки и которую следует распределить по емкостям перед использованием (неполная среда, готовая к использованию).
Пример - Агар триптозный с сульфитом и циклосерином (TSC), агар Baird-Parker, агар с фибриногеном плазмы кролика (RPF).
3.3.5.2 питательная среда, приготовленная из имеющейся в продаже дегидратированной формы (medium prepared from commercially dehydrated formulations): Питательная среда в сухой форме, которая требует добавления воды и обработки перед использованием, в результате чего образуется один из двух видов среды:
- среда, полностью готовая к использованию;
- неполная среда, к которой необходимо добавить ингредиенты перед применением.
Пример - Порошки, компактные гранулы, лиофилизированные продукты.
3.3.5.3 питательная среда, приготовленная из отдельных ингредиентов (medium prepared from individual components): Питательная среда, приготовленная в микробиологической лаборатории полностью из конкретных ингредиентов.
3.4 Термины, касающиеся тест-микроорганизмов
3.4.1 тест-микроорганизмы (test organisms): Микроорганизмы, обычно используемые для эксплуатационных испытаний питательных сред.
Примечание - Тест-микроорганизмы далее определены в соответствии с их источником (см. 3.4.2-3.4.7).
3.4.2 контрольный (эталонный) штамм (reference strain): Микроорганизм, полученный непосредственно из официальной коллекции культур, являющейся членом Всемирной федерации коллекций культур (WFCC) или Европейской организации коллекций культур (ЕССО), для которого определены как минимум род и вид, который внесен в каталог и описан в соответствии с его характеристиками и предпочтительно при необходимости установлено его происхождение в плане пищевых продуктов, кормов для животных или окружающей среды зоны производства пищевых продуктов и кормов для животных или воды.
3.4.3 контрольные (эталонные) исходные культуры (reference stock): Набор отдельных идентичных культур, полученных в результате одного пересева контрольного штамма, либо имеющегося в лаборатории, либо полученного от поставщика.
3.4.4 исходная культура (stock culture): Первый пересев контрольной (эталонной) исходной культуры.
3.4.5 рабочая культура (working culture): Пересев контрольной исходной культуры, исходной культуры или стандартного образца, сертифицированного или нет.
3.4.6 стандартный образец (reference material, RM): Материал, содержащий определенное количество жизнеспособных микроорганизмов, достаточно однородный и стабильный в плане данных микроорганизмов, который пригоден для применения в процессах измерения.
Примечание - См. [3].
3.4.7 сертифицированный стандартный образец (certified reference material, CRM): Стандартный образец, прошедший метрологическую процедуру определения количества жизнеспособных микроорганизмов, сопровождаемый сертификатом, в котором указаны установленное значение количества жизнеспособных микроорганизмов, значение соответствующей неопределенности и приведены данные о метрологической прослеживаемости.
Примечание - См. [3].
4 Обеспечение качества питательных сред
4.1 Документация
4.1.1 Документация, требуемая от изготовителя
От изготовителя (коммерческих или некоммерческих организаций, поставляющих среды третьей стороне) требуется предоставление следующей информации о средах:
- наименование среды, отдельных ингредиентов, всех добавок и по возможности товарные коды среды;
- технические данные, например, состав, цель применения, количество (при необходимости), ссылки;
- сведения, касающиеся безопасности и/или рисков (при необходимости);
- код партии;
- значение рН готовой среды;
- информация о хранении и дата истечения срока годности;
- предписанный срок хранения;
- свидетельство о контроле качества с указанием используемого тест-микроорганизма и результатов эксплуатационных испытаний с критериями приемлемости.
4.1.2 Сдача-приемка продукции
Для каждой партии продукции (ингредиента или питательной среды) проводят проверку следующих показателей:
- идентификации продукции;
- целостности упаковки;
- даты истечения срока годности продукции;
- сопроводительной документации;
- количества полученных единиц продукции.
Регистрируют дату получения.
4.2 Хранение
4.2.1 Общие положения
Во всех случаях необходимо следовать инструкциям изготовителя.
4.2.2 Контроль качества и управление качеством обезвоженных (сухих) питательных сред и добавок
Питательные среды поставляют в форме обезвоженных порошков или гранул в герметично закрытых контейнерах, а добавки различных селективных или диагностических веществ поставляют либо в лиофилизированном, либо в жидком состоянии. Однако приобретение необходимо планировать заранее, чтобы обеспечить регулярный поток (т.е. "первым получен - первым использован").
При вскрытии нового контейнера осуществляют:
- проверку герметичности;
- запись даты первого вскрытия;
- визуальную оценку содержимого вскрытых контейнеров.
Качество среды будет зависеть от условий хранения после того, как вскроют новый контейнер. Потеря качества обезвоженных сред проявляется в изменении текучести (сыпучести) порошка, изменении гомогенности, комковании, изменениях цвета и т.д. Любую обезвоженную среду, которая абсорбировала влагу или демонстрирует очевидные изменения физического внешнего вида, не следует использовать.
При вскрытии бутылки с обезвоженной средой на бутылке ставят соответствующую дату и указывают максимальное время хранения.
4.3 Приготовление сред в лаборатории
4.3.1 Общие положения
Правильное приготовление питательных сред является одним из основных этапов для обеспечения достоверности микробиологического исследования, и ему необходимо уделить особое внимание.
Следуют нормам надлежащей лабораторной практики и инструкциям изготовителя в том, что касается операций с обезвоженными средами и другими ингредиентами, в частности с теми, которые содержат опасные вещества, такие как желчные соли, азид натрия, антибиотики и прочие селективные агенты.
При приготовлении сред из обезвоженных коммерчески доступных рецептур строго следуют инструкциям изготовителя. Документируют все сопутствующие данные, такие как код, номер партии, масса/объем, рН, дата приготовления, условия стерилизации, сведения об изготовителе.
При приготовлении сред из отдельных ингредиентов строго следуют рецептуре. Записывают все подробности (как и ранее), а также полную идентификацию всех используемых ингредиентов (код, номер партии и дату истечения срока годности при наличии таковых).
В приложении D приведен пример учетной карточки с данной информацией.
4.3.2 Качество основных ингредиентов питательных сред
Рецептуры основных ингредиентов питательных сред приведены в конкретных стандартах (см. библиографию). В рецептуре дополнительно могут быть указаны молекулярная масса и номер CAS химического вещества.
_________________
Номер CAS (регистрационный номер CAS) - это однозначный цифровой идентификатор Chemical Abstracts Service (CAS), присваиваемый химическим элементам, соединениям, полимерам, биологическим последовательностям, смесям и сплавам.
Иногда определенные ингредиенты (например, приведенные ниже), входящие в рецептуру, могут быть модифицированы для того, чтобы эксплуатационные характеристики среды были неизменными и стабильными.
Данные ингредиенты включают:
- пептоны, мясные и дрожжевые экстракты, питательные свойства которых подвержены изменениям;
- агар, желирующие свойства которого подвержены изменениям;
- буферные вещества;
- желчные соли, желчный экстракт, дезоксихолат, антибактериальные красители в зависимости от их селективных свойств;
- красители-индикаторы;
- антибиотики в зависимости от их активности и взаимодействия с другими ингредиентами.
Примечание - При выпуске сред в промышленном масштабе производители, как правило, дают указания, что рецептура среды может быть оптимизирована с тем, чтобы добиться соответствия требуемым эксплуатационным критериям. Распространенной является практика, когда вначале выбирают ингредиент и затем регулируют концентрацию от партии к партии с целью достижения одинаковых эксплуатационных характеристик и минимизации колебаний от партии к партии.
4.3.3 Вода
При приготовлении питательных сред используют только воду, которая подвергалась предварительной очистке - дистиллированную, деминерализованную, деионизированную, обработанную путем обратного осмоса либо эквивалентного качества, не содержащую веществ, которые могут ингибировать или иным способом повлиять на рост микроорганизмов в условиях испытания (например, следы хлора, аммиака или ионов металлов).
Очищенную воду хранят в герметично упакованных емкостях из инертного материала (нейтральное стекло, полиэтилен и т.п.), который не содержит ингибирующих веществ. Воду очищают перед использованием при приготовлении питательных сред.
Микробное загрязнение не должно превышать 10 колониеобразующих единиц (КОЕ) на кубический сантиметр, и оно должно быть предпочтительно менее 10
КОЕ/см
. Микробное загрязнение следует регулярно контролировать в соответствии с [4], проводя инкубирование при температуре (22±1)°С в течение (68±4) ч или используя аналогичный метод.
Примечание - Вода, которая была пропущена через ионообменник (деминерализованная), может содержать весьма значительное количество микроорганизмов. Таким образом, не рекомендуется использовать данный процесс без проверки воды на микробное загрязнение. Для поиска наилучшего способа минимизации микробного загрязнения следует проконсультироваться с производителем. Деминерализованная вода с высоким уровнем загрязнения, даже стерилизованная путем фильтрации, все еще может содержать вещества, подавляющие рост определенных микроорганизмов.
Электропроводность воды, используемой в лаборатории, должна быть не более 25 мкС/см (что эквивалентно сопротивлению 0,4 МОм·см) и предпочтительно ниже 5 мкС/см (степень чистоты 3 по [5]) при температуре 25°С, если не требуется иное. Электропроводность воды следует проверять перед использованием.
4.3.4 Взвешивание и растворение
Соблюдая необходимые меры предосторожности, аккуратно взвешивают требуемое количество обезвоженной среды или отдельных ингредиентов и постепенно смешивают с необходимым количеством воды, избегая образования комков. Соблюдают требуемый баланс; максимально допустимая ошибка составляет 1% или менее, как это установлено в ISO 7218 и ISO 8199. Если не указано иное, ингредиенты добавляют к требуемому объему воды, а не доводят объем водой до нужного уровня.
4.3.5 Растворение и диспергирование
Если необходимо, для растворения обезвоженные среды требуется быстро диспергировать путем периодического или постоянного перемешивания с последующим нагреванием. Средам, содержащим агар, перед нагреванием с перемешиванием для растворения необходимо дать несколько минут на пропитывание, и затем их разливают перед автоклавированием, если это необходимо. Следует избегать перегрева.
4.3.6 Измерение и регулирование рН
рН измеряют с помощью рН-метра и регулируют перед стерилизацией, если необходимо, так, чтобы после стерилизации и охлаждения до температуры 25°С среда имела требуемое значение рН ±0,2 ед. рН, если нет иных указаний. Регулировку рН обычно осуществляют с помощью раствора гидроксида натрия (NaOH) концентрацией приблизительно 40 г/дм (примерно 1 моль/дм
) или разбавленной соляной кислоты (HCI) концентрацией приблизительно 36,5 г/дм
(примерно 1 моль/дм
). При регулировании рН среды после стерилизации используют стерильные растворы. Дополнительная информация, касающаяся измерения рН, приведена в ISO 7218 и ISO 8199.
Примечание - Имеющиеся в продаже среды могут демонстрировать значительные изменения рН до и после обработки в автоклаве. Однако при условии использования дистиллированной или деионизованной воды надлежащего качества регулирование рН перед обработкой в автоклаве, как правило, не потребуется.
4.3.7 Разливка
Среду разливают по соответствующим емкостям, при этом оставляют достаточное свободное пространство над средой во избежание выкипания среды в процессе охлаждения после тепловой обработки при автоклавировании или переплавке либо перелива среды после внесения добавок.
Примечание - Данное свободное пространство может не потребоваться, если в процессе охлаждения в автоклаве поддерживается надлежащее давление.
4.3.8 Стерилизация
4.3.8.1 Общие положения
Готовые питательные среды стерилизуют в день приготовления.
Стерилизацию питательных сред и реактивов, как правило, проводят при помощи влажного пара (см. 4.3.8.2) или фильтрации (см. 4.3.8.3).
Определенным средам для стерилизации не требуется обработка в автоклаве, их можно использовать после кипячения. Например, среды для выращивания Enterobacteriaceae, содержащие бриллиантовый зеленый, особенно чувствительны к нагреванию и действию света, и после кипения их необходимо быстро охладить и защищать от интенсивного света. Некоторые реактивы также могут использоваться без стерилизации. В любом случае необходимо ссылаться на соответствующий стандарт или инструкции изготовителя.
4.3.8.2 Стерилизация влажным паром
Стерилизацию влажным паром выполняют в автоклаве или специальном аппарате для приготовления питательных сред.
Для объемов свыше 1000 см режим стерилизации в автоклаве адаптируют соответствующим образом, чтобы обеспечить надлежащую тепловую обработку. В любом случае необходимо следовать положениям соответствующего стандарта или инструкциям изготовителя.
Примечание - Если в автоклаве обрабатывают большие объемы сред (>1000 см), может произойти перегрев.
После нагревания необходимо дать средам остыть таким образом, чтобы предотвратить выкипание. Это особенно важно для сред в большом объеме и для сред, содержащих чувствительные к воздействию тепла ингредиенты, например, сред с бриллиантовым зеленым.
Дополнительная информация по стерилизации влажным паром приведена в ISO 7218 и в [11].
Стерилизацию паром оценивают при помощи значений F, принимая во внимание обработку паром в процессе нагрева и охлаждения. Параметры тепловой обработки необходимо определить для конкретной загрузки с тем, чтобы добиться надлежащей обработки емкостей независимо от местоположения в автоклаве.
4.3.8.3 Стерилизация фильтрацией
Стерилизацию фильтрацией можно выполнить под вакуумом или под давлением. Используют стерильное оборудование и мембраны с диаметром пор 0,2 мкм. Стерилизуют различные части фильтровального оборудования в соответствии с ISO 7218 или ISO 8199 либо используют заранее стерилизованное оборудование.
На некоторых фильтровальных мембранах могут задержаться протеины или другие вещества (такие как антибиотики). Для получения требуемой концентрации пользователь должен выбрать подходящий тип мембраны, например мембрану с малой способностью связывать белки, и использовать предварительно смоченный фильтр.
4.3.9 Подготовка добавок
МЕРЫ ПРЕДОСТОРОЖНОСТИ - С готовыми добавками, содержащими токсичные вещества, особенно антибиотики, необходимо обращаться с осторожностью, избегая рассеивания порошка, что может вызвать аллергические или другие реакции у лабораторного персонала. Необходимо соблюдать технику безопасности и следовать инструкциям изготовителя при приготовлении растворов.
Нельзя использовать просроченные добавки, поскольку, например, для рабочих растворов антибиотиков срок годности истекает обычно в тот же самый день. При определенных обстоятельствах растворы антибиотиков можно хранить в замороженном состоянии подходящими объемами (аликвотами), но не допускается вторичное замораживание после размораживания. Пользователю рекомендуется обсудить с изготовителем потенциальную потерю активности в результате замораживания или определить ее самостоятельно.
4.4 Хранение и срок годности приготовленных сред
4.4.1 Среды, поставляемые из коммерческих источников
Следуют инструкциям изготовителя в том, что касается условий хранения, даты истечения срока годности и использования сред.
4.4.2 Среды, приготовленные в лаборатории
4.4.2.1 Общие положения
Все среды идентифицируют для обеспечения их прослеживаемости.
Срок годности сред может быть разным. Конкретные стандарты могут устанавливать определенные условия и сроки хранения, однако они должны быть проверены в лаборатории. Частоту процедур проверки устанавливают в лаборатории.
Среды хранят в условиях, в которых не происходит никаких изменений их состава, в частности в условиях защиты от света и высыхания. Если их не используют незамедлительно или их используют иным образом в соответствии с конкретным стандартом, среды хранят в холодильнике при температуре (5±3)°С.
Срок хранения сред в чашках Петри в холодильнике не должен превышать 2-4 недели, а бутылок и пробирок 3-6 месяцев, если в конкретных стандартах не указано иное или результаты проверки срока годности при хранении в лаборатории подтверждают возможность обеспечения более длительного периода сохранности. Дополнительная информация о максимальном сроке хранения для приготовленных сред приведена в ISO 8199, [17] и [21].
Рекомендуется среды, к которым добавлены лабильные добавки, использовать в день приготовления, если в конкретных стандартах не указано иное или результаты проверки срока годности в лаборатории не показывают более длительную сохранность (см. 4.4.2.2). Плотные среды, содержащие химически активные и/или лабильные вещества, следует хранить в таре, в которой осуществляют их плавление.
Перед применением или перед нагреванием питательные среды рекомендуется выдерживать до установления равновесия с окружающей температурой.
4.4.2.2 Оценка срока годности среды
Дату истечения срока годности для хранимых сред устанавливают путем проверки состояния среды после определенного периода времени хранения на основании ее физических, химических и микробиологических характеристик, как это установлено в настоящем стандарте. Частоту процедур проверки устанавливают в лаборатории.
Наблюдают любые изменения цвета среды, признаки испарения/обезвоживания, изменения величины рН или неудовлетворительной производительности, селективности или специфичности (при необходимости). Дату истечения срока годности устанавливают на основании периода хранения, по прошествии которого все вышеуказанные эксплуатационные характеристики остаются приемлемыми.
Примечание - Данная проверка также пригодна для сред, поставляемых из коммерческих источников.
4.4.2.3 Хранение сред в чашках Петри
Затвердевшие среды используют незамедлительно или хранят в перевернутом виде в условиях защиты снижения качества и обезвоживания, т.е. в темноте и/или в холодильнике при температуре (5±3)°С. На нижнюю часть или боковую поверхность чашки наносят дату приготовления среды и/или дату истечения срока годности, а также идентификационные данные. Допускается использовать альтернативную систему кодирования, соответствующую конкретным требованиям.
Срок годности среды в чашках Петри может быть увеличен при хранении в запечатанных пластиковых или целлофановых мешках. С целью минимизации конденсации влаги перед помещением в мешки чашки Петри охлаждают. Перед помещением чашек в холодильник поверхность агара не следует высушивать.
4.5 Подготовка к применению
4.5.1 Плавление агаризованных питательных сред
Расплавляют питательную среду, поместив ее на кипящую водяную баню или с помощью любого другого процесса, который дает аналогичные результаты (например, в автоклаве текучим паром, как это установлено в ISO 7218 и ISO 8199). Среды, которые ранее прошли обработку в автоклаве, рекомендуется снова нагревать в течение минимального времени, чтобы поддержать качество среды. Необходимо избегать перегрева и прекратить нагревание, если среда уже расплавилась. Выдерживают на теплоустойчивой поверхности при комнатной температуре в течение короткого периода времени, например, 2 мин, перед помещением в водяную баню для охлаждения во избежание растрескивания стекла.
Охлаждают расплавленную среду до температуры от 47 до 50°С на водяной бане с контролем температуры. Время, необходимое для достижения температуры от 47 до 50°С, зависит от типа среды, объема и количества сосудов в водяной бане. Расплавленную среду рекомендуется использовать по возможности сразу, оставляя в таком состоянии не более чем на 4 ч. При работе с особо чувствительными средами время выдержки расплавленной среды следует сократить, и это должно быть установлено в соответствующем стандарте. Неиспользованную среду не следует подвергать вторичному затвердеванию для последующего использования.
Устанавливают и документируют режим нагрева агара путем установки термометра в агаризованную среду в отдельном контейнере, аналогичном тому, который используется для испытуемой среды. Это зависит от количества и размеров контейнеров, помещенных в водяную баню.
Примечание - Среды, используемые в чашках Петри, следует нагреть до температуры от 44 до 47°С или как это установлено в соответствующем стандарте. Используют водяную баню, установленную на температуру от 44 до 47°С. Дополнительная информация, касающаяся использования и проверки водяных бань, приведена в ISO 7218.
4.5.2 Деаэрация питательных сред
Если необходимо обеспечить требуемое содержание воздуха (или кислорода), непосредственно перед применением нагревают питательную среду на кипящей водяной бане или текучим паром в течение 15 мин, приоткрыв крышку или колпачок; после нагревания плотно закрывают крышки и быстро охлаждают до необходимой температуры.
4.5.3 Введение дополнительных ингредиентов
Не устойчивые к нагреванию ингредиенты рекомендуется добавлять в среду после ее охлаждения до температуры ниже 50°С. Если среда содержит агар, стерильному ингредиенту дают достичь по меньшей мере комнатной температуры перед добавлением его в плотную среду. Холодные жидкости могут вызвать желатинизацию агара или образование прозрачных хлопьев, при этом требуемое диспергирование не достигается. Следуют инструкциям изготовителя. Все добавленные в среду ингредиенты осторожно и тщательно перемешивают, а затем распределяют по конечным контейнерам по возможности максимально быстро.
4.5.4 Приготовление плотных сред в чашках Петри
Разливают расплавленную агаровую питательную среду по чашкам Петри так, чтобы получить слой толщиной не менее 3 мм (например, для чашек диаметром 90 мм обычно требуется от 18 до 20 см агара), или как это установлено в соответствующем стандарте. При хранении чашек, или когда инкубирование длится более 72 ч, или когда температура инкубирования выше 40°С, может потребоваться больший объем питательной среды. Дают агару охладиться и застыть, разместив чашки Петри с закрытыми крышками на холодной горизонтальной поверхности.
Готовые чашки с агаром следует хранить и использовать в соответствии с инструкциями изготовителя.
4.5.5 Приготовление среды для инокуляции
Для поверхностной инокуляции плотной питательной среды высушивают среду непосредственно перед использованием до тех пор, пока с поверхности среды не исчезнут капли. Слой среды не следует подвергать чрезмерному высушиванию.
При высушивании слоев среды важными являются следующие аспекты:
- степень влажности питательной среды является принципиальной, поскольку оптимальный рост бактерий зависит от количества влаги внутри или на среде. Значительная потеря влаги может привести, например, к увеличению концентрации ингибирующих веществ в селективной питательной среде и снижению активности воды на поверхности среды;
- при выращивании бактерий, которые не демонстрируют быстрый рост, и слои среды выглядят сухими после кондиционирования, ситуация такова, что высушивание не всегда является необходимым. В этом случае высушивание можно не проводить, поскольку это может только повысить вероятность загрязнения и приводит к ненужной потере влаги;
- температуру и время высушивания подбирают такими, чтобы вероятность загрязнения была минимальной и нагревание не повлияло бы негативно на качество питательной среды. Время высушивания зависит от степени присутствия конденсата в чашке Петри, и оно должно быть максимально коротким;
- во избежание загрязнения и когда слои среды высушивают не в ламинарном боксе, среду всегда высушивают таким образом, чтобы поверхность среды, инокуляция которой будет проводиться, была перевернута вниз.
На практике допускается высушивание слоя среды переворачиванием агаровой поверхности вниз, при этом крышка чашки Петри должна быть полуоткрыта; в боксе установлена температура от 25 до 50°С. Слои высушивают до тех пор, пока с поверхности крышек чашек Петри не исчезнут капли. При достижении этого высушивание прекращают. Слои агара допускается также высушивать, когда их поверхность направлена вверх, в безопасном ламинарном боксе (при комнатной температуре) в течение 30-60 мин, или выдерживать их в течение ночи при комнатной температуре с закрытыми крышками.
4.6 Инкубирование плотных сред в чашках Петри
В процессе инкубирования агаровые среды будут терять влагу. При определенных обстоятельствах это может повлиять на рост микроорганизмов. Факторами, влияющими на потерю влаги, являются состав среды, количество среды в чашке, тип термостата (например, термостат может быть оснащен устройством, обеспечивающим движение воздуха, или иными средствами), влажность атмосферы термостата, положение и количество чашек в термостате, температура инкубирования. Потерю влаги можно уменьшить путем размещения чашек в стопки, содержащие максимум шесть чашек, в пластиковые мешки с открытым верхом (во избежание избыточной конденсации). В качестве альтернативы влажность воздуха в термостате можно увеличить путем помещения открытой емкости с водой на дно прибора. Воду в емкости следует часто менять, а емкость подвергать дезинфекции, чтобы не допустить заражения грибками.
4.7 Утилизация сред
Использованные питательные среды необходимо утилизировать безопасным способом, в соответствии с нормативными документами, действующими на территории присоединившихся стран.
5 Тест-микроорганизмы для эксплуатационных испытаний
5.1 Общие положения
Новые или пересмотренные стандарты устанавливают эксплуатационные испытания питательных сред, в том числе технические условия на контрольные штаммы и критерии приемлемости, в соответствии с требованиями приложения J.
5.2 Выбор тест-микроорганизмов
Набор тест-микроорганизмов должен содержать микроорганизмы со стабильными характеристиками, которые являются представительными для данного вида и которые демонстрируют надежность оптимальных эксплуатационных характеристик конкретной приготовленной среды. Данные тест-микроорганизмы должны прежде всего содержать штаммы, которые легко доступны при их получении из эталонной коллекции культур. Вместе с тем допускается использовать штаммы, выделенные в лаборатории, если они демонстрируют требуемые характеристики. Предпочтительно следует использовать штаммы, выделенные из пищевых продуктов или воды, однако не для всех коллекций культур имеется соответствующая информация об источнике штамма.
Соответствующие характеристики контрольной исходной культуры исследуют и записывают в лаборатории. Если имеют место различия в характеристиках штаммов, исследуют возможные воздействия на питательную среду при получении одной и той же среды от различных производителей и приобретают дополнительную контрольную культуру из коллекции культур, в которой данная культура первоначально находилась.
ВАЖНОЕ ЗАМЕЧАНИЕ - Пользователи могут запрашивать информацию, касающуюся изменчивости штаммов и их эксплуатационных свойств, в ISO, ТК 34 "Пищевые продукты", ПК 9 "Микробиология", РГ 5 "Питательные среды" через секретариат ISO/TК 34/ПК 9.
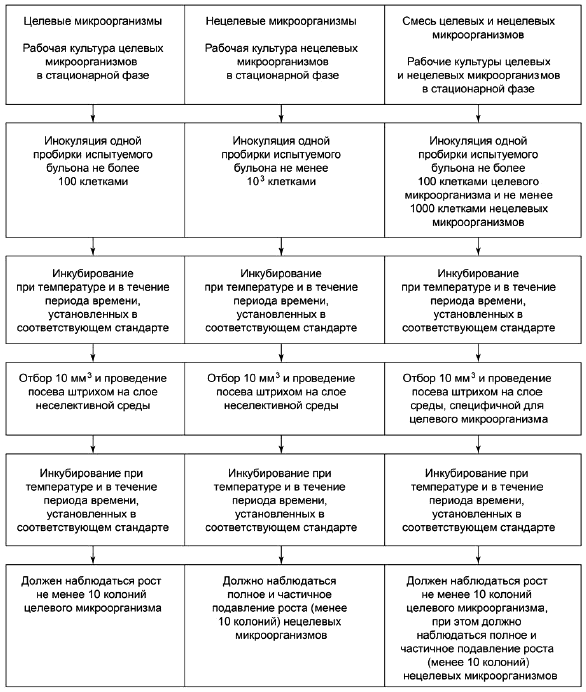
Тест-микроорганизмы, используемые для тестирования каждой среды, могут включать:
- жизнестойкие положительные штаммы с типичными характеристиками целевого микроорганизма;
- нежизнестойкие положительные штаммы;
- отрицательные штаммы, не проявляющие требуемых характеристик, присущих целевому микроорганизму (отрицательные характеристики);
- штаммы, частично или полностью ингибированные.
В приложении Е приведены тест-микроорганизмы, которые используют в конкретных международных стандартах на пищевую микробиологию. В приложении F приведены тест-микроорганизмы, которые используют в конкретных международных стандартах на микробиологию воды.
Примечание - Некоторые национальные ограничения и директивы требуют использования сероваров, отличных от приведенных в данных таблицах. При выборе сероваров Salmonella ссылаются на соответствующие требования национальных нормативных документов.
5.3 Консервация и поддержание жизнеспособности тест-микроорганизмов
5.3.1 Общие положения
Существует несколько методов, например лиофилизация, хранение на шариках при температуре минус 70°С или с использованием жидкого азота, для успешного сохранения и поддержания всех микроорганизмов, имеющих отношение к микробиологии пищевых продуктов и воды. Один и тот же метод может не подойти ко всем штаммам. Приводятся также дополнительные методы сохранения микроорганизмов в соответствии с требованиями [14], [15], [36], [37], [38].
Количество пересевов тест-микроорганизмов следует задокументировать, чтобы предотвратить избыточное субкультивирование, которое увеличивает риск фенотипических изменений. Одной операцией считается перенос материала жизнеспособной культуры в свежеприготовленную среду, при этом должен наблюдаться рост микроорганизмов. Любой способ субкультивирования рассматривают как форму переноса. Приводится дополнительная информация в соответствии с [27], [28], [35], [38].
В приложении В приведены блок-схемы (см. рисунки В.1 и В.2) и дополнительная информация, касающаяся сохранения и приготовления тест-микроорганизмов.
5.3.2 Тест-микроорганизмы из коммерческих источников
При получении тест-микроорганизмов из эталонных коллекций или у коммерческих поставщиков, имеющих сертификацию по [2] или иную необходимую сертификацию, когда микроорганизмы находятся в своем оригинальном контейнере, следуют указаниям изготовителя относительно их культивирования и использования.
Лаборатории необходимо удостовериться, является ли доставленный штамм контрольным штаммом или контрольной исходной культурой, и установить, какое количество пересевов материала штамма проводилось до его получения. Соответствующую информацию документируют.
Лаборатория устанавливает наличие требуемых характеристик.
5.3.3 Контрольные исходные культуры, приготовленные в лаборатории
Контрольные исходные культуры, которые приготавливают из контрольных штаммов (см. приложение В, рисунок В.1) для проведения эксплуатационных испытаний, поддерживают и используют таким образом, чтобы свести к минимуму возможность перекрестного заражения, а также изменения типичных характеристик. Контрольные исходные культуры хранят несколькими порциями, как правило, либо сильно замороженными (например, при температуре ниже минус 70°С), либо в лиофилизированном виде. При более высокой температуре возможны снижение жизнеспособности микроорганизмов и генетические изменения.
Характеристики роста культур должны быть подробно задокументированы для каждой партии среды, с указанием данных о микроорганизмах, используемых в качестве тест-микроорганизмов.
Контрольные исходные культуры не допускается использовать для приготовления контрольных штаммов.
5.3.4 Исходные культуры
Исходные культуры готовят из лиофилизированных или сильно замороженных контрольных исходных культур (см. приложение В, рисунок В.2). С порциями культуры обращаются таким образом, чтобы не допустить возможного перекрестного заражения контрольной исходной культуры и/или ее порчи. Исходные культуры готовят путем ресуспензирования порции контрольной исходной культуры в или на неселективной среде. Среду инкубируют до получения культуры в стационарной фазе.
Информация о хранении и документировании приведена в 5.3.3.
В случае коммерчески доступных систем сохранения строго следуют инструкциям изготовителя.
Исходные культуры не допускается использовать для приготовления контрольных штаммов или контрольных исходных культур.
5.3.5 Рабочие культуры
Рабочие культуры готовят из исходных культур или контрольных исходных культур и используют для приготовления инокулята для испытаний.
Рабочие культуры не допускается использовать для приготовления контрольных штаммов, контрольных исходных культур, исходных культур или для приготовления последующих рабочих культур.
5.4 Микроорганизмы для эксплуатационных испытаний
5.4.1 Общие положения
Соответствующие микроорганизмы для стандартных эксплуатационных испытаний приведены в приложениях Е и F.
Объемы инокулятов и количества микроорганизмов являются весьма важными параметрами (см. 5.4.2.4 и 5.4.2.5).
Нижеприведенные руководящие указания даны в качестве примера методик, используемых для получения стандартных объемов инокулята для контроля качества питательных сред. Данные методики применимы в общем случае, однако для приготовления некоторых микроорганизмов может потребоваться создание особых условий, например, для анаэробов, галофильных, осмофильных или ксерофильных микроорганизмов, а также для тех, у которых особые требования к росту и питанию.
5.4.2 Приготовление
5.4.2.1 Приготовление исходных культур
При необходимости инокулируют плотную среду (например, триптонный соевый агар или кровяной агар) контрольной исходной культурой таким образом, чтобы образовались отдельные колонии. Инкубируют в соответствующих условиях: например, большинство аэробных бактерий инкубируют в течение 18-24 ч при температуре 37°С.
Проверяют чистоту данной плотной исходной культуры и используют ее в течение установленного времени (например, в течение 14 дней при определенной температуре во избежание значительных изменений в микроорганизмах).
5.4.2.2 Приготовление рабочих культур
Рабочие культуры готовят из контрольных исходных культур (или при необходимости из исходных культур), используя чистую культуру в стационарной фазе в неселективном бульоне. Для большинства аэробных бактерий это достигается после инкубирования в течение 18-24 ч.
Допускается приготовление рабочей культуры из коммерчески доступного эталонного образца (сертифицированного или несертифицированного), либо ее готовят в лаборатории. Концентрация приготовленной суспензии должна быть стабильной и однородной в течение периода ее использования в соответствии с [7], [10], [11], [21], [29], [30].
Допускается применение различных методик для обеспечения чистоты инокулята, его стандартизации, что позволит использовать его на последующих стадиях.
В зависимости от размера колоний отбирают одну или две колонии от среды с исходной культурой при помощи петли. Во избежание забора слишком большого количества инокулята рекомендуется использовать петлю, позволяющую отбирать 1 мм материала.
Инокулят переносят в неселективную жидкую среду (например, в триптонный соевый бульон [TSB]) и тщательно перемешивают.
Инкубируют в подходящих условиях в течение необходимого времени (например, 18-24 ч при температуре 37°С в случае большинства аэробных бактерий).
Данную рабочую культуру используют в течение установленного времени (например, в течение максимум трех дней при соответствующей температуре, чтобы не допустить значительных изменений в структуре микроорганизмов).
Информация, касающаяся приготовления и хранения спор бактерий и грибков, используемых в качестве рабочих культур, приведена в [10], [11], [24], [25], [30].
5.4.2.3 Приготовление суспензий (инокулята) для испытаний
Серию разведений готовят в разбавителе (например, в растворе Ringer с концентрацией, сниженной в четыре раза, пептонном солевом растворе), при этом выбирают самый оптимальный шаг разведения для получения требуемого количества микроорганизмов (КОЕ) в установленном объеме.
Разведение, требуемое для использования в качестве инокулята в испытаниях, определяют на основе предыдущих испытаний, все стадии которых проводились в четко определенных стандартизованных условиях.
Суспензию (инокулят) используют в течение установленного времени (например, в течение 2 ч при комнатной температуре или в течение 24 ч при хранении при температуре (5±3)°С; допускаются более длительные периоды хранения, если была произведена проверка пригодности материала в соответствии с [10], [21]).
Допускается использование замороженного инокулята, если будет показано, что данный микроорганизм способен выживать при низких температурах в течение установленного периода.
5.4.2.4 Объем инокулята
Объем инокулята, используемый для проведения количественных эксплуатационных испытаний, должен соотноситься с объемом, используемым в условиях испытаний для соответствующих сред.
В случае разбавителей и жидких сред, используемых для количественных испытаний, объем инокулята должен быть пропорционален объемам, используемым при применении соответствующих стандартов, и составляет 10% от объема исследуемой среды.
5.4.2.5 Концентрация микроорганизмов в инокуляте
5.4.2.5.1 Концентрация микроорганизмов в инокуляте при испытаниях на производительность
5.4.2.5.1.1 Количественное испытание
В случае количественного испытания, когда проводят подсчет микроорганизмов, для достижения приемлемой точности требуется концентрация микроорганизмов приблизительно 10 КОЕ (см. таблицу 1). Для этого может потребоваться несколько чашек Петри.
Целесообразно применять диапазон от 80 до 120 КОЕ на чашку с минимальным количеством, равным 50 КОЕ на чашку. При использовании фильтров требуется то же самое количество КОЕ (используют один или несколько фильтров). В таблице 1 приведены значения 95-процентных доверительных интервалов, имеющих отношение к подсчету колоний.
В случае количественных испытаний разбавителей и жидких транспортных сред необходимая концентрация микроорганизмов в инокуляте должна быть от 10 до 10
КОЕ, чтобы концентрация, равная приблизительно 100 КОЕ, была в объеме, распределяемом по чашкам.
Таблица 1 - Пределы 95-процентных доверительных интервалов для количества колоний, подчиняющихся распределению Пуассона по [21], [26]
Количество подсчитанных колоний | Предельная точность (с точностью до процента) | Приблизительные пределы 95-процентных доверительных интервалов |
500 | ±9 | 455-545 |
400 | ±10 | 360-440 |
320 | ±11 | 284-356 |
200 | ±14 | 172-228 |
100 | ±20 | 80-120 |
80 | ±22 | 62-98 |
50 | ±28 | 36-64 |
30 | ±37 | 19-41 |
20 | ±47 | 11-29 |
16 | ±50 | 8-24 |
10 | ±60 | 4-16 |
6 | ±83 | 1-11 |
5.4.2.5.1.2 Качественные испытания
Объем, используемый для испытания, должен содержать:
- от 10 до 10
КОЕ для качественных испытаний сред, разлитых по чашкам;
- не менее 100 КОЕ для испытаний на производительность сред обогащения или предварительного обогащения;
- от 10 до 10
КОЕ для качественных испытаний плотных транспортных сред.
5.4.2.5.2 Концентрация микроорганизмов в инокуляте при испытаниях на селективность
При испытании на селективность питательной среды суспензию нецелевых микроорганизмов, содержащую от 10 до 10
КОЕ, инокулируют на слой среды в чашке или в пробирку со средой.
5.4.2.5.3 Концентрация микроорганизмов в инокуляте при испытаниях на специфичность
При количественном испытании на специфичность питательной среды в чашке используют инокулят с концентрацией микроорганизмов от 10 до 10
КОЕ.
5.4.2.6 Инкубирование
Питательную среду инкубируют в условиях, установленных в соответствующем стандарте. В приложении Е приведены условия инкубирования, используемые при применении конкретного международного стандарта на микробиологию пищевых продуктов, в приложении F приведены условия инкубирования, используемые при применении конкретного международного стандарта на микробиологию воды.
Информация, касающаяся предотвращения потерь влаги агаровой средой в процессе инкубирования, приведена в 4.6.
Минимальное допускаемое время инкубирования, установленное в настоящем стандарте, используют в отношении целевого(ых) микроорганизма(ов), в то время как максимальное допускаемое время инкубирования для определения селективности устанавливают в соответствующем стандарте.
6 Проведение эксплуатационных испытаний питательных сред
6.1 Общие положения
Нижеследующие подпункты содержат описание требований ко всем видам питательных сред. Они применимы независимо от размера партии.
В практических условиях пробы могут содержать микроорганизмы, подверженные стрессу. Следует принять во внимание, что пригодность среды в плане восстановления данных клеток микроорганизмов проводят в соответствии с [21], [31]-[33].
Качество питательной среды зависит от качества основных ингредиентов среды, правильности рецептуры, качества методики приготовления, степени отсутствия микробного заражения, а также от надлежащих условий упаковки и хранения.
Управление качеством питательной среды адаптируют к целям использования среды (для количественных либо качественных испытаний). Перед использованием эксплуатационные характеристики каждой партии питательной среды тестируют в соответствии с категориями сред, описанными в 6.4. Если перед использованием среды проведение испытания не представляется возможным по причине нестабильности среды или добавок, проводят параллельное эксплуатационное испытание наряду с испытанием пробы.
6.2 Определение физических и химических показателей
Готовая питательная среда должна иметь определенные физико-химические характеристики, как это установлено в соответствующих стандартах. Кроме того, оценка качества, проводимая визуально, должна гарантировать, что каждая питательная среда соответствует установленным рекомендациям, например, в том, что касается:
- объема наполнения и/или толщины;
- внешнего вида, цвета и однородности;
- гелеобразной консистенции;
- содержания влаги.
Кроме того, необходимо определить значение рН.
Отдельные ингредиенты и любые питательные или селективные добавки также должны подвергаться оценке их качества.
6.3 Определение микробиологических показателей
6.3.1 Общие положения
Микробиологические эксплуатационные испытания проводят на пробах, которые являются представительными для партии конечного продукта по [6], [8], [9], [21].
6.3.2 Контрольная среда
В целях обеспечения надежности результатов эксплуатационных испытаний используемая контрольная среда должна иметь стабильное высокое качество.
Пользователю необходимо выполнить следующие условия:
- использовать количественный стандартный образец (см. 3.4.6), содержащий четко установленное количество микроорганизмов, при определении качества контрольной среды;
- использовать установленный процесс приготовления, в том числе переплавку (при необходимости);
- контактировать с одним и тем же изготовителем (или другим источником), который осуществляет поставку сред или их ингредиентов;
- использовать широкий спектр тест-микроорганизмов в работе (включая выявляемые микроорганизмы);
- выбирать нужную контрольную среду для определения качества;
- проводить требуемые процедуры, гарантирующие обеспечение качества среды, используемой в качестве контрольной.
При оценке пригодности контрольной среды нет необходимости учитывать все вышеуказанные аспекты. Лаборатория должна обосновать выбор конкретной методики.
Подходящие тест-микроорганизмы, методы контроля и критерии приемлемости для контрольной среды триптонного соевого агара (TSA) приведены в приложениях Е и F. При выполнении вышеуказанных условий допускается использовать другие неселективные контрольные среды.
6.3.3 Микробное заражение
В зависимости от размера партии питательной среды испытывают требуемое количество среды на наличие или отсутствие микробного заражения (на стерильность), проводя инкубирование в определенных условиях.
Испытуемой пробой должна быть как минимум одна чашка Петри или пробирка, если партия небольшая (менее 100 шт.). В случае более крупных партий изготовители должны разработать спецификации, например на основе ингредиентов среды, параметров и пределов процессов и типа упаковки, используя соответствующие допустимые пределы качества. Дополнительная информация приведена в [6], конкретных национальных стандартах и других источниках по [9], [21].
Критерии приемлемости устанавливают и подтверждают для каждой среды.
6.4 Общие требования для микробиологических эксплуатационных испытаний
6.4.1 Общие положения
Для проведения оценки партии готовой питательной среды, питательных ингредиентов или добавок надлежащим образом оценивают параметры роста при помощи количественных или качественных методов, как это установлено в настоящем стандарте.
Плотные, полужидкие и жидкие среды инокулируют подходящим объемом (см. 5.4.2.4) рабочей культуры, содержащей определенный тест-микроорганизм, используя подходящее устройство; действуют в соответствии с методикой инокуляции, установленной в соответствующих стандартах (см. приложения Е и F).
В настоящем стандарте приведены примеры количественных и качественных методов испытаний плотных и жидких питательных сред. Допускается выбор любого из приведенных методов, однако нет необходимости использовать все методы.
В случае, когда питательную среду предстоит использовать для целей подсчета, испытания проводят количественными методами.
При оценке новой среды или среды, поставляемой новым изготовителем, рекомендуется проводить количественные методы испытаний для получения дополнительной информации, чтобы обнаружить возможные изменения свойств среды.
В случае жидких сред взаимодействия, приводящие к успешному росту микроорганизмов, являются более сложными и, таким образом, выбор методов эксплуатационных испытаний будет менее очевиден, чем для плотных сред.
Информация о комбинации испытаний плотных сред с мембранными фильтрами приведена в ISO 7704.
Предполагается, что пользователь ознакомлен с основами микробиологических методов и соответствующие методы максимально не детализированы.
Соответствующие тест-микроорганизмы, методы контроля и критерии приемлемости приведены в приложениях Е и F.
Частоту проведения испытаний устанавливает конечный пользователь, принимая во внимание масштабы приготовлений в лаборатории, а также уровень обеспечения качества в лаборатории.
6.4.2 Среды, готовые к использованию
Изготовители коммерчески доступных сред, готовых к использованию, особенно тех, которые соответствуют ISO 9001, должны иметь действующую программу качества и могут выпускать сертификат качества, поставляемый вместе со средой. В этом случае пользователю может не потребоваться проведение всесторонних испытаний данных сред, однако необходимо гарантировать, что условия хранения соблюдаются такими, какие были рекомендованы изготовителем.
В отношении готовых к применению сред, в которые внесены добавки и которые проходят контроль со стороны изготовителя в соответствии с настоящим стандартом, рекомендуется провести как минимум качественные испытания.
Пользователь должен быть уверен, что изготовители коммерчески доступных сред, готовых к использованию, имеют действующую программу качества для данного вида продукции и выпускают сертификаты управления качеством, соответствующие требованиям настоящего стандарта, в которых приведены ожидаемые и полученные результаты. Лаборатория пользователя также проверяет документированные данные, гарантирующие, что критерии приемлемости изготовителя, касающиеся эксплуатационных испытаний, соответствуют внутренним требованиям лаборатории.
Чтобы удостовериться, что качество сред сохраняется в процессе их транспортирования, проводят периодические проверки.
Также проводят проверки сред после их хранения и дальнейших операций со средами в лаборатории пользователя (например, плотные среды расплавляют). Частота данных проверок должна быть обоснована.
В случае не полностью готовых сред, добавки к которым вносят в лаборатории пользователя (см. 3.3.5.1), необходимо проведение дополнительной проверки - либо проверяют результаты производительности, либо проводят качественное испытание, чтобы убедиться, что была внесена подходящая добавка.
6.4.3 Среды, приготовленные из коммерчески доступных обезвоженных рецептур
Для сред, используемых для подсчета, проводят количественное испытание. Для других типов сред часто бывает достаточным качественное испытание. Количественные испытания обеспечивают большую степень гарантии качества среды.
Для сред, которые не приводятся в приложениях Е и F, процедуры контроля качества должны быть установлены в соответствии с нижеприведенными рекомендациями.
В отношении сред, которые не содержат индикаторов или селективных агентов, допускается использовать ограниченное количество штаммов. Если среды содержат индикаторы или селективные агенты, следует использовать штаммы, демонстрирующие функции индикаторов и селективность. Для сложных сред, т.е. содержащих добавки, каждую партию среды проверяют с использованием штаммов с характеристиками, приведенными в 5.2.
6.4.4 Среды, приготовленные из базовых индивидуальных ингредиентов
В дополнение к требованиям, изложенным в 6.4.3, количественные испытания проводят с целью мониторинга трендов состояния качества базовых материалов, производительности среды и при ведении внутренних протоколов лаборатории.
6.5 Оценка эксплуатационных характеристик и интерпретация результатов
Партия питательной среды демонстрирует удовлетворительные эксплуатационные характеристики, если все используемые тест-микроорганизмы проявляют свои свойства в соответствии с установленными спецификациями. Партия считается приемлемой, если основные и микробиологические критерии качества соблюдены.
Если удовлетворительные эксплуатационные характеристики не достигнуты, см. приложение Н, где приведены возможные причины данного несоответствия.
6.6 Среды и реактивы для подтверждения
6.6.1 Среды для подтверждения
Эксплуатационные характеристики питательных сред, используемых для тестов на подтверждение, должны проверяться до их использования. Соответствующие положительные и отрицательные тест-микроорганизмы необходимо использовать для проверки таким образом, как это описано в конкретном стандарте (см. [9], [16]).
6.6.2 Реактивы для подтверждения
Перед использованием среды выполняют проверку на функциональность с использованием растворов для окраски по Граму, реактивов Ковача, VP, нитрита, оксидазы, каталазы и других реактивов, применяемых для демонстрации биохимических характеристик. Соответствующие положительные и отрицательные штаммы необходимо использовать для проверки, следует установить срок хранения. Для проведения тестов на подтверждение рекомендуется использовать реактивы аналитической степени чистоты. При использовании реактивов из коммерческих источников следуют инструкциям изготовителя в том, что касается хранения и использования реактивов (см. [18], [19]).
7 Методы эксплуатационных испытаний плотных питательных сред
7.1 Общие положения
Настоящий раздел содержит описание количественных и качественных эксплуатационных испытаний плотных питательных сред, приведенных в стандартах на пищевые продукты и воду. Данные методы являются основными и пригодными для большинства питательных сред. Методы могут быть непригодными для испытаний некоторых видов сред, используемых для роста плесеней. В приложении С приведены итоговые блок-схемы каждого метода.
7.2 Методы количественных испытаний
7.2.1 Методы количественных испытаний - определения
7.2.1.1 Производительность
Производительность должна достигать определенного минимального предела (см. соответствующий конкретный международный стандарт или приложения Е и F).
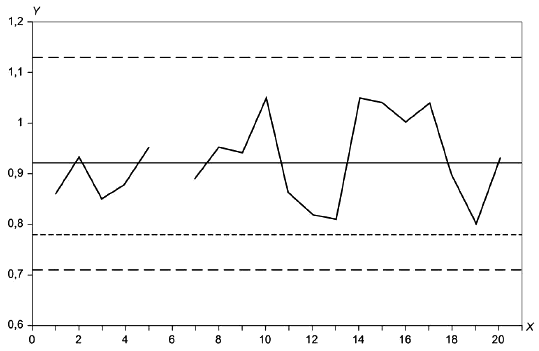
См. приложение G для использования контрольных графиков при мониторинге эксплуатационных характеристик плотных питательных сред согласно методике, приведенной ниже.
Для количественных методов коэффициент производительности P (см. [21]) вычисляют по формуле:
![]() , (1)
, (1)
где N - общее количество колоний, полученных в или на питательной среде, подвергнутой испытанию, например, количество колоний в чашках;
N - общее количество колоний, полученных в или на определенной контрольной питательной среде, в одной или нескольких чашках; оно должно быть приблизительно 100 КОЕ (см. 5.4.2.5.1).
Интерпретация результатов приведена в 7.2.2.1.2.
7.2.1.2 Селективность
Селективные питательные среды и неселективную контрольную среду инокулируют различными разведениями нецелевого(ых) микроорганизма(ов).
Коэффициент селективности S (см. [22]) вычисляют по формуле:
![]() , (2)
, (2)
где D - максимальное разведение, демонстрирующее рост на неселективной контрольной среде;
D - максимальное разведение, демонстрирующее сопоставимый рост на селективной испытуемой среде;
S, D
и D
выражены в единицах log
.
Примечание - Например, если D равно 10
(=log
4,0) и D
равно 10
(=log
3,0), то коэффициент селективности S
=1,0.
Интерпретация результатов приведена в 7.2.2.1.2.
7.2.2 Количественный метод для плотных питательных сред
7.2.2.1 Общие положения
Данный протокол требует использования бактериальной суспензии с возможностью подсчета бактерий (которая может являться количественным стандартным образцом или испытуемой суспензией), имеющей требуемую концентрацию микроорганизмов целевого штамма. Выход микроорганизмов от новой партии питательной среды сравнивают с выходом микроорганизмов в неселективной питательной среде (контрольной среде) или в особых случаях от предварительно принятой партии среды того же состава.
7.2.2.1.1 Методика
a) используют рабочие культуры и инокуляты известной требуемой концентрации целевого штамма, а также при необходимости нецелевого штамма, как это описано в 5.3.2, или подходящий стандартный образец;
b) для одного микроорганизма используют одну или несколько чашек. Их количество зависит от размера партии, достоверности методики установления гарантии качества, надежности и количества микроорганизмов в испытуемой суспензии. Оператор в лаборатории должен привести обоснование выбранного количества чашек;
c) следует убедиться, что поверхность слоев среды должным образом высушена (см. 4.5.5);
d) проводят инокуляцию путем распределения инокулята по поверхности среды или методом мембранной фильтрации, чтобы получить количество, которое попадает в диапазон с рекомендуемыми пределами, приведенными в 5.4.2.5.1, для количественного испытания.
Для получения в чашках колоний, подлежащих подсчету, допускается также использовать модифицированный поверхностный капельный метод Miles-Misra, другие системы добавления по каплям или спиральный дозатор.
- Метод поверхностного посева в чашках используют для питательных сред, обычно используемых для подсчета таким образом.
- Контрольную среду или чашки со средой предварительно принятой партии инокулируют аналогичным образом.
- Чашки инкубируют в условиях, установленных в конкретных стандартах.
- Проводят подсчет колоний, присутствующих в каждой чашке. Оценивают размер и внешний вид колоний, выросших в или на среде в условиях испытаний при сравнении с ростом на неселективной питательной среде (контрольной среде) или на предварительно принятой партии среды того же состава.
7.2.2.1.2 Вычисления и интерпретация результатов
В случае количественного испытания с подсчетом для достижения приемлемой точности (см. таблицу 1) необходим уровень приблизительно 100 КОЕ. Это может потребовать использования более одной чашки Петри.
Результаты считают действительными при выполнении следующих условий:
- для каждой чашки должен быть получен положительный количественный результат (целевой бактериальный рост);
- каждый отдельный заявленный результат попадает в стандартный диапазон анализа (не более 100 колоний для методов с фильтрацией и не более 150 колоний для поверхностных методов).
С целью интерпретации результатов вычисляют коэффициент производительности P (см. 7.2.1.1) и при необходимости коэффициент селективности S
(см. 7.2.1.2).
a) P должен быть не менее 0,50 при сравнении селективной среды с неселективной контрольной средой, приведенной в приложениях Е и F. P
должен быть не менее 0,70 при сравнении неселективной среды с неселективной контрольной средой или как это установлено в стандарте или приложениях Е и F. Это также имеет место в особых случаях, когда сравнение проводят с предыдущей партией.
b) Если P превышает 1,4, устанавливают причину этого.
c) S для нецелевых микроорганизмов должен быть не менее 2.
В особых случаях см. приложения Е, F и J. Данные критерии могут быть неприменимы к средам, которые не указаны в приложениях Е и F, например, к тем, которые описаны в региональных стандартах.
7.2.2.2 Использование стандартных образцов при проверке роста микроорганизмов
Применяют стандартные образцы (RM), сертифицированные стандартные образцы или стандартные образцы, произведенные в лаборатории, для получения стабильной бактериальной суспензии, содержащей известное количество колониеобразующих единиц целевых или нецелевых штаммов. Количество микроорганизмов, выросших на новой партии питательной среды, сравнивают с ожидаемым количеством КОЕ в стандартном образце, сертифицированном стандартном образце или стандартном образце, произведенным в лаборатории.
Для расчета допускаемых пределов можно использовать критическую разность (см. [34]). См. таблицу 1.
Информация о приготовлении и оценке внутренних стандартных образцов приведена в [21] и [29].
Качество стандартных образцов проверяют с использованием контрольной среды.
7.3 Испытания питательных сред, используемых для мембранной фильтрации
Проводят предварительную оценку качества используемых мембранных фильтров в соответствии с ISO 7704, чтобы установить их пригодность для использования.
При тестировании эксплуатационных характеристик питательных сред применительно к мембранной фильтрации используют рабочие культуры и инокуляты, как это описано в 5.4.2. Инокулируют среду-суспензию, в том числе жидкость-разбавитель, стерильную воду инокулятом с требуемой концентрацией микроорганизмов, приведенной в 5.4.2.5.
Жидкость фильтруют в соответствии с требованиями конкретного стандарта. Мембрану помещают на поверхность агара, который испытывают. Инокулируют достаточное количество мембран/слоев с целью получения в сумме приблизительно 100 КОЕ для испытаний на производительность. Процедуру повторяют с использованием новой мембраны и помещают вторую мембрану на поверхность контрольной среды, используя разведения, если они требуются для испытаний на селективность. Посевы инкубируют в соответствии с конкретным стандартом.
Данную процедуру повторяют каждый раз, когда меняют партию мембран или используют новую партию среды.
При необходимости с целью оценки влияния мембраны на результаты тестовый инокулят также распределяют по испытуемой среде и контрольной среде в отсутствие мембран.
7.4 Методы количественных испытаний*
________________
* Письмом Росстандарта от 27.10.2017 г. N 1715-ОГ/03 разъясняется, что "В наименовании пункта 7.4 ГОСТ ISO 11133-2016 допущена опечатка". Наименование пункта 7.4 следует читать: Методы качественного анализа. - .
7.4.1 Количественный метод посева штрихом
7.4.1.1 Методика
Рабочие культуры и инокуляты используют согласно 5.4.2.
При определении производительности и специфичности используют слой испытуемой среды и проводят штриховой посев каждого тест-микроорганизма таким образом, чтобы получить отдельные колонии.
При определении селективности используют один слой испытуемой среды и проводят штриховой посев каждого тест-микроорганизма, прочерчивая единичную прямую линию при помощи петли, позволяющей отбирать 1 мм материала, на поверхности испытуемой среды. Для некоторых тест-микроорганизмов допускается проводить штриховой посев на том же слое среды в виде параллельных линий, избегая пересечений. Линии должны быть различимы, чтобы позволить наблюдение типичной морфологии. Допускается применять и другие стандартизованные методы штрихового посева.
Чашки инкубируют в условиях, установленных в конкретном стандарте.
7.4.1.2 Интерпретация результатов
Интенсивность роста на слое после инкубации оценивают следующим образом:
- 0 соответствует нулевому росту;
- 1 соответствует слабому росту (либо сокращению роста или размеров колоний);
- 2 соответствует выраженному росту.
Целевые микроорганизмы должны соответствовать уровню 2 и иметь характерный внешний вид, размеры и морфологию колоний. В испытании на селективность степень ингибирования зависит от типа среды. Рост нецелевых микроорганизмов должен быть частично или полностью подавлен.
7.4.2 Определение специфичности
Определение термина "специфичность" приведено в 3.2.6. Специфичность питательной среды - возможность при определенных условиях выявить существенные видимые физиологические характеристики, позволяющие отличить данные микроорганизмы по размеру и морфологии колоний, а также выявить их присутствие, отсутствие и/или степень выраженности биохимических реакций. Требования к рабочим культурам и инокулятам приведены в 5.4.2.
7.4.3 Другие количественные методы для плотных сред
Допускается использовать другие количественные методы (см. [9], [21]).
8 Методы эксплуатационных испытаний жидких питательных сред
8.1 Общие положения
Настоящий раздел описывает количественные и качественные методы эксплуатационных испытаний жидких питательных сред. Блок-схема каждого метода приведена в приложении С.
8.2 Количественный метод эксплуатационных испытаний жидких питательных сред с использованием пробирок (метод разведения до нулевого уровня)
8.2.1 Общие положения
Настоящий метод является основным методом, который допускается использовать для неселективной или селективной жидкой среды. Он также пригоден для проведения эксплуатационных испытаний жидких сред, используемых для подсчета, например, в методах наиболее вероятного числа.
8.2.2 Приготовление серии разведений
- Выбирают репрезентативное количество пробирок (см. 6.3.1).
- Готовят подходящую серию разведений из рабочей культуры целевых или нецелевых микроорганизмов в подходящем разбавителе, как это описано в ISO 6887-1 и ISO 8199, так, чтобы в наибольшем разведении (нулевой уровень) микроорганизмы отсутствовали (например, от 10 до 10
). Наиболее часто используют серию десятичных разведений, тем не менее серии разведений с шагом 1/5 или 1/2 также являются пригодными.
- Серию разведений используют в течение установленного времени (см. 5.4.2.3).
- В течение времени выполнения работы переносят заданный объем (например, 0,1 см каждого разведения) на поверхность неселективной агаровой среды и распределяют по поверхности.
- Инкубируют в заданных условиях с целью обеспечения роста конкретного микроорганизма.
- Проводят подсчет количества колоний на поверхности агаровой среды для наименьшего разведения, содержащей не более 150 колоний, а также количество колоний для последующих разведений; результаты записывают.
8.2.3 Методика испытания жидкой среды
- Отбирают количество пробирок с испытуемой средой, соответствующее количеству пробирок серии разведений.
- Используя разведения, приготовленные по 8.2.2 и начиная с наибольшего разведения, инокулируют заданный объем суспензии тест-микроорганизма (например, 0,1 см) в соответствующую пробирку со средой.
- Пробирки инкубируют в условиях, установленных в соответствующем стандарте (см. 5.4.2.6).
- После инкубирования при помощи петли, удерживающей объем материала 10 мм, пересевают материал каждой пробирки с инкубированной средой (при этом каждый раз используют новую петлю) на неселективную агаровую среду.
- Инокулированные слои инкубируют в условиях, обеспечивающих эффективный рост микроорганизмов.
- После инкубирования исследуют каждый посев на наличие или отсутствие роста.
Примечание - Для целевых микроорганизмов, как правило, достаточно использовать разведения от 10 до 10
. Для нецелевых микроорганизмов, как правило, достаточными являются разведения от 10
до 10
.
8.2.4 Вычисления и интерпретация результатов
Производительность жидкой обогатительной среды является удовлетворительной, если наблюдается выраженный рост целевого микроорганизма (не менее 10 КОЕ из 10 мм материала петли) из разведений, которые позволяют получить менее 100 КОЕ при посеве 100 мм
на поверхность среды.
Для селективных жидких сред определяют коэффициент селективности S на основе наибольшего разведения рабочей культуры, демонстрирующего выраженный рост (не менее 10 КОЕ) на слое агара, и наибольшего разведения инокулированной селективной жидкой среды, демонстрирующей отсутствие роста (или рост менее 10 КОЕ) нецелевого микроорганизма на неселективном агаровом слое. Значение S
должно быть не менее 2.
Примечание - Дополнительные методы количественного испытания жидких сред применительно к оценке разрабатываемых сред или в сравнительных исследованиях приведены в приложении I.
8.3 Качественный метод эксплуатационных испытаний жидких селективных питательных сред с использованием пробирок
8.3.1 Общие положения
В данном методе используют целевые, нецелевые либо смесь целевых и нецелевых микроорганизмов в одной пробирке.
8.3.2 Методика
- Отбирают количество пробирок, каждая из которых содержит 10 см среды или 10 см
порции из каждой партии для испытаний (см. 3.1.2 и 6.3.1). Действуют в соответствии с процедурой, описанной ниже, в соответствии с требованиями, установленными в приложениях Е и F.
- Приготовление инокулятов см. 5.4.2.3.
- Инокуляция целевым микроорганизмом: инокулируют одну пробирку испытуемого бульона инокулятом, содержащим 100 КОЕ целевого микроорганизма, и перемешивают.
- Инокуляция нецелевым микроорганизмом: инокулируют одну пробирку испытуемого бульона одним микроорганизмом при помощи инокулята с высокой концентрацией микроорганизма (>1000 КОЕ) и перемешивают.
- Инокуляция целевым и нецелевым микроорганизмами в одной пробирке, когда это требуется в соответствии с приложениями Е и F или когда проводят оценку новой среды или нового изготовителя: инокулируют одну пробирку испытуемого бульона целевым микроорганизмом в количестве 100 клеток и большим количеством нецелевых микроорганизмов (
1000 клеток на каждую пробирку) и перемешивают.
- Пробирки инкубируют в условиях, установленных в конкретных стандартах (см. 5.4.2.6).
- Отбирают петлей материал (приблизительно 10 мм) из пробирки, содержащей целевой микроорганизм, и проводят посев штрихом на слое неселективной среды (например, TSA).
- При использовании смешанной культуры целевого и нецелевых микроорганизмов отбирают петлей материал (приблизительно 10 мм) и проводят посев штрихом на слое среды, специфичной для целевого микроорганизма.
- Отбирают петлей материал (приблизительно 10 мм) культуры нецелевого микроорганизма и проводят посев штрихом на поверхность селективной среды (например, XLD).
- Посевы инкубируют в условиях, установленных в конкретных международных стандартах.
При использовании больших объемов среды пользователь может принять решение о пропорциональном увеличении размера инокулята с тем, чтобы были получены эквивалентные результаты.
8.3.3 Вычисления и интерпретация результатов
Производительность испытуемого жидкого бульона является удовлетворительной, если наблюдается выраженный рост (не менее 10 КОЕ или линия сплошного роста) целевого микроорганизма на среде, специфичной для данного микроорганизма.
Селективность испытуемого жидкого бульона является удовлетворительной, если наблюдается отсутствие роста (или менее 10 КОЕ) нецелевых микроорганизмов на поверхности неселективной агаровой среды.
8.4 Качественный метод эксплуатационных испытаний жидких сред с использованием одной пробирки (определение мутности)
8.4.1 Общие положения
Настоящий метод пригоден для эксплуатационных испытаний неселективных жидких питательных сред и селективных сред, используемых для испытаний с подтверждением (например, бульона с бриллиантовым зеленым, желчью и лактозой [BGBLB], см. [41]). Метод является чисто качественным, и подсчитанные баллы являются только ориентировочными. По сути, мутные среды могут тестироваться данным методом, если только с них пересевают на плотную среду с тем, чтобы продемонстрировать наличие роста.
Для прозрачных сред использована следующая градация:
- 0 соответствует отсутствию мутности;
- 1 соответствует незначительной мутности;
- 2 соответствует выраженной мутности.
8.4.2 Методика
8.4.2.1 Среда предварительного обогащения
- Отбирают количество пробирок, каждая из которых содержит 10 см среды или 10 см
порции каждой испытуемой партии (см. 3.1.2 и 6.3.1).
- При эксплуатационных испытаниях среды предварительного обогащения, например буферной пептонной воды (BPW), инокулируют среду подходящим объемом инокулята (см. конкретный стандарт), содержащим 100 КОЕ, добавляя инокулят непосредственно в испытуемую среду.
- Приготовление инокулятов см. 5.4.2.3.
- Пробирку инкубируют в условиях, установленных в конкретном стандарте (см. 5.4.2.6).
- Исследуют среду на наличие роста микроорганизмов.
8.4.2.2 Подтверждающая среда
- При эксплуатационных испытаниях жидкой подтверждающей среды испытуемую среду инокулируют суспензией рабочей культуры (содержащей >10 КОЕ/см
) при помощи петли, позволяющей отбирать 1 мм
материала.
- Пробирку инкубируют в условиях, установленных в конкретных стандартах (см. 5.4.2.6).
- Если неинокулированная среда изначально мутная, проводят пересев на плотную среду, инкубируют слои в условиях, установленных в конкретных стандартах, и исследуют среду на наличие роста.
8.4.3 Интерпретация результатов
- Качественную оценку проводят визуально, наблюдая выраженную мутность (т.е. на уровне 2), что соответствует выраженному росту (см. 8.4.1). Качественную оценку непрозрачных сред при приготовлении проводят, наблюдая рост на плотной среде.
Примечания
1 В некоторых случаях рост микроорганизмов можно наблюдать только как агрегацию клеток или образование осадка из клеток на дне пробирки или бутылки. В данном случае улучшить оценку и интерпретацию может тщательное встряхивание.
2 При помощи данного метода можно также определять другие характеристики, такие как газообразование или изменение цвета.
9 Методы эксплуатационных испытаний разбавителей и транспортных сред
9.1 Общие положения
Микробиологические эксплуатационные испытания проводят на пробе, которая является репрезентативной для партии конечного продукта (см. 6.3.1).
9.2 Метод испытаний разбавителей
9.2.1 Метод количественного испытания разбавителей
9.2.1.1 Общие положения
Данный метод определяет способность разбавителя обеспечивать выживаемость микроорганизмов при отсутствии нежелательного размножения или сокращения их количества в течение периода контакта с разбавителем до посева на агар или инокуляции в жидкую среду.
9.2.1.2 Методика
Инокулируют испытуемую порцию (например, 9 см) разбавителя 1 см
суспензии тест-микроорганизма, содержащей приблизительно 10
КОЕ/см
, и перемешивают (информация, касающаяся приготовления инокулята, приведена в 5.4.2). Незамедлительно отбирают 0,1 см
инокулированного разбавителя и распределяют по поверхности неселективного агара (контрольная среда), например, cpeды TSA (t
).
Выдерживают инокулированный разбавитель при комнатной температуре в течение периода времени, установленного в соответствующей части ISO 6887 (все части) или ISO 8199, который длится с момента окончания приготовления исходной суспензии и до момента, когда инокулят начинает контактировать с питательной средой (как правило, 45 минут). Перемешивают, отбирают тот же самый объем (0,1 см) и повторно проводят посев на контрольной среде (t
).
Контрольную среду инкубируют при заданной температуре и в течение определенного периода времени (например, при температуре 30°С в течение 72 ч).
9.2.1.3 Считывание и интерпретация результатов
После инкубирования подсчитывают колонии в чашках t и t
.
Количество микроорганизмов, t, после инкубирования разбавителя должно быть в пределах ±30% от первоначального количества (t
).
9.3 Метод испытания транспортных сред
9.3.1 Общие положения
Настоящий метод устанавливает способность транспортной среды обеспечивать выживаемость инокулированных микроорганизмов в течение периода транспортирования при отсутствии нежелательного размножения или сокращения их количества.
Если транспортные системы оснащены устройством отбора проб, его используют для инокуляции транспортной среды. В иных случаях инокуляцию проводят в условиях, которые имеют место на практике.
Инокулированную транспортную среду инкубируют при заданной температуре и в течение определенного периода времени, как это принято на практике или установлено в конкретном стандарте [12], [13].
Пример - Транспортные системы для транспортирования проб в условиях пониженной температуры тестируют при температуре (5±3)°С, когда период транспортирования стандартный (например, составляет 24 ч до проведения повторного посева).
9.3.2 Метод количественных испытаний жидких транспортных сред
9.3.2.1 Методика
Порцию пробы (например, объемом 10 см) жидкой транспортной среды инокулируют подходящим тест-микроорганизмом, для которого используется среда. Количество микроорганизмов для каждой пробирки на 10 см
должно составлять от 10
до 10
клеток; инокулят готовят по 5.4.2. Незамедлительно отбирают 0,1 см
инокулированной среды и распределяют ее по поверхности неселективной агаровой среды (контрольной среды), например, TSA (t
).
При инокуляции транспортной системы устройством для отбора проб устройство помещают в подходящий объем (например, для тампонов - 0,1 см) разведения рабочей культуры (содержащей от 10
до 10
клеток) приблизительно на 10 с и затем инокулируют транспортную среду устройством для отбора проб. Незамедлительно отбирают 0,1 см
инокулированной жидкой транспортной среды и распределяют ее по поверхности неселективной агаровой среды (контрольной среды), например, TSA (t
).
Инокулированные транспортную и контрольную среды инкубируют при заданной температуре и в течение определенного периода времени, как это принято на практике или установлено в конкретном стандарте: например, транспортную среду - при температуре 25°С в течение 5 сут, контрольную среду - при температуре 30°С в течение 3 сут. После этого повторно проводят посев на контрольной среде (t).
9.3.2.2 Считывание и интерпретация результатов
После инкубирования подсчитывают колонии в чашках t и t
.
Количество микроорганизмов, t, после инкубирования транспортной среды должно быть в пределах ±30% от первоначального количества (t
).
9.3.3 Метод количественных испытаний плотных транспортных сред
9.3.3.1 Методика
Инокулируют порцию пробы плотной транспортной среды подходящим тест-микроорганизмом, для которого используется среда. Количество микроорганизмов в инокуляте должно составлять от 10 до 10
клеток; инокулят готовят по 5.4.2.
При инокуляции транспортной системы устройством для отбора проб устройство помещают в подходящий объем (например, для тампонов - 100 мм) разведения рабочей культуры (содержащей от 10
до 10
клеток) приблизительно на 10 с и затем инокулируют транспортную среду устройством для отбора проб.
Инокулированную транспортную среду инкубируют при заданной температуре и в течение определенного периода времени, как это принято на практике или установлено в конкретном стандарте. Пересевают на неселективную агаровую среду (контрольную среду), например TSA, и инкубируют, как это принято на практике или установлено в конкретном стандарте.
9.3.3.2 Считывание и интерпретация результатов
После инкубирования исследуют неселективную агаровую среду на наличие роста микроорганизмов.
После инкубирования должен наблюдаться заметный рост.
10 Документирование результатов испытаний
10.1 Информация, предоставляемая изготовителем
Изготовитель или поставщик питательных сред по требованию должен предоставить конкретные характеристики роста микроорганизмов, а также основную информацию, касающуюся конкретной партии питательной среды.
10.2 Прослеживаемость
Все данные по повседневным эксплуатационным испытаниям должны быть задокументированы надлежащим образом и храниться в течение необходимого периода времени в соответствии с используемой системой качества. Для документирования и оценки результатов испытаний рекомендуется использование контрольных диаграмм (см. приложение D).
Приложение А
(справочное)
Обозначение ингредиентов питательных сред в международных стандартах на микробиологический анализ пищевых продуктов, кормов для животных и воды
А.1 Общие положения
С целью гармонизации описания различных ингредиентов питательных сред в микробиологических методах, изложенных в международных стандартах, ISO/TК 34/ПК 9 одобрил использование нижеприведенных обозначений.
А.2 Пептоны
- Ферментативный перевар казеина.
Примечание - Данный препарат содержит панкреатический или пептический перевар казеина, триптический перевар казеина и триптон;
- ферментативный перевар сои или соевого шрота;
- ферментативный перевар животных тканей.
Примечание - Данный препарат содержит мясной пептон, пептический перевар мяса, панкреатический перевар мяса;
- ферментативный перевар сердца;
- ферментативный перевар желатина;
- ферментативный перевар животных и растительных тканей.
Примечание - Данный препарат содержит триптозу;
- кислотный гидролизат казеина.
А.3 Экстракты и настойки
- Мясной экстракт и мясная настойка;
- сердечно-мозговой экстракт и сердечно-мозговая настойка;
- дрожжевой экстракт.
А.4 Агар
Бактериологический агар.
А.5 Другие препараты
- Эмульсия яичного желтка;
- сухое обезжиренное молоко;
- цельная, дефибринированная или лизированная кровь, кровяная мука, плазма, фибриноген, гемин определенных видов животных;
- бычья желчь для бактериологических целей;
- желчные соли.
Примечание - В том числе желчные соли N 3.
Приложение В
(обязательное)
Приготовление контрольных (эталонных) исходных культур и рабочих культур
В.1 Приготовление контрольной (эталонной) исходной культуры из контрольного (эталонного) штамма
Рисунок В.1 - Блок-схема приготовления контрольной (эталонной) исходной культуры из контрольного (эталонного) штамма
________________
Как правило, повторное суспензирование в питательном бульоне и время контактирования для оживления.
Проверка морфологии колоний и окраски по Граму или идентификация с использованием биохимических тестов.
Например, криозащитная среда, такая как TSB с добавкой от 10 до 15% (по объему) глицерина.
Криопробирки могут содержать шарики.
Замораживание при температуре ниже минус 70°С позволяет хранить длительное время. Срок хранения при более высоких температурах ограничен [36].
Может также использоваться как рабочая культура.
В.2 Приготовление рабочей культуры из контрольной (эталонной) исходной культуры
Рисунок В.2 - Блок-схема приготовления рабочей культуры из контрольной (эталонной) исходной культуры
________________
Проверяют и архивируют документы, в том числе проверяют прослеживаемость по контрольному штамму и иные соответствующие характеристики в случае, если контрольная исходная культура получена из стороннего источника.
Данная процедура предпочтительнее.
Данная процедура может быть необходима для некоторых штаммов, например, для количественных испытаний. Документируют все стадии.
Например, инокулируют пробирку со средой TSA, TSA с овечьей кровью или другой подходящей средой, инкубируют в течение 24 ч и хранят при подходящей температуре (от 18 до 25°С или от 2 до 8°С в зависимости от вида микроорганизмов) в течение четырех недель [36].
Например, криозащитная среда, такая как TSB с добавкой от 10 до 15% (по объему) глицерина. Замораживание при температуре ниже минус 70°С позволяет хранить длительное время. Срок хранения при более высоких температурах ограничен [36].
Приложение С
(обязательное)
Блок-схемы методов эксплуатационных испытаний
С.1 Общие положения
См. раздел 7.
С.2 Количественный метод для плотных питательных сред: производительность и селективность (см. 7.2.2 и рисунок С.1)
Обозначения:
P - коэффициент производительности;
S - коэффициент селективности.
Коэффициент производительности P можно использовать при сравнении:
а) неселективной среды с неселективной контрольной средой;
b) селективной среды с неселективной контрольной средой;
c) селективной среды с селективной контрольной средой.
Примечание - Информация, касающаяся инкубирования (см. третью ячейку данной блок-схемы), приведена в 5.4.2.6.
Рисунок С.1 - Блок-схема количественных испытаний плотных питательных сред
С.3 Количественный метод эксплуатационных испытаний жидких обогатительных сред с использованием пробирок. Метод разведения до нулевого уровня (см. 8.2 и рисунок С.2)
Примечание - Информация, касающаяся инкубирования (см. пятую ячейку данной блок-схемы), приведена в 5.4.2.6.
Рисунок С.2 - Блок-схема проведения эксплуатационных испытаний жидких обогатительных сред (с разведением до нулевого уровня)
С.4 Качественный метод для жидких селективных обогатительных сред с использованием одной пробирки (используют целевые, нецелевые или смесь целевых и нецелевых микроорганизмов в одной пробирке) (см. 8.3 и рисунок С.3)
Примечание - Информация, касающаяся инкубирования (см. пятую ячейку каждой колонки данной блок-схемы), приведена в 5.4.2.6.
Рисунок С.3 - Блок-схема метода качественных испытаний для жидких селективных обогатительных сред с использованием одной пробирки
С.5 Качественный метод для неселективных и селективных жидких сред с использованием одной пробирки: определение мутности (см. 8.4 и рисунок С.4)
При необходимости проверяют наличие признаков бактериального роста в каждой жидкой среде (например, наличие газообразования, изменение цвета).
Примечание - Информация, касающаяся инкубирования (см. третью ячейку данной блок-схемы), приведена в 5.4.2.6.
Рисунок С.4 - Блок-схема качественного испытания жидких сред с использованием одной пробирки (определение мутности)
Приложение D
(справочное)
Пример карточки записи результатов испытаний питательных сред
D.1 Пример карточки записи результатов испытаний питательных сред приведен в таблице D.1.
Таблица D.1
Контрольная карточка внутренних испытаний качества питательных сред | |||||||||||||||||
Питательная среда: | Объем: | Дата розлива: | Внутренний код партии: | ||||||||||||||
Обезвоженная среда (и код): | Поставщик: | Партия | Количество: | Дата/подпись: | |||||||||||||
Добавка: | Поставщик: | Партия | Количество: | Дата/подпись: | |||||||||||||
Подробная информация о процессе | |||||||||||||||||
Контроль физического качества | |||||||||||||||||
Ожидаемый внешний вид обезвоженной питательной среды: | Цвет нормальный | Качество подтверждено: | Дефекты: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Сыпучесть высокая | |||||||||||||||||
Ожидаемое значение рН: | Измеренное значение рН: | Качество подтверждено: | Дефекты: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Ожидаемое количество среды и/или толщина слоя: | Наблюдается: | Качество подтверждено: | Дефекты: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Ожидаемый цвет: | Наблюдается: | Качество подтверждено: | Дефекты: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Ожидаемая прозрачность/наличие оптических аномалий: | Наблюдается: | Качество подтверждено: | Дефекты: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Ожидаемая стабильность/консистенция/ влажность геля: | Наблюдается: | Качество подтверждено: | Дефекты: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Микробное заражение | |||||||||||||||||
Количество испытуемых чашек или пробирок: | Результат: | Качество подтверждено: | Количество зараженных чашек или пробирок: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Инкубирование: | |||||||||||||||||
Микробиологический рост - | Метод контроля: количественный | качественный | |||||||||||||||
Производительность | |||||||||||||||||
Штаммы: Инкубирование: | Критерии: | Результат: | Качество подтверждено: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Контрольная среда: | |||||||||||||||||
Микробиологический рост - Селективность | Метод контроля: количественный | качественный | |||||||||||||||
Штаммы: Инкубирование: | Критерии: | Результат: | Качество подтверждено: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Контрольная среда: | |||||||||||||||||
Микробиологический рост - Специфичность | Метод контроля: количественный | качественный | |||||||||||||||
Штаммы: Инкубирование: | Критерии: | Результат: | Качество подтверждено: | Дата/подпись: | |||||||||||||
да | нет | ||||||||||||||||
Контрольная среда: | |||||||||||||||||
Разрешение на выпуск партии | |||||||||||||||||
Информация о хранении: | Разрешение на выпуск партии | Дата/подпись: | |||||||||||||||
да | нет | ||||||||||||||||
Приложение Е
(обязательное)
Тест-микроорганизмы и эксплуатационные критерии для питательных сред, которые широко используют в пищевой микробиологии
В настоящем приложении приведена информация о питательных средах, условиях культивирования, тест-микроорганизмах, номерах культурной коллекции тест-микроорганизмов и ожидаемых реакциях при проведении эксплуатационных испытаний питательных сред.
Для проведения испытаний отбирают определенные штаммы с целью гарантирования схожести результатов в разных лабораториях и облегчения демонстрации различий между средами (от партии к партии, а также в зависимости от изготовителя). Данные штаммы прошли всестороннюю оценку с целью гарантирования их пригодности и стабильности при эксплуатации.
В случае, когда приводится более чем один штамм в каждом аспекте эксплуатационных испытаний (производительность, селективность, специфичность), должны как минимум использоваться штаммы, обозначенные символом b. Коммерческие и некоммерческие поставщики предполагают использование дополнительных штаммов, например, указанных в таблице Е.1, чтобы более обоснованно гарантировать качество поставляемых питательных сред.
Таблица Е.1 была составлена с учетом контрольных штаммов, используемых в Европейской фармакопее (ЕР), и рекомендаций, касающихся питательных сред для пищевой микробиологии рабочей группы Международного комитета по пищевой микробиологии и гигиене (ICFMH). Эти критерии должны быть включены в конкретные международные стандарты при их разработке и пересмотре в будущем. Валидированной партией питательной среды является партия, которая демонстрирует удовлетворительные эксплуатационные характеристики. Номера штаммов, указанные в таблице Е.1, заимствованы из каталога универсальных идентификаторов штаммов, составленных Всемирным центром данных по микроорганизмам (WDCM) [20]. Данный каталог содержит данные о контрольных штаммах, представленных каждым номером WDCM, а также контактные данные о культурных коллекциях. Все приведенные среды описаны в европейских и международных стандартах.
Если имеют место различия в характеристиках штаммов, исследуют возможные воздействия на питательную среду (например, при получении одной и той же среды от различных производителей) и приобретают дополнительную контрольную культуру из коллекции культур, в которой данная культура первоначально находилась. Пользователи могут запрашивать соответствующую информацию, касающуюся изменчивости штаммов, у РГ 5 "Питательные среды" ISО/TК 34/ПК 9 через секретариат ISО/TК 34/ПК 9.
Таблица Е.1 - Тест-микроорганизмы и эксплуатационные критерии для питательных сред, широко используемых в пищевой микробиологии
Селективные среды для подсчета микроорганизмов | |||||||||||
Среда | Тип | Микро- | Между- | Функция | Инкуби- | Контрольный штамм | Номер WDCM | Конт- | Метод контроля | Критерии | Характерная реакция |
Агар для Listeria в соответ- | S | Listeria mono- | ISO 11290-2 | Производи- | (44±4) ч/ | Listeria monocytogenes 4b | 00021 | TSA | Количест- | P | Сине-зеленые колонии с непрозрачным ореолом
|
Listeria monocytogenes 1/2a | 00109 | ||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингиби- | - | |||||
Enterococcus faecalis | 00009 или 00087 | ||||||||||
Специ- | Listeria innocua | 00017 | - | Качест- | - | Сине-зеленые колонии без непрозрачного ореола | |||||
Baird- | S | Коагулаза- | ISO 6888-1 | Производи- | (24±2) ч - | Staphylococcus aureus | 00034 | TSA | Количест- | P | Черные или серые колонии с прозрачным ореолом (реакция просветления с яичным желтком) |
Селек- | (48±2) ч/ | Escherichia coli | 00012 | - | Качест- | Полное ингиби- | - | ||||
Специ- | (24±2) ч - | Staphylococcus | 00159 | - | Качест- | - | Черные или серые колонии без реакции просветления с яичным желтком | ||||
BGBLB | L | Колиформы | ISO 4831 | Производи- | (24±2) ч - | Escherichia coli | 00012 | - | Качест- | Мутность (2) | Газообразо- |
Citrobacter freundii | 00006 | ||||||||||
Селек- | (24±2) ч - | Enterococcus faecalis | 00009 | - | Качест- | Частичное ингиби- | - | ||||
CFC | S | Pseudomonas spp. | ISO 13720 | Производи- | (44±4) ч/ | Pseudomonas fluorescens | 00115 | TSA | Количест- | P | - |
Pseudomonas fragi | 00116 | ||||||||||
Селек- | Escherichia coli | 00012 | - | Качест- | Полное ингиби- | - | |||||
DG18 | S | Дрожжи и плесени | ISO 21527-2 | Производи- | 5 сут/ | Saccharomy- | 00058b | SDA | Количест- | P | Характерные для каждого вида колонии/ростки |
Wallemia sebi | 00182 | ||||||||||
Aspergillus restrictus | 00183 | ||||||||||
Eurotium rubrum | 00184 | ||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Отсутствие роста | - | |||||
Bacillus subtilis subsp. spizizenii | 00003 | ||||||||||
DRBC | S | Дрожжи и плесени | ISO 21527-1 | Производи- | 5 сут/ | Saccharomy- | 00058 | SDA | Количест- | P | Характерные для каждого вида колонии/ростки
|
Aspergillus brasiliensis | 00053 | ||||||||||
Candida albicans | 00054 | ||||||||||
Mucor racemosus | 00181 | ||||||||||
DRBC | S | Дрожжи и плесени | ISO 21527-1 | Селек- | 5 сут/ | Escherichia coli | 00012 или 00013 | - | Качест- | Отсутствие роста | - |
Bacillus subtilis subsp. spizizenii | 00003 | ||||||||||
ЕС | L | Escherichia coli | ISO 7251 | Производи- | (24±2) ч - | Escherichia coli | 00012 | - | Качест- | Мутность (2) | Газообразо- |
Селек- | Pseudomonas aeruginosa | 00025 | - | Качест- | Отсутствие роста | - | |||||
IS ("TS") | S | Сульфитре- | ISO 15213 | Производи- | (24±3) ч - | Clostridium perfringens | 00007 | ТSА или другая неселек- | Количест- | P | Черные колонии |
Специ- | Escherichia coli | 00012 | - | Качест- | - | Отсутствие почернения | |||||
LST | L | Колиформы | ISO 4831 | Производи- | (24±2) ч - | Escherichia coli | 00012 | - | Качест- | Мутность (2) | Газообразо- |
Селек- | Citrobacter freundii | 00006 | |||||||||
Enterococcus faecalis | 00009 | - | Качест- | Отсутствие роста | - | ||||||
LST | L | Escherichia coli | ISO 7251 | Производи- | (24±2) ч - | Escherichia coli | 00012 | - | Качест- | Мутность (2) | Газообразо- |
Селек- | Enterococcus faecalis | 00009 | - | Качест- | Отсутствие роста | - | |||||
mCCDA | S | Campylo- | ISO 10272-2 | Производи- | (44±4) ч/ | Campylobacter jejuni | 00156 | Кровя- | Количест- | P | Сероватые, плоские и влажные, иногда с металлическим блеском |
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | - | - | |||||
Staphylococcus aureus | 00034 | - | Качест- | - | - | ||||||
MRS | S | Lactic acid bacteria | ISO 15214 | Производи- | (72±3) ч/ | Lactobacillus sakei | 00015 | Партия среды MRS уже валиди- | Количест- | P | Колонии, характерные для каждого вида
|
Lactococcus lactis | 00016 | ||||||||||
Pediococcus pentosaceus | 00158 | ||||||||||
Селек- | (72±3) ч/ | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингиби- | - | ||||
Bacillus cereus | 00001 | ||||||||||
MYP | S | Bacillus cereus | ISO 7932 | Производи- | (24±3) ч - | Bacillus cereus | 00001 | TSA | Количест- | P | Розовые колонии с ореолом осадка |
Селек- | (44±4) ч/ (30±1)°С | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингиби- | - | ||||
Специ- | Bacillus subtilis subsp. spizizenii | 00003 | - | Качест- | - | Желтые колонии без ореола осадка | |||||
RPFA | S | Coagulase- | ISO 6888-2 | Производи- | (24±2) ч - | Staphylococcus aureus | 00034 | TSA | Количест- | P | Черные или серые колонии с ореолом мутности |
Селек- | (48±2) ч/ | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингиби- | - | ||||
Специ- | (24±2) ч - (48±2) ч/ (37±1)°С | Staphylococcus | 00159 | - | Качест- | - | Черные или серые колонии без ореола мутности
| ||||
Staphylococcus epidermidis | 00036 | ||||||||||
РРА | S | Pseudomonas spp. | ISO/TS 11059 | Производи- | (48±2) ч/ | Pseudomonas fluorescens | 00115 | TSA | Количест- | P | - |
Pseudomonas aeruginosa | 00025 | ||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингиби- | - | |||||
ТВХ | S |
| ISO 16649-1 и ISO 16649-2 | Производи- | (21±3) ч/ | Escherichia coli | 00012 | TSA | Количест- | P | Синие колонии |
Селек- | Enterococcus faecalis | 00009 | Качест- | Полное ингиби- | - | ||||||
Специ- | Citrobacter freundii | 00006 | Качест- | - | Колонии от белого до зелено- | ||||||
Pseudomonas aeruginosa | 00025 | ||||||||||
TSC (SC) | S | Clostridium perfringens | ISO 7937 | Производи- | (20±2) ч/ | Clostridium perfringens | 00007 | TSA или другая неселек- | Количест- | P | Черные колонии |
Селек- | (20±2) ч/ | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингиби- | - | ||||
Pseudomonas aeruginosa | 00025 | ||||||||||
VRBG | S | Enterobacteri- | ISO 21528-2 | Производи- | (24±2) ч/ | Escherichia coli | 00012 | TSA | Количест- | P | Колонии от розового до красного цвета с или без ореола осадка |
Селек- | Enterococcus faecalis | 00009 | - | Качест- | Полное ингиби- | - | |||||
VRBL | S | Колифор- | ISO 4832 | Производи- | (24±2) ч/ | Escherichia coli | 00012 | TSA | Количест- | P | Пурпурно- |
Селек- | Enterococcus faecalis | 00009 | - | Качест- | Полное ингиби- | - | |||||
Специ- | Pseudomonas aeruginosa | 00025 | Качест- | - | Колонии, имеющие окраску от бесцветной до бежевой | ||||||
Неселективные среды для подсчета микроорганизмов | |||||||||||
РСА МРСА | S | Подсчет колоний | ISO 4833 | Производи- | (72±3) ч/ | Bacillus subtilis subsp. Spizizenii | 00003 | TSA | Количест- | P | - |
Селективные среды для обогащения | |||||||||||
Bolton | L | Campylobacter | ISO 10272-1 | Производи- | (5±1) ч/ | Campylobacter jejuni | 00156 или 00005 | - | Качест- | >10 колоний на mCCDA | Сероватые, плоские и влаж- |
атмосфера | +Escherichia coli | 00012 | |||||||||
Селек- | Escherichia coli | 00012 | - | Качест- | Полное ингиби- | - | |||||
ЕЕ | L | Enterobacteri- | ISO 21528-1 | Производи- | (24±2) ч/ | Escherichia coli | 00012 | - | Качест- | >10 колоний на VRBG | Колонии от розового до красного цвета с или без ореола осадка
|
Salmonella Typhimuriumi | 00031 или 00030 | ||||||||||
+Enterococcus faecalis | 00009 или 00087 | ||||||||||
Селек- | Enterococcus faecalis | 00009 или 00087 | - | Качест- | Полное ингиби- | - | |||||
Fraser | L | Listeria mono- | ISO 11290-1 | Производи- | (48±2) ч/ | Listeria monocytogenes 4b | 00021 | - | Качест- | более 10 колоний на агаре для Listeria в соответ- | Сине-зеленые колонии с ореолом мутности |
+Enterococcus faecalis | 00009 или 00087 | ||||||||||
Listeria monocytogenes 1/2a | 00109 | ||||||||||
+Enterococcus faecalis | 00009 или 00087 | ||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингиби- | - | |||||
Enterococcus faecalis | 00009 или 00087 | - | Качест- | <100 колоний на TSA | - | ||||||
Giolitti Cantoni | L | Coagulase- | ISO 6888-3 | Производи- | (24±2) ч - | Staphylococcus aureus | 00034 | - | Качест- | >10 колоний на Baird Parker или RPFA | Колонии, характерные для каждой среды (см. ISO 6888-1 для Baird Parker и ISO 6888-2 для RPFA) |
Staphylococcus aureus | 00032 | ||||||||||
+Escherichia coli | 00012 или 00013 | ||||||||||
Селек- | (48±2) ч/ | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингиби- | - | ||||
Half- | L | Listeria mono- | ISO 11290-1 | Производи- | (24±2) ч/ | Listeria monocytogenes 4b | 00021 | - | Качест- | более 10 колоний на агаре для Listeria в соответ- | Сине-зеленые колонии с ореолом мутности |
+Enterococcus faecalis | 00009 или 00087 | ||||||||||
Listeria monocytogenes 1/2a | 00109 | ||||||||||
+Enterococcus faecalis | 00009 или 00087 | ||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингиби- | - | |||||
Enterococcus faecalis | 00009 или 00087 | - | Качест- | <100 колоний на TSA | - | ||||||
ITC | L | Yersinia enterocolitica | ISO 10273 | Производи- | (44±4) ч/ | Yersinia enterocolitica | 00038 | - | Качест- | более 10 колоний на CIN или SSDC | Колонии, характерные для каждой среды (см. ISO 10273) |
+Pseudomonas aeruginosa | 00025 | ||||||||||
Селек- | Pseudomonas | 00025 | - | Качест- | Полное ингиби- | - | |||||
МKТТn | L | Salmonella | ISO 6579 | Производи- | (24±3) ч/ | Salmonella Enteritidis | 00030 | - | Качест- | >10 колоний на XLD или другой выбранной среде | Колонии, характерные для каждой среды (см. ISO 6579) |
+Escherichia coli | 00012 или 00013 | ||||||||||
+Pseudomonas aeruginosa | 00025 | ||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Частичное ингиби- | - | |||||
Enterococcus faecalis | 00009 или 00087 | - | Качест- | <10 колоний нa TSA | - | ||||||
Продолжение таблицы Е.1
Селективные среды для подсчета микроорганизмов | ||||||||||||
Среда | Тип | Микро- | Между- | Функция | Инкуби- | Контрольный штамм | Номер WDCM | Конт- | Метод контроля | Критерии | Характерная реакция | |
MSRV | SS | Salmonella | ISO 6579 | Производи- | 2·(24±3) ч/ | Salmonella Enteritidis | 00030 | - | Качест- | Серо-белая мутная зона, распрост- | Возможные явления: характерные колонии после субкультиви- | |
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Возможный рост в зоне инокули- | - | ||||||
Enterococcus faecalis | 00009 или 00087 | - | Качест- | Отсутствие роста | - | |||||||
MMG | L |
| ISO 16649-3 | Производи- | (24±2) ч/ | Escherichia coli | 00012 | - | Качест- | Выработка кислоты | Изменение окраски на желтую | |
Селек- | Enterococcus faecalis | 00009 или 00087 | - | Качест- | Отсутствие роста | - | ||||||
PSB | L | Yersinia enterocolitica | ISO 10273 | Производи- | 3-5 сут/ | Yersinia enterocolitica | 00038 | - | Качест- | >10 колоний на CIN или SSDC | Колонии, характерные для каждой среды (см. ISO 10273) | |
+Pseudomonas aeruginosa | 00025 | |||||||||||
Yersinia enterocolitica | 00160 | |||||||||||
+Escherichia coli | 00012 | |||||||||||
+Pseudomonas aeruginosa | 00013 или 00025 | |||||||||||
Селек- | Pseudomonas Aeruginosa | 00025 | - | Качест- | Полное инги- | - | ||||||
Proteus mirabilis | 00023 | |||||||||||
RVS | L | Salmonella | ISO 6579 | Производи- | (24±3) ч/ | Salmonella Enteritidis | 00030 | - | Качест- | >10 колоний нa XLD или другой выб- | Колонии, харак- | |
Salmonella Typhimuri- | 00031 | |||||||||||
+Escherichia coli | 00012 или 00013 | |||||||||||
+Pseudomonas aeruginosa | 00025 | |||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Частичное ингибиро- | - | ||||||
Enterococcus faecalis | 00009 или 00087 | - | Качест- | <10 колоний нa TSA | - | |||||||
TSPB | L | Bacillus cereus | ISO 21871 | Производи- | (48±4) ч/ | Bacillus cereus | 00001 | - | Качест- | более 10 колоний на РЕМВА или МYР | Колонии, характерные для каждой среды (см. ISO 21871) | |
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибиро- | - | ||||||
Неселективные жидкие среды | ||||||||||||
BHI | L | Коагулаза- | ISO 6888-1 | Производи- | (24±2) ч/ | Staphylococcus aureus | 00034 | - | Качест- | Мутность (1-2) | - | |
Brucella | L | Campylobacter | ISO 10272 (все части) | Производи- | 2-5 сут/ | Campylobacter jejuni | 00156 | - | Качест- | Мутность (1-2) | - | |
Разбави- | L | Разбавители | ISO 6887 (все части) | Разбави- | 45 мин - 1 ч/ | Escherichia coli | 00012 или 00013 | TSA | Качест- | ±30% колоний/Т | - | |
с бромо- | Staphylococcus aureus | 00034 | ||||||||||
Раствор Ringer с концен- | L | Разбавители | ISO 6887 (все части) | Разбави- | 45 мин -1 ч/ | Escherichia coli | 00012 или 00013 | TSA | Количест- | ±30% колоний/Т | - | |
Пеп- | Staphylococcus aureus | 00034 | ||||||||||
Тиогли- | L | Clostridium perfringens | ISO 7937 | Производи- | (21±3) ч/ | Clostridium perfringens | 00007 | - | Качест- | Мутность (1-2) | - | |
TSYEB | L | Listeria mono- | ISO 11290 (все части) | Производи- | (21±3) ч/ | Listeria monocytogenes 4b | 00021 | - | Качест- | Мутность (1-2) | - | |
Listeria monocytogenes 1/2a | 00109 | |||||||||||
Селективные среды для выделения | ||||||||||||
Агар для Listeria Ottaviani и Agosti | S | Listeria monocytogenes | ISO 11290-1 | Производи- | (44±4) ч/ | Listeria monocytogenes 4b | 00021 | - | Качест- | Выраженный рост (2) | Сине-зеленые колонии с ореолом мутности | |
Listeria monocytogenes 1/2a | 00109 | |||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибиро- | - | ||||||
Enterococcus faecalis | 00009 или 00087 | |||||||||||
Специ- | Listeria innocua | 00017 | - | Качест- | - | Сине-зеленые колонии без ореола мутности | ||||||
mCCDA | S | Campylobacter | ISO 10272 (все части) | Производи- | (44±4) ч/ | Campylobacter jejuni | 00156 | - | Качест- | Выраженный рост (2) | Сероватые, плоские и влажные, иногда с металли- | |
Селек- | Escherichia coli | 000012 или 00013 | - | Качест- | Частичное или полное ингибиро- | Характерные колонии отсутствуют | ||||||
Staphylococcus aureus | 00034 | - | Качест- | Полное ингибиро- | - | |||||||
CT-SMAC | S | Escherichia coli | ISO 16654 | Производи- | (21±3) ч/ | Escherichia coli О157:H7 | 00014 (нетокси- | - | Качест- | Выраженный рост (2) | Прозрачные колонии, имеющие бледную желтовато- | |
Селек- | Staphylococcus aureus | 00032 или 00034 | - | Качест- | Полное ингибиро- | - | ||||||
Escherichia coli | 00012 или 00013 | - | Качест- | Частичное ингибиро- | Рост некоторых розовых колоний | |||||||
CIN SSDC | S | Yersinia enterocolitica | ISO 10273 | Производи- | (21±3) ч/ | Yersinia enterocolitica | 00038 | - | Качест- | Выраженный рост (2) | Колонии, характерные для каждой среды (см. ISO 10273) | |
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное или частичное ингиби- | Характерные колонии отсутствуют | ||||||
Staphylococcus aureus | 00034 | - | Качест- | Полное ингибиро- | - | |||||||
СРС mCPC | S | Виды Vibrio spp., отличные от Vibrio Parahaemo- | ISO/TS 21872-2 | Производи- | (24±3) ч/ | Vibrio vulnificus | 00187 | - | Качест- | Выраженный рост (2) | Желтые колонии, окруженные желтой окраской среды | |
Vibrio cholerae за исключением О1 и О139 | 00203 | - | Качест- | Выраженный рост (2) | Пурпуровые колонии, окруженные пурпуровой окраской среды | |||||||
Селек- | Escherichia coli | 00012, или 00013, или 00090 | - | Качест- | Полное ингибиро- | - | ||||||
MYP | S | Bacillus cereus | ISO 21871 | Производи- | (21±3) ч - | Bacillus cereus | 00001 | - | Качест- | Выраженный рост (2) | Розовые колонии с ореолом осадка | |
Селек- | (44±4) ч/ | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибиро- | - | |||||
Специ- | Bacillus subtilis subsp. spizizenii | 00003 | - | Качест- | - | Желтые колонии без ореола осадка | ||||||
РЕМВА | S | Bacillus cereus | ISO 21871 | Производи- | (21±3) ч - | Bacillus cereus | 00001 | - | Качест- | Выраженный рост (2) | Бирюзово- | |
Селек- | (44±4) ч/ | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибиро- | - | |||||
Специ- | Bacillus subtilis subsp. spizizenii | 00003 | - | Качест- | - | Белые колонии без ореола осадка | ||||||
SDS | S | Виды Vibrio spp., отличные от Vibrio parahaemo- | ISO/TS 21872-2 | Производи- | (24±3) ч/ | Vibrio vulnificus | 00187 | - | Качест- | Выраженный рост (2) | Пурпуровые/ | |
Vibrio cholerae за исключением О1 и О139 | 00203 | - | Качест- | Выраженный рост (2) | Желтые колонии с ореолом мутности | |||||||
Селек- | Escherichia coli | 00012, или 00013, или 00090 | - | Качест- | Полное ингибиро- | - | ||||||
ТВХ | S |
| ISO 16649-3 | Производи- | (21±3) ч/ | Escherichia coli | 00012 | - | Качест- | Выраженный рост (2) | Синие колонии | |
Селек- | Enterococcus faecalis | 00009 или 00087 | - | Качест- | Полное ингибиро- | - | ||||||
Специ- | Citrobacter freundii | 00006 | - | Качест- | - | Колонии, имеющие окраску от белой до зелено- | ||||||
VRBG | S | Enterobacteri- | ISO 21528-1 | Производи- | (24±2) ч/ | Escherichia coli | 00012 | - | Качест- | Выраженный рост (2) | Колонии от розового до красного цвета с или без ореола осадка | |
Salmonella Typhimurium | 00013 | |||||||||||
Salmonella Typhimurium | 00031 или 00032 | |||||||||||
Селек- | Enterococcus faecalis | 00009 или 00087 | - | Качест- | Полное ингибиро- | - | ||||||
XLD | S | Salmonella | ISO 6579 | Производи- | (24±3) ч/ | Salmonella Typhimuri- | 00031 | - | Качест- | Выраженный рост (2) | Колонии, имею- | |
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Рост или частичное ингиби- | Желтые колонии | ||||||
Enterococcus faecalis | 00009 или 00087 | - | Качест- | Полное ингиби- | - | |||||||
Неселективные среды для выделения | ||||||||||||
Nutrient agar | S | Enterobacteri- | ISO 21528 (все части) | Производи- | (24±2) ч/ | Escherichia coli | 00012 | - | Качест- | Выраженный рост (2) | - | |
Salmonella | ISO 6579 | (24±2) ч/ | Salmonella Typhimuri- | 00030 | ||||||||
Salmonella | 00031 | |||||||||||
Yersinia enterocolitica | ISO 10273 | (24±2) ч/ (30±1)°С | Yersinia enterocolitica | 00038 | ||||||||
TSYEA | S | Listeria mono- | ISO 11290 (все части) | Производи- | (21±3) ч/ | Listeria monocytogenes 4b | 00021 | - | Качест- | Выраженный рост (2) | - | |
Listeria monocytogenes 1/2a | 00109 | |||||||||||
Многоцелевые среды | ||||||||||||
BPW | L | Разбавитель для всех спо- | ISO 6887 (все части), ISO 6887-5 | Разведение | 45 мин - 1 ч/ | Escherichia coli | 00012 | TSA | Качест- | ±30% коло- | - | |
Staphylococcus aureus | 00013 | |||||||||||
Разбавитель для подсчета Listeria mono- | ISO 11290-2 | Разведение | (1 ч ± 5 мин)/ | Listeria monocytogenes 4b | 00021 | TSA | Качест- | ±30% коло- | - | |||
Listeria monocytogenes 1/2a | 00109 | |||||||||||
Предвари- | ISO 6579 | Производи- | (18±2) ч/ (37±1)°С | Salmonella Typhimuri- | 00031 | - | Качест- | Мутность (1-2) | - | |||
Salmonella Enteritidis | 00030 | |||||||||||
Предвари- | ISO 21528-1 | Производи- | (18±2) ч/ (37±1)°С | Escherichia coli | 00012 | - | Качест- | Мутность (1-2) | - | |||
Контрольные среды для подсчета микроорганизмов | ||||||||||||
Агар с кровью | S | Campylobacter | ISO 10272-2 | Производи- | (44±4) ч/ (41,5±1)°С | Campylobacter jejuni | 00156 | Партия среды агара с кровью уже валиди- | Количест- | P | - | |
TSA | S | Подсчет колоний | - | Производи- | Как уста- | Bacillus cereus | 00001 | Партия среды TSA уже валиди- | Количест- | P | Колонии, характерные для каждого вида | |
Listeria monocytogenes 4b | 00021 | |||||||||||
Staphylococcus aureus | 00034 | |||||||||||
SDA | S | Подсчет колоний | - | Производи- | Как установ- | Saccharomyces cerevisiae | 00058 | Партия среды SDA уже валиди- | Количест- | P | Колонии/
| |
| ||||||||||||
Таблица Е.2 - Аббревиатуры сред, приведенных в таблице Е.1
Аббревиатура среды | Полное наименование среды | Соответствующий международный стандарт |
Baird-Parker | Среда Бэрда-Паркера | ISO 6888-1 |
BGBLB | Бульон с бриллиантовым зеленым, лактозой и желчью | ISO 4831 |
BHI | Бульон настойки мозга и сердца | ISO 6888-1 и ISO 6888-3 |
Bolton | Бульон Болтона | ISO 10272-1 |
BPW | Буферная пептонная вода | ISO 6887 (все части) ISO 6579 ISO 11290-2 ISO 21528-1 |
Brucella | Бульон для бруцелл | ISO 10272 (все части) |
CFC | Агар с цефалотином, фуцидином и цетримидом | ISO 13720 |
CIN | Агар с цефзулодином, иргазаном и новобиоцином | ISO 10273 |
CPC | Агар с целлобиозой, полимиксином В и колистином | ISO/TS 21872-2 |
CT-SMAC | Агар Мак-Конки с цефиксимом, теллуритом и сорбитолом | ISO 16654 |
DG18 | Агар с дихлораном и глицерином | ISO 21527-2 |
DRBC | Бенгальский агар с дихлоран-розой и хлорамфениколом | ISO 21527-1 |
EC | Бульон ЕС | ISO 7251 |
ЕЕ | Буферный бульон с бриллиантовым зеленым, желчью и глюкозой | ISO 21528-1 |
Fraser | Бульон Фразера | ISO 11290-1 |
Half-Fraser | Бульон Фразера полуконцентрированный | ISO 11290-1 |
IS ("TS") | Агар с железом и сульфитом (Триптозный сульфитный агар) | ISO 15213 |
ITC | Бульон с иргазаном, тикарциллином и хлоратом | ISO 10273 |
LST | Бульон с лаурилсульфатом, бульон с лаурилом и триптозой | ISO 4831 и ISO 7251 |
mCCDA | Модифицированный агар с активированным углем, цефоперазоном и дезоксихолатом | ISO 10272 (все части) |
mCPC | Модифицированный агар с целлобиозой, полимиксином В и колистином | ISO/TS 21872-2 |
MKTTn | Бульон Мюллера-Кауфмана с тетратионатом и новобиоцином | ISO 6579 |
MMG | Глутаматная среда, модифицированная минеральными соединениями | ISO 16649-3 |
MPCA | Агар для подсчета колоний с сепарированным молоком/агар для подсчета с молоком | ISO 4833 |
MRS | Среда MRS (Мэн, Рогоза и Шарп) | ISO 15214 |
MSRV | Модифицированная полужидкая среда Раппапорта-Вассилиадиса | ISO 6579 |
MYP | Агар с маннитолом, яичным желтком и полимиксином | ISO 7932 |
PCA | Агар для подсчета в чашке | ISO 4833 |
РЕМВА | Агар с полимиксином, пируватом, яичным желтком, маннитолом и бромтимоловым синим | ISO 21871 |
РРА | Агар с пенициллином и пимарицином | ISO/TS 11059 |
PSB | Бульон с пептоном, сорбитолом и желчными солями | ISO 10273 |
RPFA | Агар с фибриногеном плазмы кролика | ISO 6888-2 |
RVS | Пептонный соевый бульон Раппапорта-Василиадиса | ISO 6579 |
SDA | Агар Саборода с декстрозой | - |
SDS | Агар с натрия додецилсульфатом, полимиксином и сахарозой | ISO/TS 21872-2 |
SSDC | Агар для сальмонелл и шигелл с дезоксихолатом кальция | ISO 10273 |
ТВХ | Агар с триптоном, желчью и Х-глюкуронидом | ISO 16649 (все части) |
TCBS | Агар с тиосульфатом, цитратом, желчными солями и сахарозой | ISO/TS 21872-1 |
Thioglycollate | Жидкая среда с тиогликоллятом | ISO 7937 |
TSA | Триптонный соевый агар | - |
TSC/SC | Агар с сульфитом и циклосерином/агар с триптозой, сульфитом и циклосерином без яичного желтка | ISO 7937 |
TSPB | Триптонный соевый бульон с полимиксином | ISO 21871 |
TSYEA | Триптонный соевый агар с экстрактом дрожжей | ISO 11290 (все части) |
TSYEB | Триптонный соевый бульон с экстрактом дрожжей | ISO 11290 (все части) |
VRBG | Фиолетово-красный агар с желчью и глюкозой | ISO 21528 (все части) |
VRBL | Фиолетово-красный агар с желчью и лактозой | ISO 4832 |
XLD | Агар с ксилозой, лизином и дезоксихолатом | ISO 6579 |
Приложение F
(обязательное)
Тест-микроорганизмы и эксплуатационные критерии для питательных сред, которые широко используют в микробиологии воды
Для проведения испытаний отбирают определенные штаммы с целью гарантирования схожести результатов в разных лабораториях и облегчения демонстрации различий между средами (от партии к партии, а также в зависимости от изготовителя). Данные штаммы, приведенные в таблице F.1, прошли всестороннюю оценку с целью гарантирования их пригодности и стабильности при эксплуатации.
В случае, когда приводится более чем один штамм в каждом аспекте эксплуатационных испытаний (производительность, селективность, специфичность), должны как минимум использоваться штаммы, обозначенные символом b. Коммерческие и некоммерческие поставщики предполагают использование дополнительных штаммов, например, указанных в таблице F.1, чтобы более обоснованно гарантировать качество поставляемых питательных сред.
Эти критерии должны быть включены в конкретные стандарты при их разработке и пересмотре в будущем. Валидированной партией питательной среды является партия, которая демонстрирует удовлетворительные эксплуатационные характеристики. Номера штаммов, указанные в таблице F.1, заимствованы из каталога универсальных идентификаторов штаммов, составленных Всемирным центром данных по микроорганизмам (WDCM) [20]. Данный каталог содержит данные о контрольных штаммах, представленных каждым номером WDCM, а также контактные данные о культурных коллекциях. Все приведенные среды описаны в европейских и международных стандартах.
Если имеют место различия в характеристиках штаммов, исследуют возможные воздействия на питательную среду (например, при получении одной и той же среды от различных производителей) и приобретают дополнительную контрольную культуру из коллекции культур, в которой данная культура первоначально находилась. Пользователи могут запрашивать соответствующую информацию, касающуюся изменчивости штаммов, у РГ 5 "Питательные среды" ISО/TК 34/ПК 9 через секретариат ISО/TК 34/ПК 9.
Таблица F.1 - Тест-микроорганизмы и эксплуатационные критерии для питательных сред, широко используемых в микробиологии воды
Селективные среды для подсчета микроорганизмов путем сравнения с неселективной контрольной средой | ||||||||||||||||||
Среда | Тип | Микро- | Между- | Функция | Инкубиро- | Контрольный штамм | Номер WDCM | Контроль- | Метод контроля | Критерии | Характерная реакция | |||||||
Colilert | L | Escherichia соli/ | ISO 9308-2 | Производи- | (20±2) ч/ | Escherichia coli | 00013 | TSA | Количест- | P | Желтая окраска и флуоресценция (Е. Coli) | |||||||
Селек- | Klebsiella pneumoniae | 00206 | TSA | Количест- | P | Желтая окраска, такая же или более интенсивная, чем образец сравнения (колиформные бактерии) | ||||||||||||
Pseudomonas aeruginosa | - | - | Качест- | Полное ингибирование (0) | Более бледная желтая окраска, чем у образца сравнения | |||||||||||||
GVPC | S | Legionella | ISO 11731 и ISO 11731-2 | Производи- | 2-5 сут/ | Legionella pneumophila | 00107 | BCYE | Количест- | P | Бело-серо-сине- | |||||||
5-10 сут/ | Legionella anisa | 00106 | ||||||||||||||||
Селек- | 3 сут/ (36±2)°С | Enterococcus faecalis | 00009 или 00087 | - | Качест- | Полное ингибирование (0) | - | |||||||||||
Pseudomonas aeruginosa | 00026 или 00025 | - | Качест- | Полное и частичное ингибирование (0-1) | - | |||||||||||||
Escherichia coli | 00026 или 00025 | |||||||||||||||||
Lactose ТТС | S | Escherichia соli/ | ISO 9308-1 | Производи- | (21±3) ч/ | Escherichia coli | 00179 | TSA | Количест- | P | Желтая окраска среды под мембраной | |||||||
Enterobacter aerogenes | 00175 | |||||||||||||||||
Селек- | Enterococcus faecalis | 00009 или 00087 | - | Качест- | Полное ингибирование (0) | - | ||||||||||||
Специ- | Pseudomonas aeruginosa | 00025 или 00026 | - | Качест- | - | Красные колонии, синяя окраска среды | ||||||||||||
mСР | S | Clostridium perfringens | Директива Совета 98/83/EC | Производи- | (21±3) ч/ (44±1)°С анаэробная атмосфера | Clostridium perfringens | 00007 | TSA или другая неселек- | Количест- | P | Желтые колонии; тест на фосфатазу положительный | |||||||
Специ- | Clostridium bifermentans | 00079 | - | Качест- | - | Синие колонии; тест на фосфатазу отрицательный | ||||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибирование (0) | - | ||||||||||||
Pseudo- | S | Pseudomonas aeruginosa | ISO 16266 | Производи- | (44±4) ч/ | Pseudomonas aeruginosa | 00024 | TSA | Количест- | P | Сине-зеленые колонии, флуорес- | |||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибирование (0) | - | ||||||||||||
Enterococcus faecalis | 00009 или 00087 | |||||||||||||||||
Slanetz and Bartley | S | Кишечные энтерококки | ISO 7899-2 | Производи- | (44±4) ч/ | Enterococcus faecalis | 00009 | TSA | Количест- | P | Красно- | |||||||
Enterococcus faecium | 00177 | |||||||||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибирование (0) | - | ||||||||||||
Staphylococcus aureus | 00032 или 00034 | |||||||||||||||||
Sulfite Iron Tryptose Sulfite (TS) | S | Сульфит- | ISO 6461-2 | Производи- | (44±4) ч/ | Clostridium perfringens | 00007 | TSA, агар с кровью или другая несе- | Количест- | P | Черные колонии | |||||||
Специ- | Escherichia coli | 00012 или 00013 | - | Качест- | - | Отсутствие почернения | ||||||||||||
TSC | S | Clostridium perfringens | ISO 14189 | Производи- | (21±3) ч/ | Clostridium perfringens | 00007 | TSA, агар с кровью или другая несе- | Количест- | P | Черные колонии | |||||||
Селек- | Bacillus subtilis subsp. spizizenii | 00003 | - | Качест- | Полное ингибирование (0) | - | ||||||||||||
Селективные среды для подсчета микроорганизмов путем сравнения с партией, принятой ранее (для использования в особых случаях) | ||||||||||||||||||
Colilert | L | Escherichia соli/ | ISO 9308-2 | Производи- | (20±2) ч/ | Escherichia coli | 00013 | Партия среды Colilert ранее вали- | Количест- | P | Желтая окраска и флуорес- | |||||||
Klebsiella pneumoniae | 00206 | Партия среды Colilert ранее вали- | Количест- | P | Желтая окраска, такая же или более интенсивная, чем образец сравнения (колиформные бактерии) | |||||||||||||
Селек- | Pseudomonas aeruginosa | 00207 или 00025 | - | Качест- | Полное ингибирование (0) | Более бледная желтая окраска, чем образец сравнения | ||||||||||||
GVPC | S | Legionella | ISO 11731 и ISO 11731-2 | Производи- | 2-5 сут/ | Legionella pneumophila | 00107 | Партия среды GVPC уже валиди- | Количест- | P | Бело-серо-сине- | |||||||
5-10 сут/ | Legionella anisa | 00106 | ||||||||||||||||
Селек- | 3 сут/ | Enterococcus faecalis | 00009 или 00087 | - | Качест- | Полное ингибирование (0) | - | |||||||||||
Pseudomonas aeruginosa | 00026 или 00025 | - | Качест- | Полное или частичное ингибирование (0-1) | - | |||||||||||||
Escherichia coli | 00012 или 00013 | |||||||||||||||||
Lactose ТТС | S | Escherichia соli/ | ISO 9308-1 | Производи- | (21±3) ч/ | Escherichia coli | 00179 | Партия среды Lactose ТТС уже валиди- | Количест- | P | Желтая окраска среды под мембраной | |||||||
Enterobacter aerogenes | 00013 | |||||||||||||||||
Селек- | (21±3) ч/ | Enterococcus faecalis | 00009 или 00087 | - | Качест- | Полное ингибирование (0) | - | |||||||||||
Специ- | Pseudomonas aeruginosa | 00025 или 00026 | - | Качест- | - | Красные колонии, синяя окраска среды | ||||||||||||
mСР | S | Clostridium perfringens | Директива Совета 98/83/ЕС | Производи- | (21±3) ч/ | Clostridium perfringens | 00007 | Партия среды mСР уже вали- | Количест- | P | Желтые колонии; тест на фосфатазу положительный | |||||||
Специ- | Clostridium bifermentans | 00079 | - | Качест- | - | Синие колонии; тест на фосфатазу отрицательный | ||||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибирование (0) | - | ||||||||||||
Pseudo- | S | Pseudomonas aeruginosa | ISO 16266 | Производи- | (44±4) ч/ | Pseudomonas aeruginosa | 00024 | Партия среды Pseudo-
| Количест- | P | Сине-зеленые колонии, флуорес- | |||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибирование (0) | - | ||||||||||||
Enterococcus faecalis | 00009 или 00087 | |||||||||||||||||
Slanetz and Bartley | S | Кишечные энтерококки | ISO 7899-2 | Производи- | (44±4) ч/ | Enterococcus faecalis | 00009 | Партия среды Slanetz and Bartley уже валиди- | Количест- | P | Красно- | |||||||
Enterococcus faecium | 00177 | |||||||||||||||||
|
|
| Селек- |
| Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибирование (0) | - | ||||||||
Staphylococcus aureus | 00032 или 00034 | |||||||||||||||||
Sulfite Iron Tryptose Sulfite (TS) | S | Сульфит- | ISO 6461-2 | Производи- | (44±4) ч/ | Clostridium perfringens | 00007 | Партия среды Sulfite iron или TS уже валиди- | Количест- | P | Черные колонии | |||||||
Специ- | Escherichia coli | 00012 или 00013 | - | Качест- | - | Отсутствие почернения | ||||||||||||
TSC | S | Clostridium perfringens | ISO 14189 | Производи- | (21±3) ч/ | Clostridium perfringens | 00007 | Партия среды TSC уже вали- | Количест- | P | Черные колонии | |||||||
Селек- | Bacillus subtilis subsp. spizizenii | 00003 | - | Качест- | Полное ингибирование (0) | - | ||||||||||||
Неселективные среды для подсчета микроорганизмов | ||||||||||||||||||
YEA | S | Общая микрофлора | ISO 6222 | Производи- | (44±4) ч/ | Escherichia coli | 00012 или 00013 | Партия среды YEA уже вали- | Количест- | P | - | |||||||
Bacillus subtilis subsp. spizizenii | 00003 | |||||||||||||||||
Bolton Preston | L | Campylobacter | ISO 17995 | Производи- | (44±4) ч/ | Campylobacter jejuni | 00156 | - | Качест- | более 10 колоний на mCCDA | Мелкие, плоские или выпуклые колонии с гладкой поверхностью | |||||||
Campylobacter coli | 00005 | |||||||||||||||||
Селек- | (44±4) ч/ | Escherichia coli | 00012 или 00013 | - | Качест- | Полное ингибирование на TSA (0) | - | |||||||||||
Proteus mirabilis | 00023 | |||||||||||||||||
MUG/ | L | Escherichia соli/ | ISO 9308-3 | Производи- | 48 ч/ | Escherichia coli | 00179 | Более подробная информация о контроле качества и критериях качества среды MUG/ЕС приведена в ISO 9308-3:1998, приложение Е | ||||||||||
MUD/ | L | Кишечные энтерококки | ISO 7899-1 | Производи- | (44±4) ч/ | Enterococcus faecalis | 00176 | Более подробная информация о контроле качества и критериях качества среды MUG/SF приведена в ISO 7899-1:1998, приложение Е | ||||||||||
Enterococcus hirae | 00089 | |||||||||||||||||
Enterococcus faecium | 00178 | |||||||||||||||||
Селек- | Aerococcus viridans | 00061 | ||||||||||||||||
Lactococcus lactis | 00016 | |||||||||||||||||
Staphylococcus epidermidis | 00132 | |||||||||||||||||
RVS | L | Salmonella | ISO 19250 | Производи- | (24±3) ч/ | Salmonella | 00030 | - | Качест- | >10 колоний на XLD или другой выб- | Колонии, характерные для каждой среды (см. стандарт) | |||||||
Salmonella | 00031 | |||||||||||||||||
+Escherichia coli | 00012 или 00013 | |||||||||||||||||
+Pseudomonas aeruginosa | 00025 | |||||||||||||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Частичное ингибирование не более 100 колоний на TSA | - | ||||||||||||
|
|
| (24±3) ч/ | Enterococcus faecalis | 00009 или 00087 | - | Качест- | менее 10 колоний на TSA | - | |||||||||
Неселективные жидкие среды | ||||||||||||||||||
DRCM | L | Сульфит- | ISO 6461-1 | Производи- | (44±4) ч/ | Clostridium perfringens | 00007 | - | Качест- | Мутность (1-2) | Почернение | |||||||
Специ- | Escherichia coli | 00012 или 00013 | - | Качест- | Мутность (0-1) | Отсутствие почернения | ||||||||||||
Раствор хло- рида натрия Пеп- тонный разба- витель Пеп- тонный солевой раствор Раствор Ringer с концен- тра- цией, снижен- ной в 4 раза Фосфат- ный буфер- ный раст- вор | L | Разбавители | ISO 8199 | Разбави- | 45 мин-1 ч/ | Escherichia coli | 00012 или 00013 | TSA | Количест- | ±30% колоний/ | - | |||||||
Селективные среды для выделения | ||||||||||||||||||
mCCDA | S | Campylobacter | ISO 17995 | Производи- | (44±4) ч/ | Campylobacter jejuni | 00156 или 00005 | - | Качест- | Значительный рост (2) | Мелкие, плоские или выпуклые колонии с гладкой поверхностью | |||||||
Campylobacter coli | 00004 | |||||||||||||||||
Селек- | Escherichia coli | 00012, или 00013, или 00179, или 00090 | - | Качест- | Полное или частичное ингибирование (0-1) | Характерные колонии отсутствуют | ||||||||||||
Staphylococcus aureus | 00032 или 00034 | - | Качест- | Полное ингибирование (0) | - | |||||||||||||
XLD | S | Salmonella | ISO 19250 | Производи- | (24±3) ч/ | Salmonella Typhimuri- | 00031 | - | Качест- | Значительный рост (2) | Колонии с чер- | |||||||
Селек- | Escherichia coli | 00012 или 00013 | - | Качест- | Рост или частичное ингибирование (0-1) | Желтые колонии | ||||||||||||
Enterococcus faecalis | 00009 или 00087 | - | Качест- | Полное ингибирование (0) | - | |||||||||||||
Многоцелевые среды | ||||||||||||||||||
BPW | L | Разбавитель для подсчета всех микро- | ISO 6887 | Разведение | 45 мин - 1 ч/ | Escherichia coli | 00012 или 00013 | TSA | Количест- | ±30% колоний/ | - | |||||||
Staphylococcus aureus | 00034 | |||||||||||||||||
Предваритель- | ISO 19250 | Производи- | (18±2) ч/ | Salmonella Typhimuri- | 00031 | - | Качест- | Мутность (1-2) | - | |||||||||
Salmonella Enteritidis | 00030 | |||||||||||||||||
Контрольные среды для подсчета микроорганизмов | ||||||||||||||||||
BCYE | S | Подсчет колоний | ISO 11731 и ISO 11731-2 | Производи- | 2-5 сут/ | Legionella pneumophila | 00107 | Партия среды BCYE уже валиди- | Количест- | P | Бело-серо-сине- | |||||||
TSA | S | Подсчет колоний | - | Производи- | В соответствии с методом, в котором TSA используют в качестве контрольной среды | Escherichia coli | 00012 | Партия среды TSA уже валиди- | Количест- | P | Колонии, характерные для каждого вида | |||||||
Clostridium Perfringens | 00007 | |||||||||||||||||
Pseudomonas Aeruginosa | 00024 | |||||||||||||||||
Enterococcus faecalis | 00087 | |||||||||||||||||
| ||||||||||||||||||
________________
* Текст документа соответствует оригиналу. - .
Таблица F.2 - Аббревиатуры питательных сред, приведенных в таблице F.1
Аббревиатура среды | Полное наименование среды | Соответствующий международный стандарт |
BCYE | Буферная агаровая среда с активированным углем и дрожжевым экстрактом | ISO 11731 и ISO 11731-2 |
Bolton | Бульон Болтона | ISO 17995 |
BPW | Буферная пептонная вода | ISO 6887 ISO 19250 |
DRCM | Дифференциальная усиленная среда для клостридий | ISO 6461-1 |
GVPC | Буферная агаровая среда с активированным углем, дрожжевым экстрактом, глицином, ванкомицином, полимиксином В и циклогексимидом | ISO 11731 и ISO 11731-2 |
Lactose TTC | Лактозная агаровая среда с трифенилтетразолия хлоридом и гептадецилсульфатом натрия | ISO 9308-1 |
mCCDA | Модифицированный агар с активированным углем, цефоперазоном и дезоксихолатом | ISO 17995 |
mCP | Мембранная агаровая среда для Clostridium perfringens | Директива Совета 98/83/EC |
MUD/SF | Среда с 4-метилумбеллиферил- | ISO 7899-1 |
MUD/EC | Среда с 4-метилумбеллиферил- | ISO 9308-3 |
Preston | Бульон Престона | ISO 17995 |
Pseudomonas CN | Агар с цетримидом и налидиксовой кислотой для Pseudomonas | ISO 16266 |
RVS | Соевый пептонный бульон Раппапорта-Вассилиадиса | ISO 19250 |
Slanetz and Bartley | Среда Сланеца и Бартли | ISO 7899-2 |
Sulfite Iron | Агар с сульфитом железа | ISO 6461-2 |
Tryptose Sulfite (TS) | Агар с триптозой и сульфитом | ISO 6461-2 |
TSA | Триптонный соевый агар | - |
TSC | Агар с триптозой, сульфитом и циклосерином (без яичного желтка) | ISO 14189 |
XLD | Агар с ксилозой, лизином и дезоксихолатом | ISO 19250 |
YEA | Агар с дрожжевым экстрактом | ISO 6222 |
Приложение G
(обязательное)
Использование контрольных графиков для мониторинга количественных испытаний плотных питательных сред
G.1 Общие положения
Настоящее приложение содержит описание применения контрольных графиков для мониторинга результатов, в частности тех, которые выражены в виде коэффициента производительности P, как это описано в 7.2, при испытаниях селективных и неселективных агаровых сред по сравнению с подходящими неселективными эталонными агаровыми средами или предварительно принятыми партиями той же селективной агаровой среды.
Необходимо внимательно применять контрольные графики в случае испытаний различных партий одного и того же агара, так как любое ухудшение качества последовательных партий может быть незаметно до тех пор, пока испытуемые суспензии не будут тщательно контролироваться в плане получения требуемого количества микроорганизмов или не будут применяться эталонные среды (см. 3.4.6). Любая система QC среды, основанная на проверках от партии к партии, должна быть проверена на пригодность для цели предназначения перед ее использованием.
Каждый источник и партия испытуемого агара, вероятнее всего, продемонстрируют различные уровни производительности, и отдельные лаборатории могут использовать различные виды эталонного агара в сравнительных испытаниях с испытуемыми видами агара. Таким образом, отдельные лаборатории должны установить и обосновать свои собственные пределы и/или диапазоны приемлемых значений коэффициента производительности для каждого испытуемого агара при повседневном использовании в пределах значений коэффициента производительности, указанных в 7.2.2.1.2. Контрольные графики составляют на основе начальных данных валидации, пределы приемлемости устанавливают при использовании статистического анализа и затем графики используют для мониторинга последовательных партий агара. Пределы приемлемости пересматривают периодически (например, после прохождения каждых 30 испытаний) и при необходимости корректируют (соответствующая информация приведена в G.2.6).
Данные процедуры требуют использования микробной суспензии с известной концентрацией целевого штамма, установленного для питательной среды в приложении Е или F; это целевое значение для испытания. Испытуемой суспензией должна быть коммерческая эталонная среда (см. 3.4.6) или суспензия, приготовленная в лаборатории из тщательно стандартизованных рабочих культур эталонных штаммов. В течение периода использования концентрация микроорганизмов в лабораторной суспензии (целевое число) должна быть стабильной и суспензия должна быть гомогенной.
В целях оптимизации контроля данные суспензии должны содержать приблизительно 100 КОЕ (диапазон должен быть от 80 до 120 КОЕ) в объеме инокулята, который применяют к питательной среде в чашке, и испытание, как правило, проводят по меньшей мере дважды. В таблице 1 (см. 5.4.2.5.1) приведены значения прецизионности при различных уровнях инокулирования с тем, чтобы показать важность сохранения данного оптимального уровня инокулята.
Слои агара инокулируют методами распределения, добавления или мембранной фильтрации в соответствии с эталонным стандартным методом, в котором применяют агар, и инкубируют в условиях, установленных в конкретных стандартах.
Колонии, присутствующие на или в каждом слое, подсчитывают в соответствии с эталонными стандартными методами, а коэффициенты производительности рассчитывают согласно 7.2.1.1.
G.2 Применение контрольных графиков
G.2.1 Общие методики
Для составления нового контрольного графика необходимо провести не менее 10 испытаний на различных партиях одного и того же испытуемого агара, желательно в двух повторностях, проводя испытания в разные дни и с участием различных операторов (условия межлабораторной воспроизводимости). Проведение 20 испытаний (как это показано в методике в G.2.2) позволит получить более надежные значения пределов, и, таким образом, график, на котором обозначены 10 начальных испытаний (минимальное количество), необходимо пересчитать, когда станут доступны данные о 20 результатах. Индивидуальные графики используют на постоянной основе с не менее 30 испытаниями для каждой повторяющейся оценки текущего качества сред (см. G.2.6).
G.2.2 Составление контрольных графиков
Данная методика основана на стандартном инокуляте, содержащем (100±20) КОЕ в 0,1 см инокулята, используемого для испытания, проводимого методом распределения по слою. Она также пригодна при использовании других объемов инокулята и при других методах посева, таких как глубинный посев или мембранная фильтрация, при условии, что инокулят содержит количество колониеобразующих единиц, лежащее в диапазоне приемлемости - (100±20) КОЕ.
Среднее значение двух серий дублей при испытании i равно х КОЕ/0,1 см
для испытуемой среды и y
КОЕ/0,1 см
для контрольной среды. Далее, коэффициент производительности при испытании i равен х
/y
=r
. Для серии испытаний, i =1, 2, ..., n, где n - минимум равно 10 и желательно, чтобы было равно 20, среднее значение коэффициента производительности
вычисляют по формуле:
![]() . (G.1)
. (G.1)
Средний диапазон значений коэффициента производительности вычисляют по формуле:
![]() , (G.2)
, (G.2)
где i - номер испытания;
n - общее количество испытаний;
- значение P
при i-испытании.
Далее определяют стандартное отклонение s по формуле:
![]() . (G.3)
. (G.3)
Примечание - Константа 0,8865 (или обратное ей число 1,128) - стандартизованное значение, рекомендуемое ASTM для определения стандартного отклонения из среднего диапазона дублированных значений результатов испытаний.
Рассчитывают 95% (±2s) и 99% (±3s) пределы распределения результатов.
На оси у контрольного графика отмечают общее среднее значение P,
, и каждый из двух верхних (+2s и +3s) и двух нижних (-2s и -3s) пределов; затем чертят линии, параллельные оси х. Результаты каждого индивидуального значения P
для испытаний, i=1, 2, ..., n наносят на ось х (см. пример).
Каждый раз, когда готовят новую партию среды, проводят ее испытания с использованием стандартной суспензии инокулята, и величину P рассчитывают как отношение количества колониеобразующих единиц, подсчитанных после инкубирования на испытуемой и эталонной средах, как это описано выше. Данное значение наносят на контрольный график и проверяют на соответствие установленным пределам.
G.2.3 Рабочий пример составления контрольного графика при наличии 20 результатов
В таблице G.1 приведены результаты 20 последовательных проверок коэффициента производительности на партиях одного и того же испытуемого неселективного агара при использовании стандартного инокулята с содержанием микроорганизмов 110 КОЕ/0,1 см, подсчитанных на эталонной неселективной среде (фактические значения при подсчете на эталонной среде будут отличаться от данного значения на практике, однако эти данные используются для демонстрации принципа составления контрольных графиков только на основе рассчитанных коэффициентов производительности).
Таблица G.1 - Данные, касающиеся 20 последовательных проверок коэффициента производительности на неселективном агаре, используемые для составления контрольного графика (приведены фактические значения, полученные при подсчете только на испытуемом агаре; значения подсчета на эталонной среде, y, во всех случаях равны 110 КОЕ)
Результаты испытаний | ||||||||||
i | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
КОЕ (испытуемый агар), х | 95 | 102 | 94 | 97 | 105 | 68 | 98 | 105 | 103 | 116 |
0,86 | 0,93 | 0,85 | 0,88 | 0,95 | 0,62 | 0,89 | 0,95 | 0,94 | 1,05 | |
| - | 0,07 | 0,08 | 0,03 | 0,07 | - | 0,06 | 0,06 | 0,01 | 0,11 |
Результаты испытаний | ||||||||||
i | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
КОЕ (испытуемый агар), х | 95 | 90 | 89 | 116 | 114 | 110 | 114 | 98 | 88 | 102 |
0,86 | 0,82 | 0,81 | 1,05 | 1,04 | 1,00 | 1,04 | 0,89 | 0,80 | 0,93 | |
| 0,19 | 0,04 | 0,01 | 0,24 | 0,01 | 0,04 | 0,04 | 0,15 | 0,09 | 0,13 |
Важно заметить, что нижний результат испытания 6 в данном примере для неселективного агара оказался ниже значения допустимого диапазона, установленного для допустимых значений P от 0,70 до 1,40 для неселективного агара (см. 7.2.2.1.2), и все подобные результаты следует исключить как резко отклоняющиеся при определении среднего и стандартного отклонения для контрольного графика.
Причины, по которым результаты испытаний по определению P выходят за допустимый диапазон, необходимо исследовать, поскольку они часто связаны с ненадлежащим проведением испытания, а не с тем, что качество питательной среды низкое. Это часто происходит, когда используемый инокулят содержит количество КОЕ, выпадающее из установленного диапазона от 80 до 120 КОЕ.
Среднее значение P вычисляют по формуле:
![]() . (G.4)
. (G.4)
(Оно показано на рисунке G.1 сплошной линией.)
Значения диапазона ![]() определяют абсолютную разницу последовательных значений, за исключением случая, когда значение исключают (например, в испытании 6 таблицы G.1), т.е.:
определяют абсолютную разницу последовательных значений, за исключением случая, когда значение исключают (например, в испытании 6 таблицы G.1), т.е.: ![]() ;
; ![]() ;
; ![]() и т.д.
и т.д.
Средний диапазон вычисляют по формуле:
![]() . (G.5)
. (G.5)
Таким образом, стандартное отклонение s=0,8865·0,08=0,071.
95-процентные доверительные пределы (показаны на рисунке G.1 пунктирными линиями с короткими черточками) равны:
![]() . (G.6)
. (G.6)
98-процентные доверительные пределы (показаны на рисунке G.1 пунктирными линиями с длинными черточками) равны:
![]() . (G.7)
. (G.7)
Обозначения:
Y - коэффициент производительности P;
X - номер испытания
Рисунок G.1 - Контрольный график, составленный на основе значений коэффициента производительности, полученных в результате первых 20 проверок, приведенных в таблице G.1 (результат испытания 6, являющийся резко отклоняющимся значением, исключен)
G.2.4 Оценка эксплуатационных характеристик и интерпретация результатов
Партию питательной среды принимают, если выполнены критерии общего (см. 6.2) и микробиологического качества.
Новую партию среды отклоняют, если в процессе проведения количественных испытаний, выполненных как это описано выше, получают любые из перечисленных ниже результатов, когда ситуация "выходит из-под контроля":
- выход за пределы ±3s;
- результаты двух из трех наблюдений подряд превышают пределы ±2s;
- шесть наблюдений подряд демонстрируют неуклонное увеличение или уменьшение;
- девять наблюдений подряд располагаются на одной и той же стороне от среднего значения.
Примечание - Критерий на основе четырех наблюдений подряд, когда уровень ±1s превышен, может также быть важным, так как свидетельствует о существовании проблемы.
G.2.5 Альтернативные подходы к мониторингу эксплуатационных свойств сред
Методика использования контрольных графиков для мониторинга эксплуатационных свойств сред, приведенная выше, специально составлена для нанесения значений P без трансформирования подсчета колоний в единицы log
.
Допустимо использование альтернативных подходов, основанных на непосредственном нанесении значений подсчета колоний или подсчета колоний в единицах log, если они демонстрируют приемлемость. Методы проверки, соответствует ли распределение данных подсчета колоний нормальному или нет без трансформации log
, с использованием теста Колмогорова-Смирнова или теста хи-квадрат, а также соответствующие практические примеры приведены в [39].
Вместе с тем следует заметить, что если в подсчеты не включен коэффициент разбавления, то маловероятно, что будет уместной трансформация log. Конвертирование непосредственного подсчета (например, 100 КОЕ на чашку) должно предполагать использование распределения Пуассона, для которого трансформация подсчета х равна
. Более того, в любой ситуации, когда подсчеты колоний наносят непосредственно, важно гарантировать, чтобы уровень микроорганизмов в испытуемом инокуляте оставался постоянным в процессе проведения испытаний, иначе это приведет к получению недостоверных результатов.
G.2.6 Периодический пересмотр контрольных графиков
Первый и последующие контрольные графики для среды, проходящей отдельные испытания, должны периодически пересматриваться с целью гарантирования того, что установленные пределы остаются приемлемыми при составлении графиков в любое время. Первый график, содержащий минимум 20 значений данных, пересматривают с целью установления первоначальных пределов, и затем последующие графики можно пересматривать с определенной частотой при наличии каждых 30 значений данных по методике, приведенной ниже (в данном подпункте).
Как только контрольный график составлен полностью, снова рассчитывают среднее значение и стандартное отклонение s, исключая результаты, которые не попадают в установленный диапазон или пределы. При использовании трансформации log все расчеты проводят, используя результаты, трансформированные в единицы log
.
Стандартное отклонение текущего графика сравнивают со стандартным отклонением всех предыдущих результатов, s и проверяют на вариации, используя следующий критерий:
 , (G.8)
, (G.8)
где F (0,975; n-1, n-1) - значение F испытания при вероятности
=0,025 при количестве наблюдений n величины s, и количестве наблюдений n
величины s
.
Вариации значительно увеличиваются, когда s не удовлетворяет данному критерию, в таком случае необходимо выяснить возможную причину данного факта.
В случае, когда стандартное отклонение составленного контрольного графика соответствует данному критерию, для составления следующего контрольного графика эти данные объединяют с результатами предыдущих наблюдений [в качестве примера для вычислений см. формулу (G.9)].
Кроме того, сравнивают среднее значение текущего графика со средним значением всех предыдущих наблюдений
и проверяют, выполняется ли следующий критерий:
 , (G.9)
, (G.9)
где - среднее значение текущего контрольного графика;
- среднее значение всех предыдущих контрольных графиков;
s - стандартное отклонение контрольного графика;
s - стандартное отклонение всех предыдущих контрольных графиков;
n - общее количество наблюдений текущего контрольного графика;
n - общее количество наблюдений всех предыдущих контрольных графиков.
Если среднее значение текущего контрольного графика соответствует данному критерию, эти данные объединяют с данными предыдущих наблюдений для составления следующего контрольного графика.
В случае, когда данный критерий не выполняется, выясняют возможную причину этого. Если причину установить не удается, составляют новый контрольный график и устанавливают новые пределы, основанные на предыдущих наблюдениях, путем пересчета пределов для среднего значения и стандартного отклонения для всех наблюдений.
Пример вычислений:
Примеры данных приведены в таблице G.2, они касаются трех контрольных графиков, каждый из которых содержит 30 результатов наблюдений. Значения x, s
и s
относятся к обобщенным данным из графиков 1 и 2.
Значение одного наблюдения во втором графике (номер 22, выделено курсивом) превышает предел приемлемости, установленный лабораторией на основе ее собственных данных. Таким образом, данное значение не используют в расчетах.
Таблица G.2 - Значения результатов испытаний в рамках трех контрольных графиков для оценки и сравнения с пределами, установленными лабораторией (см. [39])
Результаты испытаний | ||||||||||
Измерения | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
График 1 | 100 | 77 | 108 | 75 | 83 | 92 | 70 | 81 | 90 | 88 |
График 2 | 74 | 81 | 60 | 66 | 109 | 83 | 73 | 82 | 74 | 89 |
График 3 | 89 | 75 | 67 | 63 | 90 | 77 | 90 | 75 | 53 | 91 |
Результаты испытаний | ||||||||||
Измерения | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
График 1 | 78 | 82 | 90 | 95 | 75 | 86 | 100 | 98 | 75 | 92 |
График 2 | 80 | 83 | 95 | 71 | 98 | 74 | 76 | 92 | 84 | 88 |
График 3 | 99 | 74 | 88 | 68 | 100 | 81 | 97 | 89 | 80 | 71 |
Результаты испытаний | ||||||||||
Измерения | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
График 1 | 74 | 80 | 98 | 79 | 82 | 91 | 78 | 90 | 65 | 60 |
График 2 | 67 | 130 | 97 | 98 | 64 | 85 | 101 | 73 | 67 | 82 |
График 3 | 63 | 84 | 82 | 84 | 99 | 79 | 86 | 70 | 72 | 98 |
Расчеты значений для каждого графика | ||||||||||
s | s | x | s | s | Расчеты значений на основе обобщения значений, относящихся к графикам 1 и 2 | |||||
График 1 | 84,4 | 11,1 | 122,7 | 83,0 | 11,7 | 136,1 | ||||
График 2 | 81,6 | 12,3 | 150,8 | - | - | - | ||||
График 3 | 81,1 | 12,1 | 147,5 | - | - | - | ||||
В результате проверки вариаций значений стандартного отклонения путем сравнения значения стандартного отклонения s графика 3 со значениями стандартных отклонений первых двух графиков (s) был получен следующий результат:
 . (G.10)
. (G.10)
Критическое значение F (0,975; 29,58)=1,83. Наблюдаемое значение меньше критического, и, таким образом, не существует значительной разницы между стандартным отклонением графика 3 и графиков 1 и 2.
В результате последующей проверки того, было ли среднее значение изменено, как это описано выше для этих данных, были получены следующие результаты.
На основе данных, касающихся графика 3, было получено значение 1,9 (по формуле ![]() ), а критическое значение равно
), а критическое значение равно
![]() . (G.11)
. (G.11)
Рассчитанное для графика 3 значение меньше критического и, таким образом, не имеется существенной разницы между средним значением для графика 3 и для графиков 1 и 2.
Поскольку проверка вариаций была достоверной, данные для графика 3 объединяют с данными графиков 1 и 2 для расчета значений новых пределов. Таким образом, новый контрольный график составляют на основе среднего значения, равного 82,4 и стандартного отклонения, равного 11,80.
Приложение Н
(справочное)
Обеспечение качества питательных сред - выявление и устранение недостатков
Н.1 Сведения о видах недостатков, которые могут иметь питательные среды, а также о вероятных причинах их наличия, приведены в таблице Н.1.
Таблица Н.1
Вид недостатка | Возможная причина недостатка |
Агаровая среда не застывает | Перегрев среды во время приготовления. Низкое значение рН, приводящее к кислому гидролизу. Использована неправильная масса агара. Агар был растворен не до конца. Недостаточное перемешивание ингредиентов |
Неверное значение рН среды | Перегрев среды во время приготовления. Неудовлетворительное качество воды. Загрязнение химическими веществами извне. рН измерен при неправильной температуре. рН-метр неправильно калиброван. Неудовлетворительное качество обезвоженной (сухой) среды |
Некорректный цвет среды | Перегрев среды во время приготовления. Неудовлетворительное качество воды. Неудовлетворительное качество обезвоженной (сухой) среды. Отсутствие одного или нескольких ингредиентов. Использованы неправильные ингредиенты. Неправильное значение рН. Загрязнение извне |
Образование осадка | Перегрев среды во время приготовления. Неудовлетворительное качество воды. Неудовлетворительное качество обезвоженной (сухой) среды. Неудовлетворительный контроль рН. При приготовлении из отдельных ингредиентов - примеси в сырье |
Ингибирование среды или низкая производительность среды | Перегрев среды во время приготовления. Неудовлетворительное качество обезвоженной (сухой) среды. Неудовлетворительное качество воды. Использована неправильная рецептура, например, ингредиенты неправильно взвешены, добавки введены в неверной концентрации. В посуде, где проводится приготовление, или в воде присутствует токсичный осадок. Контрольный(е) микроорганизм(ы) приготовлен(ы) неправильно |
Недостаточная селективность или специфичность среды | Перегрев среды во время приготовления. Неудовлетворительное качество обезвоженной (сухой) среды. Использована неправильная рецептура. Неправильно осуществлено добавление ингредиентов, например, если среда была слишком горячая или неправильной концентрации. Загрязнение добавок. Контрольный(е) микроорганизм(ы) приготовлен(ы) неправильно |
Загрязнение среды | Ненадлежащая стерилизация. Неэффективные методы асептики. Загрязнение добавок |
Приложение I
(справочное)
Количественные испытания жидких сред
I.1 Общие положения
Настоящее приложение содержит описание методов количественных испытаний жидких сред, которые могут предоставить дополнительную информацию по сравнению с рабочими методами, описанными в разделе 8. Данные методы применимы главным образом для оценки сред, которые разрабатывают или используют в сравнительных исследованиях.
Качество жидкой среды в том, что касается обеспечения оптимального роста микроорганизмов, наиболее явно проявляется в течение ранней фазы роста микроорганизмов. Анализ продолжительности периода протекания лаг-фазы и роста микроорганизмов в течение ранней стадии лаг-фазы позволяет получить наиболее точную информацию о производительности и селективности целевых и нецелевых микроорганизмов как в испытуемом, так и в эталонном бульоне. Таким образом, если имеется необходимость в обнаружении лишь небольших различий в качестве питательных сред, посев штрихом из жидкой среды на поверхность плотной среды следует проводить после короткого периода инкубирования (например, продолжительностью 6 или 12 ч).
I.2 Метод количественных испытаний неселективных жидких питательных сред при помощи целевых микроорганизмов
I.2.1 Методика
- Отбирают количество пробирок, каждая из которых содержит не менее 10 см среды или 10 см
порции из каждой испытуемой партии (см. 3.1.2).
- Используют рабочие культуры (см. 5.4.2.2).
- Проводят инокуляцию целевыми микроорганизмами: испытуемый бульон и плотную эталонную среду инокулируют каждым тест-микроорганизмом; количество клеток должно быть не более 100.
- Инкубирование инокулированных сред проводят в условиях, установленных в конкретных стандартах.
- Готовят достаточное количество разведений из каждой инкубированной среды для достижения количества колоний, которое поддается подсчету (см. 5.4.2.5).
- Отмеренный объем (например, 10 мм) распределяют по поверхности неингибирующей агаровой среды в чашке Петри (см. 7.2.2.1.1).
I.2.2 Подсчет и интерпретация результатов
После инкубирования подсчитывают количество колоний в чашках (см. 7.2.2.1.1 и 7.2.2.1.2). Интерпретация результатов будет зависеть от цели испытания, например, сравнения с предыдущей партией, эталонной средой или эталонным материалом.
Концентрация целевых микроорганизмов в испытуемом бульоне должна быть в диапазоне от 10 до 10
КОЕ/см
.
I.2.3 Блок-схема для количественного метода для неселективных жидких питательных сред с применением целевых микроорганизмов
На рисунке I.1 приведена блок-схема для количественного метода для неселективных жидких питательных сред с применением целевых микроорганизмов.
Рисунок I.1 - Блок-схема для проведения эксплуатационных испытаний неселективных жидких питательных сред с применением целевых микроорганизмов (см. J.2.1 и J.2.2)
I.3 Метод количественных испытаний селективных жидких питательных сред при помощи целевых и нецелевых микроорганизмов
I.3.1 Методика
- Отбирают количество пробирок, каждая из которых содержит не менее 10 см среды или 10 см
порции из каждой испытуемой партии (см. 3.2.2).
- Используют рабочие культуры, как это описано в 5.4.2.
- Инокуляция целевыми микроорганизмами: инокулируют испытуемый бульон, эталонный бульон и плотную контрольную среду каждым тест-микроорганизмом, количество клеток должно быть не более 100. Плотную эталонную среду используют для подсчета КОЕ в инокуляте.
- Инокуляция нецелевыми микроорганизмами: инокулируют испытуемый бульон, эталонный бульон и плотную эталонную среду каждым тест-микроорганизмом, количество клеток должно быть не менее 1000.
- Инокуляция целевым и нецелевым микроорганизмами для получения смешанной культуры: для испытаний смешанных культур в селективной среде инокулируют испытуемый бульон, эталонный бульон и плотную контрольную среду целевым микроорганизмом (не более 100 клеток) и нецелевым микроорганизмом (не менее 1000 клеток) в одной и той же пробирке или на одной и той же чашке. При испытании смешанных культур распределение инокулята должно проводиться по возможности на слое неселективного агара, что позволит дифференцировать микроорганизмы смешанной культуры (например, агар с MUG для подсчета Escherichia coli или Salmonella spp.). Когда нет возможности различить смешанные культуры на неселективном агаре, необходимо использовать среды с селективным агаром при условии, что их эксплуатационные характеристики были предварительно проверены.
- Инкубируют среды в условиях, установленных в конкретных стандартах.
Отбирают отмеренный объем или при необходимости объем после разведения от каждого бульона и распределяют по поверхности слоя неингибирующего агара в случае пробирок, содержащих только целевые или только нецелевые микроорганизмы, как это описано в 8.2.2. В случае пробирок, содержащих и целевые, и нецелевые микроорганизмы, инокулят распределяют по поверхности слоя той же самой селективной среды, что использовалась выше.
Для получения количества колоний в чашках, которое поддается подсчету, допускается использовать модифицированный метод поверхностого прикапывания Miles-Misra, спиральный дозатор или иные системы прикапывания.
I.3.2 Подсчет колоний, вычисления и интерпретация результатов
На каждом слое подсчитывают колонии целевых и нецелевых микроорганизмов и рассчитывают выход по сравнению с эталонным бульоном, учитывая при этом разведения, использованные для подсчета (при необходимости). В случае смешанных культур проводят различие разных видов.
Расчеты и интерпретация зависят от цели исследования. Интерпретация результатов зависит от цели испытания, например, в том, что касается сравнения с предыдущей партией, эталонной средой или эталонным материалом.
Концентрация целевого микроорганизма должна быть в диапазоне от 10 до 10
КОЕ/см
, и данный микроорганизм должен быть преобладающим в селективной среде.
В случае смешанных культур выход целевого микроорганизма не должен быть снижен по сравнению с выходом из чистой культуры целевого микроорганизма.
I.3.3 Блок-схема для количественного метода для селективных жидких питательных сред с применением целевого и нецелевого микроорганизмов
На рисунке I.2 приведена блок-схема для количественного метода для селективных жидких питательных сред с применением целевого и нецелевого микроорганизмов.
Рисунок I.2 - Блок-схема количественного испытания селективных жидких питательных сред с применением целевых и нецелевых микроорганизмов (см. I.3.1 и I.3.2)
Приложение J
(обязательное)
Инструкции по установлению условий проведения микробиологических эксплуатационных испытаний для стандартизованных питательных сред
J.1 Область применения
Настоящее приложение предоставляет руководителям проектов рабочих групп по стандартизации инструкции по установлению микробиологических эксплуатационных критериев, методов и контрольных штаммов при создании или пересмотре международных стандартов, касающихся микробиологического анализа (микробиологии пищевых продуктов или воды).
J.2 Общие положения
Микробиологические эксплуатационные требования (эксплуатационные критерии, методы контроля и цели), применимые к стандартизованным питательным средам, должны быть включены в каждый стандарт, касающийся микробиологического анализа.
Данные эксплуатационные требования могут включать:
- заимствованные или при необходимости пересмотренные требования, приведенные в настоящем стандарте, к питательным средам, изложенным в данном приложении; или
- требования, установленные для любой новой питательной среды, в соответствии с нормами, изложенными в данном приложении.
Примечание - Данное установление условий к требованиям проведения микробиологических эксплуатационных испытаний не распространяется на реактивы или среды для подтверждения.
J.3 Эксплуатационные критерии, методы и цели
Оцениваемые критерии (производительность, селективность, специфичность), используемые методы испытаний (качественные и количественные) и поставленные цели должны быть установлены в соответствии с характеристиками каждой питательной среды, как это показано в таблице J.1.
Критерии для питательных сред могут быть следующими:
- форма среды (бульон, агар);
- состав среды (селективная, неселективная);
- функция среды в стандартизованном методе (среда для обогащения, среда для разведения, среда для выявления, среда для подсчета).
Таблица J.1
Среда | Критерий и метод испытания |
Селективный бульон для подсчета | Производительность (метод: количественный) Селективность (качественный) |
Селективный агар для подсчета | Производительность (количественный) Селективность (качественный) Специфичность (качественный) |
Селективный бульон для обогащения | Производительность (качественный) Селективность (качественный) |
Селективный агар для выявления | Производительность (качественный) Селективность (качественный) Специфичность (качественный) |
Неселективный агар для подсчета | Производительность (количественный) |
Неселективный бульон для обогащения | Производительность (качественный) |
Неселективный бульон для разведения | Производительность (количественный) |
Неселективный агар для выявления | Производительность (качественный) |
1 Производительность: целью данного эксплуатационного критерия является проверка способности к удовлетворительному росту целевых штаммов (и морфологии колоний) на агаровых средах.
Цель: результат должен быть равен 2 (удовлетворительный рост) для инокулята с не более 100 КОЕ целевого микроорганизма (см. 8.4.1).
Цель: Значение P Колонии целевого микроорганизма должны иметь характерный внешний вид.
Цель: Не менее 10 колоний целевого микроорганизма наблюдают на селективной среде для выделения, используемой для выявления после инокуляции не более 100 КОЕ.
Цель: результат должен быть равен 2 (удовлетворительный рост) для целевого микроорганизма. Колонии целевого микроорганизма должны иметь характерный внешний вид.
Цель: для разбавителей количество микроорганизмов после периода контактирования должно быть в пределах ±30% от первоначального количества. 2 Селективность: целью данного эксплуатационного критерия является проверка того, что мешающие (нецелевые) штаммы частично или полностью подавляются селективной средой.
Цель: испытуемые (нежелательные) микроорганизмы должны полностью подавляться.
Цель: испытуемые (нежелательные) микроорганизмы должны частично или полностью подавляться.
Цель: нежелательные микроорганизмы на неселективной агаровой среде, используемой для выявления, не должны проявлять никакого роста или их количество должно быть менее 10 КОЕ. 3 Специфичность: целью данного эксплуатационного критерия является проверка того, что мешающие (нецелевые) штаммы, которые не подавлены, не производят характерных колоний.
Цель: колонии испытуемых нецелевых штаммов не имеют характерный внешний вид целевых микроорганизмов в стандартизованном методе. Данные критерии должны быть верифицированы при соблюдении стандартизованных температуры и периода времени инкубирования. | |
J.4 Выбор эксплуатационных контрольных штаммов
J.4.1 Общие положения
Цели различных эксплуатационных критериев и область применения стандартизованных методов должны определить выбор контрольных штаммов:
- целевых штаммов (производительность), выявленных и подсчитанных в рамках данного метода, и
- нецелевых штаммов (селективность, специфичность), являющихся мешающей флорой, которая обычно присутствует в анализируемых пробах.
Необходимо по возможности использовать контрольные штаммы, описанные в приложениях Е и F, которые уже были испытаны на данной среде.
При наличии соответствующего обоснования (генетическая нестабильность, недостаточная воспроизводимость результатов на предыдущих штаммах QC и т.п.) руководитель проекта может внести предложение по модификации требуемых штаммов в соответствии с инструкциями данного подраздела.
J.4.2 Оценка пригодности новых контрольных штаммов
Перед использованием новых штаммов их пригодность для использования в эксплуатационных испытаниях необходимо проверить и задокументировать. Это требует демонстрации воспроизводимости эксплуатационного контроля в не менее двух (а предпочтительно трех) независимых лабораториях при использовании двух или трех различных партий продукции со стандартизованной рецептурой или от различных производителей в каждой лаборатории.
J.4.3 Новые среды
Для каждой новой среды контрольные штаммы должны быть:
- предпочтительно отобранными из тех, которые уже описаны в приложениях Е и F;
- предварительно оценены и проверены на пригодность (см. J.4.2);
- или введены заново при следующих условиях:
- они предпочтительно должны иметь пищевое происхождение или быть получены из проб воды;
- они должны быть доступны из не менее двух международных коллекций штаммов (взаимно эквивалентных), по приемлемой цене;
- они должны быть предварительно оценены и проверены на пригодность (см. J.4.2).
J.4.4 Количество штаммов, используемых в соответствии с данным микробиологическим эксплуатационным критерием
Сноска а к таблице J.1 - Качественная производительность (жидкая среда): см. 8.4.
Два целевых штамма: штамм типа А и штамм типа В.
Тип А: штамм, испытываемый при эксплуатационном контроле качества производителем среды и конечным пользователем.
Тип В: штамм, требуемый для испытаний только производителем среды.
Сноска b к таблице J.1 - Количественная производительность (агаровая среда): см. 7.2.1.1.
Два целевых штамма: штамм А и штамм В.
Сноска с к таблице J.1 - Качественная производительность (жидкая среда): см. 8.3.
Два целевых штамма: штамм А и штамм В, каждый из которых ассоциирован с двумя нецелевыми штаммами.
Сноска d к таблице J.1 - Качественная производительность (агаровая среда): см. 7.4.
Два целевых штамма: штамм А и штамм В.
Сноска е к таблице J.1 - Количественная производительность (жидкая среда): см. 8.2.
Два целевых штамма: штамм А и штамм В.
Сноска f к таблице J.1 - Качественная селективность (жидкая среда): см. 8.3.
Два нецелевых штамма: штамм А и штамм В.
Сноска g к таблице J.1 - Качественная селективность (агаровая среда): см. 7.4.
Два нецелевых штамма: штамм А и штамм В.
Сноска h к таблице J.1 - Качественная селективность (жидкая среда): см. 8.3.
Два нецелевых штамма: штамм А и штамм В.
Сноска i к таблице J.1 - Качественная специфичность (агаровая среда): см. 7.4.
Один нецелевой штамм: штамм А.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 6887-1 | - | * |
ISO 6887-2 | - | * |
ISO 6887-3 | - | * |
ISO 6887-4 | - | * |
ISO 6887-5 | - | * |
ISO 6887-6 | - | * |
ISO 7704 | - | * |
ISO 7218 | IDT | ГОСТ ISO 7218-2011 "Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям" |
ISO 8199 | - | * |
* Соответствующий межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Официальный перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов Российской Федерации. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: - IDT - идентичный стандарт. | ||
Библиография
[1] ISO 9000, Quality management systems - Fundamentals and vocabulary
[2] ISO 9001, Quality management systems - Requirements
[3] ISO Guide 30:1992/Amd.1:2008, Terms and definitions used in connection with reference materials - Amd.1: Revision of definitions for reference materials and certified reference materials
[4] ISO 6222, Water quality - Enumeration of culturable micro-organisms - Colony count by inoculation in a nutrient agar culture medium
[5] ISO 3696, Water for analytical laboratory use - Specification and test methods
[6] ISO 2859-1, Sampling procedures for inspection by attributes - Part 1: Sampling schemes indexed by acceptance quality limit (AQL) for lot-by-lot inspection
[7] ISO/TS 22117, Microbiology of food and animal feeding stuffs - Specific requirements and guidance for proficiency testing by interlaboratory comparison
[8] Nordic Committee on Food Analysis (NMKL) Procedure no 10, 2002, Control of microbiological media
[9] Australian Society for Microbiology. Guidelines for assuring quality of food and water microbiological culture media. Second Edition, 2014
[10] European Pharmacopoeia. 2010 7th ed, Council of Europe, France. Chapters 2.6.12 and 2.6.13
[11] United States Pharmacopoeia. 2011, 35th ed, The United States Pharmacopoeial Convention, USA. Chapter 1117. Microbiological Best Laboratory Practice
[12] DIN 58942-4:2003, Medical Microbiology - Culture media - Transport systems for specimen containing bacteria
[13] DIN 58942-4, Suppl. 1:2003, Medical Microbiology - Culture Media - Systems, media and conditions for the transport of selected pathogens in clinical specimens
[14] DIN 58959-6, Suppl. 1:1997, Quality management in medical microbiology - Requirements for control strains - Examples for production and preservation of bacteria used as stock cultures and working cultures
[15] DIN 58959-6, Suppl. 2:1997, Quality management in medical microbiology - Requirements for control strains - Examples for production and preservation of fungi used as stock cultures and working cultures
[16] DIN 58959-9, Suppl. 1:1997, Quality management in medical microbiology - Requirements for the use of control strains for testing culture media - Control strains for commonly used culture media
[17] DIN 58959-9, Suppl. 2:1997, Quality management in medical microbiology - Requirements for the use of control strains for testing culture media - Maximum storage times for ready-to-use culture media
[18] DIN 58959-10:1997, Quality management in medical microbiology - Requirements for the use of control strains for testing reagents, dyes and biological materials
[19] DIN 58959-10, Suppl. 1:1997, Quality management in medical microbiology - Requirements for the use of control strains for testing reagents, dyes and biological materials - Control strains for commonly used materials
[20] World Data Centre for Microorganisms. Reference Strain Catalogue pertaining to organisms for performance testing of culture media. Available (viewed 2013-10-14) at http://www.wfcc.info
[21] Corry J.E.L., Curtis G.D.W., Baird R.M. eds. Handbook of Culture Media for Food and Water Microbiology. Royal Society of Chemistry, UK, Third Edition, 2012
[22] Curtis G.D.W,. Baird R.M., Skovgaard N.P., Corry J.E.L. Int. J. Food Microbiol. 1998, 45 p.65 [A statement from the IUMS-ICFMH working party on culture media II]
[23] Bell C., Neaves P., Williams A.P. Food Microbiology and Laboratory Practice. Blackwell Science, Oxford, 2005
[24] Hagemann J.H. et al. Single, chemically defined sporulation medium for Bacillus subtilis. J. Bacteriol. 1984, 160 pp.438-441
[25] Sharma V.K., & Hobson P.N. A sporulation medium for strict anaerobes. Lett. Appl. Microbiol. 1985, 1 pp.31-32
[26] Jarvis B. Statistical aspects of the microbiological examination of foods. Academic Press, London, Second Edition, 2008
[27] Cundell A.M., Chatellier S., Schumann P., Lilischkis R. Equivalence of quality control strains of microorganisms used in the compendial microbiological tests: are national culture collection strains identical? PDA J. Pharm. Sci. Technol. 2010, 64 pp.137-155
[28] Cross L.J., Russell J.E., Desai M. Examining the genetic variation of reference microbial cultures used within food and environmental laboratories using fluorescent amplified fragment length polymorphism analysis. FEMS Microbiol. Lett. 2011, 321 (2) pp.100-106
[29] Schijven J.F., Havelaar A.H., Bahar M. A simple and widely applicable method for preparing homogeneous and stable quality control samples in water microbiology. Appl. Environ. Microbiol. 1994, 60 (11) pp.4160-4162
[30] Araujo R., Rodrigues A.G., Pina-Vaz С. A fast practicable and reproducible procedure for standardization of the cell density of an Aspergillus inoculums. J. Med. Microbiol. 2004, 53 pp.783-786
[31] Wesche M. et al. Stress, sublethal injury, resuscitation, and virulence of bacterial foodborne pathogens. J. Food Prot. 2009, 72 (5) pp.1121-1138
[32] Kell DB et al. 1998, Viability and activity in readily culturable bacteria: a review and discussion of the practical issues. A v Leeuwenhoek 73 pp.169-187
[33] Rowan N.J. Viable but non-culturable forms of food and waterborne bacteria: Quo Vadis? Trend Food Sciences. 2004, 15 pp.462-467
[34] ISO 5725-6, Accuracy (trueness and precision) of measurement methods and results - Part 6: Use in practice of accuracy values
[35] Garrity G.M. ed. et al. Bergey's Manual of Systematic Bacteriology. 2nd ed. Springer, New York, NY, USA, 2001-2012
[36] American Type Culture Collection. Bacterial Culture Guide. Manassas, VA, USA, 2012
[37] American Type Culture Collection. Preservation and recovery of filamentous fungi. Tech. Bull. No 2 Manassas, VA, USA, 2011
[38] American Type Culture Collection. Reference strains - How many passages are too many? Tech. Bull, No 6 Manassas, VA, USA, 2011
[39] NEN 6603, Environmental and Food - Internal quality control by the use of control charts with chemical and microbiological analysis
[40] ISO 4831, Microbiology of food and animal feeding stuffs - Horizontal method for the detection and enumeration of coliforms - Most probable number technique
[41] ISO 4832, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coliforms - Colony-count technique
[42] ISO 4833, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of micro-organisms - Colony-count technique at 30°C
[43] ISO 6461-1, Water quality - Detection and enumeration of the spores of sulfite-reducing anaerobes (Clostridia) - Part 1: Method by enrichment in a liquid medium
[44] ISO 6461-2, Water quality - Detection and enumeration of the spores of sulfite-reducing anaerobes (Clostridia) - Part 2: Method by membrane filtration
[45] ISO 6579, Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Salmonella spp.
[46] ISO 6579:2002/Amd.1:2007, Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Salmonella spp. - Amendment 1: Annex D: detection of Salmonella spp. in animal faeces and in environmental samples from the primary production stage
[47] ISO 6888-1, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) - Part 1: Technique using Baird - Parker agar medium
[48] ISO 6888-2, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) - Part 2: Technique using rabbit plasma fibrinogen agar medium
[49] ISO 6888-3, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) - Part 3: Detection and MPN technique for low numbers
[50] ISO 7251, Microbiology of food and animal feeding stuffs - Horizontal method for the detection and enumeration of presumptive Escherichia coli - Most probable number technique
[51] ISO 7899-1:1998, Water quality - Detection and enumeration of intestinal enterococci - Part 1: Miniaturized method (Most Probable Number) for surface and waste water
[52] ISO 7899-2, Water quality - Detection and enumeration of intestinal enterococci - Part 2: Membrane filtration method
[53] ISO 7932, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of presumptive Bacillus cereus - Colony-count technique at 30 degrees С
[54] ISO 7937, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of Clostridium perfringens - Colony-count technique
[55] ISO 9308-1, Water quality - Enumeration of Escherichia coli and coliform bacteria - Part 1: Membrane filtration method for waters with low bacterial background flora
[56] ISO 9308-2, Water quality - Enumeration of Escherichia coli and coliform bacteria - Part 2: Most probable number method
[57] ISO 9308-3:1998, Water quality - Detection and enumeration of Escherichia coli and coliform bacteria - Part 3: Miniaturized method (Most Probable Number) for the detection and enumeration of E. coli in surface and waste water
[58] ISO 10272-1, Microbiology of food and animal feed - Horizontal method for detection and enumeration of Campylobacter - Part 1: Detection method
[59] ISO/TS 10272-2, Microbiology of food and animal feeding stuffs - Horizontal method for detection and enumeration of Campylobacter spp. - Part 2: Colony-count technique
[60] ISO 10272-3, Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Campylobacter spp. - Part 3: Semi-quantitative method
[61] ISO 10273, Microbiology of food and animal feeding stuffs - Horizontal method for the detection of pathogenic Yersinia enterocolitica
[62] ISO/TS 11059|IDF/RM 225, Milk and milk products - Method for the enumeration of Pseudomonas spp
[63] ISO 11290-1, Microbiology of food and animal feed - Horizontal method for the detection and enumeration of Listeria monocytogenes and other Listeria species - Part 1: Detection method
[64] ISO 11290-2, Microbiology of food and animal feed - Horizontal method for the detection and enumeration of Listeria monocytogenes and other Listeria species - Part 2: Enumeration method
[65] ISO 11731, Water quality - Enumeration of Legionella
[66] ISO 11731-2, Water quality - Detection and enumeration of Legionella - Part 2: Direct membrane filtration method for waters with low bacterial counts
[67] ISO 13720, Meat and meat products - Enumeration of presumptive Pseudomonas spp.
[68] ISO 14189, Water quality - Enumeration of Clostridium perfringens - Method using membrane filtration
[69] ISO 15213, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of sulfite-reducing bacteria growing under anaerobic conditions
[70] ISO 15214, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of mesophilic lactic acid bacteria - Colony-count technique at 30 degrees С
[71] ISO 16266, Water quality - Detection and enumeration of Pseudomonas aeruginosa - Method by membrane filtration
[72] ISO 16649-1, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of beta-glucuronidase-positive Escherichia coli - Part 1: Colony-count technique at 44 degrees С using membranes and 5-bromo-4-chloro-3-indolyl beta-D-glucuronide
[73] ISO 16649-2, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of beta-glucuronidase-positive Escherichia coli - Part 2: Colony-count technique at 44 degrees С using 5-bromo-4-chloro-3-indolyl beta-D-glucuronide
[74] ISO 16649-3, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of beta-glucuronidase-positive Escherichia coli - Part 3: Detection and most probable number technique using 5-bromo-4-chloro-3-indolyl-beta-D-glucuronide
[75] ISO 16654, Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Escherichia coli О157
[76] ISO 17995, Water quality - Detection and enumeration of thermotolerant Campylobacter species
[77] ISO 19250, Water quality - Detection of Salmonella spp.
[78] ISO 21527-1, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of yeasts and moulds - Part 1: Colony count technique in products with water activity greater than 0,95
[79] ISO 21527-2, Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of yeasts and moulds - Part 2: Colony count technique in products with water activity less than or equal to 0,95
[80] ISO 21528-1, Microbiology of food and animal feeding stuffs - Horizontal methods for the detection and enumeration of Enterobacteriaceae - Part 1: Detection and enumeration by MPN technique
[81] ISO 21528-2, Microbiology of food and animal feed - Horizontal methods for the detection and enumeration of Enterobacteriaceae - Part 2: Colony-count method
[82] ISO 21871, Microbiology of food and animal feeding stuffs - Horizontal method for the determination of low numbers of presumptive Bacillus cereus - Most probable number technique and detection method
[83] ISO/TS 21872-1, Microbiology of food and animal feeding stuffs - Horizontal method for the detection of potentially pathogenic Vibrio spp. - Part 1: Detection of Vibrio parahaemolyticus and Vibrio cholerae
[84] ISO/TS 21872-2, Microbiology of food and animal feeding stuffs - Horizontal method for the detection of potentially pathogenic Vibrio spp. - Part 2: Detection of species other than Vibrio parahaemolyticus and Vibrio cholerae
[85] European Culture Collections' Organisation (ECCO), available at http://www.ecosite.org
[86] European Council Directive 98/83/EC of 3 November 1998 on the quality of water intended for human consumption. Available (viewed 2013-10-14) at http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=О-J:L:1998:330:0032:0054:EN:PDF
[87] World Federation for Culture Collections (WFCC). Available at htpp://www.wfcc.info
УДК 664:636.084:579.67:006.354 | МКС 07.100.30 | IDT |
Ключевые слова: пищевые продукты, корма для животных, вода, питательная среда, приготовление питательных сред, производство питательных сред, хранение питательных сред, определение рабочих характеристик, эксплуатационные испытания питательных сред, качество питательных сред, микробиологический анализ, проба окружающей среды | ||
Электронный текст документа
и сверен по:
, 2016