ФЕДЕРАЛЬНОЕ АГЕНТСТВО
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ

НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТР
71580—
2024
(ИСО 20698:2018)
НАБОРЫ ДЛЯ УСТАНОВКИ НЕЙРОАКСИАЛЬНЫХ КАТЕТЕРОВ
Стерильные катетеры однократного применения и вспомогательные принадлежности к ним
(ISO 20698:2018, MOD)
Издание официальное
Москва Российский институт стандартизации 2024
ГОСТ Р 71580—2024
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Медтехстандарт» (ООО «Мед-техстандарт») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 011 «Медицинские приборы, аппараты и оборудование»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 30 августа 2024 г. № 1150-ст
4 Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 20698:2018 «Наборы для установки нейроаксиальных катетеров. Стерильные катетеры однократного применения и вспомогательные принадлежности к ним» (ISO 20698:2018 «Catheter systems for neuraxial application — Sterile and single-use catheters and accessories», MOD) путем включения дополнительных положений и замены нормативных ссылок оригинала, которые выделены в тексте курсивом.
Сведения о соответствии ссылочных национальных и межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененном международном стандарте, приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
© ISO, 2018 ©Оформление. ФГБУ «Институт стандартизации», 2024
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
ГОСТ Р 71580—2024
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................2
3 Термины и определения...............................................................2
4 Предусмотренные характеристики.......................................................3
5 Конструктивные особенности...........................................................4
6 Материалы..........................................................................5
7 Оценка проекта......................................................................5
8 Стерилизация........................................................................7
9 Упаковка............................................................................7
10 Информация, предоставляемая изготовителем...........................................7
Приложение А (обязательное) Метод испытания на коррозионную стойкость.....................9
Приложение В (обязательное) Определение скорости потока через катетер.....................10
Приложение С (обязательное) Метод испытания на утечку жидкости под давлением..............12
Приложение D (обязательное) Метод определения усилия на разрыв..........................13
Приложение Е (справочное) Другие единицы измерения.....................................14
Приложение ДА (справочное) Сведения о соответствии ссылочных национальных и межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененном международном стандарте........................15
Библиография........................................................................15
III
ГОСТ Р 71580—2024
Введение
Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 20698:2018, разработанному Техническим комитетом по стандартизации ТК 84 «Устройства для введения лекарственных препаратов и внутрисосудистые катетеры» Международной организации по стандартизации (ИСО).
Международных стандартов, охватывающих катетерные системы для нейроаксиального применения, не существовало, при этом соответствующий класс медицинских изделий очень широк и насчитывает несколько миллионов вводимых или имплантируемых катетеров в год. Для многих применений (например, когда целью являются головной мозг или позвоночник) существуют значительные клинические риски.
Повышение осведомленности о потенциальной роли несовместимых соединителей привело к сокращению числа таких инцидентов, как неправильный путь доставки лекарственных препаратов и другие неправильные соединения между медицинскими изделиями. Соединители для нейроаксиального применения описаны в ГОСТ Р ИСО 80369-6.
Настоящий стандарт разработан специально для нейроаксиального применения.
Руководство по переходным периодам внедрения требований настоящего стандарта приведено в[1].
IV
ГОСТ Р 71580—2024 (ИСО 20698:2018)
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
НАБОРЫ ДЛЯ УСТАНОВКИ НЕЙРОАКСИАЛЬНЫХ КАТЕТЕРОВ
Стерильные катетеры однократного применения и вспомогательные принадлежности к ним
Catheter systems for neuraxial application. Sterile and single-use catheters and accessories
Дата введения — 2025—05—01
1 Область применения
Настоящий стандарт устанавливает общие требования и методы испытаний для катетерных систем для нейроаксиального применения.
Настоящий стандарт определяет требования к предусмотренным функциональным характеристикам, конструктивным особенностям, материалам, оценке проекта, изготовлению, стерилизации, упаковке и информации, предоставляемой изготовителем, а также испытания для демонстрации соответствия этим требованиям.
Катетеры для нейроаксиального применения предназначены для введения лекарственных препаратов непосредственно в нейроаксиальные области, для обезболивания при инфильтрации раны и для других процедур регионарной анестезии или для мониторинга или удаления жидкости из нейроак-сиальных областей в терапевтических или диагностических целях.
Примечания
1 Области для нейроаксиального применения включают позвоночник, интратекальное или субарахноидальное пространство и эпи-, экстра- или перидуральное пространство (указанные области являются лишь примерами, а не исчерпывающим перечнем). При нейроаксиальном применении анестетики/анальгетики могут быть введены регионарно, воздействуя на большую часть тела, такую как конечность, и включать блокады сплетений, такие как блокады плечевого сплетения или блокады отдельных нервов. Процедуры при нейроаксиальном применении включают непрерывное вливание в раны местных анестетиков.
2 Местная анестезия/обезболивание с введением анестетика подкожно и системное введение анестетиков не считаются нейроаксиальными применениями.
Настоящий стандарт распространяется на изделия следующих типов:
- спинальные/эпидуральные катетерные системы;
- спинальные/эпидуральные катетерные порт-системы;
- катетерные системы для блокады периферических нервов;
- катетерные системы для вливания в рану (также известные как катетеры для непрерывной анестезии в месте операции).
Настоящий стандарт не распространяется:
- на насосы и другие изделия, предназначенные для доставки лекарственных препаратов через катетерные системы;
- катетеры, обычно предназначенные для введения в организм веществ, которые не предназначены для непосредственного взаимодействия с нервной системой, но которые оказывают косвенное воздействие на нервную систему (например, иглы-канюли);
- дренажные катетеры для любого другого применения, кроме нейроаксиального.
Издание официальное
1
ГОСТ Р 71580—2024
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ ISO 7886-1 Шприцы инъекционные однократного применения стерильные. Часть 1 Шприцы для ручного использования
ГОСТ ISO 10555-1 Катетеры внутрисосудистые однократного применения стерильные. Часть 1. Общие требования
ГОСТ ISO 10993-1 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска
ГОСТ ISO 10993-7 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации
ГОСТ ISO 11607-1 Упаковка для медицинских изделий, подлежащих финишной стерилизации. Часть 1. Требования к материалам, барьерным системам для стерилизации и упаковочным системам
ГОСТ Р ИСО 9626 Трубки игольные из нержавеющей стали для изготовления медицинских изделий. Требования и методы испытаний
ГОСТ Р ИСО 14155 Клинические исследования медицинских изделий, проводимые с участием человека в качестве субъекта. Надлежащая клиническая практика
ГОСТ Р ИСО 80369-6 Соединители малого диаметра для жидкостей и газов, используемые в здравоохранении. Часть 6. Частные требования к соединителям нейроаксиального применения
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 катетер (catheter): Трубчатое изделие, предназначенное для частичного или полного введения или имплантирования в организм для введения и/или удаления жидкостей.
3.2 дистальный конец (distal end): Конец катетера (3.1), который вводится как можно дальше в организм пациента.
3.3 канюля (hub): Соединитель(и) на проксимальном конце катетера (3.1), который является неотъемлемой частью катетера (3.1) либо надежно прикрепляется к проксимальному концу катетера (3.1).
Примечание — Проксимальный конец (proximal end) — это конец катетера, к которому может быть произведено подключение.
3.4 эффективная длина (effective length): Длина катетера (3.1), которая может быть введена в тело.
Примечание — См. рисунки 1 и 2.
3.5 функциональная длина (functional length): Длина катетера (3.1) между наконечником и наиболее проксимальным отверстием.
Примечания
1 Применяется к катетерам с боковыми отверстиями.
2 См. рисунки 1 и 2.
3.6 полная длина (total length): Общая длина катетера (3.1), включая соединитель катетера.
Примечание — См. рисунки 1 и 2.
2
ГОСТ Р 71580—2024
3.7 наружный диаметр (outside diameter): Наибольший диаметр катетера (3.1) по эффективной длине (3.4).
3.8 соединительный узел (junction): Соединение одной или нескольких трубок с остальной частью катетера (3.1 )/изделия, в которых сборка трубок обеспечивает механическую опору в растяже-нии/сжатии во время клинического использования.
3.9 стилет (stylet): Гибкое изделие внутри катетера (3.1) для облегчения введения катетера (3.1).
3.10
оценка риска (risk assessment): Полный процесс анализа риска и оценивания риска [ГОСТ ISO 14971—2021, пункт 3.20]
ti
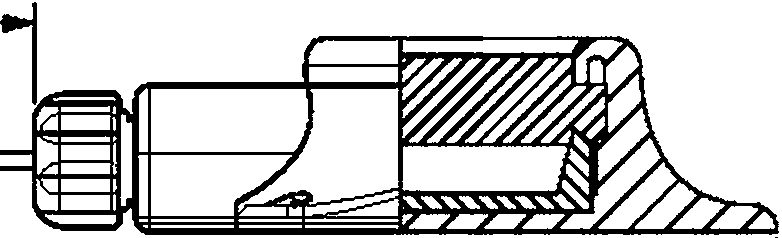
^•2
L1 — эффективная длина (3.4); L2 — полная длина (3.6); L3 — функциональная длина (3.5)
Рисунок 1 — Пример катетера для нейроаксиального применения с указанием длин и разметки — спинальный/ эпидуральный порт
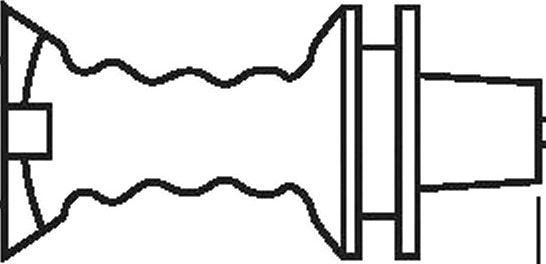
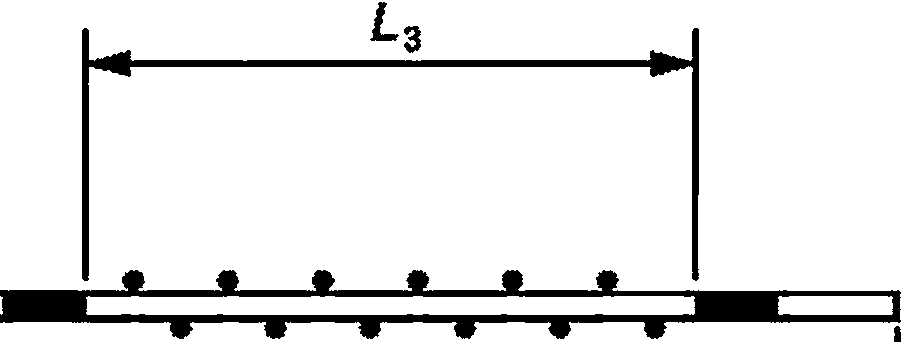
Г — эффективная длина (3.4); L2 — полная длина (3.6); L3 — функциональная длина (3.5)
Рисунок 2 — Пример катетера для нейроаксиального применения с указанием длин и разметки — катетер для вливания в рану
4 Предусмотренные характеристики
Предусмотренные характеристики катетера для нейроаксиального применения должны быть описаны и задокументированы с особым вниманием к безопасности. Должно быть учтено следующее:
а) предусмотренная цель(и).
В частности, должно быть прояснено:
- каково целевое назначение катетера и
- тип контакта с пациентом (например, полностью/частично имплантируемый, инвазивный);
Ь) функциональные характеристики;
с) предусмотренные условия использования;
d) предусмотренный срок службы и/или время имплантации, если это необходимо.
3
ГОСТ Р 71580—2024
Должно быть приведено определение характеристик скорости потока (см. также 7.2.5).
5 Конструктивные особенности
5.1 Номинальный размер катетера
5.1.1 Общие положения
Номинальный размер катетера должен быть обозначен в соответствии с 5.1.2 и 5.1.3.
5.1.2 Наружный диаметр
Если иное не указано в одном из других разделов настоящего стандарта для конкретного типа катетера, то наружный диаметр должен быть выражен как номинальный размер в миллиметрах. Дополнительно могут быть использованы единицы систем измерений, отличные от указанных (например, калибровочная шкала, определенная в приложении Е).
Примечание — Обозначение номинального размера и количества значащих цифр после запятой может быть указано в соответствии с оценкой рисков и производственными допусками.
Для изделий, которые не являются круглыми согласно конструкции, размер должен определяться размером наибольшей оси. В уместном случае изготовители могут указать дополнительную информацию, касающуюся профиля изделия, например размер второй оси для овальной формы.
5.1.3 Длина катетера
Вся длина катетера (как определено в 3.4—3.6) должна быть выражена в миллиметрах или сантиметрах.
Примечание — В настоящем стандарте не указаны допуски для всех длин.
5.2 Отверстия катетера
Конструкция, количество и расположение отверстий катетера должны быть такими, чтобы свести к минимуму неблагоприятное воздействие на катетер и травмирование тканей.
5.3 Дистальный конец
Дистальный конец должен быть гладким, закругленным, конусообразным или обработанным аналогичным образом, чтобы свести к минимуму травмирование тканей во время введения и использования катетера.
5.4 Поверхность
Наружная поверхность эффективной длины катетера, включая дистальный конец, не должна иметь технологических и поверхностных дефектов. Определение дефектов должно основываться на требованиях предусмотренного применения и оценке риска.
5.5 Канюля
Если катетер укомплектован встроенной либо отдельной канюлей, то это должна быть гнездовая канюля, которая соответствует ГОСТ Р ИСО 80369-6.
Соответствие канюль ГОСТ Р ИСО 80369-6 также применимо к любым принадлежностям, входящим в комплект поставки изделия, которые предназначены для прямого или косвенного доступа в нейроаксиальную область.
5.6 Разметка
На катетер должна быть нанесена соответствующая разметка, основанная на оценке риска и предусмотренном применении.
Примеры соответствующей разметки катетеров для различных применений приведены на рисунках 1 и 2.
5.7 Фильтр
Если в комплект входит фильтр, то должны быть указаны его технические характеристики (например, номинальный размер пор).
4
ГОСТ Р 71580—2024
5.8 Стилет
Если предусмотрен стилет, он не должен выступать из дистального конца или боковых отверстий катетера. Если предполагается, что стилет должен быть съемным, он должен быть снабжен рукояткой, позволяющей безопасно извлекать стилет из катетера.
Извлечение стилета из катетера не должно приводить к деформации при сжатии или разрыву катетера.
5.9 Способность обнаружения
Катетер или, по крайней мере, его эффективная длина должны обнаруживаться с помощью рентгеновского снимка или других средств (ультразвук, МРТ и т. д.), если этого требует оценка риска.
5.10 Фиксирующие изделия
Фиксирующее изделие (при наличии) не должно снижать скорость потока более чем на 10 % по сравнению со скоростью потока при отсутствии фиксирующего изделия.
6 Материалы
6.1 Общие положения
Материалы изделия выбирают с учетом свойств, требуемых для предусмотренного применения. При выборе также должны быть приняты во внимание последствия изготовления, обращения, стерилизации и хранения, а также любая обработка (химическая, электрохимическая, термическая, механическая и т. д.), применяемая к поверхности или части поверхности материала изделия с целью изменения его свойств. Должны быть рассмотрены возможные реакции или взаимодействия.
Если изделие содержит какие-либо металлические детали, которые могут подвергаться воздействию тканей или лекарственных препаратов, они должны быть устойчивы к коррозии (см. 7.2.4).
Если лекарственный препарат является неотъемлемой частью изделия, то этот лекарственный препарат оценивают в соответствии с фармацевтическими принципами.
6.2 Биосовместимость
Биосовместимость изделия необходимо оценивать в соответствии с ГОСТ ISO 10993-1.
6.3 Совместимость лекарственных препаратов и материалов
Материалы, используемые для изготовления катетерных систем, должны сводить к минимуму риск взаимодействия изделия с другими материалами, изделиями или веществами и газами, которые будут введены через изделие или находиться с ним в контакте.
7 Оценка проекта
7.1 Общие положения
Оценка проекта должна определять общие требования безопасности и требования к функциональным характеристикам медицинского изделия.
Следовательно, оценка проекта должна включать менеджмент риска на протяжении жизненного цикла, клиническое применение, эксплуатационную пригодность и послепродажное наблюдение. Оценка проекта должна определять методы и критерии для оценки соотношения польза/риск медицинского изделия, находящегося на стадии разработки, в процессе производства и после выхода на рынок.
7.2 Доклиническая оценка
7.2.1 Общие положения
На основе общих методов оценки проекта для каждого изделия должны быть проведены клиническая и доклиническая оценки, основанные на проверке и валидации. Доклиническая оценка должна в достаточной мере соответствовать критериям, перечисленным в настоящем пункте. Проверку и валидацию выполняют с использованием готового к применению изделия.
5
ГОСТ Р 71580—2024
Примечание - Настоящий подпункт содержит неполный перечень минимальных требований к изделиям, охватываемым настоящим стандартом.
7.2.2 Рентгеноконтрастность
Соответствие требованиям к рентгеноконтрастности, если это применимо (см. 5.9), должно быть продемонстрировано с помощью соответствующего метода испытания.
Примечание — Могут быть использованы методы испытаний, описанные в [2] или [3].
7.2.3 Совместимость с магнитным резонансом
Если применимо, опасность изделий для нейроаксиального применения в условиях магнитного резонанса должна оцениваться соответствующим методом.
Примечание — Могут быть использованы методы испытаний, описанные в [4], [5], [6] или [7].
7.2.4 Коррозионная стойкость
При испытании в соответствии с методом, приведенным в приложении А, ни на одном из им-плантируемых/инвазивных металлических компонентов изделия не должно быть видимых признаков коррозии.
Если на открытых внешних металлических компонентах изделия могут появиться видимые признаки коррозии, уровень коррозии следует оценить с учетом предусмотренного применения и оценки риска, подвергнув катетер испытанию на коррозию, описанному в приложении А.
В зависимости от оценки риска (например, предусмотренного времени контакта) вместо метода, описанного в приложении А, может быть применен более жесткий метод испытания.
Примечание — Примеры более жестких методов испытаний приведены в приложении А, ГОСТ ISO 10555-1 или [8].
7.2.5 Скорость потока
Скорость потока определяют в соответствии с приложением В.
Длина испытуемого катетера должна быть клинически значимой.
В случае, если другие характеристики потока имеют значение и указаны для катетера, они должны быть определены с помощью соответствующего метода испытания.
Примечание — Это испытание также предназначено для проверки проходимости системы.
7.2.6 Герметичность (конструкция)
Канюля или узел соединения фитингов или любая другая часть катетера не должны допускать утечку жидкости при испытании в соответствии с методом, приведенным в приложении С.
7.2.7 Усилие на разрыв
Усилие на разрыв должно быть испытано в соответствии с методом, приведенным в приложении D. Оценка минимального допустимого усилия на разрыв должна быть определена при оценке риска изделия.
Испытание на усилие на разрыв необходимо проводить для всей катетерной системы, включая, если применимо, канюлю. В качестве альтернативы каждая отдельная секция катетерной системы может быть испытана независимо. Должна быть проведена проверка как трубчатых элементов, так и мест соединения катетера.
Если в комплект входит съемный стилет, то при скорости перемещения зажимов испытательного аппарата 200 мм/мин усилие на разрыв для отделения рукоятки от стилета должно составлять не менее 15 Н.
7.2.8 Испытание на продольный изгиб катетера
Характеристики продольного изгиба катетера должны быть определены в соответствии с оценкой риска и испытаны в соответствии с применимым методом испытаний.
Примечание — Могут быть использованы методы испытаний, описанные в [9].
7.2.9 Поверхность
При осмотре нормальным или скорректированным до нормального зрением с увеличением не менее 2,5х внешняя поверхность эффективной длины катетера должна выглядеть свободной от посторонних частиц.
6
ГОСТ Р 71580—2024
7.3 Клиническая оценка
Клиническое исследование должно проводиться в соответствии с требованиями ГОСТ Р ИСО 14155.
8 Стерилизация
8.1 Общие положения
Стерильные катетерные системы для нейроаксиального применения должны иметь уровень обеспечения стерильности (SAL) 10~6. В качестве дополнения/изменения к нему следует рассмотреть следующее:
- катетерная система должна быть стерилизована соответствующим валидированным методом и должна быть проверена на безопасность и функциональные характеристики после стерилизации (см. также раздел 7).
8.2 Остаточные содержания после стерилизации
Испытание на наличие остаточных содержаний после стерилизации проводят в соответствии с принципами, изложенными в ГОСТ ISO 10993-1. Если применимо, уровень остаточного содержания этиленоксида не должен превышать пределов, указанных в ГОСТ ISO 10993-7.
Наличие микробных остатков после стерилизации (например, пирогенов) должно быть надлежащим образом проверено, в частности, на предмет попадания жидкости в позвоночник.
Примечание — Законодательство некоторых регионов рекомендует максимально допустимый уровень пирогена, например EUPH и USP.
9 Упаковка
Упаковка должна соответствовать ГОСТ ISO 11607-1.
10 Информация, предоставляемая изготовителем
10.1 Маркировка на изделии
Для обеспечения прослеживаемости, если изделие предназначено для полной имплантации, на нем должна быть указана следующая информация:
- наименование или торговая марка изготовителя;
- код (номер) партии или серийный номер.
Если маркировка может повлиять на предусмотренные функциональные характеристики, или если имплантат слишком мал, или физические свойства имплантата препятствуют различимости маркировки, необходимая информация должна быть указана на этикетке или другими способами для обеспечения прослеживаемости.
10.2 Информация в инструкции по эксплуатации и/или на упаковке
Упаковка и/или инструкция по эксплуатации должны содержать, по крайней мере, следующую информацию:
а) сведения, строго необходимые для идентификации изделия (включая соответствующие конструктивные особенности, определенные в разделе 5, и содержимое упаковки;
Ь) предусмотренные характеристики (см. раздел 4);
с) там, где это уместно или требуется на местном уровне, уникальную идентификацию изделия;
d) описание любых добавок или материалов для покрытия, если применимо;
е) когда предъявляются особые требования из-за наличия добавки или покрытия, если применимо, указывают следующее:
- описание добавки или материала для покрытия;
7
ГОСТ Р 71580—2024
- продолжительность эффективности при эксплуатации;
- любые противопоказания, предупреждения и меры предосторожности, основанные на добавке или материале(ах) покрытия;
f) информация об отверстиях (количестве и положении), функциональной длине и конфигурации наконечника, если применимо;
д) объяснение любой маркировки катетера, если применимо;
h) информацию относительно скорости потока (см. 7.2.5), включая испытуемую длину катетера;
i) любые ограничения в размере шприца или другом способе введения жидкости, которые не следует использовать с изделием;
j) любые специальные рекомендации, касающиеся использования фильтров или предварительной фильтрации лекарственных препаратов, если применимо.
8
ГОСТ Р 71580—2024
Приложение А (обязательное)
Метод испытания на коррозионную стойкость
А.1 Принцип
Изделие погружают в раствор хлорида натрия, затем в кипящую дистиллированную или деионизированную воду, после чего осматривают на наличие признаков коррозии.
А.2 Реагенты
А.2.1 Солевой раствор, содержащий хлорид натрия аналитического качества в свежеприготовленной дистиллированной или деионизированной воде [c(NaCI) = 0,15 моль/л].
А.2.2 Дистиллированная или деионизированная вода.
А.З Оборудование
А.3.1 Сосуд из боросиликатного стекла.
А.4 Процедура
А.4.1 Погружают изделие в стеклянный сосуд (А.3.1) с солевым раствором (А.2.1) при температуре (22 ± 5) °C на 5 ч.
А.4.2 Извлекают испытуемый образец и погружают его в кипящую дистиллированную или деионизированную воду (А.2.2) на 30 мин.
А.4.3 Дают воде и испытуемому образцу остыть до (37 ± 2) °C и поддерживают их при этой температуре в течение 48 ч.
А.4.4 Извлекают испытуемый образец и дают ему высохнуть при комнатной температуре.
А.4.5 Разбирают образцы, имеющие два или более компонента, если предполагается, что при эксплуатации они могут разъединяться. Не снимают и не срезают никаких покрытий на металлических компонентах. Проверяют образцы путем осмотра на наличие признаков коррозии.
Примечание — Дополнительное испытание может быть проведено с использованием альтернативных сроков и температур в зависимости от соответствующего клинического обоснования, основанного на риске.
А.5 Протокол испытания
Протокол испытания должен содержать следующую информацию:
а) ссылку на настоящий стандарт;
Ь) идентификацию изделия;
с) заключение о том, произошла ли коррозия во время испытания;
d) любые отклонения от процедуры;
е) какие-либо наблюдаемые необычные особенности;
f) дату проведения испытания.
9
ГОСТ Р 71580—2024
Приложение В (обязательное)
Определение скорости потока через катетер
В.1 Принцип
Через катетерную систему пропускают воду и измеряют величину потока по объему или по весу.
В.2 Реагент
В.2.1 Дистиллированная или деионизированная вода или другие клинически значимые среды.
Допускается использовать питьевую дегазированную воду, пригодную для потребления человеком, или обычный 0,9 %-ный солевой раствор.
В.З Оборудование
В.3.1 Резервуар постоянного уровня, оснащенный трубкой подачи и соединителем, способным, когда испытуемый катетер не присоединен, обеспечивать скорость потока (525 ± 25) мл/мин, и имеющий высоту гидростатического напора (1000 ± 5) мм.
Пример подходящего оборудования показан на рисунке В.1.
Размеры в миллиметрах
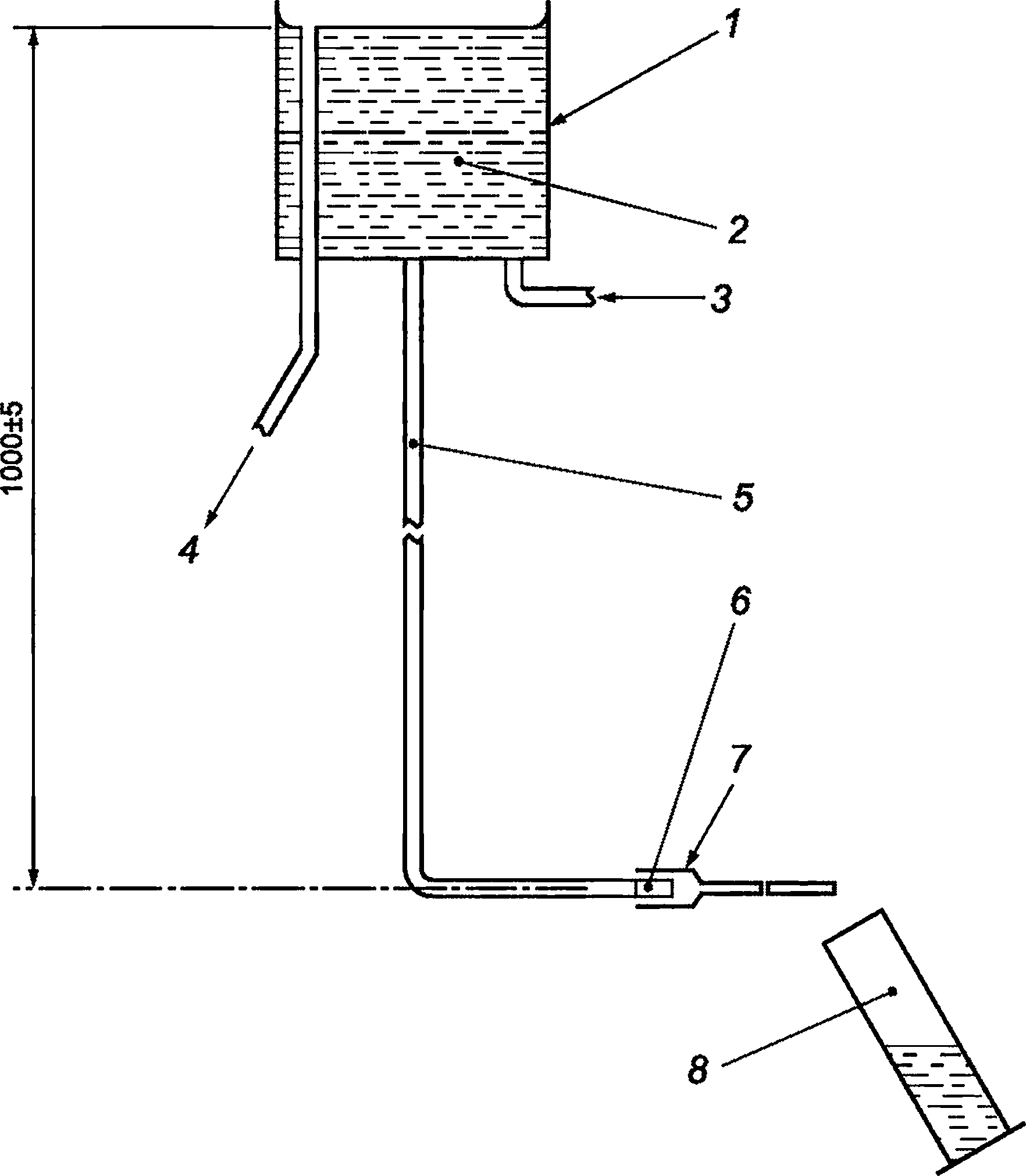
1 — резервуар постоянного уровня; 2 — дистиллированная или деионизированная вода; 3 — вход; 4 — переполнение; 5 — труба подачи; 6 — соединитель; 7 — испытуемая катетерная система; 8 — сосуд для сбора и измерения
Рисунок В.1 — Пример оборудования для определения скорости потока воды
10
ГОСТ Р 71580—2024
В.3.2 Оборудование для сбора и определения массы или объема жидкости, вытекающей из катетерной системы с точностью ±1 %, или другие соответствующие средства измерения скорости потока.
Примечание — Современным требованиям к точности удовлетворяет посуда, соответствующая [10] (класс А для всех объемов и класс В для объемов не менее 100 мл) и [11] (класс А для всех объемов и класс В для объемов не менее 100 мл).
В.3.3 Способ измерения времени тестового периода, например, с помощью таймера.
В.4 Процедура
В.4.1 Наполняют резервуар постоянного уровня (В.3.1) средой при температуре (22 ± 2) °C. Прикрепляют испытуемую катетерную систему к соединителю.
В.4.2 Запускают поток среды через катетерную систему. Собирают вытекающий поток в течение определенного периода времени (не менее 30 с) и определяют его объем с помощью измерительного цилиндра или путем взвешивания с учетом плотности среды, или непосредственно измеряют скорость потока.
В.4.3 Выполняют три измерения для каждой применимой катетерной системы.
В.5 Выражение результатов
Вычисляют среднее арифметическое трех измерений и выражают эту величину как среднюю скорость потока через катетер в миллилитрах в минуту. Округляют расчетную среднюю скорость потока до целого числа для значений более одного миллилитра в минуту и до десятых для значений менее одного миллилитра в минуту.
В.6 Протокол испытания
Протокол испытания должен содержать следующую информацию:
а) ссылку на настоящий стандарт;
Ь) идентификацию катетерной системы и длину испытуемого катетера;
с) среднюю скорость потока, выраженную в миллилитрах в минуту (см. В.5);
d) если применимо, идентификацию компонентов, используемых для соединения оборудования с катетерной системой;
е) любые отклонения от процедуры;
f) какие-либо наблюдаемые необычные особенности;
д) дату проведения испытания.
11
ГОСТ Р 71580—2024
Приложение С (обязательное)
Метод испытания на утечку жидкости под давлением
С.1 Принцип
Катетерную систему подсоединяют через герметичное соединение к шприцу или аппарату под давлением. К катетерной системе и соединительному узлу, при наличии, прикладывают гидравлическое давление и трубку катетера проверяют на утечку.
С.2 Реагенты
С.2.1 Дистиллированная или деионизированная вода, или питьевая вода, пригодная для потребления человеком.
С.З Оборудование
С.3.1 Герметичный соединитель для подсоединения катетерной системы к шприцу или аппарату под давлением (С.3.3), который оснащен манометром, способным измерять давление не менее 300 кПа, и имеет небольшой внутренний объем.
С.3.2 Соединитель для обеспечения герметичного соединения между шприцем или аппаратом под давлением (С.3.3) и катетерами, которые не имеют канюль.
С.3.3 Шприц или аппарат под давлением, который может подавать давление не менее 300 кПа в течение не менее 30 с на испытуемое изделие (например, шприц, испытанный на отсутствие утечки через поршень, и наконечник в соответствии с ГОСТ ISO 7886-1).
С.3.4 Средство для перекрывания испытуемого образца, например зажим.
С.4 Процедура
С.4.1 При испытании катетеров, имеющих канюлю (или канюли), при необходимости собирают разъемные соединения в соответствии с инструкциями изготовителя. Подсоединяют канюлю к герметичному разъему (С.3.1), чтобы обеспечить герметичное соединение.
С.4.2 При испытании катетеров, которые не имеют канюли, подсоединяют катетер к шприцу или аппарату под давлением (С.3.3) с помощью соединителя (С.3.2).
С.4.3 Заполняют шприц или аппарат под давлением (С.3.3) водой (С.2.1) при температуре (22 ± 5) °C и удаляют воздух из всего испытуемого изделия. Перекрывают (С.3.4) испытуемый образец как можно ближе к дистальному концу.
С.4.4 Прикладывают давление не менее 300 кПа. Поддерживают давление в течение 30 секунд. Осматривают соединение канюли, при наличии, и трубку катетера на утечку жидкости, т. е. образования одной или более падающих капель воды, и записывают, имела ли место утечка или нет.
Примечание — Для облегчения идентификации утечки в реагент может быть добавлен краситель (например, Patent blue V или метиленовый синий).
С.5 Протокол испытания
Протокол испытания должен содержать следующую информацию:
а) ссылку на настоящий стандарт;
Ь) идентификацию катетерной системы;
с) заключение в отношении наличия или отсутствия утечки из соединительного узла, при наличии, или трубки катетера;
d) любые отклонения от процедуры;
е) какие-либо наблюдаемые необычные особенности;
f) дату проведения испытания.
12
ГОСТ Р 71580—2024
Приложение D (обязательное)
Метод определения усилия на разрыв
D.1 Принцип
Испытуемые образцы или полную длину катетера выбирают таким образом, чтобы испытанию подвергалась каждая трубчатая часть, каждое место соединения между канюлей или соединителем и трубкой и каждое соединение между трубчатыми частями. К каждому испытуемому образцу прикладывают растягивающее усилие до тех пор, пока трубка или место соединения не разорвутся или не отделятся друг от друга.
D.2 Оборудование
D.2.1 Аппарат для проведения испытания на растяжение, способный обеспечить нагрузку более 15 Н.
D.3 Процедура
D.3.1 Собирают катетерную систему в соответствии с инструкциями изготовителя. Выбирают участок катетерной системы для испытания. Включают в испытательный участок канюлю или соединитель, в зависимости от ситуации, а также соединение между сегментами, например между трубкой и дистальным концом.
D.3.2 Готовят образцы для испытаний в соответствии с назначением. Продолжительность предварительной подготовки должна соответствовать клинически стабильной фазе. Испытывают в соответствии с D.3.3—D.3.6 сразу после кондиционирования.
D.3.3 Фиксируют испытуемый участок в аппарате для проведения испытания на растяжение. Если присутствует канюля или соединитель, используют соответствующее крепление, чтобы не допустить их деформации.
D.3.4 Измеряют калибровочную длину испытуемого участка, т. е. расстояние между зажимами аппарата для испытания на растяжение или расстояние между канюлей или соединителем и зажимом, удерживающим другой конец испытуемого участка, в зависимости от ситуации.
D.3.5 Прикладывают растягивающее усилие со скоростью растяжения 20 мм в минуту на миллиметр калибровочной длины (см. таблицу D.1) до тех пор, пока не произойдет разделение испытуемого участка на две или больше частей. Записывают пиковое растягивающее усилие в ньютонах, достигнутое во время испытания на растяжение испытуемого участка катетера до момента или в момент разделения на две части.
D.3.6 Не допускается проводить более одного испытания для одного и того же испытуемого участка катетера.
Таблица В.1 — Примеры условий для скорости растяжения 20 мм/мин/мм
Калибровочная длина, мм | Скорость при испытании, мм/мин |
10 | 200 |
20 | 400 |
25 | 500 |
D.4 Протокол испытаний
Протокол испытания должен содержать следующую информацию: а) ссылку на настоящий стандарт;
Ь) идентификацию изделия;
с) идентификацию катетерной системы;
d) пиковую силу растяжения в ньютонах;
е) местоположение разрыва;
f) любые отклонения от процедуры;
д) какие-либо наблюдаемые необычные особенности;
h) дату проведения испытания.
13
ГОСТ Р 71580—2024
Приложение Е (справочное)
Другие единицы измерения
Е.1 Общие положения
Следующие единицы измерения отличаются от указанных в настоящем стандарте и могут быть использованы дополнительно. Их используют для обозначения номинального размера игл и катетеров.
Е.2 Французская шкала, или шкала Шарьера
Идентификация по номинальным размерам наружного размера катетера, вычисленная как трехкратный диаметр (в миллиметрах): Fr = 3 • D (мм). Слово «французский» может быть сокращено как F, FR, Fr, Fg, СН или Ch.
Е.З Калибр иглы
Калибр иглы представляет наружный диаметр игл. Большие числа калибра относятся к игле меньшего диаметра, см. таблицу Е.1.
Примечание — Дополнительная информация о калибрах приведена в ГОСТ Р ИСО 9626.
Таблица Е.1—Размеры калибров
Обозначенный метрический размер, мм | Калибр |
0,18 | 34 |
0,2 | 33 |
0,23 | 32 |
0,25 | 31 |
0,3 | 30 |
0,33 | 29 |
0,36 | 28 |
0,4 | 27 |
0,45 | 26 |
0,5 | 25 |
0,55 | 24 |
0,6 | 23 |
0,7 | 22 |
0,8 | 21 |
0,9 | 20 |
1,1 | 19 |
1,2 | 18 |
1,4 | 17 |
1,6 | 16 |
1,8 | 15 |
2,1 | 14 |
2,4 | 13 |
2,7 | 12 |
3 | 11 |
3,4 | 10 |
14
ГОСТ Р 71580—2024
Приложение ДА (справочное)
Сведения о соответствии ссылочных национальных и межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененном международном стандарте
Таблица ДА.1
Обозначение ссылочного национального, межгосударственного стандарта | Степень соответствия | Обозначение и наименование ссылочного международного стандарта |
ГОСТ ISO 10993-1—2021 | IDT | ISO 10993-1:2018 «Оценка биологического действия. Часть 1. Оценка и исследования в процессе менеджмента риска» |
ГОСТ ISO 10993-7—2016 | IDT | ISO 10993-7:2008 «Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание эти-леноксида после стерилизации» |
ГОСТ ISO 11607-1—2018 | IDT | ISO 11607-1:2006 «Упаковка медицинских изделий, подлежащих финишной стерилизации. Часть 1. Требования к материалам, барьерным системам для стерилизации и упаковочным системам» |
ГОСТ Р ИСО 14155—2022 | IDT | ISO 14155:2020 «Клинические исследования медицинских изделий, проводимые с участием человека в качестве субъекта. Надлежащая клиническая практика» |
ГОСТ Р ИСО 80369-6—2023 | IDT | ISO 80369-6:2016 «Соединители малого диаметра для жидкостей и газов, используемые в здравоохранении. Часть 6. Соединители для нейроаксиального применения» |
Примечание — В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT — идентичные стандарты. | ||
Библиография
[1] ISO/TR 19244:2014
[2] АСТМ F640—23 (ASTM F640—23)
[3] ДИН 13273-7;2020 (DIN 13273-7;2020)
[4] АСТМ F2052—21 (ASTM F2052—21)
Руководство по переходным периодам документов, разработанных ISO/TC 84. Устройства для введения медицинских препаратов и катетеры (Guidance on transition periods for standards developed by ISO/TC 84 — Devices for administration of medicinal products and catheters)
Стандартные методы испытания для определения рентгеноконтрастности для медицинского применения (Standard Test Methods for Determining Radiopacity for Medical Use)
Катетеры медицинские. Часть 7. Определение поглощения рентгеновского излучения катетерами. Требования и испытания (Catheters for medical use — Part 7: Determination of the X-ray attenuation of catheters — Requirements and testing)
Стандартный метод испытаний для измерения магнитно-индуцированной силы смещения неактивных имплантатов в среде магнитного резонанса (Standard Test Method for Measurement of Magnetically Induced Displacement Force on Passive Implants in the Magnetic Resonance Environment)
15
ГОСТ Р 71580—2024
[5] АСТМ F2213—17 (ASTM F2213—17) | Стандартный метод испытаний для измерения магнитно-индуцированного крутящего момента на медицинских изделиях в среде магнитного резонанса (Standard test method for measurement of magnetically induced torque on medical devices in the magnetic resonance environment) |
[6] АСТМ F2182—19е2 (ASTM F2182—19е2) | Стандартный метод испытаний для измерения радиочастотного индуцированного нагрева на или вблизи неактивных имплантатов во время магнитно-резонансной томографии (Standard Test Method for Measurement of Radio Frequency Induced Heating On or Near Passive Implants During Magnetic Resonance Imaging) |
[7] АСТМ F2119—24 (ASTM F2119—24) | Стандартный метод испытаний для оценки артефактов на MP-изображениях от неактивных имплантатов (Standard Test Method for Evaluation of MR Image Artifacts from Passive Implants) |
[8] АСТМ F2129—19а (ASTM F2129—19а) | Стандартный метод испытаний для проведения циклических потенциодинамиче-ских измерений поляризации для определения подверженности коррозии малых имплантатов (Standard Test Method for Conducting Cyclic Potentiodynamic Polarization Measurements to Determine the Corrosion Susceptibility of Small Implant Devices) |
[9] ЕН 13868:2002 (EN 13868:2002) | Катетеры. Методы испытаний на изгиб однопросветных катетеров и медицинских трубок (Catheters — Test methods for kinking of single lumen catheters and medical tubing) |
[10] ИСО 4788:2005 (ISO 4788:2005) | Посуда стеклянная лабораторная. Мерные градуированные цилиндры (Laboratory glassware — Graduated measuring cylinders) |
[11] АСТМ Е1272—02(2019) Стандартная спецификация для лабораторных стеклянных градуированных цилин-[ASTM Е1272—02(2019)] дров (Standard Specification for Laboratory Glass Graduated Cylinders)
УДК 615.472.5:006.354 | ОКС 11.040.20 |
Ключевые слова: катетерная система, нейроаксиальное применение, характеристики, материалы, испытания, упаковка, маркировка
Редактор Л.В. Каретникова Технический редактор В.Н. Прусакова Корректор Е.Д- Дульнева Компьютерная верстка А.Н. Золотаревой |
Сдано в набор 30.09.2024. Подписано в печать 03.10.2024. Формат 60x847а. Гарнитура Ариал. Усл. печ. л. 2,32. Уч.-изд. л. 1,86.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «Институт стандартизации» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.
