ГОСТ Р 50855-96
Группа Р29
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
КОНТЕЙНЕРЫ ДЛЯ КРОВИ И ЕЕ КОМПОНЕНТОВ
Требования химической и биологической безопасности и методы испытаний
Containers for blood and its components.
Requirements for chemical and biological safety and methods of testing
ОКС 11.040.20
ОКП 94 4470
Дата введения 1997-01-01
ПРЕДИСЛОВИЕ
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники АО НПО "Экран"
ВНЕСЕН Главным управлением стандартизации информационных технологий продукции электротехники и приборостроения
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 1 февраля 1996 г. N 45
3 ВВЕДЕН ВПЕРВЫЕ
1 ОБЛАСТЬ ПРИМЕНЕНИЯ
Настоящий стандарт распространяется на полимерные стерильные контейнеры однократного применения (далее - контейнеры), предназначенные для взятия крови, разделения ее на компоненты, а также их хранения, транспортирования и переливания.
Стандарт устанавливает требования химической и биологической безопасности и методы проверки при приемочных, приемо-сдаточных и сертификационных испытаниях.
Требования настоящего стандарта являются обязательными.
2 НОРМАТИВНЫЕ ССЫЛКИ
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 8.423-81 ГСИ. Секундомеры механические. Методы и средства поверки
ГОСТ 244-76 Натрия тиосульфат кристаллический. Технические условия
ГОСТ 859-78 Медь. Марки
ГОСТ 860-75 Олово. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Технические условия
ГОСТ 2405-88 Манометры, вакуумметры, мановакуумметры, напоромеры, тягомеры и тягонапоромеры. Общие технические условия
ГОСТ 3022-80 Водород технический. Технические условия
ГОСТ 3118-77 Кислота соляная. Технические условия
ГОСТ 4108-72 Барий хлористый. Технические условия
ГОСТ 4204-77 Кислота серная. Технические условия
ГОСТ 4232-74 Калий йодистый. Технические условия
ГОСТ 4233-77 Натрий хлористый. Технические условия
ГОСТ 4461-77 Кислота азотная. Технические условия
ГОСТ 5457-75 Ацетилен растворенный и газообразный технический. Технические условия
ГОСТ 5556-81 Вата медицинская гигроскопическая. Технические условия
ГОСТ 5905-79 Хром металлический. Технические условия
ГОСТ 5962-67 Спирт этиловый. Технические условия
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 7164-78 Приборы автоматические следящего уравновешивания ГСП. Общие технические условия
ГОСТ 8728-88 Пластификаторы. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 10163-76 Крахмал растворимый. Технические условия
ГОСТ 10782-85 Бутылки стеклянные для крови, трансфузионных и инфузионных препаратов. Технические условия
ГОСТ 12026-75 Бумага фильтровальная, лабораторная. Технические условия
ГОСТ 14919-83 Электроплиты, электроплитки и жаропрочные электрошкафы бытовые. Общие технические условия
ГОСТ 15860-84 Баллоны стальные сварочные для сжиженных углеводородных газов на давление до 1,6 МПа. Технические условия
ГОСТ 17433-80 Промышленная чистота. Сжатый воздух. Классы загрязненности
ГОСТ 20490-75 Калий марганцовокислый. Технические условия
ГОСТ 22280-76 Натрий лимоннокислый 5,5-водный. Технические условия
ГОСТ 22860-93 Кадмий высокой чистоты. Технические условия
ГОСТ 22861-93 Свинец высокой чистоты. Технические условия
ГОСТ 23932-90 Посуда и оборудование лабораторные стеклянные. Общие технические условия
ГОСТ 24104-88 Весы лабораторные общего назначения и образцовые. Общие технические условия
ГОСТ 24297-87 Входной контроль продукции. Основные положения
ГОСТ 24861-91 Шприцы инъекционные однократного применения. Типы, основные параметры и размеры. Технические требования. Методы испытаний
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуировочные. Часть 1. Общие требования.
ГОСТ 29251-91 Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
3 ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
В настоящем стандарте применяют следующие термины с соответствующими определениями:
3.1 Контейнеры для крови и ее компонентов - стерильные изделия медицинского назначения однократного применения, предназначенные для взятия крови, разделения ее на компоненты, а также их хранения, транспортирования и переливания.
Примечание - Контейнеры могут быть изготовлены из различных полимерных материалов. В зависимости от назначения контейнеры могут быть одно- и многокамерными, различной емкости, могут содержать консервант.
3.2 Химическая безопасность - отсутствие вредного действия на организм химических соединений, которые могут мигрировать из материалов или изделий медицинского назначения, контролируемое с помощью совокупности санитарно-химических и токсикологических показателей.
3.3 Биологическая безопасность - отсутствие в материалах или изделиях медицинского назначения биологических факторов, таких как живые микроорганизмы, их споры, токсичные продукты их метаболизма, контролируемое с помощью показателей стерильности и пирогенности.
3.4 Санитарно-химические испытания - испытания, проводимые с целью определения суммарного количества мигрирующих в водную вытяжку из полимерных материалов и изделий химических соединений с помощью интегральных показателей, а также индивидуальных потенциально опасных соединений (составляющих полимерных композиций, технологических добавок, стерилизующих агентов, примесей в сырье и т.п.).
3.5 Токсикологические испытания - испытания, проводимые с целью выявления вредного действия материалов изделия на организм, включающие оценку гемолитической активности, общетоксического, сенсибилизирующего, раздражающего и цитотоксического эффектов.
3.6 Контроль стерильности - проверка отсутствия жизнеспособных микробов в рабочих объемах контейнеров.
3.7 Контроль апирогенности - проверка допустимых концентраций липополисахаридов в рабочих объемах контейнеров.
3.8 Партия контейнеров, не содержащих консервант крови - количество контейнеров, простерилизованных за сутки.
3.9 Партия контейнеров, содержащих консервант крови - количество контейнеров, заполненных консервантом крови из одной партии и простерилизованных за сутки.
3.10 Серия контейнеров, содержащих консервант крови - количество контейнеров, заполненных консервантом крови из одной партии и простерилизованных за один цикл стерилизации в одном стерилизаторе.
4 ТРЕБОВАНИЯ ХИМИЧЕСКОЙ И БИОЛОГИЧЕСКОЙ БЕЗОПАСНОСТИ
4.1 Санитарно-химическим, токсикологическим испытаниям, испытаниям на стерильность и пирогенность (далее - испытания) подлежат контейнеры на стадии приемочных, приемо-сдаточных и сертификационных испытаний, изготовленные из материалов, рекомендованных к применению.
4.2 Приемочные и сертификационные испытания контейнеров проводят организации, уполномоченные Минздравмедпромом России и Госстандартом России.
4.2.1 Санитарно-химические испытания контейнеров проводят на соответствие требованиям 5.3.1-5.3.4 по следующим показателям:
- определение восстановительных примесей;
- определение изменения величины рН вытяжки;
- ультрафиолетовое поглощение;
- определение содержания металлов.
4.2.1.1 Если контейнеры изготовлены из пластифицированного диоктилфталатом (ДИ-(2-этилгексил)-фталатом) поливинилхлоридного пластиката, то санитарно-химические испытания дополнительно проводят на соответствие требованиям 5.3.5, 5.3.6 по следующим показателям:
- определение диоктилфталата (ДОФ)-пластикатора;
- определение винилхлорида (ВХ) - остаточного мономера.
4.2.1.2 При изготовлении контейнеров из других полимерных материалов перечень дополнительных санитарно-химических показателей и их допустимые уровни определяют в каждом конкретном случае в соответствии с нормативным документом на данный контейнер.
4.2.2 Токсикологические испытания контейнеров проводят на соответствие требованиям 5.4.1-5.4.5 по следующим показателям:
- острая токсичность на белых мышах;
- индекс токсичности (цитотоксичность) на сперматозоидах быка;
- гемолитическая активность;
- раздражающее действие на кожу крыс и слизистую глаза кролика;
- сенсибилизирующий эффект на белых крысах.
4.2.3 Испытания контейнеров на стерильность проводят на соответствие требованиям 5.4.6.
4.2.4 Испытания контейнеров на апирогенность проводят на соответствие требованиям 5.4.7.
4.3 Приемо-сдаточные испытания контейнеров, а также контроль полимерного сырья, используемого для изготовления контейнеров, проводит предприятие-изготовитель.
4.3.1 Полимерное сырье, из которого изготавливают основной функциональный элемент контейнера - собственно контейнер, подвергают контролю на соответствие требованиям ГОСТ 24297 с учетом следующих показателей:
- санитарно-химические с определением восстановительных примесей (5.3.1), изменения величины рН вытяжки (5.3.2);
- токсикологические с определением токсичности на клеточном тест-объекте (5.4.5) или острой токсичности на мышах (5.4.1).
4.3.2 В течение трех лет с начала серийного выпуска каждую партию изделий подвергают санитарно-химическим испытаниям с определением восстановительных примесей (5.3.1) и изменения величины рН вытяжки (5.3.2); токсикологическим испытаниям с определением токсичности на клеточном тест-объекте (5.4.5) или на мышах (5.4.1), испытаниям на апирогенность (5.4.7.1 или 5.4.7.2). Испытаниям на стерильность подвергают каждую серию изделий, стерилизованных паровым методом, и каждую партию, стерилизованную радиационным методом.
4.3.3 При отсутствии на предприятии в течение 3 лет с начала серийного выпуска изделий случаев выбраковки по санитарно-химическим показателям и токсичности контроль по указанным показателям проводят от каждой 25-й партии, но не реже одного раза в месяц. Испытаниям на апирогенность подвергают каждую партию изделий. Испытаниям на стерильность - каждую 15-ю партию контейнеров, стерилизованных радиационным методом, и каждую серию контейнеров, простерилизованных паровым методом.
4.3.4 В случае превышения допустимых значений санитарно-химических показателей, выявления токсичности изделий испытаниям по указанным показателям подвергают 10 партий контейнеров подряд. В дальнейшем при отсутствии выбраковки по санитарно-химическим показателям и токсичности контроль проводят от каждой 25-й партии, но не реже одного раза в месяц.
В случае выбраковки по нестерильности радиационно-стерилизованных контейнеров в течение первого года выпуска после устранения причины брака контролю на стерильность подвергают каждую партию контейнеров. При отсутствии в течение первого года выпуска выбраковки по нестерильности контролируют каждую 5-ю партию изделий, в последующем - каждую 15-ю.
4.4 Допустимые значения санитарно-химических и биологических показателей
4.4.1 Значения санитарно-химических и токсикологических показателей, а также показателей стерильности и апирогенности должны соответствовать приведенным в таблице 1.
Таблица 1 - Значения санитарно-химических, токсикологических показателей, показателей стерильности и апирогенности
Наименование группы показателей | Перечень показателей | Допустимое значение | Номер пункта методов испытаний |
1 Санитарно-химические показатели | |||
1.1 Общие показатели для всех видов контейнеров | Восстановительные примеси | Не более 1,0 мл | 5.3.1 |
Изменение значения рН | В пределах ±1,0 | 5.3.2 | |
Ультрафиолетовое поглощение | Не более 0,2 в диапазоне 230-360 нм | 5.3.3 | |
Содержание металлов: | 5.3.4 | ||
бария, меди, свинца, олова, хрома | Не более | ||
кадмия | Не более 0,1 мг/л | ||
1.2 Дополнительные показатели для контейнеров из поливинилхлоридного пластиката | Содержание винилхлорида | Не более 0,01 мг/л | 5.3.5 |
Содержание диоктилфталата | Не более 10 мг/100 мл | 5.3.6 | |
2 Токсикологические показатели | Острая токсичность | Нетоксично | 5.4.1 |
Индекс токсичности | 70-120% | 5.4.5 | |
Гемолитическая активность | Не более 2% | 5.4.4 | |
Раздражающее действие | Отсутствует | 5.4.2 | |
Сенсибилизирующий эффект | Отсутствует | 5.4.3 | |
3 Стерильность | Проросты | Отсутствуют | 5.4.6 |
4 Апирогенность | ЛПС | Не более 0,01 мкг/мл | 5.4.7 |
5 МЕТОДЫ ИСПЫТАНИЙ
5.1 Порядок подготовки к испытаниям
5.1.1 Отбор образцов
5.1.1.1 Для проведения испытаний контейнеров образцы отбирают из разных мест партии в количестве 0,1%, но не менее указанного в таблице 2.
Таблица 2 - Количество контейнеров, необходимое для испытаний
Вид испытания | Вместимость контейнера, мл | Количество образцов для испытания, шт. | ||||
санитарно-хими- ческого | токсиколо- гического | стерильности | пироген- ности | сумма | ||
Приемочные и сертификационные испытания | 500 или 300 | 5 | 5 | 0,4 | 5 | 15+0,4 |
500/300 | 4 | 5 | 0,4 | 5 | 14+0,4 | |
500/300/300 | 3 | 4 | 0,4 | 5 | 12+0,4 | |
500/300/300/300 | 3 | 4 | 0,4 | 5 | 12+0,4 | |
Приемо-сдаточные испытания | 500 или 300 | 3 | 3 | 0,4 | 5 | 11+0,4 |
500/300 | 3 | 3 | 0,4 | 5 | 11+0,4 | |
500/300/300 | 3 | 2 | 0,4 | 5 | 11+0,4 | |
500/300/300/300 | 3 | 2 | 0,4 | 5 | 11+0,4 | |
Обозначение: | ||||||
5.1.2 Приготовление вытяжек из контейнеров
5.1.2.1 Все работы по приготовлению вытяжек из контейнеров выполняют с соблюдением требований асептики.
5.1.2.2 Для проведения санитарно-химических и токсикологических испытаний не заполненных консервантом контейнеров образцы изделий извлекают из упаковки. Каждую емкость независимо от их числа заполняют дистиллированной водой через донорскую трубку (однокамерные контейнеры) или через надрез, сделанный на соединяющих емкости трубках (многокамерные контейнеры). Контейнеры вместимостью 500 мл заполняют 100 мл дистиллированной воды, контейнеры вместимостью 300 мл заполняют 50 мл дистиллированной воды. Вода должна быть равномерно распределена по всему изделию. Иглу герметизируют предохранительным колпачком, а соединительные трубки пережимают зажимами ниже надреза (ближе к мешку). Затем контейнеры выдерживают в термостате при температуре (70±2) °С в горизонтальном положении в течение 24 ч.
В качестве контрольного раствора используют дистиллированную воду, помещенную в колбу со шлифом, которая термостатируется в тех же условиях.
По истечении указанного срока контейнеры и контрольный раствор извлекают из термостата и охлаждают до комнатной температуры.
В первую очередь непосредственно из контейнеров производится отбор проб для определения хроматографически активных веществ по 5.3.5.3.
Оставшуюся часть вытяжек сливают в стеклянную емкость со шлифом.
5.1.2.3 Для санитарно-химических и токсикологических испытаний контейнеров с консервантом от партии отбирают необходимое количество незаполненных контейнеров, которые предварительно взвешивают. Затем незаполненные контейнеры заполняют дистиллированной водой через донорскую трубку путем передавливания дистиллированной воды из каждой предыдущей емкости в последующую по 100 г (для контейнеров вместимостью 500 мл) и 50 г (для контейнеров вместимостью 300 мл). Вода должна быть равномерно распределена в заполняемой емкости. Иглу герметизируют предохранительным колпачком, соединительные трубки пережимают зажимами.
В качестве контрольного раствора используют дистиллированную воду, помещенную в герметичный стеклянный флакон.
Затем заполненные водой контейнеры вместе с контрольными растворами помещают в стерилизатор, где они подвергаются одному циклу стерилизационного воздействия подобно контейнерам с консервантом.
В заводских условиях контейнеры, заполненные дистиллированной водой, и контрольный раствор стерилизуют одновременно с контейнерами, заполненными консервантом в том же стерилизаторе. После окончания стерилизационного воздействия контейнеры и контрольный раствор извлекают из стерилизатора и охлаждают до комнатной температуры.
В первую очередь непосредственно из контейнеров проводят отбор проб для хроматографически активных веществ по 5.3.5.3. Оставшуюся часть вытяжек сливают в стеклянную емкость со шлифом.
5.1.2.4 Приготовление вытяжек для контроля апирогенности.
Приготовление вытяжек для контроля на апирогенность проводят аналогично 5.1.2.2 и 5.1.2.3, используя в качестве экстрагента 0,9%-ный раствор хлорида натрия. Заполненные 0,9%-ным раствором хлорида натрия контейнеры помещают в термостат на 24 ч при температуре (37±2) °С.
5.1.2.5 Приготовление смывов для контроля стерильности проводят по 5.4.6.
5.1.3 Контроль сырья
5.1.3.1 Для проверки сырья на соответствие санитарно-химическим и токсикологическим показателям 300 г полимерного материала (гранулята) помещают в стеклянную емкость со шлифом, заливают 1000 мл дистиллированной воды и выдерживают в термостате при температуре (70±2) °С в течение 24 ч.
В качестве контрольного раствора используют дистиллированную воду, помещенную в колбу со шлифом, которая термостатируется в тех же условиях.
По истечении указанного срока колбы с испытуемыми материалами и контрольными растворами извлекают из термостата и охлаждают до комнатной температуры. Вытяжку из материала сливают в колбу со шлифом.
5.2 Средства контроля и вспомогательные устройства
5.2.1 Средства контроля, вспомогательные устройства и химические реактивы, применяемые для испытаний, приведены в приложении А.
5.3 Санитарно-химические испытания
По санитарно-химическим показателям изделия должны соответствовать требованиям, приведенным в таблице 1.
5.3.1 Определение в вытяжке восстановительных примесей (окисляемых веществ)
Определение восстановительных примесей относится к интегральным показателям и позволяет оценивать общее количество мигрирующих из контейнеров в водную вытяжку веществ восстановительного характера.
5.3.1.1 Методика определения восстановительных примесей
20 мл исследуемой вытяжки переносят пипеткой в коническую колбу вместимостью 250 мл, снабженную притертой пробкой, прибавляют 20 мл раствора марганцовокислого калия (0,002 н.) и 1 мл серной кислоты (3 н.), закрывают колбу пробкой, осторожно перемешивают содержимое колбы и оставляют стоять на 15 мин. По истечении указанного срока прибавляют 0,1 г йодистого калия и выделившийся йод титруют раствором серноватистокислого натрия (0,02 н.) до светло-желтого цвета. Затем добавляют 0,5 мл раствора крахмала (0,5%) и продолжают титровать до обесцвечивания раствора. Титрование контрольного раствора проводят в тех же условиях. Для этого используют 20 мл контрольного раствора. Определение проводят не менее чем в двух параллельных пробах (из одной и той же вытяжки или контрольного раствора). Расхождение между параллельными пробами не должно превышать 0,05 мл 0,02 н. раствора серноватистокислого натрия.
5.3.1.2 Обработка результатов
Количество восстановительных примесей выражают в объеме 0,02 н. раствора серноватистокислого натрия, затраченного на их определение (), мл, и рассчитывают по формуле
![]() ,
,
где - объем 0,02 н. раствора серноватистокислого натрия, израсходованного на титрование контрольного раствора, мл;
- объем 0,02 н. раствора серноватистокислого натрия, израсходованного на титрование вытяжки, мл.
Результат определения (с доверительной вероятностью 0,95) считается приемлемым, если расхождение между значениями не превышает 0,05 мл, и расхождение между значениями
также не превышает 0,05 мл.
За результат испытаний принимают среднее арифметическое двух приемлемых результатов определения, округленное до десятичных долей.
5.3.2 Определение изменения величины рН вытяжки
Величина рН характеризует кислотность или основность вытяжки.
5.3.2.1 Методика измерения
Испытуемую вытяжку и контрольный раствор помещают в стеклянный стакан и измеряют величину рН вытяжки и контрольного раствора.
5.3.2.2 Обработка результатов
Изменение величины рН - рН рассчитывают по формуле
![]() ,
,
где ![]() - рН вытяжки;
- рН вытяжки;
![]() - рН контрольного раствора.
- рН контрольного раствора.
(рН) вытяжки рассчитывают как среднее арифметическое трех параллельных определений (с доверительной вероятностью 0,95), которые считают приемлемыми, если расхождение между наибольшим и наименьшим результатами определений не превышает 0,05 ед. рН.
(рН) контрольного раствора рассчитывают как среднее арифметическое двух параллельных определений (с доверительной вероятностью 0,95), которые считаются приемлемыми, если расхождение между ними не превышает 0,02 ед. рН.
Значение результатов определения рН округляют до десятичных долей.
5.3.3 Ультрафиолетовое поглощение
Ультрафиолетовое поглощение относится к интегральным показателям и позволяет оценить суммарное количество мигрирующих из контейнеров веществ, поглощающих в области длин волн от 230 до 360 нм.
5.3.3.1 Проведение определения
Снимают спектр поглощения водной вытяжки из контейнеров в диапазоне длин волн 230-360 нм. В качестве раствора сравнения используют контрольный раствор. Определяют максимальное значение оптической плотности в измеряемом диапазоне длин волн.
5.3.3.2 Обработка результатов
Значение оптической плотности рассчитывают как среднее арифметическое двух параллельных определений (с доверительной вероятностью 0,95), которые считаются приемлемыми, если расхождение между ними не превышает 0,02 ед. оптической плотности.
Значение результатов определения округляют до десятичных долей.
5.3.4 Определение содержания металлов
Определение содержания хрома, меди, свинца, кадмия, олова и бария проводят с помощью атомно-абсорбционного метода анализа. Сущность метода основана на измерении атомного поглощения указанных металлов в условиях, приведенных в таблицах 4 и 5.
Таблица 4 - Условия определения хрома, меди, свинца и кадмия атомно-абсорбционным методом
Элемент | Аналитическая линия, нм | Рабочий ток на лампу, мА | Тип пламени | Высота горелки, мм | Ширина щели монохронометра, мм |
Хром | 357,9 | 5 | Ацетилен-воздух | 10 | 0,25 |
Медь | 324,7 | 4 | Пропан-воздух | 14 | 0,25 |
Свинец | 283,3 | 5 | Пропан-воздух | 14 | 0,25 |
Кадмий | 228,8 | 4 | Пропан-воздух | 14 | 0,25 |
Таблица 5 - Условия определения олова и бария атомно-абсорбционным электротермическим методом
Элемент | Анали- тическая линия, нм | Рабочий ток на лампу, мА | Ширина щели монохро- нометра, мм | Температура и продолжительность обработки пробы | |||||
Высушивание | Пиролиз | Атомизация | |||||||
Темпера- тура, °С | Продол- житель- ность, с | Темпера- тура, °С | Продол- житель- ность, с | Темпера- тура, °С | Продол- житель- ность, с | ||||
Олово | 286,3 | 7,5 | 1,0 | 100 | 40 | 1700 | 10 | 2300 | 5 |
Барий | 553,5 | 10 | 1,0 | 100 | 40 | 1500 | 10 | 2500 | 5 |
5.3.4.1 Проведение анализа
5.3.4.1.1 При определении хрома, меди, свинца и кадмия анализируемый раствор распыляют в пламени при условиях, указанных в таблице 4, и измеряют атомное поглощение. Одновременно измеряют атомное поглощение контрольного раствора. Значение атомного поглощения контрольного раствора вычитают из значения атомного поглощения анализируемого раствора. Объем анализируемого раствора на один элемент определения составляет 5 мл.
Массу хрома, меди, свинца и кадмия определяют по градуировочному графику.
5.3.4.1.2 При определении олова и бария микродозатором объемом 20 мкл в графитовый анализатор последовательно вводят градуировочные растворы, контрольный и анализируемый растворы. Атомизация пробы осуществляется в атмосфере инертного газа аргона при условиях, указанных в таблице 5. Расход аргона - 0,5 л/мин. Атомное поглощение измеряют амплитудой пика, записываемой на самописец.
Массовую концентрацию олова и бария определяют по градуировочному графику.
5.3.4.1.3 Построение градуировочного графика
Для градуировки приборов применяют градуировочные растворы в соответствии с таблицей 6. Измеряют атомное поглощение приготовленных растворов, как указано в 5.3.4.1.
По полученным значениям атомного поглощения растворов и соответствующим им содержаниям определяемых элементов строят градуировочный график.
Таблица 6 - Градуировочная зависимость абсорбции от концентрации (линейный участок)
Элемент | Концентрация металлов в градуировочных растворах в мкг/мл (линейный участок градуировочной зависимости атомного поглощения от концентрации) | |||||
Хром | 0,02 | 0,05 | 0,1 | 0,5 | ||
Медь | 0,02 | 0,05 | 0,1 | 0,5 | ||
Свинец | 0,05 | 0,1 | 0,5 | 1,0 | 2,0 | |
Кадмий | 0,02 | 0,05 | 0,1 | 0,5 | 1,0 | |
Олово | 0,05 | 0,1 | 0,5 | 1,0 | 2,0 | |
Барий | 0,5 | 1,0 | 2,0 | |||
5.3.4.2 Абсолютная погрешность результатов анализа и допускаемые расхождения параллельных определений не должны превышать значений, указанных в таблице 7.
Таблица 7 - Диапазон и характеристики погрешностей результатов анализа при доверительной вероятности =0,95
Элемент | Диапазон определяемых концентраций, мкг/мл | Абсолютная погрешность результатов анализа, мкг/мл | Допускаемое расхождение двух параллельных определений, мкг/мл |
Хром | 0,02-0,5 | 0,10 | 0,14 |
Медь | 0,02-0,5 | 0,10 | 0,14 |
Свинец | 0,05-2,0 | 0,10 | 0,14 |
Кадмий | 0,02-1,0 | 0,18 | 0,25 |
Олово | 0,05-2,0 | 0,14 | 0,18 |
Барий | 0,5-2,0 | 0,12 | 0,16 |
Обозначение: | |||
5.3.5 Определение винилхлорида
Методика предназначена для определения остаточных количеств мономера винилхлорида в вытяжках из контейнеров методом газожидкостной хроматографии равновесной паровой фазы ("head space").
5.3.5.1 Калибровка газового хроматографа
Калибровку прибора осуществляют с помощью растворов винилхлорида в дистиллированной воде. Все работы, связанные с приготовлением и использованием растворов винилхлорида, проводят с соблюдением условий герметичности. Стеклянный флакон вместимостью 60-65 мл заполняют взвешенным количеством дистиллированной воды (до 0,1 мг) так, чтобы объем незаполненного пространства составлял примерно 1,0 мл. Затем флаконы герметизируют с помощью резиновой прокладки и пластмассовой крышки с отверстием посередине. С целью предотвращения сорбции паров раствора резиновой прокладкой ее изолируют алюминиевой фольгой.
Затем во флакон вводят шприцем примерно 1 мл (около 2,5 мг) газообразного винилхлорида, массу которого определяют взвешиванием с точностью до 0,1 мг. Получают раствор с концентрацией винилхлорида примерно 40 мг/л (раствор 1), который тщательно перемешивают в течение 15 мин. 1,5 мл полученного раствора вводят в стеклянный стакан вместимостью 60-65 мл, заполненный дистиллированной водой, как описано выше. Получают раствор винилхлорида с концентрацией примерно 1,1 мг/л (раствор 2). Из этих растворов, используя набор микрошприцев и флаконов, подготовленных аналогично вышеизложенному, готовят серию стандартных растворов с концентрациями 0,001-0,01 мг/л (из раствора 2) и 0,05-0,1 мг/л (из раствора 1). В заранее приготовленные загерметизированные пенициллиновые флаконы шприцем отбирают по 3 мл каждого из приготовленных стандартных растворов. Затем эти флаконы термостатируют на кипящей водяной бане в течение 40-50 мин. По истечении указанного времени подогретым шприцем отбирают по 2 мл паровой фазы из каждой пробы и вводят в испаритель хроматографа.
5.3.5.2 Условия хроматографирования
Температуры:
- термостата колонок 60 °С;
- испарителя 90 °С;
- детектора 100 °С.
Скорости газов:
- гелия 30 мл/мин;
- водорода 30 мл/мин;
- воздуха 300 мл/мин.
Время выхода винилхлорида 24 с.
Допускается изменение условий хроматографирования в пределах, обеспечивающих определение винилхлорида в соответствии с требованиями методики.
Площади пиков обсчитывают с помощью интегратора. При отсутствии интегратора площади пиков рассчитывают как произведение высоты на среднюю линию пика. Строят калибровочный график в координатах: по оси абсцисс - концентрация винилхлорида , мг/л, по оси ординат - площади пиков
, мкВ·с. Предел обнаружения винилхлорида 0,0005 мг/л. Калибровку проводят не реже одного раза в месяц. В случае неисправности прибора после устранения неполадок необходимо откалибровать прибор заново.
5.3.5.3 Проведение анализа
Для определения винилхлорида в вытяжках от партии контейнеров отбирают не менее трех изделий. Вытяжки из контейнеров, приготовленные в соответствии с 5.3.5.1 и 5.3.5.2, отбирают непосредственно из изделий путем прокола иглой шприца донорской трубки. Из каждого контейнера отбирают не менее двух проб по 3 мл каждая.
3 мл отобранной вытяжки помещают в заранее подготовленные загерметизированные пенициллиновые флаконы. Затем флаконы термостатируют на водяной бане 40-50 мин. 2 мл паровой фазы отбирают подогретым шприцем и вводят в испаритель хроматографа.
Из каждого флакона для анализа отбирают не менее трех параллельных проб.
Концентрацию винилхлорида в вытяжке из контейнеров , мг/л, рассчитывают по формуле
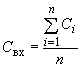 ,
,
где - концентрация винилхлорида в пробе, найденная по калибровочному графику, мг/л;
- число проб.
С целью оценки полученных результатов для выборки каждого отобранного из партии образца рассчитывают среднее арифметическое и среднее квадратическое отклонения, по которым уже для каждой выборки рассчитывают коэффициент вариации :
![]() ,
,
где - среднее квадратическое отклонение;
- среднее арифметическое отклонение.
В случае получения значения коэффициента вариации более 15% хотя бы для одной из выборок, определение повторяют. Если значение коэффициента вариации для каждой из выборок менее или равно 15%, то результат считают статистически значимым.
5.3.6 Определение диоктилфталата (ДОФ) - пластификатора
Пластификатор ДОФ определяют в водной вытяжке из контейнеров путем экстракции его водно-спиртовым раствором с последующим снятием спектра поглощения в УФ области в диапазоне длин волн от 230 до 360 нм.
5.3.6.1 Построение калибровочного графика
Снимают спектры поглощения стандартных растворов с концентрацией ДОФ: 1, 2, 5, 10 и 20 мг/100 мл. В качестве раствора сравнения используют экстрагирующий водно-спиртовой раствор. Строят график в координатах: по оси ординат - оптическая плотность при максимуме поглощения () при 272 нм, по оси абсцисс - концентрация ДОФ
, мг/100 мл.
5.3.6.2 Экстрагирование ДОФ
Через узел для взятия крови заполняют три пустых полимерных контейнера до половины их номинальной вместимости. Используют предварительно нагретый до температуры (37±2) °С экстрагирующий водно-спиртовой раствор. Полностью удаляют из контейнеров воздух и герметично закрывают узел для взятия крови. Заполненные контейнеры в горизонтальном положении погружают на (60±1) мин в водяной термостат, не встряхивая. По истечении указанного времени извлекают контейнеры из термостата, аккуратно перевертывают 10 раз и переливают содержимое контейнеров в стеклянную колбу со шлифом.
5.3.6.3 Определение ДОФ в вытяжках из контейнеров
Снимают спектр поглощения экстракта из контейнеров, используя в качестве раствора сравнения экстрагирующий водно-спиртовой раствор. Определение проводят не менее чем в двух параллельных пробах из одного и того же экстракта. Измеряют оптическую плотность при максимуме поглощения ().
5.3.6.4 Обработка результатов
Содержание ДОФ в экстракте определяют путем сравнения результатов, полученных для контейнеров, с данными калибровочного графика для стандартных растворов.
Значение концентрации ДОФ рассчитывают как среднее арифметическое двух результатов параллельных определений (с доверительной вероятностью 0,95), которые считаются приемлемыми, если расхождение между ними не превышает 0,02 ед. оптической плотности.
Значение результатов определения округляют до десятичных долей.
5.4 Токсикологические исследования
Требования к изделиям по показателям токсичности должны соответствовать приведенным в таблице 1.
5.4.1 Определение острой токсичности на белых мышах
Вытяжки из изделий испытывают на беспородных белых мышах-самцах массой 18-25 г, прошедших 7-дневный карантин. В опытной и контрольной группах должно быть не менее 8 животных. Водные вытяжки в количестве 50 мл на килограмм массы тела животных вводят однократно внутрибрюшинно. Животным контрольной группы в том же объеме вводят дистиллированную воду. Через 24 ч после введения вытяжек состояние животных оценивают по следующим тестам:
- масса тела в граммах - определяют до введения вытяжек и через сутки после введения, натощак;
- общее состояние животных: поведение, подвижность, состояние шерстного покрова - сразу после введения, через 4 и 24 ч после введения;
- макроскопическая оценка состояния внутренних органов и тканей на вскрытии - животных через 24 ч умерщвляют декапитацией. Сначала вскрывают контрольную группу, затем подопытную, обращая внимание на область введения вытяжки, состояние подкожной клетчатки, брюшины, мышц брюшной стенки, региональных лимфоузлов и их протоков, внутренних органов;
- взвешивание внутренних органов: печени, почек, селезенки - определение коэффициентов массы внутренних органов делением массы органа в миллиграммах на массу тела в граммах. Полученные цифровые данные подлежат статистической обработке с использованием критерия "t" Стьюдента. В случае получения достоверной разницы между подопытной и контрольной группами по двум из исследуемых показателей вытяжка из изделия признается токсичной. При обнаружении достоверного отличия по одному из показателей состояния животных испытания следует повторить на удвоенном количестве животных. При повторном обнаружении достоверных различий изделие считают токсичным. В случае гибели 1-2 животных испытание повторяют на удвоенном количестве животных (по 16 мышей в каждой группе). При гибели хотя бы одного подопытного животного при повторном испытании изделие считают токсичным.
5.4.2 Определение раздражающего действия на кожу белых крыс и слизистую глаза кролика
Определение раздражающего действия на кожу белых крыс и слизистую глаза кролика проводят на белых крысах при нанесении экстракта из изделия на кожу выстриженного бока либо на кроликах при инстилляции экстракта в конъюнктивальный мешок глаза.
На белых крысах испытания проводят при ежедневном в течение 7 дней нанесении 1 мл экстракта из изделия на участок 2х2 см выстриженного бока. Контрольным животным аналогичным образом апплицируют контрольный раствор. В каждой группе должно быть по 8 животных. Каждый день до и после аппликации отмечают реакцию кожи на контакт с вытяжкой в соответствии с классификацией, приведенной в таблице 8.
Таблица 8 - Оценка кожно-раздражающего действия
Кожная реакция | Оценка о баллах |
Эритема | |
Нет эритемы | 0 |
Очень слабая эритема | 1 |
Отчетливая эритема | 2 |
Средняя эритема | 3 |
Сильная эритема (свекольно-красная) | 4 |
Образование отека | |
Нет отека | 0 |
Очень слабый отек | 1 |
Отчетливый отек | 2 |
Средний отек (возвышение на 1 мм) | 3 |
Сильный отек (возвышение более 1 мм) | 4 |
Общий возможный балл, оценивающий раздражение, - 8. | |
Для получения индекса раздражения для одного животного надо сложить баллы раздражения как по эритеме, так и по отеку для всех сроков обследования и разделить на число обследований. Общий индекс раздражения сравнивают с приведенным в таблице 9.
Таблица 9 - Оценка кожно-раздражающего действия
Кожная реакция | Средний балл |
Не принимается во внимание | 0-0,4 |
Слабая реакция | 0,5-1,9 |
Средняя реакция | 2-4,9 |
Сильная реакция | 5-8 |
Изучение раздражающего действия на слизистую глаза проводят на 3 кроликах, которым в один глаз вносят вытяжку ежедневно в течение 5 дней с помощью пипетки по 1-2 капли. Состояние глаз контролируют через 1 и 24 ч, перед следующим воздействием.
Реакцию учитывают в соответствии со шкалой, приведенной в таблице 10.
Таблица 10 - Оценка раздражающего действия на слизистую глаза
Реакция слизистой оболочки | Оценка в баллах |
Реакции нет | 0 |
Легкое покраснение конъюнктивы | 1 |
Покраснение конъюнктивы и частично склеры | 2 |
Резкое покраснение конъюнктивы и всей склеры, гнойный офтальмит | 3 |
Результаты обследования каждого из 3 кроликов суммируют и делят на число обследований. Общий индекс раздражения определяют по таблице 10.
5.4.3 Определение сенсибилизирующего действия на белых крысах
Определение сенсибилизирующего действия проводят на белых крысах. В каждой группе должно быть не менее 8 животных. Сенсибилизируют животных при введении 0,02 мл вытяжки из контейнеров в кожу наружной поверхности уха. Контрольным животным вводят контрольный раствор - дистиллированную воду. Через 10 дней проводят 5-7 ежедневных эпикутанных аппликаций вытяжки, нанося на кожу выстриженного бока по 0,5 мл вытяжки. На следующий день после последней аппликации проводят провокационную внутрикожную пробу. Для этого 0,02 мл вытяжки инъецируют в кожу другого выстриженного бока животного. Реакцию на провокационную внутрикожную пробу отмечают через 15 мин, 24 и 48 ч, отмечая интенсивность покраснения и площадь гиперемированного участка. Через 48 ч после введения внутрикожной пробы животных забивают декапитацией, отбирая кровь для проведения специфических иммунологических реакций. Используют иммунологические тесты, основанные на определении образования комплекса антиген-антитело: реакцию дегрануляции тучных клеток (РДТК), реакцию пассивной гемагглютинации (РПГА), реакцию связывания комплемента (РСК), реакцию специфической агломерации лейкоцитов (РСАЛ), реакцию специфического лизиса лейкоцитов (РССЛ). До начала проведения иммунологических специфических реакций необходимо тщательно подобрать рабочую концентрацию вытяжки, не вызывающую денатурации сывороточных белков и не оказывающую цитотоксического действия.
У забитых животных определяют коэффициенты массы иммунокомпетентных органов - селезенки и тимуса и обрабатывают полученный материал статистически с определением коэффициента "t" Стьюдента.
При оценке сенсибилизирующего эффекта учитывают результаты внутрикожной пробы, определения коэффициентов массы внутренних органов и иммунологических тестов с кровью животных.
5.4.4 Определение гемолитической активности
5.4.4.1 Принцип метода-определение гемолитического действия вытяжки по 100%-ному гемолизу.
5.4.4.2 Вытяжки готовятся в соответствии с 4.1.
5.4.4.3 Приготовление 10%-ной взвеси эритроцитов
Для приготовления взвеси эритроцитов может быть использована эритроцитная масса или цитратная кровь, заготовленная на 3,9%-ном растворе цитрата натрия в соотношении 1:9. Срок хранения цитратной крови (эритроцитной массы) 72 ч при температуре от 4 до 6 °С. 5 мл крови (эритроцитной массы) центрифугируют 10 мин при 2000 об/мин. Надосадочную жидкость сливают, к осадку добавляют 8 мл стерильного 0,9%-ного раствора хлористого натрия. Содержимое взбалтывают и центрифугируют 10 мин при 2000 об/мин. Надосадочную жидкость сливают. Эту операцию (отмывание клеток) повторяют два раза. После отмывания надосадочная жидкость должна быть прозрачна, бесцветна и не иметь следов гемолиза.
Если надосадочная жидкость не отвечает указанным требованиям, эритроциты не могут быть использованы для приготовления взвеси.
Для получения 10%-ной взвеси эритроцитов 1 мл осадка клеток смешивают с 9 мл 0,9%-ного раствора хлористого натрия. Полученную взвесь эритроцитов допускается хранить не более 24 ч при температуре от 4 до 6 °С в холодильнике.
5.4.4.4 Приготовление проб (контрольной и с 100%-ным гемолизом)
5.4.4.4.1 а) Контрольная проба - 0,5 мл 10%-ной взвеси эритроцитов и 5 мл 0,9%-ного раствора хлористого натрия - для контейнеров "Компопласт".
б) Контрольная проба - 0,5 мл 10%-ной взвеси эритроцитов и 5 мл раствора "Глюгицир" (в стекле), используемого в качестве контрольного образца данной испытуемой партии, - для контейнеров "Гемакон".
5.4.4.4.2 Проба с 100%-ным гемолизом: 0,5 мл 10%-ной взвеси эритроцитов и 5 мл дистиллированной воды - происходит полное разрушение эритроцитов, что соответствует 100%-ному гемолизу.
Контрольную пробу и пробу с 100%-ным гемолизом готовят для каждого образца эритроцитной взвеси.
5.4.4.5 Проведение определения
В три пробирки помещают по 0,5 мл 10%-ной взвеси эритроцитов. К 0,5 мл 10%-ной взвеси эритроцитов в каждую пробирку прибавляют по 5 мл вытяжки, в которую предварительно добавлен хлористый натрий. Смесь ставят в термостат на 1 ч при температуре (37±2) °С, затем центрифугируют в течение 20 мин при 2000 об/мин.
Все манипуляции по отношению к контрольной пробе и пробе с 100%-ным гемолизом проводят параллельно с опытными пробами, как описано выше. Надосадочную жидкость отделяют для проведения измерений оптической плотности.
5.4.4.6 Оптические измерения
Оптическую плотность опытной, контрольной пробы и пробы с 100%-ным гемолизом измеряют на фотоэлектроколориметре при длине волны 540 нм против "холостой" пробы (вода). Толщина кюветы 1 см.
Результаты регистрируют по оптической плотности.
5.4.4.7 Расчет процента гемолиза проводят по формуле
Процент гемолиза = ![]() ,
,
где - оптическая плотность опытной пробы;
- оптическая плотность контрольной пробы;
- оптическая плотность воды со взвесью эритроцитов - 100%-ный гемолиз;
- поправочный коэффициент, учитывающий дополнительное разбавление дистиллированной водой при условии, что
>1,0.
Примечание - Если оптическая плотность контрольной пробы (10%-ная эритроцитная взвесь с 0,9%-ным раствором хлористого натрия) составляет 0,03 и более, результаты всего опыта недостоверны и не учитываются.
Оптическая плотность раствора с 100%-ным гемолизом должна быть не менее 0,8 и не более 1,0.
В случае отклонения от указанного предела опыт следует повторить с вновь приготовленной эритроцитной взвесью.
5.4.4.8 Оценка результатов
Испытуемое изделие свободно от гемолитически действующих веществ, если процент гемолиза во всех трех пробах менее двух.
Если процент гемолиза одной пробы более 2, опыт следует повторить. При получении такого же результата вытяжку считают гемолитически активной, и дальнейшие испытания не проводят.
В случае отсутствия гемолитического действия проводят дальнейшие токсикологические испытания.
5.4.5 Определение индекса токсичности на сперматозоидах быка
5.4.5.1 Все растворы в течение эксперимента должны находиться при постоянной температуре (40+1,5) °С.
5.4.5.2 Для определения индекса токсичности опытного раствора необходимо сравнить его с контрольным (модельным) раствором. В качестве контрольного раствора выбирают глюкозо-цитратную среду (глюкоза - 4 г, цитрат натрия 1 г, дистиллированная вода 100 мл). Контрольная среда одновременно является разбавителем для оттаивания замороженной спермы. Опытным раствором является вытяжка из изделия, доведенная до изотонии глюкозой и цитратом (глюкоза - 4 г, цитрат 1 г, вытяжка 100 мл). Контрольный и опытный растворы по 1 мл помещают в пробирки с притертыми пробками и ставят в водяную баню при температуре (40+1,5) °С. Контрольный и опытный растворы приготавливают заранее, за час до начала эксперимента.
5.4.5.3 Оттаивание замороженной спермы
Дозируют в пробирки по 0,25 или 0,5 мл разбавителя и ставят их в водяную баню при температуре (40+1,5) °С. Охлажденным до температуры жидкого азота анатомическим пинцетом извлекают из сосуда Дьюара гранулу спермы и быстро опускают в нагретый раствор. НЕ ДОПУСКАЕТСЯ ОТТАИВАТЬ НЕСКОЛЬКО ГРАНУЛ В ОДНОЙ ПРОБИРКЕ! Сразу после размораживания содержимое пробирок с целью приготовления маточного раствора спермы сливают в пробирку и тщательно перемешивают.
5.4.5.4 Приготовление рабочих образцов
В каждую пробирку контрольной и опытной серий помещают по 0,2 мл маточного раствора спермы.
5.4.5.5 Подготовка пробы к исследованию
Каждый рабочий образец переносят в кювету. Кювету герметизируют, устанавливают в кюветодержатель и помещают в стенд.
5.4.5.6 Накопление экспериментальных данных
Нажатием кнопки "ПУСК" включают процесс накопления данных. При достижении нулевых значений показателя подвижности во всех кюветах отжатием кнопки "ПУСК" производят остановку процесса накопления данных.
5.4.5.7 Обработка экспериментальных данных
Обработку экспериментальных данных осуществляют с помощью компьютера. Для каждого образца рассчитывают среднее время подвижности в условных единицах
![]() ,
,
где -
-e значение показателя подвижности;
- текущий номер оценки показателя подвижности.
Для контрольной и опытной выборок образцов вычисляют среднее арифметическое значение и среднее квадратическое отклонение, по которым в свою очередь рассчитывают для каждой выборки коэффициент вариации по формуле
![]() ,
,
где - среднее квадратическое отклонение;
- среднее арифметическое значение.
В случае получения значения коэффициента вариации более 15% хотя бы для одной из выборок, эксперимент повторяют. Если значение коэффициента вариации для каждой из выборок меньше или равно 15%, результаты считаются статистически верными.
Затем рассчитывают индекс токсичности по формуле
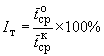 ,
,
гдe ,
- среднее арифметическое значений среднего времени подвижности для опытной и контрольной выборок образцов соответственно.
5.4.5.8 Оценка результатов контроля
Испытуемую партию изделий считают нетоксичной, если индекс токсичности в пределах 70-120%. Во всех остальных случаях партию изделий считают токсичной.
5.4.6 Испытания на стерильность
5.4.6.1 Испытания на стерильность методом прямого посева
5.4.6.1.1 Отбор проб
Количество проб, отбираемых для первичного посева, составляет 0,4, где
- количество изделий в серии или партии.
Максимальное количество проб, отбираемых для первичного посева, составляет: 13 - при паровом методе стерилизации; 40 - при радиационном методе стерилизации.
Кроме изделий, направленных непосредственно на анализ, отбирают также дубликаты в тройном количестве: две части из них используют в случае необходимости для повторного контроля, одну часть оставляют для арбитражного хранения.
5.4.6.1.2 Испытания на стерильность
Испытания на стерильность проводят методом прямого посева в тиогликолевую среду. Посевы помещают в термостат при температуре 32 °С и выдерживают 8 сут при паровом методе стерилизации или 14 сут при радиационном методе стерилизации, после чего проводят учет результатов.
5.4.6.2 Испытания на стерильность с использованием биотестов
5.4.6.2.1 Методика контроля стерильности полимерных контейнеров, стерилизованных паровым методом с помощью биотестов
5.4.6.2.1.1 Требования к биотесту
5.4.6.2.1.1.1 Биотест представляет собой носитель (инсулиновый флакон), содержащий споры микроорганизмов Вас. Stearothrmophilus ВКМ В-718 с регламентированной устойчивостью к пару.
5.4.6.2.1.1.2 Биотесты поставляются в комплекте, состоящем из носителей с высушенными спорами микроорганизма; цветной питательной среды; стерильного шприца и стерильных резиновых пробок размером 6,5; термовременных бумажных индикаторов; соответствующих эталонов цвета питательной среды и термоиндикаторов, а также инструкции по применению комплекта. Изготовитель биотестов должен быть аттестован.
5.4.6.2.1.1.3 Каждая партия биотестов сопровождается паспортом с указанием:
- метода стерилизации, для которого предназначен биотест;
- названия культуры микроорганизма;
- количества спор в биотесте;
- устойчивости биотеста к пару;
- номера партии;
- срока годности;
- условий хранения;
- наименования предприятия-изготовителя.
5.4.6.2.1.2 Контроль стерильности
5.4.6.2.1.2.1 Контролю подвергают каждую серию продукции, изготовленную на одном предприятии и простерилизованную в одной стерилизационной камере за один цикл. Биотесты должны быть упакованы в пакеты из упаковочной бумаги, запечатанные в полиэтиленовые пакеты.
5.4.6.2.1.2.2 Число и расположение биотестов в стерилизационной камере зависят от размера камеры и типа стерилизатора (прямоугольный, круглый) в соответствии с таблицей 11.
Таблица 11 - Расположение контрольных точек в паровых стерилизаторах
Емкость камеры стерилизатора, дм | Общее число контрольных точек | Расположение контрольных точек | |
в стерилизационных коробках | вне стерилизационных коробок | ||
До 100 | 5 | 3 | 2 |
Св. 100 до 750 | 11 | 9 | 2 |
Св. 750 | 13 | 11 | 2 |
Примечание - Точка 1 - у загрузочной двери; 2 - у противоположной стенки (разгрузочной двери); 3-13 - внутри стерилизационной камеры на разных уровнях или внутри стерилизуемых упаковок. | |||
5.4.6.2.1.2.3 На предприятиях, длительное время осуществляющих стерилизацию на собственной базе, периодичность контроля, количество биотестов, помещаемых в камеру, могут быть изменены.
5.4.6.2.1.2.4 Методика и техника исследования биотестов
После цикла стерилизации биотесты извлекают и собирают в полиэтиленовый пакет, где они хранятся до проведения контроля стерильности. Для определения жизнеспособности популяции спор носители (флаконы) вынимают из защитной упаковки (до исследования флаконы допускается хранить 2 недели в холодильнике). Резиновую пробку флакона с индикаторной питательной средой обрабатывают спиртом и прокалывают стерильной иглой с ватным фильтром. Затем пробку прокалывают иглой шприца и набирают в него питательную среду из флакона. Над огнем спиртовки в каждый биотест наливают примерно по 1 мл цветной питательной среды, флаконы закрывают стерильной резиновой пробкой и оставляют в термостате при 55 °С на 48 ч.
5.4.6.2.1.2.5 Обработка результатов
Обработку результатов исследования биотестов проводят после термостатирования в течение 48 ч. Предварительный учет результатов проводят через 24 ч.
О гибели спор в биотесте в процессе стерилизации свидетельствует неизменный цвет по всех биотестах-флаконах. После сравнения с эталонами делается вывод об эффективности процесса стерилизации и о стерильности данной партии продукции. Если цвет питательной среды во флаконе-биотесте в процессе термостатирования изменился на желтый, это свидетельствует о наличии жизнеспособных микроорганизмов. В этом случае для убедительности проводят бактериологический анализ (если в данном учреждении имеется бактериологическая лаборатория) выросших микроорганизмов. При выявлении роста тест-культуры (Вас. Stearothrmophilus) делается вывод о неэффективности процесса стерилизации и о нестерильности данной партии продукции.
5.4.6.2.2 Методика контроля стерильности полимерных контейнеров, стерилизованных радиационным методом с помощью биотестов.
5.4.6.2.2.1 Требования к биотесту
5.4.6.2.2.1.1 Биотест представляет собой носитель (шприц инъекционный однократного применения 2А или 5Б Луер по ГОСТ 24861), содержащий споры культуры микроорганизмов с радиорезистентностью не менее 2,1 кГр, например. Вас. Subtilis JSY 228.
5.4.6.2.2.1.2 Биотесты поставляются в комплекте, состоящем из носителей со спорами и индикаторной питательной среды, расфасованной во флаконы. Изготовитель биотестов должен быть аттестован.
5.4.6.2.2.1.3 Каждая партия биотестов сопровождается паспортом с указанием:
- метода стерилизации, для которого предназначен биотест;
- стерилизующей дозы, на которую рассчитан биотест;
- названия культуры микроорганизмов;
- количества микробных клеток;
- радиорезистентности культуры микроорганизмов;
- номера партии;
- срока годности;
- условий хранения;
- наименования предприятия-изготовителя.
5.4.6.2.2.2 Контроль стерильности
5.4.6.2.2.2.1 Контролю стерильности подвергают каждую партию стерилизуемой продукции. Партией считают однотипную продукцию, изготовленную на одном предприятии и простерилизованную за один технологический цикл. Для проведения контроля биотесты помещают в коробки (ящики) с продукцией между индивидуальными упаковками. В каждую коробку (ящик) укладывают 5 биотестов. Каждую коробку (ящик), содержащую биотест, маркируют. Коробки (ящики), содержащие биотесты, облучают одновременно с контролируемой продукцией. Допускается использовать фантомы, имитирующие облучаемую продукцию.
5.4.6.2.2.2.2 Для гамма-установок с периодическим технологическим циклом на каждый цикл 3 коробки (ящика) с биотестами размещают в местах поля гамма-установок с наименьшей мощностью дозы. Для гамма-установок с непрерывным технологическим циклом коробку (ящик) с биотестами помещают на транспортное устройство через каждые 2 ч работы установки, но не менее 3 коробок на партию продукции. Для ускорителей электронов, работающих в циклическом режиме, на каждый цикл используют одну коробку (ящик) с биотестами. Для ускорителей электронов, работающих в непрерывном режиме, - одну коробку через каждые 2 ч работы, но не менее 3 коробок на партию продукции.
5.4.6.2.2.2.3 На предприятиях, осуществляющих стерилизацию на собственной базе, по результатам оценки санитарно-гигиенического состояния производства, технологии стерилизации, вида стерилизуемой продукции могут быть изменены периодичность контроля, количество биотестов, помещаемых в коробку, количество коробок, используемых для контроля, период их помещения на транспортное устройство.
5.4.6.2.2.2.4 Методика и техника исследования биотестов
После проведения облучения партии продукции работник службы контроля качества предприятия извлекает биотесты из коробок (ящиков) и собирает в полиэтиленовый пакет, где они хранятся не менее 24 ч до проведения контроля стерильности.
Для определения жизнеспособности популяции микроорганизмов носители (шприцы) вынимают из защитной упаковки (до исследования шприцы допускается хранить в защитной упаковке 2 недели в холодильнике), снимают колпачок с иглы, прокалывают иглой обработанную спиртом резиновую пробку флакона с индикаторной питательной средой и, не освобождая цилиндр от воздуха, набирают в цилиндр 1 мл питательной среды. Колпачок вновь надевают на иглу, а шприц с питательной средой возвращают в пакет и устанавливают в термостате при температуре (37±1) °С. Пакет помещают таким образом, чтобы шприц оказался иглой вниз. Биотесты помещают в термостат и оставляют в термостате на 48 ч.
5.4.6.2.2.2.5 Обработка результатов
Обработку результатов исследования биотестов проводят после термостатирования в течение 48 ч. Предварительную обработку результатов проводят через 24 ч.
О гибели микроорганизмов в шприце-биотесте в процессе стерилизации свидетельствует неизменный цвет питательной среды (зеленый). Сохранение цвета питательной среды во всех шприцах-биотестах свидетельствует об эффективности процесса стерилизации и о стерильности данной партии продукции.
Изменение цвета питательной среды в шприце в процессе термостатирования на желтый свидетельствует о наличии жизнеспособных микроорганизмов. В этом случае проводят бактериологический анализ выросших микроорганизмов. При выявлении роста тест-культуры делают вывод о неэффективности процесса стерилизации и о нестерильности данной партии продукции.
5.4.7 Испытания на пирогенность
5.4.7.1 Испытание на пирогенность на кроликах
Отбор, содержание, подготовку животных к испытаниям, повторность их использования проводят по Государственной Фармакопеи XI издания.
Тест-доза - 10 мл на килограмм массы кролика. Вытяжку вводят в ушную вену.
Испытуемую партию продукции считают непирогенной, если после введения вытяжки ни у одного из 3 подопытных кроликов ни при одном из трех измерений не наблюдалось повышение температуры более чем на 0,6 °С по сравнению с исходной температурой и в сумме повышение температуры при каждом измерении у 3 кроликов не превышало 1,4 °С.
Если у одного или двух кроликов температура повысилась более чем на 0,6 °С и в сумме при каждом измерении у 3 кроликов повышение температуры составило более 1,4 °С, испытание повторяют дополнительно на 5 кроликах.
Партию полимерных контейнеров считают непирогенной, если не более чем у 3 из 8 кроликов наблюдалось индивидуальное повышение температуры не более чем на 0,6 °С, и общая сумма повышений температуры у всех 8 кроликов не превышала 3,7 °С.
Допускается максимальное понижение температуры на 0,6 °С. В случае понижения температуры у одного кролика более чем на 0,6 °С испытание повторяют на 5 кроликах.
Партию полимерных контейнеров считают непирогенной, если после повторного исследования ни у одного из 5 кроликов максимальное понижение температуры не превысило 0,6 °С, и не более чем у 2 кроликов из 5 температура понизилась на 0,6 °С по сравнению с исходной. В противном случае партию контейнеров бракуют.
5.4.7.2 Испытание на пирогенность методом реакции связывания комплемента
5.4.7.2.1 Приготовление раствора антител
Берут длинным анатомическим пинцетом замороженную гранулу антител из сосуда Дьюара и помещают в пробирку.
5.4.7.2.2 Приготовление раствора антигена концентрацией 5 минимальных пирогенных доз в миллилитрах.
Вскрывают ампулу с липополисахаридом, содержащую 500 минимальных пирогенных доз в 1 мл. 0,1 мл этого препарата переливают в пробирку с 0,9 мл апирогенного раствора хлорида натрия. Приготовленный раствор тщательно перемешивают, при этом концентрация антигена в нем составляет 50 минимальных пирогенных доз в 1 мл. Берут 0,1 мл этого раствора и переливают в пробирку с 0,9 мл апирогенного раствора хлорида натрия. После этого концентрация антигена будет составлять 5 минимальных пирогенных доз в 1 мл.
5.4.7.2.3 Приготовление раствора комплемента
Берут длинным анатомическим пинцетом гранулу замороженного комплемента и помещают в пробирку.
5.4.7.2.4 Приготовление опытного образца
В пробирку с притертой пробкой наливают 1 мл испытуемого образца вытяжки, антитела и комплемент согласно паспорту. Содержимое пробирки перемешивают встряхиванием.
5.4.7.2.5 Приготовление контрольного образца с отрицательной реакцией
В пробирку с притертой пробкой наливают 1 мл раствора хлорида натрия, антитела и комплемент согласно паспорту. Содержимое пробирки перемешивают встряхиванием.
5.4.7.2.6 Приготовление контрольного образца с положительной реакцией
В пробирку с притертой пробкой наливают 0,1 мл раствора антигена по 5.4.7.2.2 и добавляют антитела и комплемент согласно паспорту. Содержимое пробирки перемешивают встряхиванием.
5.4.7.2.7 Опытный и контрольные образцы помещают в термостат. Проводят инкубацию в течение 18-24 ч при температуре (27±2) °С в термостате или при температуре (5±2) °С в холодильнике. Рекомендуемый температурный режим - в соответствии с указанным в паспорте.
5.4.7.2.8 Приготовление биосенсорной системы
В пробирки отмеряют пипеткой объем разбавителя, указанный в паспорте, ставят их в водяную баню при температуре (40+1,5) °С. В каждую пробирку добавляют объем антител, указанный в паспорте, тщательно перемешивают встряхиванием. Длинным анатомическим пинцетом, охлажденным до температуры жидкого азота, извлекают из сосуда Дьюара гранулу спермы и быстро опускают в нагретый раствор. После оттаивания гранулы содержимое пробирки перемешивают и выдерживают 15 мин. НЕ ДОПУСКАЕТСЯ ОТТАИВАТЬ НЕСКОЛЬКО ГРАНУЛ В ОДНОЙ ПРОБИРКЕ! Содержимое пробирок сливают в одну и перемешивают встряхиванием. Получается маточный раствор спермы.
5.4.7.2.9 Приготовление рабочих образцов
В каждую пробирку контрольной и опытной серий добавляют по 0,2 мл маточного раствора спермы.
5.4.7.2.10 Подготовка пробы к исследованию на стенде
Каждый рабочий образец переносят в кювету. Затем кювету устанавливают в кюветодержатель стенда.
5.4.7.2.11 Проведение накопления экспериментальных данных
Нажатием кнопки "ПУСК" включают процесс накопления. При достижении нулевых значений показателя подвижности во всех кюветах или по желанию оператора проводят остановку процесса накопления данных отжатием кнопки "ПУСК".
5.4.7.2.12 Обработка экспериментальных данных
Для каждого образца выживаемость рассчитывают по формуле
![]() ,
,
где -
-е значение показателя подвижности;
- текущий номер оценки показателя подвижности;
- количество оценок показателя подвижности.
5.4.7.2.13 Оценка результатов контроля
5.4.7.2.13.1 Если для контрольных образцов с положительной и отрицательной реакциями выполнено соотношение
![]() ,
,
где и
- среднее арифметическое выживаемости выборок образцов положительного и отрицательного контроля, то оценивают результаты испытаний образцов по 5.4.7.2.13.2. В любом другом случае испытания повторяют, начиная с 5.4.7.2. Если при повторных испытаниях результат будет таким же, испытания повторяют с новым набором реактивов и посуды.
5.4.7.2.13.2 Оценка результатов испытаний образца вытяжки
Если ![]() , образец считают апирогенным;
, образец считают апирогенным;
если ![]() , образец признают пирогенным,
, образец признают пирогенным,
где - среднее арифметическое выживаемости выборки образцов опыта.
При обнаружении пирогенности испытания по 5.4.7.2 необходимо повторить. При этом вытяжку приготавливают из вновь отобранных изделий. При получении такого же результата вытяжку признают пирогенной.
Результаты приемочных испытаний оформляют токсикологическим заключением. Результаты приемо-сдаточных и сертификационных испытаний оформляют протоколами.
ПРИЛОЖЕНИЕ А
(обязательное)
СРЕДСТВА КОНТРОЛЯ, ВСПОМОГАТЕЛЬНЫЕ УСТРОЙСТВА И ХИМИЧЕСКИЕ РЕАКТИВЫ
Таблица А.1
Вид испытания, процедура | Применяемое оборудование, реактивы | Требования к оборудованию и реактивам | Номер государственного стандарта |
Приготовление вытяжек | Оборудование | ||
Термостат | Температура (70±2) °С | ||
Стерилизатор воздушный | Температура (180+2) °С | ||
Стерилизатор паровой | Температура (120+2) °С | ||
Давление пара (1,1+0,2) кг/см | |||
Весы | Погрешность взвешивания 0,1 г | ||
Колбы конические со шлифом | Объем 250, 500, 1000 мл | ГОСТ 1770 | |
Бутылки стеклянные для крови, трансфузионных и инфузионных препаратов | Объем 250 мл | ГОСТ 10782 | |
Цилиндр | Объем 50 и 100 мл | ГОСТ 1770 | |
Реактивы | |||
Вода дистиллированная | ГОСТ 6709 | ||
Стерильный, апирогенный, изотонический раствор 0,9%-ного хлорида натрия | |||
Санитарно-химические испытания | |||
Восстановительные примеси | Оборудование | ||
Весы аналитические | Погрешность взвешивания 0,0002 г | ||
Секундомер | ГОСТ 8.423 | ||
Бюретка | Объем 5 мл; | ГОСТ 29251 | |
Колбы мерные | Объем 100 и 1000 мл | ГОСТ 1770 | |
Пипетки мерные | Объем 0,1-20 мл | ГОСТ 29227 | |
Колбы конические со шлифом | Объем 250 мл | ГОСТ 1770 | |
Реактивы | |||
Калий марганцовокислый KMnО | х.ч. | ГОСТ 20490 | |
0,002 н. раствор (готовят в день проведения анализа из 0,1 н. раствора) | |||
Натрия тиосульфат кристаллический 0,1 н. раствор; | х.ч. | ГОСТ 244 | |
0,02 н. раствор (готовят в день проведения анализа из 0,1 н. раствора) | |||
Калий йодистый | х.ч. | ГОСТ 4232 | |
Кислота серная Н | х.ч., плотность 1,84 г/мл | ГОСТ 4204 | |
Крахмал растворимый 0,5%-ный раствор | х.ч. | ГОСТ 10163 | |
Изменение величины рН вытяжки | Оборудование |
|
|
Вода дистиллированная | ГОСТ 6709 | ||
Ультрафиолетовое поглощение | Оборудование | ||
УФ-спектрофотометр | Рабочий диапазон длин волн от 230 до 360 нм | ||
Кюветы из кварцевого стекла | Толщина 1,0 см | ||
Определение металлов | Оборудование | ||
Спектрометр атомно-флюоресцентный для определения хрома, меди, свинца, кадмия | Тип АФА "Квант-444" | ||
Спектрометр атомно-абсорбционный с графитовым атомизатором для определения олова и бария | Тип "Квант-Зееман ЭТАЛ-233" | ||
Самописец | Тип СП-КСП-4 | ГОСТ 7164 | |
Микродозатор пипеточный | Тип П1-0,02 | ||
Лампы с полым катодом на хром, медь, свинец, кадмий, олово и барий | Тип ЛТ-2 | ||
Весы лабораторные аналитические | 2-й класс точности | ГОСТ 24104 | |
Ацетилен растворенный и газообразный | ГОСТ 5457 | ||
Пропан-бутан: смесь в баллонах | |||
Воздух сжатый в баллонах* | ГОСТ 17433 | ||
Аргон высокой чистоты | |||
Редуктор ацетиленовый | |||
Плитка электрическая с закрытой спиралью | ГОСТ 14919 | ||
Пипетки градуировочные | Объем 1-10 мл | ГОСТ 29227 | |
Колбы мерные | Объем 25-500 мл | ГОСТ 1770 | |
Стаканчики (бюкса) для взвешивания | Тип СВ | ГОСТ 25336 | |
Стаканы термостойкие | Объем 50-100 мл | ГОСТ 25336 | |
Реактивы | |||
Кадмий высокой чистоты | ГОСТ 22860 | ||
Свинец высокой чистоты | ГОСТ 22861 | ||
Олово металлическое | ГОСТ 860 | ||
Медь металлическая | ГОСТ 859 | ||
Хром металлический | ГОСТ 5905 | ||
Барий хлористый | ГОСТ 4108 | ||
Кислота азотная | ГОСТ 4461 | ||
Кислота соляная | ГОСТ 3118 | ||
Вода дистиллированная | ГОСТ 6709 | ||
Стандартный раствор хрома концентрацией 1 мг/мл; готовят следующим образом: | Устойчив в течение года | ||
0,5000 г хрома растворяют в 30 мл 18%-ной (об.) соляной кислоты, доводят до 500 мл дистиллированной водой | |||
Стандартные растворы меди, свинца и кадмия концентрацией 1 мг/мл; готовят следующим образом: | Устойчивы в течение года | ||
0,5000 г соответствующего металла растворяют в 20 мл 50%-ной (об.) азотной кислоты, доводят до 500 мл дистиллированной водой | |||
Стандартный раствор олова концентрацией 1 мг/мл; готовят следующим образом: | Устойчив в течение 2 мес. | ||
0,5000 г олова растворяют в 40 мл царской водки, добавляют 60 мл концентрированной азотной кислоты, доводят до 500 мл дистиллированной водой | Хранят в полиэтиленовой посуде | ||
Стандартный раствор бария концентрацией 1 мг/мл; готовят следующим образом: | Устойчив в течение года | ||
0,8893 г бария хлорида 2-водного растворяют в дистиллированной воде, добавляют 20 мл концентрированной соляной кислоты, доводят до 500 мл дистиллированной водой | |||
Растворы хрома, меди, свинца, кадмия, бария и олова концентрацией 0,1 мг/мл; готовят разбавлением соответствующих стандартных растворов концентрацией 1 мг/мл дистиллированной водой | Устойчивы в течение 2-3 мес. | ||
Градуировочные растворы концентрацией металлов 2 мкг/мл и 10 мкг/мл; готовят разбавлением растворов металлов концентрацией 0,1 мг/мл дистиллированной водой | Устойчивы в течение 2-3 недель | ||
Градуировочные растворы концентрацией 0,02; 0,05 и 0,1 мкг/мл; готовят разбавлением растворов металлов концентрацией 1 мкг/мл дистиллированной водой | Устойчивы в течение 1-2 дней | ||
Градуировочные растворы олова должны содержать 5% (об.) концентрированной азотной кислоты; хранят их в полиэтиленовой посуде | Устойчивы в течение 1-й недели | ||
Определение винилхлорида | Оборудование | ||
Газовый хроматограф с пламенно-ионизационным детектором и интегратором | Тип 3700, | ||
Баллоны со сжатыми газами: | |||
- гелием | ГОСТ 15860 | ||
- водородом** | ГОСТ 3022 | ||
- воздухом** | ГОСТ 17433 | ||
Шприц стеклянный | Объем 1,0 мл; цена деления 0,02 мл | ||
Шприц стеклянный | Объем 1-5 мл | ||
Шприц газовый | Объем 1-5 мл | ||
Шприц микролитровый | Объем 50-500 мкл | ||
Весы аналитические | Погрешность взвешивания 0,1 мг | ||
Секундомер | ГОСТ 8.423 | ||
Флаконы стеклянные с резиновыми прокладками и пластмассовыми крышками с отверстиями посередине | Объем 60-65 мл | ||
Стальная колонка 1,8 м х 3 мм, заполненная 10%-ным Carbovax 20M на Cromosorb W-AW-DMCS 80/100 меш. | |||
Флаконы пенициллиновые с силиконовыми прокладками и герметичными крышками | Объем 10 мл | ||
Реактивы | |||
Винил хлористый С | Технический | ||
Вода дистиллированная | ГОСТ 6709 | ||
Определение диоктилфталата | Оборудование | ||
УФ-спектрофотометр | Рабочий диапазон длин волн от 230 до 360 нм | ||
Кюветы из кварцевого стекла | Толщина 1,0 см | ||
Термостат водяной | Температура (37±2) °С | ||
Пикнометр | Рабочий диапазон плотностей 0,9373-0,9378 г/мл | ||
Секундомер | ГОСТ 8.423 | ||
Весы аналитические | Погрешность взвешивания 0,0002 г | ||
Колбы мерные | Объем 100-1000 мл | ГОСТ 1770 | |
Пипетки мерные | Объем 1-10 мл | ГОСТ 29227 | |
Реактивы | |||
Вода дистиллированная | ГОСТ 6709 | ||
Спирт этиловый C | ГОСТ 5962 | ||
Диоктилфталат С | Плотность 0,982-0,986 г/мл | ГОСТ 8728 | |
Показатель преломления при 20 °С равен 1,486-1,487 | |||
Экстрагирующий раствор: | Плотность по пикнометру 0,9373-0,9378 г/мл | ||
смесь дистиллированной воды и этилового спирта | |||
Раствор диоктилфталата в этиловом спирте концентрацией 1 г/100 мл | |||
Стандартные растворы диоктилфталата в экстрагирующем растворе концентрациями: 1; 2; 5; 10; 20 мг/100 мл | |||
Токсикологические испытания | |||
Определение гемолитической активности | Оборудование | ||
Центрифуга | 6000 об/мин | ||
Фотометр | Тип КФК-3 | ||
Пробирки химические | Объем 1-5 мл | ГОСТ 1770 | |
Пипетки | Объем 1-2 мл | ГОСТ 29227 | |
Штатив для пробирок | |||
Шприцы | Объем 1-5 мл | ||
Вата | ГОСТ 5556 | ||
Ножницы | |||
Реактивы | |||
Спирт этиловый 96%-ный | ГОСТ 5962 | ||
Хлорид натрия - водный | ГОСТ 4233 | ||
Натрий лимонно-кислый | ГОСТ 22280 | ||
Определение острой токсичности | Оборудование | ||
Весы лабораторные | Типа ВЛКТ-500 | ГОСТ 24104 | |
Шприцы | Объем 2 мл | ||
Лупа | |||
Определение раздражающего действия | Стаканчик химический | Объем 50 и 100 мл | ГОСТ 23932 |
Пипетка глазная | |||
Шпатель | |||
Лупа | |||
Определение сенсибилизирующей активности | Шприц | Объем 1 мл | |
Пипетка глазная | |||
Шпатель | |||
Весы лабораторные | Предел взвешивания 200 г | ГОСТ 24104 | |
Пробирки центрифужные | Объем 10 мл | ГОСТ 1770 | |
Центрифуга | 6000 об/мин | ||
Стекла предметные | |||
Стекла покровные | Размер 18х18 мм | ГОСТ 6672 | |
Электроплитка | |||
Микроскоп | Тип БМИ-3 | ||
Пипетки пастеровские | |||
Груши резиновые | |||
Скальпель | |||
Термостат | Температура (40±2) °С | ||
Бумага фильтровальная | ГОСТ 12026 | ||
Чашка фарфоровая | Объем 100 мл | ГОСТ 9147 | |
Реактивы | |||
Хлорид натрия - водный раствор 0,9%-ный | ГОСТ 4233 | ||
Парафин | |||
Токсикологические испытания на клеточном тест-объекте | Оборудование | ||
Стенд для испытаний на клеточном тест-объекте | Технические характеристики стенда приведены в приложении Б | ||
Пробирки с притертой пробкой - 10 шт. | Объем по 3 мл | ||
Дозатор пипеточный | Объем 0,2; 0,5 мл | ||
Мерная колба - 2 шт. | Объем 100 мл | ||
Весы аналитические | Погрешность взвешивания не более 0,001 г | ||
Пинцет анатомический | Длина 250 мм | ||
Сосуд Дьюара - 2 шт. | Тип СДС-25 | ||
Peaктивы | |||
Вода дистиллированная | ГОСТ 6709 | ||
Сперма быка замороженная | |||
Испытания на апирогенность | Оборудование | ||
Стенд для испытаний на клеточном тест-объекте | Технические характеристики стенда приведены в приложении Б | ||
Пробирки с притертой пробкой - 10 шт. | Объем по 3 мл | ||
Дозатор пипеточный | Объем 0,5; 0,2; 0,1; 0,05; 0,02 мл | ||
Весы аналитические | Погрешность взвешивания не более 0,001 г | ||
Пинцет анатомический | Длина 250 мм | ||
Сосуд Дьюара - 2 шт. | Тип СДС-25 | ||
Стерилизатор воздушный медицинский | Температура (180+2) °С | ||
Холодильник бытовой | |||
Термостат | Максимальная температура плюс 50 °С | ||
рН-метр | Тип рН-121 | ||
Реактивы | |||
Стерильный, апирогенный изотонический раствор хлорида натрия 0,9%-ный | |||
Сперма быка (замороженная в жидком азоте)*** | |||
Антитела (замороженные в жидком азоте)*** | |||
Комплемент (замороженный в жидком азоте)*** | |||
Липополисахарид (в ампуле)*** | |||
Испытания на стерильность | Оборудование | ||
Ножницы хирургические | |||
Пинцет анатомический | Длина 250 мм | ||
Термостат | Температура (40±2) °С | ||
Реактивы | |||
Питательная среда тиогликолевая*** | |||
Биотест для контроля стерильности радиационно-стерилизованных изделий*** | |||
Биотест для контроля стерильности изделий, стерилизованных паровым методом*** | |||
________________ * Допускается использование компрессора воздушного типа ПК-1, давление воздуха 4-6 кг/см ** Допускается использование генератора водорода типа СГС-2 (давление водорода 1-2 кг/см *** Поставляют в виде набора. | |||
ПРИЛОЖЕНИЕ Б
(обязательное)
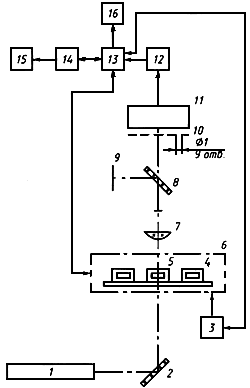
СТЕНД ДЛЯ ИСПЫТАНИЯ КОНТЕЙНЕРОВ ДЛЯ ХРАНЕНИЯ КРОВИ И ЕЕ КОМПОНЕНТОВ НА ТОКСИЧНОСТЬ И ПИРОГЕННОСТЬ
Б.1 Назначение стенда
Б.1.1 Стенд для испытания контейнеров на токсичность и пирогенность (далее - стенд) предназначен для проверки вытяжек из контейнеров на цитотоксичность и пирогенность.
Б.2 Технические характеристики стенда
Б.2.1 Длина волны лазерного излучения - 0,63 мкм.
Б.2.2 Мощность лазерного излучения не менее 1 мВт.
Б.2.3 Время одного анализа от 10 до 300 с с шагом 10 с.
Б.2.4 Время перемещения капилляра с образцом не более 2 с.
Б.2.5 Время обратного хода каретки не более 15 с.
Б.2.6 Температура проб и рабочих образцов в диапазоне 35-45 °С с шагом 1 °С. Отклонение температуры от установленного значения в пределах ±0,5 °С.
Б.2.7 Основные размеры капилляра должны соответствовать приведенным на рисунке Б.1.
Б.3 Краткое техническое описание стенда
Б.3.1 Принципиальная схема стенда и основные геометрические размеры должны соответствовать приведенным на рисунке Б.2. Конструктивное исполнение стенда обеспечивает одновременную оценку подвижности суспензии рабочего образца и визуальное наблюдение за клетками суспензии.
Рисунок Б.1 - Капилляр
1 - лазер;
2 - светоделительная пластина; 3 - блок термостатирования; 4 - каретка; 5 - капилляр; 6 - привод; 7 - микрообъектив; 8 - светоделительная пластина; 9 - экран; 10 - маска; 11 - фотодиод; 12 - усилитель; 13 - контроллер; 14 - компьютер; 15 - принтер; 16 - блок подготовки проб и рабочих образцов.
Рисунок Б.2 - Принципиальная схема стенда
Б.3.2 Проведение испытаний
Включают стенд. С помощью компьютера 14 задают контроллеру 13 необходимые значения температуры каретки и блока подготовки проб, время одного анализа, количество используемых в данном эксперименте капилляров. После получения на дисплее компьютера информации о достижении заданных значений температуры готовят рабочие образцы в соответствии с 5 4.5.4 настоящего стандарта.
Переносят рабочие образцы в капилляры и герметизируют путем поочередного окунания концов капилляров 5 в ванну с парафином, находящуюся на блоке подготовки проб, на глубину 3 мм. Помещают капилляры 5 с рабочими образцами на каретку 4 и устанавливают в привод 6. С помощью компьютера 14 проводят идентификацию капилляров и запускают процесс накопления экспериментальных данных. При достижении нулевых значений показателя подвижности во всех капиллярах останавливают процесс накопления экспериментальных данных и проводят их математическую обработку по алгоритмам, приведенным в 5.4.5.7 и 5.4.7.2.12 настоящего стандарта. Результаты расчетов распечатывают на принтере 15 и записывают в базу данных. При необходимости происходящее в капиллярах с рабочими образцами наблюдают визуально на экране 9. Поддержание необходимой температуры каретки и на блоке подготовки проб, а также перемещение каретки осуществляют автоматически с помощью контроллера 13 и компьютера 14.
Текст документа сверен по:
М.: Издательство стандартов, 1996