ГОСТ 32644-2014
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Острая пероральная токсичность - метод определения класса острой токсичности
OECD guidelines for the testing of chemicals. Acute oral toxicity - fcute toxic class method
МКС 13.020.01
Дата введения 2015-06-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ"); Техническим комитетом по стандартизации N 339 "Безопасность сырья, материалов и веществ" Федерального агентства по техническому регулированию и метрологии на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 28 марта 2014 г. N 65-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Азербайджан | AZ | Азстандарт |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Туркмения | TM | Глагосслужба "Туркменстандартлары" |
Узбекистан | UZ | Узстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 24 сентября 2014 г. N 1214-ст межгосударственный стандарт ГОСТ 32644-2014 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2015 г.
5 Настоящий стандарт идентичен международному документу OECD Test N 423:2001* "Острая пероральная токсичность - метод определения класса острой токсичности" ("Acute Oral Toxicity - Acute Toxic Class Method", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Сентябрь 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Руководства ОЭСР по испытаниям химических веществ периодически пересматриваются с учетом научного прогресса или изменений методов оценивания. Первоначальное Руководство 423 было принято в марте 1996 года, как альтернатива обычному тестированию на острую токсичность, описанному в Руководстве 401. Основанное на рекомендациях нескольких совещаний экспертов, исправление считается своевременным, так как: а) была достигнута международная договоренность по согласованным пороговым значениям ![]() для классификации химических веществ, которые отличаются от тех, что заявлены в версии Руководства 1996 года; и б) в настоящее время считается достаточным тестирование на представителях одного пола (обычно самок).
для классификации химических веществ, которые отличаются от тех, что заявлены в версии Руководства 1996 года; и б) в настоящее время считается достаточным тестирование на представителях одного пола (обычно самок).
1 Область применения
Метод острой токсичности [2], изложенный в данном руководстве, - это поэтапная процедура с использованием трех животных одного пола на каждом этапе. В зависимости от смертности и/или предсмертного состояния животных для того, чтобы сделать заключение об острой токсичности исследуемого вещества, в среднем необходимо 2-4 этапа. Эта процедура воспроизводима, использует очень небольшое количество животных и дает возможность оценить вещества таким же образом, что и другие методы тестирования острой токсичности (Руководства по тестированию 420 и 425). Метод определения класса острой токсичности основан на биометрических оценках [3, 4, 5, 6] с фиксированными дозами, которые распределены по времени приема так, чтобы было возможно оценить вещество по степени опасности и систематизировать результаты. Метод, принятый в 1996 году, был в значительной степени подтвержден in vivo, в отличие от данных по ![]() , полученных из литературы, как в масштабах страны [7], так и в международном масштабе [8].
, полученных из литературы, как в масштабах страны [7], так и в международном масштабе [8].
Руководство по выбору наиболее подходящего метода исследования для данной цели можно найти в документе Руководства по тестированию острой пероральной токсичности [9]. Этот документ руководства также содержит дополнительную информацию по проведению и толкованию Руководства по тестированию 423.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 доза (dose): Количество вводимого тестируемого вещества. Доза выражается как отношение массы тестируемого вещества к единице массы подопытного животного (например, мг/кг).
2.2 острая оральная токсичность (acute oral toxicity): Неблагоприятные явления, которые возникают после приема внутрь однократной дозы вещества или нескольких доз в течение 24 часов.
2.3 отложенная смерть (delayed death): Животное не умерло или не находится при смерти в течение 48 часов, но умирает позже, во время 14-дневного периода наблюдения.
2.4 предельная доза (limit dose): Доза, являющаяся самой большой при тестировании (2000 или 5000 мг/кг).
2.5 прогнозируемая смерть (impending death): Определенные клинические признаки, свидетельствующие о смерти в будущем, до запланированного конца эксперимента, например: неспособность добраться до воды или пищи (см. Методический документ по гуманности конечных показателей [10] для более подробной информации).
2.6 СГС (GHS): Согласованная на глобальном уровне система классификации опасности и маркировки химической продукции. Совместная деятельность ОЭСР (Организация экономического сотрудничества и развития), Комитета экспертов ООН по перевозке опасных грузов (физико-химические свойства) и МОТ (информирование об использовании опасных материалов), координируемая Межорганизационной программой по рациональному регулированию химических веществ (МПРРХВ).
2.7 угроза смерти (predictable death): Предсмертное состояние или смерть до следующей запланированной даты наблюдения. У грызунов указывающими на это знаками являются конвульсии, боковое положение, лежачее положение и тремор (см. Методический документ по гуманности конечных показателей [10] для более подробной информации).
2.8 умирающий (moribund status): Находящийся в состоянии смерти или неспособности выжить даже при лечении (см. Методический документ по гуманности конечных показателей [10] для более подробной информации).
2.9 ![]() (средняя летальная пероральная доза): Статистически определенная однократная доза вещества, которая может стать причиной смерти 50% животных при введении пероральным путем. Значение
(средняя летальная пероральная доза): Статистически определенная однократная доза вещества, которая может стать причиной смерти 50% животных при введении пероральным путем. Значение ![]() выражается в отношении массы тестируемого вещества к единице массы подопытного животного (мг/кг).
выражается в отношении массы тестируемого вещества к единице массы подопытного животного (мг/кг).
3 Принцип тестирования
Принцип исследования состоит в том, что, основываясь на поэтапной процедуре с использованием минимального количества животных на каждом этапе, появляется достаточное количество информации по острой токсичности исследуемого вещества для того, чтобы эту информацию классифицировать. Вещество вводится перорально каждой группе подопытных животных в одной из заданных доз. Вещество тестируется с помощью поэтапной процедуры, с использованием на каждом этапе трех животных одного пола (обычно самок). Отсутствие или наличие связанной с веществом смертности животных, дозируемых на одном этапе, будет определять следующий этап, т.е.:
- нет необходимости в дальнейшем исследовании,
- дозирование трех дополнительных животных такой же дозой,
- дозирование трех дополнительных животных следующим, по возрастающей или по нисходящей, уровнем дозы.
Детали процедуры исследования описаны в приложении А. Методика позволит сделать вывод относительно классификации исследуемого вещества с отнесением его к одному из разрядов классов токсичности, определяемых фиксированным ![]() пороговых значений.
пороговых значений.
Не нужно вводить тестируемые вещества в дозах, про которые известно, что они могут вызывать явную боль или недомогание из-за своего разъедающего или тяжелого раздражающего действия. Агонизирующие животные или животные, явно испытывающие боль или демонстрирующие признаки тяжелого и длительного недомогания, должны быть гуманным образом умерщвлены. Их следует учитывать в интерпретации результатов тестирования так же, как и животных, умерших во время исследования. Критерии для принятия решения об умерщвлении агонизирующих или испытывающих тяжелые боли животных, а также руководство по распознаванию прогнозируемой или неминуемой смерти отдельно рассматриваются в документе Руководства [10].
Метод использует заранее установленные дозы, и его результаты позволяют ранжировать и классифицировать вещество согласно Согласованной на глобальном уровне системе классификации опасности и маркировки химической продукции, вызывающей острую токсичность [11].
В принципе метод не предназначен для подсчета точной ![]() , но позволяет определить заданный интервал воздействия, когда предполагается летальный исход, так как смертность относительно количества животных остается главным ожидаемым результатом такого исследования.
, но позволяет определить заданный интервал воздействия, когда предполагается летальный исход, так как смертность относительно количества животных остается главным ожидаемым результатом такого исследования.
Исследовательская лаборатория должна изучить всю имеющуюся информацию по тестируемому веществу до начала исследования. Такая информация будет включать отличительные особенности и химическую структуру вещества; его физико-химические свойства; результаты любых in vitro и in vivo исследований токсичности вещества; токсикологические данные по структурно родственным веществам; предполагаемое использование вещества. Эта информация является необходимой, чтобы убедить все заинтересованные стороны относительно того, что исследование имеет важное значение для защиты здоровья человека, а также она поможет в выборе наиболее подходящей начальной дозы.
4 Описание метода
4.1 Животные
4.1.1 Выбор видов животных
Предпочтительным видом грызунов являются крысы, хотя могут использоваться и другие виды грызунов. Как правило, используются самки. Это объясняется тем, что обзоры литературы по стандартным исследованиям ![]() демонстрируют, что, хотя существует лишь небольшое различие в восприимчивости между полами, в тех случаях, когда такое различие наблюдается, самки, как правило, несколько более восприимчивы [12]. Тем не менее, если информация о токсикологических или токсикокинетических свойствах структурно родственных веществ показывает, что самцы, возможно, должны быть более восприимчивы, тогда следует использовать их. Если исследование проводится на самцах, это необходимо должным образом обосновать.
демонстрируют, что, хотя существует лишь небольшое различие в восприимчивости между полами, в тех случаях, когда такое различие наблюдается, самки, как правило, несколько более восприимчивы [12]. Тем не менее, если информация о токсикологических или токсикокинетических свойствах структурно родственных веществ показывает, что самцы, возможно, должны быть более восприимчивы, тогда следует использовать их. Если исследование проводится на самцах, это необходимо должным образом обосновать.
Следует использовать молодых здоровых половозрелых животных лабораторных видов. Самки не должны быть беременными или рожавшими. Каждое животное к началу его дозирования должно быть в возрасте от 8 до 12 недель, и ее* масса тела должна попадать в интервал +20% средней массы ранее дозируемых животных.
_______________
* Текст документа соответствует оригиналу. - .
4.1.2 Условия содержания и кормления
Температура в комнатах подопытных животных должна быть 22°С (±3°С). Хотя относительная влажность воздуха должна быть как минимум 30% и желательно не превышать 70% (если только не проводится уборка помещения), оптимальная влажность - 50-60%. Свет должен быть искусственным с последовательностью: 12 часов - свет, 12 часов - темнота. Для кормления могут использоваться традиционные лабораторные диеты с неограниченным количеством питьевой воды. Животных группировать по клеткам по дозам, но количество животных в клетке не должно мешать свободному наблюдению за каждым животным.
4.1.3 Подготовка животных
Животные выбираются случайным образом, маркируются индивидуальными идентификаторами и содержатся в своих клетках как минимум в течение 5 дней до начала дозирования, чтобы дать им возможность адаптироваться в лабораторных условиях.
4.2 Подготовка доз вещества
Как правило, исследуемое вещество должно вводиться в постоянном объеме в диапазоне доз, чтобы исследовать изменение концентрации дозируемого препарата. Когда, однако, исследуется жидкость как конечный продукт или смесь, для последующей оценки опасности этого вещества более актуальным может быть использование неразбавленного исследуемого вещества, т.е. в постоянной концентрации, и это является требованием некоторых регулирующих органов. В любом случае, объем максимальной дозы для введения превышать не следует. Максимальный объем жидкости, который может быть введен за один раз, зависит от размера подопытного животного. У грызунов объем в норме не должен превышать 1 мл/100 г массы тела; однако в случае с водными растворами можно рассматривать и 2 мл/100 г. Что касается технологии приготовления дозируемого препарата, рекомендуется, если возможно, использование водных растворов/суспензий/эмульсий; далее, по предпочтительности, следуют растворы/суспензии/эмульсии в масле (например, кукурузное) и затем возможны растворы в других средах. Для сред, отличных от воды, должны быть известны их токсикологические свойства. Дозы должны готовиться непосредственно перед введением, за исключением случаев, когда известна стабильность препарата в течение периода, когда он будет использован, и доказана его приемлемость.
4.3 Процедура проведения испытания
4.3.1 Количество и пол животных
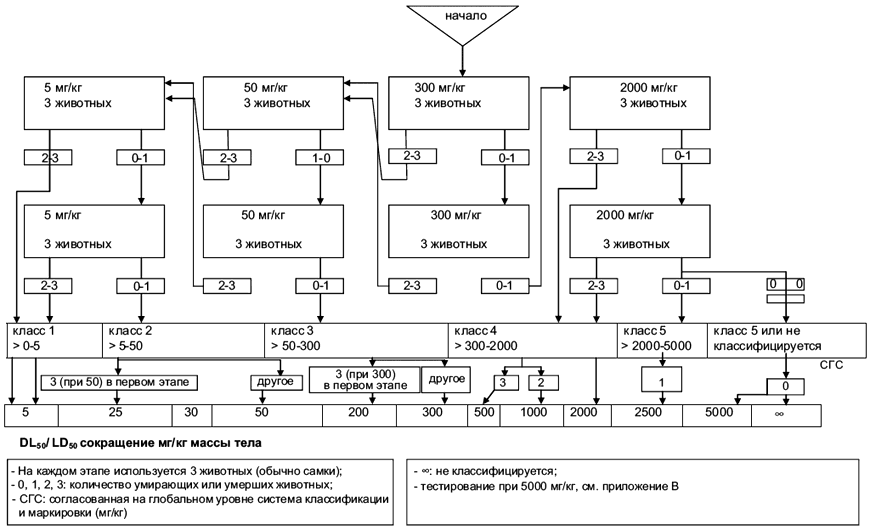
На каждом этапе используют трех животных. Уровень дозы, используемой как начальная доза, выбирается из одного из четырех фиксированных уровней: 5, 50, 300 и 2000 мг/кг массы тела. Уровень начальной дозы должен быть таким, чтобы с наибольшей вероятностью вызвать смерть некоторых из дозируемых животных. Блок-схема приложения А описывает процедуру, которой необходимо следовать для каждой из начальных доз.
Когда имеющаяся информация показывает, что на самом высоком уровне начальной дозы (2000 мг/кг массы тела) смертельный исход маловероятен, проводится испытание предельной дозы. Когда информация по тестируемому веществу отсутствует, из соображений благополучия животных рекомендуется использовать начальную дозу 300 мг/кг массы тела.
Временной интервал между экспериментальными группами определяется наступлением, продолжительностью и тяжестью признаков токсичности. Введение вещества животным в следующей дозе необходимо отложить до того момента, когда появится уверенность в выживании дозированной ранее группы.
В исключительных случаях и только тогда, когда это оправдано конкретными нормативными требованиями, можно рассматривать использование дополнительного верхнего уровня дозы в 5000 мг/кг массы тела (см. приложение В). Ввиду интересов благополучия животных их тестирование в диапазонах класса 5 (2000-5000 мг/кг) СГС не рекомендуется и должно рассматриваться только тогда, когда имеется большая вероятность, что результаты такого исследования имеют прямое отношение к защите здоровья человека или животных или окружающей среды.
4.3.2 Введение доз вещества
Исследуемое вещество вводится одной дозой через зонд с помощью желудочного зонда или подходящей полой трубки для зондирования. В чрезвычайных обстоятельствах, когда введение одной дозой невозможно, доза может вводиться небольшими порциями в течение периода, не превышающего 24 часа.
До введения дозы животные должны оставаться голодными [например, в случае с крысами пища (но не вода) должна отсутствовать всю ночь, в случае с мышами пища (но не вода) должна отсутствовать 3-4 часа]. За периодом голодания следует взвешивание животных и введение им тестируемого вещества. После того как вещество было введено, пища может отсутствовать еще 3-4 часа у крыс и 1-2 часа у мышей. Когда доза вводится порциями через промежуток времени, необходимо обеспечить животных пищей и водой в зависимости от величины этого временного промежутка.
4.3.3 Испытание предельной дозы
Испытание предельной дозы используется, прежде всего, в случаях, когда исследователь располагает информацией о том, что исследуемое вещество, вероятно, нетоксично, т.е. имеет токсичность только выше нормативного предела доз. Информация о токсичности исследуемого вещества может быть получена из сведений о схожих тестируемых соединениях или схожих тестируемых смесях или продуктах, с учетом отличий и процента компонентов с известным токсикологическим значением. В тех случаях, когда информации о токсичности вещества мало или нет совсем или когда предполагается, что исследуемое вещество токсично, должно быть проведено основное исследование.
Испытание предельной дозы в 2000 мг/кг массы тела может проводиться на шести животных (три животных на каждый этап). В особых случаях испытание предельной дозы в 2000 мг/кг массы тела может проводиться на трех животных (см. приложение В). Если имела место смертность, связанная с тестируемым веществом, может быть необходимо проведение дальнейшего исследования со следующим, более низким уровнем.
4.4 Наблюдения
Животных обследуют индивидуально после введения дозы как минимум в первые 30 минут, периодически в течение первых 24 часов (с особым вниманием в течение первых 4 часов) и ежедневно в дальнейшем все 14 дней, за исключением случаев, когда они должны быть удалены из исследования и гуманным образом умерщвлены из соображений благополучия животных или когда были найдены мертвыми. Однако длительность обследования не должна быть жестко фиксирована. Она определяется реакциями на токсичность, временем начала и длительностью восстановительного периода и может, таким образом, быть продлена, если это считается необходимым. Время, когда появляются и исчезают признаки токсичности, очень важно, особенно если имеется тенденция отсроченного проявления признаков токсичности [13]. Все наблюдения систематично регистрируются, создаются индивидуальные отчеты по каждому животному.
Понадобятся дополнительные обследования, если животные продолжают демонстрировать признаки токсичности. Обследование должно включать изменения кожи и шерсти, глаз и слизистых оболочек, дыхательной, кровеносной, вегетативной и центральной нервной систем, а также соматомоторную активность и характер поведения. Внимание должно быть направлено на наблюдения тремора, конвульсий, слюноотделения, диареи, вялости, сна и комы. Принципы и критерии, суммированные в Методическом документе по гуманности конечных показателей [10], должны быть приняты во внимание. Животные, обнаруженные в предсмертном состоянии, и животные, демонстрирующие сильные боли или длительные признаки тяжелых мучений, должны быть гуманным образом умерщвлены. Когда животные умерщвляются по гуманным соображениям или их находят умершими, время смерти следует записывать как можно точнее.
4.4.1 Масса тела
Индивидуальная масса тела животных должна быть определена непосредственно перед введением исследуемого вещества и как минимум еженедельно в дальнейшем. Изменения массы тела должны подсчитываться и записываться. В конце исследования выживших животных взвешивают и гуманным способом умерщвляют.
4.4.2 Патология
Все животные в исследовании (включая тех, что умерли во время тестирования и были удалены из исследования по соображениям благополучия животных) должны быть подвергнуты общей аутопсии. Все видимые патологические изменения должны быть записаны для каждого животного. Микроскопические исследования органов, демонстрирующих признаки общей патологии у животных, проживших 24 или более часов, также могут рассматриваться, поскольку они могут дать полезную информацию.
5 Данные исследования и отчет
5.1 Данные исследования
Должны быть обеспечены данные по отдельным животным. Все данные дополнительно суммируются в табличной форме, отображая для каждой тестируемой группы количество подопытных животных; количество животных, демонстрирующих признаки токсичности; количество животных, обнаруженных мертвыми во время исследования или умерщвленных из гуманных соображений; время смерти каждого животного; описание и период действия проявлений токсичности и их обратимость и данные аутопсии.
5.2 Отчет по результатам исследования
Отчет об исследовании должен содержать следующую информацию.
Исследуемое вещество:
- физическая природа, чистота и, при необходимости, физико-химические свойства (в том числе изомеризация);
- идентификационные данные, в том числе номер CAS.
Растворитель (при необходимости):
- обоснование выбора растворителя (если это не вода).
Подопытные животные:
- вид/род используемых животных;
- микробиологический статус животных, если известен;
- число, возраст и пол животных (в том числе, при необходимости, обоснование применения самцов вместо самок);
- происхождение, условия содержания, питание и т.д.;
Данные об условиях проведения исследования:
- подробное описание приготовления состава тестируемого вещества, включая подробную информацию о физической форме вводимого вещества;
- подробное описание введения вещества, в том числе объемы дозирования и время дозирования;
- качество пищи и воды (в том числе тип диеты/источник диеты, источник воды);
- обоснование выбора начальной дозы;
Результаты:
- сведение в таблицу данных об ответной реакции и уровне дозы для каждого животного (т.е. животные, демонстрирующие признаки токсичности, включая смертность; характер, тяжесть и продолжительность воздействий);
- таблица массы тела животного и ее изменения;
- индивидуальная масса тела животных в день дозирования, с еженедельной периодичностью, а также в момент смерти или умерщвления;
- дата и время смерти, если она произошла до запланированного умерщвления;
- время появления признаков токсичности, а также были ли они обратимы по каждому животному;
- данные аутопсии и гистопатологические данные для каждого животного, если таковые имеются.
Обсуждение и интерпретация результатов.
Заключение.
Приложение А
(рекомендуемое)
Процедура, которая должна проводиться для каждой начальной дозы
Общие сведения
1. Для каждой начальной дозы должна выполняться процедура, которая указана в схеме в данном приложении:
- А.1: начальная доза составляет 5 мг/кг массы тела;
- А.2: начальная доза составляет 50 мг/кг массы тела;
- А.3: начальная доза составляет 300 мг/кг массы тела;
- А.4: начальная доза составляет 2000 мг/кг массы тела.
В зависимости от количества гуманно умерщвленных или умерших животных испытания следует проводить по указанной схеме.
А.1: начальная доза составляет 5 мг/кг массы тела
|
А.2: начальная доза 50 мг/кг массы тела
|
А.3: начальная доза 300 мг/кг массы тела
|
А.4: начальная доза 2000 мг/кг массы тела
|
Приложение В
(рекомендуемое)
Критерии для классификации исследуемых веществ с предполагаемым уровнем ![]() более 2000 мг/кг без необходимости тестирования
более 2000 мг/кг без необходимости тестирования
В.1 Критерий опасности класса 5 предназначен для идентификации исследуемых веществ, которые имеют относительно низкую опасность острой токсичности, но которые, при определенных обстоятельствах, могут представлять опасность для уязвимых групп населения. Эти вещества, как ожидается, имеют прероральную или дермальную ![]() в диапазоне 2000-5000 мг/кг или эквивалентные дозы при других способах введения. Исследуемое вещество должно быть отнесено к классу опасности, определяемой по формуле: 2000 мг/кг
в диапазоне 2000-5000 мг/кг или эквивалентные дозы при других способах введения. Исследуемое вещество должно быть отнесено к классу опасности, определяемой по формуле: 2000 мг/кг![]() 5000 мг/кг (класс 5 в СГС) в следующих случаях:
5000 мг/кг (класс 5 в СГС) в следующих случаях:
а) любая из схем тестирования А.1-А.4, приложение А, основанная на случаях смертности, относится к этому классу;
б) если уже есть достоверные доказательства того, что ![]() находится в диапазоне класса 5, или другие исследования на животных или данных токсического воздействия на человеке вызывают опасение за здоровье человека из-за остронаправленного действия вещества;
находится в диапазоне класса 5, или другие исследования на животных или данных токсического воздействия на человеке вызывают опасение за здоровье человека из-за остронаправленного действия вещества;
в) если путем экстраполяций, оценкой и измерениями данных принадлежность к более опасному классу не подтверждается и
- достоверная информация свидетельствует о существенных токсических реакциях у людей, или
- при испытаниях до уровней 4 класса (при введении пероральным путем) наблюдается смертность, или
- если мнение экспертов подтверждает явные клинические признаки токсичности, при испытаниях до уровней 4 категории, за исключением диареи, пилоэрекции, неопрятного внешнего вида, или
- если мнение экспертов подтверждает достоверную информацию о возможности значительного острого воздействия из других исследований на животных.
В.2 Тестирование при дозах выше 2000 мг/кг
Признавая необходимость защиты животных, тестирование животных в диапазоне класса 5 (5000 мг/кг) удручает, и его следует рассматривать только тогда, когда есть большая вероятность того, что результаты таких испытаний имеют прямое отношение к охране здоровья человека или животных [10]. Никакие дальнейшие исследования при более высоких дозах проводиться не должны.
Когда исследование требует дозировки 5000 мг/кг, нужен только один этап (т.е. три животных). Если первое животное, получившее дозу, умирает, то дозирование сокращается до 2000 мг/кг в соответствии с блок-схемой в Приложении А. Если первое животное выживет, дозируются два следующих животных. Если только одно из трех животных умирает, то значение ![]() предположительно превысит 5000 мг/кг. Если оба животных погибают, то дозирование сокращается до 2000 мг/кг.
предположительно превысит 5000 мг/кг. Если оба животных погибают, то дозирование сокращается до 2000 мг/кг.
Библиография
[1] | Руководящий документ OECD Test N 423 "Acute Oral Toxicity - Acute Toxic Class Method" |
[2] | Roll R., |
[3] | Roll R., |
[4] | Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, 559-610 |
[5] | Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 729-734 |
[6] | Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alternatives to |
[7] | Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic-Class Method - An Alternative to the LD50 Test. Arch. Toxicol. 66, 455-470 |
[8] | Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 659-670 |
[9] | OECD (2000) Guidance Document on Acute Oral Toxicity. Environmental Health and Safety Monograph Series on Testing and Assessment N 24 |
[10] | OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation Environmental Health and Safety Monograph Series on Testing and Assessment N 19 |
[11] | OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p.11 |
[12] | Lipnick R.L., Cotruvo, J.A., Hill R.N., Bruce R.D., Stitzel K.A., Walker A.P., Chu I.; Goddard M., Segal L/, Springer J A and Myers R С (1995)/ Comparison of the Up-and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, 223-231 |
[13] | Chan P.K. and Hayes A.W. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA |
УДК 661:615.099 | МКС 13.020.01 |
Ключевые слова: химическая продукция, воздействие на организм человека, метод испытаний, острая пероральная токсичность, класс острой токсичности | |
Электронный текст документа
и сверен по:
, 2019