ГОСТ 32477-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Определение биоаккумуляции на придонных малощетинковых червях
Testing of chemicals of environmental hazard. Bioaccumulation in Sediment-dwelling Benthic Oligochaetes
МКС 71.100.01
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 5 ноября 2013 г. N 61-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Азербайджан | AZ | Азстандарт |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 800-ст межгосударственный стандарт ГОСТ 32477-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD Test No. 315:2008* "Биоаккумуляция придонными малощетинковыми червями" ("Bioaccumulation in Sediment-dwelling Benthic Oligochaetes", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Май 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Эндобентос, потребляющий донные отложения, может подвергаться воздействию химических веществ, содержащихся в них [1]. Среди подобных организмов, потребляющих донные отложения, большое значение имеют водные олигохеты (малощетинковые черви), обитающие в придонных слоях водных систем. Данные организмы обитают в осадочных отложениях и часто являются наиболее многочисленными, особенно в местах с неблагоприятными экологическими условиями для других организмов. Поскольку данные животные проводят биотурбацию осадка и являются пищей для других организмов, водные олигохеты могут оказывать сильное влияние на биодоступность химических веществ для других организмов, например бентосных рыб. В отличие от эпибентосных организмов эндобентосные водные олигохеты роют норы в осадке и потребляют частицы нижнего (неповерхностного) слоя осадка. По этой причине данные организмы подвержены воздействию химических веществ различных путей поступления, в том числе в результате прямого контакта, употребления в пищу загрязненных частиц осадка, поровой воды и воды водного объекта. Некоторые виды донных олигохет, которые в настоящее время используют в экотоксикологических испытаниях, описаны в приложении А.
Параметры, характеризующие биоаккумуляцию вещества, включают прежде всего фактор биоаккумуляции (BAF), константу скорости поглощения осадка и константу скорости выведения
.
Для оценки потенциала биоаккумуляции химических веществ в целом, а также для изучения биоаккумуляции веществ, которые имеют тенденцию к распределению на поверхности и в толще осадка, необходим специальный метод испытания [1]-[4].
1 Область применения
Настоящий стандарт устанавливает методы для оценки биоаккумуляции содержащихся в осадке (связанных) химических веществ на малощетинковых червях. Исследуемое вещество вводят в осадок. Использование такого осадка предназначено для имитации загрязненных отложений.
Описываемый метод используют для стабильных, нейтральных органических химических веществ, которые включаются в осадок. Рассматриваемый метод используют для оценки биоаккумуляции ассоциированных с осадком, стабильных металлорганических соединений [12]. Метод не применим для металлов и других микроэлементов [11] без изменения структуры испытания в части субстрата и объема воды и, возможно, размера образца.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 искусственный осадок, или смешанный, реконструированный, или синтетический осадок (artificial sediment): Смесь материалов, используемых для имитации физических компонентов природных донных отложений.
2.2 биоаккумуляция (bioaccumulation): Увеличение концентрации исследуемого вещества в организме по отношению к концентрации этого же вещества в окружающей среде. Биоаккумуляция является результатом процессов биоконцентрации и биоманификации.
2.3 фактор биоаккумуляции (bioaccumulation factor (BAF): концентрация исследуемого вещества в/на тестовом организме ( в граммах на килограмм сырого или сухого веса), отнесенная к концентрации исследуемого вещества в окружающей среде (
в граммах на килограмм сырого или сухого веса осадка) в любое время фазы поглощения в данном тесте. Для соответствия единицам измерения
и
BAF выражается в килограммах осадка на килограмм червя (15).
2.4 кинетический фактор биоаккумуляции (bioaccumulation factors (![]() ): Коэффициент биоаккумуляции, рассчитанный непосредственно из соотношения константы скорости поглощения осадка и константы скорости выведения.
): Коэффициент биоаккумуляции, рассчитанный непосредственно из соотношения константы скорости поглощения осадка и константы скорости выведения.
2.5 биоконцентрирование (bioconcentration): Увеличение концентрации исследуемого вещества в/на организме исключительно в результате поглощения через поверхность тела по отношению к концентрации исследуемого вещества в окружающей среде.
2.6 биоманификация (biomagnification): Увеличение концентрации исследуемого вещества в/на организме, главным образом в результате поглощения загрязненной пищи или добычи по отношению к концентрации исследуемого вещества в пище или добыче. Биоманификация может привести к передаче или накоплению исследуемого вещества по пищевой цепи.
2.7 фактор аккумуляции биота-осадок (biota sediment accumulation factor (BSAF): Липиднормированная концентрация исследуемого вещества в равновесном состоянии в/на тестовом организме, отнесенная к нормализованной по органическому углероду концентрации вещества в осадке в равновесном состоянии. здесь выражается в граммах на килограмм содержания липидов в организме и
- в граммах на килограмм органического материала в осадке.
2.8 период кондиционирования (conditioning period): Период стабилизации микробиологической составляющей осадка и удаления, например, аммиака, содержащегося в компонентах осадка; данную процедуру проводят до внесения исследуемого вещества в осадок. Как правило, поверхностные воды после кондиционирования удаляют.
2.9 выведение исследуемого вещества (elimination): Удаление вещества из тканей тестового организма в активном или пассивном процессе, который происходит независимо от наличия или отсутствия исследуемого вещества в окружающей среде.
2.10 фаза выведения (elimination phase): Период времени после переноса контрольных организмов из среды с исследуемым веществом в среду, не содержащую исследуемое вещество, в течение которого исследуется выведение (или удаление) вещества из тестовых организмов.
2.11 константа скорости выведения (elimination rate constant ): Числовое значение, определяющее скорость снижения концентрации исследуемого вещества в/на тестовом организме после переноса его из среды с исследуемым веществом в среду, не содержащую исследуемое вещество;
выражается в день
.
2.12 период равновесия (equilibration period): Период, использующийся для обеспечения распределения исследуемого вещества между твердой фазой, поровой водой и поверхностной водой; это происходит после внесения исследуемого вещества в осадок и до внесения тестовых организмов.
2.13 коэффициент распределения н-октанол-вода (octano - water partitioning coefficient ): Отношение растворимости вещества в н-октаноле и в воде в равновесном состоянии, иногда выражается в виде
. Логарифм
(
![]() ) используется в качестве показателя потенциальной способности вещества к биоаккумуляции в водных организмах.
) используется в качестве показателя потенциальной способности вещества к биоаккумуляции в водных организмах.
2.14 коэффициент распределения органический углерод-вода (organic carbon - water partitioning coefficient ): Отношение концентрации вещества в/на фракции органического углерода в отложениях и концентрации вещества в воде в состоянии равновесия.
2.15 поверхностная вода (overlying water): Вода на поверхности осадка в тестовом сосуде.
2.16 плато или равновесное состояние (plateau or steady state): Равновесие между процессами поглощения и выведения, которые происходят одновременно во время экспозиции. Устойчивое состояние достигается, когда на графике BAF для каждого периода отбора проб в момент времени кривая становится параллельна оси времени и три последовательных анализа BAF, проведенных для проб, отобранных с интервалом не менее двух дней, находятся в диапазоне ±20% друг от друга, и нет статистически значимых различий между данными тремя периодами отбора проб. Для тестовых веществ, которые поглощаются медленно, более приемлемыми являются промежутки времени в семь дней [5].
2.17 поровая вода или интерстициальная вода (pore or interstitial water): Вода, занимающая пространство между осадком или частицами почвы.
2.18 константа скорости поглощения (sediment uptake rate constant ): Числовое значение, определяющее темпы роста концентрации исследуемого вещества в/на тестовом организме в результате поглощения осадка.
выражается в граммах осадка на килограмм червя в день.
2.19 привитый осадок (spiked sediment): Осадок, в который было внесено исследуемое вещество.
2.20 фактор биоаккумуляции в равновесном состоянии (steady state bioaccumulation factor ![]() ): Представляет собой BAF в равновесном состоянии и существенно не изменяется в течение длительного периода времени, концентрация исследуемого вещества в окружающей среде (
): Представляет собой BAF в равновесном состоянии и существенно не изменяется в течение длительного периода времени, концентрация исследуемого вещества в окружающей среде ( выражается в граммах на килограмм сырого или сухого веса осадка) является постоянной в течение данного периода времени.
2.21 фаза поглощения или фаза воздействия (uptake or exposure phase): Время, в течение которого тестовые организмы подвергаются воздействию исследуемого вещества.
3 Предварительные условия и информация об исследуемом веществе
3.1 В настоящее время существует всего несколько доступных хорошо описанных количественных зависимостей "структура - активность" (QSAR), затрагивающих процессы биоаккумуляции [14]. Наиболее широко используемым соотношением является корреляция между биоаккумуляцией и биоконцентрацией стойких органических веществ и их липофильностью (выражается как логарифм коэффициента распределения н-октанол/вода (![]() )), которая была разработана для описания распределения вещества между водой и рыбой. Корреляция для содержания в осадке была также установлена с использованием данного соотношения [15]-[18]. Корреляция
)), которая была разработана для описания распределения вещества между водой и рыбой. Корреляция для содержания в осадке была также установлена с использованием данного соотношения [15]-[18]. Корреляция ![]() в качестве основного QSAR может быть полезна для первой предварительной оценки потенциала биоаккумуляции ассоциированных с осадком химических веществ. Тем не менее BAF может зависеть от содержания липидов в тестовом организме и содержания органического углерода в отложениях. Поэтому
в качестве основного QSAR может быть полезна для первой предварительной оценки потенциала биоаккумуляции ассоциированных с осадком химических веществ. Тем не менее BAF может зависеть от содержания липидов в тестовом организме и содержания органического углерода в отложениях. Поэтому также может быть использован в качестве основного детерминанта биоаккумуляции ассоциированных с осадком органических веществ.
3.2 Настоящий метод используется для:
- стойких органических веществ, имеющих значения ![]() от 3,0 до 6,0 [5], [19] и липофильных веществ, имеющих значения
от 3,0 до 6,0 [5], [19] и липофильных веществ, имеющих значения ![]() более 6,0 [5];
более 6,0 [5];
- веществ, которые относятся к классу органических соединений, известных своей способностью к биоаккумуляции в живых организмах, например, поверхностно-активных веществ или веществ, обладающих значительной адсорбционной способностью (например, с высоким ).
3.3 Информация об исследуемом веществе (например, меры предосторожности, надлежащие условия хранения и стабильность, аналитические методы) должна быть собрана до начала исследования. Руководство по испытаниям химических веществ с физико-химическими свойствами, создающими трудности для исследования, приведено в [20] и [21]. До проведения испытания биоаккумуляции на водных олигохетах об исследуемом веществе должна быть известна следующая информация:
- общепринятое наименование, химическое наименование (желательно по номенклатуре IUPAC), структурная формула, номер CAS, чистота;
- растворимость в воде (Руководство 105; [22]);
- коэффициент распределения н-октанол - вода, (Руководство 107, 117; [22]);
- коэффициент распределения осадок - вода, выраженный как или
(Руководство 121 [22]);
- гидролиз (Руководство 111; [22]);
- фототрансформации в воде [23];
- давление пара (Руководство 104; [22]);
- биоразлагаемость (Руководство 301 F и 310; [22]);
- поверхностное натяжение (Руководство 115; [22]);
- критическая концентрация мицеллообразования [24].
Кроме того, может быть необходима следующая информация при наличии:
- биоразлагаемость в водной среде (Руководство 308 и 309; [22]);
- константа Генри.
3.4 Радиоактивное маркирование исследуемых веществ может облегчить анализ воды, донных отложений и биологических образцов и может быть использовано, когда необходимо провести идентификацию и количественное определение продуктов разложения. Данный метод был проверен в международном межлабораторном исследовании [12] для веществ . Если измеряется общее количество радиоактивных остатков, BAF основывается на исходном соединении, включая любые связанные с ним продукты разложения. Кроме того, можно объединить исследования метаболизма с исследованием биоаккумуляции путем анализа и количественной оценки процента исходного соединения и продуктов его разложения в образцах, отобранных в конце фазы поглощения или на пиковом уровне биоаккумуляции. В любом случае рекомендуется, чтобы расчет BAF был основан на концентрации исходного соединения в организмах и не только на общем количестве радиоактивных остатков.
3.5 В дополнение к свойствам исследуемого вещества требуется также информация о токсичности для водных олигохет, используемых в испытании, такая, как средняя летальная концентрация для времени, необходимого для фазы поглощения, так как выбранная концентрация должна быть значительно ниже токсичного уровня. Если возможно, предпочтение должно отдаваться величинам токсичности, полученным в долгосрочных исследованиях на сублетальных показателях (
). Если такие данные отсутствуют, полезная информация может быть получена в тесте на острую токсичность в условиях, идентичных условиям испытания биоаккумуляции, или из данных о токсичности для других суррогатных (замещающих) видов.
3.6 Для использования должны быть доступны соответствующий аналитический метод с известной точностью и чувствительностью для количественного определения вещества в тестовых растворах, осадке и в биологическом материале, а также информация о подготовке и хранении образцов и паспорт безопасности вещества. Должны быть известны аналитические пределы обнаружения исследуемого вещества в воде, осадке и тканях тестового организма. Если используется маркированное вещество, также должны быть известны удельная радиоактивность (т.е. ![]() ), положение меченого атома и процент радиоактивности, связанный с примесями. Удельная радиоактивность исследуемого вещества должна быть как можно выше для возможности обнаружения как можно более низких тестовых концентраций [11].
), положение меченого атома и процент радиоактивности, связанный с примесями. Удельная радиоактивность исследуемого вещества должна быть как можно выше для возможности обнаружения как можно более низких тестовых концентраций [11].
3.7 Должны быть известны информация о характеристиках осадка, который будет использоваться [(например, происхождение осадка или его компонентов, рН и концентрация аммиака в поровой воде (полевые отложения)], содержание общего органического углерода (ООУ), распределение частиц по размерам (соотношение песка, ила и глины) и сухой остаток [6].
4 Принцип метода
4.1 Испытание состоит из двух стадий: фаза поглощения (экспозиция) и фаза выведения (пост-экспозиция). Во время фазы поглощения червей подвергают воздействию осадка, содержащего исследуемое вещество, с поверхностным слоем реконструированной воды, уравновешенного соответствующим образом [11]. Контрольные группы червей находятся в аналогичных условиях, но без содержания исследуемого вещества.
4.2 Для фазы выведения червей перемещают в систему осадок - вода, не содержащую исследуемого вещества. Фаза выведения необходима для получения информации о скорости, с которой тестовые организмы выделяют исследуемое вещество [19], [25]. Фаза выведения требуется всегда, если поглощение исследуемого вещества во время фазы экспозиции было незначительным (например, нет статистической разницы между концентрацией исследуемого вещества в тестовом и контрольном организмах). Если равновесное состояние не было достигнуто во время фазы поглощения, определение кинетики - ![]() , констант скорости поглощения и выведения - может быть сделано с использованием результатов фазы выведения. Изменение концентрации исследуемого вещества в/на черве контролируют на протяжении обоих этапов испытания.
, констант скорости поглощения и выведения - может быть сделано с использованием результатов фазы выведения. Изменение концентрации исследуемого вещества в/на черве контролируют на протяжении обоих этапов испытания.
4.3 Во время фазы поглощения измерения проводят до момента выхода BAF на плато или достижения равновесного состояния. По умолчанию продолжительность фазы поглощения должна составлять 28 дней. Практический опыт показывает, что фаза поглощения продолжительностью от 12 до 14 дней достаточна для ряда устойчивых, нейтральных органических веществ для достижения равновесного состояния [6], [8], [9].
4.4 Однако, если равновесное состояние не достигается в течение 28 дней, фаза выведения начинается с переноса водных олигохет в сосуды, содержащие ту же среду, но без исследуемого вещества. Фаза выведения заканчивается, когда либо достигается 10% уровень концентрации, измеренной в червях на 28-й день фазы поглощения, либо через 10 дней (максимальной продолжительности). Остаточный уровень в червях в конце фазы выведения регистрируется в качестве дополнительной конечной точки, например, как невыведенный остаток (NER). Коэффициент биоаккумуляции ![]() рассчитывают как соотношение концентрации в черве
рассчитывают как соотношение концентрации в черве и в осадке
при очевидном равновесном состоянии и как кинетический фактор биоаккумуляции
![]() как соотношение константы скорости поглощения из осадка
как соотношение константы скорости поглощения из осадка и константы скорости выведения
, предполагая кинетику первого порядка. Если стационарное состояние не достигается в течение 28 дней,
![]() рассчитывают из констант скоростей поглощения и выведения. Расчет приведен в приложении В. Если использование кинетики первого порядка является неприемлемым, необходимо использовать более сложные модели.
рассчитывают из констант скоростей поглощения и выведения. Расчет приведен в приложении В. Если использование кинетики первого порядка является неприемлемым, необходимо использовать более сложные модели.
4.5 Если плато не достигается в течение 28 дней, фаза поглощения может быть продлена для отобранных групп червей с проведением дальнейших измерений до достижения равновесного состояния; параллельно фаза выведения должна быть запущена на 28-й день фазы поглощения.
4.6 Константа скорости поглощения, константа скорости выведения (или константы, когда используют более сложные модели), кинетический фактор биоаккумуляции ![]() и по возможности доверительные интервалы для каждого из данных параметров рассчитывают из модельных уравнений (приложение В для моделей). Адекватность любой модели может быть определена из коэффициентов корреляции или коэффициентов детерминации (коэффициенты, близкие к 1, указывают на хорошую аппроксимацию).
и по возможности доверительные интервалы для каждого из данных параметров рассчитывают из модельных уравнений (приложение В для моделей). Адекватность любой модели может быть определена из коэффициентов корреляции или коэффициентов детерминации (коэффициенты, близкие к 1, указывают на хорошую аппроксимацию).
4.7 Для уменьшения вариабельности в результатах испытаний для органических веществ с высокой липофильностью коэффициенты биоаккумуляции должны быть дополнительно выражены в связи с содержанием липидов в тестовых организмах и содержания органического углерода (ООУ) в осадке (фактор аккумуляции в биоте-осадке или BSAF в килограммах ТОС в осадке на килограмм содержания липидов в черве). Данный подход основан на опытных и теоретических соотношениях для водной среды, где для некоторых классов химических веществ есть четкая взаимосвязь между способностью вещества к биоаккумуляции и его липофильностью, которая была четко установлена для рыб в качестве модельного организма [14], [25], [27].
Существует также взаимосвязь между содержанием липидов в тестовой рыбе и наблюдаемой биоаккумуляцией подобных веществ. Для донных организмов были установлены аналогичные корреляции [15]-[18]. Если доступно достаточное количество ткани червя, содержание липидов в тестовых организмах может быть определено с использованием того же биологического материала, что и для определения концентрации исследуемого вещества. Тем не менее целесообразно использовать акклиматизированных контрольных животных по крайней мере в начале или предпочтительно в конце фазы поглощения для измерения содержания липидов, которые затем могут быть использованы для нормализации значений BAF.
5 Достоверность испытания
Для того чтобы испытание могло считаться достоверным, должны быть выполнены следующие условия:
- совокупная смертность червей (контрольных и тестовых) на конец испытания не должна превышать 20% первоначального количества;
- кроме того, должно быть показано, что черви роют ходы в осадке для обеспечения максимального воздействия. Для более подробной информации см. 6.5.
6 Описание метода
6.1 Тестовые виды
6.1.1 В испытании могут быть использованы несколько видов водных олигохет. Наиболее часто используемые виды перечислены в приложении А.
6.1.2 Чтобы продемонстрировать состояние тестовых организмов, исследования токсичности (96 ч только в воде) следует проводить регулярно (например, раз в месяц) со стандартными токсичными веществами, такими, как хлорид калия KCI или медный купорос ![]() [1], [6]. Если исследования со стандартным тестовым веществом не проводят регулярно, группа организмов, которых будут использовать в исследовании биаккумуляции, должна быть протестирована с помощью стандартных токсичных веществ. Измерение содержания липидов также может дать полезную информацию о состоянии организмов.
[1], [6]. Если исследования со стандартным тестовым веществом не проводят регулярно, группа организмов, которых будут использовать в исследовании биаккумуляции, должна быть протестирована с помощью стандартных токсичных веществ. Измерение содержания липидов также может дать полезную информацию о состоянии организмов.
6.2 Культура тестовых организмов
Для получения достаточного количества червей для проведения испытания червей необходимо содержать постоянно в отдельной лабораторной культуре. Лабораторные методы культивирования отдельных тестовых видов приведены в приложении А. Для более подробной информации см. ссылки [8]-[10], [18], [28]-[32].
6.3 Оборудование
Следует проявлять осторожность, чтобы избежать использования в оборудовании материалов, которые могут растворять, поглощать исследуемое вещество или вступать с ним в реакцию и оказать тем самым негативное влияние на тестовые организмы. Могут быть использованы стандартные прямоугольные или цилиндрические камеры, изготовленные из химически инертного материала и подходящие емкости в соответствии с величиной загрузки, то есть количеством тестовых червей. Следует избегать использования мягких пластиковых трубок для введения воды или воздуха. Тефлон, нержавеющую сталь и/или стекло следует использовать для любого оборудования, вступающего в контакт с тестовой средой. Для веществ с высоким коэффициентом адсорбции также может быть необходимо использование таких веществ, как синтетические пиретроиды, силанизированные стекла. В этом случае оборудование должно быть уничтожено после использования [5]. Для маркированных веществ и летучих химических веществ следует соблюдать осторожность, чтобы не допустить утечки исследуемого вещества. Необходимо использовать ловушки (например, стеклянные бутыли для улавливания газа), содержащие подходящие абсорбенты для удержания любых остатков, испаряющихся из тестовых камер [11].
6.4 Вода
6.4.1 Поверхностная вода должна быть такого качества, которое обеспечит выживание тестовых видов на время акклиматизации и тестирования без появления каких-либо аномалий внешнего вида или поведения. В испытании и для культивирования лабораторных видов червей в качестве поверхностной воды рекомендуется использовать реконструированную воду в соответствии с [25]. Было показано, что в такой воде могут выживать, расти и размножаться несколько тестовых видов [8], и были приведены максимально стандартизированные условия испытания и культивирования. Должны быть получены по крайней мере следующие характеристики воды: рН, электропроводность и жесткость. Полезную информацию может дать анализ воды на наличие микропримесей до проведения испытания (приложение С).
6.4.2 В период испытания вода должна быть постоянного качества. Величина рН поверхностной воды должна находиться в диапазоне от 6 до 9. Общая жесткость должна составлять 90-400 мг ![]() на литр в начале испытания [7]. Диапазоны рН и жесткости указанной реконструированной воды приведены в [25]. Если ожидается появление взаимодействия между ионами жесткости и исследуемым веществом, должно проводиться снижение жесткости воды. В приложении С приведены дополнительные критерии приемлемой воды для разбавления в соответствии с [34].
на литр в начале испытания [7]. Диапазоны рН и жесткости указанной реконструированной воды приведены в [25]. Если ожидается появление взаимодействия между ионами жесткости и исследуемым веществом, должно проводиться снижение жесткости воды. В приложении С приведены дополнительные критерии приемлемой воды для разбавления в соответствии с [34].
6.5 Осадок
6.5.1 Осадок должен быть такого качества, которое обеспечивает выживаемость и (желательно) воспроизводство тестовых организмов на время акклиматизации и периода испытаний без появления каких-либо аномалий внешнего вида или поведения. Черви должны зарываться в осадок. Роющее поведение может оказывать влияние на экспозицию и, следовательно, на BAF. Таким образом, избегание осадка или роющего поведения тестовых организмов должно быть зарегистрировано, если мутность воды позволяет проводить такие наблюдения. Черви (контрольные и тестовые) должны начинать рыть ходы в осадке в течение 24 ч после помещения в тестовые сосуды. Если роющее поведение не наблюдается или происходит избегание осадка (например, более чем на 20% по сравнению с половиной фазы поглощения), то это означает, что либо условия испытания не являются подходящими, либо тестовые организмы не являются здоровыми, либо концентрация исследуемого вещества вызывает подобное поведение. В таком случае испытание должно быть прекращено и проведено повторно с улучшенными условиями.
Дополнительная информация о поглощении осадка может быть получена с помощью методов, описанных в [35]-[36], которые определяют поглощение осадка или распределение в тестовых организмах. Если же наблюдается по крайней мере наличие или отсутствие фекальных шариков на поверхности осадка, указывающих на поглощение осадка червями, результаты испытания должны быть зарегистрированы и обработаны в отношении возможных путей воздействия.
6.5.2 Искусственный осадок, полученный на основе искусственной почвы, описание которого приведено в [40], рекомендуется использовать как для испытания, так и для культивирования лабораторных видов червей (приложение Г), так как природные осадки надлежащего качества не могут быть доступны в течение всего года. Кроме того, аборигенные организмы, а также возможное присутствие микропримесей в естественных осадках могут оказать влияние на проведение испытаний. На искусственных осадках могут выживать, расти и размножаться несколько видов [8].
6.5.3 Должны быть получены, как минимум, следующие характеристики искусственного осадка: происхождение его составляющих, распределение частиц по размерам (процентное содержание песка, ила и глины), содержание органического углерода (ООУ), содержание воды и рН. Измерение окислительно-восстановительного потенциала осадка не является обязательным. Природные осадки из незагрязненных мест также могут служить в качестве среды для испытаний и/или культивирования лабораторных культур [1]. Природные отложения должны характеризоваться по крайней мере по происхождению (место отбора), рН и содержанию аммиака в поровой воде, содержанию органического углерода (ООУ), распределению частиц по размерам (процентное содержание песка, ила и глины) и содержанию воды [6]. Рекомендуется до внесения исследуемого вещества выдерживать естественный осадок в течение семи дней в условиях дальнейших испытаний, если не предполагается образование аммиака. По окончании данного периода кондиционирования поверхностные воды должны быть удалены. Полезная информация может быть получена при проведении анализа осадка или его составляющих на наличие микропримесей до его использования.
6.6 Подготовка
Обработка природных осадков до их использования в лаборатории описана в [1], [6], [44]. Подготовка искусственного осадка описана в приложении D.
6.7 Хранение
Период хранения природного осадка в лаборатории должен быть как можно короче. Рекомендуется хранить осадок в течение максимум восьми недель при температуре (4±2)°С в темноте. В контейнерах для хранения осадка не должно быть свободного пространства для воздуха. Рекомендации по хранению искусственных осадков приведены в приложении Г.
6.8 Внесение исследуемого вещества
6.8.1 В осадок вносят исследуемое вещество. Процедура внесения вещества включает покрытие одного или нескольких компонентов осадка исследуемым веществом. Например, кварцевый песок или его часть (например, 10 г кварцевого песка на тестовую камеру) могут быть пропитаны раствором исследуемого вещества в подходящем растворителе, который затем медленно упаривают досуха. Покрытая фракция может быть затем перемешана с сырым осадком. Количество песка в смеси (исследуемое вещество - песок) должно быть принято во внимание при подготовке осадков, то есть осадок должен быть приготовлен с меньшим количеством песка [6].
6.8.2 С природными осадками исследуемое вещество может быть внесено в высушенную порцию осадка, как описано выше для искусственного осадка, или путем перемешивания исследуемого вещества с сырым осадком с последующим испарением любого растворителя. Подходящими растворителями для внесения исследуемых веществ в мокрые осадки являются этанол, метанол, монометиловый эфир этиленгликоля, диметиловый эфир этиленгликоля, диметилформамид и триэтиленгликоль [5], [34]. Токсичность и летучесть растворителя и растворимость исследуемого вещества в выбранном растворителе должны быть основными критериями для выбора подходящего растворителя. Следует уделять внимание тому, чтобы исследуемое вещество, добавленное в осадок, было тщательно и равномерно распределено внутри осадка. Повторные пробы основного осадка должны быть проанализированы для проверки концентрации исследуемого вещества в осадке, а также для определения однородности распределения исследуемого вещества.
6.8.3 После внесения в осадок исследуемого вещества и подготовки поверхностной воды желательно позволить исследуемому веществу распределиться между осадком и водной фазой. Желательно сделать это при температуре и аэрации, используемых в испытании. Соответствующее время достижения равновесия зависит от осадка и природы химического вещества и может составлять от часов до нескольких дней и в редких случаях до нескольких недель (4-5 недель) [28], [42]. В данном испытании установления равновесия не ожидают, но рекомендуется использовать период установления равновесия от 48 ч до 7 дней. В зависимости от цели исследования (например, когда должны быть воссозданы условия окружающей среды) осадок с исследуемым веществом может уравновешиваться и выдерживается в течение более длительного периода [11].
7 Проведение испытания
7.1 Предварительный тест
В целях оптимизации условий результирующего теста (например, для выбора концентрации исследуемого вещества, продолжительности фазы поглощения и выведения) может быть полезно провести предварительное испытание. Поведение червей (например, избегание осадка, то есть когда черви не зарываются в осадок, что может быть обусловлено присутствием химического вещества и/или непосредственно самим осадком) должно быть учтено и зарегистрировано во время предварительного теста. Избегание осадка также может быть использовано в качестве сублетального параметра в предварительном испытании для оценки концентрации исследуемого вещества для использования в исследовании биоаккумуляции.
7.2 Условия воздействия
7.2.1 Продолжительность фазы поглощения
Подопытные организмы подвергаются воздействию исследуемого вещества во время фазы поглощения. Первый образец следует отбирать по прошествии 4-24 ч после начала фазы поглощения. Фаза поглощения должна быть запущена на срок до 28 дней [1], [6], [11], если невозможно продемонстрировать, что равновесие было достигнуто ранее. Устойчивое состояние возникает, когда:
- график зависимости коэффициента биоаккумуляции в каждый период отбора проб от времени параллелен оси времени;
- три последовательных анализа BAF, проведенные на образцах, взятых с интервалом не менее двух дней, составляют не более чем ±20% друг от друга;
- нет никаких существенных различий между этими тремя периодами отбора образцов (на основании статистических сравнений, например дисперсионного и регрессионного анализов). Если стационарное состояние не было достигнуто за 28 дней, фаза поглощения может быть прекращена путем запуска фазы выведения, и ![]() может быть вычислен из констант скорости поглощения и выведения (см. 4.3-4.5).
может быть вычислен из констант скорости поглощения и выведения (см. 4.3-4.5).
7.2.2 Продолжительность фазы выведения
Первый образец следует отбирать по прошествии от 4 до 24 ч после начала фазы выведения, поскольку в начальный период могут произойти быстрые изменения в тканях. Фазу выведения рекомендуется прекращать либо когда концентрация исследуемого вещества составляет менее 10% равновесной концентрации, либо по истечении 10 дней - максимальной продолжительности фазы. Остаточный уровень вещества в червях в конце фазы выведения используется в качестве второй конечной точки. Данный период может регулироваться периодом, в течение которого концентрация исследуемого вещества в червях остается выше аналитического предела обнаружения.
7.3 Тестовые организмы
7.3.1 Количество тестовых червей
7.3.1.1 Количество червей в одном образце должно соответствовать такой массе тканей червей, чтобы масса исследуемого вещества в образце в начале фазы поглощения и в конце фазы выведения соответственно была значительно выше предела обнаружения для исследуемого вещества в биологическом материале. В указанных стадиях фаз поглощения и выведения концентрация в тестовых животных, как правило, относительно низкая [6], [8], [18]. Так как индивидуальный вес у многих видов водных олигохет очень мал (5-10 мг сырого веса для одного червя для Lumbriculus variegatus и Tubifex tubifex), черви из одной тестовой камеры могут быть объединены для взвешивания и анализа исследуемого вещества. Для тестовых видов с большим индивидуальным весом (например, Branchiura sowerbyi) могут быть использованы повторные пробы, содержащие индивидуальную особь, но в таких случаях количество проб должно быть увеличено до 5% для точки отбора проб [11]. Однако следует отметить, что Branchiura sowerbyi не был включен в межлабораторный тест [12], и поэтому не рекомендуется для использования в качестве предпочтительного вида в руководстве.
7.3.1.2 Следует использовать червей одинакового размера (для Lumbriculus variegatus см. приложение А). Черви должны быть получены из одного источника и быть взрослыми или крупными особями одной возрастной группы (см. приложение А). Вес и возраст особи могут оказать существенное влияние на величины BAF (например, из-за различного содержания липидов и/или наличия яиц), эти параметры должны быть точно зарегистрированы. Для измерения среднего сырого и сухого веса подвыборку червей следует взвесить до начала испытания.
7.3.1.3 Для видов Lumbriculus variegatus и Tubifex tubifex во время тестового периода ожидается их воспроизводство. Отсутствие воспроизводства в исследовании биоаккумуляции должно быть зарегистрировано и учитываться при интерпретации результатов испытания.
7.3.2 Загрузка червей
7.3.2.1 Высокие соотношения черви - осадок и черви - вода должны быть использованы для того, чтобы свести к минимуму снижение концентрации исследуемого вещества в осадке во время фазы поглощения и избежать снижения концентрации растворенного кислорода. Выбранные величины загрузки должны также соответствовать естественной плотности поселения используемого вида [43]. Например, для Tubifex tubifex рекомендуемые нормы загрузки составляют 1-4 мг ткани червя (живого веса) на грамм сырого осадка [8], [11]. Источники [1] и [6] рекомендуют нормы загрузки не более 1 г сухого веса ткани червя на 50 г органического углерода в осадке для Lumbriculus variegatus.
7.3.2.2 Черви, которые будут использованы в испытании, удаляют из культуры просеиванием культивационной среды. Червей (взрослых или больших червей без признаков недавней фрагментации) переносят в стеклянную посуду (например, чашки Петри), содержащую чистую воду. Если условия испытания отличаются от условий культивирования, рекомендуется использование 24-часовой фазы акклиматизации. Перед взвешиванием избыток воды удаляют из червей. Это можно сделать путем аккуратного размещения червей на предварительно смоченной бумаге. Не рекомендуется использовать поглощающую бумагу для высушивания червей, поскольку это может вызвать стресс или повреждение червей. Рекомендуется использовать невысушенных червей, составляющих примерно 1,33 целевой биомассы. Дополнительные 33% соответствуют разнице между высушенным и невысушенным червем [28].
7.3.2.3 В начале фазы поглощения (день 0 испытания) тестовые организмы удаляют из камеры акклиматизации и случайным образом распределяют в емкостях (например, чашки Петри), содержащих реконструированную воду, путем добавления группы из двух червей до тех пор, пока каждый сосуд не будет содержать 10 червей. Каждую из данных групп червей затем случайно переводят в различные тестовые сосуды, например, с использованием мягкого стального пинцета. Тестовые сосуды затем инкубируют в условиях испытания.
7.3.3 Кормление
В связи с низким содержанием питательных веществ в искусственном осадке осадок должен быть кондиционирован за счет источника пищи. Для того чтобы не допустить ошибки воздействия на тестовые организмы, например, путем выборочного кормления незагрязненной пищей, пища, необходимая для размножения и роста тестовых организмов, должна быть добавлена к осадку один раз перед или во время внесения исследуемого вещества (приложение Г).
7.3.4 Соотношение осадок - вода
Рекомендуемое соотношение осадок - вода составляет 1:4 [45]. Данное соотношение считается пригодным для поддержания концентрации кислорода на соответствующем уровне и предотвращения накопления аммиака в надосадочных слоях воды. Содержание кислорода в вышележащих слоях воды следует поддерживать на уровне не менее 40% насыщения. Надосадочные слои воды в тестовых сосудах должны быть аккуратно аэрированы (например, 2-4 пузырька в секунду) с помощью пипетки Пастера, расположенной примерно на 2 см выше поверхности грунта так, чтобы минимизировать взбалтывание осадка.
7.3.5 Освещение и температура
Фотопериод при культивации и проведении испытания составляет 16 ч [1], [6]. Интенсивность освещения в тестовой зоне должна сохраняться на уровне около 500-1000 лк. Температура должна составлять (20±2)°С на протяжении всего теста.
7.3.6 Тестовые концентрации
Одну тестовую концентрацию (как можно более низкую) используют для определения кинетики поглощения, также может быть использована вторая (более высокая) концентрация (например, [46]). В таком случае образцы отбирают и анализируют в равновесном состоянии или по прошествии 28 дней для подтверждения того, что BAF оценивается по наименьшей концентрации [11]. Наибольшую концентрацию следует выбирать так, чтобы исключить негативное воздействие.
Пример - Выбирают примерно 1% наименьшей из известных хронических концентраций как производных из соответствующих исследований токсичности.
Наименьшая тестовая концентрация должна быть значительно выше, чем предел аналитического обнаружения вещества в осадках и биологических образцах. Если эффективная концентрация исследуемого вещества близка к аналитическому пределу обнаружения, рекомендуется использование маркированного исследуемого вещества с высокой удельной радиоактивностью.
7.3.7 Тестовые и контрольные повторные пробы
7.3.7.1 Минимальное количество тестовых проб для кинетических измерений должно равняться трем для каждой точки отбора [11] в течение всей фазы поглощения и выведения. Также следует использовать дополнительные пробы, например, для получения дополнительных данных. Для фазы выведения соответствующее количество повторных проб готовится с осадком, не содержащим исследуемого вещества, и надосадочной водой таким образом, чтобы подопытные организмы могли быть перенесены из тестовых сосудов в сосуды, не содержащие исследуемого вещества, по окончании фазы поглощения. Общее количество проб должно быть достаточным для фазы поглощения и фазы выведения.
7.3.7.2 Черви, предназначенные для отбора проб во время фазы выведения, могут быть помещены в один большой контейнер, содержащий осадок с исследуемым веществом из партии, которую используют для измерения кинетики поглощения. Необходимо продемонстрировать, что условия испытания (например, глубина осадка, соотношение осадок - вода, загрузка, температура, качество воды) сопоставимы с условиями для проб, предназначенных для фазы поглощения. По окончании фазы поглощения вода, осадок и образцы с червями должны быть отобраны из данного контейнера для анализа и достаточное количество крупных червей без признаков недавней фрагментации должно быть аккуратно удалено и перенесено в образцы, подготовленные для фазы выведения (например, по десять особей на один образец).
7.3.7.3 Если никакой другой растворитель, помимо воды, не используют, как минимум, девять повторных проб для отрицательного контроля (не менее трех проб в начале, трех - в конце фазы поглощения и трех - в конце фазы выведения) должны быть отобраны для биологического и фонового анализа. Если для внесения исследуемого вещества используют какой-либо растворитель, следует проводить контроль с растворителем (не менее трех репликаций в начале, трех - в конце фазы поглощения и трех - в конце фазы выведения). В этом случае по крайней мере четыре повторные пробы для отрицательного контроля (без растворителя) должны быть представлены для отбора проб в конце фазы поглощения. Данные повторные пробы должны быть биологически сравнимы с пробами для контроля растворителя в целях получения информации о возможном влиянии растворителя на тестовые организмы. Более подробная информация приведена в приложении С.
7.3.8 Частота измерений качества воды
В течение фазы поглощения и фазы выведения должны быть измерены по крайней мере следующие параметры качества для поверхностной воды:
- температура: в одном сосуде для каждого уровня дозы в день отбора проб и в одном контрольном сосуде один раз в неделю, а также в начале и конце фаз поглощения и выведения; температура окружающей среды (в воздухе или водяной бане) или, например, в одном репрезентативном тестовом сосуде, непрерывно или с часовыми интервалами;
- растворенный кислород: в одном сосуде для каждого уровня дозы и в одном контрольном сосуде в день отбора пробы; выражается в миллиграммах на литр и процентах величины насыщения воздухом;
- подача воздуха: контролируют по крайней мере один раз в день (по рабочим дням) и корректируют по мере необходимости;
- рН: в одном тестовом сосуде для каждого уровня дозы в день отбора пробы и одном контрольном сосуде один раз в неделю и в начале и конце фаз поглощения и выведения;
- общая жесткость воды: как минимум, в одном тестовом сосуде и одном контрольном сосуде в начале и конце фаз поглощения и выведения, выражается в миллиграммах ![]() на литр;
на литр;
- общее содержание аммиака: как минимум, в одном тестовом сосуде и одном контрольном сосуде в начале и конце фаз поглощения и выведения; выражается в миллиграммах на литр или
или общего азота - N.
8 Отбор проб и анализ червей, осадка и воды
8.1 График отбора проб
8.1.1 Примеры графиков отбора проб для 28-дневной фазы поглощения и 10-дневной фазы выведения приведены в приложении Е.
8.1.2 Отбирают пробы воды и осадка из тестовых камер для определения концентрации исследуемого вещества до внесения червей и во время фазы поглощения и фазы выведения. Во время испытания концентрацию исследуемого вещества определяют в червях, осадке и воде в целях мониторинга распределения исследуемого вещества в компонентах тестовой системы.
8.1.3 Образцы червей, осадка и воды отбирают, как минимум, шесть раз в течение фазы поглощения и также фазы выведения.
8.1.4 Отбор проб продолжают до тех пор, пока не установится плато (равновесное состояние), или в течение 28 дней. Если плато не было достигнуто в течение 28 дней, начинают фазу выведения. Для начала фазы выведения червей переносят в сосуды, содержащие необработанный исследуемым веществом осадок и воду (4.4-4.5).
8.2 Отбор и подготовка проб
8.2.1 Пробы воды получают декантацией, отбирают сифоном или пипеткой. Объем пробы должен быть достаточным для измерения количества исследуемого вещества в ней.
8.2.2 Оставшуюся надосадочную воду аккуратно сливают или откачивают из тестовой камеры. Пробы осадка следует отбирать осторожно, оказывая минимальное воздействие на червей.
8.2.3 Во время отбора пробы всех червей удаляют из тестового сосуда.
Пример - Суспендируют осадок с надосадочной водой и переносят содержимое каждого сосуда в лоток, затем выбирают червей с помощью мягкого стального пинцета. Червей быстро промывают водой в мелком стеклянном или стальном лотке. Избыток воды удаляют.
Затем червей аккуратно переносят в предварительно взвешенные сосуды для взвешивания. Червей замораживают (например, при температуре менее или равной минус 18°С). Наличие и количество коконов и/или ювенильных особей должно быть зарегистрировано.
8.2.4 В общем случае черви должны быть взвешены и заморожены сразу после отбора пробы без прочистки кишечника для получения консервативного значения BAF, который учитывает загрязненное содержимое кишечника, и для предотвращения потерь тела при прочистке кишечника [8]. Предполагается, что вещества с ![]() >5 не будут значительно выводиться в течение любого периода очистки кишечника, в то время вещества с
>5 не будут значительно выводиться в течение любого периода очистки кишечника, в то время вещества с ![]() <4 могут быть утрачены в заметных количествах [47].
<4 могут быть утрачены в заметных количествах [47].
8.2.5 Во время фазы выведения черви сами прочищают кишечник в чистом осадке. Это означает, что измерения непосредственно перед фазой выведения включают загрязненное содержимое кишечника, в то время как предполагается, что по прошествии начальных 4-24 ч фазы выведения большая часть загрязненного содержимого кишечника будет заменена чистым осадком [11], [47]. Концентрация в червях в данном образце может быть рассмотрена как концентрация в тканях после прочистки кишечника. Для учета разбавления концентрации исследуемого вещества незагрязненным осадком во время фазы выведения вес содержимого кишечника может быть оценен как соотношение живого/минерализованного веса червя или сухого/минерализованного веса червя.
8.2.6 Если цель конкретного исследования заключается в измерении биодоступности и истинного остатка в тканях тестовых организмов, то по крайней мере подвыборка тестовых организмов (например, из трех дополнительных репликаций) отбирается во время равновесного состояния. Подвыборка должны быть взвешена, очищена в чистой воде в течение 6 ч [47] и взвешена снова перед проведением анализа. Данные о весе червя и концентрации вещества в тканях у данной подвыборки затем могут быть сопоставлены со значениями, полученными из неочищенных червей. Червей, предназначенных для измерения выведения, не надо очищать до перевода в чистый осадок для уменьшения дополнительного стресса для организма.
8.2.7 Предпочтительно проводить анализ воды, осадка и образцов червей немедленно (то есть в течение одного-двух дней) после отбора в целях предотвращения деградации или других потерь, а также рассчитывать примерные скорости поглощения и выведения во время проведения испытания. Немедленный анализ также позволяет избежать задержки в определении момента достижения плато.
8.2.8 Если невозможно провести анализ немедленно, пробы необходимо хранить в надлежащих условиях. Информацию о стабильности и надлежащих условиях хранения конкретного исследуемого вещества следует получить перед началом исследования (например, продолжительность и температура хранения, процедура экстракции и пр.). Если такая информация отсутствует, а ее наличие необходимо, контрольные пробы с исследуемым веществом исследуют параллельно для определения стабильности при хранении.
8.3 Качество аналитического метода
8.3.1 Поскольку вся процедура по существу регулируется точностью, прецизионностью и чувствительностью аналитического метода, используемого для определения вещества, необходимо экспериментально проверить, что точность и воспроизводимость результатов химического анализа, а также извлечения исследуемого вещества из проб воды, осадка и червей подходят для конкретного метода. Также необходимо удостовериться, что исследуемое вещество не определяется в контрольных сосудах в концентрациях выше фоновых. При необходимости значения ,
и
исправляют с учетом извлечения и фоновых значений в контрольных пробах. Все пробы на протяжении всего испытания следует обрабатывать так, чтобы свести к минимуму загрязнения и потери (например, в результате адсорбции исследуемого вещества на устройстве для отбора проб).
8.3.2 Общее извлечение и извлечение исследуемого вещества из организма червя, осадка, воды и, если используются, из ловушек с абсорбентами для удержания испаряющегося исследуемого вещества, должны быть зарегистрированы и приведены в итоговом отчете.
8.3.3 Поскольку рекомендуется использовать маркированные вещества, можно проводить анализ на общую радиоактивность (то есть исходные продукты и продукты распада). Однако, если это аналитически возможно, количественная оценка исходного вещества и продуктов распада в равновесном состоянии или в конце фазы поглощения может предоставить важную информацию. Если планируется проводить такие измерения, пробы должны быть подвергнуты соответствующим процедурам экстракции так, чтобы можно было определить отдельно количество исходного вещества. Когда обнаруженные продукты распада представляют значительный процент (например, более 10%) радиоактивности, измеренной в тестовых организмах в равновесном состоянии или в конце фазы поглощения, рекомендуется идентифицировать такие продукты распада [5].
8.3.4 Из-за низкой индивидуальной биомассы часто не представляется возможным определить концентрацию исследуемого вещества в каждом отдельном черве, если не используют вид Branchiura sowerbyi (40-50 мг сырого веса на одного червя) [11]. Таким образом, объединение организмов в произвольную выборку из данного тестового сосуда является приемлемым, но это не ограничивает применение статистических процедур к данному виду. Если конкретные статистические процедуры и мощность являются важными условиями, то достаточное количество тестовых животных и/или репликаций для размещения желаемой выборки, обеспечения соответствующей процедуры и мощности должно быть включено в испытание.
8.3.5 Рекомендуется выражать BAF в качестве зависимости от общего живого веса, общего сухого веса и при необходимости (например, для сильно липофильных веществ) зависимости от содержания липидов и общего содержания органического углерода в осадке. Для определения содержания липидов следует использовать соответствующие методы [48], [49]. В качестве стандартного метода рекомендуется экстракция хлороформом/метанолом [48], [50]. Чтобы избежать использования хлорсодержащих растворителей, может быть использована международная модификация метода Блая и Дайера [50], как описано в [51]. Поскольку различные методы дают неодинаковые значения [48], важно подробно знать характеристики используемого метода. Если возможно, то есть при наличии достаточного количества ткани червя, содержание липидов измеряют в той же пробе или экстрагируют так же, как и для проведения анализа исследуемого вещества, поскольку липиды часто должны быть удалены из экстракта при проведении хроматографического анализа (5). Тем не менее целесообразно использовать акклиматизированные контрольные организмы, по крайней мере в начале или желательно в конце фазы поглощения для измерения содержания липидов, например, в трех образцах.
9 Данные и отчет о проведении испытания
9.1 Обработка результатов
Кривую поглощения исследуемого вещества получают путем построения в арифметической шкале зависимости концентрации исследуемого вещества в/на червях во время фазы поглощения от времени. Если кривая достигает плато, вычисляют BAF в равновесном состоянии:
- в равновесном состоянии или на 28-й день (среднее);
- в равновесном состоянии или на 28-й день (среднее).
Определяют ![]() как отношение
как отношение ![]() , как правило, определяют из кривой выведения (то есть графика зависимости концентрации исследуемого вещества в червях от времени во время фазы выведения).
, как правило, определяют из кривой выведения (то есть графика зависимости концентрации исследуемого вещества в червях от времени во время фазы выведения). затем рассчитывают из кинетики кривой поглощения. Предпочтительный метод для получения
![]() и констант
и констант и
заключается в использовании нелинейного метода оценки (приложение В). Если кинетика фазы выведения не первого порядка, то следует использовать более сложные модели [25], [27], [52].
Фактор аккумуляции в биоте-осадке (BSAF) определяют путем деления ![]() на содержание липидов в черве и общее содержание органического углерода в осадке.
на содержание липидов в черве и общее содержание органического углерода в осадке.
9.2 Интерпретация результатов
Результаты следует рассматривать с осторожностью, если измеренные значения концентрации исследуемого вещества оказываются на уровнях, близких к пределу аналитического обнаружения.
Четко определенные кривые поглощения и выведения являются указанием на достоверность и хорошее качество данных биоаккумуляции. В общем случае доверительные интервалы для значений BAF в хорошо спланированных исследованиях не должны превышать 25% [5].
9.3 Отчет о проведении испытания
Отчет о проведении испытания должен содержать следующую ниже информацию.
9.3.1 Исследуемое вещество:
- физическая природа и физико-химические свойства, например, ![]() , растворимость в воде;
, растворимость в воде;
- данные идентификации, источник исследуемого вещества, данные идентификации и концентрация любого используемого растворителя;
- если используют радиоактивные маркеры, точное положение меченых атомов, удельная радиоактивность и процент радиоактивности, связанной с примесями.
9.3.2 Тестовые виды:
- научное наименование, штамм, источник, предварительная подготовка, акклиматизация, возраст, диапазон размеров и пр.
9.3.3 Условия проведения испытания:
- используемая процедура испытания (например, статическая, полустатическая или проточная);
- тип и характеристики используемого освещения и фотопериода;
- структура испытания (например, количество, материал и размеры тестовых камер, объем воды, масса и объем осадка, скорость замещения воды (для проточной или полустатической процедуры), использование любой аэрации до и во время испытания, количество повторных проб, количество червей в повторной пробе, количество используемых тестовых концентраций, продолжительность фаз поглощения и выведения, частота отбора проб);
- метод подготовки и внесения исследуемого вещества, а также обоснование выбора конкретного метода;
- номинальная тестовая концентрация;
- источник составляющих для реконструированной воды и осадка или, если используют природные среды, происхождение воды и осадка, описание любой предварительной обработки, результаты любых проверок способности тестовых организмов к выживанию и/или воспроизведению в используемых средах, характеристики осадка (рН и содержание аммиака в поровой воде (для природных осадков), содержание органического углерода (ООУ), распределение частиц по размерам (процентное содержание песка, ила и глины, процентное содержание воды и любые другие показатели) и характеристики воды (рН, жесткость, проводимость, температура, концентрация растворенного кислорода, остаточное содержание хлора (если измерялось) и любые другие показатели);
- номинальный и измеренный сухой вес в процентах от сырого веса (или соотношение сухого и сырого весов) искусственного осадка; измеренный сухой вес в процентах от сырого веса (или соотношение сухого и сырого весов) для полевых осадков;
- качество воды в тестовых камерах, которое характеризуется температурой, рН, содержанием аммония, общей жесткостью и концентрацией растворенного кислорода;
- подробная информация о подготовке проб воды, осадка и червей, включая сведения о подготовке, хранении, процедуре внесения, экстрагирования и аналитических процедурах (и точности) для исследуемого вещества и содержания липидов и извлечения исследуемого вещества.
9.3.4 Результаты:
- смертность червей в контрольной группе и в каждом испытательном сосуде и любые другие наблюдаемые сублетальные эффекты, включая аномальное поведение (например, избегание осадка, наличие или отсутствие фекальных шариков, отсутствие воспроизведения);
- измеренный сухой вес в процентах от сырого веса (или соотношение сухого и сырого весов) осадка и тестовых организмов (для нормализации);
- содержание липидов в червях;
- кривые, демонстрирующие кинетику фаз поглощения и выведения исследуемого вещества в червях и время достижения равновесного состояния;
- ,
и
(со стандартным отклонением и диапазоном в случае необходимости) для каждого времени отбора проб (
выражается в граммах на килограмм сырого и сухого веса всего тела,
выражается в граммах на килограмм сырого и сухого веса осадка и
- в милиграммах на литр). Если требуется определение фактора аккумуляции осадок-биота (BSAF) (например, для сравнения результатов двух или более испытаний, проведенных на организмах с разным содержанием липидов),
необходимо дополнительно представить в виде грамм/килограмм содержания липидов в организме,
выражается в граммах на килограмм органического углерода в осадке;
- BAF (в килограммах сырого осадка на килограмм живого червя), константа скорости поглощения осадка (выражается в граммах сырого осадка на килограмм живого червя в день) и константа скорости выведения
(выражается в день
); BSAF (в килограммах органического углерода в осадке на килограмм содержания липидов в черве) может быть сообщено дополнительно;
- неудаленный остаток (NER) в конце фазы выведения;
- если измеряется: процент исходного соединения, продуктов распада и связанных остатков (то есть процент исследуемого вещества, который не может быть извлечен с помощью обычных методов экстракции) в тестовых организмах;
- методы, используемые для статистического анализа данных.
Оценка результатов:
- соответствие результатов критериям достоверности, приведенным в разделе 6;
- неожиданные или необычные результаты, например, неполные фазы выведения исследуемого вещества из тестовых организмов; в таких случаях результаты каких-либо предварительных исследований могут дать полезную информацию.
Приложение А
(справочное)
Виды олигохет, рекомендованные для использования в исследовании биоаккумуляции
А.1 Tubifex tubifex (MLLER), Tubificidae, Oligochaeta
Трубочник обыкновенный (Tubificidae, Oligochaeta) Tubifex tubifex (MLLER) обитает в пресноводных донных отложениях в трубчатых норках, которые строит из слизи. Черви зарывают передний конец тела в норки (трубы), поглощают частицы осадка, питаясь находящимися в нем микроорганизмами и органическими остатками. Задняя часть тела червя обычно выставлена над поверхностью грунта для дыхания. Хотя данный вид олигохет обитает во множестве различных типов донных отложений во всем Северном полушарии, Tubifex tubifex предпочитает субстрат с относительно мелкими размерами частиц [59]. Пригодность данного вида для экотоксикологических испытаний описана, например, в [8], [29], [31], [39], [60], [62], [63].
Методы культивирования
Для получения достаточного количества Tubifex tubifex для проведения исследования биоаккумуляции червей необходимо постоянно выращивать в лаборатории. Для культивирования Tubifex tubifex рекомендуется использовать систему, состоящую из искусственного осадка на основе искусственной почвы в соответствии с [40] и реконструированной воды в соответствии с [25], [8].
В качестве сосудов для культивирования могут быть использованы стеклянные контейнеры или контейнеры из нержавеющей стали высотой от 12 до 20 см. В каждый контейнер загружают слой сырого искусственного осадка, приготовленного, как описано в приложении D. Глубина слоя осадка должна обеспечивать естественное роющее поведение червей (минимальная глубина для Tubifex tubifex - 2 см). В систему добавляют реконструированную воду. Воду следует добавлять осторожно, чтобы не нарушить целостность осадка. Вода аккуратно аэрируется (например, 2 пузырька в секунду 0,45 мкм профильтрованным воздухом) с помощью пипетки Пастера, установленной на расстоянии 2 см от поверхности грунта. Рекомендуемая температура культуры составляет (20±2)°С.
Червей вносят в систему для культивирования с максимальной загрузкой 20000 особей/м поверхности осадка. Более плотная загрузка может привести к сокращению скорости роста и размножения [43].
В искусственных осадках червей необходимо кормить. Питание состоит из измельченного корма для рыб.
Пример - Tetra Min может служить в качестве дополнительного питания [8].
Количество корма должно обеспечить достаточный рост и размножение червей и не приводить к накоплению аммиака и росту грибка в культуре. Пища может быть внесена два раза в неделю (например, 0,6-0,8 мг на квадратный сантиметр поверхности грунта). Практика показывает, что применение суспензии корма в гомогенизированной, деионизированной воде может способствовать равномерному распределению пищи на поверхности осадка в контейнерах для культивирования. Чтобы избежать накопления аммиака, поверхностную воду необходимо менять автоматически (проточная система) или по крайней мере раз в неделю вручную. Субстрат для культуры следует заменять каждые три месяца.
Отбор проб червей может осуществляться путем просеивания осадка с культурой через сито с диаметром ячеек 1 мм, если требуются только взрослые особи. Для сохранения коконов используют сито с диаметром ячеек 0,5 мм, а для ювенильных особей - сито с диаметром ячеек 0,25 мм. Сита могут быть помещены в реконструированную воду после просеивания осадка. Червей удаляют из сита, они могут быть отобраны из воды с помощью мягкого стального пинцета или пипетки с оплавленными краями.
Для теста или нового культивирования используют только неповрежденные и четко идентифицированные образцы Tubifex tubifex (например, [64]). Больных и поврежденных червей, а также коконы, зараженные грибком, необходимо удалять.
Синхронизированная культура может служить источником червей определенного возраста в подходящие промежутки времени, когда это необходимо. Новые сосуды для культивирования устанавливаются в выбранные интервалы (например, каждые две недели), начиная с организмов определенного возраста (например, коконов). В условиях культивирования, описанных здесь, черви считаются взрослыми через восемь-десять недель. Маточную культуру можно отобрать, когда черви закладывают новые коконы, например, по прошествии десяти недель. Взрослые особи могут быть использованы для теста, после чего запускают новое культивирование.
А.2 Lumbriculus variegatus (MLLER), Lumbriculidae, Oligochaeta
Lumbriculus variegatus (Lumbriculidae, Oligochaeta) также обитает в пресноводных донных отложениях по всему миру и широко используется в экотоксикологических экспериментах. Информация о биологии, условиях культивирования и чувствительности вида может быть получена из [1], [6], [9], [36]. Lumbriculus variegatus также может быть культивирован на искусственном осадке, рекомендованном для Tubifex tubifex [8] при определенных ограничениях. Так, в природе Lumbriculus variegatus предпочитает более грубый субстрат, чем Tubifex tubifex [59]; лабораторные культуры с искусственным осадком, рекомендуемым для Tubifex tubifex, могут погибнуть после четырех-шести месяцев. Практический опыт показывает, что Lumbriculus variegatus может содержаться в песчаном грунте (например, кварцевом песке, мелком гравии) в проточной системе с кормом для рыб в качестве источника питания в течение нескольких лет без обновления субстрата. Главным преимуществом Lumbriculus variegatus по сравнению с другими водными видами олигохет является его быстрое размножение в результате быстрого роста биомассы в лабораторных популяциях [1], [6], [9], [10].
Методы культивирования
Условия культивирования для Lumbriculus variegatus подробно изложены в [10], [28], [1], [6]. Краткое резюме данных условий приведено ниже. Червей можно культивировать в больших аквариумах (57-80 л) при 23°С с фотопериодом (16 ч свет, 8 ч темнота при 100-1000 лк) с использованием ежедневно обновляемой природной воды (45-50 л в аквариуме). Субстрат готовят за счет разрезания небеленой коричневой бумаги на полоски, которые затем могут быть смешаны с водой для культивирования на несколько секунд для получения маленьких кусочков бумажного субстрата. Данный субстрат может быть непосредственно использован в аквариумах для культивирования Lumbriculus variegatus, покрывая нижнюю часть аквариума, или может храниться в замороженном виде в деионизированной воде для последующего использования. Субстрат, как правило, обновляется один раз в два месяца.
Каждая новая культура начинается с 500-1000 червей, для кормления используют 10 мл суспензии, содержащей 6 г корма для форели, три раза в неделю в проточных или обновляемых условиях. Статические или полустатические культуры должны получать меньшее количество корма для предотвращения бактериального и грибкового роста. Корм и бумажный субстрат должен быть проанализирован на содержание химических веществ, которые будут использованы в тесте на биоаккумуляцию.
В этих условиях количество особей в культуре, как правило, удваивается примерно в течение 10-14 дней.
Lumbriculus variegatus может быть удален из культуры, например, путем просеивания субстрата мелким ситом или отбором отдельных особей с использованием стеклянной пипетки с широким концом (около 5 мм в диаметре) в отдельный стакан. Если субстрат также переносят в данный стакан, стакан, содержащий червей и субстрат, выдерживают в течение ночи в проточных условиях, что позволяет удалить субстрат из стакана в то время, когда черви остаются на дне сосуда. Затем они могут быть перенесены во вновь подготовленные аквариумы для культивирования или использоваться для испытаний, как указано в [1] и [6]. Следует не допускать повреждения червей, например, при использовании пипетки с оплавленными краями или шпателя из нержавеющей стали для отбора червей.
Критическим моментом при использовании Lumbriculus variegatus в испытаниях биоаккумуляции является его режим воспроизводства (архитомия с последующим морфаллаксисом). Такое бесполое размножение приводит к получению двух фрагментов, которые не питаются в течение определенного периода, пока не произойдет регенерация передней или задней части тела (например, [36], [37]). Это означает, что потребление Lumbriculus variegatus отложений и загрязнений с приемом пищи не может проходить непрерывно, как в случае с трубочниками, которые не размножаются путем фрагментации.
Таким образом, синхронизация должна быть выполнена для минимизации неконтролируемого размножения и регенерации, а также для последующей высокой изменчивости результатов испытания. Такие изменения могут произойти, когда некоторые особи, фрагментированные и, следовательно, не потребляющие пищу в течение определенного периода времени, в меньшей степени подвержены воздействию исследуемого вещества, чем другие особи, которые не размножались во время испытания (например, [38]).
Черви должны пройти искусственную фрагментацию (синхронизацию) [65] за 10-14 дней до начала экспозиции. Следует использовать больших червей, которые предпочтительно не имеют признаков недавней фрагментации. Этих червей можно поместить на предметное стекло в каплю воды для культивирования и фрагментировать в средней части тела с помощью скальпеля.
Задние части тела должны быть одинакового размера и оставлены для регенерации в сосуде со средой для культивирования, содержащей тот же субстрат, который использовался при выращивании и реконструированной воде, до начала экспозиции.
Регенерация новой передней части регистрируется, когда синхронизированные черви закапываются в субстрат (наличие регенерации передней части тела может быть подтверждено путем проверки представительной подвыборки под бинокулярным микроскопом). Считается, что после этого тестовые организмы находятся в одинаковом физиологическом состоянии. Это означает, что при регенерации морфаллаксис происходит у синхронизированных червей во время испытания, практически все особи, как ожидается, будут в равной степени подвержены воздействию осадка с исследуемым веществом.
Кормление синхронизированных червей должно начаться, как только черви начнут зарываться в субстрат или через семь дней после фрагментации. Режим кормления должен соответствовать режиму для регулярных культур, кормить синхронизированных червей можно тем же кормом, который будет использован в испытании. Червей необходимо содержать при температуре (20±2)°С. После регенерации неповрежденных целых червей одинакового размера, активно плавающих или ползающих после механического раздражения, следует использовать в испытании. Повреждения червей следует не допускать, например, при использовании для отбора червей пипетки с оплавленными краями или шпателя из нержавеющей стали.
При использовании Lumbriculus variegatus в испытании в связи с особенностями режима воспроизводства данного вида во время теста должно происходить увеличение количества червей, если условия являются подходящими [6]. Отсутствие воспроизводства в эксперименте биоаккумуляции с Lumbriculus variegatus должно быть зарегистрировано и учитываться при интерпретации результатов испытания.
А.3 Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (не проверялись в межлабораторном тесте)
Branchiura sowerbyi обитает в различных типах донных отложений водоемов, озер, прудов и рек, изначально в тропических районах. Черви данного вида могут быть также обнаружены в теплых водоемах Северного полушария. Тем не менее они более распространены в илистых отложениях с высоким содержанием органических веществ. Кроме того, данные черви живут в осадках сточных вод. Задней частью тела черви, как правило, закапываются в субстрат. Этот вид легко определить по жаберным лепесткам на задней части. Взрослые особи могут достигать в длину 9-11 см и массы 40-50 мг. Черви обладают высокой скоростью размножения, показывают удвоение популяции менее чем за две недели в условиях температуры и кормления, описанных ниже (Aston et al., 1982, [65]). Branchiura sowerbyi использовались как в исследованиях токсичности, так и биоаккумуляции (Marchese & Brinkhurst 1996, [31], Roghair et al. 1996, [67] соответственно).
Методы культивирования
Для культивирования тестовых организмов не требуется использование специальной техники. Организмы могут культивироваться с использованием незагрязненных природных осадков [31]. Практический опыт показывает, что среда, состоящая из природного ила и песка, больше подходит для червей по сравнению с чистым природным илом [32], [67]. Для культивирования могут быть использованы трехлитровые стаканы, содержащие 1500 мл осадка в воде, состоящей из 375 мл природного незагрязненного ила (около 10% общего органического углерода, около 17% частиц диаметром менее или равным 63 мкм), 375 мл чистого песка (например, М32) и 750 мл реконструированной или дехлорированной водопроводной воды [31], [32], [67]. Бумажные фильтры также могут быть использованы в качестве субстрата для культивирования, но прирост популяции будет ниже, чем в естественном субстрате. В полустатических системах слой воды в стакане медленно аэрируют, а поверхностная вода должна обновляться один раз в неделю.
Каждый стакан содержит 25 молодых червей до начала культивирования. По прошествии двух месяцев больших червей удаляют из осадка пинцетом и помещают в новый стакан со свежеприготовленной средой из субстрата и воды. В старом стакане также содержатся коконы и молодые черви. Таким образом, может быть отобрано до 400 молодых червей на стакан. Взрослые черви могут быть использованы для воспроизводства в течение не менее одного года.
Культуру нужно содержать при температуре от 21°С до 25°С. Изменение температуры не должно превышать ±2°С. Время, необходимое для эмбрионального развития от отложения яйца до раскрытия кокона, составляет около трех недель при температуре 25°С. Плодовитость, полученная от одного червя Branchiura sowerbyi, находится в диапазоне от 6,36 [31] до 11,2 [30] в иле при 25°С. Число яиц в коконе колеблется от 1,8 до 2,8 [66], [69] или до 8 [68].
Содержание растворенного кислорода, жесткость воды, температура и рН должны измеряться еженедельно. Корм для рыб (например, TetraMin) можно добавлять в виде суспензии два или три раза в неделю без ограничений. Червей также можно кормить листьями салата ad libitum.
Главным преимуществом данного вида является высокая биомасса отдельных особей (до 40-50 мг сырого веса). Поэтому данный вид может быть использован для испытаний биоаккумуляции тестируемых веществ без радиоактивных маркеров. Черви данного вида могут подвергаться воздействию в системах, используемых для Tubifex tubifex или Lumbriculus variegatus с одной особью на пробу [11]. Количество повторных проб должно быть увеличено, если не используют большие тестовые камеры [11]. Кроме того, критерий достоверности, связанный с роющим поведением, должен быть скорректирован для данного вида.
Приложение В
(рекомендуемое)
Расчет параметров поглощения и выведения
Основной конечной точкой испытания биоаккумуляции является BAF. Измеренный BAF может быть рассчитан путем деления концентрации исследуемого вещества в тестовом организме на концентрацию исследуемого вещества в осадке
в устойчивом состоянии. Если равновесные условия не достигаются во время фазы поглощения, BAF рассчитывают таким же образом на 28-й день. Тем не менее следует указать, на чем основано значение BAF (на концентрации в равновесном состоянии или нет).
Наиболее предпочтительным способом для расчета кинетического фактора биоаккумуляции ![]() , константы скорости поглощения осадка
, константы скорости поглощения осадка и константы скорости выведения
является использование нелинейного метода оценки параметров. С учетом временных серий средних значений фактора аккумуляции (
, средние значения для каждого времени отбора проб, деленные на
, средние значения для каждого времени отбора проб равны
) фазы поглощения в расчете на сырой вес червя и осадка модельное уравнение выглядит следующим образом:
![]() , (В.1)
, (В.1)
где ![]() представляет собой отношение концентрации исследуемого вещества в организме червя и его концентрации в осадке в любой заданный момент времени
представляет собой отношение концентрации исследуемого вещества в организме червя и его концентрации в осадке в любой заданный момент времени фазы поглощения, вычисляют значения BAFK,
и
.
При достижении равновесного состояния в ходе фазы поглощения (т.е. ) уравнение В.1 может быть сведено к:
![]() , (В.2)
, (В.2)
где - константа скорости поглощения в тканях (грамм осадка на килограмм червя в день);
- константа скорости выведения (день
).
Тогда ![]() выражает подход к концентрации исследуемого вещества в тканях червя в равновесном состоянии (
выражает подход к концентрации исследуемого вещества в тканях червя в равновесном состоянии ().
Фактор аккумуляции биота-осадок BSAF должен быть рассчитан следующим образом:
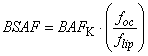 , (В.3)
, (В.3)
где - фракция органического углерода в осадке в пересчете на сухой вес;
- фракция липидов в червях, оба показателя - в расчете на сухой или на сырой вес.
С учетом временных серий значений концентраций кинетика выведения может быть смоделирована с помощью следующих модельных уравнений и компьютерного расчета, основанного на нелинейном методе оценки параметров.
Среднее значение измеренного остаточного количества вещества в конце фазы поглощения рекомендуется использовать в качестве основной отправной точки. Использование значения смоделированного/оцененного из фазы поглощения возможно только в случае, если измеренное значение значительно отличается от смоделированного значения остатка в теле. См. также 7.3.7.2 для альтернативной предварительной экспозиции червей, предназначенных для фазы выведения; в этом подходе образцы предварительно обработанных червей в день нулевой фазы выведения считаются демонстрирующими реальные значения остатков в теле, с которых начинается фаза выведения.
Если график зависимости экспериментальных данных от времени указывает на постоянное экспоненциальное снижение концентрации исследуемого вещества в тестовых организмах, однокомпонентная модель [уравнение (В.5)] может быть использована для описания временного хода фазы выведения
![]() . (В.4)
. (В.4)
Процессы выведения иногда оказываются двухфазными, демонстрируя быстрое снижение на ранних стадиях, которое переходит в медленное удаление исследуемого вещества в поздних стадиях фазы выведения ([8], [19], [25]). Две фазы могут быть оценены с допущением, что в организме существуют два различных отдела, из которых исследуемое вещество удаляется с различными скоростями. В этих случаях необходимо использовать специальные источники информации [15], [16], [17], [25].
Двухфазные процессы выведения описываются, например, следующим уравнением [25]:
![]() . (В.5)
. (В.5)
и
соответствуют размерам отделов (в процентах от общего остатка в ткани),
где - отдел с быстрым удалением вещества,
- с медленным удалением исследуемого вещества.
Сумма и
равна 100% от общего объема животных в стационарном состоянии.
и
представляют соответствующие константы фазы выведения [день
].
Если обе модели соответствуют данным очищения, константа скорости поглощения может быть определена следующим образом [53], [54]:
![]() . (В.6)
. (В.6)
Тем не менее данные модельные уравнения следует использовать с осторожностью, особенно если происходят изменения в биодоступности во время испытания [42].
В качестве альтернативы модельным уравнениям, приведенным выше, кинетика ( и
) также может быть рассчитана в одном испытании с применением модели кинетики первого порядка ко всем данным для фаз поглощения и выведения вместе.
Неудаленный остаток NER должен быть рассчитан как вторичная конечная точка путем умножения соотношения средней концентрации в черве на 10-й день фазы выведения фазы и средней концентрации в черве
в равновесном состоянии (28-й день фазы поглощения) на 100:
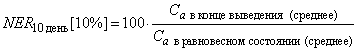 . (В.7)
. (В.7)
Приложение С
(справочное)
Некоторые физико-химические характеристики воды для разбавления
Таблица С.1 - Содержание компонентов в воде для разбавления
Вещество | Концентрация |
Взвешенные вещества | <20 мг/л |
Общий органический углерод | <2 мкг/л |
Неионизированный аммоний | <1 мкг/л |
Остаточный хлор | <10 мкг/л |
Общее содержание фосфорорганических пестицидов | <50 нг/л |
Общее содержание хлорорганических пестицидов и полихлорированных бифенилов | <50 нг/л |
Общий органический хлор | <25 нг/л |
Рекомендуемый состав реконструированной воды:
1 Раствора хлорида кальция
Растворяют 11,76 г ![]() в деионизированной воде, доводят деионизированной водой до 1 л.
в деионизированной воде, доводят деионизированной водой до 1 л.
2 Раствор сульфата магния
Растворяют 4,93 г ![]() в деионизированной воде, доводят деионизированной водой до 1 л.
в деионизированной воде, доводят деионизированной водой до 1 л.
3 Раствор бикарбоната натрия
Растворяют 2,59 г ![]() в деионизированной воде, доводят деионизированной водой до 1 л.
в деионизированной воде, доводят деионизированной водой до 1 л.
4 Раствор хлорида калия
Растворяют 0,23 г KCI в деионизированной воде, доводят деионизированной водой до 1 л.
Все химические вещества должны быть аналитической чистоты. Проводимость дистиллированной или деминерализованной воды не должна превышать 10 мкСм/м.
25 мл каждого из растворов [(1)-(4)] смешивают и общий объем доводят деионизированной водой до 1 л. Сумма ионов кальция и магния в этом растворе составляет 2,5 ммоль/л.
Соотношение ионов Са:Мg должно составлять 4:1 и ионов Na:К - 10:1. Кислотная емкость этого раствора составляет 0,8 ммоль/л.
Воду для разбавления аэрируют до насыщения кислородом, затем выдерживают ее в течение примерно двух дней без последующей аэрации перед использованием. Значение рН воды должно находиться в диапазоне от 6-9.
Приложение D
(рекомендуемое)
Искусственный осадок - рекомендации по подготовке и хранению
D.1 Общие сведения
Содержание торфа в искусственном осадке рекомендуется 2% сухого веса для того, чтобы соответствовать низкому или умеренному содержанию органических веществ в природных осадках (58).
Таблица D.1 - Содержание сухих компонентов в искусственном осадке
Компонент | Характеристика | Сухой осадок, % |
Торф | торфсфагнум степень разложения: "средняя", высушенный на воздухе, без содержания видимых растительных остатков, мелко измельченный (размер частиц | 2±0,5 |
Кварцевый песок | Размер зерна: | 76 |
Каолинитовая глина | Содержание каолинита | 22±1 |
Источник пищи | Foliaurticae, измельченные листья Urtica sp. (крапива), мелко измельченные (размер частиц | 0,4-0,5 |
Карбонат кальция |
| 0,05-1 |
Деионизированная вода | Проводимость | 30-50 |
Если ожидается повышение концентрации аммиака, например, если исследуемое вещество подавляет процесс нитрификации, может быть полезно заменить 50% богатого азотом порошка крапивы целлюлозой (например, порошком -целлюлозы, химически чистым, размер частиц
0,5 мм).
D.2 Подготовка
Торф сушат на воздухе и измельчают в мелкий порошок (размер частиц менее или равен 0,5 мм, без видимых растительных остатков). Суспензия необходимого количества порошка торфа готовится с использованием порции деионизированной воды, добавляемой к сухому осадку (объем воды 11,5, умноженный на сухую массу торфа, является приемлемым для подготовки суспензии торфа [8]) с использованием гомогенизирующего устройства.
рН данной суспензии доводят до (5,5±0,5) ![]() . Суспензию выдерживают в течение не менее двух дней при осторожном перемешивании при температуре (20±2)°С для стабилизации рН и установления устойчивого микробиологического фона. рН измеряют повторно и доводят до (6,0±0,5)
. Суспензию выдерживают в течение не менее двух дней при осторожном перемешивании при температуре (20±2)°С для стабилизации рН и установления устойчивого микробиологического фона. рН измеряют повторно и доводят до (6,0±0,5) ![]() , если это необходимо. Затем все суспензии смешивают с другими сухими компонентами, отбирая порцию для внесения исследуемого вещества. Оставшуюся деионизированную воду добавляют до получения однородного осадка. рН измеряют снова и корректируют от 6,5 до 7,5
, если это необходимо. Затем все суспензии смешивают с другими сухими компонентами, отбирая порцию для внесения исследуемого вещества. Оставшуюся деионизированную воду добавляют до получения однородного осадка. рН измеряют снова и корректируют от 6,5 до 7,5 ![]() , если это необходимо. Однако, если ожидается выделение аммиака, может быть необходимо установить рН осадка ниже 7,0 (например, между 6,0 и 6,5). Образцы осадка отбирают для определения сухого остатка и содержания органического углерода. Если ожидается выделение аммиака, искусственный осадок может быть выдержан в течение семи дней в условиях последующего теста (например, при соотношении осадок - вода 1:4, с высотой слоя осадка, как в тестовых сосудах) до внесения исследуемого вещества, то есть осадок должен быть покрыт водой, которая должна быть аэрирована. По окончании периода кондиционирования надосадочную воду удаляют. Отбирают образцы осадка для определения сухого веса и общего содержания органического углерода (например, три пробы).
, если это необходимо. Однако, если ожидается выделение аммиака, может быть необходимо установить рН осадка ниже 7,0 (например, между 6,0 и 6,5). Образцы осадка отбирают для определения сухого остатка и содержания органического углерода. Если ожидается выделение аммиака, искусственный осадок может быть выдержан в течение семи дней в условиях последующего теста (например, при соотношении осадок - вода 1:4, с высотой слоя осадка, как в тестовых сосудах) до внесения исследуемого вещества, то есть осадок должен быть покрыт водой, которая должна быть аэрирована. По окончании периода кондиционирования надосадочную воду удаляют. Отбирают образцы осадка для определения сухого веса и общего содержания органического углерода (например, три пробы).
После этого кварцевый песок с исследуемым веществом смешивают с осадком для каждого испытания, осадок распределяют по экспериментальным сосудам и добавляют тестируемую воду (например, соотношение осадок - вода 1:4, высота слоя осадка, как в тестовых сосудах). Затем сосуды инкубируют при условии последующих испытаний. В этот момент начинается период установления равновесия. Для надосадочной воды должна быть проведена аэрация.
Выбранный источник пищи следует добавить до или во время внесения исследуемого вещества в осадок или первоначально смешать с навеской торфа. Чрезмерного разложения источника пищи до добавления подопытных организмов (например, в случае длительного периода достижения равновесия) можно избежать, сделав период времени между добавлением пищи и началом экспозиции как можно более коротким. Чтобы гарантировать, что пища хорошо контактирует с исследуемым веществом, источник пищи необходимо смешать с осадком не позднее чем на следующий день после внесения тестируемого вещества в осадок. Исключения могут быть сделаны в случае, если продолжительность периода достижения равновесия приводит к чрезмерной микробиологической деградации пищи перед добавлением тестовых организмов. Образцы осадка отбирают для определения сухого веса и содержания общего органического углерода (например, три пробы осадка с исследуемым веществом или контрольного осадка).
Сухой вес компонентов (торф, песок, каолин) следует указывать в граммах и в процентах от общего сухого веса.
Объем воды, добавленной к сухим компонентам в процессе подготовки осадка, следует также указывать в процентах от общего сухого веса (например, 100% сухого веса + 46% воды означает, что на 1000 г сухого вещества добавляют в общей сложности 460 мл воды, в результате получают 1460 г сырого осадка).
D.3 Хранение
Сухие компоненты искусственного осадка можно хранить в сухом, прохладном месте при комнатной температуре. Подготовленный сырой осадок можно хранить (дальнейшее использование только для культивирования) при (4±2)°С в темноте в течение от 2 до 4 недель со дня изготовления [8].
Осадок с внесенным в него исследуемым веществом следует использовать немедленно, если нет информации о том, что конкретный осадок можно хранить без влияния на токсичность и биодоступность исследуемого вещества. Образцы осадка с исследуемым веществом можно хранить в условиях, рекомендованных для конкретного исследуемого вещества.
Приложение Е
(справочное)
Пример графика отбора проб в 28-дневном исследовании биоаккумуляции
Таблица Е.1 - Фаза поглощения (включая четырехдневный процесс установления равновесия)
День | Действия |
минус 6 | Подготовка суспензии торфа для осадка; кондиционирование суспензии в течение 48 ч |
минус 4 | Введение исследуемого вещества в осадок или фракцию осадка; смешение всех компонентов осадка; отбор проб подготовленного осадка и осадка из контроля с растворителем для определения концентрации исследуемого; добавление поверхностной воды; инкубация при условиях испытания (фаза равновесия) |
минус 3/минус 2 | Отделение тестовых организмов от общей культуры для акклиматизации |
0 | Оценка качества воды [6.4]; отбор нескольких проб воды и осадка для определения концентрации исследуемого вещества; случайное распределение червей по тестовым сосудам; сохранение достаточной подвыборки червей для аналитического определения фоновых значений; контроль за подачей воздуха, если используют замкнутую тестовую систему |
1 | Отбор проб; контроль подачи воздуха; поведения червей; качества воды [8.1]; отбор воды, осадка и червей для определения концентрации исследуемого вещества |
2 | Контроль подачи воздуха, поведения червей и температуры |
3 | То же, что в 1-й день |
4-6 | То же, что во 2-й день |
7 | То же, что в 1-й день; компенсация испарившейся воды в случае необходимости |
8-13 | То же, что во 2-й день |
14 | То же, что в 1-й день; компенсация испарившейся воды в случае необходимости |
15-20 | То же, что во 2-й день |
21 | То же, что в 1-й день; компенсация испарившейся воды в случае необходимости |
22-27 | То же, что во 2-й день |
28 | То же, что в 1-й день; измерение качества воды [6.4]; завершение фазы поглощения; сохранение достаточной подвыборки червей для аналитического определения фоновых концентраций, сырого и сухого веса и содержание липидов; перенос червей из оставшихся тестовых сосудов в сосуды, содержащие чистый осадок для начала фазы выведения (без очистки кишечника); отбор проб воды, осадка и червей из пробы для контроля с растворителем; отбор проб раствора абсорбента, если он использовался |
Предварительную подготовку (фазы равновесия) следует планировать с учетом свойств исследуемого вещества. Если требуется, проводят кондиционирование подготовленного осадка под поверхностной водой при температуре (20±2)°С в течение 7 дней; в данном случае подготовку осадка производят заранее. |
Таблица Е.2 - Фаза удаления
День | Действия |
минус 6 | Подготовка суспензии торфа для осадка; кондиционирование суспензии в течение 48 ч |
минус 4 | Смешение всех составляющих осадка; отбор проб подготовленного осадка и осадка для проведения контроля с растворителем для определения концентрации исследуемого вещества; добавление поверхностной воды; инкубация в условиях испытания |
0 | Измерение качества воды [6.4]; перенос червей из оставшихся тестовых сосудов в сосуды с чистым осадком; через 4-6 ч отбор проб воды, осадка и червей для определения концентрации исследуемого вещества; случайное распределение червей по тестовым сосудам |
1 | Отбор проб; контроль подачи воздуха, поведения червей, качества воды [6.4]; отбор проб воды, осадка и червей для определения концентрации исследуемого вещества |
2 | Контроль подачи воздуха, поведения червей и температуры |
3 | То же, что в 1-й день |
4 | То же, что во 2-й день |
5 | То же, что в 1-й день |
6 | То же, что во 2-й день |
7 | То же, что в 1-й день; компенсация испарившейся воды в случае необходимости |
8-9 | То же, что во 2-й день |
10 | То же, что в 1-й день; завершение фазы выведения; анализ качества воды; отбор проб воды, осадка и червей из контроля с растворителем; отбор проб раствора абсорбента, если он использовался |
Подготовку осадка до начала фазы выведения следует проводить в том же порядке, что и для фазы поглощения | |
Действия для 2-го дня следует проводить ежедневно (по крайней мере по рабочим дням) |
Библиография
[1] | ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA |
[2] | EC (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I-IV. Office for Official Publications of the EC (European Commission), Luxembourg |
[3] | OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris |
[4] | Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P.F., Norberg-King, T.J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894 |
[5] | OECD (1996a). OECD Guidelines for testing of chemicals: Bioconcentration: Flow-through fish test. Guideline No. 305. OECD, Paris |
[6] | U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000 |
[7] | OECD (2004). Guideline for the Testing of Chemicals No. 218: "Sediment-water chironomid toxicity test using spiked sediment". OECD, Paris |
[8] | Egeler, Ph., |
[9] | Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P.F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculusvariegatus. Environmental Toxicology and Chemistry 22, 872-885 |
[10] | Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279 |
[11] | Egeler, Ph., |
[12] | Egeler, Ph., Meller, M., |
[13] | Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990). Effects of tributyltin within a Thalassiaseagrass ecosystem. Estuaries 13, 301-310 |
[14] | Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim |
[15] | Landrum, P.F., Lee II, H., & Lydy, M.J. (1992). Toxiсоkinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709-1725 |
[16] | Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443-1450 |
[17] | Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225-1231 |
[18] | Kukkonen, J. and Landrum, P.F. (1994). Toxiсоkinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468 |
[19] | Franke, C., Studinger, G., Berger, G., |
[20] | OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23 |
[21] | U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency |
[22] | OECD Guidelines for the testing of chemicals. OECD, Paris. http://www.oecd.org/env/testguidelines |
[23] | OECD (1996c). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paris |
[24] | Antoine, M.D., Dewanathan, S. & Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165-172 |
[25] | Веек, В., S. Boehling, U. Bruckmann, С. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: В. Веек): Bioaccumulation - New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235-276 |
[26] | Spacie, A. & Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320 |
[27] | Hawker, D.W. & Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701-707 |
[28] | Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201 |
[29] | Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificidae oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061-1072 |
[30] | Aston, R.J. & Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155-160 |
[31] | Marchese, M.R. & Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163-168 |
[32] | Roghair, C.J. & Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027 |
[33] | OECD (1992b). Guidelines for Testing of Chemicals No. 203. Fish, Acute Toxicity Test. OECD, Paris |
[34] | OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris |
[35] | Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184 |
[36] |
|
[37] |
|
[38] |
|
[39] | Martinez-Madrid, M., Rodriguez, P., Perez-lglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex ( |
[40] | OECD (1984). Guidelines for Testing of Chemicals No. 207. Earthworm, Acute Toxicity Test. OECD, Paris |
[41] | Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30 |
[42] | Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588-595 |
[43] | Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst and D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175-184. Plenum Press, New York |
[44] | ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94 |
[45] | Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022 |
[46] | Franke, С. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897-1905 |
[47] | Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249 |
[48] | Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ. Toxicol. Chem. 10, 1431-1436 |
[49] | Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105 |
[50] | Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911-917 |
[51] | De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme |
[52] | Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark |
[53] | Zok, S., |
[54] | (54) Nagel, R. (1988). Umweltchemikalien und Fische - |
[55] | Janssen, M.P.M., A Bruins, Т.Н. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312 |
[56] | Van Brummelen, T.C. & Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellioscaber. Arch. Environ. Contam. Toxicol. 31: 277-285 |
[57] | Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167-1171 |
[58] | Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175 |
[59] | Wachs, B. (1967). Die Oligochaeten-Fauna der der Beziehungzwischen der Tubificiden-Besiedlung und demSubstrat. Arch. Hydr. 63, 310-386 |
[60] | Oliver, B.G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785-790 |
[61] | Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47-67 |
[62] | Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69-78 |
[63] | Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC |
[64] | Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22 |
[65] | Egeler, Ph., Meller, M., |
[66] | Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137-145 |
[67] | Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026 |
[68] | Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89-94 |
[69] | Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274 |
УДК 658.382.3:006.354 | МКС 71.100.01 |
Ключевые слова: химическая продукция, воздействие на окружающую среду, окружающая среда, биоаккумуляция, черви | |
Электронный текст документа
и сверен по:
, 2019
