ГОСТ 32379-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Испытания по оценке репродуктивной/эмбриональной токсичности (скрининговый метод)
Testing of chemicals of human hazard. Reproduction/developmental toxicity screening test
МКС 71.100.01
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным бюджетным учреждением здравоохранения "Российский регистр потенциально опасных химических и биологических веществ" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУЗ "Российский регистр потенциально опасных химических и биологических веществ" Роспотребнадзора), Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ") на основе собственного перевода на русский язык англоязычной версии международного документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 18 октября 2013 г. N 60-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 807-ст межгосударственный стандарт ГОСТ 32379-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD, Test N 421* "Скрининговое исследование репродуктивной/эмбриональной токсичности" ("Reproduction/Developmental Toxicity Screening Test, IDT")
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Апрель 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Предварительные скрининговые исследования репродуктивной токсичности успешно применяются для первоначальной оценки химических веществ.
Представленный тест основан на опыте изучения химических веществ многотоннажного производства и поисковых исследований с позицитивным контролем химических веществ.
Цель метода - получение данных, касающихся воздействия исследуемого вещества на мужскую и женскую репродуктивную способность, а именно на функцию половых желез, поведение при спаривании, оплодотворение, развитие оплодотворенного яйца и роды. Он не является альтернативой или заменой другим методам, рекомендованным ОЭСР.
1 Область применения
Настоящий стандарт может быть использован для получения предварительных данных о возможном воздействии на репродуктивность и/или эмбрион как на первоначальном этапе оценки токсических свойств нового химического вещества, так и при исследовании известных химических веществ, вызывающих опасения. Метод исследования может использоваться как часть ряда первоначальных скрининговых исследований химических веществ, о которых отсутствуют или ограничены токсикологические данные; как исследование по поиску уровня дозы химического вещества для более широких репродуктивных/эмбриональных исследований или для других значимых целей.
Это исследование не обеспечивает полноту данных по всем аспектам репродуктивности и эмбрионального развития. В частности, оно предлагает только ограниченные средства для обнаружения послеродовых проявлений предродовых воздействий или результатов, которые могут быть вызваны послеродовыми воздействиями. По многим причинам, в частности в связи с относительно малым количеством животных в экспериментальных группах, избирательностью конечных целей и непродолжительностью исследования, этот метод не обеспечивает доказательств токсического воздействия химического вещества. Как следствие, отрицательные данные не служат доказательством абсолютной безопасности в отношении репродуктивности и эмбрионального развития. Данная информация может послужить некоторым подтверждением, если фактическое воздействие дозы очевидно меньше, чем воздействие дозы, относящейся к наименьшему уровню наблюдаемого вредного воздействия (NOAEL). Более того, в отсутствие данных о других исследованиях на репродуктивную/эмбриональную токсичность, положительные результаты применимы для первоначальной оценки опасности и способствуют принятию решений относительно необходимости и длительности дополнительного исследования.
Стандарт предполагает пероральный способ введения тестируемого вещества. При использовании другого способа введения требуется обоснование.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 выраженная токсичность (evident toxicity): Общий термин, описывающий явные признаки токсичности, вызванные введением исследуемого вещества. Они должны быть достаточны для оценки опасности и такими, чтобы повышение вводимой дозы предполагало в результате тяжелые токсические проявления и возможную смерть.
2.2 доза (Dose): Количество вводимого тестируемого вещества. Доза выражается либо по массе (г, мг), либо массой тестируемого вещества на единицу массы тела животного (г, мг/кг), либо постоянной концентрацией в пище (ppm).
2.3 дозировка (dosage): Основное понятие, включающее в себя дозу, частоту и продолжительность введения.
2.4 материнская токсичность (maternal toxicity): Неблагоприятное воздействие на беременных самок, происходящее как непосредственно (прямое воздействие), так и опосредовано (непрямое воздействие).
2.5 ослабление фертильности (impairment of fertility): Расстройство мужских и женских репродуктивных функций или способностей.
2.6 репродуктивная токсичность (reproduction toxicity): Неблагоприятное воздействие на потомство и/или ослабление мужских и женских репродуктивных функций или способностей.
2.7 эмбриотоксичность (developmental toxicity): Проявление репродуктивной токсичности, представляющее собой пред-, пере-, постнатальные структурные или функциональные расстройства потомства.
2.8 NOAEL: Наивысший уровень воздействия, при котором не наблюдается вредный эффект.
3 Принцип метода испытания
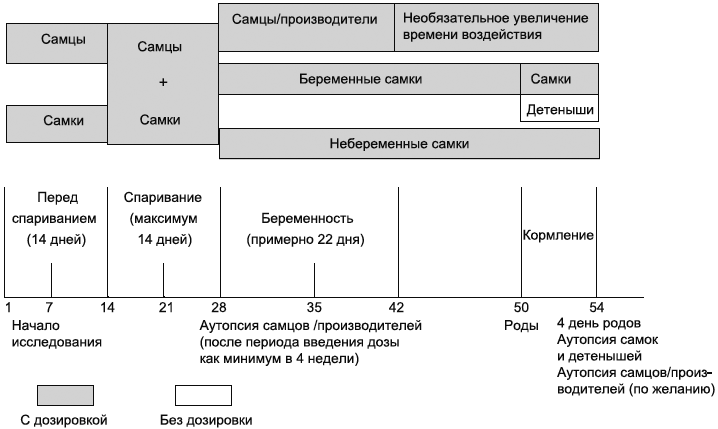
Исследуемое вещество вводится градуированными дозами нескольким группам мужских и женских особей. Самцам следует давать дозу, как минимум, четыре недели и больше, включая день перед запланированным умерщвлением (период включает как минимум две недели перед спариванием, период спаривания и примерно две недели после спаривания). Принимая во внимание ограниченный период дозирования мужских особей перед спариванием, фертильность не может являться точным значимым показателем тестикулярной токсичности. Вследствие этого важны подробные гистологические исследования яичек. Сочетание двухнедельного периода дозирования перед спариванием и последующего наблюдения спаривания/фертильности с общим периодом введения, как минимум, четыре недели, за которым следует подробная гистопатология семенников, считается достаточным для обнаружения преобладающего воздействия на оплодотворяющую способность спермы и сперматогенез.
Женские особи должны получать дозы на протяжении всего исследования. Сюда включаются две недели перед спариванием (с целью покрыть как минимум два полных цикла течки), переменная времени зачатия, срок беременности и, как минимум, четыре дня после родов, до дня перед планируемым умерщвлением включительно.
Срок исследования после акклиматизации зависит от поведения женских особей и составляет приблизительно 54 дня, (как минимум 14 дней перед спариванием, до 14 дней спаривание, 22 дня - беременность, 4 дня - кормление).
В течение периода введения вещества животных тщательно обследуют на предмет выявления признаков токсичности. Животным, которые умерли или были убиты в ходе тестирования, проводится аутопсия. По окончании исследования, выживших животных умерщвляют и также проводят аутопсию.
4 Подготовка
4.1 Выбор видов животных
Рекомендуется применение крыс. Если используются другие виды, необходимы соответствующие обоснования. Животных с низкой плодовитостью или с хорошо известной высокой степенью дефектов развития использовать не следует. Должны использоваться здоровые девственные животные, ранее не подвергавшиеся опытным испытаниям. Подопытные животные должны быть описаны по роду, виду, полу, массе и/или возрасту. В начале исследования разница в массе подопытных животных должна быть минимальна и не превышать ±20% от средней массы всех животных, задействованных в исследовании, отдельно каждого пола.
4.2 Условия содержания и кормления
Температура в помещении с экспериментальными животными должна быть (22±3) °С. Относительная влажность должна быть как минимум 30% и не должна превышать 70% (если только не проводится уборка помещения), оптимальная влажность составляет от 50% до 60%. Свет искусственный с последовательностью 12 часов - свет, 12 часов - темнота. Для кормления могут использоваться традиционные лабораторные диеты с неограниченным количеством питьевой воды. На выбор пищи может влиять необходимость добавления к ней исследуемого вещества, когда введение осуществляется таким способом.
Животные могут находиться отдельно или содержаться в клетках небольшими группами одного пола; при групповом расселении следует помещать не более пяти животных в каждую клетку. Процедура спаривания должна осуществляться в подходящих для такого случая клетках. Беременных самок следует селить отдельно и обеспечить их материалами для гнездования.
4.3 Подготовка животных
Здоровые молодые взрослые животные произвольно распределяются на контрольную и экспериментальные группы. Клетки надо размещать таким образом, чтобы свести к минимуму возможное влияние на них их местоположения. Животных помечают индивидуальными идентификаторами и содержат в клетках как минимум 5 дней перед началом исследования для акклиматизации к лабораторным условиям.
4.4 Подготовка доз
Исследуемое вещество рекомендуется вводить перорально, если только другой путь введения не считается более подходящим. Если выбран пероральный путь, исследуемый состав обычно вводится через зонд, при этом, в качестве альтернативы исследуемый состав может вводиться с пищей или питьевой водой.
При необходимости, тестируемое вещество растворяется или примешивается в подходящую среду. Рекомендуется использовать, в первую очередь, водные растворы/суспензии, затем раствор эмульсии в масле (например, кукурузное масло) и затем искать возможное решение с использованием других сред. Для сред, отличных от воды, должны быть известны их токсические свойства. Следует определить устойчивость исследуемого вещества в среде.
5 Процедура испытания
5.1 Количество и пол животных
В начале исследования каждая группа должна состоять как минимум из 10 животных каждого пола. Исключая случаи явного токсического воздействия, это обеспечит как минимум 8 беременных самок в каждой группе, что в норме является минимальным допустимым числом беременных самок в группе. Целью является получение достаточного количества беременностей и потомства, чтобы гарантировать значимую оценку потенциальной возможности вещества влиять на фертильность, беременность, материнское поведение и поведение грудного потомства, на рост и развитие потомства от зачатия до четвертого дня после родов.
5.2 Дозирование
Необходимо использовать как минимум три экспериментальные и одну контрольную группы. Уровни доз могут быть основаны на данных исследований острой токсичности или на результатах исследований повторной дозы. С животными контрольной группы необходимо обращаться так же, как и с животными экспериментальной группы. Если для введения исследуемого вещества используется среда, контрольная группа должна получать ее в максимальном используемом объеме.
Уровни доз должны выбираться с учетом любых имеющихся токсичных и токсикокинетических данных об исследуемом веществе. Для токсического воздействия следует выбрать самый высокий уровень доз, при этом необходимо избегать смертности или тяжелых страданий животных. Следовательно, нисходящая последовательность уровней доз должна избираться с учетом любых доказанных реакций на дозу и наивысшего уровня воздействия, при котором не наблюдается вредный эффект (NOAEL), как самого низкого уровня дозы. Двойной или четвертной диапазон зачастую оптимален для установления снижения уровня дозы, для очень больших интервалов между дозами (например, с диапазоном более 10) предпочтительно использование четвертой экспериментальной группы.
5.3 Испытание с использованием предельной дозы
Если при пероральном вводе одного уровня дозы как минимум в 1000 мг/кг в день с пищей или питьевой водой, а также равноценное его процентное содержание в пище или питьевой воде, используемые для этого исследования вещества не оказывают токсического воздействия, и если токсичность для структурно близких веществ не установлена, то проводить полное исследование с использованием нескольких уровней доз не следует. Изучение эмбриотоксичности предельной дозы не применяется в тех случаях, когда воздействие на организм теплокровных показывает необходимость повышения используемого перорального уровня дозы. При других способах введения, таких как ингаляционный или дермальный, использование максимально достижимой концентрации может быть продиктовано физико-химическими свойствами вещества.
5.4 Введение экспериментальной дозы
Животные должны получать дозу исследуемого вещества ежедневно в течение семи дней в неделю. Когда исследуемое вещество вводится принудительно, это следует делать разовой дозой, используя желудочный зонд или подходящую полую трубку. Максимальный объем жидкости, который может быть введен за один раз, зависит от размеров подопытного животного. Объем не должен превышать 1 мл/100 г, при введении водных растворов допустима концентрация 2 мл/100 г. За исключением веществ, вызывающих раздражение или коррозию, которые обычно проявляют более выраженный эффект при более высоких концентрациях, изменения тестируемого объема должны быть минимизированы путем регулирования концентрации для обеспечения постоянного объема при всех уровнях дозы.
При введении веществ с пищей или питьевой водой, важно, чтобы количество вводимого исследуемого вещества не препятствовало нормальному пищевому или водному балансу. Когда тестируемое вещество вводится с пищей, могут быть использованы либо постоянная концентрация в пище (мг/кг или ppm), либо постоянный уровень дозы в зависимости от массы тела животного, другое использование должно быть обосновано. При вводе веществ через зонд доза должна вводиться в одно и то же время ежедневно и корректироваться как минимум еженедельно для поддержания постоянного уровня дозы по отношению к массе тела животного.
5.5 Схема исследования
Введение дозы животным обоих полов следует начинать, как минимум, за две недели до спаривания, после прохождения ими пятидневной акклиматизации. Исследование должно быть запланировано таким образом, чтобы спаривание начиналось сразу по достижению животными половой зрелости. Этот период может слегка различаться для разных видов крыс. Например, крысы вида Sprague Dawley - в возрасте 10 недель, крысы вида Wistar - 12 недель. Самки с потомством должны умерщвляться на четвертый день после родов или вскоре после этого. День родов (т.е. когда роды завершились) считается нулевым днем после родов. Самки, не демонстрирующие признаков беременности, умерщвляются на 24-26 день после последнего дня периода спаривания. Введение доз животным обоих полов продолжается весь период спаривания. Самцам продолжают введение доз после периода спаривания, пока минимальный период дозировки не достигнет 28 дней. Затем их умерщвляют или сохраняют и продолжают дозирование для возможного второго спаривания, если необходимо.
Ежедневное введение доз беременным самкам следует продолжать всю беременность и как минимум до третьего дня после родов включительно или за день до умерщвления. Для исследований, где тестируемое вещество вводится ингаляционно или дермально, введение доз продолжается, как минимум, до 19 дня беременности включительно.
График схемы исследования, показывающий максимальную длительность исследования, основанную на полном четырнадцатидневном периоде спаривания, приведен в Приложении А.
5.6 Процедура спаривания
Обычно в таких исследованиях используется спаривание 1:1 (одна самка на одного самца). Исключения могут быть сделаны при случайной смерти самцов. Самку следует помещать с одним и тем же самцом до наступления беременности или в течение 2-х недель. Каждое утро самки должны проверяться на наличие спермы или вагинальной пробки. Нулевым днем беременности считается день обнаружения вагинальной пробки или спермы. В случае, если спаривание неуспешно, может быть рассмотрено повторное спаривание с самцами, уже осуществившими успешное спаривание.
6 Наблюдения
В течение всего периода исследования общее клиническое наблюдение должно проводиться как минимум раз в день и чаще, если обнаруживаются признаки токсичности. Их предпочтительно проводить ежедневно в одно и то же время, принимая во внимание период максимума предполагаемого воздействия дозы. Соответствующие изменения поведения, признаки трудных или продолжительных родов и все другие проявления токсичности, включая летальный исход, следует фиксировать. Такие записи должны включать время начала, степень и длительность признаков токсичности.
Длительность беременности должна фиксироваться и отсчитываться от 0-го дня беременности. Каждый приплод должен быть изучен как можно раньше после рождения для установления количества и пола детенышей, мертворожденных, родившихся живыми, малорослых (детеныши, которые заметно меньше, чем детеныши из контрольной группы) и наличия явных аномалий.
Живые детеныши должны быть подсчитаны, следует установить их пол. Приплод следует взвешивать в течение 24 часов после родов (нулевой или первый день после родов) и на 4-й день после родов. В дополнение к наблюдению за родительскими особями любое аномальное поведение потомства должно быть зафиксировано.
6.1 Масса тела и потребление воды/пищи
Самцы и самки должны взвешиваться в первый день введения дозы, как минимум еженедельно в дальнейшем и по окончании исследования. Во время беременности самок следует взвешивать в нулевой, седьмой, четырнадцатый и двадцатый дни, в течение 24 часов после родов (нулевой или первый день после родов) и на четвертый день после родов. Все наблюдения должны фиксироваться отдельно по каждому взрослому животному.
В течение периодов перед спариванием, беременности и кормления, потребление пищи должно измеряться как минимум еженедельно. Измерение потребления пищи в период спаривания необязательно. Потребление воды в этот период следует измерять, если исследуемое вещество вводится с питьевой водой.
6.2 Патология
После умерщвления или смерти во время исследования взрослые особи должны быть изучены макроскопически на наличие аномальных или патологических изменений. Особое внимание должно быть уделено органам репродуктивной системы. Количество мест имплантации должно быть зафиксировано. Настоятельно рекомендуется подсчет желтых тел.
Яички и придатки яичек всех взрослых самцов должны быть взвешены.
Мертворожденные детеныши и умерщвленные на четвертый день после родов или вскоре после этого должны быть, как минимум, внимательно изучены наружно на наличие явных внешних аномалий.
Яичники, яички, придатки яичек и связанные с ними половые железы, а также все органы, демонстрирующие макроскопические поражения всех взрослых животных должны быть сохранены. Для стандартных исследований яичек и придатков яичек не рекомендуется сохранение в формалине. Для сохранения таких тканей подходящим способом является фиксатор Буэна.
6.3 Гистопатология
Делается подробное гистологическое исследование яичников, яичек и придатков яичек (с особым вниманием к фазе спермогенеза и гистопатологии межтканевого тестикулярного строения клетки) животных из групп с самой высокой группой дозирования и контрольной группы. Все остальные сохраненные органы могут изучаться по необходимости. Изучение следует распространить на животных из групп с другой дозировкой, если присутствуют видимые изменения в группе с самой высокой дозировкой.
7 Данные и отчет о проведении испытания
7.1 Данные
Данные по каждому животному должны быть предоставлены отдельно. В дополнение, все данные должны быть сведены в табличную форму, отражающую для каждой тестовой группы количество животных на начало исследования; количество животных, умерших во время исследования или умерщвленных по гуманным соображениям и время каждой смерти или умерщвления; количество способных к деторождению животных; количество беременных самок; количество животных, демонстрирующих признаки токсичности; описание наблюдаемых признаков токсичности, включая время начала, продолжительность и тяжесть любых токсических проявлений; тип гистопатологических изменений и все соответствующие данные по приплоду. Табличная форма для отчета, одобренная в качестве наиболее подходящей для оценки воздействия на репродуктивность/эмбрион, представлена в Приложении Б.
В связи с ограниченностью масштаба измерений в таком исследовании, статистический анализ в виде исследований "значимости" представляет ограниченную ценность для многих показателей репродуктивности. Если же статистический анализ проводится, он должен соответствовать распределению рассматриваемой переменной и выбираться до начала исследования. Из-за небольших размеров группы, использование данных наблюдения (например, количество приплода), где возможно, может быть полезно как помощь для интерпретации исследования.
7.2 Оценка результатов
Полученные данные исследования токсичности должны быть охарактеризованы в показателях результатов наблюдений, аутопсии и макроскопических данных. Оценка будет включать соотношение между дозой исследуемого вещества и наличием или отсутствием, количеством и тяжестью аномалий, включая макроскопические повреждения, определение органов-мишеней, бесплодность, клинические аномалии, воздействие на репродуктивность и потомство, изменения массы тела, влияние на смертность и любые другие токсические проявления.
В связи с непродолжительностью периода введения вещества самцам при оценке воздействия на их репродуктивность гистопатология яичек и придатков яичек должны рассматриваться вместе с данными по фертильности.
7.3 Отчет о проведении испытания
Отчет об исследовании должен содержать следующую информацию:
Исследуемое вещество:
- физическая природа и, при необходимости, физико-химические свойства;
- идентификационные данные;
Среда (при необходимости):
- обоснование выбора среды (если это не вода);
Подопытные животные:
- вид/род используемых животных;
- число, возраст и пол животных;
- происхождение, условия содержания, питание и так далее;
- масса каждого животного в начале эксперимента;
Данные об условиях проведения исследования:
- обоснование выбора уровня дозы;
- подробное описание приготовления состава тестируемого вещества (пищи, достигнутая концентрация, устойчивость и однородность вещества);
- подробное описание введения вещества;
- переводной коэффициент от концентрации исследуемого вещества в пище/питьевой воде (ррm) к фактической дозе (мг/кг в день), если возможно;
- качество пищи и воды;
Результаты:
- масса/изменения массы;
- потребление пищи и воды, если возможно;
- данные реакции на токсичность по полу и дозе, включая фертильность, беременность и любые другие признаки токсичности;
- длительность беременности;
- токсичное или иное влияние на репродуктивность, потомство, рост после рождения и др.;
- характер, тщательность и длительность клинических наблюдений (можно ли их однозначно интерпретировать или нет);
- количество живого потомства и постимплантационная гибель плодов;
- количество детенышей с явно наблюдаемыми аномалиями, количество малорослых;
- время смерти в течение исследования или дожившие до его окончания животные;
- количество зародышей, желтые тела (рекомендуется), размер и масса приплода на момент отчета;
- масса тела на момент умерщвления и данные по массе органов родительских животных;
- данные аутопсии;
- подробное описание обнаруженных микроскопических изменений половых путей и других тканей самцов, если имеются;
- данные по абсорбции, если имеются;
- статистическая обработка, когда требуется;
Обсуждение результатов.
Заключение.
7.4 Интерпретация результатов
Исследование даст оценку репродуктивной/эмбриональной токсичности, связанной с введением повторяющихся доз. Оно может показать необходимость проведения дополнительного изучения и стать руководством по разработке дальнейших исследований.
Приложение А
(Обязательное)
График схемы исследования, показывающий максимальную длительность исследования, основанную на полном 14-дневном периоде спаривания
|
Приложение Б
(рекомендуемое)
Пример Таблицы итогового отчета воздействий на репродуктивность/эмбрион
НАБЛЮДЕНИЯ | ОЦЕНКИ | |||
Доза (единицы) | 0( | .. | … | |
Пары на начало (N) | ||||
Самки с признаками совокупления (N) | ||||
Самки, достигшие беременности (N) | ||||
Дни зачатия 1-5 (N) | ||||
Дни зачатия 6-... | ||||
Беременность | ||||
Беременность =22 дня (N) | ||||
Беременность | ||||
Самки с живыми новорожденными (N) | ||||
Самки с живыми детенышами к 4 дню (N) | ||||
Желтое тело/самка (в среднем) | ||||
Эмбрионы/самка (в среднем) | ||||
Живые детеныши/самка при рождении (в среднем) | ||||
Живые детеныши/самка к 4-му дню (в среднем) | ||||
Численное соотношение полов (самцы/самки) к моменту рождения (в среднем) | ||||
Численное соотношение полов (самцы/самки) к 4-му дню (в среднем) | ||||
Масса приплода при рождении (в среднем) | ||||
Масса приплода к 4-му дню (в среднем) | ||||
Масса детеныша при рождении (в среднем) | ||||
Масса детеныша к 4-му дню (в среднем) | ||||
АНОМАЛИИ ДЕТЕНЫШЕЙ | ||||
Самки с 0 | ||||
Самки с 1 | ||||
Самки | ||||
ПОТЕРИ ПОТОМСТВА | ||||
Предимплантационный (желтые тела минус зародыши) | ||||
Самки с 0 | ||||
Самки с 1 | ||||
Самки с 2 | ||||
Самки | ||||
предродовой/постимплантационный (зародыши минус рожденные живыми) | ||||
Самки с 0 | ||||
Самки с 1 | ||||
Самки с 2 | ||||
Самки | ||||
послеродовой (рожденные живыми минус живые к 4 дню после родов) | ||||
Самки с 0 | ||||
Самки с 1 | ||||
Самки с 2 | ||||
Самки | ||||
_______________
Последний день периода спаривания
Библиография
[1] OECD, Test N 421 "Reproduction/ Developmental Toxicity Screening Test"
[2] OECD, Paris (1990). Room Document No. 1 for the 14th Joint Meeting of the Chemicals Group and Management Committee
[3] OECD, Paris (1992). Chairman's Report of the ad hoc Expert Meeting on Reproductive Toxicity Screening Methods, Tokyo, 27th-29th October, 1992
УДК 661:615.099:006.354 | МКС 71.100.01 |
Ключевые слова: химическая продукция, воздействие на организм человека, метод испытаний, репродуктивность, эмбриотоксичность. | |
Электронный текст документа
и сверен по:
, 2019