ГОСТ Р 59545-2021/ISO/TS 19337:2016
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Нанотехнологии
НАНОСУСПЕНЗИИ ДЛЯ МЕТОДОВ IN VITRO
Основные характеристики и методы измерений
Nanotechnologies. Nanosuspensions for in vitro methods. Main characteristics and measurement methods
ОКС 07.030
Дата введения 2022-03-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия" (ФГУП "") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 441 "Нанотехнологии"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 1 июня 2021 г. N 493-ст
4 Настоящий стандарт идентичен международному документу ISO/TS 19337:2016* "Нанотехнологии. Характеристики рабочих суспензий нанообъектов при анализе in vitro для оценки собственной токсичности нанообъекта" (ISO/TS "19337:2016 Nanotechnologies - Characteristics of working suspensions of nano-objects for in vitro assays to evaluate inherent nano-object toxicity", IDT).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5-2012 (пункт 3.5).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет ()
Введение
Перед промышленным производством и реализацией на рынке наноматериалы следует проверять на их возможное влияние на здоровье человека и окружающую среду.
Оценку токсичности методами in vitro с применением культуральной среды, как правило, используют для скрининга опасных материалов. По результатам данных испытаний получают информацию о механизмах биологических эффектов, вызываемых материалами. При этом следует учитывать особенности нанообъектов при оценке токсичности методами in vitro, так как их свойства отличаются от свойств водорастворимых химических веществ. Например, сразу после введения в культуральную среду нанообъекты претерпевают изменения, такие как: a) растворение, которое представляет собой растворение нанообъектов в их ионных аналогах; b) образование короны, представляющей собой компоненты культуральной среды, адсорбированные на поверхности нанообъекта; c) изменения состояний агрегации/агломерации, приводящие к изменению размеров частиц и седиментации. В связи с этим при проведении испытаний следует учитывать вышеуказанные явления для установления того, связаны ли наблюдаемые эффекты с самими испытуемыми нанообъектами или другими неконтролируемыми факторами, и во избежание неправильной интерпретации полученных результатов.
Определение точных значений характеристик наносуспензии до и во время оценки токсичности методами in vitro имеет важное значение для исключения факторов, искажающих результаты методов in vitro. Например, образование короны, высвобождение ионов металла из нанообъектов и примесей (остаточные материалы от процесса синтеза нанообъектов) могут препятствовать проведению некоторых испытаний методами in vitro [1] и являться причиной получения неточных результатов измерений. Следует учитывать, что образование агломератов и агрегатов в наносуспензии может изменить показатели токсичности. Поэтому следует обеспечить получение точных и достоверных результатов измерений и описаний характеристик рабочей суспензии и содержащихся в ней испытуемых нанообъектов.
В настоящем стандарте приведены основные характеристики рабочих суспензий, содержащих нанообъекты и применяемых в методах in vitro для оценки токсичности этих нанообъектов, и сведения о соответствующих методах измерений. Целью настоящего стандарта является обеспечение заинтересованных лиц (представителей контролирующих органов, общественных организаций, изготовителей и конечных потребителей) нормативными документами, направленными на получение точных и достоверных сведений о токсичности нанообъектов. Настоящий стандарт не устанавливает методы испытаний рабочих суспензий, содержащих нанообъекты.
1 Область применения
Настоящий стандарт распространяется на рабочие суспензии, содержащие нанообъекты (наносуспензии) и применяемые в методах in vitro для оценки токсичности этих нанообъектов. Настоящий стандарт устанавливает перечень основных характеристик наносуспензий и содержит рекомендации по применению соответствующих методов измерений.
Настоящий стандарт распространяется на наносуспензии, содержащие нанообъекты, их агрегаты и агломераты размерами более 100 нм.
Примечание - Настоящий стандарт допускается применять в качестве руководства по установлению источника токсичности, т.е. являются ли источниками токсичности испытуемые нанообъекты или другие элементы наносуспензии.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующий стандарт. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения).
ISO 29701, Nanotechnologies - Endotoxin test on nanomaterial samples for in vitro systems - Limulus amebocyte lysate (LAL) test [Нанотехнологии. Испытания эндотоксинов на образцах наноматериалов для систем in vitro. Испытание Limulus amebocyte lysate (LAL)]
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 культуральная среда (culture medium): Водный раствор питательных веществ, необходимых для роста клеток.
3.2 вторичная частица (secondary particle): Комплексный агломерат/агрегат первичной(ых) частицы (частиц), белков и других компонентов среды.
3.3 стабильность (stability): Свойство рабочей суспензии оставаться неизменной в течение определенного времени при установленных или разумно ожидаемых условиях хранения и использования в методах in vitro.
3.4 рабочая суспензия (наносуспензия) (working suspension): Суспензия, приготовленная для анализа in vitro и содержащая культуральную среду и испытуемые нанообъекты.
4 Обозначения и сокращения
В настоящем стандарте применены следующие обозначения и сокращения:
ААС - атомно-абсорбционная спектрометрия;
BCA - бицинхониновая кислота;
ДЛИ - дифракция лазерного излучения;
ДРС - динамическое рассеяние света;
ИСП-АЭС - атомно-эмиссионная спектрометрия с индуктивно связанной плазмой;
ИСП-МС - масс-спектрометрия с индуктивно связанной плазмой;
ООУ - общий органический углерод;
ОСФ - оптическая спектрофотометрия в ультрафиолетовой и видимой областях спектра;
ПФП - проточное фракционирование в силовом поле;
СРС - статическое рассеяние света;
У/Ф - ультрафильтрация;
ФТП - фильтрация в тангенциальном потоке;
Ц-У/Ф - ультрафильтрация с применением центрифугирования.
5 Основные характеристики наносуспензий и методы измерений
5.1 Общие положения
С целью определения пригодности наносуспензии для применения в методах in vitro для оценки токсичности этих нанообъектов следует предварительно определить ее характеристики, которые могут повлиять на испытуемую биологическую систему. В настоящем разделе установлен перечень основных характеристик наносуспензии и приведены рекомендации по применению соответствующих методов измерений.
Основные характеристики наносуспензии:
- наличие и концентрация эндотоксинов;
- стабильность;
- концентрации ионов металлов;
- концентрации компонентов культуральной среды.
Указанные характеристики определяют для каждой приготовленной дозы наноcуспензии. Наличие и концентрацию эндотоксинов определяют в нанообъектах, предназначенных для приготовления наносуспензии, или в готовой наносуспезии. В приложении А приведен алгоритм проведения испытаний по определению характеристик наносуспензий в качестве примера последовательности этапов испытаний.
5.2 Наличие и концентрация эндотоксинов
Загрязнение эндотоксинами, входящими в состав наружной мембраны грамотрицательных бактерий, может существенно изменить результаты оценки токсичности нанообъектов методами in vitro. В связи с этим следует определить наличие и концентрацию эндотоксинов в наносуспензии. Наличие и концентрацию эндотоксинов в наносуспензии определяют с использованием лизата амебоцитов (ЛАЛ-тест) в соответствии с ИСО 29701 и теста активации моноцитов (MAT) (см. [2], [3]).
5.3 Стабильность
5.3.1 Общие положения
Стабильность наносуспензии является ее ключевой характеристикой, т.к. данная характеристика влияет на условия испытаний в методах in vitro, т.е. дозу нанообъектов в клетках ([4], [5]). Агрегация/агломерация и осаждение нанообъектов под действием гравитационных сил являются основными факторами, влияющими на стабильность наносуспензии. Стабильность наносуспензии оценивают по двум характеристикам: относительному изменению репрезентативных размеров вторичных частиц и относительному изменению концентрации нанообъектов, происходящих в наносуспензии при испытании методом in vitro, при осаждении под действием гравитационных сил, в течение времени, необходимого для оценки токсичности нанообъектов. Результаты определения стабильности наносуспензии выражают в процентах за период времени, затраченного на испытание по оценке токсичности методом in vitro.
Примечание - Руководство по определению стабильности рабочей суспензии см. в [6].
5.3.2 Определение изменений репрезентативных размеров вторичных частиц
Для определения изменений репрезентативных размеров вторичных частиц следует применять методы, основанные на явлениях динамического рассеяния света (ДРС) (см. [4], [7]), дифракции лазерного излучения (ДЛИ) (см. [8]) и статического рассеяния света (СРС) [9]. Допускается применять другие методы, не указанные в настоящем стандарте, обеспечивающие достоверность результатов и заданную точность измерений. Сведения о применяемых методах измерений должны быть зарегистрированы в протоколе в соответствии с 6.6.
Дополнительная информация приведена в приложении B.
5.3.3 Определение изменения концентрации нанообъектов
Для определения изменения концентрации нанообъектов в наносуспензии следует выбирать соответствующие методы измерения, например методы, основанные на рассеянии света ([4], [7] [10]), масс-спектрометрию с индуктивно связанной плазмой (ИСП-МС) ([11]-[13]), оптическую спектрофотометрию в ультрафиолетовой и видимой областях спектра (ОСФ), методы, основанные на сканировании объекта рентгеновским излучением [14] или анализе содержания общего органического углерода (ООУ) [15]. Допускается применять другие методы, не указанные в настоящем стандарте, обеспечивающие достоверность результатов и заданную точность измерений. Сведения о применяемых методах измерений должны быть зарегистрированы в протоколе в соответствии с 6.6.
Дополнительная информация приведена в приложении B.
5.4 Концентрации ионов металлов
Ионы металлов, образующиеся в результате растворения испытуемых нанообъектов, могут способствовать токсичности для испытуемых клеток. Концентрацию ионов металлов в наносуспензии определяют после отделения твердых частиц. Для отделения ионов от твердых частиц рекомендуется применять методы ультрафильтрации (У/Ф), ультрафильтрации с применением центрифугирования (Ц-У/Ф) или фильтрации в тангенциальном потоке (ФТП). Данную характеристику наносуспензии определяют в отношении всех металлов, содержащихся в испытуемых нанообъектах. Для определения концентраций ионов металлов выбирают соответствующий метод измерения, например атомно-эмиссионную спектрометрию с индуктивно связанной плазмой (ИСП-АЭС), ИСП-МС, атомно-абсорбционную спектрометрию (AAQ или колориметрический метод.Допускается применять другие методы, не указанные в настоящем стандарте, обеспечивающие достоверность результатов и заданную точность измерений. Сведения о применяемых методах измерений должны быть зарегистрированы в протоколе в соответствии с 6.6. Результаты определения концентраций ионов металлов выражают в единицах молярной, массовой или объемной концентрации в соответствующих единицах физических величин. Если токсичность для испытуемых клеток в наносуспензии не выявлена, то допускается не определять данную характеристику (см. приложение A).
Дополнительная информация приведена в приложении C.
5.5 Концентрации компонентов культуральной среды
5.5.1 Общие положения
Следует учитывать, что испытуемые нанообъекты, добавленные в культуральную среду для подготовки наносуспензии, могут адсорбировать содержащиеся в ней компоненты [1], что может привести к истощению культуральной среды. Следует учитывать, что белки и кальций являются питательными компонентами в культуральной среде и поглощаются клетками в процессе культивации, поэтому их концентрацию в наносуспензии после добавления нанообъектов в культуральную среду следует определять по истечении достаточно продолжительного периода времени. Если известны компоненты культуральной среды, отличные от белка и кальция, которые могут существенно повлиять на стабильность наносуспензии для оценки токсичности методами in vitro, также следует определить концентрации этих компонентов. Если токсичность для испытуемых клеток в наносуспензии не выявлена, то допускается не определять данную характеристику (см. приложение A).
Примечание - Следует учитывать, что нанообъекты могут оказывать влияние на показатель водородных ионов (рН), осмоляльность и другие характеристики культуральной среды.
5.5.2 Определение концентрации белков
Для определения концентрации белков в наносуспензии применяют один из методов с использованием бицинхониновой кислоты (BCA), методы Брэдфорда или Лоури, методы, основанные на ультрафиолетовом излучении, рефрактометрические методы, основанные на свойстве белков к преломлению светового потока, и СРС в сочетании с проточным фракционированием в силовом поле (ПФП) [9]. Если применяют методы с использованием BCA [16], методы Брэдфорда [17] или Лоури [18], то концентрацию белков определяют после отделения твердых частиц от наносуспензии. Результаты выражают в единицах массовой концентрации.
Дополнительная информация приведена в приложении D.
5.5.3 Определение концентрации кальция
Для определения концентрации кальция применяют соответствующий метод измерения из числа ИСП-АЭС, ИСП-МС и AAС и колориметрический метод. Результаты выражают в виде отношения массы к массе или массы к объему в соответствующих единицах физических величин.
Дополнительная информация приведена в приложении D.
6 Протокол испытаний
6.1 Общие положения
В протоколе испытаний приводят сведения о нанообъектах, включая сведения об исходных материалах, примененных для их изготовления, составляющих компонентах, примененных культуральной среде и сыворотке, результаты измерений и определения характеристик наносуспензии. Сведения в протоколе испытаний приводят в соответствии с настоящим разделом.
6.2 Наименование нанообъектов и сведения об изготовителе
В протоколе указывают наименование, каталожный номер нанообъектов и сведения об изготовителе, включая наименование, адрес и контактную информацию.
6.3 Металлические примеси, содержащиеся в нанообъектах
В протоколе приводят сведения об основных и посторонних примесях, содержащихся в нанообъектах, в том числе материалах покрытий и катализаторах, указывая их известное или предполагаемое количество.
6.4 Культуральная среда и сыворотка
В протоколе указывают наименование и изготовителя культуральной среды, тип и концентрацию добавленной сыворотки (в объемной доле или в процентах), значения pH культуральной среды до и во время проведения испытаний по оценке токсичности, а также тип и концентрации других добавок (при наличии).
6.5 Результаты испытаний
В протоколе регистрируют сведения о всех испытуемых дозах наносуспензии. Допускается регистрировать результат испытания на эндотоксин для испытуемой наносуспензии в целом, а не для ее отдельных доз.
Допускается не указывать сведения о концентрациях ионов металлов и компонентов культуральной среды, если при проведении испытаний по оценке токсичности методами in vitro не выявлена токсичность анализируемых доз наносуспензии.
В протоколе испытаний регистрируют следующие сведения по результатам определения наличия и концентрации эндотоксинов в наносуспензии:
a) положительный (наличие и концентрация эндотоксинов)/отрицательный (отсутствие эндотоксинов);
b) дату проведения испытания;
c) сведения и описание метода измерений;
d) информацию об испытательной лаборатории, точности и достоверности полученных данных;
e) другую дополнительную информацию (при наличии).
В протоколе испытаний регистрируют следующие сведения по результатам определения стабильности наносуспензии:
a) данные об изменениях репрезентативных размеров и концентраций нанообъектов;
b) дату проведения испытания;
c) сведения и описания методов измерений, примененных для определения изменений репрезентативных размеров и концентраций нанообъектов;
d) информацию об испытательной лаборатории, точности и достоверности полученных данных;
e) дополнительную информацию о способе подготовки наносуспензии;
f) другую дополнительную информацию (при наличии).
В протоколе испытаний регистрируют следующие сведения по результатам определения концентраций ионов металлов:
a) наименования ионов металлов и их концентрации;
b) дату проведения испытания;
c) сведения и описание метода измерений;
d) информацию об испытательной лаборатории, точности и достоверности полученных данных;
e) другую дополнительную информацию (при наличии).
В протоколе испытаний регистрируют следующие сведения по результатам определения концентраций компонентов культуральной среды:
a) концентрацию белка и кальция;
b) дату проведения испытания;
c) сведения и описание методов измерений, примененных для определения концентраций белка и кальция;
d) информацию об испытательной лаборатории, точности и достоверности полученных данных;
e) другую дополнительную информацию (при наличии).
6.6 Отклонения
В протоколе испытаний указывают любые отклонения от настоящего стандарта, в том числе другие примененные методы измерений и их подробное описание, точность и достоверность результатов, обоснование выбора примененных методов.
Приложение А
(справочное)
Алгоритм проведения испытаний по определению характеристик наносуспензий
В настоящем приложении приведен алгоритм испытаний по определению характеристик наносуспензий, включая соответствующие этапы, на которых выполняют измерения.
Для каждой дозы наносуспензии, приготовленной смешиванием испытуемых нанообъектов и культуральной среды, определяют стабильность, концентрации ионов металлов и компонентов культуральной среды. Наличие и концентрацию эндотоксинов определяют в нанообъектах, предназначенных для приготовления наносуспензии, или в готовой наносуспезии.
Наносуспензию разделяют на две дозы: одна - для оценки токсичности методом in vitro (анализируемая доза), другая - для определения характеристик (испытуемая доза). Испытания по определению концентраций ионов металлов и компонентов культуральной среды проводят на испытуемых дозах при выявлении токсичности в анализируемых дозах.
Схема алгоритма проведения испытаний по определению характеристик наносуспензий приведена на рисунке А.1.
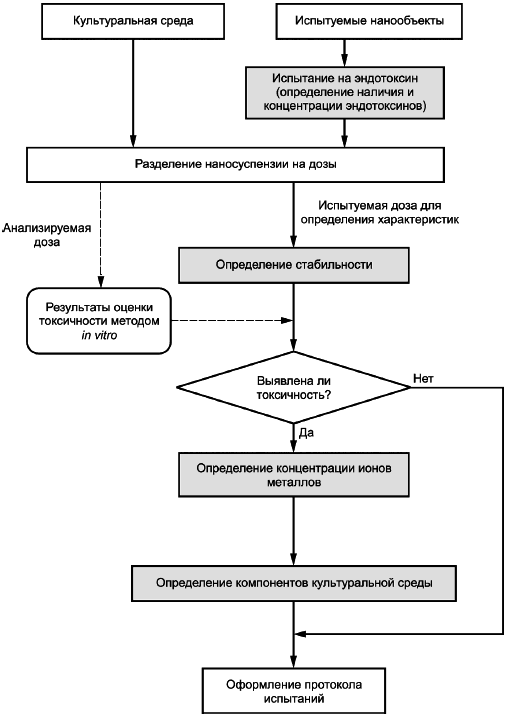 |
Рисунок A.1 - Схема алгоритма проведения испытаний по определению характеристик наносуспензий
Приложение В
(справочное)
Дополнительная информация о методах измерений, применяемых для определения стабильности наносуспензий
B.1 Общие положения
В настоящем приложении приведены сведения о методах измерений, применяемых для определения стабильности наносуспензий. Следует учитывать, что данные методы являются рекомендуемыми и не являются установленными с целью применения для определения характеристик некоторых типов нанообъектов. При проведении оценки токсичности нанообъектов методами in vitro следует учитывать разнообразие нанообъектов и выбирать подходящий метод определения стабильности наносуспензии.
Для выполнения измерений наносуспензию следует готовить в соответствии с требованиями, установленными для конкретного метода in vitro, применяемого для оценки токсичности нанообъектов. Дозы одной и той же приготовленной наносуспензии следует использовать и для испытаний по определению характеристик и оценке токсичности методами in vitro. При проведении оценки токсичности наносуспензии методами in vitro результаты определения изменений значений ее характеристик выражают в процентах. Рекомендуется выполнять не менее трех измерений и результаты представлять в виде среднего значения.
B.2 Определение изменений репрезентативных размеров вторичных частиц
Для определения изменений репрезентативных размеров вторичных частиц следует применять соответствующий метод измерения на основе ДРС, или ДЛИ, или СРС. Метод выбирают с учетом его возможности к измерению определенных диапазонов размеров вторичных частиц.
В.3 Определение изменения концентрации нанообъектов
Для определения изменений концентраций большинства типов нанообъектов допускается применять методы, основанные на мониторинге интенсивности рассеяния света, такие как ДРС или СРС, при условии, что размеры отдельных нанообъектов более размеров молекул белка в наносуспензиях. Метод анализа содержания ООУ допускается применять к углеродным нанообъектам при условии, что температуры окисления или пиролиза этих нанообъектов и культуральной среды различны. Если точно известно содержание фонового углерода в наносуспензии, то также допускается применять метод анализа содержания ООУ Метод ОСФ применяют ко всем группам нанообъектов при условии, что спектры поглощения нанообъектов можно отличить от фоновых спектров поглощения других элементов культуральной среды. При этом следует учитывать, что метод ОСФ не применяют к нанообъектам веществ, атомный номер которых менее атомного номера углерода.
Приложение С
(справочное)
Дополнительная информация о методах измерений, применяемых для определения концентраций ионов металлов в наносуспензиях
С.1 Отделение ионов металлов от твердых частиц
Для метода Ц-У/Ф следует подбирать мембрану с оптимальной молекулярной массой фракционирования в зависимости от размеров наночастиц. Метод Ц-У/Ф применяют для отделения ионов металлов от твердых частиц. Для полного извлечения фильтрата, содержащего ионы металлов, в приборе для У/Ф следует устанавливать соответствующее центробежное ускорение и время центрифугирования [19].
Допускается применять метод ультрацентрифугирования для металлических нанообъектов. Для полного извлечения раствора, содержащего ионы металлов, ультрацентрифугирование следует выполнять при соответствующих параметрах, включая центробежное ускорение и время центрифугирования.
Фильтрат или супернатант анализируют методами, приведенными в С.2.
С.2 Методы измерений
С.2.1 Выбор метода
Допускается применять метод ИСП-МС, который является высокочувствительным методом и имеет предел обнаружения на уровне триллионной доли компонента (ppt), или метод AA обеспечивающий получение наиболее достоверных результатов измерений.
Если хелатирующий агент для колориметрического измерения пригоден для обнаружения ожидаемого иона металла, то допускается применять колориметрический метод. При этом хелатирующий агент должен иметь высокую субстратную специфичность и не иметь перекрестной реактивности. При отсутствии подходящего хелатирующего агента для ожидаемого иона металла колориметрический метод не применяют.
C.2.2 Атомно-эмиссионная спектрометрия с индуктивно связанной плазмой
При применении метода ИСП-АЭС используют калибровочные кривые и стандартные растворы для ионов соответствующих химических элементов.
Руководство по применению метода ИСП-АЭС см. в [20].
C.2.3 Масс-спектрометрия с индуктивно связанной плазмой
Предварительную подготовку наносуспензии и построение калибровочных кривых выполняют в соответствии с С.1.
Руководство по применению метода ИСП-МС см. в [21] и [22].
С.2.4 Атомно-абсорбционная спектрометрия
При применении метода ААС используют калибровочные кривые и стандартные растворы для ионов соответствующих химических элементов.
С.2.5 Колориметрический метод
Если ионы металлов в наносуспензии имеют характерную полосу поглощения в ультрафиолетовой и видимой областях спектра, то для определения их концентрации рекомендуется применять колориметрический метод. Перед проведением количественного анализа спектры поглощения ионов металлов измеряют и идентифицируют. Для анализа выбирают полосу поглощения, которая характерна для конкретных ионов металлов и не перекрывает полосы поглощения других ионов металлов.
Приложение D
(справочное)
Дополнительная информация о методах измерений, применяемых для определения концентраций компонентов культуральной среды в наносуспензиях
D.1 Белки
Нанообъекты отделяют от наносуспензии методом центрифугирования или ультрацентрифугирования. Если твердые частицы отделяются от диспергатора методом центрифугирования/ультрацентрифугирования, то концентрацию белка в среде определяют методом c применением BCA [16], методом Брэдфорда [17] или методом Лоури [18], используя бычий сывороточный альбумин (BSA) в качестве стандартного образца белка. Если отделение твердых частиц от диспергатора затруднено, то применяют метод ПФП. Если культуральная среда не содержит какого-либо белка, например бессывороточная среда, то концентрацию белка не определяют.
D.2 Кальций
D.3 Другие компоненты культуральной среды
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 29701 | IDT | ГОСТ Р ИСО 29701-2015 "Нанотехнологии. Наноматериалы для испытаний в тест-системах in vitro. Метод определения содержания эндотоксинов с использованием лизата амебоцитов Limulus (ЛАЛ-тест)" |
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: - IDT - идентичный стандарт. | ||
Библиография
[1] | Horie M., Nishio K., Fujita K., Endoh S., Miyauchi A., Saito Y., Protein adsorption of ultrafine metal oxide and its influence on cytotoxicity toward cultured cells. Chem. Res. Toxicol. 2009, 22, pp.543-553 | |
[2] | Hartung T., & Sabbioni E., Alternative in vitro assays in nanomaterial toxicology. Wiley Interdisciplinary Reviews Nanomedicine Nanobiotechnology. 2011, 3 (6), pp.545-573 | |
[3] | Schindler S., von Aulock S., Daneshian M., Hartung T., Development, validation and applications of the monocyte activation test for pyrogens based on human whole blood. ALTEX. 2009, 26 (4), pp.265-277 | |
[4] | Kato H., Suzuki M., Fujita K., Horie M., Endoh S., Yoshida Y., Reliable size determination of nanoparticles using dynamic light scattering method for in vitro toxicology assessment. Toxicol. In vitro. 2009, 23, pp.927-934 | |
[5] | Teeguarden J.G., Hinderliter P.M., Orr G., Thrall B.D., Pounds J.G., Particokinetics in vitro: dosimetry considerations for in vitro nanoparticle toxicity assessments. Toxicol. Sci. 2007, 95 (2), pp.300-312 | |
[6] | ISO/TR 13097:2013, | Guidelines for the characterization of dispersion stability (Руководящие указания по определению характеристик дисперсионной стабильности) |
[7] | Kato H., Fujita K., Horie M., Suzuki M., Nakamura A., Endoh S., Dispersion characteristics of various metal oxide secondary nanoparticles in culture medium for in vitro toxicology assessment. Toxicol. In vitro. 2010, 24, pp.1009-1018 | |
[8] | ISO 13320:2009, | Particle size analysis - Laser diffraction methods (Гранулометрический анализ. Методы лазерной дифракции) |
[9] | Kato H., Shinohara N., Nakamura A., Horie M., Fujita K., Takahashi K., Characterization of fullerene colloidal suspension in a cell culture medium for in vitro toxicity assessment. Mol. Biosyst. 2010, 6, pp.1238-1246 | |
[10] | Schierz A., & Zanker H., Aqueous suspensions of carbon nanotubes: Surface oxidation, colloidal stability and uranium sorption. Environ. Pollut. 2009, 157, pp.1088-1094 | |
[11] | Saleh B.S., Pfefferle D.L., Elimelech M., Aggregation kinetics of multiwalled carbon nanotubes in aquatic systems: measurements and environmental implications. Environ. Sci. Technol. 2008, 42, pp.7963-7969 | |
[12] | Sato Y., Shibata K., Kataoka H., Ogino S., Bunshi F., Yokoyama A., Strict preparation and evaluation of water-soluble hat-stacked carbon nanofibers for biomedical application and their high biocompatibility: influence of nanofiber-surface functional groups on cytotoxicity. Mol. Biosyst. 2005, 1, pp.142-145 | |
[13] | Wang X., Xia T., Ntim S.A., Ji Z., George S., Meng H., Quantitative techniques for assessing and controlling the dispersion and biological effects of multiwalled carbon nanotubes in mammalian tissue culture cells. ACS Nano. 2010, 4, pp.7241-7252 | |
[14] | ISO 13317-3:2001, | Determination of particle size distribution by gravitational liquid sedimentation methods - Part 3: X-ray gravitational technique (Определение гранулометрического состава с помощью методов гравитационного осаждения в жидкости. Часть 3. Рентгеновский гравитационный метод) |
[15] | Kato H., Mizuno K., Shimada M., Nakamura A., Takahashi K., Hata K., Observations of bound Tween80 surfactant molecules on single-walled carbon nanotubes in an aqueous solution. Carbon. 2009, 47, pp.3434-3440 | |
[16] | Smith PK., Krohn R.I., Hermanson G.T., Mallia A.K., Gartner F.H., Provenzano M.D., Measurement of protein using bicinchoninic acid. Anal. Biochem. 1985, 150, pp.76-85 | |
[17] | Bradford M.M., A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976, 72, pp.248-254 | |
[18] | Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J., Protein measurement with the Folin phenol reagent. J. Biol. Chem. 1951, 193, pp.265-275 | |
[19] | Horie M., Kato H., Fujita K., Endoh S., Iwahashi H., In vitro evaluation of cellular response induced by manufactured nanoparticles. Chem. Res. Toxicol. 2012, 25, pp.605-619 | |
[20] | ISO 11885:2007, | Water quality - Determination of selected elements by inductively coupled plasma optical emission spectrometry (ICP-OES) (Качество воды. Определение выбранных элементов методом оптической эмиссионной спектрометрии с индуктивно связанной плазмой) |
[21] | ISO 17294-1:2004, | Water quality - Application of inductively coupled plasma mass spectrometry (ICP-MS) - Part 1: General guidelines [Качество воды. Применение масс-спектрометрии индуцируемой плазмы (ICP-MS). Часть 1. Общее руководство] |
[22] | ISO 17294-2:2003, | Water quality - Application of inductively coupled plasma mass spectrometry (ICP-MS) - Part 2: Determination of 62 elements [Качество воды. Применение масс-спектрометрии индуцируемой плазмы (ICP-MS). Часть 2. Определение 62 элементов] |
[23] | ISO/TS 80004-2, | Nanotechnologies - Vocabulary - Part 2: Nano-objects (Нанотехнологии. Словарь. Часть 2. Нанообъекты) |
УДК 57.08:006.354 | ОКС 07.030 | ||
Ключевые слова: рабочая суспензия, нанообъекты, наносуспензия, оценка токсичности, методы in vitro, основные характеристики, методы измерений | |||
