ГОСТ Р 54763-2011
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Средства лекарственные для ветеринарии
ТЕХНОЛОГИЧЕСКИЕ РЕГЛАМЕНТЫ ПРОИЗВОДСТВА
Содержание, порядок разработки, согласования и утверждения
Medicinal remedies for veterinary. Manufacture production regulations. The maintenance, order of working out, coordination and confirmation
ОКС 11.220
Дата введения 2013-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН Рабочей группой, состоящей из представителей Государственного научного учреждения "Всероссийский научно-исследовательский и технологический институт биологической промышленности" Российской академии сельскохозяйственных наук (ГНУ "ВНИТИБП" Россельхозакадемии), Федерального государственного бюджетного учреждения "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ"), Федерального государственного унитарного предприятия "Курская биофабрика" (ФГУП "Курская биофабрика"), Федерального государственного унитарного предприятия "Щелковский биокомбинат" (ФГУП "Щелковский биокомбинат")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 454 "Охрана жизни и здоровья животных и ветеринарно-санитарная безопасность продуктов животного происхождения и кормов"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 13 декабря 2011 г. N 1391-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на фармакологические, биологические и гомеопатические лекарственные средства для ветеринарии (далее - ЛС) и устанавливает общие требования к содержанию, порядку разработки, согласованию и утверждению технологических регламентов производства.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р 7.0.5-2008 Система стандартов по информации, библиотечному и издательскому делу. Библиографическая ссылка. Общие требования и правила составления
ГОСТ Р 12.1.019-2009 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ Р ИСО 9001-2008* Системы менеджмента качества. Требования
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ ISO 9001-2011, здесь и далее по тексту. - .
ГОСТ Р ИСО 14001-2007 Системы экологического менеджмента. Требования и руководство по применению
ГОСТ Р ИСО 14041-2000 Управление окружающей средой. Оценка жизненного цикла. Определение цели, области исследования и инвентаризационный анализ
ГОСТ Р ИСО 14644-1-2000* Чистые помещения и связанные с ними контролируемые среды. Часть 1. Классификация чистоты воздуха
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ ИСО 14644-1-2002, здесь и далее по тексту. - .
ГОСТ Р ИСО 14644-2-2001 Чистые помещения и связанные с ними контролируемые среды. Часть 2. Требования к контролю и мониторингу для подтверждения постоянного соответствия
ГОСТ Р ИСО 14644-3-2007 Чистые помещения и связанные с ними контролируемые среды. Часть 3. Методы испытаний
ГОСТ Р ИСО 14644-4-2002 Чистые помещения и связанные с ними контролируемые среды. Часть 4. Проектирование, строительство и ввод в эксплуатацию
ГОСТ Р ИСО 14644-5-2005 Чистые помещения и связанные с ними контролируемые среды. Часть 5. Эксплуатация
ГОСТ Р 50779.10-2000 (ИСО 3534-1-93) Статистические методы. Вероятность и основы статистики. Термины и определения
ГОСТ Р 50779.11-2000 (ИСО 3534-2-93) Статистические методы. Статистическое управление качеством. Термины и определения
ГОСТ Р 50779.42-99 (ИСО 8258-91) Статистические методы. Контрольные карты Шухарта
ГОСТ Р 51141-98 Делопроизводство и архивное дело. Термины и определения
ГОСТ Р 51705.1-2001 Системы качества. Управление качеством пищевых продуктов на основе принципов ХАССП. Общие требования
ГОСТ Р 51897-2011 Менеджмент риска. Термины и определения
ГОСТ Р 51898-2002 Аспекты безопасности. Правила включения в стандарты
ГОСТ Р 51901.1-2002 Менеджмент риска. Анализ риска технологических систем
ГОСТ Р 52249-2009 Правила производства и контроля качества лекарственных средств
ГОСТ Р 52537-2006 Производство лекарственных средств. Система обеспечения качества. Общие требования
ГОСТ Р 52550-2006 Производство лекарственных средств. Организационно-технологическая документация
ГОСТ Р 52682-2006 Средства лекарственные для животных. Термины и определения
ГОСТ Р 52683-2006 Средства лекарственные для животных. Упаковка, маркировка, транспортирование и хранение
ГОСТ Р 52684-2006 Средства лекарственные для животных. Правила приемки, методы отбора проб
ГОСТ 2.105-95 Единая система конструкторской документации. Общие требования к текстовым документам
ГОСТ 2.106-96 Единая система конструкторской документации. Текстовые документы
ГОСТ 2.301-68 Единая система конструкторской документации. Форматы
ГОСТ 3.1109-82 Единая система технологической документации. Термины и определения основных понятий
ГОСТ 3.1120-83 Единая система технологической документации. Общие правила отражения и оформления требований безопасности труда в технологической документации
ГОСТ 8.417-2002 Государственная система обеспечения единства измерений. Единицы величин
ГОСТ 12.0.002-80 Система стандартов безопасности труда. Термины и определения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.008-76 Система стандартов безопасности труда. Биологическая безопасность. Общие требования
ГОСТ 12.1.044-89 (ИСО 4589-84) Система стандартов безопасности труда. Пожаровзрывоопасность веществ и материалов. Номенклатура показателей и методы их определения
ГОСТ 12.2.003-91 Система стандартов безопасности труда. Оборудование производственное. Общие требования безопасности
ГОСТ 12.3.002-75 Система стандартов безопасности труда. Процессы производственные. Общие требования безопасности
ГОСТ Р 12.3.047-98 Система стандартов безопасности труда. Пожарная безопасность технологических процессов. Общие требования. Методы контроля
ГОСТ 12.4.011-89 Система стандартов безопасности труда. Средства защиты работающих. Общие требования и классификация
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 15.601-98 Система разработки и постановки продукции на производство. Техническое обслуживание и ремонт техники. Основные положения
ГОСТ 17.2.3.02-78 Охрана природы. Атмосфера. Правила установления допустимых выбросов вредных веществ промышленными предприятиями
ГОСТ 28.001-83 Система технического обслуживания и ремонта техники. Основные положения
ГОСТ 16299-78 Упаковывание. Термины и определения
ГОСТ 17527-2003 Упаковка. Термины и определения
ГОСТ 18322-78 Система технического обслуживания и ремонта техники. Термины и определения
ГОСТ 20831-75 Система технического обслуживания и ремонта техники. Порядок проведения работ по оценке качества отремонтированных изделий
ГОСТ 30772-2001 Ресурсосбережение. Обращение с отходами. Термины и определения
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ Р ИСО 14001, ГОСТ Р 50779.10, ГОСТ Р 50779.11, ГОСТ Р 51141, ГОСТ Р 51705.1, ГОСТ Р 51897, ГОСТ Р 51901.1, ГОСТ Р 52249, ГОСТ Р 52682, ГОСТ 3.1109, ГОСТ 12.0.002, ГОСТ 16299, ГОСТ 17527, ГОСТ 18322, ГОСТ 30772, [1].
4 Общие положения
4.1 В соответствии с ГОСТ Р 52550 технологический регламент охватывает все аспекты технологического процесса, требования к качеству сырья, внутрипроизводственному контролю, контролю качества, безопасности труда, экологической безопасности, утилизации отходов и пр.*
_______________
* В соответствии с ГОСТ Р 52249 технологический регламент не относится к техническим регламентам, предусмотренным Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании"; данный термин используется только в области производства ЛС.
4.2 Технологический регламент должен быть дополнен и взаимосвязан путем ссылок с другими документами системы организационно-технологической документации на производство данного вида продукции (инструкции, методики, спецификации, операционные процедуры и др.).
4.3 Технологический регламент - основной технологический документ, являющийся частью организационно-распорядительной (ГОСТ Р 51141) и организационно-технологической (ГОСТ Р 52550) систем документации предприятия, а также системы менеджмента качества (ГОСТ Р ИСО 9001), поэтому при его разработке не нарушают соответствие между документами предприятия, разрешительной документацией и регистрационным досье, а также учитывают требования надзорных органов, нормативных и нормативно-правовых документов, действие которых распространяется на производство ЛС.
4.4 Технологический регламент производства ЛС используют в качестве основного технологического документа:
- при проведении технологических процессов в серийном производстве;
- разработке исходных данных для проектирования или реконструкции промышленного производства;
- установлении технико-экономических нормативов, в том числе норм расхода сырья и материалов;
- разработке технологических инструкций, а также инструкций по технике безопасности, производственной санитарии и противопожарным мероприятиям;
- разработке и осуществлении мероприятий по утилизации отходов производства, обезвреживанию и очистке промышленных стоков и выбросов в атмосферу.
4.5 В зависимости от назначения технологические регламенты подразделяют:
- на лабораторные;
- опытно-промышленные;
- пусковые;
- промышленные.
4.6 В соответствии с требованиями ГОСТ Р 52249 технологический регламент разрабатывают и утверждают для каждого вида (формы) ЛС.
Требования одного технологического регламента распространяют на разные дозировки ЛС одного наименования строго определенной лекарственной формы, выпускаемые по одной нормативной документации на однотипном оборудовании. Не допускается составление и утверждение регламентов на группы ЛС даже в производстве с простыми технологическими процессами на однотипном оборудовании.
4.7 Допускается по усмотрению изготовителя разработка самостоятельных (отдельных) регламентов на промежуточные продукты, являющиеся в данном производстве (цехе) конечной продукцией, а также в случае применения одного промежуточного продукта для нескольких производств (например: производство очищенной воды, чистого воздуха, защитной среды для материалов, подвергаемых сублимационной сушке, основы питательной среды и др.).
5 Лабораторный регламент
5.1 Лабораторный регламент является первым нормативным технологическим документом, разработкой которого завершаются научные исследования в лабораторных условиях по созданию нового ЛС (новой технологии).
Лабораторный регламент устанавливает методы изготовления продукции и условия, обеспечивающие воспроизводимость технологических процессов в лабораторных условиях со стабильными выходами, а также правила техники безопасности (ГОСТ Р 52550).
Лабораторный регламент разрабатывают в соответствии с теми же правилами и он содержит те же разделы, что и промышленный регламент (см. раздел 8).
5.2 Описываемые в лабораторном регламенте параметры технологических процессов и операций изготовления нового продукта (новой технологии), а также способы (методы) контроля, мониторинга критических точек, сроки и условия хранения продукта определяют в процессе научно-исследовательской работы на основе спланированных сравнительных, рандомизированных, контролируемых исследований с математической обработкой результатов.
5.3 В лабораторном регламенте совмещают требования надлежащей лабораторной практики (GLP) и надлежащей производственной деятельности (GMP) (ГОСТ Р 52249), поскольку по этому регламенту в лабораторных условиях готовят опытные (экспериментальные) серии препарата, предназначенные для доклинических исследований и клинических испытаний на животных. Препарат, предназначенный для испытаний, должен максимально соответствовать тому ЛС, которое в дальнейшем планируется производить в промышленных (или опытно-промышленных) условиях, поэтому он должен быть изготовлен по требованиям GMP.
5.4 Приложением к лабораторному регламенту является краткое технико-экономическое обоснование (или бизнес-план), примерная структура и содержание которого представлены в приложении А.
6 Опытно-промышленный регламент
6.1 Опытно-промышленный регламент - технологический документ, которым завершают научные исследования при разработке нового ЛС (новой технологии) в лабораторных условиях. Опытно-промышленный регламент, как и промышленный, должен содержать те же разделы, охватывающие все аспекты технологического процесса (см. раздел 8). Основой для разработки опытно-промышленного регламента является лабораторный регламент, а также результаты исследований и разработок, доклинических и клинических испытаний ЛС.
6.2 Опытно-промышленный регламент на новую продукцию (технологию) должен содержать данные на проектирование опытно-промышленной (или промышленной) технологической линии заданной мощности, контрольно-измерительного и испытательного оборудования, используемых в технологическом процессе; технико-экономические показатели для уточнения и дополнения технико-экономического обоснования (бизнес-плана), а также данные токсиколого-гигиенических исследований для обоснования гигиенических нормативов.
6.3 Опытно-промышленный регламент на новую продукцию разрабатывается одновременно с фармакопейной статьей или другим нормативным документом на данное лекарственное средство.
6.4 В случае организации опытного производства (например, на базе предприятия-разработчика) для выпуска небольших партий нового ЛС в течение длительного периода допускается использование опытно-промышленного регламента в качестве основного технологического документа с пересмотром его через каждые три года и утверждением в порядке, установленном для промышленного регламента.
7 Пусковой регламент
7.1 Пусковой (временный) регламент - технологический документ, на основании которого осуществляют освоение промышленного производства вновь созданного ЛС. Пусковой регламент разрабатывается предприятием на основе опытно-промышленного регламента и проектной документации на новое производство или на основе действующих производств, если в их технологию вносятся принципиальные изменения. Пусковой регламент должен полностью соответствовать требованиям, предъявляемым к промышленному регламенту (см. раздел 8).
7.2 По мере освоения производства в пусковой регламент вносят изменения и дополнения. Освоение производства считается законченным, когда достигнуто стабильное выполнение требований нормативной документации на продукцию, а также достигнуты проектные данные как по мощности, так и по основным технико-экономическим показателям производства, после чего взамен пускового регламента оформляют промышленный регламент производства. Дальнейшее серийное производство лекарственного средства осуществляют на основе промышленного регламента.
Срок действия пускового регламента в производстве - не более трех лет.
8 Промышленный регламент
8.1 Серийный выпуск товарной продукции осуществляют на основе промышленного регламента, который оформляют после завершения периода освоения промышленного производства вновь созданного ЛС вместо пускового регламента.
8.2 Согласно требованиям ГОСТ Р 52550 промышленный регламент состоит из следующих разделов:
- характеристика готового продукта;
- технологическая схема производства;
- аппаратурная схема производства и спецификация оборудования;
- характеристика сырья, промежуточных продуктов, исходных и упаковочных материалов (вспомогательных материалов);
- изложение технологического процесса;
- материальный баланс;
- переработка и обезвреживание отходов производства;
- контроль производства;
- безопасная эксплуатация производства;
- охрана окружающей среды;
- перечень производственных инструкций;
- технико-экономические нормативы;
- информационные материалы.
8.3 Характеристика готового продукта
8.3.1 Характеристика готового продукта должна содержать следующую информацию:
- наименование продукта;
- категорию и номер действующего нормативного документа, регистрационный номер;
- сведения об организации (юридическом или физическом лице) - производителе или поставщике;
- основное назначение продукта и его потребительские свойства;
- условия безопасности применения, хранения, транспортирования, утилизации;
- требования к упаковке и маркировке;
- срок годности.
8.3.2 Наименование продукта должно соответствовать нормативному документу, например "Вакцина против рожи свиней из штамма ВР-2".
8.3.3 В описании основного назначения продукта указывают:
- категорию продукта (готовая лекарственная форма и т.п.);
- наименование лекарственной формы (инъекционные растворы, таблетки, аэрозоли, жидкости, эмульсии, взвеси и т.д.), ее дозировку и размер серии, ее качественные характеристики со ссылкой на соответствующий документ (например, фармакопейную статью);
- показания к применению в ветеринарной практике согласно действующей инструкции.
8.3.4 Информацию о безопасности применения, хранения, транспортирования и утилизации составляют на основе государственных нормативных требований по охране труда, технике безопасности, охране окружающей среды, других известных производителю требований и сведений (например [1]), необходимых потребителю для принятия мер по обеспечению безопасности на всем пути от приобретения товара до утилизации и/или ликвидации отходов. При отсутствии или недостаточности нормативных требований в информацию о безопасности включают справочные данные либо данные, полученные на основе испытаний (исследований), при этом ссылка на источник информации данных и сведений обязательна.
Информация о безопасности должна содержать следующие обязательные сведения:
- физические и химические свойства препарата;
- стабильность и химическую (биологическую) активность;
- правила обращения и хранения;
- требования безопасности при транспортировании;
- виды реального и возможного опасного воздействия и условия их возникновения;
- меры первой помощи;
- дополнительную информацию.
8.3.5 Требования к упаковке, маркировке и сроку годности излагают в соответствии с указаниями в нормативной документации.
8.4 Технологическая схема производства
Данный раздел регламента должен состоять из трех подразделов, представляющих:
- общую схему технологического процесса;
- схемы стадий и операций;
- план производственного цеха (участка).
8.4.1 Общая схема технологического процесса
8.4.1.1 Общая схема технологического процесса должна наглядно (графически в виде блок-схемы) отображать последовательность выполнения работ в данном производстве по стадиям и операциям с указанием основных точек поступления сырья и материалов, получения промежуточных продуктов, точек технологического контроля, мест образования отходов, сточных вод, выбросов в атмосферу, систем очистки и утилизации. На схеме рекомендуется выделять критические процессы.
8.4.1.2 Для химико-фармацевтических производств, включающих в технологический процесс химические превращения, дополнительно составляют химическую схему производства, которую излагают в виде блок-схемы основных химических превращений структурными химическими формулами последовательно по ходу технологического процесса. На схеме указывают химические формулы веществ, которые выделяются в процессе производства, а также химические формулы вводимых в реакцию веществ с обозначением особо важных условий проведения химической реакции (катализатора, температуры, давления, рН среды и др.) и выход веществ в процентах от теоретического. Под структурной химической формулой указывают название продукта и его относительную молекулярную массу.
8.4.1.3 Общую технологическую схему производства представляют в виде блок-схемы. Пример изображения общей технологической схемы производства вирусвакцины приведен в приложении Б.
В случае сложности и громоздкости технологического процесса возможно разделение его на технологические этапы и изображение схемы каждого этапа на отдельном листе. На каждом технологическом этапе выделяют свои подготовительные, вспомогательные и другие работы, с обозначением технологического этапа.
Пример
ТЭ1; ТП1.1; ТП1.2; ВР1.1; ВР1.2; ТЭ2; ТП2.1; ТП2.2.
Первая цифра обозначает номер технологического этапа.
В технологической схеме используют следующие обозначения:
"ПР" - подготовительные работы - работы по подготовке оборудования и помещений к проведению технологического процесса;
"ВР" - вспомогательные работы, например приготовление моющих или дезинфицирующих растворов, очищенной воды и др.;
"ТП" - стадии и операции основного технологического процесса;
"ПО" - переработка отходов;
"ОБО" - обезвреживание отходов;
"ОБВ" - обезвреживание технологических и вентиляционных выбросов в атмосферу.
8.4.2 Схемы стадий и операций
Каждая стадия характеризуется наименованием и обозначающим ее индексом, состоящим из условного обозначения и порядкового номера. Нумерацию стадий осуществляют в порядке выполнения по ходу технологического процесса, начиная с поступления и подготовки сырья и кончая отгрузкой готового продукта.
Схемы отдельных стадий технологического процесса и вспомогательных работ изображают в виде блок-схем с указанием материальных потоков, необходимых энергоресурсов и образующихся технологических отходов с указанием направления их дальнейшей переработки. На схеме указывают точки технологического контроля (КТ), имеющие порядковый номер, начиная с единицы. Пример изображения схем отдельной стадии технологического процесса и вспомогательной работы приведен в приложении В.
Технологические операции также изображают в виде блок-схем с указанием принадлежности к определенной стадии.
Пример
Стадия 1, операции 1.1, 1.2,.... 1.5
Вспомогательные работы, которые осуществляют с использованием отдельного оборудования на какой-либо стадии основного технологического процесса, включают в эту стадию основного производства. Если вспомогательные работы осуществляют с использованием отдельного оборудования для нескольких стадий производства (например, приготовление очищенной воды, растворов и т.п. для всего цеха), их выделяют в отдельные стадии вспомогательных работ.
Если переработку отходов или их обезвреживание осуществляют как самостоятельные производственные работы, они могут не включаться в технологическую схему производства. В данном случае на технологической схеме указывают стрелкой, куда поступают отходы - на переработку или обезвреживание.
8.4.3 План производственного цеха (участка)
Планировочные решения помещений и конструкция оборудования должны соответствовать логической последовательности производственных операций и обеспечивать выполнение требований к чистоте. Размещение оборудования и материалов должно быть последовательным и логичным, чтобы сводить к минимуму риск ошибок, предусматривать проведение эффективной уборки и обслуживания с целью предотвращения перекрестного загрязнения, появления пыли и грязи, устранения любого фактора, ухудшающего качество продукции.
Освещение, температурный режим, влажность и вентиляция должны соответствовать назначению помещения и не оказывать влияния на работу оборудования и ЛС во время их изготовления и хранения.
Поэтажный план производственного цеха составляют с указанием всех помещений (в том числе чистых), с условным обозначением технологического оборудования и рабочих площадей помещений.
Категории производства обозначают по классам чистоты и по пожарной опасности. Класс чистоты воздуха определяют и согласовывают заранее (ГОСТ ИСО 14644-1).
Детальный поэтажный план производственного цеха представляют в приложении к регламенту, а в тексте регламента допускаются ссылки на спецификации помещений и оборудования, которые также представляют в соответствующем приложении.
8.5 Аппаратурная схема производства и спецификация оборудования
8.5.1 Этот раздел регламента состоит из чертежа аппаратурной схемы производства и спецификации оборудования, закрепленного за данным конкретным производством. Содержание раздела должно давать полное представление об основном и вспомогательном технологическом оборудовании, которое может оказывать существенное влияние на качество продукта. В связи с этим характеристика оборудования должна содержать информацию о материале рабочей зоны оборудования, контактирующей с продуктом в процессе работы, и средствах измерения (датчиках), поверхности которых непосредственно контактируют с продуктом.
8.5.2 Чертеж аппаратурной схемы должен четко показывать все технологическое оборудование, включая вспомогательное (хранилища-сборники, мерники, массообменные, теплообменные и улавливающие аппараты, аварийные емкости, канализационные приемники-отстойники, насосы, компрессоры, специальные транспортные приспособления, подводка энергоносителей и др.).
На чертеже аппаратурной схемы изображают материальные трубопроводы и направление движения по ним сырья, промежуточных продуктов и отходов, а также другие виды трубопроводов, аппаратуру и предохранительные устройства, которые имеют существенное значение для правильного и безопасного ведения технологического процесса. Изменения, вносимые в схему этих трубопроводов, оформляют как изменения регламента. Остальные виды трубопроводов на чертеже схемы не приводят. Места подачи в аппараты пара, охлаждающей воды, сжатого воздуха, азота и т.п. обозначают условными знаками. Аппаратурные схемы вычерчивают для каждой стадии производства раздельно в соответствии с технологической схемой производства.
Оборудование, используемое в нескольких производствах предприятия, в аппаратурной схеме не приводят (например, складские емкости цеха или завода, централизованные станции для получения инертного газа, водорода, кислорода, очищенной воды и т.д.).
8.5.2.1 Оборудование и приборы изображают и нумеруют на схеме в строгой последовательности по ходу технологического процесса с указанием точек технологического контроля (КТ). Условное обозначение оборудования выполняют по государственным стандартам Единой системы конструкторской документации (ЕСКД) (таблица 1).
Таблица 1 - Обозначение оборудования на аппаратурной схеме
Оборудование | Обозначения |
Средства измерения | СИ |
Системы регулирования | СР |
Реакторы, автоклавы, ферментеры и т.п. | Р |
Фильтровальная аппаратура | Ф |
Сушильные установки | СУ |
Оборудование для размола и измельчения | М |
Емкости (сборники, отстойники) | Е |
Компрессоры | К |
Насосы | Н |
Холодильные установки | X |
Оборудование для фасовки и упаковывания | У |
Термостаты | Т |
Центрифуги | Ц |
В случае отсутствия стандартного условного графического обозначения какого-либо оборудования используют произвольное обозначение, по возможности, с отражением конструктивных особенностей изделия в контурном изображении вертикальной плоскости. При наличии в технологическом процессе оборудования, не включенного в приведенный список обозначений, в тексте регламента дают буквенное обозначение этого оборудования и используют его в аппаратурной схеме.
Каждая единица оборудования должна иметь наименование и индивидуальный номер, что важно для обеспечения прослеживаемости производства каждой серии продукции.
8.5.2.2 Обозначения основных величин и условные изображения приборов выполняют в соответствии с действующей документацией. Шифр средств измерений, относящихся к основному оборудованию, складывается из шифра и номера оборудования, где контролируется параметр; порядкового номера датчика на данном оборудовании; буквы, определяющей последовательность расположения блоков схемы.
Пример
Р-11.2 б.
8.5.2.3 Системы регулирования (СР), средства измерения (СИ), контролирующие качественные и количественные показатели в конце стадии технологического процесса, относят к основному оборудованию и шифруют следующим образом: буквенное обозначение, дефис, порядковый номер по схеме, точка, порядковый номер датчика в данной схеме, прописная буква, определяющая последовательность расположения блоков схемы.
8.5.2.4 На аппаратах и трубопроводах указывают все контрольно-измерительные и регулирующие приборы, а также устройства отбора проб для анализов.
8.5.3 Спецификацию оборудования представляют по форме таблицы 2.
Таблица 2 - Спецификация оборудования и средств измерения
Шифр согласно схеме процесса | Наименование оборудования и средств измерения | Количество единиц | Техническая характеристика с указанием материалов рабочей зоны | Аппараты, подлежащие государственному техническому надзору, регистрационный номер |
1 | 2 | 3 | 4 | 5 |
В графе 1 приводят шифр оборудования по 8.5.2.1-8.5.2.3. Средства измерений записывают после оборудования, на котором они установлены или для обслуживания которого они предназначены. Если в производстве установлены специальные комплексные установки, их наименование приводят в графе 2 с последующим перечислением основного оборудования, входящего в установку.
В графе 4 указывают:
- для стандартного оборудования - номер стандарта, чип, марку и шифр;
- для нестандартного оборудования - код чертежа, наименование организации, разработавшей оборудование;
- для импортного оборудования - марку, наименование фирмы и страну происхождения.
Далее в графе 4 приводят краткую техническую характеристику оборудования и средств измерений. Однотипные средства измерений (манометр, рН-метр и др.) описывают подробно к первому аппарату (например, реактору, ферментеру и т.п.). При описании одинаковых средств измерений к следующим по схеме аппаратам дают ссылку на шифр первоначально описанного средства измерения.
Для отдельных групп оборудования и средств измерения в графе 4 приводят следующие данные:
- для автоклавов, реакторов, выпарных аппаратов (Р) - вид реактора, рабочее давление, вместимость;
- для аппаратов непрерывного действия - производительность, способ нагрева или охлаждения с указанием площади поверхности теплообмена или способа измерения температуры, вид и частота вращения мешалки, приспособления для загрузки, выгрузки, осмотра, габаритные размеры;
- для хранилищ, сборников и мерников - вместимость (л, м), способ загрузки (залив, заполнение под вакуумом и т.п.), способ передачи продуктов в другой аппарат (самотек, перекачивание насосом и т.п.); для сосудов, работающих под давлением, указывают рабочее давление;
- для фильтровальной аппаратуры (Ф) - конструкция фильтра, фильтрующий материал, величина фильтрующей поверхности (м);
- для сушильных установок (СУ) - вид конструкции, способ нагрева, мощность калорифера, теплоноситель и величина поверхности нагрева, производительность (в час или за цикл), способ загрузки и выгрузки, габаритные размеры;
- для оборудования для размола и размельчения (М) - конструкция, производительность, способ загрузки и выгрузки, габаритные размеры;
- для вспомогательного стандартного оборудования, компрессоров (К), насосов (Н), холодильных установок (X) - завод-изготовитель, тип, производительность;
- для оборудования, применяемого для фасовки и упаковывания продукции, - завод-изготовитель, тип, марка, производительность;
- для средств измерений (СИ), систем регулирования (СР) - тип, предел измерений, класс точности исполнения прибора и его работы.
В спецификацию оборудования (таблица 2) в конце включают спецификацию на стеклянные емкости.
Если в технологическом процессе используют специально смонтированную стеклянную посуду, то дают описание (в графе 5 таблицы 2) монтажа (сифонные трубки, пробки и т.д.). Чертежи монтажа прилагают к аппаратурной схеме.
8.6 Характеристика сырья, промежуточных продуктов, исходных и упаковочных материалов (вспомогательных материалов)
8.6.1 Этот раздел регламента должен содержать данные, устанавливающие требования к качеству сырья, материалов и промежуточных продуктов в данном производстве.
Согласно ГОСТ Р 52249 требования к исходным материалам предварительно должны быть четко определены в документально оформленных спецификациях. В регламенте ссылки на спецификации обязательны.
8.6.2 В регламенте характеристику сырья и материалов представляют в виде данных по форме таблицы 3.
Таблица 3 - Сырье и материалы, применяемые в производстве
Наименование сырья и материалов | Обозначение НД | Показатели, обязательные для проверки | Назначение | |
Наименование | Норма в пределах | |||
1 | 2 | 3 | 4 | 5 |
Наименования сырья и материалов (графа 1) приводят в алфавитном порядке с подразделением на основные и вспомогательные. В группу основных включают все виды сырья и промежуточных продуктов, получаемые извне для данного производства, в том числе из других цехов предприятия, и воду для технологических нужд.
В группу вспомогательных включают сырье, материалы и комплектующие изделия, применяемые в технологическом процессе как вспомогательные (фильтры, упаковка, моющие и дезинфицирующие растворы, используемые при санитарной обработке персонала, помещений и оборудования и т.п.).
В графу 3 включают перечень основных показателей качества, которые независимо от наличия данных поставщика подлежат проверке перед использованием в производстве. Значения показателей, включаемые в таблицу, приводят с допустимыми отклонениями (графа 4). Для субстанций и вспомогательных материалов, входящих в состав лекарственных форм, обязательными для проверки показателями являются контаминация посторонней микрофлорой, содержание механических включений, апирогенность (для субстанций, используемых в производстве инъекционных растворов).
В графе 5 указывают, для производства каких промежуточных продуктов используется данный вид сырья.
8.6.3 Перечень промежуточных продуктов, получаемых в производстве, приводят по форме таблицы 4.
Таблица 4 - Промежуточные продукты, получаемые в производстве
Наименование промежуточного продукта | Обозначение НД* | Нормативные требования | Стадия, операция | |
где производится | где используется | |||
1 | 2 | 3 | 4 | 5 |
* Качество используемых промежуточных продуктов, получаемых в производстве, регламентируют спецификациями или стандартами предприятия. | ||||
8.6.4 При производстве иммунобиологических ЛС в данном разделе регламента приводят подробное описание производственных штаммов микроорганизмов:
- его наименование и обозначение;
- место получения;
- сведения об истории выделения;
- метод аттенуации;
- биологические свойства - иммуногенность, патогенность, токсичность;
- полную характеристику морфологических, культуральных и других свойств;
- условия размножения и приготовления посевного материала;
- условия и сроки хранения, транспортирования и методы консервирования.
Количество генераций (пассажей) между посевным материалом и готовой продукцией должно соответствовать требованиям нормативной документации.
8.6.5 Характеристику применяемых в производстве животных-продуцентов и лабораторных животных приводят по форме таблицы 5.
Таблица 5 - Характеристика животных, применяемых в данном производстве в качестве продуцентов и для контроля качества продукции
Вид животных | Порода, линия, генотип | Пол | Возраст (дней, месяцев, лет) | Вес (живая масса) | Статус | Примечание |
1 | 2 | 3 | 4 | 5 | 6 | 7 |
В графе 1 указывают видовую принадлежность животных в соответствии с систематикой и таксономией животного мира. Название вида дают на русском и латинском языках.
В графе 2 указывают породу животных, например лошади, крупный рогатый скот.
Для характеристики традиционных видов лабораторных животных (мыши, крысы, морские свинки, хомяки, кролики) указывают генотип используемых животных, затем дают общепринятое наименование линии с использованием букв латинского алфавита.
В графе 6 приводят требования, касающиеся клинического состояния животных и их микробиологического статуса, степени свободы животных от патогенной и условно патогенной микрофлоры (бактерий, вирусов, микоплазм, возбудителей паразитарных заболеваний).
В графе 7 указывают наименование питомника или хозяйства - источника поступления животных, в том числе SPF-животных*.
_______________
* SPF-животные - животные, у которых отсутствуют эндопаразиты, патогенные и условно патогенные бактерии и вирусы, использующиеся для производства и контроля иммунобиологических препаратов. Содержание таких животных требует соблюдения особого санитарно-гигиенического режима.
8.7 Изложение технологического процесса
8.7.1 Технологический процесс излагают последовательно по стадиям и операциям в точном соответствии с технологической и аппаратурной схемами производства. В начале изложения технологического процесса для каждой стадии (в том числе и для ВР) приводят сведения о видах и количестве используемых и получаемых в производстве сырья, материалов, промежуточных продуктов, об отходах, допустимых потерях и выходе готового продукта. В заключительной части описания каждой стадии производства указывают возможные отклонения от технологического процесса, приводящие к браку или возникновению аварийных ситуаций, а также меры их предупреждения.
Описание технологических работ содержит следующую информацию:
- санитарную подготовку персонала, помещений и оборудования;
- осмотр и подготовку оборудования к работе;
- подготовку и загрузку сырья;
- ведение и контроль технологических работ;
- выгрузку и передачу на дальнейшую обработку продуктов (промежуточных продуктов, отходов);
- упаковку, маркировку и отгрузку готовой продукции.
Полнота описания технологического процесса должна быть подкреплена ссылками на другие документы (инструкции, методики, специальные операционные процедуры и т.д.), наиболее важные из которых целесообразно представить в приложениях к регламенту.
8.7.2 Санитарная подготовка персонала, помещений и оборудования
8.7.2.1 К производству ЛС, особенно стерильных иммунобиологических препаратов, предъявляют специфические требования для минимизации риска загрязнения продукта микроорганизмами, механическими частицами и химическими веществами (пирогенами). Эти требования касаются как персонала, так и организации процесса производства, в том числе эксплуатации производственных помещений и оборудования.
В технологическом регламенте применительно к производству конкретного продукта излагают способы и периодичность проведения микробиологического мониторинга персонала (руки персонала и технологическая одежда), помещений (стены, потолок, полы, двери, воздух), оборудования (рабочие поверхности, приборы для тестирования и др.), воды, сжатого воздуха и т.п.
8.7.2.2 Для выполнения технологических работ необходим персонал определенной численности и квалификации. Кроме квалификационных требований разрабатывают правила личной гигиены персонала с учетом особенностей конкретного производства. Устанавливают персональную ответственность сотрудников за точное выполнение требований инструкций, правил поведения, личной гигиены, процедур по поддержанию чистоты, обращению с технологической одеждой, входа и выхода в производственные и другие помещения, пределы необходимости передвижения персонала по предприятию. В чистые помещения, склады, зоны карантинного хранения и другие помещения допускают только лиц, работающих в них или выполняющих контрольные и обслуживающие функции. Мониторинг персонала осуществляют в соответствии с утвержденной программой, прилагаемой к регламенту.
8.7.2.3 Подготовка помещений к работе должна представлять собой комплекс мероприятий в соответствии с инструкцией, состоящий из влажной уборки и дезинфекции стен, полов и различных поверхностей, направленный на достижение соответствующего класса чистоты (ссылка на инструкцию).
В данном разделе регламента формулируют основную цель, для достижения которой необходимо чистое помещение, приводят перечень технологических операций, выполняемых в чистых помещениях (например, наполнение стерильных продуктов, асептическая сборка компонентов и др.).
В целях обнаружения тенденций в изменении параметров чистого помещения задают требования к чистым помещениям и разрабатывают инструкцию по проведению контроля чистых помещений во время эксплуатации с указанием периодичности контроля, методов контроля, плана действий в случае несоответствия требованиям, порядка и периодичности сбора, анализа и хранения данных. Для разработки такой инструкции, прилагаемой к технологическому регламенту производства стерильных ЛС, целесообразно ориентироваться на требования и рекомендации стандартов ГОСТ Р ИСО 14644-2, ГОСТ Р ИСО 14644-3, ГОСТ Р ИСО 14644-4 и ГОСТ Р ИСО 14644-5.
8.7.2.4 Мойку и стерилизацию съемных частей, а также обработку внутренних и наружных поверхностей оборудования моющими и дезинфицирующими средствами, разрешенными к применению, проводят до и после проведения технологического процесса. Операции по очистке оборудования выполняют в соответствии с подробными письменными инструкциями. Инвентарь и материалы для очистки не должны быть источниками загрязнения. Средства и методы мойки, дезинфекции и стерилизации должны быть протестированы и валидированы.
8.7.3 Осмотр и подготовка оборудования к работе
При изложении порядка осмотра оборудования перед загрузкой выделяют наиболее важные требования: чистота и влажность аппарата, герметичность, стерильность и другие показатели, указывая способы их проверки.
Неисправное оборудование изымают из зоны производства и контроля качества или обозначают соответствующим образом. Если в процессе подготовки оборудования необходимо осуществлять специальные работы в соответствии с планом предупредительного ремонта, то такие работы оговаривают заранее и проводят в соответствии с документированными процедурами выполнения этих работ (ГОСТ 15.601, ГОСТ 28.001, ГОСТ 20831).
8.7.4 Подготовка и загрузка сырья
В этом подразделе регламента излагают порядок и методы цехового контроля полученного сырья (или промежуточных продуктов) на соответствие требованиям действующей нормативной документации (ссылки на описанные процедуры).
При изложении порядка загрузки сырья (промежуточных продуктов) указывают количество, способы и условия загрузки (из мерника, через люк аппарата, заполнение под вакуумом, время загрузки, интервал температур, при перемешивании или при выключенной мешалке и т.п.). Оборудование указывают с обозначением его номера по аппаратурной схеме и кода (см. таблицу 2).
В тех случаях, когда загрузку отдельных видов сырья (промежуточных продуктов) в аппарат осуществляют не сразу, а порционно в процессе выполнения технологической операции, изложение должно точно воспроизводить порядок работы.
8.7.5 Ведение и контроль технологических работ
8.7.5.1 При изложении порядка и условий ведения технологических работ описывают ход их проведения от начального до конечного момента выполнения каждого элемента операции, последовательность перехода и связь между ними. При этом указывают основные параметры (величину температуры нагрева или охлаждения, интервал температур выдержки, рН среды и регулирование этого показателя, оптимально допустимое рабочее давление и т.д.).
Окончание элемента операции фиксируют определенным показателем, например температурой, содержанием определенного вещества в маточном растворе, концентрацией микроорганизмов и т.д. В определенных случаях, при невозможности установить показатель окончания процесса, указывают продолжительность проведения такого элемента в заданных условиях. В тех случаях, когда выполнение технологических работ осуществляют с соблюдением особых условий в организации производства, эти условия, способы и технические средства их обеспечения излагают при описании технологического процесса на стадии. Например, допустимые пределы относительной влажности воздуха производственных помещений при работе с особо гигроскопическими веществами; допустимый предел температуры воздуха при работе с термолабильными веществами (микроорганизмами); особые требования к обеспечению пожароопасности (работа с ацетоном, эфиром, спиртом и др.); требования полной асептичности при производстве стерильных препаратов и т.п.
Контроль проводят в лабораториях, которые должны быть отделены от производственных помещений, что особенно важно при контроле биологических и микробиологических препаратов.
8.7.5.2 Внутрипроизводственный (технологический) контроль описывают одновременно с описанием работ по операциям. При этом указывают количество контрольных точек и перечень контролируемых показателей, затем подробно описывают каждую контрольную точку. Описание (паспорт) включает в себя:
- место контрольной точки (КТ) - шифр стадии или операции технологического процесса;
- наименование объекта контроля;
- наименование определяемых параметров и их регламентированные нормативы;
- порядок отбора проб (ГОСТ Р 52684);
- методы контроля;
- указание, кто проводит контроль и с какой периодичностью;
- указание, кто и в каком документе регистрирует результаты контроля;
- меры, принимаемые при отклонении результатов контроля от допустимых значений.
Все операции по внутрипроизводственному контролю, в том числе операции, выполняемые лицами, непосредственно работающими в производственных зонах, проводят в соответствии с методиками, утвержденными отделом контроля качества. Аналитические методики должны быть аттестованы (валидированы), за исключением методов, установленных нормативными документами. Результаты контроля оформляют в виде протокола с указанием:
- наименования материала или продукции;
- номера серии и наименования производителя и/или поставщика;
- ссылок на соответствующие спецификации и методики испытаний;
- результатов испытаний со ссылками на протоколы всех анализов;
- даты проведения испытаний;
- фамилий и инициалов лиц, проводящих испытания;
- однозначного заключения о разрешении к использованию или отклонении продукции (или другого решения о статусе продукта, например, о соответствии требованиям действующей нормативной документации), даты и подписи ответственного лица.
Целесообразно разработать стандартную форму протокола или сделать ссылку на документированную процедуру службы обеспечения качества по составлению протокола.
Результаты анализов в контрольных точках используют для оценки стабильности технологических процессов статистическими методами и для коррекции параметров технологического процесса по ГОСТ Р 50779.11, ГОСТ 50779.42 и [2].
Анализ рисков в критических контрольных точках (ГОСТ Р 51705.1, ГОСТ Р 51901.1, ГОСТ Р 52537) позволяет выявить узкие места в производстве и ненадежные элементы в оборудовании.
8.7.6 Выгрузка и передача на дальнейшую обработку продуктов (промежуточных продуктов, отходов)
При изложении порядка выгрузки продуктов (промежуточных продуктов, отходов) и передачи их на дальнейшую обработку описывают способы выгрузки продуктов (промежуточных продуктов, отходов) с указанием освобождаемого аппарата и аппарата, в который эти продукты передаются, объем (массу) и краткую характеристику свойств передаваемых продуктов (например, рН среды, массовую долю воды, особые свойства, которые учитывают в процессе выгрузки и транспортирования, в том числе наличие неприятного запаха или веществ с вредным воздействием на обслуживающий персонал и т.д.), а также дают рекомендации по материалу промежуточной тары (если продукт передается не в аппарат, а в промежуточную тару), указывают условия и сроки хранения в таре.
8.7.7 Упаковка, маркировка и отгрузка готовой продукции
8.7.7.1 Это завершающая стадия технологического процесса, которая состоит из двух операций: упаковка готовой продукции в потребительскую тару и ее маркировка и упаковка в групповую и транспортную тару. Особенности выполнения этой стадии технологического процесса в производстве ЛС предусмотрены в ГОСТ Р 52683. Для каждого вида продукции, размера и вида упаковки разрабатывают и утверждают подробные инструкции по упаковке. Очистку и подготовку к работе линии упаковки продукции также выполняют по специальным инструкциям.
8.7.7.2 В данном разделе регламента описывают технологию упаковки и маркировки со всеми основными и вспомогательными операциями, а также используемым оборудованием. Приводят перечень всех упаковочных материалов, необходимых для серии конкретной продукции, в том числе количество, размер и тип упаковочного материала с указанием кода или номера в соответствии со спецификацией. Также указывают специальные меры предосторожности, в том числе проверку оборудования и зоны упаковки, гарантирующие чистоту упаковочной линии перед началом и во время работы, подробно описывают проведение и результаты внутрипроизводственного контроля с указанием порядка отбора проб и допустимых пределов значений контролируемых параметров. Контроль процесса упаковки должен включать в себя проверку общего вида упаковки, соответствия упаковочного материала упаковываемой продукции, правильности маркировки, правильности работы устройств контроля на линии упаковки и т.д.
8.7.7.3 На предприятии разрабатывают документированную систему внутрипроизводственного этикетирования для маркировки исходных материалов и готовой продукции, оборудования, помещений и зон, технологической одежды и т.д. В тексте регламента должны быть ссылки на эти документы.
До начала процесса фасовки и упаковки в протоколе на серию продукции указывают количество полученной нерасфасованной продукции и материалы, необходимые для ее упаковки, с указанием номера серии и документа, подтверждающего их качество. Маркировка упаковочных материалов разрешенными способами должна быть отчетливой и устойчивой к внешним воздействиям. Правильность выполнения любых печатных операций (например, нанесения кодов или срока годности) при упаковке и после нее тщательно контролируют и оформляют документально. После завершения процесса упаковки подводят баланс между количеством нерасфасованной продукции, упаковочных материалов и полученной готовой продукции. Выполнение каждой операции должно сопровождаться подписью исполнителя.
8.7.7.4 При описании отгрузки готовой продукции на склад указывают вид внутризаводского транспорта, условия погрузки и выгрузки, порядок передачи и сдачи продукции с указанием сопроводительной документации, условия временного хранения продукции до отгрузки потребителю.
8.7.8 Ведение протокола на серию готовой продукции
8.7.8.1 При разработке технологической документации (регламента в том числе) предусматривают порядок регистрации хода выполнения технологического процесса и получаемых результатов, заверенных подписями ответственных лиц. Выполнение каждой операции оформляют документально таким образом, чтобы можно было проследить весь ход производства и контроля качества ЛС. Согласно требованиям ГОСТ Р 52249 на каждую серию продукции составляют протокол (протокол на серию продукции).
8.7.8.2 Перед началом любого технологического процесса проверяют и оформляют протокол о том, что рабочее место и оборудование находятся в чистом состоянии, не содержат остатков предыдущего продукта, документации и материалов, не относящихся к данному процессу, и готовы к использованию. Такие протоколы должны входить в состав протокола на серию продукции.
8.7.8.3 Содержание полного (сводного) протокола на производство серии продукции должно соответствовать требованиям ГОСТ Р 52249 (подраздел 4.17). Протокол на упаковку серии продукции составляют по требованиям ГОСТ Р 52249 (подраздел 4.18). Все данные, внесенные в состав протоколов, оформляют документально одновременно с выполнением соответствующей операции.
8.7.8.4 Составленные и проверенные ответственным лицом протокол на производство серии и протокол на упаковку серии, подписанные и утвержденные в установленном на предприятии порядке, входят в состав протокола на серию продукции.
8.7.8.5 Технологическим документом, предваряющим протокол на серию продукции, может быть маршрутная карта производства серии продукции. Маршрутная карта, которую заполняет непосредственно исполнитель конкретных процедур, представляет собой совокупность протоколов всех процедур и операций технологического процесса производства данной серии ЛС*. Дополненная документами о результатах контроля конечного продукта и о разрешении на его реализацию маршрутная карта служит протоколом на серию продукции. Регламент должен содержать методики составления и заполнения маршрутной карты и протокола на серию продукции.
_______________
* Маршрутная карта может содержать информацию о финансовых затратах на ведение технологического процесса, в таком случае она станет полезным документом при рассмотрении технологического процесса с точки зрения бизнес-процесса (ГОСТ Р ИСО 9001).
8.7.8.6 На предприятии разрабатывают формы документов с изготовлением бланков для внесения данных (записей) при выполнении технологических операций. Примеры протоколов производства серии продукции, подготовленных в форме отдельных бланков, приведены в ГОСТ Р 52550 (приложении G).
8.8 Материальный баланс
Данный раздел регламента должен содержать полную информацию о теоретическом значении выхода продукции на каждой стадии производства с указанием максимального и минимального показателей выхода, при превышении которых требуется проведение расследования в соответствии с порядком, установленным на предприятии.
Пределы приемлемости от 95% до 105% номинального количества для действующих веществ и пределы от 90% до 110% номинального количества для вспомогательных веществ не требуют дополнительного обоснования (ГОСТ Р 52550, приложение Д).
Допускаются более широкие пределы приемлемости, которые должны быть обоснованы доказательством, что серии с составом, близким к значениям предлагаемых нижних и верхних пределов приемлемости, продолжают соответствовать спецификациям на готовую продукцию. Если количество действующего вещества рассчитывается из действительного количественного содержания в данной серии ("факторизация"), то это должно быть указано.
Материальный баланс составляют на единицу выпускаемой продукции (на см, кг, т, 1000 доз и т.п.) или на один производственный цикл и представляют по форме таблицы 6 для каждой стадии отдельно (что предпочтительнее) или для всего технологического процесса в целом.
Таблица 6 - Материальный баланс
|
| Загружено |
|
| Получено | ||||
Шифр стадии | Наиме- | на одну серию готового препарата или один производ- | на условную единицу (1000 см | Коли- | Наиме- | на одну серию готового препарата или один производ- | на условную единицу (1000 см | Выход, % | Потери, % |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
При составлении таблицы возможны варианты по использованию систем измерений, введению дополнительных граф и др.
Материальный баланс для новых производств составляют по данным проекта, для действующих - по данным регламента, полученным по результатам испытаний установочных серий препарата. Пересматривается порядок составления материального баланса только в случае изменений технологического процесса, влияющих на расход сырья, выход продукта и количество отходов.
8.9 Переработка и обезвреживание отходов производства
8.9.1 В данном разделе регламента описывают технологические процессы переработки отходов (ПО), обезвреживания отходов (ОБО) и технологических (вентиляционных) выбросов в атмосферу (ОБВ). Нумерацию стадий и операций осуществляют по 8.4.2. Методы (способы) обработки отходов на стадиях ПО, ОБО и ОБВ излагают в соответствии с требованиями к описанию новых технологических процессов и в соответствии с аппаратурной схемой.
В том случае, когда в технологическом процессе нет отходов, в соответствующем разделе регламента указывают "отходов нет". Если в технологическом процессе отходы по каким-либо причинам не обезвреживаются или не используются (перерабатываются) при их наличии, то в тексте регламента это должно быть указано.
8.9.2 В подразделе регламента, описывающем стадию ПО, данные представляют по форме таблицы 7 с перечнем и краткой характеристикой отходов.
Таблица 7 - Перечень и характеристика отходов, перерабатываемых на стадиях производства
| Количество отхода | Характеристика отхода |
| ||||
Наименование отхода и место его образования (шифр стадии и код оборудования по схеме) | Наименование, шифр и код по схеме оборудования, в котором собирают отход до переработки | от одной техноло- | в пересчете на единицу готового препарата | Агрегатное состояние, плотность или удельный объем | Содержание ценных веществ в отходе | Наименование и шифр стадии, на которой перераба- тывается отход | |
до обработки | после обработки | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
В графе 3 таблицы 7 указывают количество отхода от одной технологической операции в случае периодического процесса или в единицу времени при непрерывном процессе. В таблице 7 приводят данные только о тех отходах, которые перерабатываются на отдельных стадиях того производства, на которое составлен данный регламент. В эту таблицу включают также данные о газообразных отходах, подвергаемых рекуперации в данном производстве.
8.9.3 Перед описанием процессов обезвреживания отходов (стадии ОБО) приводят перечень и краткую характеристику этих отходов по форме таблицы 8.
Таблица 8 - Перечень и характеристика отходов, обезвреживаемых на стадиях производства
| Количество отхода | Характеристика отхода |
| ||||||
Наименование отхода и место его образования, шифр стадии и код оборудования по схеме | Наименование, код и номер по схеме оборудования, на котором отбирают отход | от одной техноло- | в пересчете на единицу конечного продукта | Агрегатное состояние, плотность или удельный объем, кг/м | Наиме- | Содержание вредных веществ в отходе | Наиме- | ||
кг/сут | м | до обез- | после обе- | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
В таблице 8 приводят данные только о тех отходах, обезвреживание которых осуществляют в процессе того производства, на которое составлен регламент. В графе 7 приводят наименования тех вредных веществ, содержащихся в отходах, обезвреживание которых осуществляют в данном технологическом процессе.
Например, в биотехнологическом производстве жидкие или твердые отходы, такие как дебрис, после отбора материала из яиц; одноразовые бутыли для культур, нежелательные культуры или биологические агенты; трупы животных, использованных для приготовления или контроля препаратов, которые целесообразно стерилизовать или дезинфицировать перед удалением их из изолированной зоны.
8.9.4 Если отходы перерабатываются или обезвреживаются централизованно на специальных установках предприятия совместно с отходами других технологических процессов, сведения о таких отходах приводят конкретно на каждый вид отхода по форме таблицы 9.
Таблица 9 - Перечень и характеристика отходов производства, перерабатываемых (обезвреживаемых) централизованно
|
|
|
| Нормативные требования к чистоте отхода | Фактическая чистота отхода | ||||
Наименование отхода и место его образования (номер стадии и обору- | Шифр и наименование стадии, шифр и код обору- | Агре- | Коли- | Куда отправ- | Наиме- | Норматив | Макси- | Средне- | |
Макси- | Средне- | ||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
В графах 6-8 указывают наименование вредных компонентов, содержащихся в отходах, обезвреживание которых осуществляют в данном процессе. Также указывают способ доставки отходов к установкам централизованной переработки или обезвреживания, например использование герметичных контейнеров или трубопроводов.
В сопроводительной документации на отходы производства, предназначенные для централизованной переработки (или обезвреживания) на предприятии, а также поставляемые на рынок или на другие предприятия для переработки, указывают требования для обеспечения безопасности при транспортировании, применении, хранении, утилизации, удалении (ликвидации) веществ (материалов).
8.9.5 Перед описанием процессов обезвреживания технологических и вентиляционных выбросов (стадии ОБВ) приводят их перечень и краткую характеристику на каждый вид выброса по форме таблицы 10.
Таблица 10 - Перечень и характеристика обезвреживаемых и очищенных технологических и вентиляционных выбросов
| Количество выброса | Характеристика выброса | |||||||
Наименование выброса и место его образования (номер стадии и обору- | Наименование выброса: перио- | от одной техноло- | в пересчете на единицу конечного продукта, кг (м | наиме- | содержание вредных веществ в выбросе мг/м | ПДК (ОБУВ) загрязняющих веществ в атмосферном воздухе населенных мест, мг/м | Наименование и номер стадии, на которой обезвреживается выброс, или наименование и номер венти- | ||
кг, кг/сут | м | до обезвре- | после обезвре- | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
В таблице 10 приводят данные о выбросах, которые обезвреживают (очищают) в производстве с использованием специальных установок и оборудования.
8.9.6 Формы таблиц 7-10 могут быть модифицированы с учетом особенностей конкретного технологического процесса и удобства представления информации об отходах производства.
8.9.7 В конце настоящего раздела регламента приводят сводную таблицу (или протокол) данных об отходах производства. Перечень отходов приводят постадийно, последовательно по ходу технологического процесса (вспомогательные работы, основные процессы, переработка и обезвреживание отходов) по двум группам:
А - отходы, которые передают для переработки или обезвреживания в централизованном порядке на специальных установках.
Б - отходы, которые вывозят за пределы производства для уничтожения.
В сводной таблице приводят наименование веществ и компонентов, определяющих вредность отхода для окружающей среды, предельно допустимое количество (ПДК):
- вредных веществ, ПДК которых в воде водоемов установлены [3]-[5];
- возбудителей заболеваний животных и человека;
- веществ, оказывающих вредные и неприятные воздействия на органы чувств (специфический запах и т.п.).
В сводную таблицу также включают данные о биологической и химической потребности в кислороде (БПК, ХПК), рН среды и др.
Сводную таблицу (или протокол) заполняют с учетом требований к протоколам данного производства и специальных инструкций, определяющих порядок сбора, вывоза и уничтожения вредных отходов.
8.10 Контроль производства
8.10.1 В настоящем разделе регламента приводят перечень точек производства, контроль которых обеспечивает надежное соблюдение установленного режима технологического процесса. В понятие контрольной точки включают место (шифр стадии или операции технологического процесса), объект контроля, наименование определяемого параметра и его норматив, методы и средства контроля. Контрольные точки описывают в предыдущих разделах регламента (см. 8.4, 8.5 и 8.7). В перечень контрольных точек включают только такие точки, которые необходимы для обеспечения правильного и безопасного ведения технологического процесса и изменение показателей которых оформляют как изменение технологического регламента.
Примеры обязательных для контроля точек:
- требования к оборудованию и помещениям при их подготовке к работе (стерильность, герметичность, целостность антикоррозионного покрытия и др.);
- контроль сырья и материалов перед использованием в процессе производства;
- контроль основных параметров и требований при загрузке сырья и проведении отдельных технологических операций;
- контроль качества полученных промежуточных продуктов;
- контроль показателей, регламентирующих сброс промышленных стоков и т.д.
8.10.2 Перечень и характеристики КТ представляют по форме таблицы 11.
Таблица 11 - Перечень и характеристики точек контроля производства
Шифр стадии и обору- | Наиме- | Шифр по схеме и наиме- нование средства измерения | Наиме- | Регламен- | Метод и перио- | Должностное лицо или организация, осуществ- | Документ, в котором регистрируют результаты контроля |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
В графе 1 для каждой стадии производства приводят шифр (обозначение, номер или код), затем шифр или код оборудования согласно аппаратурной схеме, под каждым обозначением оборудования - наименование соответствующих точек контроля.
Объектами контроля (графа 2) являются: помещения, оборудование, сырье, материалы, промежуточные продукты, конечный продукт, технологические операции и их отдельные элементы, отходы и т.д.
В графе 3 приводят шифр по схеме и наименование средства измерения. Если контроль проб анализируемого объекта осуществляют физико-химическими или микробиологическими методами, то в графе 4 указывают вид анализа с указанием в графе 2 места отбора проб.
В графе 4 приводят наименование контролируемого параметра; если контроль осуществляют согласно действующей нормативной документации (НД) в полном объеме, то в графе 4 указывают только название и шифр (код) НД; в таком случае в графе 5 также приводят ссылку на документ без изложения нормативов; если контроль проводят по отдельным показателям НД, то в графе 4 наряду со ссылкой на документ приводят наименование этих показателей, а в графе 5 - нормативы.
В графе 6 дают ссылку на метод определения: визуально, по специальной методике, согласно НД. Нестандартные методики нумеруют по порядку и приводят в этом разделе после таблицы. В графе 7 указывают также порядок отбора пробы: от каждой технологической операции или от нескольких при периодических процессах, через какой промежуток времени - при периодических процессах, через какой промежуток времени - при непрерывных процессах.
В графе 7 указывают должностное лицо или организацию, осуществляющую контроль: оператор, лаборатория, отдел биологического контроля (ОБК) и т.д. В случае отбора проб указывают, кто должен отбирать пробу.
Документами, в которых регистрируются результаты контроля (графа 8), являются: производственные протоколы со ссылками на все первичные документы (например, операционный лист, заполненный оператором; ленты самописца с контрольных регистрирующих аппаратов; рабочий журнал цеховой лаборатории или другие документы; перечень таких документов должен быть приведен в регламенте) и документы выпуска.
Протоколы должны постоянно и четко отражать все стадии производства. В них должны быть описаны все испытания, независимо от полученных результатов. Протоколы должны храниться на протяжении всего периода годности, указанного для серии или партии препарата, и в течение всего времени быть доступными для проверки контрольным органом.
8.10.3 При автоматизированном управлении процессом в таблице 11 приводят:
- в графе 1 - перечень технологического оборудования;
- графе 2 - наименование процесса;
- графе 3 - перечень контрольно-регулирующих устройств;
- графах 4 и 5 - показатели, подтверждающие правильность хода процесса.
8.10.4 Порядок и методики контроля готового препарата излагают в нормативной документации на продукцию.
8.10.5 Порядок проверки правильности осуществления контроля за ходом технологического процесса регламентируют организационно-распорядительными документами, приведенными в 8.13.
8.10.6 Результаты контроля служат подтверждением того, что технологический процесс организован правильно, а конечный продукт производства содержит активные ингредиенты, по качественному и количественному составу соответствующие регистрационному досье, имеет требуемую чистоту, правильно упакован и маркирован.
8.10.7 Технологический регламент содержит (в качестве самостоятельного приложения) программу последующих испытаний стабильности реализованного готового лекарственного средства. Целями этой программы являются контроль самого продукта в течение его срока годности и установление того, что продукт соответствует (или не соответствует) спецификации при условиях хранения, указанных в маркировке. Число серий, периодичность испытаний, форму отчета о работе по программе последующих испытаний стабильности определяет производитель с учетом требований ГОСТ Р 52249 (подразделы 6.23-6.33).
Результаты испытаний должны находиться на месте производства и обеспечивать достаточный объем данных для проведения анализа тенденций изменений качества ЛС в процессе хранения. Необходимо анализировать случаи выхода за пределы спецификации, существенные необычные (в том числе негативные) тенденции и доводить до сведения надзорных органов.
8.11 Безопасная эксплуатация производства
8.11.1 Раздел о безопасной эксплуатации производства является обязательным для технологических регламентов, как действующих, так и проектируемых, расширяемых и реконструируемых производств. Этот раздел регламента подлежит согласованию со службой охраны труда и техники безопасности предприятия. Для вновь создаваемых и реконструируемых производств раздел должен быть согласован с организацией - разработчиком проекта и соответствовать требованиям действующих нормативных документов.
Основополагающими документами для разработки данного раздела стандарта являются стандарты, входящие в систему стандартов безопасности труда (ССБТ), ГОСТ 3.1120, ГОСТ Р 51898, а также [6]-[7].
Требования ССБТ, распространяющиеся на производство ЛС, учитывают при разработке технологического регламента. Кроме того, особое внимание обращают на соблюдение санитарно-противоэпидемического и ветеринарно-санитарного режимов, производственной санитарии и биологической безопасности.
8.11.2 Согласно требованиям ГОСТ 12.1.008 безопасность труда при работе с биологическими объектами, представляющими производственную опасность, обеспечивают:
- производственные процессы;
- производственное оборудование;
- средства защиты;
- система специальных профилактических мероприятий.
8.11.2.1 Производственные процессы должны:
- соответствовать требованиям ГОСТ 12.3.002, ГОСТ Р 51901.1 и ГОСТ Р 52249;
- допускать возможность обеззараживания или обезвреживания территории, помещений, оборудования, транспортных средств, одежды и средств защиты применительно к специфике работы с данным биологическим объектом;
- допускать возможность контроля за условиями труда и соблюдением гигиенических требований;
- исключать неблагоприятное воздействие методов работы с биологическими объектами на персонал;
- исключать возникновение пожаров и взрывоопасных условий при выделении продуктов жизнедеятельности и распада биологических объектов;
- исключать возможность загрязнения внешней среды.
8.11.2.2 Производственное оборудование должно:
- соответствовать требованиям ГОСТ 12.2.003;
- соответствовать психофизиологическим, санитарно-гигиеническим и эргономическим требованиям;
- обеспечивать возможность контроля за проведением измерений конкретных параметров биологической опасности в целях сопоставления их с соответствующими предельно допустимыми величинами;
- допускать возможность контроля за физиологическим состоянием и поведением биологического объекта;
- допускать возможность обеззараживания и обезвреживания.
8.11.2.3 Средства защиты должны соответствовать требованиям ГОСТ 12.4.011.
8.11.2.4 Система специальных профилактических мероприятий должна:
- обеспечивать возможность создания у персонала с патогенными микроорганизмами специфического активного или пассивного иммунитета;
- обеспечивать нормирование продолжительности труда во вредных условиях;
- обеспечивать возможность повышения сопротивляемости организма (профилактическое питание).
8.11.3 Согласно [7] в данном разделе регламента должны быть приведены технологические данные, необходимые для разработки и осуществления мер по обеспечению безопасности и оптимальных санитарно-гигиенических условий труда персонала, в том числе характеристика опасностей производства, возможные способы их предупреждения и локализации, защита технологических процессов и оборудования от аварий и персонала от травмирования, а также меры безопасности, которые следует соблюдать при эксплуатации производственных объектов.
8.11.4 Характеристика опасностей производства должна содержать основные сведения о пожароопасных свойствах сырья, полупродуктов, готовой продукции и отходов производства (по форме таблицы 12), а также о пожарной опасности производственных помещений и наружных установок (по форме таблицы 13). При заполнении таблиц 12 и 13 ссылки на справочные и нормативные документы обязательны.
Таблица 12 - Перечень и характеристика взрыво- и пожароопасных веществ (материалов)
Наиме- | Агре- гатное состо- яние (при нормаль- ных условиях) | Удель- ный вес для твердых и жидких веществ, г/дм | Плотность паров (газа) по воздуху (для жид- костей и горючих газов), г/дм | Раство- | Возможность воспла- менения или взрыва вещества при воздействии на него | Температура, 0 °С | Пределы взрываемости, % к объему воздуха (для горючих газов) и пыли, образующих с воздухом взрывоопасную смесь | При- меча- | ||||
воды (да, нет) | кисло- | само- | вос- пла- | вспышки паров горючих жидкостей и газов | ниж- | верх- | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
Таблица 13 - Категории производств по пожарной опасности, классы производственных помещений и наружных установок, категории и группы взрывоопасных смесей по ПУЭ
|
| Классификация производств | Классификация по ПУЭ | ||||||||
N по плану и наименование производ- | N по плану и наименование производств, располо- | Кате- | Вещества, определяющие категорию производства | Сред- ства пожа- | Класс поме- | Вещества, определяющие класс помещения и наружных установок | Кате- | Вещества, определяющие категорию и группу взрывоопасных смесей | |||
Наиме- | N п/п табл. | Наиме- | N п/п табл. | Наиме- | N п/п табл. | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
8.11.5 Степень пожарной и взрывоопасности производственных помещений, оборудования, технологических процессов, веществ и материалов определяют по ГОСТ 12.1.004, ГОСТ 12.1.044, ГОСТ 12.2.003 и ГОСТ Р 12.3.047.
8.11.6 В данном разделе также описывают основные опасности производства, обусловленные: использованием вредных веществ (ГОСТ 12.1.007), особенностями технологического процесса или выполнения отдельных производственных операций (ГОСТ Р 52249); особенностями используемого оборудования и условиями его эксплуатации (ГОСТ Р 12.1.019, ГОСТ 12.2.003); нарушениями правил безопасности работающими.
8.11.7 В производстве ЛС могут использоваться опасные токсичные материалы, а также микроорганизмы различной степени патогенности и опасности для человека, животных и окружающей среды. Все используемые и образующиеся в производстве микроорганизмы и вещества оценивают с точки зрения опасности вредного воздействия их на персонал производства при попадании в рабочую зону производственных помещений и опасности загрязнения ими внешней среды при технологических выбросах. Перечень и характеристики вредных веществ и микроорганизмов, для которых утверждены ПДК или ориентировочно безопасные уровни воздействия (ОБУВ), приводят по форме таблицы 14.
Таблица 14 - Перечень и характеристики вредных веществ и микроорганизмов
Наименование вещества и в какой форме оно попадает в окружающую среду (газ, пар, пыль, аэрозоль) | ПДК или ОБУВ в рабочей зоне | Для микроорганизмов - патогенность | ПДК в атмосфере | Документ или источник информации | |
Максимально разовая | Среднесуточная | ||||
1 | 2 | 3 | 4 | 5 | 6 |
При использовании в производстве патогенных для человека и животных микроорганизмов руководствуются действующими инструкциями органов исполнительной власти в области здравоохранения, сельского хозяйства, санитарно-эпидемиологического надзора.
8.11.8 Опасные места производства, на которых в случае нарушения установленных режимов и правил работы могут произойти аварии, несчастные случаи, возникнуть профессиональные заболевания, перечисляют по форме таблицы 15.
Таблица 15 - Перечень опасных мест производства
Наименование опасных мест производства (помещений, оборудования, установок, процессов) | В чем заключается опасность | Меры по обеспечению безопасности и нормальных условий труда |
1 | 2 | 3 |
К опасным местам производства относят возможные пути выделения микроорганизмов из оборудования в окружающую среду, например валы перемешивающих устройств биореактора, инокуляция среды, взятие проб, отходящие газы, аварии (утечки из оборудования, нарушение герметизации, проливание инфицированного материала и т.д.).
В случае если в производстве не образуются и не используются вредные вещества и микроорганизмы или нет опасных мест производства, то в таблицах 14 и 15 указывают "Вредные вещества и микроорганизмы в производстве не используются и не образуются", "Опасных мест в производстве нет".
8.11.9 Сведения о возможных неполадках и аварийных ситуациях, которые могут возникнуть при несоблюдении требований ведения технологического процесса, выполнении производственных операций, эксплуатации оборудования и коммуникаций, которые могут стать причиной пожара, взрыва, травмирования или отравления работающих, загрязнения окружающей среды, приводят по форме таблицы 16.
Таблица 16 - Возможные неполадки, аварийные ситуации, способы их предупреждения и устранения
Возможные производственные неполадки, аварийные ситуации | Предельно допустимые значения параметров, превышение (снижение) которых может привести к аварии | Причины возникновения производственных неполадок, аварийных ситуаций | Способы устранения |
1 | 2 | 3 | 4 |
Кроме того, таблица должна содержать информацию о приборах контроля, регулирования защиты, при отказе работы которых необходима аварийная остановка или перевод на другой режим (циркуляцию, ручное управление и др.). К основным возможным аварийным состояниям производства относят: отключение электроэнергии, топлива, газа, пара, воды, воздуха, прорывы газов, легковоспламеняющихся жидкостей, материалов, содержащих опасные микроорганизмы и др.
8.11.10 Сведения об устройствах для защиты технологических процессов и оборудования от аварий и травмирования работающих [блокировках, средствах регулирования, сигнализации, устройствах для экстренной (аварийной) остановки оборудования, предохранительных, сбросных, отсекающих клапанах] с обязательным указанием их функционального назначения и производимых действий приводят по форме таблицы 17.
Таблица 17 - Защита технологических процессов и оборудования от аварий
Наименование оборудования, стадий технологического процесса | Категория взрывоопасности технологического блока | Контролируемый параметр или наименование защищаемого участка (места) оборудования | Допустимый предел контролируемого параметра или опасность защищаемого участка (места) оборудования | Предусмотренная защита оборудования, стадии технологического процесса |
1 | 2 | 3 | 4 | 5 |
Данная часть раздела регламента содержит информацию о требованиях безопасности при пуске и остановке технологических систем и отдельных видов оборудования, выводе их в резерв, нахождении в резерве и при вводе из резерва в работу.
Разрабатывают и документально оформляют основные правила:
- плановой остановки производства;
- аварийной остановки производства, его отдельных стадий и аппаратов;
- пуска оборудования в эксплуатацию после остановок на ремонт (для вновь вводимых производств также правила первого пуска).
8.11.11 При описании безопасной эксплуатации производства излагают меры безопасности при ведении технологического процесса, выполнении регламентных производственных операций.
Технологический принцип биологической безопасности производства заключается в минимизации или предотвращении возможности выделения микроорганизмов или продуктов их метаболизма в производственную среду.
Общие правила безопасности при работе с микроорганизмами потенциального риска детально описывают в технологических инструкциях и в документах системы управления охраной труда на предприятии.
Правила работы с конкретными биологическими объектами в конкретном производстве и меры по предотвращению потенциальной биологической опасности разрабатывают и детально излагают в технологической инструкции, давая ссылку в регламенте.
8.11.12 Регламент должен содержать разработанные производителем требования безопасности при складировании и хранении сырья, промежуточных продуктов и готовой продукции, обращении с ними, а также при перевозке и применении готовой продукции.
Требования безопасности разрабатывают:
- на фармацевтические и биологические субстанции;
- промежуточные продукты, являющиеся в данном производстве конечной продукцией;
- готовые лекарственные формы;
- отходы производства, поставляемые на рынок или на другие предприятия для переработки.
8.11.13 Информацию о средствах индивидуальной защиты персонала по ГОСТ 12.4.011 приводят по форме таблицы 18.
Таблица 18 - Перечень и характеристика средств индивидуальной защиты работающих
Наименование стадий технологического процесса | Профессии персонала на стадии | Средства индивидуальной защиты персонала | Наименование и номер нормативной документации | Срок носкости | Периодичность стирки, чистки защитных средств | Примечание |
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Описывают способы обезвреживания и нейтрализации продуктов производства при розливах и авариях, которые состоят в том, что случайные проливы жидкостей, особенно содержащих живые микроорганизмы, быстро и безопасным способом ликвидируют. Для каждого типа микроорганизмов следует иметь аттестованные (валидированные) методики деконтаминации.
8.11.14 Санитарную характеристику производственных процессов в целях определения состава специальных бытовых помещений и устройств приводят по форме таблицы 19.
Таблица 19 - Санитарная характеристика производственных процессов
Наименование производственных процессов и помещений | Производственные факторы, определяющие санитарную характеристику процесса | Другие вредные факторы производственного процесса | Определение состава специальных бытовых помещений и устройств* |
1 | 2 | 3 | 4 |
* Определение состава специальных бытовых помещений и устройств проводят в соответствии с требованиями [8]. | |||
8.12 Охрана окружающей среды
8.12.1 В данном разделе регламента приводят перечень всех выбросов в окружающую среду: пылегазообразных, жидких, твердых. Указывают их наименование, источник выброса (аппарат, стадия), количество с допустимыми отклонениями, периодичность, продолжительность, а также химический состав и физические показатели по возможности (ГОСТ 17.2.3.02, ГОСТ Р ИСО 14041).
В регламенте указывают, что система вентиляции и очистки воздуха (ГОСТ 12.4.021) гарантирует защиту от выбросов инфекционного материала и вредных веществ в окружающую среду (ГОСТ 12.1.005). Также отражают меры, обеспечивающие надежность охраны водных ресурсов и воздушного бассейна в случае аварийных ситуаций и остановок производства на ремонт. Указывают наличие аварийных и дренажных емкостей, поддонов, факелов, адсорбентов, дезинфицирующих растворов и т.п. для предупреждения залповых выбросов в окружающую среду.
Систематизированные данные по выбросам в атмосферу, сточным водам и твердым отходам, по влиянию конечного продукта производства на окружающую среду представляют в виде таблиц.
8.12.2 Сведения обо всех постоянных и периодических технологических, вентиляционных и неорганизованных выбросах в атмосферу через трубы и вентиляционные шахты приводят по форме таблицы 20.
Таблица 20 - Выбросы в атмосферу
Источники выброса и параметры газовоздушной смеси | Требования к выбросу | |||||||||||
Наимено- | Наиме- | Количество выброса на единицу продукции (кг на кг; | Перио- | Коли- | Высо- | Диа- | Объем, | Тем- | Наиме- | Еди- | Нор- | Факти- |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
8.12.3 Данные обо всех технологических стоках, стоках от промывки оборудования и смыва полов приводят по форме таблицы 21.
Таблица 21 - Сточные воды
Наименование стока, отделения, аппарат | Место сброса | Количество стоков, м | Периодичность сброса | Характеристика сброса | Примечание | |
Состав сброса, мг/дм | Допустимое кол-во сбрасываемых вредных веществ, кг/сут | |||||
1 | 2 | 3 | 4 | 5 | 6 | 7 |
8.12.4 Данные о твердых и жидких отходах приводят по форме таблицы 22.
Таблица 22 - Твердые и жидкие отходы
Наименование отделения, аппарат | Место складирования, транспорт, тара | Количество отходов, кг | Периодичность сброса | Характеристика сброса | Примечание | |
Химический состав, влажность | Физические показатели | |||||
1 | 2 | 3 | 4 | 5 | 6 | 7 |
В графе 7 излагают условия захоронения токсических отходов, если они не обезвреживаются в технологическом процессе.
8.12.5 Норму выброса для действующих производств устанавливают на основании достигнутых показателей работы производства. Для вновь пускаемых производств нормой выброса является его проектное количество.
8.12.6 Обобщенные данные о влиянии производственного процесса изготовления и готового ЛС на окружающую среду приводят по форме таблицы 23.
Таблица 23 - Влияние производственного процесса изготовления ЛС на окружающую среду
Производственный процесс | Использование природных ресурсов | Загрязнение воды | Загрязнение воздуха | Загрязнение и разрушение почвы | Отходы (характер отходов) | Шумы и другое вредное влияние* |
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Производство | ||||||
Распространение | ||||||
Потребление | ||||||
Уничтожение (в том числе повторная переработка) | ||||||
* Имеются в виду запах, нарушение эстетики природной среды и населенных пунктов. | ||||||
Контроль состава и количество промышленных стоков, пылегазообразных выбросов производства предусматривают для всех процессов.
8.13 Перечень производственных инструкций
8.13.1 В данном разделе регламента указывают обозначения (коды) и названия инструкций, наличие которых и следование которым является обязательным для ведения технологического процесса, в том числе инструкции:
- по всем рабочим местам в соответствии со штатным расписанием (должностные);
- технике безопасности, производственной санитарии, ветеринарно-санитарному режиму и пожарной безопасности;
- подготовке оборудования к работе, к ремонту и приему из ремонта;
- эксплуатации оборудования, средств измерений и средств автоматизации;
- ликвидации аварийных ситуаций;
- предупреждению контаминации сырья и готовой продукции при хранении и в производстве;
- фасовке и упаковке;
- уходу и содержанию животных-продуцентов и животных, используемых для контроля.
8.13.2 Технологические инструкции, разрабатываемые на каждое рабочее место (отдельную установку, участок производства) согласно требованиям ГОСТ Р 52249, содержат:
- общие положения;
- данные о месте нахождения производства и основном оборудовании;
- подробное описание всех работ на данном рабочем месте в соответствии с регламентом, в том числе по подготовке оборудования к работе, контролю материалов, предварительной обработке, приготовлению рабочих растворов и питательных сред, последовательности операций, внутрипроизводственному контролю, а также описание порядка содержания и эксплуатации используемых в производстве животных и т.д.;
- информацию об опасных местах в производстве и основные требования безопасности и производственной санитарии для данного рабочего места;
- перечень первичной документации и указания о порядке ее заполнения в процессе выполнения работ на данном рабочем месте;
- подчиненность и взаимосвязь со смежными рабочими местами;
- порядок приема и сдачи смены;
- обязанности, права и ответственность.
Примечание - В технологической инструкции вместо полного описания всех процедур и контроля, выполняемого в процессе подготовки производства, допускается приводить ссылки на соответствующие инструкции (методики), если они разработаны, утверждены в установленном на предприятии порядке и имеются в наличии.
8.13.3 Инструкции по фасовке и упаковке должны соответствовать технологическому регламенту и содержать следующие сведения:
- наименование ЛС; описание его лекарственной формы и содержание действующего вещества;
- количество ЛС в упаковке, выраженное в штуках, единицах массы или объема либо других единицах измерения с указанием, при необходимости, допустимых отклонений;
- полный перечень всех упаковочных материалов, требуемых для серии определенного размера, в том числе количество, размеры и типы материалов с указанием кода на каждый упаковочный материал согласно спецификациям;
- при необходимости образец или копию соответствующих маркированных упаковочных материалов с наличием свободного места для отметки номера серии и срока годности продукции;
- особые меры предосторожности, в том числе указание о тщательной проверке зоны оборудования с целью подтверждения ее очистки перед началом работы;
- описание процесса фасовки и упаковки, в том числе основных и вспомогательных операций и используемого оборудования;
- подробное описание технологического контроля со ссылками на методику отбора проб (образцов) и допустимыми предельными значениями контролируемых параметров.
8.13.4 Инструкции по технике безопасности, производственной санитарии и пожарной безопасности должны отражать правила безопасной эксплуатации оборудования и установок, наиболее опасные места производства и сведения о действиях работающих в случае возникновения аварии, правила и приемы безопасной работы при проведении технологического процесса, правила пользования средствами индивидуальной защиты и правила оказания первой помощи пострадавшим.
8.13.5 Инструкции по эксплуатации оборудования и средств измерений должны предусматривать меры, обеспечивающие их надежную работу, а также качественный и своевременный анализ получаемых результатов.
8.13.6 Инструкции по предупреждению микробной загрязненности должны содержать требования к личной гигиене персонала, порядок контроля обсемененности рук и технологической одежды, порядок подготовки помещений и т.д.
8.13.7 Инструкции по содержанию и уходу за животными-продуцентами и лабораторными животными должны содержать следующую основную информацию:
- порядок ведения записей о дате поступления животных, их происхождении, возрасте, генетическом и микробиологическом статусе и других характеристиках;
- порядок организации и проведения карантина для вновь поступивших животных или в случае, если они фактически или предположительно больны или являются разносчиками заболевания;
- порядок контроля и регистрации данных о состоянии здоровья животных, их поведении, обследовании, а также диагностировании и лечении при необходимости;
- требования к чистоте помещений, клеток, кормушек, резервуаров, емкостей и другого вспомогательного оборудования;
- требования к условиям хранения пищевых продуктов и подстилкам для животных, обеспечивающим защиту от неблагоприятного воздействия окружающей среды, заражения паразитами и загрязнения;
- требования к наличию и использованию приспособлений для уборки отходов из вивария и побочных продуктов с соблюдением мер предосторожности, сводящих к минимуму заражение паразитами, распространение резких запахов, риск заболеваний и загрязнение окружающей среды.
8.13.8 Производственные инструкции разрабатываются и пересматриваются предприятием, а также утверждаются одновременно с утверждением технологического регламента руководителем организации - разработчика регламента; изменения к технологическим регламентам должны вноситься и в производственные инструкции.
8.13.9 В перечень инструкций должны включаться также инструкции, обеспечивающие процесс производства и контроля качества продукции документами, требуемыми ГОСТ Р 52249, не упомянутые в настоящем разделе.
8.14 Технико-экономические нормативы
8.14.1 В настоящем разделе приводят нормативы затрат, характеризующие технический уровень производства и ведения технологического процесса по требованиям регламента, в том числе:
- нормы расхода основных видов сырья и материалов;
- нормы технологических энергозатрат (пара, воды, электроэнергии, сжатого воздуха, инертного газа и др.);
- трудозатраты на единицу конечного продукта.
Нормативные показатели рассчитывают по данным технико-экономического обоснования (или бизнес-плана), который является обязательным приложением к опытно-промышленному регламенту и уточняется при разработке промышленного регламента. Окончательные величины нормативных показателей определяют на основании фактических данных, получаемых в процессе изготовления и контроля установочных серий нового (осваиваемого) лекарственного средства, или лекарственного средства, изготавливаемого по новой (осваиваемой) технологии.
8.14.2 Нормы расхода основных видов сырья и материалов приводят по форме таблицы 24.
Таблица 24 - Нормы расхода сырья и материалов на единицу конечного продукта
Наименование сырья и материалов, N НТД | Нормы расхода | |||
Регламентные | Допустимые отклонения | |||
на одну серию препарата | на единицу выпускаемой продукции (1000 доз; 100 г и т.д.) | на одну серию препарата | на единицу выпускаемой продукции (1000 доз; 100 г и т.д.) | |
1 | 2 | 3 | 4 | 5 |
8.14.3 Нормы расхода пара, воды, сжатого воздуха, инертного газа, электроэнергии и другие виды энергетических затрат приводят в виде таблицы 25.
Таблица 25 - Нормы расхода пара, воды, сжатого воздуха, инертного газа, электроэнергии и другие виды энергетических затрат
Наименование затрат | Краткая характеристика | Нормы расхода | |
на одну серию | на условную единицу продукции (1000 доз, 100 дм | ||
1 | 2 | 3 | 4 |
В графе 2 дают краткую характеристику вида энергетических затрат, например: пар - давление (до 1 МПа), вода - артезианская (с температурой 8 °С - 10 °С) и т.д.
8.14.4 Показатели трудовых затрат в человеко-часах (человеко-днях) приводят в целом на производство конечного продукта по данному регламенту с подразделением на основные и вспомогательные работы в соответствии с проектными данными и на основе достигнутых показателей.
Трудозатраты на единицу продукции , чел.ч/кг (1 серию; 1000 доз; 100 л и т.п.) рассчитывают по формуле
![]() , (1)
, (1)
где - число основных рабочих, чел.;
- время отработки одним рабочим, чел.ч;
- выработка продукции, кг.
8.14.5 В промышленном регламенте приводят также другие показатели и нормативы, определяющие технический уровень и эффективность производства, как, например, съем продукции с единицы производственной площади или с единицы стоимости основных фондов и другие показатели.
8.15 Информационные материалы
В раздел включают справочный материал, характеризующий обоснованность методов и технологических решений, ссылки на научные отчеты и литературные источники, где содержатся данные, которые были или могут быть использованы при модернизации и расширении производства, а также при проектировании и определении технического уровня производства и выпускаемой продукции.
В разделе приводят:
- сведения о разработчиках препарата и регламентов его производства с указанием даты разработки;
- сведения со ссылками на экспериментальные работы предприятий и организаций, подтверждающие правильность выбора оптимальных параметров технологических процессов;
- источники, содержащие сведения о вредности применяемых в производстве веществ и мерах предосторожности при работе с ними;
- сведения о патентной чистоте продукции и принятого метода его получения с перечислением охраняющих патентов;
- сведения о показателях качества зарубежных аналогов подобной продукции, обладающих сходством по функциональному значению и условиям применения;
- перечень литературных источников и отчетов о научно-исследовательских, опытно-конструкторских и проектных работ, на которые делаются ссылки в тексте регламента, для рукописей указывают места их хранения.
9 Оформление регламента
9.1 Содержание регламента и оформление его текста должны соответствовать требованиям ГОСТ 2.105, ГОСТ 2.106 и настоящего стандарта.
9.2 Текст регламента печатают с одной стороны листа (формат А4 по ГОСТ 2.301) с использованием компьютерной или другой техники. Схемы оформляют на листах (формат А4 - А1).
9.3 Текст регламента разделяют на разделы, подразделы и пункты. Разделы и подразделы должны иметь порядковые номера в пределах всего документа, обозначенные арабскими цифрами без точки и записанные с абзацного отступа.
Подразделы должны иметь нумерацию в пределах каждого раздела. Номер подраздела состоит из номеров раздела и подраздела, разделенных точкой. В конце номера подраздела точка не ставится.
Пункты нумеруются, если необходимо, но заголовков не имеют.
9.4 Каждый раздел регламента рекомендуется начинать с нового листа (страницы) и формировать в виде отдельного файла для обеспечения возможности изъятия раздела (или его части), содержащего описание технологического ноу-хау данного производства. Каждый лист (страница) регламента должен быть пронумерован (нумерация сквозная) и иметь колонтитул (верхний, нижний или верхний и нижний) по форме и по содержанию принятым на данном предприятии.
9.5 Текст регламента должен быть кратким, четким и не допускать различных толкований. Не допускается применять для одного и того же понятия различные научно-технические термины, близкие по смыслу (синонимы), а также иностранные слова и термины при наличии равнозначных слов и терминов в русском языке.
9.6 В регламенте применяют стандартизированные единицы физических величин, их наименование и обозначения в соответствии с ГОСТ 8.417. Применение в одном документе разных систем обозначения физических величин не допускается.
9.7 Порядок изложения формул, математических уравнений и таблиц должен соответствовать требованиям ГОСТ 2.105.
9.8 Примечания приводят, если необходимы пояснения или справочные данные к содержанию текста, таблиц или графического материала. Примечания не должны содержать требований. Порядок изложения примечаний - по ГОСТ 2.105.
9.9 Материал, дополняющий текст регламента, помещают в приложениях. Приложениями могут быть, например, графический материал (подробные технологические схемы, планировки помещений и т.п.), таблицы большого формата, расчеты, описания аппаратуры, приборов, методик, специальных операционных процедур, спецификаций и др.
Приложение оформляют как продолжение регламента на последующих его листах. Приложения могут быть обязательными и информационными. Информационные приложения могут быть рекомендуемого или справочного характера.
Приложение "Библиография" располагают последним. Оформление приложения "Библиография" и ссылок на источники информации в тексте регламента должно соответствовать требованиям ГОСТ Р 7.0.5.
9.10 Первым листом регламента является титульный лист, который оформляют в соответствии с образцами, представленными в приложении Г (форма 1 - образец оформления титульного листа лабораторного регламента, форма 2 - опытно-промышленного, форма 3 - пускового, форма 4 - промышленного).
Подписи руководителей проектных организаций на титульных листах регламентов размещают только при участии проектной организации в разработке данного производства (при создании нового или реконструкции существующего производства).
9.11 За титульным листом регламента следует лист с заглавием "Содержание регламента", составленный по требованиям ГОСТ 2.105.
9.12 Последний лист технологических регламентов подписывают основные разработчики документа с указанием наименования подразделения предприятия (организации) и занимаемой должности.
9.12.1 Последний лист лабораторного регламента подписывают:
- начальник отдела (лаборатории), разработавшего регламент;
- научный руководитель темы (разработчик);
- непосредственные разработчики регламента;
- руководитель службы охраны труда и производственной санитарии;
- главный метролог;
- руководитель службы стандартизации и обеспечения качества разрабатываемой продукции;
- руководитель финансово-экономического подразделения.
9.12.2 Последний лист опытно-промышленного регламента подписывают от организации-разработчика:
а) заместитель руководителя организации по научной работе;
б) научный руководитель темы (разработчик);
в) начальник отдела (лаборатории), разработавшего регламент;
г) непосредственные разработчики регламента;
д) руководитель службы стандартизации и обеспечения качества продукции;
е) руководитель службы охраны труда, производственной санитарии и охраны окружающей среды;
ж) главный метролог;
и) от предприятия - изготовителя опытных серий продукции:
1) руководитель производства;
2) главный инженер;
3) начальник цеха;
4) начальник отдела биологического и технического контроля;
5) начальник отдела контрольно-измерительных приборов и автоматизации и/или главный метролог;
6) руководитель службы обеспечения качества и технологического контроля;
7) руководитель службы охраны труда, промышленной санитарии и охраны окружающей среды;
8) руководитель финансово-экономического подразделения.
9.12.3 Последние листы пускового и промышленного регламентов подписывают:
- руководитель производства;
- главный инженер;
- начальник цеха;
- непосредственные разработчики регламента;
- начальник отдела биологического и технического контроля;
- начальник отдела контрольно-измерительных приборов и автоматизации и/или главный метролог;
- руководитель службы обеспечения качества и технологического контроля;
- руководитель службы охраны труда, производственной санитарии и охраны окружающей среды;
- руководитель финансово-экономической службы.
10 Порядок разработки и утверждения регламентов
10.1 Технологические регламенты на новую продукцию* разрабатывают научно-исследовательские организации и предприятия (научно-производственные, производственные и другие различных форм собственности), имеющие опыт работы по разработке ЛС для ветеринарии и документы, подтверждающие их авторские права.
_______________
* Под новой продукцией понимаются препараты, ранее не производившиеся в стране, или новые разработки, не имеющие аналогов.
10.2 Лабораторный и опытно-промышленный регламенты на новую продукцию разрабатывает организация - автор ЛС одновременно с фармакопейной статьей, стандартом предприятия или другим нормативным документом, содержащим требования к качеству выпускаемой продукции. Лабораторный и опытно-промышленный регламенты - обязательная часть документации научно-технической разработки.
10.3 На предприятии (в организации), разрабатывающем и утверждающем технологические регламенты, должна быть создана компетентная технологическая (методическая) комиссия, в обязанности которой входит рассмотрение проектов технологических регламентов (других технологических документов) и принятие решений о возможности их утверждения. Разрабатывают Положение о технологической (методической) комиссии и назначают ее председателя.
Председателем комиссии назначают, как правило, одного из заместителей руководителя предприятия. Чаще всего - это руководитель производства или службы обеспечения и контроля качества продукции. Членами комиссии должны быть специалисты уровня руководителей (или их первых заместителей) основных подразделений предприятия. Это те работники предприятия, которые несут ответственность за нормальное безаварийное функционирование производства и выпуск продукции, отвечающей нормативным требованиям, при условиях рационального использования материальных, трудовых, энергетических и других ресурсов, правильной эксплуатации и сохранности оборудования, исключения возможности загрязнения окружающей среды и обеспечения безопасного ведения технологического процесса.
10.4 Протокол рассмотрения проекта регламента на заседании технологической (методической) комиссии является приложением к технологическому регламенту любого уровня (лабораторному, опытно-промышленному, пусковому, промышленному).
10.5 Лабораторный регламент утверждает руководитель организации - разработчика новой продукции по рекомендации председателя технологической (методической) комиссии после рассмотрения проекта регламента на заседании комиссии и принятия решения о возможности его утверждения (см. форму 1 приложения Г).
10.6 Опытно-промышленный регламент утверждает руководитель организации - разработчика новой продукции или технологического процесса также по рекомендации председателя технологической (методической) комиссии после рассмотрения и одобрения проекта регламента технологической (методической) комиссией (см. форму 2 приложения Г).
Если отработка технологического процесса осуществлялась на опытно-промышленной установке промышленного предприятия, на котором планируется серийное производство новой продукции, опытно-промышленный регламент должен иметь двойное утверждение организации-разработчика и предприятия-изготовителя. С проектной организацией опытно-промышленный регламент согласовывают только в том случае, если проектная организация использует его в качестве исходных данных для проектирования.
10.7 Пусковой и промышленный регламенты утверждает руководитель промышленного предприятия, на котором осваивается серийный выпуск новой продукции. Утверждению регламента предшествует рассмотрение его проекта технологической (методической) комиссией предприятия, а также согласование этого проекта с организацией - разработчиком осваиваемой продукции (технологии) и проектной организацией (см. формы 3 и 4 приложения Г).
10.8 К проекту промышленного регламента на впервые осваиваемую предприятием продукцию (технологию), направляемому на согласование, прилагается протокол приемочных испытаний промышленного производства продукции, составленный на основании результатов изготовления и испытания установочных серий продукта, а также валидационных испытаний в соответствии с ГОСТ Р 52249.
10.9 Срок действия промышленного регламента не ограничивают, но подтверждают его действие через каждые пять лет.
10.10 Изменения в регламент организация-разработчик вносит на основании результатов проведенных научно-исследовательских и экспериментальных работ по совершенствованию технологии или данных производственной работы, а также при получении сведений об изменении приведенных в регламенте нормативных показателей, утвержденных соответствующими нормативными актами (правила и нормы пожарной безопасности, техники безопасности, промышленной санитарии, технико-экономические нормативы и т.п.).
10.11 Изменения к регламенту оформляют в виде "Ведомости изменений к регламенту" (приложение Д) в сопровождении пояснительной записки по ГОСТ 2.106 и технико-экономического обоснования необходимости внесения изменений, а также документов, подтверждающих целесообразность изменений (например, акты испытаний, протоколы и др.).
10.12 При внесении существенных изменений в регламент следует проводить валидацию критических стадий (операций) процесса производства с целью подтверждения, что данный процесс, используемый материал и оборудование позволяют постоянно производить продукцию требуемого качества.
10.13 Согласование и утверждение изменений технологических регламентов проводят в том же порядке, что и для самих регламентов.
10.14 Ответственность за содержание, своевременное внесение изменений и пересмотр регламентов несет руководитель предприятия, утвердивший регламент.
Приложение А
(справочное)
Примерные структура и содержание краткого технико-экономического обоснования (или бизнес-плана), прилагаемого к лабораторному и опытно-промышленному регламентам
Краткое (предварительное) технико-экономическое обоснование (или бизнес-план) отличается от полного степенью детализации информации и содержит следующие разделы (общий объем документа - не более 20 страниц).
1 Общие положения
В данном разделе приводят обоснование необходимости проекта разработки и внедрения нового ЛС, его цель и главные задачи (1-2 стр.).
2 Рынок
Раздел содержит следующую информацию (2-3 стр.):
- окружающая (эпизоотическая) обстановка;
- оценка емкости рынка, платежеспособности потребителя и спроса;
- основные конкуренты и их технологии;
- торговые организации, цены;
- оценки предполагаемого объема продаж (пессимистическая, оптимистическая, наиболее вероятная);
- оценка маржинальной рентабельности (доля маржинальной прибыли в выручке);
- основные мероприятия программы продвижения продукции;
- требуемые средства для обеспечения продаж.
3 Разработка и испытания нового ЛС
В разделе приводят следующую информацию о разработке и испытании нового ЛС с указанием основных статей расхода на каждом этапе (4-5 стр.):
- научно-исследовательскую работу;
- доклинические исследования;
- клинические (полевые) испытания;
- разработку нормативно-технической документации;
- оформление патентов и разрешительной документации.
Примечание - В разделе конкретизируют наиболее капиталоемкие работы с выделением первоочередных и критических, затраты и эффективность, планируемые к использованию ресурсы с указанием имеющихся и труднодоступных вариантов их получения.
4 Запуск нового лекарственного средства в серийное производство
В разделе приводят информацию о запуске нового ЛС в серийное производство (2-3 стр.) с указанием:
- наличия патентов, лицензий и разрешительной документации;
- наличия (дефицита) мощностей, технологий и кадров для качественного производства (по результатам аудита будущего производителя на соответствие требованиям GMP);
- резервов развития производства;
- необходимости дополнительных мощностей;
- возможности кооперации;
- основных мер по обеспечению производства и сроки их реализации;
- требуемых ресурсов.
5 Основные риски и компенсирующие их мероприятия
В разделе приводят следующие основные риски и компенсирующие их мероприятия (2-3 стр.):
- отраслевые;
- региональные и национальные;
- рыночные;
- производственные (технологические);
- финансовые;
- правовые, включая лицензии и разрешительные документы;
- специфические риски проекта разработки и внедрения нового ЛС.
6 Финансовые ресурсы и инвестиции
В разделе приводят следующую информацию о финансовых ресурсах и инвестициях (1,5-2,0 стр.):
- затраты (инвестиции), млн. руб., капитального характера на строительство, капитальный ремонт, приобретение зданий, строений и т.п.;
- затраты (инвестиции), млн. руб., на оборудование и материалы, приобретение (пополнение) оборотных средств, всего, в том числе по очередности и по годам;
- необходимые заемные средства и их источники, всего по очередности и по годам;
- график плана движения денежных средств и его комментарии.
7 Ожидаемые результаты
В разделе приводят следующую информацию (1,5-2,0 стр.):
- результаты (объемы продаж, маржинальная прибыль, чистая прибыль) всего, по годам;
- эффективность затрат (рентабельность вложений, сроки начала поступления денежных средств, выхода проекта на самофинансирование, на окупаемость, на двойную окупаемость, порог безубыточности проекта);
- упущенная прибыль (за 3 года) при невыполнении проекта и при сдвиге его начала на один квартал;
- прочие (политические, имиджевые и т.п.).
8 Приложения
В разделе приводят следующие приложения (6-7 стр.):
- план продаж (1 стр.);
- план движения денежных средств поквартально на четыре года (2-3 стр.);
- сетевой график работ (3-4 стр.).
Приложение Б
(справочное)
Пример изображения общей технологической схемы производства вирусвакцины (при культивировании вируса в развивающихся куриных эмбрионах)
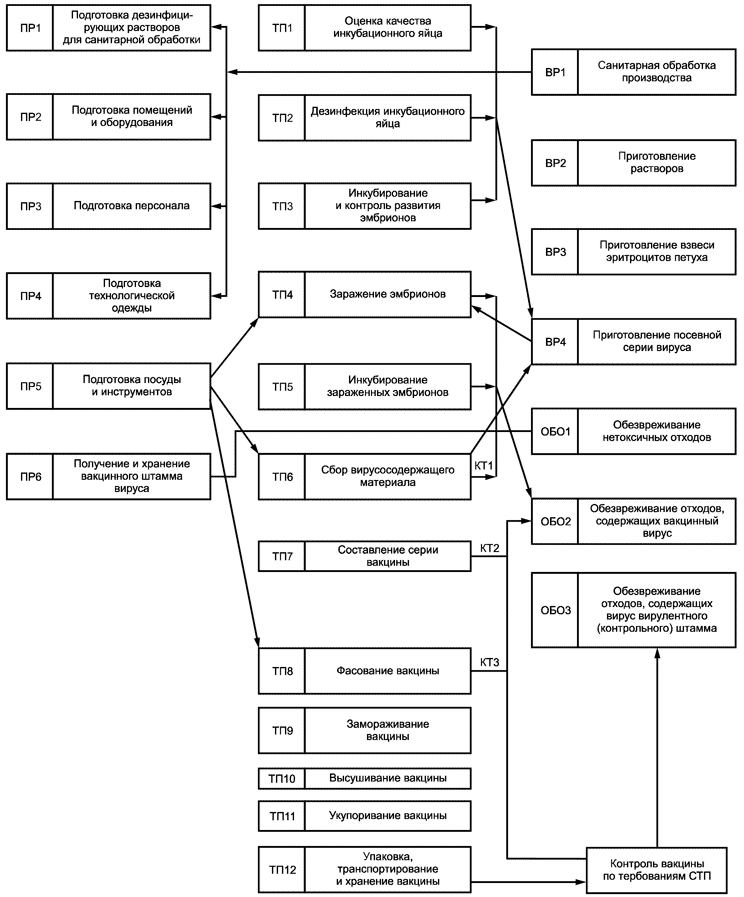
Приложение В
(справочное)
Примеры изображения схем отдельных стадий технологического процесса

Рисунок 1 - Пример изображения схемы получения и хранения вакцинного штамма вируса
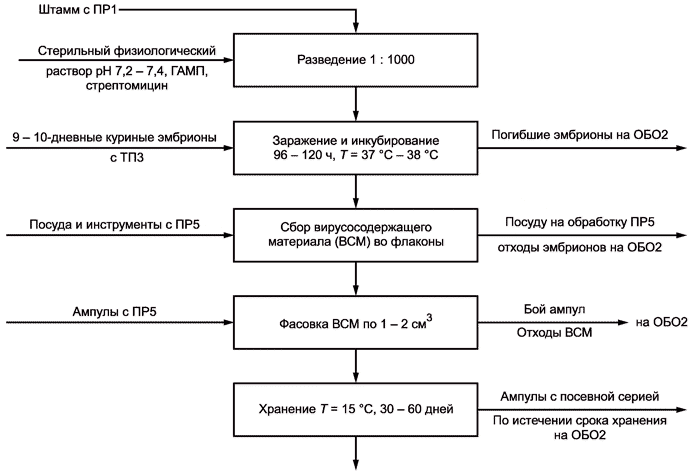
Рисунок 2 - Пример изображения схемы приготовления посевной серии вируса
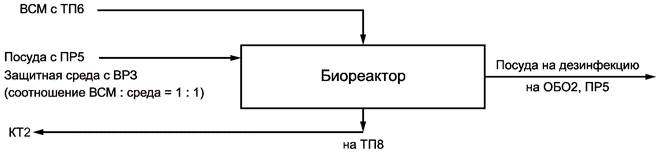
Рисунок 3 - Пример изображения схемы по составлению серии вакцины
Приложение Г
(справочное)
Оформление титульных листов технологических регламентов
Г.1 Титульный лист лабораторного регламента (форма 1)
Полное наименование организации-разработчика | ||||||
УТВЕРЖДАЮ | ||||||
Руководитель | ||||||
(полное наименование организации-разработчика) | ||||||
(личная подпись) | (фамилия, инициалы) | |||||
(дата) | ||||||
ЛАБОРАТОРНЫЙ РЕГЛАМЕНТ | ||||||
на производство | ||||||
(наименование продукции) | ||||||
(обозначение регламента) | ||||||
РЕКОМЕНДОВАНО к утверждению | ||||||
Председатель технологической (методической) комиссии | ||||||
(личная подпись) | (фамилия, инициалы) | |||||
(дата) | ||||||
Срок действия регламента до "____"_________________________20___г. | ||||||
Г.2 Титульный лист опытно-промышленного регламента (форма 2)
Полное наименование организации-разработчика | ||||||||||||
УТВЕРЖДАЮ | ||||||||||||
Руководитель | ||||||||||||
(полное наименование организации-разработчика) | ||||||||||||
(личная подпись) | (фамилия, инициалы) | |||||||||||
(дата) | ||||||||||||
Руководитель | ||||||||||||
(полное наименование организации-изготовителя) | ||||||||||||
(личная подпись) | (фамилия, инициалы) | |||||||||||
(дата) | ||||||||||||
ОПЫТНО-ПРОМЫШЛЕННЫЙ РЕГЛАМЕНТ | ||||||||||||
на производство | ||||||||||||
(наименование продукции) | ||||||||||||
(обозначение регламента) | ||||||||||||
Срок действия регламента до "____"_________________________20___г. | ||||||||||||
(дата) | ||||||||||||
СОГЛАСОВАНО | РЕКОМЕНДОВАНО | |||||||||||
к утверждению | ||||||||||||
Руководитель | ||||||||||||
(наименование проектной организации) | Председатель технологической (методической) комиссии | |||||||||||
(личная подпись) | (фамилия, инициалы) | (личная подпись) | (фамилия, инициалы) | |||||||||
(дата) | (дата) | |||||||||||
Г.3 Титульный лист пускового регламента (форма 3)
Полное наименование организации-разработчика | ||||||||||||
УТВЕРЖДАЮ | ||||||||||||
Руководитель | ||||||||||||
(полное наименование предприятия/организации, | ||||||||||||
на котором вводится производственная мощность) | ||||||||||||
(личная подпись) | (фамилия, инициалы) | |||||||||||
(дата) | ||||||||||||
ПУСКОВОЙ РЕГЛАМЕНТ | ||||||||||||
на производство | ||||||||||||
(наименование продукции) | ||||||||||||
(обозначение регламента) | ||||||||||||
Срок действия регламента до "____"_________________________20___г. | ||||||||||||
(дата) | ||||||||||||
СОГЛАСОВАНО | РЕКОМЕНДОВАНО | |||||||||||
к утверждению | ||||||||||||
Руководитель | ||||||||||||
(наименование организации - | Председатель технологической | |||||||||||
(методической) комиссии | ||||||||||||
разработчика новой продукции или технологического процесса) | ||||||||||||
(личная подпись) | (фамилия, инициалы) | (личная подпись) | (фамилия, инициалы) | |||||||||
(дата) | (дата) | |||||||||||
СОГЛАСОВАНО | ||||||||||||
Руководитель | ||||||||||||
(наименование проектной | ||||||||||||
организации) | ||||||||||||
(личная подпись) | (фамилия, инициалы) | |||||||||||
(дата) | ||||||||||||
Г.4 Титульный лист промышленного регламента (форма 4)
УТВЕРЖДАЮ | ||||||||||
Руководитель | ||||||||||
(полное наименование предприятия - | ||||||||||
изготовителя продукции) | ||||||||||
(личная подпись) | (фамилия, инициалы) | |||||||||
(дата) | ||||||||||
ПРОМЫШЛЕННЫЙ РЕГЛАМЕНТ | ||||||||||
производства | ||||||||||
(наименование продукции) | ||||||||||
(обозначение регламента) | ||||||||||
СОГЛАСОВАНО | РЕКОМЕНДОВАНО | |||||||||
к утверждению | ||||||||||
Руководитель | ||||||||||
(наименование организации - | Председатель технологической | |||||||||
(методической) комиссии | ||||||||||
разработчика новой продукции или технологического процесса) | ||||||||||
(личная подпись) | (фамилия, инициалы) | (личная подпись) | (фамилия, инициалы) | |||||||
(дата) | (дата) | |||||||||
СОГЛАСОВАНО | ||||||||||
Руководитель | ||||||||||
(наименование проектной | ||||||||||
организации) | ||||||||||
(личная подпись) | (фамилия, инициалы) | |||||||||
(дата) | ||||||||||
Приложение Д
(справочное)
Ведомость изменений к регламенту
Д.1 Форма ведомости изменений к регламенту
(наименование организации, разработавшей регламент) | ||
УТВЕРЖДАЮ | ||
(должность, фамилия, инициалы, личная подпись лица, утвердившего документ) | ||
(дата утверждения) | ||
ВЕДОМОСТЬ ИЗМЕНЕНИЙ N______ | ||
(наименование регламента) | ||
(наименование продукции) | ||
СОГЛАСОВАНО* | ||
(должность, фамилия, инициалы, личная подпись лица, согласовавшего документ) | ||
(дата утверждения) | ||
_______________
* Порядок согласования и утверждения ведомости изменений к регламенту должен соответствовать согласованию и утверждению соответствующей категории технологического регламента.
Д.2 Последующие листы ведомости изменений к регламенту
N пункта регламента | Старая редакция | Новая редакция | Краткое обоснование изменений |
1 | 2 | 3 | 4 |
Личные подписи*
_______________
* На последнем листе ведомости изменений к регламенту должны быть те же личные подписи, что и на самом регламенте.
Библиография
[1] | Федеральный закон | Об обращении лекарственных средств |
[2] | Р 50.1.021-99 | Обеспечение стабильности технологических процессов в системах качества по моделям стандартов ИСО серии 9000. Приемочные контрольные карты |
[3] | ГН 2.1.5.689-98* | Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования |
________________ * На территории Российской Федерации документ не действует. Действуют ГН 2.1.5.1315-03. - . | ||
[4] | СанПиН 2.1.4.1074-2001 | Питьевая вода. Гигиенические требования к качеству централизованных систем питьевого снабжения. Контроль качества |
[5] | СанПиН 2.1.4.1116-2002 | Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества |
[6] | РД 09-251-98 | Положение о порядке разработки и содержании раздела "Безопасная эксплуатация производств" технологического регламента, утвержденное постановлением Госгортехнадзора России от 18 декабря 1998 г. N 77 |
[7] | Положение об отраслевой системе управления охраной труда в АПК*, утвержденное Министром сельского хозяйства Российской Федерации 08.02.2002 г. | |
________________ * Документ в информационных продуктах не содержится. За информацией о документе Вы можете обратиться в Службу поддержки пользователей. - . | ||
[8] | СП 44.13330.2011 | Административные и бытовые здания (Актуализированная редакция СНиП 2.09.04-87) |
Электронный текст документа
и сверен по:
, 2013
