ГОСТ Р 54064-2010
Группа Р31
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ВАКЦИНЫ ПРОТИВ САЛЬМОНЕЛЛЕЗА ЖИВОТНЫХ ЖИВЫЕ
Общие технические условия
Live vaccines against salmonellosis of animals. General specifications
ОКС 11.220
ОКП 93 8412
Дата введения 2012-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГУ "ВГНКИ")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 454 "Охрана жизни и здоровья животных и ветеринарно-санитарная безопасность продуктов животного происхождения и кормов"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 30 ноября 2010 г. N 700-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на живые вакцины против сальмонеллеза животных (далее - вакцины), предназначенные для профилактической иммунизации восприимчивых животных.
Примечания
1 Вакцины представляют собой взвесь живых клеток аттенуированных штаммов сальмонелл в защитной среде, лиофилизированных под вакуумом.
2 Вакцины содержат аттенуированные штаммы сальмонелл серологических вариантов (далее - серовары), соответствующие этиологической структуре сальмонеллеза у животных данного вида.
3 В состав вакцин против сальмонеллеза телят входят серовары Salmonella dublin и Salmonella typhimurium, сальмонеллеза свиней - Salmonella choleraesuis и Salmonella typhimurium, овец и водоплавающей птицы - Salmonella typhimurium.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО 7886-1-2009 Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования
ГОСТ Р 50460-92 Знак соответствия при обязательной сертификации. Форма, размеры и технические требования
ГОСТ Р 51314-99 Колпачки алюминиевые и комбинированные для укупорки лекарственных средств. Общие технические условия
ГОСТ Р 52683-2006 Средства лекарственные для животных. Упаковка, маркировка, транспортирование и хранение
ГОСТ Р 52684-2006 Средства лекарственные для животных. Правила приемки, методы отбора проб
ГОСТ Р 54063-2010 Средства лекарственные для животных. Методы определения безвредности
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.008-76 Система стандартов безопасности труда. Биологическая безопасность. Общие требования
ГОСТ 12.2.003-91 Система стандартов безопасности труда. Оборудование производственное. Общие требования безопасности
ГОСТ 12.3.002-75 Система стандартов безопасности труда. Процессы производственные. Общие требования безопасности
ГОСТ 12.4.011-89 Система стандартов безопасности труда. Средства защиты работающих. Общие требования и классификация
ГОСТ 17.0.0.01-76 Система стандартов в области охраны природы и улучшения использования природных ресурсов. Основные положения
ГОСТ 17.2.3.02-78 Охрана природы. Атмосфера. Правила установления допустимых выбросов вредных веществ промышленными предприятиями
ГОСТ 3164-78 Масло вазелиновое медицинское. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9142-90 Ящики из гофрированного картона. Общие технические условия
ГОСТ 9293-74 Азот газообразный и жидкий. Технические условия
ГОСТ 12301-2006 Коробки из картона, бумаги и комбинированных материалов. Общие технические условия
ГОСТ 12303-80 Пачки из картона, бумаги и комбинированных материалов. Общие технические условия
ГОСТ 14192-96 Маркировка грузов
ГОСТ 16280-2002 Агар пищевой. Технические условия
ГОСТ 17206-96 Агар микробиологический. Технические условия
ГОСТ 20730-75 Питательные среды. Бульон мясо-пептонный (для ветеринарных целей). Технические условия
ГОСТ 22967-90 Шприцы медицинские инъекционные многократного применения. Общие технические требования и методы испытаний
ГОСТ 24061-89 Препараты биологические сухие. Метод определения влажности
ГОСТ 25046-81* Иглы инъекционные однократного применения. Основные размеры. Технические требования. Методы испытаний
_______________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р ИСО 7864-2009, здесь и далее по тексту. - .
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25377-82 Иглы инъекционные многократного применения. Технические условия
ГОСТ 27785-88 Препараты биологические сухие. Метод определения кислорода во флаконах с препаратом
ГОСТ 28083-89 Препараты биологические. Метод контроля вакуума в ампулах и флаконах
ГОСТ 29112-91 Среды питательные плотные (для ветеринарных целей). Общие технические условия
ГОСТ 29230-91 (ИСО 835-4-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 4. Пипетки выдувные
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 вакцина живая: Иммунобиологический препарат, получаемый из живых ослабленных аттенуированных штаммов микроорганизмов, возбудителей болезней животных и человека.
3.2 аттенуация: Искусственное стойкое ослабление и изменение патогенности и вирулентности возбудителей инфекционных болезней.
3.3 вакцинация: Применение вакцины для предупреждения инфекционной болезни.
3.4 лиофилизация: Метод высушивания биологических объектов в замороженном состоянии под вакуумом.
3.5 вирулентность: Степень патогенности (болезнетворности) микроорганизмов.
3.6 штамм (вакцинный): Генетически однородная популяция микроорганизмов с постоянными, наследственно закрепленными свойствами.
3.7 серия вакцины: Определенное количество вакцины, изготовленной за один технологический цикл в одних производственных условиях из одной расплодки штамма, смешанной с защитной средой в одной емкости, расфасованной в однородную тару, высушенной водном сублимационном аппарате, однородной по показателям качества, получившей свой номер серии и оформленной документом о качестве.
3.8 микробиологическая чистота: Отсутствие в популяции штамма микроорганизмов других видов (типов, сероваров).
3.9 диссоциация: Появление в популяции штамма микроорганизмов измененных клеточных форм.
3.10 безвредность (вакцины): Отсутствие вредных для организма последствий местного и общего характера после введения вакцины.
3.11 реактогенность (вакцины): Способность живых вакцин вызывать при введении незначительную реакцию местного или общего характера (отечность, болезненность, кратковременное повышение температуры и др.).
3.12
доза лекарственного средства для животных: Определенное количество лекарственного средства для животных, вводимого в организм животного. [ГОСТ Р 52682-2006, статья 21] |
3.13
летальная доза лекарственного средства для животных: Количество лекарственного средства для животных, приводящее животное, для лечения которого данное средство предназначено, к летальному исходу. [ГОСТ Р 52682-2006, статья 22] |
3.14 минимальная летальная доза лекарственного средства для животных (![]() ): Доза лекарственного средства, содержащая минимальное количество возбудителя, вызывающее гибель 95% взятых для опыта лабораторных животных за фиксированный период времени.
): Доза лекарственного средства, содержащая минимальное количество возбудителя, вызывающее гибель 95% взятых для опыта лабораторных животных за фиксированный период времени.
3.15 смертельная доза контрольного штамма возбудителя сальмонеллеза: Подтитрованная доза контрольного вирулентного штамма, вызывающая 100%-ную гибель лабораторных животных.
3.16 иммуногенность (вакцины): Способность вакцины вызывать у вакцинированных особей формирование состояния невосприимчивости к инфекционной болезни.
3.17 колония микроорганизма: Потомство одной микробной клетки на твердой питательной среде.
3.18 регидратация: Метод выведения лиофилизированных культур микроорганизмов из состояния анабиоза с целью восстановления их жизнедеятельности.
3.19 серологический вариант: Таксономическая единица бактерий рода Salmonella, имеющая определенную антигенную структуру.
4 Технические требования
4.1 Вакцины должны соответствовать требованиям настоящего стандарта и изготавливаться в соответствии с технологическими регламентами производства, утвержденными в установленном порядке организацией-производителем.
4.2 Вакцины по физико-химическим, морфологическим, культуральным, биологическим свойствам должны соответствовать требованиям и нормам, указанным в таблице 1.
Таблица 1
Наименование показателя | Характеристика и норма |
Внешний вид и цвет | Сухая пористая масса белого или светло-серого цвета |
Наличие посторонней примеси, плесени, трещин ампул, флаконов, изменение цвета и консистенции вакцины | Не допускается |
Время регидратации, мин | 2-3 |
Массовая доля влаги, % | 1-3 |
Наличие вакуума в ампулах | Должен быть вакуум |
Наличие кислорода во флаконах с азотом, %, не более | 1 |
Чистота и типичность роста | Посев на МПА, МПБ, МППБ, среду Эндо и агар Сабуро должен давать типичный рост вакцинного штамма. Рост посторонней микрофлоры не допускается |
Количество живых бактерий в 1 см | 40 |
Безвредность | Должна быть безвредна |
Иммуногенная активность | Должна быть иммуногенной |
Примечание - МПА - мясо-пептонный агар; МПБ - мясо-пептонный бульон; МППБ - мясо-пептонный печеночный бульон (среда Китт-Тароцци). | |
4.3 Фасование и лиофилизация
Вакцину расфасовывают в стерильные ампулы или стерильные флаконы. Бактериальную культуру, разведенную средой высушивания, расфасовывают по 1-4 см в ампулы или по 4 см
во флаконы вместимостью 10 см
и подвергают лиофильной сушке. После окончания лиофилизации ампулы запаивают под вакуумом, флаконы заполняют азотом особой чистоты по ГОСТ 9293, укупоривают стерильными резиновыми пробками и обжимают алюминиевыми колпачками по ГОСТ Р 51314.
4.4 Упаковывание и маркирование
4.4.1 На ампулы (флаконы) с вакциной наклеивают этикетку с указанием:
- организации-производителя и ее адреса;
- названия вакцины;
- числа доз вакцины в ампуле (флаконе);
- номера серии;
- срока годности (месяца и года);
- условий хранения.
На этикетку может быть нанесена дополнительная информация.
4.4.2 Ампулы (флаконы) с вакциной (10-50 шт.) упаковывают в картонные коробки по ГОСТ 12301 или пачки по ГОСТ 12303 с наличием гнезд или перегородок, обеспечивающих их неподвижность и целостность. В каждую коробку (пачку) вкладывают инструкцию по применению.
4.4.3 На коробку (пачку) с вакциной наклеивают этикетку с указанием:
- наименования и товарного знака организации-производителя;
- адреса и телефона организации-производителя;
- названия вакцины;
- числа ампул (флаконов) в коробке (пачке);
- числа доз в ампуле (флаконе);
- номера серии;
- даты изготовления (месяца и года);
- срока годности (месяца и года);
- условий хранения;
- способа применения;
- обозначения настоящего стандарта;
- штрихкода (при наличии);
- знака соответствия по ГОСТ Р 50460;
- номера государственной регистрации;
- надписи: "Для ветеринарного применения".
4.4.4 Коробки (пачки) с вакциной упаковывают в ящики из гофрированного картона по ГОСТ 9142 или другие аналогичные, обеспечивающие сохранность вакцины при транспортировании. Масса брутто ящика - не более 20 кг.
В каждый ящик вкладывают четыре-пять экземпляров инструкции по применению и упаковочный лист с указанием:
- организации-производителя;
- торгового названия вакцины;
- числа коробок (пачек) в ящике;
- номера серии;
- фамилии или номера упаковщика.
4.4.5 На каждое грузовое место (ящик) наносят транспортную маркировку по ГОСТ 14192 с указанием манипуляционных знаков: "Хрупкое. Осторожно", "Ограничение температуры", "Верх, не кантовать".
4.4.6 Маркировка, характеризующая упакованную продукцию, должна содержать следующие обозначения:
- организацию-производитель, ее товарный знак, адрес и телефон;
- название вакцины и число коробок (пачек) в ящике;
- номер серии;
- срок годности (месяц и год);
- условия хранения;
- массу нетто;
- надпись: "Для ветеринарного применения".
Допускается нанесение дополнительной информации в маркировку, характеризующую упакованную продукцию.
5 Требования безопасности
5.1 По биологической безопасности вакцина должна соответствовать требованиям ГОСТ 12.1.008.
5.2 В процессе производства вакцин необходимо осуществлять контроль за выполнением требований обеспечения пожарной безопасности по ГОСТ 12.1.004.
5.3 Организация производственного процесса - в соответствии с требованиями ГОСТ 12.3.002, а производственное оборудование - в соответствии с ГОСТ 12.2.003.
5.4 Обучение персонала мерам безопасности - в соответствии с ГОСТ 12.0.004.
5.5 Средства защиты работающих - в соответствии с ГОСТ 12.4.011.
5.6 Воздух рабочей зоны - в соответствии с ГОСТ 12.1.005.
5.7 Контроль за выбросами во внешнюю среду - в соответствии с ГОСТ 17.2.3.02.
5.8 Утилизацию вакцин с истекшим сроком годности и серий, не выдержавших контрольных испытаний, оставшихся после испытаний, проводят путем автоклавирования в течение 1 ч при температуре (126±2) °С и давлении 1,5 атм (151,99 кПа или 1,5 кгс/см) с соблюдением требований ГОСТ 17.0.0.01 и [1].
6 Правила приемки
6.1 Каждая серия вакцины должна быть принята (проверена) отделом биологического технологического контроля (ОБТК) организации - производителя согласно ГОСТ Р 52684. После проведения контроля на каждую серию вакцины оформляют документ о качестве.
6.2 В документе о качестве указывают:
- организацию-производитель;
- название вакцины;
- номер серии;
- дату изготовления (месяц и год);
- объем серии;
- результаты испытания вакцины по показателям качества и безопасности;
- срок годности (месяц и год);
- условия хранения;
- обозначение стандарта;
- номер и дату выдачи документа о качестве;
- заключение и подпись лица, выдавшего документ о качестве.
6.3 Для контроля качества и безопасности вакцины от каждой серии отбирают выборку. Из выборки выделяют среднюю пробу в количестве 40 ампул (флаконов). 20 ампул (флаконов) с вакциной используют для проведения испытания по показателям качества, указанным в таблице 1, а 20 ампул (флаконов) направляют в архив ОБТК. Пробы в архиве хранят в течение срока годности.
6.4 Архивные образцы маркируют надписью: "Архив", опечатывают и снабжают документом установленной формы с указанием:
- названия вакцины;
- номера серии;
- даты изготовления (месяц и год);
- даты отбора проб;
- объема серии;
- числа отобранных образцов;
- должности и подписи лица, отобравшего пробы;
- срока годности (месяц и год);
- обозначения настоящего стандарта;
- срока хранения проб в архиве.
6.5 При неудовлетворительных результатах испытаний хотя бы по одному из показателей по нему проводят повторные испытания на удвоенном количестве образцов вакцины, взятой от той же серии, и на удвоенном количестве материалов и животных. Результаты повторных испытаний считают окончательными и распространяют на всю серию.
В случае неудовлетворительных результатов повторной проверки серию вакцины считают не соответствующей требованиям настоящего стандарта, ее бракуют и уничтожают путем автоклавирования в течение 1 ч при температуре (126±2) °С в соответствии с требованиями [1].
6.6 Контроль качества и безопасности вакцины, поступающей по рекламации, проводит организация-производитель, а при разногласиях в оценке качества между производителем и потребителем контроль проводит уполномоченная организация по поручению федерального органа исполнительной власти в области сельского хозяйства.
7 Методы испытания
7.1 Определение внешнего вида, цвета, наличия посторонней примеси, плесени, трещин флаконов (ампул), изменения консистенции
7.1.1 Для определения внешнего вида, цвета, наличия посторонней примеси, плесени, изменения консистенции, наличия трещин каждую ампулу (флакон) просматривают, одновременно проверяют правильность маркировки.
7.1.2 Содержимое ампулы (флакона) должно представлять собой пористую массу белого или светло-серого цвета. Во флаконах и ампулах не должно быть посторонней примеси, плесени и трещин.
7.2 Определение времени регидратации
7.2.1 Материалы
Пипетки мерные вместимостью 2 и 5 см по ГОСТ 29230.
Раствор натрия хлорида изотонический 0,9%-ный с рН от 7,2 до 7,4 [2] или вода дистиллированная по ГОСТ 6709.
7.2.2 Проведение испытания
Для определения времени регидратации в три ампулы (флакона) с сухой вакциной вносят раствор натрия хлорида изотонический 0,9%-ный или дистиллированную воду в объеме, соответствующем объему вакцины до высушивания. После этого ампулы (флаконы) осторожно взбалтывают и наблюдают за растворением вакцины. В течение 2-3 мин в ампуле должна образоваться равномерная взвесь белого или светло-серого цвета без комочков, хлопьев и осадка. Если образцы вакцины плохо растворяются или содержат хлопья, то вакцину бракуют.
7.3 Определение массовой доли влаги
Определение массовой доли влаги - по ГОСТ 24061.
Массовая доля влаги должна быть от 1% до 3%.
7.4 Определение наличия вакуума в ампулах с сухой вакциной, кислорода и азота во флаконах
7.4.1 Наличие вакуума в ампулах определяют по ГОСТ 28083.
7.4.2 Наличие кислорода и азота во флаконах с сухой вакциной определяют по ГОСТ 27785.
Во флаконах должно быть наличие азота при содержании кислорода не более 1%.
7.5 Определение чистоты и типичности роста
7.5.1 Аппаратура и материалы
Среда Эндо по [3].
Среда Сабуро по [4] или ГОСТ 29112.
Мясо-пептонный агар (МПА) по ГОСТ 29112.
Среда Китт-Тароцци (МППБ).
Термостат с температурой нагрева 37 °С - 38 °С и 20 °С - 24 °С.
Пипетки мерные вместимостью 1,2 и 5 см по ГОСТ 29230.
Пробирки стеклянные по ГОСТ 25336.
Чашки Петри по ГОСТ 25336.
Агар микробиологический по ГОСТ 17206.
Агар пищевой по ГОСТ 16280.
Бульон мясо-пептонный по ГОСТ 20730.
Масло вазелиновое медицинское по ГОСТ 3164.
Раствор натрия хлорида изотонический 0,9%-ный стерильный с рН от 7,2 до 7,4 по [2] или вода дистиллированная по ГОСТ 6709.
7.5.2 Проведение испытания
Для испытания применяют пять ампул (флаконов) с вакциной. Вакцину в каждой ампуле (флаконе) регидратируют в 4-5 см стерильного изотонического 0,9%-ного раствора натрия хлорида и производят посев по 0,1 см
взвеси вакцины на МПА, МПБ, МППБ под вазелиновым маслом и агар Сабуро в три пробирки с каждой средой. Засевают в три-четыре чашки с МПА по Дригальскому и средой Эндо. Посевы в пробирках выдерживают в течение 10 сут при температуре 37 °С - 38 °С, посевы на чашках - 1 сут, на среде Сабуро при температуре 20 °С - 22 °С - до 10 сут.
7.5.3 Учет результатов
На питательных средах должен быть типичный рост вакцинного штамма - на МПА и среде Эндо через 24 ч должны вырасти бесцветные, прозрачные, гладкие, круглые колонии в S-форме, на МПБ через 16-18 ч должно быть равномерное помутнение. При этом вакцина не должна содержать посторонних микробов и грибов.
7.6 Определение количества живых сальмонелл
7.6.1 Для определения количества живых сальмонелл применяют аппаратуру, посуду и материалы, указанные в 4.5.1, за исключением вазелинового масла и термостата с температурой нагрева 20 °С - 24 °С.
7.6.2 Для определения количества живых клеток в 1 см вакцины содержимое трех ампул (флаконов) с сухой вакциной разводят стерильным 0,9%-ным изотоническим раствором натрия хлорида по 7.2.1 до первоначального объема. Путем десятикратных разведений готовят конечную концентрацию 1000 микробных клеток в 1 см
, из этого разведения засевают по 0,1 см
(100 микробных клеток) в три чашки Петри с мясо-пептонным агаром. Для приготовления каждого разведения используют отдельную стерильную пипетку. Приготовление разведений одной пипеткой не допускается.
Чашки перед засевом подсушивают в термостате 30-40 мин. Посевы инкубируют при температуре 37 °С - 38 °С в течение 24-36 ч, после чего подсчитывают количество выросших колоний и определяют концентрацию (число) живых бактерий в 1 см вакцины
по формуле
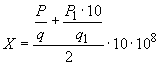 , (1)
, (1)
где - количество колоний во всех чашках из разведения 10
;
- число чашек с разведением 10
;
- количество колоний во всех чашках из разведения 10
;
- число чашек с разведением 10
;
10 - перерасчет количества живых бактерий на 1 см;
10 - степень разведения вакцины.
Для определения концентрации живых сальмонелл в вакцине подсчитывают выросшие колонии на МПА в чашках по каждому разведению, полученные показатели суммируют и делят на число чашек, определяя среднее количество живых бактерий для каждого разведения, содержащихся в 0,1 см. Затем средние показатели по каждому разведению суммируют и делят на число испытуемых разведений (два), полученное число умножают на степень разведения (10
) и полученный показатель увеличивают в 10 раз, определяя количество живых сальмонелл в 1 см
вакцины. Чашки с зонами сплошного роста культуры учету не подлежат.
7.6.3 После определения количества живых сальмонелл рассчитывают количество доз в 1 см вакцины, которое устанавливают путем деления количества живых сальмонелл в 1 см
вакцины на количество живых сальмонелл (млрд), составляющих одну иммунизирующую дозу, для данной вакцины.
Одна иммунизирующая доза содержит живых микробных клеток:
- 1 млрд - для вакцины против сальмонеллеза телят из аттенуированного штамма Сальмонелла дублин N 6;
- 1 млрд - для вакцины против сальмонеллеза молодняка крупного рогатого скота при парентеральном способе введения;
- 100 млрд - для вакцины против сальмонеллеза молодняка крупного рогатого скота при пероральном способе введения;
- 2 млрд - для сухой живой вакцины против сальмонеллеза водоплавающей птицы;
- 1 млрд - для бивалентной вакцины против сальмонеллеза свиней из аттенуированных штаммов Сальмонелла тифимуриум N 3 и Сальмонелла холераесуис N 9;
- 0,5 млрд - для сухой живой вакцины против сальмонеллеза свиней из супрессорного ревертанта Сальмонелла холераесуис N 9;
- 0,45 млрд - для сухой живой вакцины против сальмонеллеза свиней из штамма ТС-177;
- 2 млрд - для вакцины против сальмонеллеза овец.
7.7 Определение безвредности
Общие требования по определению безвредности - по ГОСТ Р 54063.
7.7.1 Аппаратура и материалы
Пипетки градуированные выдувные вместимостью 1,5 и 10 см по ГОСТ 29230.
Пробирки стеклянные по ГОСТ 25336.
Раствор натрия хлорида изотонический 0,9%-ный по [2].
Шприцы вместимостью 1 и 2 см по ГОСТ 22967 или ГОСТ Р ИСО 7886-1.
Иглы инъекционные по ГОСТ 25377 или ГОСТ 25046.
Мыши белые массой 16-18 г.
Морские свинки массой 300-350 г.
Оптический стандарт мутности ГИСК им. Тарасевича [5].
7.7.2 Проведение испытания
7.7.2.1 Вакцина против сальмонеллеза телят из аттенуированного штамма Сальмонелла дублин N 6
Для испытания используют смесь вакцины из двух ампул.
Сухую вакцину разводят стерильным 0,9%-ным изотоническим раствором натрия хлорида до концентрации 2 млн микробных клеток в 1 см по оптическому стандарту мутности и вводят десяти белым мышам подкожно в область спины в дозе 1 млн микробных клеток, в объеме 0,5 см
.
Вакцину считают безвредной, если из десяти белых мышей в течение 10 сут остаются живыми не менее восьми.
7.7.2.2 Вакцина против сальмонеллеза молодняка крупного рогатого скота
Для испытания используют смесь вакцины из двух ампул.
Сухую вакцину разводят стерильным 0,9%-ным изотоническим раствором натрия хлорида до концентрации 2 млн микробных клеток в 1 см по оптическому стандарту мутности и вводят десяти белым мышам подкожно в область спины в дозе 1 млн микробных клеток, в объеме 0,5 см
.
Вакцину считают безвредной, если из десяти белых мышей в течение 10 сут остаются живыми не менее восьми.
7.7.2.3 Вакцина живая сухая против сальмонеллеза водоплавающей птицы
Для испытания используют смесь вакцины из двух ампул.
Сухую вакцину разводят стерильным физиологическим раствором до концентрации 20 млн микробных клеток в 1 см по оптическому стандарту мутности и вводят десяти белым мышам подкожно в область спины в дозе 10 млн микробных клеток, в объеме 0,5 см
.
Вакцину считают безвредной, если из десяти белых мышей в течение 10 сут остаются живыми не менее восьми.
7.7.2.4 Бивалентная вакцина против сальмонеллеза свиней из аттенуированных штаммов Сальмонелла тифимуриум N 3 и Сальмонелла холераесуис N 9
Для испытания используют смесь вакцины из двух ампул (флаконов).
Сухую вакцину разводят стерильным физиологическим раствором до концентрации 2 млн микробных клеток в 1 см по оптическому стандарту мутности и вводят десяти белым мышам подкожно в область спины в дозе 1 млн микробных клеток, в объеме 0,5 см
.
Вакцину считают безвредной, если из десяти белых мышей в течение 10 сут остаются живыми не менее восьми.
7.7.2.5 Вакцина живая сухая против сальмонеллеза свиней из супрессорного ревертанта Сальмонелла холераесуис N 9
Для испытания используют смесь вакцины из двух ампул (флаконов).
Сухую вакцину разводят стерильным раствором до концентрации 1 млн микробных клеток в 1 см по оптическому стандарту мутности и вводят десяти белым мышам подкожно в область спины в дозе 0,5 млн микробных клеток, в объеме 0,5 см
.
Вакцину считают безвредной, если из десяти белых мышей в течение 10 сут остаются живыми не менее восьми.
7.7.2.6 Вакцина против сальмонеллеза овец
Для испытания используют смесь вакцины из двух ампул (флаконов).
Сухую вакцину разводят стерильным изотоническим 0,9%-ным раствором натрия хлорида до концентрации 20 млн микробных клеток в 1 см по оптическому стандарту мутности и вводят десяти белым мышам подкожно в область спины в дозе 10 млн микробных клеток, в объеме 0,5 см
.
Вакцину считают безвредной, если из десяти белых мышей в течение 10 сут остаются живыми не менее восьми.
7.7.2.7 Вакцина против сальмонеллеза свиней из штамма ТС-177
Для испытания используют смесь вакцины из двух флаконов.
Сухую вакцину разводят стерильным изотоническим 0,9%-ным раствором натрия хлорида до концентрации 3 млрд и 20 млн микробных клеток в 1 см по оптическому стандарту мутности. Вакцину, разведенную до концентрации 20 млн/см
микробных клеток, вводят десяти белым мышам подкожно в область спины по 0,5 см
. Вакцину, разведенную до концентрации 3 млрд/см
микробных клеток, вводят пяти морским свинкам подкожно в область живота в объеме 2 см
. Вакцину считают безвредной, если из десяти белых мышей в течение 10 сут остаются живыми не менее семи мышей, а из пяти морских свинок выживают не менее четырех.
7.8 Определение иммуногенной активности
7.8.1 Для проведения испытания вакцин применяют аппаратуру, посуду и материалы по 7.7.1 с дополнением:
мыши белые массой 14-16 г.
7.8.2 Проведение испытания
Для испытания используют три ампулы или три флакона с вакциной. В каждую ампулу (флакон) с вакциной вносят стерильный 0,9%-ный раствор натрия хлорида в объеме, равном объему до высушивания. После полной регидратации вакцину из ампул (флаконов) переносят в стерильную пробирку и из общей пробы готовят разведения вакцины в стерильном 0,9%-ном растворе натрия хлорида с концентрацией живых бактерий в 1 см, зависящей от вида вакцины.
7.8.2.1 Вакцина против сальмонеллеза телят из аттенуированного штамма Сальмонелла дублин N 6
Определение иммуногенности вакцины на морских свинках
Для проверки иммуногенности отбирают 20 морских свинок, из них 10 морским свинкам вводят вакцину подкожно в область живота в дозе 100 млн микробных клеток в объеме 1 см, остальных 10 морских свинок оставляют для контроля.
Через 14-16 сут вакцинированных и контрольных морских свинок заражают подкожно оттитрованной смертельной дозой контрольного (вирулентного) штамма Salmonella dublin N 373.
Наблюдение за опытными животными ведут в течение 10 сут после гибели половины контрольных животных.
Вакцину считают активной при выживании не менее восьми опытных свинок и гибели не менее восьми контрольных животных.
Определение иммуногенной активности на белых мышах
10 белых мышей вакцинируют подкожно в область спины в дозе по 1 млн живых бактерий в объеме 0,5 см . Через 14-16 сут иммунизированных и 10 контрольных (невакцинированных) мышей аналогичной массы заражают подкожно оттитрованной смертельной дозой контрольного штамма Salmonella dublin N 373.
Вакцина должна предохранять от гибели не менее восьми из 10 иммунизированных мышей при гибели не менее восьми из 10 контрольных животных. Срок наблюдения за опытными животными - 10 сут после гибели половины мышей в контроле.
7.8.2.2 Вакцина против сальмонеллеза молодняка крупного рогатого скота
Определение иммуногенной активности на морских свинках
Для проверки иммуногенности отбирают 20 морских свинок, из них 10 морским свинкам вводят вакцину подкожно в область живота в дозе 200 млн микробных клеток в объеме 1 см, остальных 10 морских свинок оставляют для контроля.
Через 14-16 сут вакцинированных и контрольных морских свинок заражают подкожно оттитрованной смертельной дозой контрольных штаммов Salmonella dublin N 373 и Salmonella typhimurium N 371. На каждый серовар используют по пять опытных и контрольных животных.
Наблюдение за опытными животными ведут в течение 10 сут после гибели половины контрольных животных.
Вакцину считают активной при выживании не менее четырех опытных морских свинок и гибели не менее четырех контрольных животных, зараженных каждым штаммом сальмонелл.
Определение иммуногенной активности на белых мышах
20 белых мышей вакцинируют подкожно в область спины в дозе 2 млн живых бактерий в объеме 0,5 см.
Через 14-16 сут иммунизированных и 20 контрольных (невакцинированных) мышей аналогичной массы заражают подкожно смертельной дозой вирулентных штаммов Salmonella dublin N 373 и Salmonella typhimurium N 371. На каждый серовар используют по 10 животных.
Вакцина должна предохранять от гибели не менее восьми из 10 иммунизированных мышей в каждой группе при гибели не менее восьми из 10 контрольных животных. Срок наблюдения за опытными животными - 10 сут после гибели половины мышей в контроле.
7.8.2.3 Вакцина живая сухая против сальмонеллеза водоплавающей птицы
Для проверки иммуногенности отбирают 20 морских свинок, из них 10 морским свинкам вводят вакцину подкожно в область живота в дозе 300 млн микробных клеток в объеме 1 см, остальных 10 морских свинок оставляют для контроля.
Через 14-16 сут вакцинированных и контрольных морских свинок заражают подкожно оттитрованной смертельной дозой контрольного штамма Salmonella typhimurium N 371.
Наблюдение за опытными животными ведут в течение 10 сут после гибели половины контрольных животных.
Вакцину считают активной при выживании не менее восьми опытных морских свинок и гибели не менее восьми контрольных животных.
7.8.2.4 Бивалентная вакцина против сальмонеллеза свиней из аттенуированных штаммов Сальмонелла тифимуриум N 3 и Сальмонелла холераесуис N 9
Для проверки иммуногенности отбирают 20 морских свинок, из них 10 морским свинкам вводят вакцину подкожно в область живота в дозе 200 млн микробных клеток в объеме 1 см, остальных 10 морских свинок оставляют для контроля.
Через 14-16 сут вакцинированных и контрольных морских свинок заражают подкожно оттитрованной смертельной дозой контрольных штаммов Salmonella choleraesuis N 370 и Salmonella typhimurium N 371. На каждый серовар используют по пять опытных и контрольных животных.
Наблюдение за опытными животными ведут в течение 10 сут после гибели половины контрольных животных.
Вакцину считают активной при выживании не менее четырех опытных свинок и гибели не менее четырех контрольных животных, зараженных каждым штаммом сальмонелл.
7.8.2.5 Вакцина живая сухая против сальмонеллеза свиней из супрессорного ревертанта Сальмонелла холераесуис N 9
Определение иммуногенной активности на морских свинках
Для проверки иммуногенности отбирают 20 морских свинок, из них 10 морским свинкам вводят вакцину подкожно в область живота в дозе 100 млн микробных клеток в объеме 1 см, остальных 10 морских свинок оставляют для контроля.
Через 14-16 сут вакцинированных и контрольных морских свинок заражают подкожно оттитрованной смертельной дозой контрольного штамма Salmonella choleraesuis N 370.
Наблюдение за опытными животными ведут в течение 10 сут после гибели половины контрольных животных.
Вакцину считают активной при выживании не менее восьми опытных свинок и гибели не менее восьми контрольных животных.
7.8.2.6 Вакцина против сальмонеллеза овец
Определение иммуногенности вакцины на морских свинках
Для проверки иммуногенности отбирают 20 морских свинок, из них 10 морским свинкам вводят вакцину подкожно в области живота в дозе 200 млн микробных клеток в объеме 1 см, остальных 10 морских свинок оставляют для контроля.
Через 14-16 сут вакцинированных и контрольных морских свинок заражают подкожно оттитрованной смертельной дозой контрольного штамма Salmonella typhimurium N 371.
Наблюдение за опытными животными ведут в течение 10 сут после гибели половины контрольных животных.
Вакцину считают активной при выживании не менее восьми опытных свинок и гибели не менее восьми контрольных животных.
Определение иммуногенной активности на белых мышах
10 белых мышей вакцинируют подкожно в области спины в дозе по 2 млн живых бактерий в объеме 0,5 см. Через 14-16 сут иммунизированных и 10 контрольных (невакцинированных) мышей аналогичной массы заражают подкожно смертельной дозой вирулентного штамма Salmonella typhimurium N 371.
Вакцина должна предохранять от гибели не менее восьми из 10 иммунизированных мышей при гибели не менее восьми из 10 контрольных животных. Срок наблюдения за опытными животными - 10 сут после гибели половины мышей в контроле.
7.8.2.7 Вакцина против сальмонеллеза свиней из штамма ТС-177
Проверка иммуногенной активности на морских свинках
Для проверки иммуногенности отбирают 20 морских свинок, из них 10 морским свинкам вводят вакцину подкожно в область живота в дозе 300 млн микробных клеток в объеме 1 см, остальных 10 морских свинок оставляют для контроля.
Через 16-20 сут вакцинированных и контрольных морских свинок заражают подкожно в область живота оттитрованной смертельной дозой контрольного штамма Salmonella choleraesuis N 370.
Вакцину считают активной при выживании не менее восьми опытных свинок и гибели не менее восьми контрольных животных в течение 7-10 сут. Наблюдение за опытными животными ведут в течение 10 сут после гибели свинок в контроле.
8 Хранение и транспортирование
8.1 Вакцины хранят в закрытом, сухом, темном помещении в упаковке производителя. Температура хранения от 2 °С до 10 °С в пределах срока годности.
8.2 Срок годности вакцин - один год с даты изготовления. Датой изготовления вакцин считают дату окончания процесса лиофилизации.
8.3 Вакцины транспортируют всеми видами транспорта в соответствии с ГОСТ Р 52683.
9 Указания по применению
9.1 Вакцины применяют в соответствии с инструкциями по применению, утвержденными в установленном порядке.
Библиография
[1] | СП 1.3.2322-08 | Безопасность работы с микроорганизмами III и IV групп патогенности (опасности) и возбудителями паразитарных болезней |
[2] | Государственная фармакопея X* | Раствор натрия хлорида 0,9%-ный изотонический |
________________ * Документы [2]-[5] не приводятся. За информацией о документах Вы можете обратиться в Службу поддержки пользователей. - . | ||
[3] | ФС 42-3504-98 | Питательная среда для выделения энтеробактерий сухая (агар Эндо) |
[4] | Государственная фармакопея XI | Питательные среды. Среда Сабуро |
[5] | Государственная фармакопея XII, часть 1 | Оптический стандарт мутности ГИСК им. Тарасевича |
Электронный текст документа
и сверен по:
, 2011
