ГОСТ 32370-2013
Группа Т58
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Оценка биоразлагаемости методом моделирования сточных вод
Testing of chemicals of environmental hazard. Simulation tests to assess the biodegradability of chemicals discharged in wastewater
МКС 71.040.50
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 18 октября 2013 г. N 60-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Азербайджан | AZ | Азстандарт |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Туркменистан | TM | Туркменстандартлары |
Узбекистан | UZ | Узстандарт |
Украина | UA | Минэкономразвития Украины |
4 Настоящий стандарт идентичен международному документу OECD Test No. 314* "Simulation Tests to Assess the Biodegradability of Chemicals Discharged in Wastewater" (ОЭСР Тест N 314 "Оценка биоразлагаемости методом моделирования сточных вод").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Перевод с английского языка (en).
Степень соответствия - идентичная (IDT)
5 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 802-ст межгосударственный стандарт ГОСТ 32370-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Данный стандарт описывает методы для определения степени и кинетики первичного и окончательного биоразложения органических химических веществ, которые попадают в окружающую среду через их сброс в сточные воды. Химические вещества, входящие в состав средств личной гигиены и бытовой химии, как правило, сбрасываются в канализацию на одном из этапов их стандартного использования и становятся постоянными компонентами бытовых сточных вод. Кроме того, фармацевтические препараты выводятся или в некоторых случаях сбрасываются в канализационную систему. Другие химические вещества могут периодически или постоянно поступать в сточные воды в результате производственных процессов.
Настоящий стандарт состоит из пяти отдельных, но связанных между собой методов моделирования для оценки первичного и окончательного биоразложения химических веществ в сточных водах во время их пребывания в канализации, вторичной обработки на станции аэрации, анаэробного сбраживания активного ила, а также в очищенных сточных водах при смешении с поверхностными водами и неочищенных сточных водах, которые напрямую сбрасываются в поверхностные водные объекты. Биоразложение в каждом объекте может играть важную роль при определении воздействия химических веществ на водные и наземные организмы.
На начальном этапе сточные воды поступают в канализацию, где могут оставаться в течение нескольких часов или несколько дней во время транспортировки на очистные сооружения или к непосредственному месту сброса в окружающую среду. В большинстве случаев сточные воды перед поступлением в окружающую среду проходят процесс очистки, но в некоторых ситуациях сточные воды попадают в поверхностные водные объекты напрямую или с минимальной предварительной обработкой. На стандартных очистных сооружениях определенное количество твердых веществ (40-60%) удаляется во время первичной обработки. Затем сточные воды подвергают биологической очистке, и твердые вещества удаляются в отстойнике-осветлителе. Очищенные сточные воды далее поступают в поверхностные водные объекты. Шлам удаляется во время первичной обработки, и его окончательная очистка происходит в анаэробных условиях, если предполагается дальнейшее захоронение шлама [1].
Доля химического вещества, попадающего в окружающую среду в составе очищенных сточных вод или связанных с твердыми осадками, является функциями разложения, скорости его биоразложения и других процессов (например, испарения, гидролиза, фотолиза, изолирования). Из-за зависимости от времени пребывания и удерживания, уровня биологической активности основными возможностями для значительного удаления посредством процесса биодеградации имеют место: 1) в канализационных сетях, 2) во время аэробной вторичной обработки и 3) во время анаэробного сбраживания осадка. Следовательно, эти три системы являются наиболее важными для количественного моделирования процесса биоразложения во время транспортировки и очистки сточных вод. Кроме того, влияние процессов обработки распространяется на окружающую среду во время сброса. Таким образом, определение биоразложения в зонах смешения, в воде и в твердых остатках биологического происхождения, по пути движения от места попадания исследуемого вещества является ключом к оценке концентрации ниже места сброса и воздействию.
Пять рассматриваемых методов моделирования являются методами для открытой системы или закрытой проточной газовой системы, которые включают элементы из Рекомендаций по проведению испытаний ОЭСР [2], [3], [4], [5] и [6].
Основные цели методов:
1) измерение скорости первичного биоразложения;
2) измерение скорости минерализации;
3) описание процессов образования и разложения основных продуктов трансформации веществ в окружающей среде, когда это необходимо.
Кроме того, если доступны подходящие аналитические методы, возможна характеристика и количественная оценка основных продуктов трансформации.
1 Область применения
Настоящий стандарт описывает методы для определения степени и кинетики первичного и окончательного биоразложения органических химических веществ, поступление которых в окружающую среду начинается с их сброса в сточные воды.
Данные методы могут быть предназначены для точной оценки биоразложения как новых, так и существующих химических веществ ([7], [8], [9], [10], [11], [12]), постоянно или периодически поступающих в сточные воды. В некоторых случаях результирующие кинетические константы могут служить в качестве исходных констант для модели воздействия, используемой при оценке риска. Данные методы могут использоваться для оценки биоразложения химических веществ, которые не разлагаются в предварительных испытаниях или для определения хода биоразложения для использования при оценке воздействия.
2 Основные положения
2.1 Общие принципы методов
2.1.1 Как правило, исследуемое вещество с меченым атомом в соответствующем положении инкубируют с образцом компонента окружающей среды, который был ранее отобран из соответствующего представительного места пробоотбора или получен в лаборатории в условиях, имитирующих реальные будущие условия окружающей среды. Для каждого исследуемого вещества и соответствующих условий готовят абиотические и биотические пробы. Биологическая активность подавляется в абиотическом контроле, который используется для оценки минерализации из разницы, определяющей эффективность экстракции, и извлечения исходного вещества и количественной оценки других процессов утраты исследуемого вещества, таких как гидролиз, окисление, испарение или сорбция, на экспериментальном оборудовании.
2.1.2 Если существует аналитический метод с требуемой чувствительностью, скорость разложения или трансформации исходного вещества может быть определена с использованием немеченого исследуемого вещества или путем отслеживания убывания химического вещества непосредственно в образце компонента окружающей среды. Окончательное биоразложение немеченых веществ не может быть определено, если ход биоразложения не изучен достаточно хорошо и аналитические методы с необходимой чувствительностью не доступны для потенциальных продуктов разложения.
2.1.3 Экологически значимые концентрации исследуемого вещества дозируются в абиотические и биотические тестовые системы. Подготовленные образцы инкубируют при соответствующей температуре и непрерывном перемешивании, при необходимости. Периодически из образцов отбираются пробы для определения минерализации и первичного биоразложения. Продолжительность испытания зависит от времени, необходимого для установления процесса окончательного биоразложения и определения скорости процесса биоразложения. Продолжительность испытания не обязательно отражает фактическое время пребывания химического вещества в конкретном объекте окружающей среды. Если результаты испытания используются для оценки экологического риска, соответствующее гидравлическое время удержания в объектах окружающей среды, используемое в испытании, должно основываться на сценарии конкретной оценки риска.
2.1.4 Тесты могут быть выполнены с использованием открытой системы или закрытой газовой проточной системы, в которой для улавливания выделяющихся ![]() или
или ![]() используются ловушки. Использование закрытой проточной системы является строго обязательным для летучих исследуемых веществ. Также использование закрытой системы обычно предпочтительно для
используются ловушки. Использование закрытой проточной системы является строго обязательным для летучих исследуемых веществ. Также использование закрытой системы обычно предпочтительно для меченых исследуемых веществ. Открытые системы используются для нелетучих
исследуемых веществ и определения кинетики процесса биоразложения нелетучих
исследуемых веществ, способность которых к минерализации была установлена ранее. В открытой системе минерализация до
![]() может быть определена косвенно путем измерения разности между остаточной радиоактивностью проб из биотических и абиотических образцов после подкисления. Также минерализация до
может быть определена косвенно путем измерения разности между остаточной радиоактивностью проб из биотических и абиотических образцов после подкисления. Также минерализация до ![]() может быть определена косвенно путем измерения разности в остаточной радиоактивности после сушки. Открытая система не подходит для тестирования летучих исследуемых веществ. В проточных системах выделившийся
может быть определена косвенно путем измерения разности в остаточной радиоактивности после сушки. Открытая система не подходит для тестирования летучих исследуемых веществ. В проточных системах выделившийся ![]() измеряется непосредственно в основной ловушке. Кроме того, растворенный
измеряется непосредственно в основной ловушке. Кроме того, растворенный ![]() определяется путем подкисления проб в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде. В анаэробных условиях выделяющиеся
определяется путем подкисления проб в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде. В анаэробных условиях выделяющиеся ![]() и
и ![]() собираются в каскад ловушек.
собираются в каскад ловушек. ![]() собирается в основной ловушке, а
собирается в основной ловушке, а ![]() сжигается и переводится в
сжигается и переводится в ![]() , который впоследствии улавливается аналогичным способом. Устройства для отбора газа также могут использоваться для улавливания газа из метантенка. Структура испытания зависит от типа радиоактивной метки (
, который впоследствии улавливается аналогичным способом. Устройства для отбора газа также могут использоваться для улавливания газа из метантенка. Структура испытания зависит от типа радиоактивной метки ( или
), компонента окружающей среды и свойств исследуемого вещества.
2.1.5 Пробы, отобранные из биотического и абиотического образца, анализируют на общую радиоактивность, извлекаемые исходное вещество и продукты разложения, радиоактивность извлеченных веществ. Содержание исходного вещества и продуктов разложения определяется с помощью хроматографического разделения и радиоаналитических методов обнаружения. Твердые вещества, оставшиеся после экстракции, сжигают для оценки включения в биомассу или могут быть фракционированы в дальнейшем для определения включения в различные компоненты биомассы. Полный материальный баланс тестовой системы получают из совокупности всех фракций для каждой пробы.
2.1.6 Содержание оставшегося исходного вещества в дальнейшем может быть проанализировано с использованием различных моделей разложения для оценки скорости первичного биоразложения. Кроме того, общий уровень минерализации может быть проанализирован с использованием различных моделей данного процесса для оценки скорости минерализации (см. 3.6.2.1-3.6.2.3).
2.2 Применимость и ограничения методов
Различные методы предназначены для оценки биологического разложения в основные фазы переноса сточных вод, а также во время обработки и поступления в окружающую среду. Выбор теста должен быть основан на процессе поступления в окружающую среду и ожидаемых свойствах исследуемого вещества. В случае исследования летучих химических веществ необходимо использовать соответствующую модификацию теста для оценки потерь вследствие испарения.
Методы не включают в себя удаление азота и фосфора.
2.2.1 Биоразложение в системе сточных вод
Цель данного испытания заключается в оценке биоразложения в необработанных сточных водах в условиях, в которых они обычно находятся в канализационных системах. Выполнение этого теста полезно, если время пребывания в канализации является достаточным для значительного биоразложения или утраты химического вещества. Поэтому данное испытание, как правило, наиболее полезно для относительно лабильных химических веществ, поступающих в крупные канализационные системы. Кроме того, в тесте могут быть получены данные для определения концентрации химических веществ, адсорбирующихся на первичном осадке (шламе). В данном испытании используется концентрация исследуемого вещества, соответствующая ожидаемому содержанию в сточных водах, и количество биомассы, которое обычно присутствует в представительном образце сточных вод. Несмотря на то что в тестовой системе присутствует кислород, для имитации содержания растворенного кислорода в канализационной системе проводят минимальную аэрацию тестовой системы.
2.2.2 Биоразложение в системе активного ила
Цель данного испытания заключается в оценке биоразложения во время широко используемого процесса биологической очистки сточных вод. Метод применим для любого химического вещества, подвергаемого соответствующей очистке, и имеет важное значение для определения окончательного состава сточных вод. Как правило, данный тест является первым и наиболее важным тестом серии. Данный тест характеризуется высоким содержанием биомассы и относительно низким содержанием исследуемого химического вещества в условиях хорошей аэрации. Динамическому моделированию процесса очистки на очистных сооружениях, в котором может быть определено удаление исследуемого химического вещества при определенных условиях (например, гидравлическом времени удержания, времени удержания твердых веществ, содержании твердых веществ и т.д.). Данный метод позволяет получить константы скорости первого порядка для удаления исходного вещества и минерализации, которые могут быть использованы в качестве информационной составляющей для большого числа моделей сточных вод, для оценки удаления при любом наборе условий.
2.2.3 Биоразложение при анаэробном сбраживании осадка (шлама)
Цель данного испытания заключается в оценке биоразложения во время анаэробного сбраживания осадка (шлама). Испытание особенно актуально для сорбирущихся химических веществ, которые могут распределяться в первичном и вторичном осадке. Данное испытание полезно для установления концентрации химического вещества, присутствующего в осадке очистных сооружений и обладающего потенциалом для анаэробного биоразложения. Данное испытание характеризуется восстановительными условиями, высоким содержанием анаэробной биомассы и содержанием исследуемого вещества, основанным на ожидаемой концентрации в сточных водах и способе распределения.
2.2.4 Биоразложение в смешанной системе: очищенные сточные воды - поверхностные воды
Цель данного испытания заключается в оценке биоразложения части химического вещества, которая после обработки попадает в составе сброса в поверхностные воды. Данное испытание может использоваться для демонстрации биоразложения, происходящего в очистных сооружениях и продолжающегося в окружающей среде. Метод основан на том принципе, что химическое вещество и микроорганизмы, разлагающие данное вещество, сбрасываются вместе в составе очищенных сточных вод. Результаты этого теста могут использоваться для оценки снижения концентрации химического вещества в результате биоразложения за время движения объема воды вниз по течению от станции очистки сточных вод. Данное испытание характеризуется очень низким содержанием как исследуемого вещества, так и биомассы и хорошей аэрацией. Данное испытание может использоваться для тестирования летучих веществ. Данный тест направлен на оценку первичного и окончательного биоразложения, а также образования и разрушения метаболитов химического вещества, поступающего в сточные воды.
2.2.5 Биоразложение в смешанной системе: неочищенные сточные воды - поверхностные воды
Цель данного испытания заключается в оценке биоразложения в неочищенных сточных водах, которые сбрасываются непосредственно в поверхностные воды. Данное испытание используют для определения относительной скорости биоразложения химических веществ по сравнению с другими органическими компонентами сточных вод. В условиях данного испытания содержание исследуемого вещества и биомассы основано на их ожидаемой концентрации в зоне смешения сточных и поверхностных вод. В системе присутствует кислород, но его содержание снижено из-за высокого уровня органической загрузки.
2.3 Информация об исследуемом веществе
2.3.1 В большинстве случаев для проведения данного испытания необходимы или
меченые исследуемые вещества. Для веществ с радиоактивной меткой может понадобиться использовать дополнительный немеченый материал для достижения требуемой тестовой концентрации. Для веществ с низкой специфической активностью чувствительность метода может быть частично улучшена за счет увеличения объема проб для анализа.
2.3.2 Для радиоактивная метка должна быть локализована в наиболее стабильной части молекулы для наиболее полного контроля образования и распада метаболитов. Для больших или комплексных молекул, содержащих несколько функциональных групп, может быть целесообразным проведение повторных испытаний с меткой в различных частях молекулы. В других случаях более подходящим может быть размещение метки в части молекулы, преобразования которой изучены плохо. Так или иначе, при интерпретации результатов необходимо учитывать положение метки по отношению к минерализации и получаемым продуктам разложения.
2.3.3 Для нелетучих веществ метки могут быть альтернативой
из соображений экономии или практического синтеза.
метки часто приводят к случайному или равномерному распределению атомов трития в молекуле. Важно также учитывать, что изотопы трития могут обмениваться с атомами водорода в воде [13]. Эти два обстоятельства должны приниматься во внимание при интерпретации минерализации и полученных метаболитов.
2.3.4 Немеченые исследуемые вещества могут использоваться для определения скорости разложения исходных веществ или трансформаций, если доступен аналитический метод с требуемой чувствительностью.
2.3.5 Для подготовки испытания важной является следующая информация:
- растворимость в воде [14];
- растворимость в органических растворителях (вещества, применяемые с растворителем или обладающие низкой растворимостью в воде);
- константа диссоциации (), если вещество способно принимать или отдавать протон (протонирование или депротонирование) [15];
- давление паров [16] и/или константа Генри;
- химическая стойкость в воде и в темноте (гидролиз) [17];
- концентрация в окружающей среде, если она известна или оценена;
- токсичность исследуемого вещества для микроорганизмов [18];
- биоразлагаемость [19], [20] и/или присущая способность к биоразложению [21]-[23];
- фотолиз;
- распределение в различных средах.
2.4 Стандартное вещество
В качестве стандартного вещества может использоваться вещество, которое, как правило, легко поддается разложению в условиях испытания. Целью использования подобного стандартного вещества является проверка активности микроорганизмов в тестовой системе. Кроме того, вещества, преобразования которых в окружающей среде хорошо изучены, могут использоваться в качестве стандарта для сравнения с результатами испытания. Хотя использование стандартного вещества не требуется, испытание со стандартным веществом может дать полезную информацию для интерпретации результатов теста.
2.5 Критерии качества испытания
2.5.1 Достоверность испытания
2.5.1.1 Материальный баланс, полученный в ходе абиотического испытания, используется для подтверждения извлечения исходного вещества из тестовой системы. Рекомендуется проводить сокращенные предварительные исследования до проведения определяющего испытания при установлении соответствующего способа экстракции для исходного вещества и продуктов разложения. Целевое извлечение из тестовой матрицы должно составлять от 85% до 110%, однако эти диапазоны не должны использоваться в качестве критериев для признания результатов теста действительными. Если извлечение исследуемого вещества из начальных проб, отобранных из абиотического образца, находится в целевом диапазоне, процедуры подготовки проб являются пригодными для извлечения исходного вещества из тестовой матрицы. Низкие показатели извлечения в абиотических испытаниях могут быть связаны с низкой эффективностью экстракции, сорбцией на стеклянной посуде или химической деградацией (см. ниже).
2.5.1.2 Полное извлечение радиоактивности в абиотических и биотических испытаниях, как правило, находится в диапазоне от 75% до 115% в каждой отдельной пробе, и среднее полное извлечение для всех проб в образце находится в диапазоне от 85% до 110%. Эти диапазоны не должны использоваться в качестве критериев для признания результатов теста. Если материальный баланс, полученный в ходе абиотического испытания, находится в целевом диапазоне, но материальный баланс, полученный в ходе биотического испытания, значительно ниже данного диапазона, меньшее извлечение, возможно, связано с неспособностью эффективного улавливания ![]() , восстановлением продуктов разложения или убылью продуктов разложения за счет сорбции на стеклянной посуде или испарения.
, восстановлением продуктов разложения или убылью продуктов разложения за счет сорбции на стеклянной посуде или испарения.
2.5.1.3 Если химический анализ абиотических контрольных проб показывает, что исходное вещество не подвергалось преобразованиям в течение всего испытания, биоразложение в биотическом испытании можно объяснить микробной активностью. Если в абиотическом испытании демонстрируется разложение исходного вещества с течением времени, интерпретация данных результатов может включать в себя описание/объяснение вероятных абиотических процессов, которые происходили. Сравнение степени разложения исходного вещества и образования метаболитов, наблюдаемых в обоих испытаниях, представляет собой оценку степени биологического разложения по сравнению с химической деградацией в биотическом испытании с учетом того, что потери не являются следствием подготовки образцов.
2.5.2 Чувствительность аналитических методов
Если возможно, расчетный нижний предел чувствительности аналитического метода для исследуемого вещества и продуктов преобразования должен составлять менее 1% от исходной концентрации исследуемого вещества, добавленной к тестовой системе. Если возможно, предел количественного обнаружения должен быть более или равным 3% от добавленной концентрации.
2.5.3 Результаты испытания стандартного вещества
При использовании стандартного вещества результаты испытания с ним должны приблизительно соответствовать результатам, на основе которых был сделан выбор в пользу использования данного вещества.
2.6 Данные и отчет о проведении испытания
2.6.1 График зависимости результатов испытания от времени
Для каждого образца сообщается точное время инкубации, включая время, необходимое для прекращения биологической активности, при необходимости. Также для каждого времени отбора проб сообщается процент от исходной радиоактивности, извлеченный с исходным веществом, продуктами разложения и твердыми веществами, а также общая минерализация и общий материальный баланс. Строят график зависимости данных показателей от времени для абиотического и биотического испытания, когда это необходимо.
2.6.2 Кинетический анализ (по выбору)
2.6.2.1 В некоторых случаях рекомендуется сопоставлять результаты данных испытаний с известными кинетическими моделями. Данные модели могут включать модели распада для исходных веществ и модели образования для процесса минерализации (например, ![]() или
или ![]() ). Наиболее распространенными и полезными моделями для данной цели являются модели первого порядка. Большинство моделей воздействия используют скорости первого порядка в качестве основных исходных параметров.
). Наиболее распространенными и полезными моделями для данной цели являются модели первого порядка. Большинство моделей воздействия используют скорости первого порядка в качестве основных исходных параметров.
2.6.2.2 Кинетические модели первого порядка предполагают, что константа скорости реакции зависит только от концентрации исследуемого вещества. Реальные условия первого порядка получают, когда содержание исследуемого вещества ниже концентрации, при которой происходит насыщение биологической активности системы. По мере того как концентрация исследуемого вещества превышает насыщение, данные все еще могут соответствовать функции первого порядка, но данные скорости квазипервого порядка будут ниже истинной скорости первого порядка. Такая кинетика квазипервого порядка может возникать при необходимости исследовать более высокие концентрации по сравнению с in situ вследствие аналитических ограничений или просто смоделировать фактические условия in situ.
2.6.2.3 Когда разложение происходит экспоненциально и началу данного разложения не предшествует лаг-фаза, в течение которой происходит незначительное разложение или не происходит разложение вообще, может быть возможным отнести данные образования или распада к кинетике первого порядка. При таких обстоятельствах процент оставшегося исходного вещества, как функция времени, может соответствовать простой или двухкомпонентной функции первого порядка с использованием методов нелинейной регрессии. Данные уравнения имеют вид:
![]() .
.
(1)
![]() ,
,
где - процент оставшегося исходного вещества в момент времени
;
- процент разложившегося исходного вещества с константой скорости первого порядка
;
- процент разложившегося исходного вещества с константой скорости первого порядка
.
Такое описание кривой может быть достигнуто с использованием нелинейных методов. Двухкомпонентная модель полезна, если процесс биоразложения является двухфазным для двух различных форм исследуемого вещества (например, растворенной и сорбированной), присутствующих в тестовой системе и демонстрирующих различные скорости биоразложения.
2.6.2.4 Таким же образом данные минерализации могут соответствовать простой или двухкомпонентной модели первого порядка:
![]() .
.
(2)
![]() ,
,
где - процент минерализованного вещества в момент времени
;
- процент минерализованного вещества с константой скорости первого порядка
;
- процент минерализованного вещества с константой скорости первого порядка
.
2.6.2.5 В некоторых случаях биоразложение, в частности утрата исходного вещества, может произойти так быстро, что истинный нулевой момент времени не может быть измерен в биотическом испытании. В таких случаях данные абиотического испытания могут использоваться для представления нулевого времени для кинетического анализа.
2.6.2.6 Когда наблюдается кинетика первого порядка, период полураспада можно рассчитать по оцененным скоростям первого порядка ( или
) для каждого компонента (А или В), используя следующее уравнение:
![]() , (3)
, (3)
где - период полураспада;
- константа скорости первого порядка.
2.6.2.7 В некоторых случаях наблюдаемые данные могут соответствовать ряду других моделей, таких как Monod, или другим моделям роста, что выходит за рамки настоящего стандарта. Дополнительные подробности о кинетике биоразложения представлены в докладе рабочей группы по кинетике биоразложения [24]. Период полураспада относится только к веществам, соответствующим модели первого порядка. При отсутствии кинетики первого порядка может быть целесообразным сообщить время разложения для 50% (DT) и 90% (DT
) исследуемого материала, если данные уровни разложения наблюдаются в ходе испытания. Эти значения могут быть определены непосредственно или оценены с использованием стандартных процедур интерполяции.
2.6.2.8 Когда данные соответствуют модели, модельное уравнение и программное обеспечение, используемое для сопоставления с моделью, должны быть указаны. Должны быть представлены коэффициент корреляции (), полученное значение критерия Фишера (F-критерия), при наличии, и участок кривой с фактическими данными. Оцененные константы скорости (
или
) и другие параметры (
и
) следует указывать со стандартными отклонениями.
2.7 Отчет о проведении испытания
Тип исследования, т.е. сточные воды, активный ил, зона смешения или анаэробное сбраживание шлама, должен быть четко указан в отчете о проведении испытания наряду со следующей информацией, в соответствующих случаях:
2.7.1 Исследуемое вещество:
- общепринятое наименование, химическое наименование, номер CAS, структурная формула и соответствующие физико-химические свойства исследуемого и стандартного веществ;
- химические наименования, номера CAS, структурные формулы и соответствующие физико-химические свойства веществ, используемых в качестве стандартов для идентификации продуктов разложения;
- чистота и характер известных примесей исследуемого и стандартного веществ;
- радиохимическая чистота и специфическая активность меченых химических веществ;
- положение в молекуле меченых атомов.
2.7.2 Образцы окружающей среды:
- источник образцов окружающей среды, в том числе географиическое положение и соответствующие данные об известном предшествующем или существующем воздействии химических испытаний или соответствующих материалов;
- способ оценки соответствующих концентраций в окружающей среде;
- время, дата и полевые условия сбора образцов;
- температура, pH, содержание растворенного кислорода (РК) и окислительно-восстановительный потенциал, при необходимости;
- содержание взвешенных веществ, биологическое потребление кислорода (), химическое потребление кислорода (
), общий органический углерод (
) и растворенный органический углерод (
) при необходимости;
- время между сбором и использованием образцов в лабораторных испытаниях, условия хранения и предварительной обработки образцов до начала испытания.
2.7.3 Условия проведения испытания:
- дата проведения испытания;
- используемое количество исследуемого и стандартного веществ, тестовая концентрация;
- способ применения испытуемого вещества и соответствующее логическое обоснование его выбора;
- условия инкубации, включая свет, тип аэрации и температуру;
- сведения об аналитических методах и методах, используемых для радиохимических измерений;
- количество повторных проб.
2.7.4 Результаты:
- точность и чувствительность аналитических методов, включая предел обнаружения и предел количественного определения;
- извлечение для каждого анализа и распространение внесенной радиоактивности в каждый момент времени отбора проб и образца в табличной форме;
- средний материальный баланс со стандартным отклонением для всех временных точек для каждого образца;
- процедуры и модели, используемые для оценки скорости биоразложения из полученных данных;
- скорости биоразложения и связанные параметры с соответствующими стандартными отклонениями и коэффициентами корреляции () и F-критерием для выбранных моделей;
- дополнительные характеристики или идентификация любого из основных продуктов разложения, когда это целесообразно и возможно, предлагаемые пути трансформации;
- обсуждение результатов.
3 Биоразложение в системе сточных вод
3.1 Область применения
3.1.1 Настоящий метод предназначен для исследования темпов первичного и окончательного биоразложения для химических веществ в неочищенных сточных водах во время их нахождения в канализационной системе. Он основан на методике, описанной в [7]. Сточные воды содержат большое количество микроорганизмов, способных разлагать различные химические вещества. Продолжительность теста, как правило, небольшая (менее 96 часов) для имитации времени пребывания сточных вод в канализационной системе, но испытание можно продлить для оценки степени разложения химического вещества в результате воздействия микроорганизмов. Проведение данного исследования полезно, если время пребывания сточных вод в канализационной системе достаточно для значительного разложения химического вещества. Тест применим для относительно лабильных химических веществ, сбрасываемых со сточными водами в крупные канализационные системы. Уровни аэрации в канализационной системе могут значительно изменяться. Для постоянства и имитации более типичных условий тест проводится при низком содержании растворенного кислорода () меньше 1 мг/л. Для достижения данного уровня, но избегая полного отсутствия кислорода (например, содержание
меньше 0,2 мг/л),
или соответствующую концентрацию кислорода в свободном пространстве тестового сосуда необходимо периодически контролировать. Для поддержания
в данном диапазоне в тестовые сосуды можно периодически добавлять воздух, кислород или азот.
3.1.2 Для существующих химических веществ, постоянно присутствующих в сточных водах, инкубирование свежесобранных сточных вод со следовым количеством меченого исследуемого вещества обеспечивает получение самых реалистичных кинетических параметров в отношении текущей загрузки химических веществ. Для химических веществ, не всегда присутствующих в сточных водах, достаточное количество исследуемого вещества (меченого и немеченого) необходимо добавить до приблизительно ожидаемой концентрации в сточных водах во время эпизодического выпуска или после коммерциализации новых химических веществ. Такая концентрация отражала бы общую массу сброса химического вещества и объем сточных вод, в котором происходит разбавление сброса. В [25] и [26] можно найти подходы для оценки концентрации в сточных водах. В большинстве случаев химическое вещество и продукты его разложения не находятся в равновесном состоянии, и наблюдается кинетика квазипервого порядка или второго порядка Monod.
3.2 Общая процедура испытания
3.2.1 Химическое вещество инкубируют с абиотическими и биотическими сточными водами в течение определенного периода времени в условиях низкого содержания (). Биологическая активность подавляется при абиотическом контроле, который используется для оценки минерализации по разнице, определяющей эффективность экстракции и восстановления исходной молекулы, и количественного описания других процессов разложения, таких как гидролиз, окисление, испарение или сорбция на экспериментальном оборудовании.
3.2.2 Если определен аналитический метод с необходимой чувствительностью, скорость разложения или трансформации исходного вещества может быть определена с использованием немеченого исследуемого вещества или по последующей убыли химического вещества непосредственно в сточных водах. Тем не менее окончательное биоразложение не может быть определено, если путь биоразложения не известен достаточно хорошо и для потенциальных продуктов разложения не доступны аналитические методы с необходимой чувствительностью.
3.2.3 Экологически значимые концентрации исследуемого вещества дозируются в абиотические и биотические тестовые системы, которые инкубируются с непрерывным медленным перемешиванием. Биотические образцы инкубируются таким образом, что содержание растворенного кислорода остается на уровне или ниже 1 мг/л, что является стандартным для сточных вод. Образцы периодически удаляются для определения минерализации и первичной биодеградации.
3.2.4 Тесты могут быть выполнены с использованием открытой или герметичной проточной системы, где используются ловушки для улавливания выделяющегося ![]() . Закрытая проточная система является обязательной для летучих исследуемых веществ и обычно используется для
. Закрытая проточная система является обязательной для летучих исследуемых веществ и обычно используется для меченых исследуемых веществ. Открытые системы применимы для нелетучих химических веществ
и предназначены для детализации кинетики процесса биоразложения нелетучих
меченых исследуемых веществ, чья способность к минерализации была установлена ранее. В открытой системе минерализация до
![]() может быть определена косвенно путем измерения разности между остаточной радиоактивности образцов биотической и абиотической систем после подкисления. Кроме того, минерализация до
может быть определена косвенно путем измерения разности между остаточной радиоактивности образцов биотической и абиотической систем после подкисления. Кроме того, минерализация до ![]() может быть определена косвенно путем измерения разницы в радиоактивности образцов после сушки. В проточных системах выделяющийся
может быть определена косвенно путем измерения разницы в радиоактивности образцов после сушки. В проточных системах выделяющийся ![]() измеряется непосредственно в основной ловушке. Кроме того, растворенный
измеряется непосредственно в основной ловушке. Кроме того, растворенный ![]() определяется путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
определяется путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
3.2.5 Образцы из обоих испытаний анализируют на общую радиоактивность, извлекаемые исходное вещество и продукты разложения, и радиоактивность извлекаемых твердых веществ. Содержание исходного вещества и продуктов разложения определяется с помощью хроматографического разделения и, если возможно, радиоаналитических методов обнаружения. Твердые вещества, остающиеся после процесса экстракции, сжигают для оценки включения в биомассу по разнице или в дальнейшем разделяют на фракции для определения поглощения различными компонентами биомассы. Полный массовый баланс тестовой системы получают из полной суммы всех фракций для каждого образца.
3.3 Применимость теста
Метод можно легко использовать для растворимых в воде или плохо растворимых материалов, которые не являются летучими. Метод также может быть адаптирован для летучих веществ. Как правило, для оценки минерализации требуются или
- радиоактивные метки. Для оценки первичного биоразложения можно использовать и меченые, и немеченые соединения.
3.4 Описание метода испытания
3.4.1 Экспериментальная установка
3.4.1.1 Объем сточных вод в тестовой пробе определяется в зависимости от количества и объема образцов, необходимых для оценки. Как правило, от 1 до 2 л сточных вод помещаются в двух- или четырехлитровые колбы. В наилучшем случае сточные воды инкубируют при контролируемом содержании (обычно от 0,2 до 1,0 мг/л.) Выполнение данного условия можно обеспечить с помощью кислородного зонда, погруженного в сточную воду и соединенного с кислородным контроллером, подключенным к приводу клапана, который контролирует аэрацию сточных вод (приложение А). Такая аэрация сбалансирована с непрерывным барботированием сточных вод азотом для достижения целевого уровня
. Сточные воды можно инкубировать при перемешивании, но с минимальной аэрацией для соблюдения низкого уровня
, для поддержания необходимого уровня
в тестовую систему можно периодически добавлять азот или воздух. В этом случае значения
необходимо регистрировать с регулярными интервалами.
3.4.1.2 Открытая тестовая система связана с атмосферой, но инкубируется в условиях, которые необходимы для поддержания содержания растворенного кислорода на требуемом уровне. Проточные системы закупорены соответствующим устройством, оборудованным пробоотборным отверстием с клапаном для отбора образцов сточных вод и пропускания входящих и исходящих газовых потоков. Данное устройство может представлять собой резиновую пробку, но может потребоваться и альтернативный вид заглушки при работе с летучими гидрофобными тестовыми веществами. При тестировании летучих веществ рекомендуется, чтобы газоотводы и трубки пробоотборника были изготовлены из инертных материалов [например, политетрафторэтилен (ПТФЭ), нержавеющая сталь, стекло].
3.4.1.3 Свободное пространство тестового сосуда постоянно продувается газом со скоростью, достаточной для поддержания в сточных водах необходимого уровня РК, но не слишком большой для предотвращения эффективного уноса . Тестовый сосуд соединяют с серией ловушек, содержащих гидроксид калия (например, 1,5 н.) или других соответствующих абсорбентов
. Пустые ловушки, как правило, включаются в систему улавливания для предотвращения обратного тока или конденсации.
3.4.2 Оборудование
3.4.2.1 Для проведения испытания используют следующее стандартное лабораторное оборудование:
- различная стеклянная посуда и пипетки;
- магнитные мешалки или шейкер для непрерывного перемешивания содержимого тестовых колб;
- центрифуга;
- pH-метр;
- твердый (сухой лед)/ацетон или ванна жидкого азота;
- сушилка с заморозкой (лиофилизатор);
- печь или микроволновая печь для определения сухого веса;
- аппарат для мембранной фильтрации;
- автоклав;
- средства для обработки меченых веществ;
- оборудование для количественного определения и
в жидких и твердых пробах (например, жидкий сцинтилляционный счетчик LSC);
- оборудование для количественного определения и
в твердых пробах (например, окислитель);
- оборудование для улавливания летучих и
из газовой системы улавливания (последовательные ловушки на основе активированного угля или аналогичное оборудование);
- оборудование для тонкослойной хроматографии (ТСХ) или высокоэффективной жидкостной хроматографии (ВЭЖХ);
- оборудование для количественного определения и
для ТСХ (сканер) или ВЭЖХ (последовательный детектор);
- аналитическое оборудование для определения исследуемого (и стандартного) вещества, если необходимо проведение конкретного химического анализа (например, газовый хроматограф, хроматограф для ВЭЖХ, масс-спектрометр).
3.4.2.2 Использование следующего лабораторного оборудования не является обязательным, но может быть полезным:
- оксиметр;
- кислородный контроллер с датчиком и приводом клапанов;
- сосуды для определения химической потребности в кислороде ();
- набор реагентов (аммонийный азот);
- спектрофотометр.
3.4.3 Выбор сточных вод
Источники сточных вод должны соответствовать цели проведения испытаний. Для проведения оценки конкретного места сточные воды должны быть получены из конкретной канализационной системы, для которой проводится исследование. Для общей оценки образцы сточных вод должны быть преимущественно получены из бытовых источников. Рекомендуется использовать 450 мг/л твердой взвеси и 270 мг/л в качестве стандартных значений концентрации в сточных водах, хотя это может являться трудновоспроизводимым [26]. В Северной Америке типичные сточные воды содержат от 100 до 350 мг/л твердой взвеси и от 110 до 400 мг/л
[1].
3.4.4 Сбор, транспортировка и хранение сточных вод
Сточные воды должны быть собраны в точке доступа в канализацию или на входе на станцию очистки сточных вод. Температура образца должна быть зарегистрирована в момент отбора. Контейнеры для отбора должны обеспечивать достаточную вентиляцию. Необходимо предотвращать значительное повышение температуры сточных вод по сравнению температурой испытания. Сточные воды, как правило, хранятся при температуре испытания с непрерывным медленным перемешиванием. Образцы не следует хранить в замороженном виде.
3.4.5 Подготовка тестовых проб
3.4.5.1 В свежесобранных пробах сточных вод не должно быть значительного содержания грубых частиц. В сточных водах необходимо определить общее содержание взвешенных твердых частиц (),
, pH и
(по возможности).
3.4.5.2 Подготовка абиотических проб, как правило, осуществляется с использованием комбинации химической и тепловой стерилизации. Подтвержденным способом является добавление в сточные воды хлорида ртути (1 г/л). Затем сточные воды обрабатывают в автоклаве в течение минимум 90 минут при температуре и давлении около 121 °C и 15 psi (1 атм) соответственно. Обычно объем среды должен быть менее или равным половины объема контейнера для автоклава (например, 500 мл сточных вод в литровом контейнере). После охлаждения pH абиотической пробы необходимо измерить и отрегулировать в зависимости от вида биологически активного образца. Для уменьшения образования отходов, для деактивации образца также может быть рассмотрено использование альтернативных подходов.
3.4.6 Подготовка исследуемого вещества
3.4.6.1 В наилучшем случае для приготовления основных растворов исследуемого и стандартного веществ необходимо использовать дистиллированную воду. Альтернативный метод может быть использован для солюбилизации или диспергирования исследуемого вещества в соответствии с его обычной формой поступления в исследуемые компоненты окружающей среды. Растворимые в воде нетоксичные растворители могут использоваться, если проведение испытания невозможно другим способом, но необходимо уделить внимание органическим компонентам системы, поступающим в систему при добавлении органических растворителей. Кроме того, образцы могут быть добавлены в тестовую систему в чистом виде (т.е. без воды) таким образом, чтобы обеспечить их максимальное и быстрое внесение в образец. Для веществ, которые являются плохо растворимыми в воде, и взаимодействующих с взвешенными веществами в сточных водах, может быть целесообразным адсорбировать исследуемое вещество на инертном твердом носителе, который затем добавляется к тестовой системе. Если исследуемое вещество не может быть равномерно распределено внутри тестовой системы до начальной точки отбора проб, готовятся индивидуальные тестовые системы, которые исключают из испытания на каждом этапе отбора проб.
3.4.6.2 Объем добавленного раствора должен иметь достаточную концентрацию для обеспечения быстрого и равномерного распределения исследуемого вещества в пробе и точного внесения дозы в аналогичные пробы. В идеальном случае при дозировании водных растворов добавленный объем должен быть более 2 мл и менее 10 мл; для нетоксичных растворов - менее 0,1 мл/л. При необходимости раствор для дозирования может быть подготовлен заранее и храниться в холодильнике. Активность основного раствора необходимо проверить с помощью жидкостно-сцинтилляционного измерения (LSC).
3.5 Условия проведения испытания
3.5.1 Температура испытания
Инкубация должна проводиться в темноте (предпочтительно) или в рассеянном свете при контролируемой температуре, равной температуре испытания или нормальной лабораторной температуре от 20 до 25 °C, в зависимости от расположения, среднегодовой температуры сточных вод от 10 °C до 20,1 °C, при наиболее представительной температуре 15,6 °C [1].
3.5.2 Встряхивание/перемешивание
Для поддержания твердых веществ во взвешенном состоянии содержимое тестовых сосудов непрерывно аккуратно перемешивают.
3.5.3 Продолжительность испытания
Продолжительность испытания должна быть достаточной для оценки степени и скорости биоразложения химического вещества в ходе нормального времени пребывания сточных вод в канализации. Испытание может быть продлено на большее время для получения дополнительных данных для оценки кинетических констант или определения полноты разложения в условиях испытания. В ином случае испытание может быть прекращено раньше, если процесс разложения достигает плато.
3.5.4 Количество тестовых сосудов
Как минимум, для каждой тестовой концентрации необходимо использовать один абиотический и один биотический сосуд. Для каждой пробы можно подготовить параллельные образцы с целью учета отклонений (например, по три параллельных пробы). Однако увеличение количества проб для каждого образца лучше отразится на качестве кинетических данных, полученных в большем диапазоне, чем увеличение количества параллельных проб.
3.6 Процедура испытания
3.6.1 Дозирование
В начале испытания заглушка тестового сосуда удаляется, и исследуемое вещество добавляют количественно непосредственно к образцу при постоянном перемешивании. Рекомендуется вводить дозу постепенно ниже уровня воздух-вода для обеспечения равномерного распределения исследуемого вещества в сточной воде. Биотические и абиотические образцы дозируют аналогичным способом. Как правило, биотические системы дозируются первыми, а затем абиотические системы. Точное время, как правило, имеет более важное значение для биотических систем по сравнению с абиотическими для проведения кинетических анализов.
3.6.2 График отбора проб
Интервалы отбора проб выбирают, основываясь на существующих данных о биоразложении или результатах предварительного исследования, поскольку универсального установленного графика отбора проб не существует. Рекомендуемый график отбора проб для быстро разлагающихся химических веществ - 15, 30 и 60 минут, с дополнительным отбором проб через 2, 5, 8, 12 и 24 часа и во 2, 3 и 4-й дни. Пробы должны отбираться не менее шести раз (в том числе в нулевое время), с дополнительным предварительным исследованием, которое используется для установления надлежащего режима пробоотбора. График отбора проб для медленно разлагающихся химических веществ должен быть разработан так, чтобы в ходе фазы разложения было предусмотрено достаточное количество измерений.
3.6.3 Измерение минерализации
Минерализация может быть измерена прямыми или косвенными методами.
3.6.4 Косвенные измерения 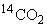
3.6.4.1 Индивидуальные параллельные образцы (например, 1 мл) отбирают из каждой пробы в отдельные флаконы, которые содержат достаточное количество кислоты (например, 1 мл 0,1 н. ) для снижения pH менее 2, и помещают в вытяжной шкаф.
3.6.4.2 В течение нескольких часов образцы барботируют воздухом или оставляют на ночь для того, чтобы растворенный ![]() диффундировал из образцов. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы образца, и анализируют с помощью жидкостной сцинтилляции (LSC). Процент
диффундировал из образцов. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы образца, и анализируют с помощью жидкостной сцинтилляции (LSC). Процент ![]() рассчитывается из разницы между общим отсчетом в биотических и абиотических образцах.
рассчитывается из разницы между общим отсчетом в биотических и абиотических образцах.
3.6.5 Прямые измерения 
3.6.5.1 Выделившийся ![]() : первая основная ловушка системы улавливания удаляется и закупоривается для предотвращения проникновения атмосферного
: первая основная ловушка системы улавливания удаляется и закупоривается для предотвращения проникновения атмосферного . Остальные ловушки продвигают вперед в том же порядке и за существующими ловушками размещают свежие ловушки, как можно скорее подключают систему улавливания. Повторные пробы (например, 1 мл) из основной ловушки удаляются, помещаются в сцинтилляционные флаконы и смешиваются со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью жидкостной сцинтилляции (LSC).
3.6.5.2 Пробы растворенного ![]() (например, от 10 до 25 мл) отбираются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент
(например, от 10 до 25 мл) отбираются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент (например, 1,5 н.
). Сосуды закупоривают и добавляют достаточное количество кислоты (например, 6 н.
) для снижения pH проб менее двух без сообщения проб с атмосферой (приложение А). Образцам позволяют отстояться в течение достаточно продолжительного времени (например, ночи), чтобы
диффундировал из раствора и произошло его улавливание абсорбентом из свободного пространства сосуда. Образцы абсорбента смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью жидкостной сцинтилляции (LSC).
3.6.6 Косвенные измерения 
3.6.6.1 Индивидуальные параллельные пробы (например, 1 мл) отбирают из тестового образца в отдельные флаконы, содержащие достаточное количество кислоты (например, 1 мл 0,1 н. ) для снижения величины pH<2, и помещают в вытяжной шкаф.
3.6.6.2 Половину проб немедленно анализируют с помощью LSC для "мокрого" измерения. Остальные пробы полностью сушат для удаления ![]() . Образцы смешивают со сцинтилляционной смесью, подходящей для матрицы пробы, и анализируют с помощью LSC. Процентное содержание
. Образцы смешивают со сцинтилляционной смесью, подходящей для матрицы пробы, и анализируют с помощью LSC. Процентное содержание ![]() рассчитывается исходя из разницы между общим отсчетом в мокрых и сухих пробах и исходным уровнем радиоактивности, введенным в образцы.
рассчитывается исходя из разницы между общим отсчетом в мокрых и сухих пробах и исходным уровнем радиоактивности, введенным в образцы.
3.6.7 Измерение общей радиоактивности в сточных водах
Параллельные пробы малого объема (например, 1 мл) анализируют непосредственно с помощью LSC для количественного определения оставшейся радиоактивности в каждом образце с течением времени. Данные измерения используются для подтверждения того, что восстановление радиоактивности из извлеченных образцов является приемлемым и для контроля испарения. Общее содержание твердых веществ в данных образцах не должно превышать 30 мг сухого веса для того, чтобы избежать проблем с эффективностью подсчета.
3.7 Измерение исходного вещества и продуктов разложения
3.7.1 Экстракция
3.7.1.1 Пробы отбирают из абиотических и биотических образцов. Объем пробы, как правило, составляет более 10 мл. Тем не менее объем будет зависеть от тестовой концентрации, удельной активности и чувствительности аналитических процедур.
3.7.1.2 Различные подходы могут использоваться для концентрирования и извлечения образцов. Например, подтвержденный подход для нелетучих исследуемых веществ включает мгновенное замораживание образцов с последующей лиофилизацией и экстракцией сухого остатка соответствующим растворителем(ями) для исходного вещества и продуктов разложения. Мгновенное замораживание быстро останавливает биологическую активность без гидролиза или иного изменения лабильных исследуемых веществ. Замораживание является быстрым процессом, если для погружения сосуда с образцом имеется достаточная глубина сухого льда/ацетона или ванны жидкого азота. Уровень заполнения ванны должен покрывать уровень пробы в сосуде. Извлекают лиофилизированные твердые вещества. Экстрагированные твердые вещества могут быть восстановлены из экстракта центрифугированием или фильтрованием. Если твердые вещества извлекаются фильтрацией, фильтр должен быть совместим с типом растворителя (например, водным или неводным). Полученные экстракты могут быть сконцентрированы испарением до анализа, и общая радиоактивность в каждом экстракте определяется с помощью LSC.
3.7.1.3 Для летучих исследуемых веществ образец может быть пропущен через фильтр и колонну или диск твердофазной экстракции (ТФЭ), расположенные в тандеме, которые затем элюируют подходящим растворителем для извлечения исходного вещества и продуктов разложения. Кроме того, образцы можно центрифугировать, и исходное вещество и продукты разложения могут быть извлечены из жидкости на твердой фазе или жидкость-жидкостной экстракцией. Твердые вещества могут быть извлечены непосредственно или в смеси с сушильным агентом (например, сульфатом натрия). Затем их сушат и проводят экстракцию с соответствующей системой растворителей. В альтернативном случае твердые вещества извлекают и сушат экстракт путем пропускания растворителя через колонку, содержащую сушильный агент. В некоторых случаях возможно напрямую извлекать полный водный образец с соответствующей системой растворителей, а затем обрабатывать его для извлечения твердых веществ. Общая радиоактивность во всех экстрактах определяется с помощью LSC. При концентрировании экстрактов, содержащих летучие исследуемые вещества или продукты разложения, необходимо соблюдать осторожность.
3.7.1.4 Могут использоваться и другие подходы, но для всех подходов важно регистрировать извлечение и учитывать время, необходимое для прекращения биологической активности, и использовать его для времени отбора проб для кинетического анализа.
3.7.2 Анализ исходного вещества и продуктов разложения
3.7.2.1 Относительно большое количество исходного вещества и продуктов разложения в экстрактах можно определять с помощью ТСХ, ВЭЖХ или других методов разделения с возможностью радиоактивного обнаружения.
3.7.2.2 Если доступны специфические чувствительные аналитические методы, первичное биоразложение можно оценить, измеряя общую остаточную концентрацию исследуемого вещества и продуктов разложения вместо использования радиоизотопных методов. Как правило, для таких исследований (без использования меченых атомов) возможно только отслеживание удаления исходного вещества из водной фазы.
3.7.3 Характеристика продуктов разложения
Хроматографическое поведение неизвестных пиков необходимо сравнивать с пиками для ожидаемых продуктов разложения, если существуют соответствующие аутентичные стандарты. В общем случае, количество и чистота продуктов разложения, полученных в настоящем испытании, делает невозможным проведение окончательной идентификации другими прямыми способами. В зависимости от хроматографического поведения, как правило, можно определить, является ли метаболит более или менее полярным, чем исходное вещество. Такая информация в сочетании с известными биохимическими реакциями и появлением и исчезновением метаболита в ходе биоразложения может сформировать дополнительную основу для идентификации. Если необходимо, основных продуктов разложения может быть оценено с помощью ВЭЖХ (например, [27]) с использованием параллельного детектора радиоактивности.
3.7.4 Измерение извлеченных твердых веществ и степени включения в биомассу
Извлеченные твердые вещества сжигают для определения уровня активности оставшихся твердых веществ. Уровень радиоактивности в биотических твердых веществах выше, чем в твердых телах из абиотического контроля, обычно является свидетельством включения радиоактивности в биомассу. Распространение данной радиоактивности в различных компонентах биомассы (т.е. нуклеиновых кислотах, белках, клеточных стенках и пр.) можно оценить, используя модифицированную процедуру Сазерленда и Уилкинсона [4], [28].
3.7.5 Измерение радиоактивности летучих веществ
Для летучих исследуемых веществ, летучие вещества извлекаются из ловушек соответствующими растворителями и радиоактивность экстрактов анализируется с помощью LSC. Относительное большое количество исходного вещества и продуктов разложения в экстракте(ах) может быть определено, как описано выше.
4 Биоразложение в системе активного ила
4.1 Область применения
4.1.1 Настоящий метод предназначен для оценки степени, в которой химическое вещество может разлагаться в активном иле, а также определения скорости первичного и окончательного биоразложения в условиях проведения испытания. Метод основан на процедуре, первоначально опубликованной в [8]. Обработка активным илом в его различных конфигурациях является наиболее распространенным вторичным процессом очистки сточных вод. Полезность измеряемых скоростей для точного прогнозирования удаления в текущем испытании с использованием моделей сточных вод (например, SimpleTreat) будет функцией точности моделирования реальных условий очистки сточных вод активным илом.
4.1.2 В настоящем методе концентрацию исследуемого вещества определяют четыре фактора:
1) сбрасывается ли вещество постоянно или эпизодически;
2) текущее присутствие в окружающей среде;
3) ожидаемое присутствие в окружающей среде для новых химических веществ;
4) аналитическая чувствительность.
4.1.3 Если химическое вещество уже постоянно присутствует в окружающей среде, наиболее точное описание кинетики процесса получают путем добавления следовых количеств меченого вещества к свежеотобранным образцам окружающей среды. В этих условиях стандартное соотношение химического вещества и разлагающих материалов не нарушается, что позволяет наблюдать скорости разложения, соответствующие скоростям in situ.
4.1.4 Если в будущем новое химическое вещество будет постоянно поступать в окружающую среду, наиболее точные значения скоростей получают, когда химическое вещество и популяция деструктора находятся в равновесном состоянии. Равновесное состояние может быть достигнуто путем добавления следовых количеств исследуемого вещества к активному илу, который подвергался воздействию химического вещества в ожидаемых условиях загрузки и управления в лабораторной непрерывной системе (например, [3]).
4.1.5 Если существующее или новое химическое вещество поступает в окружающую среду эпизодически, стандартного равновесного соотношения биомассы к содержанию исследуемого вещества не существует, таким образом, химическое вещество дозируется в свежеотобранный образец до ожидаемого уровня в сточных водах во время сброса. Данная концентрация должна отражать общую массу поступления и объем сточных вод для разбавления сброса. В [25] и [26] можно найти подходы для оценки концентрации в сточных водах.
4.1.6 Аналитическая чувствительность имеет преимущество над вышеизложенными положениями. Если невозможно использовать идеальные (например, меченые индикаторные) уровни исследуемого вещества из соображений аналитического определения, используют самую низкую возможную концентрацию. При высоких концентрациях исследуемого вещества биоразложение может быть связано с фазами, проходящими согласно процессам второго порядка (т.е. роста), которые осложняют кинетический анализ. Если данный стандарт для моделирования не достигается, наблюдаемые скорости биоразложения не могут быть полностью представительными, что может быть рассмотрено при интерпретации результатов. Данный фактор имеет особенно важное значение для химических веществ, которые постоянно поступают в окружающую среду и часто достигают равновесного состояния в системах сточных вод.
4.2 Общая процедура испытания
4.2.1 Исследуемое вещество инкубируют в абиотических и биотических условиях в активном иле в течение определенного периода времени. Биологическая активность подавляется в абиотическом контроле, который используется для оценки минерализации по разнице, устанавливающей эффективность экстракции и извлечения исходного вещества и количественного определения других процессов удаления вещества, таких как гидролиз, окисление, испарение или сорбция на экспериментальном оборудовании.
4.2.2 Если определен аналитический метод с требуемой чувствительностью, скорость разложения исходного вещества должна быть определена с использованием немеченого исследуемого вещества или по убыли химического вещества уже в сточных водах. Тем не менее окончательное биоразложение не может быть определено, если путь биоразложения не установлен достаточно хорошо и для потенциальных продуктов разложения не доступны аналитические методы с необходимой чувствительностью.
4.2.3 Экологически значимые концентрации исследуемого вещества дозируются в абиотические и биотические тестовые системы, которые инкубируют при соответствующей температуре и непрерывном перемешивании, при необходимости. Для определения минерализации и первичного биоразложения периодически отбирают пробы.
4.2.4 Тесты могут быть выполнены с использованием открытой системы или закрытой проточной системы, в которой установлена система ловушек для улавливания выделяющегося ![]() . Закрытую проточную систему необходимо использовать для летучих исследуемых веществ и обычно предпочтительно для
. Закрытую проточную систему необходимо использовать для летучих исследуемых веществ и обычно предпочтительно для меченых исследуемых веществ. Открытые системы применимы для нелетучих
исследуемых веществ и для детального описания кинетики биоразложения нелетучих
исследуемых веществ, чья способность к минерализации была установлена ранее. В открытой системе минерализация до
![]() может быть определена косвенно путем измерения разности между остаточной радиоактивностью проб из биотических и абиотических образцов после подкисления. Кроме того, минерализация до
может быть определена косвенно путем измерения разности между остаточной радиоактивностью проб из биотических и абиотических образцов после подкисления. Кроме того, минерализация до ![]() может быть определена косвенно путем измерения разницы в радиоактивности образца после сушки. В проточных системах выделившийся
может быть определена косвенно путем измерения разницы в радиоактивности образца после сушки. В проточных системах выделившийся ![]() измеряется напрямую в основной ловушке. Кроме того, растворенный
измеряется напрямую в основной ловушке. Кроме того, растворенный ![]() определяется путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
определяется путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
4.2.5 Пробы, отобранные из двух образцов, анализируют на общую радиоактивность, извлекаемое исходное вещество и продукты распада и радиоактивность извлеченных веществ. Содержание исходного вещества и продуктов разложения определяется с помощью хроматографического разделения и, если возможно, радиоаналитических методов обнаружения. Твердые вещества, оставшиеся после процесса экстракции, сжигают для оценки включения в биомассу путем разницы или могут быть извлечены при дальнейшей экстракции с помощью процедуры Сазерленда и Уилкинсона [4], [25] для определения включения в различные компоненты биомассы. Общий материальный баланс тестовой системы получают из совокупности всех фракций в каждом образце.
4.3 Применимость метода
Метод может легко применяться для растворимых в воде или плохо растворимых веществ, которые являются нелетучими. Он также может быть адаптирован для летучих веществ. Как правило, или
радиоактивная метка требуется для оценки минерализации. Как меченые, так и немеченые соединения могут быть использованы для оценки первичного биоразложения.
4.4 Описание метода испытания
4.4.1 Экспериментальная установка
4.4.1.1 Объем активного ила в тестовой пробе определяется в зависимости от количества и объема образцов, необходимых для оценки. Как правило, от 1 до 2 л активного ила помещают в двух- или четырехлитровые колбы. Открытые тестовые системы, как правило, закрывают пенной или хлопковой пробкой для минимизации потерь вследствие испарения воды. Проточные системы закупоривают соответствующей пробкой, оборудованной отверстием для отбора проб с клапаном для отбора смешанных жидких проб и пропускания исходящих и входящих газовых потоков (см. приложение А). В качестве пробки может использоваться резиновая пробка, но при работе с летучими гидрофобными исследуемыми веществами рекомендуется использовать стекло. При тестировании летучих веществ также рекомендуется, чтобы газовые и пробоотборные трубки были изготовлены из инертных материалов (например, ПТФЭ, нержавеющая сталь, стекло).
4.4.1.2 Свободное пространство тестового сосуда непрерывно барботируют воздухом или без содержания воздуха со скоростью, достаточной для поддержания активного ила в аэробных условиях, но не слишком большой для предотвращения эффективного уноса
. Тестовый сосуд соединен с серией ловушек, содержащих гидроксид калия (например, 1,5 н.) или другие соответствующие абсорбенты
. Пустые ловушки, как правило, включаются в систему улавливания для предотвращения обратного тока или конденсации.
4.4.2 Оборудование
Используются следующие виды стандартного лабораторного оборудования:
- различная стеклянная посуда и пипетки;
- магнитные мешалки или шейкер для непрерывного перемешивания содержимого тестовых колб;
- центрифуга;
- pH-метр;
- твердый (сухой лед)/ацетон или ванна жидкого азота;
- сушилка с заморозкой (лиофилизатор);
- печь или микроволновая печь для определения сухого веса;
- аппарат для мембранной фильтрации;
- автоклав;
- средства для обработки меченых веществ;
- оборудование для количественного определения и
в жидких и твердых пробах (например, жидкий сцинтилляционный счетчик LSC);
- оборудование для количественного определения и
в твердых пробах (например, окислитель);
- оборудование для улавливания летучих и
из газовой системы (последовательные ловушки на основе активированного угля или аналогичное оборудование);
- оборудование для тонкослойной хроматографии (ТСХ) или ВЭЖХ;
- оборудование для количественного определения и
для ТСХ (сканер) или ВЭЖХ (последовательный детектор);
- аналитическое оборудование для определения исследуемого (и стандартного) вещества, если необходимо проведение конкретного химического анализа (например, газовый хроматограф, хроматограф для ВЭЖХ, масс-спектрометр).
4.4.3 Выбор источника активного ила
4.4.3.1 Источник активного ила должен соответствовать цели проведения испытания. Для конкретной оценки места отбора образца активный ил должен быть получен из конкретной исследуемой станции очистки сточных вод. Для общей оценки активный ил должен быть получен от стандартной станции очистки сточных вод, перерабатывающей преимущественно бытовые сточные воды. Если исследуемое вещество является постоянным компонентом сточных вод, поступающих на станцию очистки сточных вод, или эпизодически попадает в сточные воды, необходимо использовать для проведения испытания свежеотобранный активный ил.
4.4.3.2 Для новых химических веществ, которые будут непрерывно поступать в сточные воды, активный ил в идеальном случае должен быть получен от лабораторной системы очистки сточных вод [3], на которую подаются сточные воды с содержанием немеченого исследуемого вещества. Источник исходного ила, сточные воды (приток) и условия испытания (исходная концентрация, гидравлическое время удержания, время удержания твердых веществ) для лабораторной установки должны точно отражать специфические или общие свойства места, для которого проводится исследование. В последнем случае в [3] указывается среднее гидравлическое время удержания 6 часов, а среднее время удержания ила от 6 до 10 дней. В Европейском техническом руководстве приводятся подходы для оценки концентрации в сточных водах на основе ожидаемых уровней использования [26]. В целом, равновесное состояние будет достигнуто в течение от двух- до трехкратного периода времени удержания твердых веществ, после чего ил может использоваться для испытания.
4.4.4 Сбор, транспортировка и хранение активного ила
Активный ил необходимо отбирать из области аэротенка с хорошим перемешиванием. В момент отбора должна регистрироваться температура образца. Контейнеры для сбора должны обеспечивать достаточную вентиляцию, необходимо предотвращать значительное повышение температуры образца ила по сравнению с температурой испытания. Активный ил, как правило, хранится при температуре испытания и постоянной аэрации. Образцы не должны храниться в замороженном виде.
4.5 Подготовка тестовых проб
4.5.1 Активный ил
4.5.1.1 Активный ил до использования необходимо просеять через 2 мм сито. Общее содержание взвешенных твердых веществ (ВВ) должно быть измерено и при необходимости скорректировано до необходимой концентрации. В Европейском техническом руководстве по умолчанию используется уровень 4000 мг/л для стандартного случая [26]. Для Северной Америки более типичными могут быть концентрации в диапазоне от 2500 до 3000 мг/л [1]. Ил может быть разбавлен жидкостью или водопроводной водой, если концентрация твердых веществ слишком высока. В ином случае, если концентрация твердых веществ является слишком низкой, проводят осаждение твердых веществ и удаляют лишнюю жидкость. Необходимо определить окончательное содержание ВВ и pH полученного ила.
4.5.1.2 Подготовка абиотического ила обычно выполняется с использованием комбинации химической и термической стерилизации. Подтвержденный подход заключается в добавлении раствора хлорида ртути (1 г/л) к активному илу, который затем подвергают обработке в автоклаве в течение минимум 90 минут при температуре и давлении около 121 °C и 15 psi (1 атм) соответственно. Обычно объем среды составляет менее или равно половины объема контейнера для обработки в автоклаве (например, 500 мл активного ила на литровый контейнер). После охлаждения pH абиотического ила необходимо измерить и отрегулировать до показателя биологически активного ила. Для уменьшения накопления специфических отходов, для деактивации активного ила также могут быть рассмотрены альтернативные подходы.
4.5.2 Подготовка исследуемого вещества
4.5.2.1 В идеальном случае для подготовки основных растворов исследуемого и стандартного веществ необходимо использовать дистиллированную воду. При необходимости для солюбилизации или дисперирования исследуемого вещества до состояния, в котором вещество обычно поступает в окружающую среду, может быть использован альтернативный метод. Растворимые в воде нетоксичные растворители могут использоваться, если проведение испытания невозможно другим способом, но необходимо уделить внимание органическим компонентам, поступающим в систему при добавлении органических растворителей. Кроме того, образцы могут быть добавлены в тестовую систему в чистом виде таким образом, чтобы обеспечить их максимальное и быстрое распределение в иле. Для веществ, которые являются плохо растворимыми в воде, и взаимодействующих с взвешенными веществами в сточных водах, может быть целесообразным адсорбировать исследуемое вещество на инертном твердом носителе, который затем добавляется к тестовой системе. Если исследуемое вещество не может быть равномерно распределено внутри тестовой системы до начальной точки отбора проб, готовятся индивидуальные тестовые системы, которые исключаются из испытания при каждом отборе проб.
4.5.2.2 Объем добавленного раствора должен иметь достаточную концентрацию для обеспечения быстрого и равномерного распределения исследуемого вещества в образце и точного внесения дозы в аналогичные образцы. В идеальном случае, при дозировании водных растворов добавленный объем должен быть более 2 мл и менее 10 мл; для нетоксичных растворов - менее 0,1 мл/л. При необходимости раствор для дозирования может быть подготовлен заранее и храниться в холодильнике. Активность основного раствора необходимо проверять с помощью LSC.
4.6 Условия проведения испытания
4.6.1 Температура испытания
Инкубация должна проводиться в темноте (предпочтительно) или в рассеянном свете при контролируемой температуре, равной температуре испытания или нормальной температуре лаборатории от 20 °C до 25 °C.
4.6.2 Встряхивание/перемешивание
Для поддержания ила в хорошо перемешанном и суспендированном состоянии тестовые сосуды непрерывно встряхивают или их содержимое непрерывно перемешивают. Встряхивание/перемешивание также облегчает перенос кислорода из свободного пространства сосуда в жидкую фазу, вследствие чего сохраняются необходимые аэробные условия.
4.6.3 Продолжительность испытания
Продолжительность испытания должна быть достаточной для оценки степени и скорости биоразложения исследуемого вещества в ходе нормального времени пребывания на станции аэрации. В общем случае испытание длится в течение 28 дней. Испытание можно продлить на большее время для получения дополнительных данных для оценки кинетических констант или оценки полноты разложения в данных условиях. В обратном случае испытание может быть закончено раньше, процесс биоразложения достигает плато.
4.6.4 Количество тестовых сосудов
Как минимум, для каждой тестовой концентрации необходимо использовать один абиотический и один биотический сосуд. Для каждой пробы можно подготовить параллельные образцы с целью учета отклонений (например, по три параллельных пробы). Однако увеличение количества проб для каждого образца лучше отразится на качестве кинетических данных, полученных в большем диапазоне, чем увеличение количества параллельных проб.
4.7 Процедура испытания
4.7.1 Дозирование
В начале испытания заглушка тестового сосуда удаляется, и исследуемое вещество добавляют количественно непосредственно к активному при постоянном перемешивании. Рекомендуется вводить дозу постепенно ниже уровня воздух-вода для обеспечения равномерного распределения исследуемого вещества в активном иле. Биотические и абиотические образцы дозируют аналогичным способом. Как правило, биотические системы дозируются первыми, а затем абиотические системы. Точное время, как правило, имеет более важное значение для биотических систем по сравнению с абиотическими для проведения кинетических анализов.
4.7.2 График отбора проб
Интервалы отбора выбирают, основываясь на существующих данных о биоразложении или результатах предварительного исследования, поскольку универсального установленного графика отбора проб не существует. Рекомендуемый график отбора проб для быстро разлагающихся химических веществ - 5, 15, 30, 60 и 90 минут, с дополнительным отбором проб через 2, 3, 5, 8, 12 и 24 часа. Следующие пробы могут отбираться через 2, 3, 4, 5, 6 и 7 дней и каждую неделю до 28-го дня. График отбора проб для медленно разлагающихся химических веществ должен быть разработан так, чтобы в ходе фазы разложения было предусмотрено достаточное количество измерений.
4.7.3 Измерение минерализации
Минерализация может быть измерена прямыми или косвенными методами.
4.7.4 Косвенные измерения 
4.7.4.1 Индивидуальные параллельные пробы (например, 1 мл) отбирают из каждого образца в отдельные флаконы, которые содержат достаточное количество кислоты (например, 1 мл 0,1 н. HCL*) для снижения pH<2, и помещают в вытяжной шкаф. Более того, общее содержание твердых веществ в пробе не должно превышать 30 мг сухого веса.
_______________
* Текст документа соответствует оригиналу. - .
4.7.4.2 В течение нескольких часов пробы барботируют воздухом или оставляют на ночь для того, чтобы растворенный ![]() диффундировал из проб. Пробы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью жидкостной сцинтилляции. Процент
диффундировал из проб. Пробы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью жидкостной сцинтилляции. Процент CO
рассчитывается из разницы между общим отсчетом в биотических и абиотических пробах.
4.7.5 Прямые измерения 
4.7.5.1 Для быстро разлагающихся веществ может быть сложно точно измерить скорость выделения ![]() из-за скорости массового переноса
из-за скорости массового переноса ![]() из свободного пространства сосуда в основную ловушку. В данных условиях рекомендуется проводить косвенные измерения
из свободного пространства сосуда в основную ловушку. В данных условиях рекомендуется проводить косвенные измерения ![]() одновременно с прямыми.
одновременно с прямыми.
4.7.5.2 Выделившийся ![]() : первая основная ловушка системы улавливания удаляется и быстро закупоривается. Остальные ловушки продвигают вперед в том же порядке и за существующими ловушками размещают свежие ловушки, как можно скорее подключают систему улавливания. Повторные пробы (например, 1 мл) из основной ловушки удаляются, помещаются в сцинтилляционные флаконы и смешиваются с сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью жидкостной сцинтилляции.
: первая основная ловушка системы улавливания удаляется и быстро закупоривается. Остальные ловушки продвигают вперед в том же порядке и за существующими ловушками размещают свежие ловушки, как можно скорее подключают систему улавливания. Повторные пробы (например, 1 мл) из основной ловушки удаляются, помещаются в сцинтилляционные флаконы и смешиваются с сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью жидкостной сцинтилляции.
4.7.5.3 Пробы растворенного ![]() (например, от 10 до 25 мл) удаляются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент
(например, от 10 до 25 мл) удаляются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент (например, 1,5 н.
). Сосуды закупоривают и добавляют достаточное количество кислоты (например, 6 н.
) для снижения pH проб менее двух без сообщения проб с атмосферой (приложение А). Образцам позволяют отстояться в течение достаточно продолжительного времени (например, ночи), чтобы
диффундировал из раствора и произошло его улавливание абсорбентом из свободного пространства сосуда. Образцы абсорбента смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью жидкостной сцинтилляции.
4.7.6 Косвенные измерения 
4.7.6.1 Индивидуальные параллельные пробы (например, 1 мл) отбирают из тестовых образцов в отдельные флаконы, содержащие достаточное количество кислоты (например, 1 мл 0,1 н. ) для снижения величины pH<2, и помещают в вытяжной шкаф. Более того, общее содержание твердых веществ в пробе не должно превышать 30 мг сухого веса.
4.7.6.2 Половину образцов немедленно анализируют с помощью жидкостной сцинтилляции для "мокрого" измерения. Остальные образцы полностью сушат для удаления ![]() . Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью жидкостной сцинтилляции. Процентное содержание
. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью жидкостной сцинтилляции. Процентное содержание ![]() рассчитывается исходя из разницы между общим отсчетом в мокрых и сухих образцах и исходным уровнем радиоактивности, введенным в образцы.
рассчитывается исходя из разницы между общим отсчетом в мокрых и сухих образцах и исходным уровнем радиоактивности, введенным в образцы.
4.7.7 Измерение радиоактивности в смешанных жидких пробах (MLSS)
Малые образцы смешанных жидких проб (например, 1 мл) анализируют непосредственно с помощью жидкостной сцинтилляции для количественного определения оставшейся радиоактивности в каждой пробе по прошествии определенного периода времени. Данные измерения используются для подтверждения того, что восстановление радиоактивности из экстрагированных образцов является приемлемым и для контроля испарения. Общее содержание твердых веществ в этих образцах не должно превышать 30 мг сухого веса для предотвращения проблем с эффективностью подсчета.
4.8 Измерение исходного вещества и продуктов разложения
4.8.1 Экстракция
4.8.1.1 Смешанная жидкая проба отбирается из абиотического и биотического образца. Объем пробы, как правило, составляет более или равно 10 мл. Тем не менее объем будет зависеть от концентрации исследуемого вещества, удельной активности и чувствительности аналитического метода.
4.8.1.2 Для концентрирования и экстракции образцов могут использоваться различные подходы. Подтвержденный подход для нелетучих исследуемых веществ включает мгновенное замораживание образцов с последующей лиофилизацией и извлечением сухого остатка с использованием соответствующего растворителя(ей) для исходного вещества и продуктов разложения. Мгновенное замораживание быстро останавливает биологическую активность без гидролиза или иное изменение лабильных исследуемых веществ. Мгновенное замораживание представляет собой быстрый процесс, если используется достаточный объем сухого льда/ацетона или ванны жидкого азота для погружения сосуда с образцом. Глубина погружения в ванну должна покрывать уровень пробы в сосуде. Полученные экстракты могут быть сконцентрированы выпариванием, и общая радиоактивность каждого экстракта определяется с помощью жидкостной сцинтилляции.
4.8.1.3 Для летучих исследуемых веществ смешанная проба может быть пропущена через фильтр и колонну или диск твердофазной экстракции, помещенные в тандеме, которые затем элюируют подходящим растворителем для извлечения исследуемого вещества и продуктов разложения. Кроме того, образцы можно разделить центрифугированием, и исходное вещество и продукты разложения могут быть извлечены из жидкой фазы на твердую фазу или жидкость-жидкостной экстракцией. Твердые вещества могут быть извлечены непосредственно или в смеси с сушильным агентом (например, сульфатом натрия), их предварительно сушат до извлечения с соответствующей системой растворителей. В альтернативном случае твердые вещества экстрагируют и затем удаляют воду из растворителя путем пропускания через колонну с сушильным агентом. В большинстве случаев использование жидкость-жидкостной экстракции для извлечения исходного вещества и продуктов разложения из смешанной пробы не является эффективным. Общая радиоактивность во всех экстрактах определяется с помощью жидкостной сцинтилляции. При концентрировании экстрактов, содержащих летучие вещества или продукты разложения, следует соблюдать осторожность.
4.8.1.4 Могут также использоваться и другие подходы, но для любых подходов важно регистрировать количество извлекаемых веществ и время, необходимое для прекращения биологической активности, и принимать это во внимание при кинетическом анализе.
4.8.2 Анализ исходного вещества и продуктов разложения
4.8.2.1 Относительное содержание исходного вещества и продуктов разложения в экстрактах может быть определено с помощью ТСХ, ВЭЖХ или других методов разделения с возможностью радиоактивного обнаружения.
4.8.2.2 Если доступны конкретные специфические аналитические методы, первичное биоразложение можно оценить, измеряя общую остаточную концентрацию исследуемого вещества и продуктов разложения вместо использования радиоизотопных методов.
4.8.3 Характеристика продуктов разложения
Если возможно, хроматографическое поведение неизвестных пиков необходимо сравнивать с пиками для ожидаемых продуктов разложения, если существуют соответствующие аутентичные стандарты. В общем случае количество и чистота продуктов разложения, полученных в настоящем испытании, делает невозможным проведение окончательной идентификации другими прямыми способами. В зависимости от хроматографического поведения, как правило, можно определить, является ли метаболит более или менее полярным, чем исходное вещество. Такая информация в сочетании с известными биохимическими реакциями и появлением и исчезновением метаболита в ходе биоразложения может сформировать дополнительную основу для идентификации. Если необходимо, основных продуктов разложения может быть оценено с помощью ВЭЖХ (например, [27]) с использованием параллельного детектора радиоактивности.
4.8.4 Измерение извлеченных твердых веществ и степени включения в биомассу
Извлеченные твердые вещества сжигают для определения уровня активности оставшихся твердых веществ. Уровень радиоактивности в биотических твердых веществах выше, чем в твердых телах из абиотического контроля, обычно является свидетельством включения радиоактивности в биомассу. Распространение данной радиоактивности в различных компонентах биомассы (т.е. нуклеиновых кислотах, белках, клеточных стенках и пр.) можно оценить, используя модифицированную процедуру Сазерленда и Уилкинсона [4], [25].
4.8.5 Измерение радиоактивности летучих веществ
Для летучих исследуемых веществ, летучие вещества извлекаются из ловушек соответствующими растворителями, и радиоактивность экстрактов анализируется с помощью жидкостной сцинтилляции. Относительное большое количество исходного вещества и продуктов разложения в экстракте(ах) может быть определено, как описано выше.
5 Минерализация и трансформация при анаэробном сбраживании осадка (шлама)
5.1 Введение
5.1.1 Данное испытание предназначено для оценки степени разложения химического вещества во время анаэробного сбраживания осадка (шлама). Также оно предусматривает темпы первичного и окончательного биоразложения в условиях автоклава. Анаэробное сбраживание обычно используется для стабилизации и сокращения массы осадка (шлама), образующегося в установках обработки сточных вод. Биоразложение при анаэробном сбраживании особенно важно для химических веществ с высокой склонностью к распределению в первичном или вторичном осадках. Извлечение в ходе анаэробного сбраживания может существенно снизить уровень концентрации химического вещества, присутствующего в осадке, который используют для улучшения почвы. Испытание также легко применимо к осадку септик-тенка для оценки анаэробного сбраживания в септик-тенках. Для оценки риска до проведения данного испытания обычно выполняют испытание Биоразложение в системе активного ила. В других целях эти методы испытания могут проводиться раздельно.
5.1.2 Учитывая, что многие автоклавы действуют как открытые системы или реакторы идеального вытеснения, которые имеют продолжительное время удерживания (от 30 до 60 дней), не важно, что химическое вещество и популяции его деструктора находятся в равновесном состоянии в начале испытания для получения подходящих показателей оценки воздействия.
5.1.3 Для моделирования условий, связанных с эпизодическими эмиссиями химического вещества, свежесобранный осадок (шлам) с автоклава может быть инкубирован максимальной концентрацией исследуемого химического вещества, которое, предположительно, может присутствовать в осадке (шламе) как следствие периодических эмиссий. Подходы для определения уровня ожидаемых концентраций в осадке (шламе) можно найти в [25] и [26]. Для существующих химических веществ, непрерывно поступающих в сточные воды, свежесобранный осадок (шлам) из автоклава может быть инкубирован со следовым количеством меченого исследуемого химического вещества или ожидаемой концентрацией, встречающейся в осадке (шламе) автоклава. Обычно в рамках испытания достаточно времени для адаптации новых химических веществ. Тем не менее лабораторный аэробный реактор, действующий в режиме извлечения и заполнения в зависимости от уровня ожидаемой концентрации химического вещества в осадке (шламе), может рассматриваться как вариант получения адаптированного ила. Этот вид осадка (шлама) должен привести к более точным кинетическим результатам по новому химическому веществу, который мог бы постоянно подвергать опасности сточные воды.
5.2 Общая процедура испытания
5.2.1 Исследуемое химическое вещество инкубируют с абиотическим и биотическим сброженным осадком (шламом) в течение определенного периода. Биологическая активность подавляется при абиотическом контроле, который используется для оценки минерализации по разнице, определяющей эффективность экстракции и восстановления исходной молекулы, и количественного описания других процессов разложения, таких как гидролиз, окисление, испарение или сорбция на экспериментальном оборудовании.
5.2.2 Если определен аналитический метод с необходимой чувствительностью, скорость разложения или трансформации исходного вещества может быть определена с использованием немеченого исследуемого вещества или по последующей убыли химического вещества непосредственно в сточных водах. Тем не менее окончательное биоразложение не может быть определено, если путь биоразложения не известен достаточно хорошо и для потенциальных продуктов разложения не доступны аналитические методы с необходимой чувствительностью.
5.2.3 Экологически значимые концентрации исследуемого вещества дозируются в абиотические и биотические тестовые системы, которые инкубируются при соответствующей температуре в статических условиях с периодическим или непрерывным перемешиванием. Образцы периодически удаляются для определения минерализации и первичной биодеградации.
5.2.4 Тесты могут быть выполнены с использованием открытой или герметичной проточной системы, где используются ловушки для улавливания выделяющихся ![]() и
и ![]() . Закрытая проточная система является обязательной для летучих исследуемых веществ и обычно предпочтительна для
. Закрытая проточная система является обязательной для летучих исследуемых веществ и обычно предпочтительна для меченых исследуемых веществ. Открытые системы применимы для нелетучих химических веществ
и предназначены для детализации кинетики процесса биоразложения нелетучих
меченых исследуемых веществ, чья способность к минерализации была установлена ранее. В открытой системе минерализация до
![]() и
и ![]() может быть определена косвенно путем измерения разности остаточной радиоактивности образцов биотической и абиотической систем после подкисления. Кроме того, минерализация до
может быть определена косвенно путем измерения разности остаточной радиоактивности образцов биотической и абиотической систем после подкисления. Кроме того, минерализация до ![]() может быть определена косвенно путем измерения разницы в остаточной радиоактивности образцов после сушки. В закрытых проточных системах ловушки для отбора газа также могут быть использованы для улавливания газа из анаэробного сбраживаемого осадка (шлама). В закрытых проточных системах выделяющийся
может быть определена косвенно путем измерения разницы в остаточной радиоактивности образцов после сушки. В закрытых проточных системах ловушки для отбора газа также могут быть использованы для улавливания газа из анаэробного сбраживаемого осадка (шлама). В закрытых проточных системах выделяющийся ![]() измеряется непосредственно в основной ловушке, и растворенный
измеряется непосредственно в основной ловушке, и растворенный ![]() сжигается до
сжигается до ![]() , который измеряется непосредственно во второй серии основных ловушек. В качестве альтернативы растворенный
, который измеряется непосредственно во второй серии основных ловушек. В качестве альтернативы растворенный ![]() может быть определен путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
может быть определен путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
5.2.5 Образцы из обоих испытаний анализируют на общую радиоактивность, извлекаемые исходное вещество и продукты разложения и радиоактивность извлекаемых твердых веществ. Содержание исходного вещества и продуктов разложения определяется с помощью хроматографического разделения и, если возможно, радиоаналитических методов обнаружения. Твердые вещества, оставшиеся после процесса экстракции, сжигают для оценки включения в биомассу по разнице или в дальнейшем разделяют на фракции для определения поглощения различными компонентами биомассы. Полный массовый баланс тестовой системы получают исходя из полной суммы всех фракций для каждого образца.
5.3 Применимость метода
Метод можно легко использовать для растворимых в воде или плохо растворимых материалов, которые не являются летучими. Метод также может быть адаптирован для летучих веществ. Как правило, для оценки минерализации требуются или
радиоактивные метки. Для оценки первичного биоразложения можно использовать и меченые, и немеченые соединения.
5.4 Описание метода испытания
5.4.1 Экспериментальная установка
5.4.1.1 Объем сброженного осадка (шлама) в тестовой пробе определяется в зависимости от количества и объема образцов, необходимых для оценки. Как правило, от 0,25 до 1 л сброженного осадка (шлама), разбавленного анаэробной соленой средой, помещают в емкости вместимостью от 0,5 до 2 л. Осадок (шлам) разбавляют для облегчения снятия количественных показаний сокращенных проб во время исследования. Анаэробный осадок (шлам) должен быть защищен от воздействия кислорода постоянно, в том числе при установке и отборе проб.
5.4.1.2 Открытые системы обычно закрывают пенопластовой или ватной пробкой для сведения к минимуму испарения воды и инкубируются внутри анаэробной камеры в условиях восстановительной газовой среды. Проточные тестовые сосуды закупоривают соответствующим устройством, оборудованным пробоотборным отверстием с клапаном для отбора образцов осадка (шлама) и пропускания входящих и исходящих газовых потоков. Данное устройство может представлять собой резиновую пробку, но при работе с летучими гидрофобными тестовыми веществами рекомендуется использовать стекло. При тестировании летучих веществ также рекомендуется, чтобы газоотводы и трубки пробоотборника были изготовлены из инертных материалов (например, ПТФЭ, нержавеющая сталь, стекло).
5.4.1.3 Проточная система является модификацией системы, представленной сначала авторами Штебер и Вирих [11] и уточненной позднее авторами Нук и Федерле [12]. Пример типичной системы дан в приложении А. Тестовые сосуды непрерывно продувают потоком азота и присоединяют к серии ловушек, содержащих раствор гидроксида калия (1,5) или другие соответствующие абсорбенты
. Пустые ловушки, как правило, включаются в систему улавливания для предотвращения обратного тока или конденсации. Исходящие газы из этих ловушек, смешиваясь с кислородом, проходят через кварцевую колонку, наполненную оксидом меди, и поддерживают примерно при температуре 800 °C в трубчатой печи для сжигания метана до
. Газ, выходящий из колонны сгорания, затем направляется через другой ряд основных ловушек.
5.4.2 Оборудование
5.4.2.1 Используется следующее стандартное лабораторное оборудование:
- различная стеклянная посуда и пипетки;
- магнитные мешалки или шейкер для непрерывного перемешивания содержимого тестовых колб;
- центрифуга;
- pH-метр;
- ванна с твердым (сухой лед)/ацетоном или жидким азотом;
- сушилка с заморозкой (лиофилизатор);
- печь или микроволновая печь для определения сухого веса;
- аппарат для мембранной фильтрации;
- автоклав;
- средства для обработки меченых веществ;
- оборудование для количественного определения и
в жидких и твердых пробах (например, жидкий сцинтилляционный счетчик LSC);
- оборудование для количественного определения и
в твердых пробах (например, окислитель);
- оборудование для улавливания летучих и
из газовой системы улавливания (последовательные ловушки на основе активированного угля или аналогичное оборудование);
- оборудование для ТСХ или ВЭЖХ;
- оборудование для количественного определения и
для ТСХ (сканер) или ВЭЖХ (последовательный детектор);
- аналитическое оборудование для определения исследуемого (и стандартного) вещества, если необходимо проведение конкретного химического анализа (например, газовый хроматограф, хроматограф для ВЭЖХ, масс-спектрометр).
5.4.2.2 Может быть использовано следующее специализированное оборудование:
- анаэробная камера;
- трубчатая печь;
- редокс-проба и mV-метр.
5.4.3 Выбор источника сброженного осадка (шлама)
Источник сброженного осадка (шлама) должен соответствовать испытанию моделированием. Для проведения оценки конкретного места осадок (шлам) должен быть получен из конкретной системы автоклава, для которого проводится исследование. Для общей оценки сброженный осадок (шлам) должен быть получен из стандартного одностадийного автоклава или автоклава с начальной ступенью, принимающего первичный и вторичный осадок (шлам) с установки обработки сточных вод, преимущественно бытовых сточных вод. Если химическое вещество является компонентом сточных вод, поступающих на очистные сооружения, или эпизодически попадает в сточные воды, то свежесобранный осадок (шлам) идеально подойдет для испытания. Для нового химического вещества, постоянно проникающего в сточные воды, более подходящим может быть адаптированный или полученный из лабораторного анаэробного реактора. Для общей оценки этот реактор должен воспроизводить работу одностадийного анаэробного автоклава и полунепрерывно подавать осадок (шлам), состоящий из твердых веществ комбинированного первичного и вторичного осадка (шлама) с установки обработки сточных вод, преимущественно бытовых сточных вод, которые были модифицированы исследуемым химическим веществом до его уровня ожидаемой концентрации в осадке (шламе) приблизительно в течение 60 дней.
5.4.4 Сбор, транспортировка и хранение сброженного осадка (шлама)
Сброженный осадок (шлам) должен быть собран из автоклава, предохраняя его от воздействия кислорода. Для сброженного осадка (шлама) рекомендуется использовать широкогорлые бутыли из полиэтилена высокой плотности или аналогичного материала, которые могут расширяться. Температура образца должна быть зарегистрирована в момент отбора. Контейнеры для образцов должны быть плотно закупорены. Во время транспортировки температура образца не должна значительно превышать температуру испытания. Сброженный осадок (шлам), как правило, хранится в отсутствие кислорода при температуре испытания. Контейнеры для хранения должны обеспечивать вентиляцию, позволяющую выпускать избыток биогаза, но препятствующую проникновению воздуха в контейнер.
5.4.5 Подготовка тестовых проб
5.4.5.1 Среда разбавления
До начала испытания следует приготовить следующий раствор из минеральных солей соответствующего объема. Данный раствор помещают в автоклав на 30 минут при температуре и давлении около 121 °C и 15 psi (1 атм) соответственно, со слабым выпуском газа, и оставляют охлаждаться на ночь в анаэробной камере или в условиях анаэробной атмосферы. Обычно объем среды равен или меньше половины объема контейнера для автоклава (например, 500 мл сухого сброженного осадка (шлама) в литровом контейнере).
Материал | Количество | |
Одноосновный фосфат калия, | 8,5 мг/л | |
Двухосновный фосфат калия, | 21,8 мг/л | |
Двухосновный гептагидрат фосфата натрия, | 50,3 мг/л | |
Хлорид аммония, | 20,0 мг/л | |
Гептагидрат сульфата магния, | 2,2 мг/л | |
Безводный хлорид кальция, | 2,8 мг/л | |
Дихлорид железа, | 0,25 мг/л | |
Деионизированная вода | Довести до объема |
5.4.5.2 Сброженный осадок (шлам)
Сброженный осадок (шлам) в идеале должен храниться и управляться внутри анаэробной камеры или в среде анаэробной атмосферы. Из-за высокой концентрации бактерий в осадке он быстро поглощает присутствующий кислород, создающий анаэробные условия. Тем не менее могут быть использованы другие подходы для предохранения осадка (шлама) от воздействия кислорода. Сброженный осадок (шлам) следует просеять через сито 2 мм. Общая концентрация твердых веществ должна быть измерена.
Уровень обрабатываемых твердых веществ, который может быть отобран во время исследования, составляет около 25000 мг/л. Если уровень твердых веществ слишком высокий, его могут растворить в среде разбавления. Альтернативно, если уровень твердых веществ слишком низкий, его могут оставить отстаиваться, полученный отстой слить, а осадок повторно суспендировать в среде разбавления. Затем должны быть определены конечный уровень твердых веществ и pH.
Подготовка абиотического осадка (шлама), как правило, осуществляется с использованием комбинации химической и тепловой стерилизации. Подтвержденным способом является добавление раствора хлорида ртути (1 г/л) в осадок (шлам), который затем обрабатывают в автоклаве в течение минимум 90 минут. После охлаждения pH абиотического осадка (шлама) необходимо измерять и отрегулировать в зависимости от вида биологически активного осадка. Для уменьшения образования дополнительных отходов, для деактивации осадка (шлама) также может быть рассмотрено использование альтернативных подходов. При приготовлении абиотического осадка (шлама) он должен храниться и управляться в анаэробной камере. Для защиты от воздействия кислорода необходимо использовать другой альтернативный подход.
5.4.6 Подготовка исследуемого вещества
5.4.6.1 Для приготовления основных растворов исследуемого и стандартного веществ необходимо использовать дистиллированную воду. При необходимости альтернативный метод может быть использован для солюбилизирования или диспергирования исследуемого вещества в соответствии с его обычной формой поступления в сброженный осадок (шлам). Перед началом практического использования растворы для дозирования должны быть оставлены на ночь в восстановительной атмосфере, чтобы удалить растворенный кислород. Объем добавленного раствора должен иметь достаточную концентрацию для обеспечения быстрого и равномерного распределения исследуемого вещества в пробе и точного внесения дозы в аналогичные пробы. В идеальном случае при дозировании водных растворов добавленный объем должен быть 1 мл и
10 мл; для нетоксичных растворителей
0,1 мл/л. Активность основного раствора необходимо проверить с помощью LSC. Для веществ, которые плохо растворимы в воде и обычно взаимодействуют с частицами осадка (шлама), может быть целесообразным адсорбировать исследуемое вещество на инертном твердом носителе, который затем добавляется к тестовой системе. Если исследуемое вещество не может быть равномерно распределено внутри тестовой системы до начальной точки отбора проб, готовятся индивидуальные тестовые системы, которые исключают из испытания на каждом этапе отбора проб.
5.4.6.2 В качестве альтернативы исследуемое вещество может быть применено к твердым веществам неактивного осадка (шлама), который добавляется в тестовую систему. Растворимые в воде нетоксичные растворители могут использоваться, при необходимости, но следует уделить внимание органическим компонентам системы, поступающим в систему при добавлении органических растворителей. Кроме того, исследуемое вещество может быть добавлено в чистом виде таким образом, чтобы обеспечить их максимальное и быстрое внесение в осадок (шлам).
5.4.7 Условия проведения испытания
5.4.7.1 Температура проведения испытания
Инкубация должна проводиться в темноте (предпочтительно) или в рассеянном свете при контролируемой температуре, равной стандартной рабочей температуре метантенка (35 °C ± 3 °C), температуре испытания или нормальной лабораторной температуре от 20 °C до 25 °C.
5.4.7.2 Встряхивание/перемешивание
Для моделирования статических условий внутри метантенка содержимое тестовых сосудов, обычно, не перемешивается постоянно. Во время отбора проб их содержимое необходимо тщательно перемешать, чтобы получить репрезентативную пробу. Кроме того, их можно смешивать аккуратно несколько минут два-три раза в неделю.
5.4.7.3 Продолжительность испытания
Продолжительность испытания должна быть достаточной для оценки степени и скорости биоразложения химического вещества в ходе нормального времени его пребывания в анаэробном сброженном осадке (шламе). Обычно, период испытания длится приблизительно 60 дней. Испытание может быть продлено на большее время для получения дополнительных данных для оценки кинетических констант или определения полноты разложения в условиях испытания. В ином случае, испытание может быть прекращено раньше времени, если процесс разложения достигает плато.
5.4.8 Количество тестовых сосудов
Как минимум, для каждой тестовой концентрации необходимо использовать один абиотический и один биотический сосуд. Повторные пробы могут быть подготовлены для конкретного химического анализа. Повторные пробы поддерживаются в анаэробных условиях, но, как правило, не связаны с устройством минерализации и могут быть подвергнуты подвыборке или утеряны на определенной точке отбора проб. Однако увеличение количества проб для каждого образца лучше отразится на качестве кинетических данных, полученных в большем диапазоне, чем увеличение количества повторных проб.
5.5 Процедура испытания
5.5.1 Дозирование
В начале испытания исследуемое вещество добавляют количественно непосредственно к сброженному осадку (шламу) при постоянном перемешивании. Дозирование необходимо проводить так, чтобы тестовая система была защищена от воздействия кислорода. Рекомендуется вводить дозу постепенно ниже уровня воздух-вода для обеспечения равномерного распределения исследуемого вещества в осадке (шламе). Биотические и абиотические образцы дозируют аналогичным способом.
5.5.2 График отбора проб
Интервалы отбора проб выбирают, основываясь на существующих данных о биоразложении или результатах предварительного исследования, поскольку универсального установленного графика отбора проб не существует. Рекомендуемый график отбора проб для быстро разлагающихся химических веществ - 30, 60 и 120 минут, с дополнительным отбором проб через 4, 8 и 24 часа. Последующие пробы могут быть отобраны через 2, 4 и 7 дней и каждую неделю до 56-го дня. График отбора проб для медленно разлагающихся химических веществ должен быть разработан так, чтобы в ходе фазы разложения было предусмотрено достаточное количество измерений.
5.5.3 Измерение минерализации
Минерализация может быть измерена прямыми или косвенными методами.
5.5.3.1 Косвенные измерения газов (
![]() и
и ![]() )
)
Прямой подсчет проб с помощью LSC не возможен из-за высокого уровня твердых частиц в образцах. Поэтому образцы центрифугируют, надосадочную жидкость анализируют на общую радиоактивность с помощью LSC, твердые вещества сжигают и затем анализируют на радиоактивность, чтобы определить общую радиоактивность в образце. Индивидуальные параллельные образцы сброженного осадка (например, 1 мл) отбирают из каждой пробы в центрифужные пробирки, которые содержат достаточное количество кислоты для снижения pH до 2. Образцы центрифугируют, надосадочную жидкость переносят в сцинтилляционный флакон, который оставляют в вытяжном шкафу на ночь, чтобы растворенный
![]() диффундировал из образцов. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы образца, и анализируют с помощью LSC. Твердые вещества, оставшиеся в центрифужной пробирке, сжигают с помощью окислителя образца перед LSC. Процент полученного газа
диффундировал из образцов. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы образца, и анализируют с помощью LSC. Твердые вещества, оставшиеся в центрифужной пробирке, сжигают с помощью окислителя образца перед LSC. Процент полученного газа ![]() рассчитывается из разницы между общим подсчетом в биотических и абиотических образцах.
рассчитывается из разницы между общим подсчетом в биотических и абиотических образцах.
5.5.3.2 Прямые измерения ![]() и
и ![]()
Выделившийся ![]() и
и ![]() : прямые измерения
: прямые измерения ![]() и
и ![]() возможны лишь в герметичной проточной системе с соединенными основными ловушками. Для
возможны лишь в герметичной проточной системе с соединенными основными ловушками. Для ![]() первая основная ловушка системы улавливания удаляется и быстро закупоривается. Остальные ловушки продвигают вперед в том же порядке и за существующими ловушками размещают свежие ловушки, как можно скорее подключают систему улавливания. Повторные пробы (например, 1 мл) из основной ловушки удаляются, помещаются в сцинтилляционные флаконы и смешиваются со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC. Для определения
первая основная ловушка системы улавливания удаляется и быстро закупоривается. Остальные ловушки продвигают вперед в том же порядке и за существующими ловушками размещают свежие ловушки, как можно скорее подключают систему улавливания. Повторные пробы (например, 1 мл) из основной ловушки удаляются, помещаются в сцинтилляционные флаконы и смешиваются со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC. Для определения ![]() эту процедуру повторяют со второй системой улавливания.
эту процедуру повторяют со второй системой улавливания.
Растворенный ![]() (факультативно): Образцы осадка (шлама) (например, 10 мл) отбираются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент
(факультативно): Образцы осадка (шлама) (например, 10 мл) отбираются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент (например, 1,5 н.
). Сосуды закупоривают и добавляют достаточное количество кислоты для снижения pH проб до
2 без сообщения проб с атмосферой (приложение А). Образцам позволяют отстояться в течение достаточно продолжительного времени, чтобы
диффундировал из раствора и произошло его улавливание абсорбентом из свободного пространства сосуда. Образцы абсорбента смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC.
5.5.3.3 Косвенные измерения ![]()
Параллельные пробы осадка (шлама) (например, 8) отбирают из тестовых образцов в центрифужные пробирки, содержащие достаточное количество кислоты для снижения величины pH до
2. Содержимое смешивают и центрифугируют. Индивидуальные параллельные образцы надосадочной жидкости (например, 1 мл) помещают в отдельные флаконы. Половину образцов немедленно анализируют с помощью жидкостной сцинтилляции для "мокрого" измерения. Остальные образцы оставляют на ночь в вытяжном шкафу до полной сушки и для удаления
![]() . Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC. Процентное содержание
. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC. Процентное содержание ![]() рассчитывается исходя из разницы между общим подсчетом в мокрых и сухих образцах и исходным уровнем радиоактивности, введенным в образцы.
рассчитывается исходя из разницы между общим подсчетом в мокрых и сухих образцах и исходным уровнем радиоактивности, введенным в образцы.
5.5.4 Измерение общей радиоактивности в сброженном осадке (шламе)
Прямой подсчет проб с помощью LSC не возможен из-за высокого уровня твердых частиц в образцах. Поэтому образцы центрифугируют, надосадочную жидкость анализируют на общую радиоактивность с помощью LSC, твердые вещества сжигают и затем анализируют на радиоактивность, чтобы определить общую радиоактивность в образце. Индивидуальные параллельные образцы сброженного осадка (например, 1 мл) отбирают из каждой пробы в центрифужные пробирки. Образцы центрифугируют, надосадочную жидкость переносят в сцинтилляционный флакон. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы образца, и анализируют с помощью LSC. Твердые вещества, оставшиеся в центрифужной пробирке, сжигают с помощью окислителя образца перед LSC.
5.5.5 Измерение исходного вещества и продуктов разложения
5.5.5.1 Экстракция
Пробы сброженного осадка (шлама) отбирают из абиотических и биотических образцов. Объем пробы, как правило, составляет 10 мл. Тем не менее объем будет зависеть от тестовой концентрации, удельной активности и чувствительности аналитических процедур.
Для концентрирования и извлечения образцов могут использоваться разные подходы. Подтвержденный подход для нелетучих исследуемых веществ включает мгновенное замораживание образцов с последующей лиофилизацией и экстракцией сухого остатка соответствующим(и) растворителем(ями) для исходного вещества и продуктов разложения. Мгновенное замораживание быстро останавливает биологическую активность без гидролиза или иного изменения лабильных исследуемых веществ. Замораживание является быстрым процессом, если для погружения сосуда с образцом используется достаточно глубокая ванна с сухим льдом/ацетоном или жидким азотом. Уровень заполнения ванны должен покрывать уровень пробы в сосуде. Полученные экстракты могут быть сконцентрированы выпариванием, и общая радиоактивность в каждом экстракте определяется с помощью LSC.
Для летучих исследуемых веществ образцы можно центрифугировать, и исходное вещество и продукты разложения могут быть извлечены из жидкости на твердой фазе или жидкость-жидкостной экстракцией. Твердые вещества могут быть извлечены непосредственно или в смеси с сушильным агентом (например, сульфатом натрия), их предварительно сушат до извлечения с соответствующей системой растворителей. В альтернативном случае, твердые вещества извлекают, и затем удаляют воду из растворителя путем пропускания через колонку, содержащую сушильный агент. Общая радиоактивность во всех экстрактах определяется с помощью LSC. При концентрировании экстрактов, содержащих летучие исследуемые вещества или продукты разложения, необходимо соблюдать осторожность.
Могут использоваться и другие подходы, но для всех подходов важно регистрировать извлечение и учитывать время, необходимое для прекращения биологической активности, и использовать его для времени отбора проб для кинетического анализа.
5.5.5.2 Анализ исходного вещества и продуктов разложения
Относительно большое количество исходного вещества и продуктов разложения в экстрактах может быть определено с помощью ТСХ, ВЭЖХ или других методов разделения с возможностью обнаружения радиоактивности.
Если доступны чувствительные специфические аналитические методы, первичное биоразложение можно оценить, измеряя общую остаточную концентрацию исследуемого вещества и продуктов разложения вместо использования радиоизотопных методов.
5.5.5.3 Характеристика продуктов разложения
Если возможно, хроматографическое поведение неизвестных пиков необходимо сравнивать с пиками для ожидаемых продуктов разложения, если существуют соответствующие аутентичные стандарты. В общем случае, количество и чистота продуктов разложения, полученных в настоящем испытании, делает невозможным проведение окончательной идентификации другими прямыми способами. В зависимости от хроматографического поведения, как правило, можно определить, является ли метаболит более или менее полярным, чем исходное вещество. Такая информация в сочетании с известными биохимическими реакциями и появлением и исчезновением метаболита в ходе биоразложения может сформировать дополнительную основу для идентификации. Если необходимо, основных продуктов разложения может быть оценено с помощью ВЭЖХ (например, [27]) с использованием поточного детектора радиоактивности.
5.5.6 Измерение извлеченных твердых веществ и степени включения в биомассу
Извлеченные твердые вещества сжигают для определения уровня активности оставшихся твердых веществ. Уровень радиоактивности в биотических твердых веществах выше, чем в твердых телах из абиотического контроля, что обычно является свидетельством включения радиоактивности в биомассу. Распространение данной радиоактивности в различных компонентах биомассы (т.е. нуклеиновых кислотах, белках, клеточных стенках и пр.) можно определить, используя модифицированную процедуру [28].
5.5.7 Измерение радиоактивности летучих веществ
Исследуемые летучие вещества извлекаются из ловушек соответствующими растворителями и радиоактивность экстрактов анализируется с помощью LSC. Относительное большое количество исходного вещества и продуктов разложения в экстракте(ах) может быть определено, как описано выше.
6 Биоразложение в смешанной системе очищенные: сточные воды - поверхностные воды
6.1 Введение
6.1.1 Данное испытание заключается в оценке биоразложения части химического вещества, которая после обработки попадает в составе сброса в поверхностные воды. Оно может использоваться для демонстрации биоразложения, происходящего в очистных сооружениях и продолжающегося в окружающей среде. Оно также полезно для определения степени биоразложения, а также темпов первичного и окончательного биоразложения в объекте окружающей природной среды. Результаты этого теста могут использоваться для оценки снижения концентрации химического вещества в результате биоразложения за время движения объема воды вниз по течению от станции очистки сточных вод. Тестовая система состоит из свежесобранных поверхностных вод и очищенных сточных вод. Полезность измеряемых темпов для точного прогнозирования воздействия вниз по течению будет зависеть от точности моделирования реальных условий в зоне смешения. Наряду с концентрацией исследуемого вещества к факторам, влияющим на проектирование данного испытания, относятся уровень твердых веществ в очищенных сточных водах и степень их разбавления в поверхностных водах.
6.1.2 Для моделирования условий, связанных с эпизодическими эмиссиями химического вещества, соответствующим образом отобранную смесь поверхностных и очищенных сточных вод инкубируют концентрацией исследуемого химического вещества, которое, предположительно, может присутствовать в очищенных сточных водах, разбавленных в поверхностной воде в результате эмиссий. В этих случаях химическое вещество и продукты его разложения обычно не находятся в равновесном состоянии и наблюдается кинетика квазипервого порядка или второго порядка Monod. Подходы для определения концентраций очищенных сточных вод можно найти в [25] и [26].
6.1.3 Для химических веществ, которые поступают или будут поступать непрерывно в сточные воды, продукты разложения в установке обработки будут адаптироваться к химическому веществу. Для существующих химических веществ, непрерывно поступающих в сточные воды, поверхностная вода с ожидаемым уровнем концентрации исследуемого химического вещества и свежесобранных очищенных сточных вод в рамках заданного сценария выгрузки, позволит обеспечить наиболее реалистичные кинетические результаты. Для новых химических веществ, непрерывно выгружающихся в сточные воды, использование очищенных сточных вод, которые подверглись воздействию химического вещества в лабораторных условиях моделирования активного ила (например, [3]), позволит получить более точную кинетику. Следует отметить, что использование [3] могло бы привести к завышенной оценке разложения по сравнению с реальной ситуацией в плане выбросов в окружающую среду.
6.1.4 В большинстве случаев, исходя из аналитических рекомендаций, выполнение испытания при фактических концентрациях поверхностной воды будет невозможно. Поэтому наблюдаемые показатели темпов биоразложения не могут быть полностью типичными для фактических условий окружающей среды и должны быть рассмотрены в интерпретации результатов.
6.2 Общая процедура испытания
6.2.1 Исследуемое химическое вещество инкубируют с абиотическими и биотическими смесями поверхностной воды и очищенной сточной воды в течение определенного периода. Соотношение данных компонентов базируется на специфическом или общем сценариях воздействия эмиссий очищенной сточной воды на поверхностную воду. Биологическая активность подавляется при абиотическом контроле, который используется для оценки минерализации по разнице, определяющей эффективность экстракции и восстановления исходной молекулы, и количественного описания других процессов разложения, таких как гидролиз, окисление, испарение или сорбция на экспериментальном оборудовании.
6.2.2 Если определен аналитический метод с необходимой чувствительностью, скорость разложения или трансформации исходного вещества может быть определена с использованием немеченого исследуемого вещества или по последующей убыли химического вещества непосредственно в сточных водах. Тем не менее окончательное биоразложение не может быть определено, если путь биоразложения не известен достаточно хорошо и для потенциальных продуктов разложения не доступны аналитические методы с необходимой чувствительностью.
6.2.3 Экологически значимые концентрации исследуемого вещества дозируются в абиотические и биотические тестовые системы, которые инкубируются при соответствующей температуре с непрерывным перемешиванием, если приемлемо. Образцы периодически удаляются для определения минерализации и первичной биодеградации.
6.2.4 Тесты могут быть выполнены с использованием открытой или герметичной проточной системы, где используются ловушки для улавливания выделяющегося ![]() . Закрытая проточная система является обязательной для летучих исследуемых веществ и обычно предпочтительна для
. Закрытая проточная система является обязательной для летучих исследуемых веществ и обычно предпочтительна для меченых исследуемых веществ. Открытые системы применимы для нелетучих химических веществ
и предназначены для детализации кинетики процесса биоразложения нелетучих
исследуемых веществ, чья способность к минерализации была установлена ранее. В открытой системе минерализация до
![]() может быть определена косвенно путем измерения разности остаточной радиоактивности образцов биотической и абиотической систем после подкисления. Кроме того, минерализация до
может быть определена косвенно путем измерения разности остаточной радиоактивности образцов биотической и абиотической систем после подкисления. Кроме того, минерализация до H
O может быть определена косвенно путем измерения разницы радиоактивности образцов после сушки. В закрытых проточных системах выделяющийся
![]() измеряется непосредственно в основной ловушке. К тому же, растворенный
измеряется непосредственно в основной ловушке. К тому же, растворенный ![]() определяется путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
определяется путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
6.2.5 Образцы из обоих испытаний анализируют на общую радиоактивность, извлекаемые исходное вещество и продукты разложения и радиоактивность извлекаемых твердых веществ. Содержание исходного вещества и продуктов разложения определяется с помощью хроматографического разделения и, если возможно, радиоаналитических методов обнаружения. Твердые вещества, оставшиеся после процесса экстракции, сжигают для оценки включения в биомассу по разнице или в дальнейшем разделяют на фракции для определения поглощения различными компонентами биомассы. Полный массовый баланс тестовой системы получают исходя из полной суммы всех фракций для каждого образца.
6.3 Применимость метода
Метод можно легко использовать для растворимых в воде или плохо растворимых материалов, которые не являются летучими. Метод также может быть адаптирован для летучих веществ. Как правило, для оценки минерализации требуются или
радиоактивные метки. Для оценки первичного биоразложения можно использовать и меченые, и немеченые соединения.
6.4 Описание метода испытания
6.4.1 Экспериментальная установка
6.4.1.1 Объем смеси поверхностная вода - очищенная сточная вода в тестовой пробе определяется в зависимости от количества и объема образцов, необходимых для оценки. Как правило, от 1 до 2 л поверхностной воды помещают в бутыли вместимостью 2 или 4 л. Открытые системы, обычно, закрывают пенопластовой или ватной пробкой для сведения к минимуму испарения воды. Проточные тестовые сосуды закупоривают соответствующим устройством, оборудованным пробоотборным отверстием с клапаном для отбора образцов и пропускания входящих и исходящих газовых потоков. Данное устройство может представлять собой резиновую пробку, но при работе с летучими гидрофобными тестовыми веществами рекомендуется использовать стекло. При тестировании летучих веществ также рекомендуется, чтобы газоотводы и трубки пробоотборника были изготовлены из инертных материалов (например, ПТФЭ, нержавеющая сталь, стекло).
6.4.1.2 Свободное пространство тестового сосуда постоянно продувается газом или воздухом, свободным от , со скоростью, достаточной для поддержания в активном иле аэробных условий, но не слишком большой для предотвращения эффективного уноса
. Тестовый сосуд соединяют с серией ловушек, содержащих гидроксид калия (например, 1,5
) или других соответствующих абсорбентов
. Пустые ловушки, как правило, включаются в систему улавливания для предотвращения обратного тока или конденсации.
6.4.2 Оборудование
Используется следующее стандартное лабораторное оборудование:
- различная стеклянная посуда и пипетки;
- магнитные мешалки или шейкер для непрерывного перемешивания содержимого тестовых колб;
- центрифуга;
- pH-метр;
- ванна с твердым (сухой лед)/ацетоном или жидким азотом;
- сушилка с заморозкой (лиофилизатор);
- печь или микроволновая печь для определения сухого веса;
- аппарат для мембранной фильтрации;
- автоклав;
- средства для обработки меченых веществ;
- оборудование для количественного определения и
в жидких и твердых пробах (например, жидкий сцинтилляционный счетчик LSC);
- оборудование для количественного определения и
в твердых пробах (например, окислитель);
- оборудование для улавливания летучих и
из газовой системы улавливания (последовательные ловушки на основе активированного угля или аналогичное оборудование);
- оборудование для ТСХ или ВЭЖХ;
- оборудование для количественного определения и
для ТСХ (сканер) или ВЭЖХ (последовательный детектор);
- аналитическое оборудование для определения исследуемого (и стандартного) вещества, если необходимо проведение конкретного химического анализа (например, газовый хроматограф, хроматограф для ВЭЖХ, масс-спектрометр).
6.4.3 Выбор образцов окружающей среды
6.4.3.1 Источники поверхностной воды, активного ила или очищенной сточной воды должны соответствовать испытанию моделированием. Для проведения оценки конкретного места активный ил или очищенная сточная вода должны быть получены из конкретной станции очистки сточных вод, для которой проводится исследование. Также поверхностная вода должна быть получена вверх по течению от станции очистки сточных вод. Соотношение этих компонентов должно быть выбрано для моделирования сценария удельного потока (например, слабый поток или средний поток). Альтернативно, если известны гидравлические условия ниже водостока, тестовая система может просто состоять из образцов, полученных ниже вытекающего потока. Однако такие условия изменчивы и сложны для моделирования.
6.4.3.2 Для общей оценки активный ил или очищенная сточная вода должны быть получены из обычной установки обработки сточных вод, преимущественно бытовых сточных вод. Также, поверхностная вода должна относиться к типичным поверхностным водам, куда попадают очищенные сточные воды. Если химическое вещество является компонентом сточных вод, поступающих на очистные сооружения, или эпизодически попадает в сточные воды, то свежесобранный активный ил или очищенная сточная вода будут идеальны для выполнения испытания. Очищенная сточная вода с установки по обработке сточных вод состоит из раствора активного ила и биологических твердых веществ, но она может изменяться по уровню твердых веществ и уплотняться хлорированием или другими процессами. Наилучший способ моделирования этого сценария - использовать фильтрованную сточную воду и поверхностную воду в сочетании соотношения разбавления целевого продукта и отдельного добавления биологических твердых веществ активного ила с целевой концентрацией. Если очищенную сточную воду трудно получить, активный ил может быть отфильтрован или центрифугирован для извлечения биологических твердых веществ, и затем раствор и биологические твердые вещества в определенной пропорции могут быть добавлены в тестовый материал. Для общей оценки Европейское техническое руководство допускает десятикратное разбавление очищенной сточной воды, содержащей 30 мг/л биологических твердых веществ, в поверхностной воде, содержащей 15 мг/л взвешенных частиц [26]. Поэтому 3 мг биологических твердых веществ в 100 мл фильтрованной сточной воды или раствора активного ила и 900 мл поверхностной воды приближаются к общему сценарию. Дополнительный сценарий с 10 мг биологических твердых веществ и 330 мл фильтрованной сточной воды или раствора на литр также могут быть рассмотрены для моделирования условий для критических низких потоков, которые могут возникнуть во время сухого сезона.
6.4.3.3 Для новых химических веществ, которые будут непрерывно поступать в сточные воды, активный ил в идеальном случае должен быть получен от лабораторной системы очистки сточных вод, как, например, пористый цилиндр или CAS [3], на которую подаются сточные воды с содержанием немеченого исследуемого вещества. Источник исходного ила, сточные воды (приток) и условия испытания (исходная концентрация, гидравлическое время удержания, время удержания твердых веществ) для лабораторной установки должны точно отражать специфические или общие свойства места, для которого проводится исследование. В последнем случае, для общего сценария обработки сточных вод [26] устанавливается 6,9 часов и
9,2 дней. Европейским техническим руководством также предлагаются указания по определению уровня концентрации сточных вод исходя из ожидаемых используемых объемов. В целом, равновесное состояние будет достигнуто в течение двух- или трехкратного времени удержания твердых веществ (
), после чего биологические твердые вещества или очищенная сточная вода могут использоваться для испытания.
6.4.4 Сбор, транспортировка и хранение образцов окружающей среды
Активный ил необходимо отбирать из области аэротенка с хорошим перемешиванием, очищенную сточную воду нужно отбирать с места выгрузки из установки обработки сточных вод. Поверхностную воду следует отбирать с известного места подачи сточных вод. В момент отбора должна регистрироваться температура образцов. Контейнеры для сбора должны обеспечивать достаточную вентиляцию, необходимо предпринять меры по предотвращению значительного повышения температуры образца ила по сравнению с температурой испытания. Активный ил, как правило, хранится при температуре испытания и постоянной аэрации. Образцы не должны храниться в замороженном виде.
6.4.5 Подготовка тестовых проб
6.4.5.1 Поверхностная вода должна быть охарактеризована путем измерения общего содержания взвешенных твердых частиц (), общей жесткости и pH. Подсчет стандартных пластин и анализ органического углерода не обязательны. При использовании активного ила для определения очищенных сточных вод очистных сооружений MLSS просеивают через сито 2 мм, смешивают (по выбору) и дают отстояться. В растворе измеряют уровень концентрации
. В поверхностную воду добавляют раствора объемом, достаточным для достижения концентраций целевых биологических твердых веществ. Если объем, необходимый для достижения пропорции разбавления целевого вещества в тестовом материале, больше, то фильтрованный или центрифугированный раствор активного ила добавляют для достижения необходимой степени разбавления. При использовании очищенных стоков и концентрации целевых твердых веществ биологического происхождения в активном иле сточные воды фильтруют и смешивают с поверхностной водой с целевой пропорцией разбавления. MLSS готовят, как описано выше. Необходимо измерить pH и
в подготовленной смеси поверхностной воды. Также может быть выполнен дополнительный стандартный подсчет количества пластин и анализ органического углерода.
6.4.5.2 Подготовка абиотической смеси, как правило, осуществляется с использованием комбинации химической и тепловой стерилизации. Подтвержденным способом является добавление раствора хлорида ртути (0,1 г/л) в смесь, которую затем обрабатывают в автоклаве в течение минимум 90 минут при температуре и давлении около 121 °C и 15 psi (1 атм) соответственно. Обычно объем среды составляет меньше или равен половине объема контейнера для автоклава (например, 500 мл поверхностной воды в литровом контейнере). После охлаждения рН абиотической смеси необходимо измерять и отрегулировать в зависимости от вида биологически активной смеси. Для уменьшения образования дополнительных отходов, для деактивации смеси поверхностной воды также может быть рассмотрено использование альтернативных подходов.
6.4.6 Подготовка исследуемого вещества
6.4.6.1 В идеальном случае для приготовления основных растворов исследуемого и стандартного веществ необходимо использовать дистиллированную воду. При необходимости альтернативный метод может быть использован для солюбилизирования или диспергирования исследуемого вещества в соответствии с его обычной формой поступления в окружающую среду. Растворимые в воде нетоксичные растворители могут использоваться, если испытание невозможно иначе, но следует уделить внимание органическим компонентам системы, поступающим в систему при добавлении органических растворителей. В качестве альтернативы образец может быть добавлен в тестовую систему в чистом виде таким образом, чтобы обеспечить их максимальное и быстрое распределение в тестовых пробах. Для веществ, которые плохо растворимы в воде и обычно взаимодействуют со взвешенными твердыми веществами, может быть целесообразным адсорбировать исследуемое вещество на инертном твердом носителе, который затем добавляется к тестовой системе. Если исследуемое вещество не может быть равномерно распределено внутри тестовой системы до начальной точки отбора проб, готовятся индивидуальные тестовые системы, которые исключают из испытания на каждом этапе отбора проб.
6.4.6.2 Объем добавленного раствора должен иметь достаточную концентрацию для обеспечения быстрого и равномерного распределения исследуемого вещества в пробе и точного внесения дозы в аналогичные пробы. В идеальном случае, при дозировании водных растворов добавленный объем должен быть 2 мл и
10 мл; для нетоксичных растворителей
0,1 мл/л. При необходимости растворы для дозирования могут быть приготовлены заранее и храниться на холоде. Активность основного раствора необходимо проверить с помощью жидкостной сцинтилляции LSC.
6.4.7 Условия проведения испытания
6.4.7.1 Температура испытания
Инкубация должна проводиться в темноте (предпочтительно) или в рассеянном свете при контролируемой температуре, равной температуре испытания или нормальной лабораторной температуре от 20 до 25 °C.
6.4.7.2 Встряхивание/перемешивание
Для поддержания ила в хорошо перемешанном и суспендированном состоянии тестовые сосуды непрерывно встряхивают или их содержимое непрерывно перемешивают. Встряхивание/перемешивание также облегчает перенос кислорода из свободного пространства сосуда в жидкую фазу, вследствие чего сохраняются необходимые аэробные условия.
6.4.7.3 Продолжительность испытания
Продолжительность испытания должна быть достаточной для оценки степени и скорости биоразложения химического вещества в ходе нормального времени его пребывания в очистных сооружениях в зоне смешения очищенные сточные воды - поверхностная вода. Обычно период испытания длится приблизительно 28 дней. Испытание может быть продлено на большее время для получения дополнительных данных для оценки кинетических констант или определения полноты разложения в условиях испытания. В ином случае, испытание может быть прекращено раньше времени, если процесс разложения достигает плато.
6.4.8 Количество тестовых сосудов
Как минимум, для каждой тестовой концентрации необходимо использовать один абиотический и один биотический сосуд. Для каждой пробы можно подготовить параллельные образцы с целью учета отклонений (например, по три параллельных пробы). Однако увеличение количества проб для каждого образца лучше отразится на качестве кинетических данных, полученных в большем диапазоне, чем увеличение количества параллельных проб.
6.5 Процедура испытания
6.5.1 Дозирование
В начале испытания тестовый сосуд открывают и исследуемое вещество добавляют количественно непосредственно в пробу при постоянном перемешивании. Рекомендуется вводить дозу постепенно ниже уровня воздух-вода для обеспечения равномерного распределения исследуемого вещества в исследуемой среде. Биотические и абиотические образцы дозируют аналогичным способом. Как правило, биотические системы дозируются первыми, а затем абиотические системы. Точное время, как правило, имеет более важное значение для биотических систем по сравнению с абиотическими для проведения кинетических анализов.
6.5.2 График отбора проб
Интервалы отбора проб выбирают, основываясь на существующих данных о биоразложении или результатах предварительного исследования, поскольку универсального установленного графика отбора проб не существует. Рекомендуемый график отбора проб для быстро разлагающихся химических веществ - 5, 30 и 60 минут, с дополнительным отбором проб через 3, 5, 8, 12 и 24 часа. Последующие пробы могут быть отобраны через 2, 3, 4, 5, 6 и 7 дней и каждую неделю до 28-го дня. График отбора проб для медленно разлагающихся химических веществ должен быть разработан так, чтобы в ходе фазы разложения было предусмотрено достаточное количество измерений.
6.5.3 Измерение минерализации
Минерализация может быть измерена прямыми или косвенными методами.
6.5.3.1 Косвенные измерения ![]()
Индивидуальные параллельные пробы (например, 1 мл) отбирают из каждого образца в отдельные флаконы, которые содержат достаточное количество кислоты (например, 1 мл 0,1 н. ) для снижения pH до
2, и помещают в вытяжной шкаф.
В течение нескольких часов пробы барботируют воздухом или оставляют на ночь для того, чтобы растворенный ![]() диффундировал из проб. Пробы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC. Процент
диффундировал из проб. Пробы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC. Процент ![]() рассчитывается из разницы между общим подсчетом в биотических и абиотических пробах.
рассчитывается из разницы между общим подсчетом в биотических и абиотических пробах.
6.5.3.2 Прямые измерения ![]()
Для быстро разлагающихся веществ может быть затруднительным точное измерение скорости выделения ![]() из-за скорости массового переноса
из-за скорости массового переноса ![]() из свободного пространства сосуда в основную ловушку. В данных условиях рекомендуется проводить косвенные измерения
из свободного пространства сосуда в основную ловушку. В данных условиях рекомендуется проводить косвенные измерения ![]() одновременно с прямыми.
одновременно с прямыми.
Выделившийся ![]() : первая основная ловушка системы улавливания удаляется и быстро закупоривается. Остальные ловушки продвигают вперед в том же порядке и за существующими ловушками размещают свежие ловушки, как можно скорее подключают систему улавливания. Повторные пробы (например, 1 мл) из основной ловушки удаляются, помещаются в сцинтилляционные флаконы и смешиваются с сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC.
: первая основная ловушка системы улавливания удаляется и быстро закупоривается. Остальные ловушки продвигают вперед в том же порядке и за существующими ловушками размещают свежие ловушки, как можно скорее подключают систему улавливания. Повторные пробы (например, 1 мл) из основной ловушки удаляются, помещаются в сцинтилляционные флаконы и смешиваются с сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC.
Пробы растворенного ![]() (например, от 25 до 50 мл) удаляются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент
(например, от 25 до 50 мл) удаляются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент (например, 1,5 н. КОН). Сосуды закупоривают и добавляют достаточное количество кислоты (например, 6 н.
) для снижения pH проб до
2 без сообщения проб с атмосферой (Приложение А). Образцам позволяют отстояться в течение достаточно продолжительного времени (например, ночи), чтобы
диффундировал из раствора и произошло его улавливание абсорбентом из свободного пространства сосуда. Образцы абсорбента смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC.
6.5.3.3 Косвенные измерения ![]()
Индивидуальные параллельные пробы (например, 1 мл) отбирают из тестовых образцов в отдельные флаконы, содержащие достаточное количество кислоты (например, 1 мл 0,1 н. ) для снижения величины pH до
2, и помещают в вытяжной шкаф.
Половину образцов немедленно анализируют с помощью LSC для "мокрого" измерения. Остальные образцы полностью сушат для удаления ![]() . Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы и анализируют с помощью LSC. Процентное содержание
. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы и анализируют с помощью LSC. Процентное содержание ![]() рассчитывается исходя из разницы между общим подсчетом в мокрых и сухих образцах и исходным уровнем радиоактивности, введенным в образцы.
рассчитывается исходя из разницы между общим подсчетом в мокрых и сухих образцах и исходным уровнем радиоактивности, введенным в образцы.
6.5.4 Измерение общей радиоактивности поверхностной воды
Малые образцы смешанных жидких проб (например, 1 мл) анализируют непосредственно с помощью LSC для количественного определения оставшейся радиоактивности в каждой пробе поверхностной воды по прошествии определенного периода времени. Данные измерения используются для подтверждения того, что восстановление радиоактивности из экстрагированных образцов является приемлемым и для контроля испарения.
6.5.5 Измерение исходного вещества и продуктов разложения
6.5.5.1 Экстракция
Пробу отбирают из абиотических и биотических образцов. Объем пробы, как правило, составляет 25 мл. Тем не менее объем будет зависеть от тестовой концентрации, удельной активности и чувствительности аналитических процедур.
Для концентрирования и извлечения образцов могут использоваться разные подходы. Подтвержденный подход для нелетучих исследуемых веществ включает мгновенное замораживание образцов с последующей лиофилизацией и экстракцией сухого остатка соответствующим(и) растворителем(ями) для исходного вещества и продуктов разложения. Мгновенное замораживание быстро останавливает биологическую активность без гидролиза или иного изменения лабильных исследуемых веществ. Замораживание является быстрым процессом, если для погружения сосуда с образцом используется достаточно глубокая ванна с сухим льдом/ацетоном или жидким азотом. Уровень заполнения ванны должен покрывать уровень пробы в сосуде. При фильтрации экстракта получают экстрагируемые твердые вещества. Фильтр должен быть совместим с типом растворителя (например, водным или неводным). Полученные экстракты могут быть сконцентрированы выпариванием, и общая радиоактивность в каждом экстракте определяется с помощью LSC.
Для летучих исследуемых веществ образец может быть пропущен через фильтр и колонну или диск твердофазной экстракции, помещенные в тандеме, которые затем элюируют подходящим растворителем для извлечения исследуемого вещества и продуктов разложения. Альтернативно, водные образцы могут экстрагировать с помощью соответствующей системы растворителя с последующей фильтрацией и извлечением твердых веществ биомассы при условии достаточной эффективности экстракции. Общая радиоактивность во всех экстрактах определяется с помощью LSC. При концентрировании экстрактов, содержащих летучие вещества или продукты разложения, следует соблюдать осторожность.
Могут использоваться и другие подходы, но для всех подходов важно регистрировать извлечение и учитывать время, необходимое для прекращения биологической активности, и использовать его для времени отбора проб для кинетического анализа.
6.5.5.2 Анализ исходного вещества и продуктов разложения
Относительно большое содержание исходного вещества и продуктов разложения в экстрактах может быть определено с помощью тонкослойной хроматографии (ТСХ), высокоэффективной жидкостной хроматографии (ВЭЖХ) или других методов разделения с возможностью обнаружения радиоактивности.
Если доступны чувствительные специфические аналитические методы, первичное биоразложение можно оценить, измеряя общую остаточную концентрацию исследуемого вещества и продуктов разложения вместо использования радиоизотопных методов.
6.5.5.3 Характеристика продуктов разложения
Если возможно, хроматографическое поведение неизвестных пиков необходимо сравнивать с пиками для ожидаемых продуктов разложения, если существуют соответствующие аутентичные стандарты. В общем случае количество и чистота продуктов разложения, полученных в настоящем испытании, делает невозможным проведение окончательной идентификации другими прямыми способами. В зависимости от хроматографического поведения, как правило, можно определить, является ли метаболит более или менее полярным, чем исходное вещество. Такая информация в сочетании с известными биохимическими реакциями и появлением и исчезновением метаболита в ходе биоразложения может сформировать дополнительную основу для идентификации. Если необходимо, основных продуктов разложения может быть оценено с помощью ВЭЖХ (например, [27]) с использованием поточного детектора радиоактивности.
6.5.6 Измерение извлеченных твердых веществ
Извлеченные твердые вещества сжигают для определения уровня активности оставшихся твердых веществ. Альтернативно фильтры могут анализировать непосредственно с помощью LSC. Однако при высоком уровне растворенного ![]() на фильтре сохраняются микроорганизмы и карбонаты. В таких случаях фильтр погружают в слабый раствор кислоты (1 мл 0,1 н.
на фильтре сохраняются микроорганизмы и карбонаты. В таких случаях фильтр погружают в слабый раствор кислоты (1 мл 0,1 н. ) на некоторое время (например, на ночь), чтобы
![]() диффундировал из образцов перед проведением анализа LSC. Уровень радиоактивности в биотических твердых веществах выше, чем в твердых телах из абиотического контроля, что обычно является свидетельством включения радиоактивности в биомассу.
диффундировал из образцов перед проведением анализа LSC. Уровень радиоактивности в биотических твердых веществах выше, чем в твердых телах из абиотического контроля, что обычно является свидетельством включения радиоактивности в биомассу.
6.5.7 Измерение радиоактивности летучих веществ
Летучие исследуемые вещества извлекаются из ловушек соответствующими растворителями, и радиоактивность экстрактов анализируется с помощью LSC. Относительно большое количество исходного вещества и продуктов разложения в экстракте(ах) может быть определено, как описано выше.
7 Биоразложение в смешанной системе: необработанные сточные воды - поверхностные воды
7.1 Введение
7.1.1 Общепринятой практикой развивающихся регионов, в которых отсутствует очистка сточных вод, является слив стоков непосредственно в поверхностные воды. Данный метод испытания создан для моделирования таких ситуаций и оценки биоразлагаемости химического вещества, попадающего в поверхностные воды в составе неочищенных стоков. Определяя степень биоразложения, а также скорость первичного и полного биоразложения в условиях непосредственного слива, можно получить полезные сведения, используемые для оценки снижения концентрации химических веществ, в результате биоразложения, по мере движения воды из места выпуска сточных вод. К тому же, данное снижение может быть сопоставлено с уменьшениями показателей остальных компонентов сточных вод, таких как биохимическая потребность в кислороде (), химическая потребность в кислороде (
) или общее количество органического углерода (
). Система испытания состоит из свежесобранных образцов сточных и поверхностных вод. Полезность установленных результатов скорости заключается в точном прогнозировании нижепоточного воздействия, поскольку помогут сопоставить точность моделирования с действительными условиями смешанной зоны. Наряду с концентрацией опытного материала, при создании теста необходимо учитывать такие факторы, как концентрация кислорода и степень, до которой происходит разжижение выходящего потока в поверхностных водах.
7.1.2 Что касается химических веществ, присутствующих в сточной воде, то для них свежесобранные образцы сточных вод и поверхностных вод, инкубированные следовым количеством вещества с радиоактивной меткой, обеспечат самые реалистичные кинетические параметры, касающиеся текущей нагрузки химического вещества. Для веществ, не всегда присутствующих в сточных водах, следует добавить достаточное количество опытного химического вещества (меченого и немеченого), до приблизительно ожидаемой концентрации в сточных водах во время эпизодического выпуска или после промышленного внедрения нового химического вещества. Подходы для оценки ожидаемых концентраций в сточных водах можно найти в [25] и [26].
7.1.3 Наилучшим способом при низком уровне разбавления является инкубирование смесей в условиях пониженного содержания растворенного кислорода () (от 1 до 4 мг/л) для моделирования потребности кислорода до места сброса сточной воды. В испытании такого типа, химическое вещество и популяции разрушителей не находятся в неизменном состоянии, поэтому наблюдаемая кинетика будет квазипервого или второго порядка Monod.
7.1.4 Испытание может быть выполнено однофазным или двуфазным способом. В последнем случае, биоразлагаемость оценивают в сточной воде, затем разбавляют в очищенной или поверхностных водах, содержащих сточные. В данном испытании опытное химическое вещество дозируют в сточные воды, разбавляемые в очищенных поверхностных водах, отслеживая при этом исчезновение опытного вещества и традиционных загрязняющих веществ (по ,
, т.п.) на протяжении времени (фаза 1). После чего добавляют вторую дозу опытного химического вещества и сточной воды в эту же систему для моделирования разбавления сточных вод в поверхностных водах, предварительно загрязненных сточными (фаза 2).
7.2 Общая процедура испытания
7.2.1 Опытное химическое вещество инкубируют с использованием абиотической и биотической смеси сточных вод и поверхностных вод, обычно в условиях уменьшенного содержания РК (от 1 до 4 мг/л) на протяжении всего периода. Отношение данных компонентов основано на специальных или общих сценариях сброса стоков в поверхностные воды. Биологическая активность подавляется при абиотическом контроле, который используется для оценки минерализации по разнице, определяющей эффективность экстракции и восстановления исходной молекулы, и количественного описания других процессов разложения, таких как гидролиз, окисление, испарение или сорбция на экспериментальном оборудовании.
7.2.2 Если определен аналитический метод с необходимой чувствительностью, скорость разложения или трансформации исходного вещества может быть определена с использованием немеченого исследуемого вещества или по последующей убыли химического вещества непосредственно в сточных водах. Тем не менее окончательное биоразложение не может быть определено, если путь биоразложения не известен достаточно хорошо и для потенциальных продуктов разложения не доступны аналитические методы с необходимой чувствительностью.
7.2.3 Экологически значимые концентрации исследуемого вещества дозируются в абиотические и биотические тестовые системы, которые инкубируются при соответствующей температуре с непрерывным перемешиванием. Биотические образцы инкубируются таким образом, что содержание растворенного кислорода сохраняет пониженный уровень (1 мг/л), характеризуя ситуацию ниже сброса сточных вод. Образцы периодически удаляются для определения минерализации и первичной биодеградации, попутно этому может быть определен уровень остальных компонентов сточных вод (например, ,
и аммиак).
7.2.4 В обеих фазах теста, как только произошло выравнивание биоразлагаемости опытного химического вещества и компонентов сточных вод, смешивают вторую дозу опытного химического вещества и свежих стоков в имеющейся опытной системе для моделирования разбавления сточных вод предварительно загрязненными поверхностными водами, после чего вновь проводят отбор проб.
7.2.5 Тесты могут быть выполнены с использованием открытой или герметичной проточной системы, где используются ловушки для улавливания выделяющегося ![]() . Закрытая проточная система является обязательной для летучих исследуемых веществ и обычно используется для
. Закрытая проточная система является обязательной для летучих исследуемых веществ и обычно используется для меченых исследуемых веществ. Открытые системы применимы для нелетучих химических веществ
и предназначены для детализации кинетики процесса биоразложения нелетучих
меченых исследуемых веществ, чья способность к минерализации была установлена ранее. В открытой системе минерализация до
![]() может быть определена косвенно путем измерения разности между остаточной радиоактивности образцов биотической и абиотической систем после подкисления. Кроме того, минерализация до
может быть определена косвенно путем измерения разности между остаточной радиоактивности образцов биотической и абиотической систем после подкисления. Кроме того, минерализация до ![]() может быть определена косвенно путем измерения разницы в радиоактивности образцов после сушки. В проточных системах выделяющийся
может быть определена косвенно путем измерения разницы в радиоактивности образцов после сушки. В проточных системах выделяющийся ![]() измеряется непосредственно в основной ловушке. Кроме того, растворенный
измеряется непосредственно в основной ловушке. Кроме того, растворенный ![]() определяется путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
определяется путем подкисления образцов в закрытом сосуде и измерения радиоактивности в основной ловушке, содержащейся в сосуде.
7.2.6 Образцы из обоих испытаний анализируют на общую радиоактивность, извлекаемые исходное вещество и продукты разложения и радиоактивность извлекаемых твердых веществ. Содержание исходного вещества и продуктов разложения определяется с помощью хроматографического разделения и, если возможно, радиоаналитических методов обнаружения. Твердые вещества, остающиеся после процесса экстракции, сжигают для оценки включения в биомассу по разнице. Полный массовый баланс тестовой системы получают из полной суммы всех фракций для каждого образца.
7.3 Применимость метода
Метод можно легко использовать для растворимых в воде или плохо растворимых материалов, которые не являются летучими. Метод также может быть адаптирован для летучих веществ. Как правило, для оценки минерализации требуются или
радиоактивные метки. Для оценки первичного биоразложения можно использовать и меченые, и немеченые соединения.
7.4 Описание метода испытания
7.4.1 Экспериментальная установка
7.4.1.1 Объем сточных вод в тестовой пробе определяется в зависимости от количества и объема образцов, необходимых для оценки. Как правило, от 1 до 2 л сточных вод помещаются в двух или четырехлитровые колбы. В наилучшем случае, сточные воды инкубируют в условиях контролируемого (например, 1 и 4 мг/л
). Выполнение данного условия можно обеспечить с помощью кислородного зонда, погруженного в сточную воду и соединенного с кислородным контроллером, подключенным к приводу клапана, который контролирует аэрацию сточных вод (приложение А). Такая аэрация сбалансирована с непрерывным барботированием сточных вод азотом для достижения целевого уровня
. Кроме того, сточные воды можно инкубировать при перемешивании, но с минимальной аэрацией для соблюдения низкого уровня
, для поддержания необходимого уровня
в тестовую систему можно периодически добавлять азот или воздух. В этом случае значения РК необходимо регистрировать с регулярными интервалами.
7.4.1.2 Открытая тестовая система обычно закупорена пробкой из пенопласта или ваты, чтобы свести к минимуму потери воды при испарении. Проточные системы закупорены соответствующим устройством, оборудованным пробоотборным отверстием с клапаном для отбора образцов сточных вод и пропускания входящих и исходящих газовых потоков. Данное устройство может представлять собой резиновую пробку, но может потребоваться и стеклянный вид заглушки при работе с летучими гидрофобными тестовыми веществами. При тестировании летучих веществ рекомендуется, чтобы газоотводы и трубки пробоотборника были изготовлены из инертных материалов (например, ПТФЭ, нержавеющая сталь, стекло).
7.4.1.3 Свободное пространство тестового сосуда постоянно продувается воздухом или воздухом, не содержащим , со скоростью, достаточной для поддержания аэробных условий в системе, но не слишком большой для предотвращения значительного уноса
. Тестовый сосуд соединяют с серией ловушек, содержащих гидроксид калия (например, 1,5 н.) или других соответствующих абсорбентов
. Пустые ловушки, как правило, включают и устанавливают в системе улавливания перед абсорбентом для предотвращения обратного тока или конденсации.
7.4.2 Оборудование:
- различная стеклянная посуда и пипетки;
- магнитные мешалки или шейкер для непрерывного перемешивания содержимого тестовых колб;
- центрифуга;
- pH-метр;
- ванна с твердым (сухой лед)/ацетоном или жидким азотом;
- сушилка с заморозкой (лиофилизатор);
- печь или микроволновая печь для определения сухого веса;
- аппарат для мембранной фильтрации;
- автоклав;
- средства для обработки меченых веществ;
- оборудование для количественного определения и
в жидких и твердых пробах (например, жидкий сцинтилляционный счетчик LSC);
- оборудование для количественного определения и
в твердых пробах (например, окислитель);
- оборудование для улавливания летучих и
из газовой системы улавливания (последовательные ловушки на основе активированного угля или аналогичное оборудование);
- оборудование для ТСХ или ВЭЖХ;
- оборудование для количественного определения и
для ТСХ (сканер) или ВЭЖХ (поточный детектор);
- аналитическое оборудование для определения исследуемого (и стандартного) вещества, если необходимо проведение конкретного химического анализа (например, газовый хроматограф, высокоэффективный жидкостной хроматограф, масс-спектрометр).
7.4.2.1 Использование следующего лабораторного оборудования не является обязательным, но может быть полезным:
- оксиметр;
- кислородный контроллер с датчиком и приводом клапанов;
- сосуды для определения ХПК;
- набор реагентов (азотистый аммоний);
- спектрофотометр;
- анализатор органического углерода.
7.4.3 Выбор сточных вод
7.4.3.1 Источники сточных вод должны соответствовать цели проведения испытаний. Для проведения оценки конкретного места сточные воды должны быть получены из конкретной канализационной системы, для которой проводится исследование, поверхностные воды должны быть получены выше по потоку места сброса сточных вод. Выбираемое отношение данных компонентов должно моделировать определенный сценарий течения потока (например, меженный сток, среднегодовой сток). Или же, если известны гидравлические условия ниже места сброса стоков, то тестовая система может просто состоять из образцов, полученных ниже по потоку от стока. Хотя такие условия не постоянны и трудновоспроизводимы.
7.4.3.2 Для общей оценки образцы сточных вод должны быть преимущественно получены из бытовых источников, поверхностные воды должны являться типичными поверхностными водами, в которые происходит сброс стоков. Хотя это трудно воспроизвести на практике, в Европейском Техническом Руководстве стандартный уровень твердых веществ и в сточных водах составляет 450 мг/л и 270 мг/л соответственно [26]. В Северной Америке типичные сточные воды содержат от 100 до 350 мг/л суспендированных твердых веществ,
составляет 110-400 мг/л [1].
7.4.4 Сбор, транспортировка и хранение сточных вод
7.4.4.1 Сточные воды должны быть собраны в точке доступа в канализацию или на входе на станцию очистки сточных вод. Температура образца должна быть зарегистрирована в момент отбора. Во время транспортировки температура образца не должна значительно превышать температуру испытания. Сточные воды, как правило, хранятся при температуре испытания с медленным перемешиванием. Образцы не следует хранить в замороженном виде.
7.4.4.2 Поверхностные воды должны быть собраны в точке с известными количествами сброса сточных вод. Температура образца должна быть зарегистрирована в момент отбора. Во время транспортировки температура образца не должна значительно превышать температуру испытания. Поверхностные воды, как правило, хранятся при температуре испытания с непрерывной аэрацией. Образцы не следует хранить в замороженном виде.
7.4.5 Подготовка тестовых проб
7.4.5.1 В свежесобранных пробах сточных вод не должно быть значительного содержания грубых частиц. В сточных водах необходимо определить общее содержание взвешенных твердых частиц (), pH,
. По возможности можно определить
, органический углерод и выполнить стандартный чашечный подсчет. Характеристика поверхностных вод должна осуществляться измерением общего содержания
, общей жесткости и уровня pH. Стандартный чашечный подсчет и анализ для выявления органического углерода являются необязательными. Сточные воды добавляют к поверхностным в объеме, достаточном, чтобы достигнуть нужного разбавления сточных вод в поверхностных. Измеряют уровень pH,
и
приготовленной смеси поверхностных вод. Также для данной смеси дополнительно может быть выполнен стандартный чашечный подсчет, анализ для определения уровня
и органического углерода.
7.4.5.2 Подготовка абиотических проб, как правило, осуществляется с использованием комбинации химической и тепловой стерилизации. Подтвержденным способом является добавление в сточные воды хлорида ртути (![]() 0,1 г/л). Затем сточные воды обрабатывают в автоклаве в течение минимум 90 минут при температуре и давлении около 121 °C и 15 psi (1 атм) соответственно. Обычно объем среды должен быть менее или равным половины объема контейнера для автоклава (например, 500 мл сточных вод в литровом контейнере). После охлаждения рН абиотической пробы необходимо измерить и отрегулировать в зависимости от вида биологически активного образца. Для уменьшения образования отходов, для деактивации образца также может быть рассмотрено использование альтернативных подходов.
0,1 г/л). Затем сточные воды обрабатывают в автоклаве в течение минимум 90 минут при температуре и давлении около 121 °C и 15 psi (1 атм) соответственно. Обычно объем среды должен быть менее или равным половины объема контейнера для автоклава (например, 500 мл сточных вод в литровом контейнере). После охлаждения рН абиотической пробы необходимо измерить и отрегулировать в зависимости от вида биологически активного образца. Для уменьшения образования отходов, для деактивации образца также может быть рассмотрено использование альтернативных подходов.
7.4.6 Подготовка исследуемого вещества
7.4.6.1 В наилучшем случае для приготовления основных растворов исследуемого и стандартного веществ необходимо использовать дистиллированную воду. При необходимости альтернативный метод может быть использован для растворения или диспергирования исследуемого вещества в соответствии с его обычной формой поступления в исследуемые компоненты окружающей среды. Растворимые в воде нетоксичные растворители могут использоваться, если проведение испытания невозможно другим способом, но необходимо уделить внимание органической нагрузке, возникающей с добавлением органических растворителей. Для веществ, которые являются плохо растворимыми в воде и взаимодействующих с взвешенными веществами в сточных водах, может быть целесообразным адсорбировать исследуемое вещество на инертном твердом носителе, который затем добавляется к тестовой системе. Если исследуемое вещество не может быть равномерно распределено внутри тестовой системы до начальной точки отбора проб, готовятся индивидуальные тестовые системы, которые исключают из испытания на каждом этапе отбора проб.
7.4.6.2 Объем добавленного раствора должен иметь достаточную концентрацию для обеспечения быстрого и равномерного распределения исследуемого вещества в пробе и точного внесения дозы в аналогичные пробы. В идеальном случае при дозировании водных растворов добавленный объем должен быть более 2 мл и менее 10 мл; для нетоксичных растворов менее 0,1 мл/л. При необходимости раствор для дозирования может быть подготовлен заранее и храниться в холодильнике. Активность основного раствора необходимо проверить с помощью LSC.
7.4.7 Условия испытания
7.4.7.1 Температура проведения испытания
Инкубация должна проводиться в темноте (предпочтительно) или в рассеянном свете при контролируемой температуре, равной температуре отбора проб или нормальной лабораторной температуре 20-25 °C.
7.4.7.2 Перемешивание
Для поддержания твердых веществ во взвешенном состоянии, содержимое тестовых сосудов непрерывно аккуратно перемешивают.
7.4.7.3 Продолжительность испытания
Продолжительность испытания должна быть достаточной для оценки степени и скорости биоразложения химического вещества в ходе нормального времени пребывания в смешанной зоне сточных и поверхностных вод. В норме период испытания продлится 28 дней. Испытание может быть продлено на большее время для получения дополнительных данных для оценки кинетических констант или определения полноты разложения в условиях испытания. И наоборот, испытание может быть прекращено раньше, если процесс разложения достигает плато.
7.4.8 Количество тестовых сосудов
Как минимум, для каждого материала испытания и тестовой концентрации необходимо использовать один абиотический и один биотический сосуд. Для каждой пробы можно подготовить параллельные образцы с целью учета отклонений (например, по три параллельных пробы). Однако увеличение количества проб для каждого образца лучше отразится на качестве кинетических данных, полученных в большем диапазоне, чем увеличение количества параллельных проб.
7.5 Процедура испытания
7.5.1 Дозирование
В начале испытания заглушка тестового сосуда удаляется, и исследуемое вещество добавляют количественно непосредственно к образцу при постоянном перемешивании. Рекомендуется вводить дозу постепенно ниже уровня воздух-вода для обеспечения равномерного распределения исследуемого вещества в сточной воде. Биотические и абиотические образцы дозируют аналогичным способом. Как правило, биотические системы дозируются первыми, а затем абиотические системы. Точное время, как правило, имеет более важное значение для биотических систем по сравнению с абиотическими для проведения кинетических анализов.
7.5.2 График отбора проб
Интервалы отбора проб выбирают, основываясь на существующих данных о биоразложении или результатах предварительного исследования, поскольку универсального установленного графика отбора проб не существует. Рекомендуемый график отбора проб для быстро разлагающихся химических веществ - 15, 30 и 60 минут, с дополнительным отбором проб спустя 2, 5, 8, 12 и 24 часа и во 2, 3 и 7-й дни. График отбора проб для медленно разлагающихся химических веществ должен быть разработан так, чтобы в ходе фазы разложения было предусмотрено достаточное количество измерений.
7.5.3 Измерение минерализации
Минерализация может быть измерена прямыми или косвенными методами.
7.5.3.1 Косвенные измерения ![]()
Индивидуальные параллельные образцы (например, 1 мл) отбирают из каждой пробы в отдельные флаконы, которые содержат достаточное количество кислоты (например, 1 мл 0,1 н. ), чтобы снизить уровень pH до
2, и помещают в вытяжной шкаф.
В течение нескольких часов образцы барботируют воздухом или оставляют на ночь для того, чтобы растворенный ![]() диффундировал из образцов. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы образца, и анализируют с помощью LSC. Процент
диффундировал из образцов. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы образца, и анализируют с помощью LSC. Процент ![]() рассчитывается из разницы между общим отсчетом в биотических и абиотических образцах.
рассчитывается из разницы между общим отсчетом в биотических и абиотических образцах.
7.5.3.2 Прямые измерения ![]()
Выделившийся ![]() : первая основная ловушка системы улавливания удаляется и быстро закупоривается. Остальные ловушки продвигают вперед в том же порядке и за существующими ловушками размещают свежие ловушки, как можно скорее подключают систему улавливания. Повторные пробы (например, 1 мл) из основной ловушки удаляются, помещаются в сцинтилляционные флаконы и смешиваются со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC.
: первая основная ловушка системы улавливания удаляется и быстро закупоривается. Остальные ловушки продвигают вперед в том же порядке и за существующими ловушками размещают свежие ловушки, как можно скорее подключают систему улавливания. Повторные пробы (например, 1 мл) из основной ловушки удаляются, помещаются в сцинтилляционные флаконы и смешиваются со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC.
Растворенный ![]() : Пробы (например, от 10 до 25 мл) отбираются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент
: Пробы (например, от 10 до 25 мл) отбираются через отверстие для отбора проб в тестовом сосуде. Затем их помещают в сосуды (например, стеклянный биометр Bellco 2556-10250), оборудованные отсеком, содержащим соответствующий абсорбент (например, 1,5 н.
). Сосуды закупоривают и добавляют достаточное количество кислоты (например, 6 н.
) для снижения pH проб до уровня менее двух без сообщения проб с атмосферой (приложение А). Образцам позволяют отстояться в течение достаточно продолжительного времени (например, ночи), чтобы
диффундировал из раствора, и произошло его улавливание сорбентом из свободного пространства сосуда. Образцы сорбента смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC.
7.5.3.3 Косвенное измерение ![]()
Индивидуальные параллельные пробы (например, 1 мл) отбирают из тестового образца в отдельные флаконы, содержащие достаточное количество кислоты (например, 1 мл 0,1 н. ) для снижения величины рН до уровня
2, и помещают в вытяжной шкаф.
Половину проб немедленно анализируют с помощью LSC для "мокрого" измерения. Остальные пробы полностью сушат для удаления ![]() . Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC. Процентное содержание
. Образцы смешивают со сцинтилляционным коктейлем, подходящим для матрицы пробы, и анализируют с помощью LSC. Процентное содержание ![]() рассчитывается исходя из разницы между общим отсчетом в мокрых и сухих пробах и исходным уровнем радиоактивности, введенным в образцы.
рассчитывается исходя из разницы между общим отсчетом в мокрых и сухих пробах и исходным уровнем радиоактивности, введенным в образцы.
7.5.4 Измерение общей радиоактивности в сточных водах
Параллельные пробы малого объема (например, 1 мл) анализируют непосредственно с помощью LSC для количественного определения оставшейся радиоактивности в каждом образце с течением времени. Данные измерения используются для подтверждения того, что восстановление радиоактивности из извлеченных образцов является приемлемым и для контроля испарения.
7.5.5 Измерение исходного вещества и продуктов разложения
7.5.5.1 Экстракция
Пробы отбирают из абиотических и биотических образцов. Объем пробы, как правило, составляет более 10 мл. Тем не менее объем будет зависеть от тестовой концентрации, удельной активности и чувствительности аналитических процедур.
Различные подходы могут использоваться для концентрирования и извлечения образцов. Например, подтвержденный подход для нелетучих исследуемых веществ включает мгновенное замораживание образцов с последующей лиофилизацией и экстракцией сухого остатка соответствующим растворителем(ями) для исходного вещества и продуктов разложения. Мгновенное замораживание быстро останавливает биологическую активность без гидролиза или иного изменения лабильных исследуемых веществ. Замораживание является быстрым процессом, если для погружения сосуда с образцом имеется достаточная глубина ванны с сухим льдом/ацетоном или жидким азотом. Уровень заполнения ванны должен покрывать уровень пробы в сосуде. Экстрагируют лиофилизированные твердые вещества, после чего экстракт фильтруют для выделения экстрагированных твердых веществ. Фильтр должен быть совместим с типом растворителя (например, водным или неводным). Полученные экстракты могут быть сконцентрированы испарением, и общая радиоактивность в каждом экстракте определяется с помощью LSC.
Для летучих исследуемых веществ образец может быть пропущен через фильтр и твердую фазу экстракционной колонны или диск твердофазной экстракции (ТФЭ), расположенные в тандеме, которые затем элюируют с подходящим растворителем для извлечения исходного вещества и продуктов разложения. В альтернативных случаях возможно напрямую экстрагировать водный образец с использованием соответствующей системы растворителя, а затем пропустить через фильтр для извлечения твердых веществ биомассы. Общая радиоактивность во всех экстрактах определяется с помощью LSC. При концентрировании экстрактов, содержащих летучие исследуемые вещества или продукты разложения, необходимо соблюдать осторожность.
Могут использоваться и другие подходы, но для всех подходов важно регистрировать извлечение и учитывать время, необходимое для прекращения биологической активности, и использовать его для времени отбора проб для кинетического анализа.
7.5.5.2 Анализ исходного вещества и продуктов разложения
Относительно большое количество исходного вещества и продуктов разложения в экстрактах можно определять с помощью ТСХ, ВЭЖХ или других методов разделения с возможностью радиоактивного обнаружения.
Если доступны специфические чувствительные аналитические методы, первичное биоразложение можно оценить, измеряя общую остаточную концентрацию исследуемого вещества и продуктов разложения вместо использования радиоизотопных методов.
7.5.5.3 Характеристика продуктов разложения
Если возможно, хроматографическое поведение неизвестных пиков необходимо сравнивать с пиками для ожидаемых продуктов разложения, если существуют соответствующие аутентичные стандарты. В общем случае количество и чистота продуктов разложения, полученных в настоящем испытании, делает невозможным проведение окончательной идентификации другими прямыми способами. В зависимости от хроматографического поведения, как правило, можно определить, является ли метаболит более или менее полярным, чем исходное вещество. Такая информация в сочетании с известными биохимическими реакциями и появлением и исчезновением метаболита в ходе биоразложения может сформировать дополнительную основу для идентификации. Если необходимо, основных продуктов разложения может быть оценено с помощью ВЭЖХ (например, [27]) с использованием поточного детектора радиоактивности.
7.5.6 Измерение извлеченных твердых веществ и степени включения в биомассу
Фильтры сжигают с экстрагированными твердыми веществами для определения уровня активности оставшихся твердых веществ. В противном случае, если уровень твердых веществ достаточно низкий, что позволяет выполнение анализа LSC, анализ фильтров может выполняться непосредственно LSC. Тем не менее в растворенном состоянии присутствует в высоких концентрациях, поэтому фильтр будет удерживать как микроорганизмы, так и углекислые соли. В таких обстоятельствах фильтр следует вымочить в слабокислом растворе (1 мл 0,1 н.
) в течение достаточного времени (например, на протяжении ночи), для диффундирования
![]() из образцов перед анализом LSC. Уровень радиоактивности в биотических твердых веществах выше, чем в твердых телах из абиотического контроля, обычно является свидетельством включения радиоактивности в биомассу.
из образцов перед анализом LSC. Уровень радиоактивности в биотических твердых веществах выше, чем в твердых телах из абиотического контроля, обычно является свидетельством включения радиоактивности в биомассу.
7.5.7 Измерение радиоактивности летучих веществ
При исследовании летучих веществ, летучие вещества экстрагируют из ловушек соответствующими растворителями, и радиоактивность экстрактов анализируется с LSC. Относительное большое количество исходного вещества и продуктов разложения в экстракте(ах) может быть определено, как описано выше.
Приложение А

Рисунок А.1 - Пример проточной испытательной установки

Рисунок А.2 - Пример проточной испытательной установки с контролируемой концентрацией растворенного кислорода

Рисунок А.3 - Система для улавливания растворенного ![]()

Рисунок А.4 - Пример проточной системы для испытаний в анаэробных условиях
Библиография
[1] | Tchobanoglous G and Burton FL (Revs). (1991). Wastewater Engineering: treatment, disposal and reuse/Metcalf & Eddy, Inc. McGraw-Hill. New York, NY, USA. - Чобаноглу Г., Бартон Ф.Л. (1991). |
[2] | OECD (1992). Guidelines for the Testing of Chemicals. TG 301: Ready Biodegradability. OECD, Paris. - ОЭСР (1992). |
[3] | OECD (2001). Guidelines for the Testing of Chemicals. TG 303: Simulation Test. Aerobic Sewage Treatment. OECD, Paris. - ОЭСР (2001). |
[4] | OECD (2004). Guidelines for the Testing of Chemicals. TG 309: Aerobic Mineralization in Surface water - Simulation Biodegradation Test. OECD, Paris. - ОЭСР (2004). |
[5] | OECD (2006). Guidelines for the Testing of Chemicals. TG 310: Ready Biodegradability - |
[6] | OECD (2006). Guidelines for the Testing of Chemicals. TG 311: Anaerobic Biodegradability of Organic Compounds in Digested Sludge: Measurement of gas production. OECD, Paris. |
[7] | Matthijs, E.; Debaere, G.; Itrich, N.R.; Masscheleyn, P.; Rottiers, A.; Stalmans, M.; Federle, T.W. (1995). The Fate of Detergent Surfactants in Sewer Systems. Water Sci Technol. 13:321-328. |
[8] | Federle, T.W.; Itrich, N.R. (1997). A comprehensive approach for assessing the kinetics of primary and ultimate biodegradation of chemicals in activated sludge: Application to linear alkylbenzene sulfonate (LAS). Environ Sci. STechnol. 31:3597-3603. |
[9] | Itrich, N.R.; Federle, T.W. (2004). Effect of ethoxylate number and alkyl chain length on the pathway and kinetics of linear alcohol ethoxylate biodegradation in activated sludge. Environ. Toxicol. Chem 23: 2790-2798. |
[10] | Federle, T.W.; Itrich, N.R. (2006). Fate of free and linear alcohol ethoxylate derived fatty alcohols in Activated Sludge. Ecotox. Environ. Safety 64: 30-41. |
[11] | Steber, J.; Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Res., 21, 661-667. - Штебер Дж., Вайрих П. (1987). |
[12] | Nuck, В.A.; Federle, T.W. (1996). Batch test for assessing the mineralization of 14C radiolabelled compounds under realistic anaerobic conditions. Environ Sci. &Technol 30: 3597-3600 |
[13] | Nature 218, 472-473 (4 May 1968) Tritium exchange from compounds in dilute aqueous solutions, Waterfield WR, Spanner JA, Stanford FG. |
[14] | OECD (1995). Guidelines for the Testing of Chemicals. TG 105: Water Solubility. OECD, Paris. |
[15] | OECD (1981). Guidelines for the Testing of Chemicals. TG 112: Dissociation Constants in Water. OECD, Paris. |
[16] | OECD (1995). Guidelines for the Testing of Chemicals. TG 104: Vapour Pressure. OECD, Paris. |
[17] | OECD (2004). Guidelines for the Testing of Chemicals. TG 111: Hydrolysis as a function of pH. OECD, Paris. |
[18] | OECD (1984). Guidelines for the Testing of Chemicals. TG 209: Activated Sludge, Respiration Inhibition Test. OECD, Paris. |
[19] | OECD (1992). Guidelines for the Testing of Chemicals. TG 301: Ready Biodegradability. OECD, Paris. |
[20] | OECD (2006). Guidelines for the Testing of Chemicals. TG 310: Ready Biodegradability - |
[21] | OECD (1981). Guidelines for the Testing of Chemicals. TG 302 A: Inherent Biodegradability: Modified SCAS Test. OECD, Paris |
[22] | OECD (1992). Guidelines for the Testing of Chemicals. TG 302 B: Inherent Biodegradability: Zahn Wellens/EMPA Test. OECD, Paris |
[23] | OECD (1981). Guidelines for the Testing of Chemicals. TG 302 C: Inherent Biodegradability: MITI Test (II). OECD, Paris. |
[24] | Guidance Document on Estimating Persistence and Degradation Kinetics from Environmental Fate Studies on Pesticides in EU Registration (2006). Report of the FOCUS Work Group on Degradation Kinetics, EC Document Reference Sanco/10058/2005 version 2.0, 434 pp. |
[25] | Holman, W.F. Estimating the Environmental Concentrations of Consumer Product Components. (1981). Aquatic. Toxicology and Hazard Assessment - 4th Conference, pp. 159-182. Branson, D.R. Dickson, K.L., eds. STP 737. American Society for Testing and Materials, Philadelphia, PA. |
[26] | European Chemicals Bureau (2003) Technical Guidance Document on Risk Assessment: Part II. European Commission Joint Research Centre. |
[27] | OECD (2004). Guidelines for testing of chemicals. TG 117: Partition Coefficient (n-octanol/water). High Performance Liquid Chromatography (HPLC) Method. OECD, Paris. |
[28] | Sutherland, I.W.; Wilkinson, J.F. (1971) In Methods in Microbiology. Vol 5B. Norris, J.R., D.W. Eds. Academic Press, Inc, New York. pp. 345-383. - Саузерлэнд И.В., Вилкинсон Дж.Ф. (1971). |
______________________________________________________________________
УДК 628.543:543:006.354 МКС 71.040.50 Т58
Ключевые слова: биоразложение, метод моделирования сточных вод, биоразложение в системе сточных вод, биоразложение в системе активного ила
______________________________________________________________________
Электронный текст документа
и сверен по:
, 2014
