ГОСТ Р ИСО 11239-2014
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИНФОРМАТИЗАЦИЯ ЗДОРОВЬЯ
Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, путях введения и упаковке
Health informatics - Identification of medicinal products. Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging
ОКС 35.240.80
Дата введения 2015-10-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Центральный научно-исследовательский институт организации и информатизации здравоохранения Министерства здравоохранения Российской Федерации" (ФГБУ ЦНИИОИЗ Минздрава) и Федеральным бюджетным учреждением "Консультационно-внедренческая фирма в области международной стандартизации и сертификации "Фирма "ИНТЕРСТАНДАРТ" на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 468 "Информатизация здоровья" при ЦНИИОИЗ Минздрава - постоянным представителем ISO ТС 215
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 17 ноября 2014 г. N 1619-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 11239* "Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, путях введения и упаковке" (ISO 11239:2012 "Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в справочном дополнительном приложении ДА.
5 ВВЕДЕН ВПЕРВЫЕ
6 ПЕРЕИЗДАНИЕ. Декабрь 2018 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Настоящий стандарт разработан в связи с широкой мировой потребностью в международной гармонизации описаний лекарственных средств. Он является одним из пяти стандартов, образующих базис уникальной идентификации лекарственных средств. В эту группу стандартов входят:
ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах);
ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах);
ISO 11238, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях);
ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке);
ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения).
Эти стандарты идентификации лекарственных средств (IDMP - Identification of Medicinal Products) предназначены для поддержки деятельности органов контроля обращения лекарственных средств во всем мире, включая контроль за разработкой и регистрацией лекарственных средств, управление их жизненным циклом, а также контроль рисков и фармаконадзор.
Для достижения основных целей контроля обращения лекарственных средств и фармаконадзора необходимо обеспечивать надежный, качественный и согласованный обмен информацией о лекарственных средствах. Поэтому стандарты IDMP регламентируют как минимум следующие обмены информацией:
- между органами контроля обращения лекарственных средств;
- между фармацевтической фирмой и органом контроля обращения лекарственных средств;
- между спонсором клинического исследования и органом контроля обращения лекарственных средств;
- между органом контроля обращения лекарственных средств и другими участниками обращения лекарственных средств;
- между органами контроля обращения лекарственных средств и международными источниками данных.
Составными частями стандартов IDMP являются спецификации сообщений. Они служат для описания и обеспечения целостности указанных выше обменов информацией.
Уникальные идентификаторы, присвоенные в соответствии со стандартами IDMP, предназначены для использования в тех приложениях, которым необходима надежная идентификация и отслеживание применения лекарственных средств.
Для различных целей и разных условий в стандартах информатизации здоровья, фармации и контроля лекарственных средств используется большое число базовых понятий. В настоящем стандарте приведены те термины и определения понятий, которые предназначены для уникальной идентификации регистрируемых лекарственных средств, описания их свойств и передачи соответствующей информации.
Термины и определения, принятые в настоящем стандарте, предназначены для облегчения интерпретации и применения юридических и нормативных требований, но они не должны превалировать над юридически обязывающими документами. В случае сомнения или потенциального конфликта должны применяться термины и определения, принятые в юридически обязывающих документах.
В настоящем стандарте предложены элементы данных, существенно необходимые для описания нормативных терминов, используемых для идентификации лекарственных дозированных форм, единиц представления, путей введения и упаковки, а также для перевода терминов на другой язык и ведения версий. Кроме того, в нем приведены рекомендации по отображению терминов, которые уже используются участниками обращения лекарственных средств, на систему понятий, предложенную в настоящем стандарте.
Верхний уровень понятий включает в себя:
- лекарственную дозированную форму;
- единицы представления;
- пути введения;
- упаковку.
Более технические элементы данных, обеспечивающие представление этих понятий, описаны отдельно от них. К ним относятся:
a) термины и коды;
b) переводы на другой язык;
c) версии;
d) отображения.
1 Область применения
В настоящем стандарте описаны:
- элементы данных, структуры и отношения между ними, необходимые для обмена информацией, которая уникально и однозначно идентифицирует лекарственные дозированные формы, единицы представления, пути введения и единицы упаковки (контейнеры, пробки, крышки и устройства применения), относящиеся к лекарственным средствам;
- способы установления связи между переводами отдельных понятий на разные языки, являющимися неотъемлемой частью обмена информацией;
- способ описания версий понятий, позволяющий отслеживать их эволюцию;
- правила, позволяющие местным уполномоченным органам создавать гармонизированные и конструктивные отображения существующих местных терминов на термины, предложенные в соответствии с настоящим стандартом.
Кроме того, в целях обеспечения успешного применения настоящего стандарта, в него включены ссылки, необходимые для использования других стандартов идентификации лекарственных средств группы IDMP (Identification of Medicinal Products) и стандартов обмена информацией о лекарственных средствах.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные документы*. Для датированных ссылок применяют только указанное издание ссылочного документа, для недатированных ссылок применяют последнее издание ссылочного документа (включая все его изменения).
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 639 (all parts), Codes for the representation of names of languages [(все части) Коды для представления названий языков]
ISO 3166 (all parts), Codes for the representation of names of countries and their subdivisions [(все части) Коды для представления названий стран и единиц их административно-территориального деления]
ISO 21090, Health informatics - Harmonized data types for information interchange [Информатизация здоровья. Гармонизированные типы данных для обмена информацией]
3 Термины, определения и сокращения
3.1 Термины и определения
Для целей настоящего стандарта используются следующие термины и определения.
3.1.1 применяемая дозированная форма (administrable dose form): Применяемая дозированная лекарственная форма, полученная в результате всех необходимых преобразований произведенной дозированной формы.
Примеры - Раствор для инъекций, таблетка для приёма внутрь, твердая капсула с порошком для ингаляции.
Примечание - Применяемая дозированная форма идентична произведенной дозированной форме в случаях, когда произведенный продукт не преобразуется (то есть когда он является лекарственным препаратом).
3.1.2 устройство для применения лекарственного средства (administration device): Устройство, предназначенное для правильного применения лекарственного средства
Примеры - Игла, оральный шприц.
Примечания
1 Устройство для применения может быть принадлежностью контейнера с лекарственным средством или его крышки.
2 Термин адаптирован из стандарта [ENV 12610:1997].
3.1.3 способ применения лекарственного средства (administration method): Общий способ применения лекарственного препарата.
Примеры - Аппликация, ингаляция, инъекция.
Примечание - Способ применения является общим термином, используемым для группировки понятий, описывающих сходные лекарственные дозированные формы, и не является точным описанием применения или пути введения.
3.1.4 базовая дозированная форма (basic dose form): Общая характеристика лекарственной дозированной формы, используемая для группировки понятий, описывающих сходные лекарственные дозированные формы.
3.1.5 крышка, пробка (closure): Предмет, используемый для закрывания упаковки в целях правильного хранения и (когда это приемлемо) использования лекарственного средства.
Примеры - Колпачок, защита от детей, завинчивающийся колпачок.
Примечания
1 В крышку может быть встроено устройство для применения лекарственного средства.
2 Крышка может быть неотъемлемой частью первичной упаковки.
3.1.6 кодированное понятие (coded concept): Тип данных, объединяющий совокупность кодированных терминов, описывающих одно и то же понятие, но в разной формулировке или для разных географических территорий.
Примечание - Кодированное понятие используется для управления переводами на другие языки и является базовым типом данных, присутствующим во всех высокоуровневых концептуальных моделях.
3.1.7 пара код и термин (code term pair): Тип данных, объединяющий атрибуты, необходимые для описания отдельного понятия на конкретном языке и для конкретной географической территории.
3.1.8 комбинированная лекарственная дозированная форма (combined pharmaceutical dose form): Единый термин, описывающий два или более произведенных продукта, которые специальным образом комбинируются для получения одного лекарственного препарата. В это описание включается информация о дозированной форме каждого произведенного продукта и о применяемой дозированной форме лекарственного препарата.
Пример - Порошок и его растворитель при изготовлении раствора для инъекций. Лекарственное средство представляет собой два произведенных продукта: растворяемый порошок и его растворитель. Лекарственный препарат, изготовленный из этих двух компонентов, представляет собой инъекционный раствор; комбинированной лекарственной дозированной формой является "порошок и растворитель для инъекционного раствора" (см. также таблицу А.7 в приложении А).
3.1.9 упаковка (container): Изделие, являющееся частью лекарственного средства и предназначенное для содержания, идентификации или транспортировки компонентов лекарственного средства.
Примеры - Ампула, пузырек, коробка.
Примечание - Понятие "упаковка" обобщает частные понятия первичной упаковки, промежуточной упаковки и внешней упаковки.
3.1.10 нормативный словарь (controlled vocabulary): Конечное множество допустимых значений элемента данных.
Примечания
1 Допустимыми значениями могут быть коды, текст или числа.
2 Термин адаптирован из документа CDISC Clinical Research Glossary V8.0, 2009.
3.1.11 идентификатор термина в нормативном словаре (controlled vocabulary term identifier): Идентификатор понятия, который публикуется автором системы кодирования в качестве предпочтительного идентификатора данного понятия в этой системе кодирования.
Примечания
1 Этот идентификатор не меняется с течением времени даже в случае изменения версии ресурса знаний.
2 Термин адаптирован из документа HL7 Core Principles.
3.1.12 первичная упаковка (immediate container, immediate packaging): Упаковка произведенного продукта или лекарственного препарата, имеющая с ним непосредственный контакт.
Примеры - Ампула, флакон, предварительно заполненный шприц, пузырек, блистер.
Примечания
1 Первичная упаковка может быть вложена в устройство введения лекарственного средства или в тару либо интегрирована с ними.
2 Роль первичной упаковки может выполняться дозированной лекарственной формой. Примером может служить капсула с порошком для ингаляции. В этом случае капсула не является упаковкой.
3 Альтернативное совместимое определение первичной упаковки ("immediate packaging") приведено в Директиве 92/27/ЕЕС.
4 Адаптированное определение из стандарта ENV 12610:1997
3.1.13 предполагаемое место введения (intended site): Общее указание места тела, в которое должен вводиться лекарственный препарат.
Примеры - Ушное, глазное, пероральное.
Примечание - Предполагаемое место введения является общим термином, используемым для группировки понятий, описывающих сходные лекарственные дозированные формы, и не является точным описанием места введения или пути введения.
3.1.14 промежуточная упаковка (intermediate packaging): Контейнер, содержащий первичную упаковку и вложенный во внешнюю упаковку.
Пример - Коробка.
3.1.15 произведенная дозированная форма (manufactured dose form): Произведенная дозированная форма фармацевтической субстанции, еще не преобразованная в лекарственный препарат.
Пример - Порошок для инъекционного раствора.
Примечание - Произведенная дозированная форма идентична применяемой дозированной форме в случаях, когда произведенное лекарственное средство не преобразуется (то есть когда оно является лекарственным препаратом).
3.1.16 произведенный продукт (manufactured item): Качественная и количественная композиция компонентов, содержащаяся в упаковке лекарственного средства.
Примечания
1 Лекарственное средство может содержать один или несколько произведенных продуктов.
2 Во многих случаях произведенный продукт тождественен лекарственному препарату. Однако есть примеры, когда произведенный продукт претерпевает преобразование до применения к пациенту (в качестве лекарственного средства) и тогда он не тождественен лекарственному препарату.
3 Произведенный продукт не имеет прямого контакта с внешней упаковкой за исключением случаев, когда внешняя упаковка является также и первичной упаковкой.
3.1.17 лекарственное средство (medicinal product): Вещество или комбинация веществ, применяемые к организму человека (или животного) для лечения и профилактики заболеваний с целью диагностики или восстановления, коррекции либо изменения физиологических функций.
[ENV 13607:2000; ENV 12610:1997]
Примечания
1 Лекарственное средство может содержать один или несколько произведенных продуктов и один или несколько лекарственных препаратов.
2 В некоторых юрисдикциях лекарственное средство может быть определено как любое вещество или комбинация веществ, используемых для постановки диагноза.
3.1.18 идентификатор лекарственного средства MPID (medicinal product identifier): Уникальный идентификатор, присвоенный лекарственному средству в дополнение к любому существующему регистрационному номеру, присвоенному уполномоченным органом.
Примечание - Этот идентификатор предназначен для целей учета и для повышения безопасности пациента, поскольку с его помощью можно однозначно идентифицировать лекарственные средства во всем мире.
3.1.19 внешняя упаковка (outer packaging): внешний контейнер, в котором поставляется лекарственное средство.
Пример - Коробка.
Примечания
1 Лекарственный препарат или произведенный продукт не имеет непосредственного контакта с внешней упаковкой за исключением случаев, когда внешняя упаковка служит также первичной упаковкой.
2 Альтернативное совместимое определение внешней упаковки ("outer packaging") приведено в Директиве 92/27/ЕЕС: "упаковка, в которую помещена первичная упаковка".
3.1.20 лекарственная дозированная форма (pharmaceutical dose form): Материальное проявление лекарственного средства, содержащего фармацевтические субстанции и/или вспомогательные вещества, которое должно быть применено к пациенту.
Примечание - Термин "дозированная лекарственная форма" может применяться как к применяемой дозированной лекарственной форме, так и к произведенной дозированной лекарственной форме, в зависимости от продукта, который он описывает.
3.1.21 лекарственный препарат (pharmaceutical product): Качественная и количественная композиция лекарственного средства в дозированной форме, разрешенной для применения уполномоченным органом и описанной вместе с соответствующей информацией из регистрационного досье.
Примечания
1 Лекарственное средство может содержать один или несколько препаратов.
2 Во многих случаях лекарственный препарат идентичен произведенному продукту. Однако есть примеры, когда произведенный продукт претерпевает преобразование до применения к пациенту (в качестве лекарственного препарата) и тогда он не тождественен лекарственному препарату.
3.1.22 идентификатор лекарственного препарата PhPID (Pharmaceutical Product Identifier): Глобально уникальный идентификатор лекарственного препарата.
3.1.23 характеристика действия (release characteristics): Описание модифицированного периода времени, в течение которого активный ингредиент оказывает действие на тело после применения лекарственного препарата, в сравнении с традиционным, непосредственным действием активного ингредиента.
Примеры - Замедленное, пролонгированное, не модифицированное.
3.1.24 путь введения (route of administration): Путь введения лекарственного препарата в тело или контакта с телом.
Примеры - Внутривенный, пероральный, в конъюнктивальный мешок глаза, в полость рта.
3.1.25 состояние вещества (state of matter): Физическое состояние молекулярной формы препарата.
Примеры - Газообразное, жидкое, полутвердое, твердое.
Примечание - Указание состояния вещества используется для группировки базовых дозированных форм в соответствии с их физическими свойствами.
3.1.26 преобразование (transformation): Преобразование произведенного продукта, необходимое для получения лекарственного препарата, выполняемое, например, чтобы получить применяемую дозированную форму из произведенной дозированной формы.
Примечание - Если применяемая дозированная форма совпадает с произведенной дозированной формой, то преобразование не требуется.
3.1.27 единица измерения (unit of measurement): Действительная скалярная величина, определенная и принятая по соглашению, с которой можно сравнить любую другую величину того же рода и выразить их отношение в виде числа.
Примечание - В зависимости от характера стандартной шкалы, выражение единицы измерения может представлять либо физическую единицу измерения, связанную с системой величин (например, единицы СИ), либо произвольно определенную единицу измерения, которая может относиться к определенному стандартном образцу, методике измерения, мере материала или даже к их комбинациям.
3.1.28 единица представления (unit of presentation): Качественный термин, описывающий дискретный исчисляемый объект, служащий для представления активности или количества лекарственного препарата либо произведенного продукта и используемый в тех случаях, когда активность или количество выражаются в терминах экземпляра этого объекта.
Примеры
1 Описание активности: таблетка, спрей или доза спрея "содержит 100 мкг в расчете на спрей" (единица представления = спрей).
2 Описание количества: пузырек, коробка, флакон "содержит 100 мл в пузырьке" (единица представления = пузырек).
Примечание - Единица представления может иметь то же название, что и другой элемент нормативного словаря данных, например, лекарственная дозированная форма или контейнер, но эти два понятия не эквивалентны и должны иметь в словаре разные уникальные идентификаторы терминов.
3.2 Сокращения
3.2.1 CDISC - Консорциум по стандартам обмена клиническими данными (Clinical Data Interchange Standards Consortium)
3.2.2 CTS - Общие терминологические службы (Common Terminology Services)
3.2.3 HL7 - организация Health Level Seven
3.2.4 IDMP - идентификация лекарственных средств (Identification of medicinal products)
3.2.5 MPID - идентификатор лекарственного средства (Medicinal Product Identifier)
3.2.6 PhPID - идентификатор лекарственного препарата (Pharmaceutical Product Identifier)
3.2.7 SI - международная система единиц СИ (International System of Units)
4 Требования
4.1 Общие требования к нормативным словарям
Настоящий стандарт является частью серии стандартов идентификации лекарственных средств (IDMP - Identification of Medicinal Products). В нем приведены спецификации, описывающие создание ряда нормативных словарей, существенных для применения серии в целом, в частности, следующих стандартов:
- ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах);
- ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах).
Однако нормативные словари могут использоваться также и независимо от данной серии стандартов. Для передачи нормативных словарей в информационные системы, разработанные на основе стандартов IDMP, могут использоваться сообщения, описанные в стандарте Health Level Seven (HL7) Common Terminology Services (CTS) Version 2.
В настоящем стандарте предусмотрена возможность переводов нормативных терминов, позволяющая обеспечить передачу этой информации во всемирном масштабе.
В настоящем стандарте предусмотрена также возможность управления версиями нормативных терминов, позволяющая вести историю эволюции нормативных словарей и отслеживать их изменения.
Кроме того, в настоящем стандарте приведены рекомендации, помогающие пользователям отображать имеющиеся термины на нормативные термины, что позволяет связать термины, уже использующиеся в разных регионах, с нормативными терминами.
4.2 Требования к применению нормативных словарей в стандартах серии IDMP
Чтобы нормативные словари, описанные в настоящем стандарте, могли использоваться как неотъемлемая часть реализаций стандартов IDMP, они должны удовлетворять следующим критериям:
- содержать термины и идентификаторы, необходимые для описания лекарственных дозированных форм лекарственных средств и требуемые для генерации и описания идентификаторов PhPID и MPID;
- содержать термины и идентификаторы, необходимые для указания предполагаемого пути (путей) введения лекарственного средства, требуемого для полного описания лекарственного средства и генерации идентификатора MPID;
- содержать термины и идентификаторы, необходимые для указания единиц представления лекарственного средства, требуемого для полного описания активности некоторых типов лекарственных средств при генерации идентификатора MPID;
- содержать термины и идентификаторы, необходимые для указания упаковки (включая первичную, промежуточную и внешнюю), крышки или пробки, а также устройства введения лекарственного средства, требуемого для описания лекарственного средства при генерации идентификатора MPID.
Нормативные термины и их коды должны быть общедоступными, а их применение не должно требовать лицензионных отчислений.
5 Схема
5.1 Общие положения
В настоящем стандарте предложены элементы данных, существенно необходимые для описания нормативных терминов, перевода терминов на другой язык и ведения версий. Кроме того, в нем приведены рекомендации по отображению терминов, которые уже используются участниками обращения лекарственных средств, на систему понятий, предложенную в настоящем стандарте.
К элементам данных, описывающим вспомогательные понятия, относятся:
- термины и коды;
- переводы на другой язык;
- версии;
- отображения.
Верхний уровень понятий включает в себя:
a) лекарственную дозированную форму;
b) единицы представления;
c) пути введения;
d) упаковку.
В схемах, описывающих структуру этих элементов, используются типы данных ST (строка), CD (дескриптор понятия), TS (момент времени) и INT (целое число), определенные в стандарте ИСО 21090.
По умолчанию кратность атрибута полагается равной единице (то есть [1..1]).
5.2 Концептуальные модели вспомогательных понятий
5.2.1 Общее описание
Приведенные ниже концептуальные модели определяют элементы, структуры и отношения между элементами, которые описывают вспомогательные понятия (термины и коды, переводы на другой язык, версии, отображения), используемые в каждой совокупности нормативных терминов.
5.2.2 Термины и коды
Класс "кодТермин" должен использоваться для представления базового кода, соответствующей ему строки текста и других элементов определения понятия. Он используется в качестве типа данных при описании атрибутов класса "кодированноеПонятие".
Класс "кодТермин" имеет следующие атрибуты:
a) "код": уникальный (машиночитаемый) идентификатор экземпляра класса "кодТермин" (тип данных ST);
b) "термин": текст термина, описывающего понятие (тип данных ST);
c) "определение": текстовое определение понятия (тип данных ST);
d) "домен": необязательный признак, используемый, если в базе данных хранятся термины понятий, используемых только в ветеринарии; указывает, что понятие или "медицинское и ветеринарное", или "только ветеринарное" (по умолчанию используется значение "медицинское и ветеринарное") (тип данных ST);
e) "примечание": необязательное текстовое примечание (тип данных ST);
f) "кодЯзыка": язык, на котором представлены значения атрибутов б) - г), указанный в соответствии со стандартом ИСО 639 (тип данных CD);
g) "кодТерритории": код страны или территории, использующий данный экземпляр класса "кодТермин" на языке "кодЯзыка", указанный в соответствии со стандартом ИСО 3166 (тип данных CD).
|
Рисунок 1 - Концептуальная диаграмма типа данных "кодТермин"
5.2.3 Переводы
Тип данных "кодированноеПонятие" связывает понятие, представленное на определенном языке для определенной территории (например, на английском языке в Великобритании) с нулем и более переводами этого понятия на другие языки и/или для других территорий (например, на французском для Франции, на немецком для Германии). Его атрибут "код" содержит универсальный код понятия, атрибут "значение" содержит код понятия для языка и территории, выбранных пользователем, а атрибут "перевод" содержит нуль или более кодов понятия для других языков и/или территорий; вместе эти три атрибута определяют тип данных "кодированноеПонятие".
Тип данных "кодированное понятие" имеет следующие атрибуты:
a) "код": уникальный (машиночитаемый) идентификатор экземпляра класса "кодированноеПонятие" (тип данных ST);
b) "значение": код, описывающий понятие на языке (например, на английском) для территории (например, Великобритании) по выбору пользователя (тип данных "кодТермин");
c) "перевод": нуль или более кодов, описывающих это же понятие на других языках и/или для других территорий (например, на французском для Франции, на немецком для Германии) (тип данных "кодТермин");
|
Рисунок 2 - Концептуальная диаграмма типа данных "кодированноеПонятие"
5.2.4 Версия
Класс "Версия" предназначен для представления прослеживаемой истории изменений каждого понятия от момента его создания.
Этот класс должен иметь следующие атрибуты:
a) "код": уникальный (машиночитаемый) идентификатор понятия, являющегося субъектом версии (тип данных ST);
b) "датаСоздания": штамп даты и времени, указывающий момент создания описания понятия (тип данных TS);
c) "авторПонятия": информация, идентифицирующая создателя описания понятия (тип данных ST);
d) "датаИзменения": штамп даты и времени, указывающий момент создания указанной версии описания понятия (тип данных TS);
e) "содержаниеИзменения": текстовое описание модификации, которая привела к созданию указанной версии описания понятия (тип данных ST);
f) "авторИзменения": информация, идентифицирующая лицо, изменившее описание понятия (тип данных ST);
g) "статусПонятия": статус понятия, то есть активное, отмененное и т.д. (тип данных CD);
h) "текущееПонятие" [0..*]: если понятие отменено, то в этом атрибуте может быть указан код другого понятия, которое заменяет отмененное; у одного отмененного понятия может быть несколько заменяющих (тип данных: ""кодированноеПонятие";
i) "номерВерсии": номер версии понятия (тип данных INT).
|
Рисунок 3 - Концептуальная диаграмма типа данных "Версия"
5.2.5 Отображение
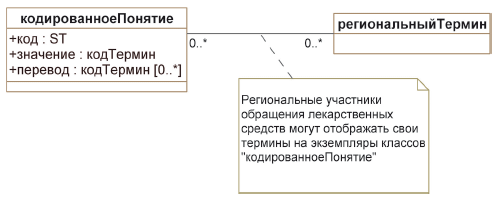
Описания понятий в терминологическом словаре, разработанном в соответствии с настоящим стандартом (называемых далее "центральными понятиями") не обязательно совпадают с терминами, используемыvb различными участниками обращения лекарственных средств в разных странах и регионах (называемых далее "региональными терминами"). Чтобы обеспечить связь уже используемых региональных терминов, в частности, тех, что применяются уполномоченными органами разных стран и регионов, с центральными понятиями, соответствующие участники обращения лекарственных средств могут отображать термины, хранящиеся в их базах данных или системах, на центральные понятия. Такие отображения помогут пользователям существующих баз данных найти для данного регионального термина эквивалентное ему центральное понятие.
Один региональный термин может отображаться на нуль или более центральных понятий, и нуль или более региональных терминов могут отображаться на одно центральное понятие.
Множественность отношений между региональным терминами и центральными понятиями связана с уровнем детализации информации в существующих базах данных, используемых в разных регионах. Например, регион А может использовать менее специфичные термины с низким уровнем детализации, при которой один региональный термин отображается на три центральных понятия, а регион Б может использовать более специфичные термины с высоким уровнем детализации, при которой три региональных термина отображаются на одно центральное понятие (см. таблицу 1).
|
Рисунок 4 - Концептуальная диаграмма, указывающая цель процесса отображения
Таблица 1 - Условные примеры отображения центральных понятий на региональные термины при низком (регион А) и высоком (регион Б) уровне детализации.
Местный термин региона А (низкая степень детализации) | Отображение на центральные понятия (один-ко-многим) | Местные термины региона Б (высокая степень детализации) | Отображение на центральные понятия (многие-к-одному) |
Инъекция | Раствор для инъекций | Мягкая капсула с гранулами | Мягкая капсула для приема внутрь |
Суспензия для инъекций | Мягкая капсула с жидкостью | ||
Раствор для внутривенного вливания | Мягкая капсула с порошком |
5.3 Концептуальные модели высокоуровневых понятий
5.3.1 Общее описание
Приведенные ниже концептуальные модели определяют элементы, структуры и отношения между элементами, описывающими нормативные высокоуровневые понятия (лекарственную дозированную форму, единицу представления, путь введения, упаковку) в целях создания нормативных терминов.
5.3.2 Лекарственная дозированная форма
5.3.2.1 Общее описание
Приведенные ниже концептуальные модели определяют понятие лекарственной дозированной формы, а также релевантные элементы, структуры и отношения между ними, которые описывают это понятие и комбинированную лекарственную дозированную форму.
5.3.2.2 Понятие лекарственной дозированной формы
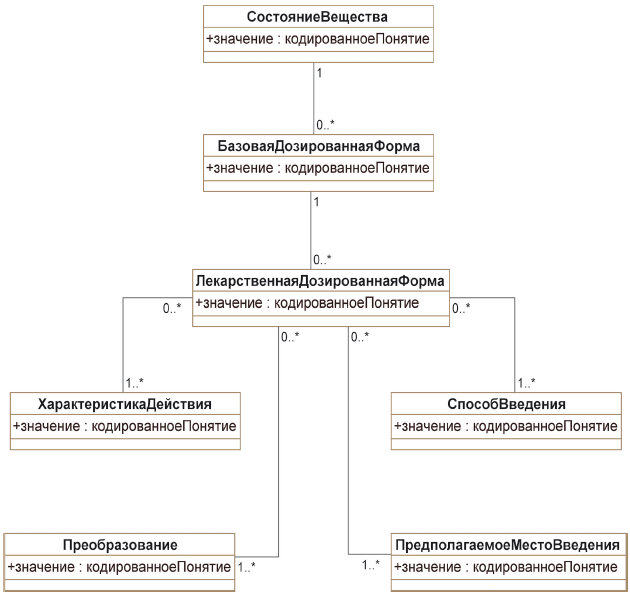
Понятие лекарственной дозированной формы является обобщением совокупности базовых дозированных форм, которые в свою очередь группируются по признаку состояния вещества. Структура описания лекарственной дозированной формы содержит атрибуты, характеризующие действие лекарства, преобразования, выполняемые перед его применением, предполагаемое место введения и предполагаемый способ введения. Для описания понятия лекарственной дозированной формы и его атрибутов используется тип данных "кодированноеПонятие", включающий в себя понятия переводов на другой язык.
|
Рисунок 5 - Концептуальная диаграмма класса "ЛекарственнаяДозированнаяФорма"
5.3.2.3 Класс "СостояниеВещества"
Понятие состояния вещества должно использоваться как высокоуровневая категория, классифицирующая базовые дозированные формы (и тем самым лекарственные дозированные формы) по значению соответствующего атрибута. Класс "СостояниеВещества" имеет ассоциации с нулем или большим числом экземпляров класса "БазоваяДозированнаяФорма".
Примеры - Твердое, полутвердое, жидкое, газообразное. См. также примеры нормативных словарей (таблица А.1 в приложении А) и примеры описания лекарственных средств в приложении В.
Состояние вещества должно быть описано с помощью типа данных "кодированноеПонятие".
5.3.2.4 Класс "БазоваяДозированнаяФорма"
Понятие базовой дозированной формы должно использоваться как высокоуровневая категория, классифицирующая лекарственные дозированные формы по общим типам таких форм. Класс "БазоваяДозированнаяФорма" имеет ассоциации с нулем или большим числом экземпляров класса "ЛекарственнаяДозированнаяФорма".
Примеры - Таблетка, капсула, порошок, раствор. См. также примеры нормативных словарей (таблица А.1 в приложении А) и примеры описания лекарственных средств в приложении В.
Базовая лекарственная форма должна быть описана с помощью типа данных "кодированноеПонятие".
5.3.2.5 Класс "ХарактеристикаДействия"
Класс "ХарактеристикаДействия" должен использоваться для описания характеристики действия лекарственной дозированной формы. Если характеристики действия не указаны, то экземпляр класса "ХарактеристикаДействия" должен быть пустым. Класс "ХарактеристикаДействия" имеет ассоциации с нулем или большим числом экземпляров класса "ЛекарственнаяДозированнаяФорма".
Примеры - Замедленное, пролонгированное, моментальное, без изменения. См. также примеры нормативных словарей (таблица А.2 в приложении А) и примеры описания лекарственных средств в приложении В.
Характеристика действия должна быть описана с помощью типа данных "кодированноеПонятие".
5.3.2.6 Класс "Преобразование"
Класс "Преобразование" должен использоваться для описания физической операции, требуемой для преобразования произведенной дозированной формы в лекарственную дозированную форму, если таковое необходимо. Если преобразование не требуется, то экземпляр класса "Преобразование" должен быть пустым. Класс "Преобразование" имеет ассоциации с нулем или большим числом экземпляров класса "ЛекарственнаяДозированнаяФорма".
Примеры - Разбавление, растворение, без преобразования. См. также примеры нормативных словарей (таблица А.3 в приложении А) и примеры описания лекарственных средств в приложении В.
Преобразование должно быть описано с помощью типа данных "кодированноеПонятие".
5.3.2.7 Класс "ПредполагаемоеМестоВведения"
Класс "ПредполагаемоеМестоВведения" должен использоваться для общего указания места тела, в которое предполагается введение лекарственной дозированной формы. Это указание дается в общих терминах, а не в детальных нормативных терминах, описывающих точное место введения. Оно не совпадает с понятием пути введения. Если предполагаемое место введения отсутствует, то экземпляр класса "ПредполагаемоеМестоВведения" должен быть пустым. Класс "ПредполагаемоеМестоВведения" имеет ассоциации с нулем или большим числом экземпляров класса "ЛекарственнаяДозированнаяФорма".
Примеры - Ушное, глазное, пероральное, не указано. См. также примеры нормативных словарей (таблица А.4 в приложении А) и примеры описания лекарственных средств в приложении В.
Предполагаемое место введения должно быть описано с помощью типа данных "кодированноеПонятие".
5.3.2.8 Класс "СпособВведения"
Класс "СпособВведения" должен использоваться для описания лекарственной дозированной формы в соответствии с общим предполагаемым способом, которым она должна быть введена. Это описание дается в общих терминах, а не в детальных нормативных терминах, описывающих точный способ введения. Если предполагаемый способ введения отсутствует, то экземпляр класса "СпособВведения" должен быть пустым. Класс "СпособВведения" имеет ассоциации с нулем или большим числом экземпляров класса "ЛекарственнаяДозированнаяФорма".
Примеры - Аппликация, ингаляция, инъекция, не указан. См. также примеры нормативных словарей (таблица А.5 в приложении А) и примеры описания лекарственных средств в приложении В.
Способ введения должен быть описан с помощью типа данных "кодированноеПонятие".
5.3.2.9 Класс "ЛекарственнаяДозированнаяФорма"
Класс "ЛекарственнаяДозированнаяФорма" должен использоваться для описания лекарственной дозированной формы в том виде, как оно приводится в описаниях лекарственных средств. Он включает в себя атрибуты, унаследованные от ассоциаций с другими классами, необходимые для должного описания этого понятия (рисунок 6).
Класс "ЛекарственнаяДозированнаяФорма" ассоциирован с одним экземпляром класса "БазоваяДозированнаяФорма", с одним или несколькими экземплярами класса "ХарактеристикаДействия", с одним или несколькими экземплярами класса "Преобразование", с нулем или несколькими экземплярами класса "ПредполагаемоеМестоВведения", с одним или несколькими экземплярами класса "Способ введения".
|
Рисунок 6 - Концептуальная диаграмма класса "ЛекарственнаяДозированнаяФорма" с унаследованными атрибутами
Примеры - Таблетка, порошок для инъекционного раствора, порошок для концентрата инъекционного раствора. См. также примеры нормативных словарей (таблица А.6 в приложении А) и примеры описания лекарственных средств в приложении В.
Лекарственная дозированная форма должна быть описана с помощью типа данных "кодированноеПонятие".
5.3.2.10 Класс "КомбинированнаяЛекарственнаяДозированнаяФорма"
Класс "КомбинированнаяЛекарственнаяДозированнаяФорма" должен использоваться для определения уникальных понятий, описывающих специфичные комбинации лекарственных дозированных форм, когда таковые требуются. В этом случае одно уникальное кодированное понятие используется для описания комбинации двух и более лекарственных дозированных форм.
|
Рисунок 7 - Концептуальная диаграмма класса "КомбинированнаяЛекарственнаяДозированнаяФорма"
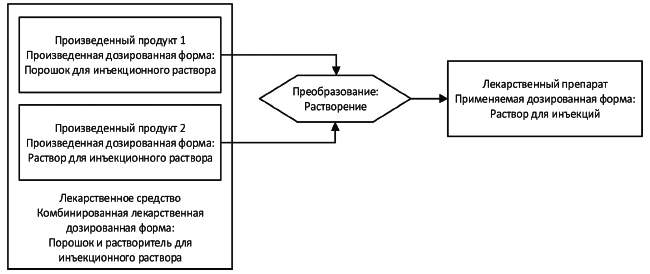
Примеры - Порошок и растворитель для инъекционного раствора (см. рисунок 8). См. также примеры нормативных словарей (таблица А.7 в приложении А) и примеры описания лекарственных средств Б.1.3* и Б.1.4* в приложении В.
_____________
* Вероятно ошибка оригинала. Следует читать:В.1.3 и В.1.4. - .
В примере, показанном на рисунке 8, упаковка лекарственного средства содержит два отдельных произведенных продукта: порошок и растворитель. В результате растворения порошка в этом растворителе получается лекарственный препарат, который должен быть введен пациенту с помощью инъекции. Эти два произведенных продукта имеют произведенные дозированные формы "порошок для инъекционного раствора" и "растворитель для инъекционного раствора" соответственно. Лекарственный препарат, образованный из этих произведенных продуктов и предназначенный для введения пациенту, имеет применяемую лекарственную форму "инъекционный раствор". Лекарственное средство в целом имеет комбинированную дозированную лекарственную форму "порошок и растворитель для инъекционного раствора".
Комбинированная лекарственная дозированная форма должна быть описана с помощью типа данных "кодированноеПонятие".
|
Рисунок 8 - Иллюстрация отношений между понятиями "произведенная дозированная форма", "применяемая дозированная форма" и "комбинированная дозированная лекарственная форма" на примере лекарственного средства, состоящего из двух произведенных продуктов и требующего преобразования
5.3.3 Единица представления
5.3.3.1 Общее описание
Описанная ниже концептуальная модель определяет понятие единицы представления и элементов ее описания.
5.3.3.2 Понятие единицы представления
Понятие единицы представления используется для описания качественной единицы, в которой представляется и описывается активность или количество произведенного продукта или лекарственного препарата, если количественная единица измерения не применима. Единица представления используется, когда активность может быть описана общим способом "в каждом"; в конкретном случае "каждое" заменяется на "таблетку", "дозу спрея", "пластырь" и т.д. Она также используется, когда активность или общее количество произведенного продукта или лекарственного препарата выражается в терминах упаковки, например, "100 мл в пузырьке".
|
Рисунок 9 - Концептуальная диаграмма класса "ЕдиницаПредставления"
5.3.3.3 Класс "ЕдиницаПредставления"
Для указания атрибутов, должным образом описывающих понятие единицы представления, необходимо использовать класс "ЕдиницаПредставления".
Примеры - Доза ингаляции, капля, пластырь, таблетка, пузырек, туба. См. также примеры нормативных словарей (таблица А.8 в приложении А) и примеры описания лекарственных средств в приложении В.
Единица представления должна быть описана с помощью типа данных "кодированноеПонятие".
5.3.4 Путь введения
5.3.4.1 Общее описание
Описанная ниже концептуальная модель определяет понятие пути введения и элементов его описания.
5.3.4.2 Понятие пути введения
Понятие пути введения используется для описания пути, по которому лекарственный препарат вводится в тело или осуществляет контакт с телом.
|
Рисунок 10 - Концептуальная диаграмма класса "ПутьВведения"
5.3.4.3 Класс "ПутьВведения"
Для указания атрибутов, должным образом описывающих понятие пути введения, необходимо использовать класс "ПутьВведения".
Примеры - Внутримышечный, внутривенный, пероральный, подкожный. См. также примеры нормативных словарей (таблица А.9 в приложении А) и примеры описания лекарственных средств в приложении В.
Путь введения должен быть описан с помощью типа данных "кодированноеПонятие".
5.3.5 Упаковка
5.3.5.1 Общее описание
Описанная ниже концептуальная модель определяет понятие упаковки, элементов его описания, структур и отношений между элементами.
5.3.5.2 Понятие упаковки
Понятие упаковки охватывает группу из трех понятий, описывающих следующие частные элементы лекарственного средства: контейнер, крышку (пробку) и устройство применения.
|
Рисунок 11 - Концептуальная диаграмма класса "Упаковка"
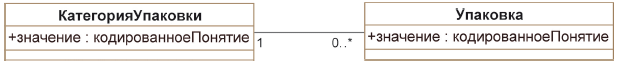
5.3.5.3 Класс "КатегорияУпаковки"
Класс "КатегорияУпаковки" должен использоваться как высокоуровневая классификация составных элементов понятия упаковки, а именно, контейнер, крышка (пробка) и устройство применения. Класс "КатегорияУпаковки" ассоциирован с нулем или более типами упаковки.
Категория упаковки должна быть описана с помощью типа данных "кодированноеПонятие".
5.3.5.4 Класс "Упаковка"
Класс "Упаковка" должен использоваться для указания атрибутов, должным образом описывающих понятия контейнера, крышки (пробки) и устройства введения. Класс "Упаковка" ассоциирован с одним экземпляром класса "КатегорияУпаковки".
Примеры
1 Контейнеры: ампула, блистер, пузырек, туба, коробка, ящик. См. также примеры нормативных словарей (таблица А.10 в приложении А) и примеры описания лекарственных средств в приложении В.
2 Крышки и пробки: колпачок, завинчивающийся колпачок, пробка. См. также примеры нормативных словарей (таблица А.10 в приложении А) и примеры описания лекарственных средств в приложении В.
3 Устройства введения: игла, оральный шприц. См. также примеры нормативных словарей (таблица А.10 в приложении А) и примеры описания лекарственных средств в приложении В.
Упаковка должна быть описана с помощью типа данных "кодированноеПонятие".
Приложение А
(справочное)
Примеры нормативных словарей
А.1 Цель представленных примеров
А.1.1 Общее описание
Примеры нормативных словарных терминов приведены в настоящем приложении только для целей иллюстрации. Хотя эти примеры могут использоваться при создании нормативных словарей, их присутствие в настоящем документе не означает, что они являются или будут являться официальными нормативными словарными терминами и что их содержание обладает полнотой.
А.1.2 Лекарственная дозированная форма
Таблица А.1 - Примеры состояний вещества и базовых дозированных форм
Состояние вещества | Базовая дозированная форма | Состояние вещества | Базовая дозированная форма |
Газообразное | Медицинский газ | Твердое | Капсула |
Пар | Пленка | ||
Жидкое | Коллодий | Гранулы | |
Концентрат | Резинка | ||
Эмульсия | Имплантант* | ||
Жидкость | Вставка | ||
Раствор | Таблетка | ||
Суспензия | Неясное | Неясная | |
Полутвердое | Крем | ||
Гель | |||
Мазь | |||
Паста |
___________________
* Текст документа соответствует оригиналу, здесь и далее по тексту. - .
Таблица А.2 - Примеры характеристики действия
Характеристика действия |
Замедленное |
Пролонгированное |
Измененное |
Немедленное |
Не указано |
Таблица А.3 - Прмеры преобразований
Преобразование |
Разведение |
Растворение |
Экстракция |
Смешивание |
Суспендирование/диспергирование |
Не требуется |
Таблица А.4 - Примеры предполагаемого места введения
Предполагаемое место введения |
Ушное |
Кожное |
Дентальное |
Внутриматочное |
Интравезикулярное |
Назальное |
Глазное |
Пероральное |
Полость рта |
Легочное |
Ректальное |
Влагалищное |
Не указано |
Таблица А.5 - Примеры способа введения
Способ введения |
Аппликация |
Ванна |
Жевание |
Полоскание |
Струйное вливание |
Инъекция |
Вставка |
Капельное вливание |
Порошковая ингаляция |
Распыление |
Глотание |
Не указан |
Таблица А.6 - Примеры лекарственных дозированных форм
Лекарственная дозированная форма |
Капсула для полости рта |
Жевательная таблетка |
Концентрат для приготовления раствора для наружного применения |
Назальный крем |
Таблетка с замедленным действием |
Шипучие гранулы |
Эмульсия для инъекции |
Таблетка с пролонгированным действием |
Пена для наружного применения |
Гранулы для приготовления суспензии для перорального применения |
Твердая капсула |
Твердая капсула с порошком для ингаляций |
Имплантант |
Таблетка защечная мукоадгезивная |
Ушная мазь |
Кожная мазь |
Оральный порошок |
Ородисперсная пленка |
Порошок для наружного применения |
Порошок для приготовления раствора для внутривенных вливаний |
Порошок для приготовления раствора для инъекций |
Раствор для ингаляций в баллоне под давлением |
Суспензия для ингаляций в баллоне под давлением |
Глазные капли пролонгированного действия |
Мягкая капсула с замедленным действием |
Растворимая таблетка |
Ушные капли |
Ушной спрей |
Глазные капли |
Раствор для внутривенных вливаний |
Раствор для инъекций |
Пероральный раствор |
Спрей для полости рта |
Спрей подъязычный |
Суппозиторий |
Оральная суспензия |
Таблетка |
Таблетка для полоскания |
Таблетка подъязычная |
Таблетка вагинальная |
Таблица А.7 - Примеры комбинированных лекарственных дозированных форм
Комбинированная лекарственная дозированная форма | Компоненты (лекарственные дозированные формы) |
Концентрат и растворитель для приготовления раствора для наружного применения | Концентрат для приготовления раствора для наружного применения |
Растворитель для приготовления раствора для наружного применения | |
Суспензия и гранулы для приготовления суспензии для перорального применения | Суспензия для приготовления суспензии для перорального применения |
Гранулы для приготовления суспензии для перорального применения |
А.1.3 Единица представления
Таблица А.8 - Примеры единиц представления
Единица представления | |
Доза спрея | Пластырь |
Пузырек | Шарик |
Капсула | Суппозиторий |
Капля | Таблетка |
Имплантант | Флакон |
Вставка | |
А.1.4 Путь введения
Таблица А.9 - Примеры пути введения
Путь введения | |
Ушной | Внутривенный |
Кожный | Интравезикальный |
Дентальный | Гортанно-глоточный |
Десенный | Назальный |
Ингаляционный | Конъюнктивальный |
Интестинальный | Пероральный |
Внутриартериальный | В ротовую полость |
Интракардиальный | Ректальный |
Интрацеребральный | Путь введения не применим |
Интрацервикальный | Подкожный |
Интралимфатический | Сублингвальный |
Внутримышечный | Трансдермальный |
Интраокулярный | Уретральный |
Внутриматочный | Влагалищный |
А.1.5 Упаковка
Таблица А.10 - Примеры упаковки и категорий упаковки
Категория упаковки | Упаковка |
Контейнер | Ампула |
Блистер | |
Пузырек | |
Коробка | |
Картридж | |
Туба | |
Крышка, пробка | Колпачок |
Защита от детей | |
Завинчивающийся колпачок | |
Устройство введения | Аппликатор |
Кисточка | |
Чашка | |
Игла для инъекций | |
Шприц для инъекций | |
Мерительная ложка | |
Оральный шприц |
Приложение В
(справочное)
Примеры нормативных словарей для описания лекарственных средств
В.1 Цель представленных примеров
Примеры описаний лекарственных средств, в которых определенные свойства описаны с использованием нормативных словарей, приведены в настоящем приложении только для целей иллюстрации, чтобы продемонстрировать, как могут создаваться такие нормативные словари терминов, используемые для присвоения идентификаторов PhPID и МРID.
В.1.1 Лекарственный препарат LITHDRUG
Лекарственная дозированная форма: произведенная = применяемая: таблетка пролонгированного действия
Состояние вещества: твердое
Базовая дозированная форма: таблетка
Характеристика действия: пролонгированное
Преобразование: не требуется
Способ введения: глотание
Предполагаемое место введения: пероральное
Единица представления: таблетка
Путь введения: пероральный
Упаковка:
Контейнер: первичная упаковка: пузырек
внешняя упаковка: коробка
Крышка, пробка: завинчивающийся колпачок
Устройство введения: не применимо
В.1.2 Лекарственный препарат INHALDRUG
Лекарственная дозированная форма: произведенная = применяемая: суспензия для аэрозольной ингаляции
Состояние вещества: жидкое
Базовая дозированная форма: суспензия
Характеристика действия: не указано
Преобразование: не требуется
Способ введения: ингаляция
Предполагаемое место введения: легочное
Единица представления: дозированное нажатие
Путь введения: ингаляционный
Упаковка:
Контейнер: первичная упаковка: баллон под давлением
промежуточная упаковка: мешочек
внешняя упаковка: коробка
Крышка, пробка: отсутствует
Устройство введения: распылительная головка
В.1.3 Лекарственный препарат ANTIHEMODRUG
Комбинированная лекарственная дозированная форма: порошок и растворитель для приготовления раствора для инъекций
Компонент 1 лекарственной дозированной формы: порошок для приготовления раствора для инъекций
Компонент 2 лекарственной дозированной формы: растворитель для приготовления раствора для инъекций
Лекарственная дозированная форма, применяемая: раствор для инъекций
Состояние вещества: жидкое
Базовая дозированная форма: раствор
Характеристика действия: не указано
Преобразование: не требуется
Способ введения: инъекция
Предполагаемое место введения: парентеральное
Компонент 1. Лекарственная дозированная форма, произведенная: порошок для приготовления раствора для инъекций
Состояние вещества: твердое
Базовая дозированная форма: порошок
Характеристика действия: не указано
Преобразование: растворение
Способ введения: инъекция
Предполагаемое место введения: парентеральное
Лекарственная дозированная форма, применяемая: раствор для инъекций
Единица представления: флакон
Путь введения: внутривенный
Упаковка:
Контейнер: первичная упаковка: флакон
внешняя упаковка: коробка
Крышка, пробка: колпачок, пробка
Устройство введения: не применимо
Компонент 2. Лекарственная дозированная форма, произведенная: раствор для приготовления раствора для инъекций
Состояние вещества: жидкое
Базовая дозированная форма: растворитель
Характеристика действия: не указано
Преобразование: растворение
Способ введения: инъекция
Предполагаемое место введения: парентеральное
Лекарственная дозированная форма, применяемая: раствор для инъекций
Единица представления: флакон
Путь введения: внутривенный
Упаковка:
Контейнер: первичная упаковка: флакон
внешняя упаковка: коробка
Крышка, пробка: колпачок, пробка
Устройство введения: не применимо
В.1.4 Лекарственный препарат INFLUENZAVAC
Комбинированная лекарственная дозированная форма: суспензия и эмульсия для приготовления эмульсии для инъекций
Компонент 1 лекарственной дозированной формы: суспензия для приготовления эмульсии для инъекций
Компонент 2 лекарственной дозированной формы: эмульсия для приготовления эмульсии для инъекций
Лекарственная дозированная форма, применяемая: эмульсия для инъекций
Состояние вещества: жидкое
Базовая дозированная форма: эмульсия
Характеристика действия: не указано
Преобразование: не требуется
Способ введения: инъекция
Предполагаемое место введения: парентеральное
Компонент 1. Лекарственная дозированная форма, произведенная: суспензия для приготовления эмульсии для инъекций
Состояние вещества: жидкое
Базовая дозированная форма: суспензия
Характеристика действия: не указано
Преобразование: смешивание
Способ введения: инъекция
Предполагаемое место введения: парентеральное
Лекарственная дозированная форма, применяемая: эмульсия для инъекций
Единица представления: флакон
Путь введения: внутримышечный
Упаковка:
Контейнер: первичная упаковка: флакон
внешняя упаковка: коробка
Крышка, пробка: пробка
Устройство введения: не применимо
Компонент 2. Лекарственная дозированная форма, произведенная: эмульсия для приготовления эмульсии для инъекций
Состояние вещества: жидкое
Базовая дозированная форма: эмульсия
Характеристика действия: не указано
Преобразование: смешивание
Способ введения: инъекция
Предполагаемое место введения: парентеральное
Лекарственная дозированная форма, применяемая: эмульсия для инъекций
Единица представления: флакон
Путь введения: внутримышечный
Упаковка:
Контейнер: первичная упаковка: флакон
внешняя упаковка: коробка
Крышка, пробка: пробка
Устройство введения: не применимо
В.1.5 Лекарственный препарат COMBIDRUG
Компонент 1. Лекарственная дозированная форма, произведенная = применяемая: вагинальная таблетка
Состояние вещества: твердое
Базовая дозированная форма: вагинальная таблетка
Характеристика действия: не указано
Преобразование: не требуется
Способ введения: вставка
Предполагаемое место введения: влагалищное
Единица представления: таблетка
Путь введения: влагалищный
Упаковка:
Контейнер: первичная упаковка: блистер
внешняя упаковка: коробка
Крышка, пробка: отсутствует
Устройство введения: аппликатор
Компонент 2. Лекарственная дозированная форма, произведенная = применяемая: крем
Состояние вещества: полутвердое
Базовая дозированная форма: крем
Характеристика действия: не указано
Преобразование: не требуется
Способ введения: аппликация
Предполагаемое место введения: кожное
Единица представления: туба
Путь введения: кожный
Упаковка:
Контейнер: первичная упаковка: туба
внешняя упаковка: коробка
Крышка, пробка: пробка, завинчивающийся колпачок
Устройство введения: не применимо
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта, документа | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 639 (все части) | - | * |
ISO 3166 (все части) | - | * |
ISO 21090 | - | * |
* Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. | ||
Библиография
[1] ISO 11238, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on substances
[2] ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of units of measurement
[3] ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated medicinal product information
[4] ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information
[5] ENV 12610:1997, Medical informatics - Medicinal product information
[6] ENV 13607:2000, Health informatics - Messages for the exchange of information on medicine prescriptions
[7] HL7 Version 2 Standard, Common Terminology Services (CTS) HL7 Draft Standard for Trial Use DSTU Release 2, 14 October 2009, HL7 Inc.
[8] HL7 Core Principles and Properties of HL7 Version 3 Models
[9] International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use Draft Consensus Guideline - Data Elements and Standards for Drug Dictionaries - M5 Revision 4, 2 February 2007
[10] European Directive 65/65/EEC, Approximation of provisions laid down by law, regulation or administrative action relating to medicinal products, January 26, 1965
[11] European Directive 92/27/EEC, Labelling of medicinal products for human use and on package leaflets, March 31, 1992
[12] CDISC Controlled Terminology, National Cancer Institute Enterprise Vocabulary Services
УДК 004:61:006.354 | ОКС 35.240.80 |
Ключевые слова: здравоохранение, информатизация здоровья, уникальная идентификация, лекарственные средства, структуры данных, передача данных, формы дозировки, единицы представления, пути введения, упаковка | |
Электронный текст документа
и сверен по:
, 2019