ГОСТ Р ИСО 10993-17-2009
Группа Р20
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 17
Установление пороговых значений для вымываемых веществ
Medical devices. Biological evaluation of medical devices. Part 17. Establishment of allowable limits for leachable substances
ОКС 11.100.20
ОКП 94 4000
Дата введения 2010-11-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий" (АНО "ИМБИИТ")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 2 декабря 2009 г. N 542-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 10993-17:2002* "Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ" (ISO 10993-17:2002 "Biological evaluation of medical devices - Part 17: Establishment of allowable limits for leachable substances").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении Е
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Соблюдение положений стандартов серии ИСО 10993 "Оценка биологического действия медицинских изделий" позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление единообразных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией их по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие соответствующую подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты серии ИСО 10993 являются руководящими документами для прогнозирования и исследования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых изделий.
В серию ИСО 10993 входят следующие части под общим названием "Оценка биологического действия медицинских изделий":
Часть 1 - Оценка и исследования;
Часть 2 - Требования к обращению с животными;
Часть 3 - Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
Часть 4 - Исследование изделий, взаимодействующих с кровью;
Часть 5 - Исследование на цитотоксичность: методы in vitro;
Часть 6 - Исследования местного действия после имплантации;
Часть 7 - Остаточное содержание этиленоксида после стерилизации;
Часть 9 - Основные принципы идентификации и количественного определения потенциальных продуктов деградации;
Часть 10 - Исследования раздражающего и сенсибилизирующего действия;
Часть 11 - Исследование общетоксического действия;
Часть 12 - Приготовление проб и контрольные образцы;
Часть 13 - Идентификация и количественное определение продуктов деградации полимерных медицинских изделий;
Часть 14 - Идентификация и количественное определение продуктов деградации изделий из керамики;
Часть 15 - Идентификация и количественное определение продуктов деградации изделий из металлов и сплавов;
Часть 16 - Моделирование и исследование токсикокинетики продуктов деградации и вымывания;
Часть 17 - Установление пороговых значений для вымываемых веществ;
Часть 18 - Исследование химических свойств материалов;
Часть 19 - Исследования физико-химических, морфологических и топографических свойств материалов;
Часть 20 - Принципы и методы исследования иммунотоксического действия медицинских изделий.
Оценка пригодности медицинского изделия для определенного использования включает сопоставление любых идентифицированных рисков в связи с клинической пользой. Риски, связанные с вымываемыми из медицинских изделий субстанциями, также необходимо учитывать.
Риски, связанные с воздействием опасных вымываемых субстанций, управляются путем определения вымываемых субстанций, вычисления сопряженного риска и ограничения воздействия до приемлемого уровня. Настоящий стандарт ИСО 10993 описывает метод, с помощью которого вычисляются максимальные пределы переносимости на основании существующих данных по опасности для здоровья. Пороговые значения могут основываться на рисках для здоровья, которые могут быть как в отношении всего организма, так и локальными, немедленные или отдаленные и различаться по степени тяжести от незначительных местных негативных последствий до опасных для жизни. Эти пороговые значения могут быть установлены с использованием настоящего стандарта токсикологами или другими информированными и опытными лицами, способными принимать обоснованные решения на основании научных данных и знания медицинских изделий.
Выведенные допустимые пределы могут быть использованы любыми лицами. В дополнение к использованию ИСО другими разработчиками стандартов, государственными организациями, нормативными агентствами и другими пользователями в целях установления пороговых значений как стандартов или норм производители и разработчики могут использовать пороговые значения (допустимые уровни) для оптимизации процессов и помощи в выборе материалов с целью охраны здоровья пациентов. В случае, если риски, связанные с воздействием определенных вымываемых субстанций, являются неприемлемыми, настоящий стандарт ИСО 10993 может быть использован для определения альтернативных материалов или процессов.
1 Область применения
Настоящий стандарт устанавливает метод определения пороговых значений (допустимых уровней) для веществ, вымываемых из медицинских изделий. Он предназначен для использования при разработке стандартов и расчете соответствующих ограничений при отсутствии стандартов. Он устанавливает систематический процесс, путем которого выявленные риски при использовании токсикологически опасных субстанций в медицинских изделиях могут быть выражены количественно.
Настоящий стандарт неприменим к изделиям, не имеющим контакта с пациентом (например, изделия для in vitro диагностики).
Воздействие конкретной химической субстанции может происходить из других источников, не имеющих отношения к медицинскому изделию, таких как пища, вода или воздух. Настоящий стандарт не описывает потенциал воздействия из таких источников.
2 Нормативные ссылки
Указанный ниже нормативный документ содержит положения, которые путем ссылок в данном тексте являются положениями настоящего стандарта ИСО 10993. При датированной ссылке дальнейшие поправки или редакции любых из приведенных публикаций неприменимы.
Тем не менее, участники соглашений, основанных на настоящем стандарте ИСО 10993, могут исследовать возможность применения новейшего издания нормативного документа, указанного ниже. При ссылке без даты применимо последнее издание указанного документа. Члены ИСО и МЭК ведут регистры действительных Международных Стандартов.
ИСО 10993-1:2003* Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
_______________
* Таблицу соответствия национальных (межгосударственных) стандартов международным см. по ссылке. - .
3 Термины и определения
В настоящем стандарте применены термины по ИСО 10993-1, а также следующие термины с соответствующими определениями:
3.1 пороговое значение (допустимый уровень), : Наибольшее количество вымываемой субстанции, поступающее в тело путем воздействия медицинского изделия, признанное допустимым на ежедневной основе.
Примечание - Допустимые пределы выражаются в дозе на пациента на каждый соответствующий период воздействия. Используемыми единицами являются масса в отрезок времени, например, миллиграммы в день. Эти дозы отражают переносимый риск медицинского изделия в условиях предназначенного применения.
3.2 оценка полезности, : Числовой фактор, принимающий во внимание пользу для здоровья вследствие применения медицинского изделия, содержащего обсуждаемую вымываемую субстанцию.
3.3 фактор сопутствующего воздействия, : Числовой фактор, учитывающий воздействие на пациента нескольких медицинских изделий, содержащих ту же вымываемую субстанцию.
Примечание - Этот фактор используется для нисходящей корректировки результата и массы тела.
3.4 значение по умолчанию: Значение, используемое при отсутствии данных для фактора неопределенности или другого фактора, используемого в вычислении допустимого уровня.
3.5 вред здоровью: Физическое повреждение и/или ущерб здоровью.
3.6 польза для здоровья: Вероятность сохранения или улучшения здоровья.
3.7 опасность для здоровья: Потенциальный источник вреда для здоровья.
3.8 риск для здоровья: Сочетание вероятности причинения вреда здоровью и тяжести этого вреда.
3.9 анализ риска для здоровья: Использование существующей информации для идентификации опасности для здоровья и определения риска для здоровья.
3.10 вымываемая субстанция: Химическое вещество, выводимое из медицинского изделия действием воды или других жидкостей, связанных с использованием изделия.
Пример - Добавки, остатки стерилизующего средства, остатки обработки, продукты деградации, растворители, смягчители, смазочные вещества, катализаторы, стабилизаторы, антиоксиданты, красители, наполнители и мономеры, и другие.
3.11 минимальный наблюдаемый уровень неблагоприятного воздействия, ![]() : Минимальная концентрация или количество субстанции, обнаруженные путем исследования или наблюдения, вызывающие обнаруживаемое неблагоприятное изменение морфологии, функциональности, роста, развития или продолжительности жизни изучаемого организма при определенных условиях воздействия.
: Минимальная концентрация или количество субстанции, обнаруженные путем исследования или наблюдения, вызывающие обнаруживаемое неблагоприятное изменение морфологии, функциональности, роста, развития или продолжительности жизни изучаемого организма при определенных условиях воздействия.
Примечание - Могут быть обнаружены изменения в морфологии, функциональности, росте, развитии или продолжительности жизни изучаемого организма, не считающиеся неблагоприятными.
3.12 минимально раздражающий уровень, ![]() : Количество вымываемой субстанции, оказывающее минимальное раздражающее воздействие на пациента.
: Количество вымываемой субстанции, оказывающее минимальное раздражающее воздействие на пациента.
Примечание - Обычно выражается в миллиграммах, но иногда в миллиграммах на миллилитр, в этом случае значение должно быть умножено на объем (миллилитры), используемый для получения массы (миллиграммы).
3.13 модифицирующий фактор, : Арифметическое произведение факторов неопределенности
,
и
.
3.14 многократное воздействие: Более чем один контакт одного и того же пациента с медицинскими изделиями, содержащими одинаковую вымываемую субстанцию, одновременно или в разное время.
3.15 не раздражающий уровень, : Наибольшее количество вымываемой субстанции, не вызывающее раздражения у пациента.
Примечание - Обычно выражается в миллиграммах, но иногда в миллиграммах на миллилитр, в этом случае значение должно быть умножено на объем (миллилитры), используемый для получения массы (миллиграммы).
3.16 уровень отсутствия наблюдаемого неблагоприятного воздействия, ![]() : Максимально возможная концентрация или количество субстанции, обнаруженные путем исследования или наблюдения, не вызывающие обнаруживаемого неблагоприятного изменения морфологии, функциональности, роста, развития или продолжительности жизни изучаемого организма при определенных условиях воздействия.
: Максимально возможная концентрация или количество субстанции, обнаруженные путем исследования или наблюдения, не вызывающие обнаруживаемого неблагоприятного изменения морфологии, функциональности, роста, развития или продолжительности жизни изучаемого организма при определенных условиях воздействия.
Примечание - Могут быть обнаружены изменения в морфологии, функциональности, росте, развитии или продолжительности жизни изучаемого организма, не считающиеся неблагоприятными.
3.17 фармакокинетическое моделирование на физиологической основе моделирования, ![]() : Система моделирования биологических эффектов, учитывающая метаболические и фармакокинетические различия между видами животных.
: Система моделирования биологических эффектов, учитывающая метаболические и фармакокинетические различия между видами животных.
Примечание - Такие данные необходимо использовать при их наличии.
3.18 фактор пропорционального контакта, : Числовой фактор контакта пациента с вымываемой субстанцией, учитывающий то, что медицинское изделие обычно не используется каждый день в течение всей интересующей категории воздействия.
Примечание - Этот фактор используется для восходящей регуляции произведения и массы тела.
3.19 повторное использование: Использование того же изделия тем же пациентом более чем один раз без повторной обработки.
3.20 безопасность: Отсутствие недопустимого риска для здоровья.
3.21 одновременное использование: Использование более чем одного изделия тем же пациентом одновременно.
3.22 переносимый уровень контакта, : Переносимое контактное воздействие вымываемой субстанции в результате контакта с медицинским изделием.
Примечание - Обычно выражается в миллиграммах на квадратный сантиметр поверхности тела.
3.23 -модифицирующий фактор,
![]() : Арифметическое произведение факторов неопределенности
: Арифметическое произведение факторов неопределенности ,
и
.
3.24 переносимое воздействие, : Произведение переносимого потребления, массы тела и фактора амортизации.
Примечание - Обычно выражается в миллиграммах в день на пациента.
3.25 толерантная доза, : Ожидаемое среднее ежедневное потребление субстанции за определенный период времени на основании массы тела, которое считается не причиняющим заметного вреда здоровью.
Примечание - Обычно выражается в миллиграммах на килограмм массы тела в день. Вычисляется в рамках общего установления допустимых пределов вымываемой субстанции в медицинском изделии.
3.26 допустимый риск: Риск, допустимый в данном контексте, основанный на современных общественных ценностях.
3.27 фактор неопределенности, : Фактор, предназначенный для учета неопределенности, свойственной оценке потенциальных эффектов химического вещества на человека, используя результаты, полученные в группах населения или суррогатных видах.
3.28 коэффициент использования, : Числовой фактор, используемый для учета применения изделия в плане частоты использования и применения в сочетании с другими медицинскими изделиями, в которых можно обоснованно предположить наличие той же вымываемой субстанции.
4 Основные принципы установления пороговых значений
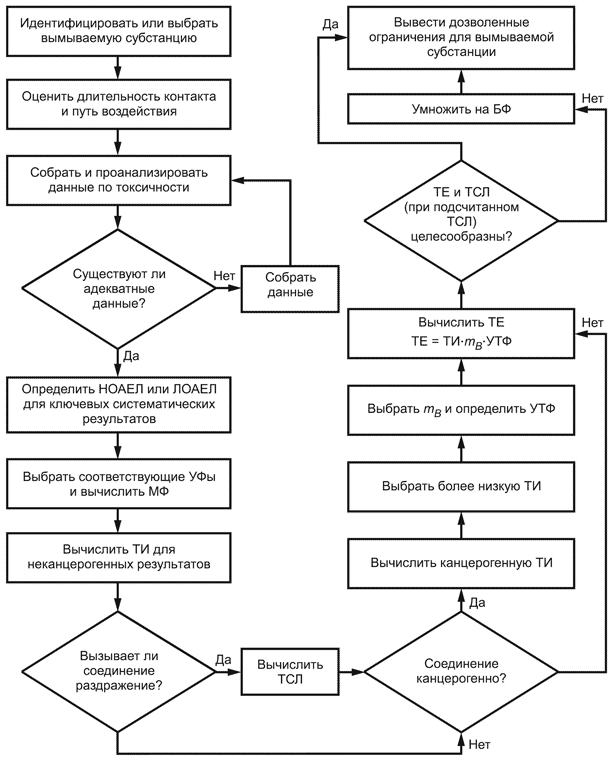
4.1 Процесс установления пороговых значений (см. рисунок 1) для идентифицированной субстанции, вымываемой из медицинских изделий, состоит из:
a) оценки биологического риска, связанного с вымываемой субстанцией (см. раздел 5) путем:
- сбора данных и определения критичных для здоровья результатов,
- определения толерантной дозы () для конкретного пути поступления и длительности воздействия и
- определения переносимых уровней контакта (), если раздражение является допустимым результатом;
b) определения переносимого воздействия () вымываемой субстанции на пациента (см. раздел 6) путем:
- определения массы тела соответствующего пациента () и
- модификации произведения переносимого потребления и массы тела, основываясь на коэффициенте использования ();
c) определения целесообразности и полезности использования, если применимо. Если определение целесообразности показывает, что технически и экономически реализуемо,
становится допустимым пределом. В случае, если
не является технически или экономически возможным (см. раздел 7), в каждом индивидуальном случае необходимо провести дальнейшую модификацию
, основываясь на оценке полезности, для установления порогового значения (см. раздел 8).
4.2 Требования настоящего стандарта ИСО 10993 должны внедряться информированными и опытными лицами, способными принимать обоснованные решения, опираясь на доступные научные данные, используя свое профессиональное мнение. Это требует опыта интерпретации токсикологических данных и токсикологической оценки риска применения медицинских изделий, а также знакомства с применением и пользой медицинских изделий и целесообразности достижения вычисленных пороговых значений.
4.3 Безопасность медицинских изделий требует отсутствия недопустимого риска для здоровья. Анализ риска для здоровья конкретных вымываемых субстанций позволяет установить пределы воздействия, которые предоставляют соответствующую степень защиты от ущерба здоровью в случае выделения опасной вымываемой субстанции в организм во время клинического использования изделия. Степень защиты, признанная приемлемой, в любой ситуации зависит от нескольких факторов, таких как характер идентифицированной опасности, возможность снижения риска и значительность пользы, полученной от применения медицинского изделия. Оценка допустимого риска для здоровья, таким образом, требует исследования и сопоставления нескольких сложных факторов. Уверенность при оценке риска зависит от качества и количества оцениваемых данных.
4.4 В самом широком смысле субстанции, вымываемые из медицинских изделий, могут попадать в тело различными путями, от абсорбции кожей до заглатывания, вдыхания, прямого системного введения. Изделия также могут быть отнесены к одной из трех категорий в зависимости от продолжительности их применения. В свою очередь, каждая категория применения может иметь несколько допустимых уровней, основанных на нескольких путях введения, как указано в ИСО 10993-1. Таким образом, общий допустимый уровень для идентифицированной вымываемой субстанции может иметь до трех составляющих: краткосрочный уровень, продолжительный уровень и пожизненный уровень. В свою очередь, возможно, что каждый из этих уровней должен нести защитную функцию по отношению к нескольким видам применения. Для достижения этого значения переносимые дозы () вычисляются индивидуально для каждого пути применения в рамках каждой соответствующей категории. Таким образом, для любой данной категории применения может существовать несколько уровней
, каждый для соответствующей категории. Во многих случаях токсикологические данные могут быть достаточно обоснованы, для того, чтобы позволить применение самого низкого значения
для категории применения или для пути введения для лучшего представления токсикологических эффектов, вызываемых вымываемыми субстанциями.
4.5 Первой ступенью при установлении допустимого уровня является идентификация субстанции, представляющей опасность для здоровья. После выбора опасной субстанции процесс установления допустимого уровня начинается с установления уровней толерантной дозы.
Примечание - Международные стандарты, такие как ИСО 14971, или другие схемы определения опасности могут быть использованы для определения потенциально опасных остатков.
5 Установление толерантной дозы ( ) для конкретных вымываемых субстанций
) для конкретных вымываемых субстанций
5.1 Общие положения
Обзор токсикологических данных предоставляет информацию, необходимую для установления "уровня отсутствия наблюдаемого неблагоприятного воздействия" (![]() ). Затем к данным применяют подход модифицирующего фактора для нераковых конечных точек (см. 5.4) для установления значения соответствующей толерантной дозы. Для определения толерантной дозы по канцерогенным данным можно использовать либо модифицирующий фактор, либо количественный подход (см. 5.5). Модифицирующий фактор учитывает тип, количество и качество оцениваемых данных, серьезность установленной опасности, неопределенность, свойственную оценке риска, уровень обеспечения безопасности, признанный допустимым, а также другие аспекты.
). Затем к данным применяют подход модифицирующего фактора для нераковых конечных точек (см. 5.4) для установления значения соответствующей толерантной дозы. Для определения толерантной дозы по канцерогенным данным можно использовать либо модифицирующий фактор, либо количественный подход (см. 5.5). Модифицирующий фактор учитывает тип, количество и качество оцениваемых данных, серьезность установленной опасности, неопределенность, свойственную оценке риска, уровень обеспечения безопасности, признанный допустимым, а также другие аспекты.
Характер идентифицированной опасности должен определяться путем оценки токсичности субстанции в плане наблюдаемых токсичных эффектов и дозировок, при которых токсические эффекты проявляются при различных путях введения.
Рисунок 1 - Установление пороговых значений (допустимого уровня) для вымываемых субстанций
5.2 Учет воздействия при вычислении ТИ
5.2.1 Используемые данные
Следующие данные используют для вычисления в разделе 5 и в дальнейшем - для определения соответствующих масс тела и коэффициента использования для вычисления допустимого уровня в разделе 9:
a) длительность воздействия на пациента вымываемой субстанции (см. 5.2.2);
b) обычные пути введения вымываемой субстанции на пациента (см. 5.2.3).
5.2.2 Учет длительности воздействия
Длительность применения конкретного изделия классифицируют, используя положения ИСО 10993-1, раздел 4, а также анализ соответствующих данных.
Для вымываемых субстанций, рассматриваемых в ИСО 10993 (все стандарты), может быть необходима постоянного контакта, длительного контакта и кратковременного контакта, например, при стерилизации, для остаточного количества этиленоксида. Если
вымываемой субстанции устанавливается безотносительно определенного изделия или для всех изделий, вычисляется
постоянного контакта с отклонениями как обязательными ограничениями для длительного и кратковременного контактов, по необходимости, основываясь на биологическом эффекте остатка. Если
установлена для вымываемой субстанции в изделии или классе изделий с особой категорией длительности,
для данной категории устанавливается с более краткосрочными отклонениями, по необходимости, основываясь на биологическом эффекте вымываемой субстанции.
Если данных для установления для конкретной категории не существует, например, если нет хронических данных для установления
постоянного контакта, данные более краткосрочных исследований могут быть использованы с более высоким модифицирующим фактором.
Если изделие может быть отнесено к более чем одной категории, должна основываться на более строгой категории.
5.2.3 Учет пути воздействия
При установлении уровня для вымываемых субстанций безотносительно определенного пути изделия или для нескольких путей, уровни
вычисляются для каждого пути потенциального воздействия в рамках данной категории длительности применения в объемах согласно ИСО 10993-1. Если уровни
для различных путей воздействия находятся в рамках значения фактора 10, самая низкая
может использоваться как
для всех путей воздействия, для всей категории длительности применения. Тем не менее, если уровни
разнятся более чем десятикратно, наличие более чем одной
может стать необходимым для категории длительности применения.
Если уровни устанавливаются для субстанций, вымываемых из конкретного изделия или класса изделий,
вычисляют только для предназначенного способа применения изделия для каждой подходящей категории длительности применения.
При отсутствии данных по конкретному применению возможно использовать уровни для других применений с данными для применения без данных. Такая количественная экстраполяция от одного пути к другому одобряется, причем любая дополнительная неопределенность учитывается как часть фактора неопределенности 3 (
).
5.3 Сбор и анализ данных
После идентификации вымываемой субстанции необходимо собрать соответствующие доступные данные. Таковые могут включать:
a) химические и физические свойства,
b) распространенность и использование,
c) фармакологию,
d) токсикинетику (абсорбция, распределение, метаболизм и выведение из организма),
e) токсикологию и
f) влияние на человека.
Данные, используемые для установления пороговых значений, должны быть высокого качества и релевантными. Все имеющиеся данные должны быть рассмотрены в контексте понимания общей токсичности субстанции. Основной подход опирается на предпосылку, что данные острого эксперимента (например, данные исследований длительностью 14 дней или менее) должны использоваться для длительного или кратковременного контакта; данные субхронического эксперимента (например, данные исследований длительностью от одного до трех месяцев) должны служить основой для длительного контакта, а данные хронического или пожизненного эксперимента (например, данные исследований длительностью шесть месяцев или более) предпочтительны субхроническим или краткосрочным данным для установления пожизненных уровней при постоянном контакте. Данные более длительного периода могут быть полезны при установлении более краткосрочных уровней. По возможности, данные, полученные на человеке, предпочтительнее данных, полученных на животных.
Данные должны быть проанализированы для определения критических неблагоприятных эффектов и установления уровней ![]() для этих эффектов. Если данные неадекватны для определения значения
для этих эффектов. Если данные неадекватны для определения значения ![]() , в дальнейших вычислениях можно использовать минимальный уровень неблагоприятного воздействия (
, в дальнейших вычислениях можно использовать минимальный уровень неблагоприятного воздействия (![]() ) или другое значение, учитывая соответствующую корректировку в связи с дополнительной неопределенностью. По возможности, необходимо исследовать взаимоотношение доза - ответ для помощи при определении значения
) или другое значение, учитывая соответствующую корректировку в связи с дополнительной неопределенностью. По возможности, необходимо исследовать взаимоотношение доза - ответ для помощи при определении значения ![]() , чтобы значимость воздействия могла быть связана с возможностью возникновения токсических эффектов в экспериментальной модели. Необходимо оценить, если это применимо, данные при нескольких способах введения, например, орального, дермального или контакта с тканями, парентерального и ингаляционного. В случае потенциального воздействия со стороны единственного пути введения данные, относящиеся к этому пути введения, наиболее релевантны, хотя также можно рассмотреть и данные по другим путям введения.
, чтобы значимость воздействия могла быть связана с возможностью возникновения токсических эффектов в экспериментальной модели. Необходимо оценить, если это применимо, данные при нескольких способах введения, например, орального, дермального или контакта с тканями, парентерального и ингаляционного. В случае потенциального воздействия со стороны единственного пути введения данные, относящиеся к этому пути введения, наиболее релевантны, хотя также можно рассмотреть и данные по другим путям введения.
Учитывая предполагаемый путь введения у человека, необходимо определить наиболее релевантные неблагоприятные эффекты как основу для установления допустимого уровня, а также дозировки, требуемые для вызова таких неблагоприятных эффектов. Необходимо выбрать наиболее подходящий уровень ![]() или, в исключительных случаях,
или, в исключительных случаях, ![]() или другое значение для использования при вычислении допустимого уровня, основанного на влиянии на здоровье. Этот выбор должен отражать оценку всех неблагоприятных эффектов, основанную на профессиональном мнении. Он должен быть сделан на основе высшего значения
или другое значение для использования при вычислении допустимого уровня, основанного на влиянии на здоровье. Этот выбор должен отражать оценку всех неблагоприятных эффектов, основанную на профессиональном мнении. Он должен быть сделан на основе высшего значения ![]() или минимального уровня неблагоприятных эффектов для любого наблюдаемого токсического эффекта, учитывая применимость и критичность токсических эффектов, путь экспериментального воздействия, известные межвидовые различия в восприимчивости, уверенность в экспериментальных данных, ожидаемые пути введения и длительность применения на человеке, а также любые другие факторы, считающиеся релевантными. Обоснование выбора уровня дозы должно быть отражено документально.
или минимального уровня неблагоприятных эффектов для любого наблюдаемого токсического эффекта, учитывая применимость и критичность токсических эффектов, путь экспериментального воздействия, известные межвидовые различия в восприимчивости, уверенность в экспериментальных данных, ожидаемые пути введения и длительность применения на человеке, а также любые другие факторы, считающиеся релевантными. Обоснование выбора уровня дозы должно быть отражено документально.
5.4 Установление  для вымываемых субстанций, не считающихся канцерогенными
для вымываемых субстанций, не считающихся канцерогенными
ТИ должна быть вычислена для каждого релевантного ожидаемого пути введения и длительности применения, используя ![]() ,
, ![]() или другое определенное значение. Каждое вычисление
или другое определенное значение. Каждое вычисление должно принимать во внимание степень серьезности идентифицированного риска и неопределенность, свойственную анализу риска.
Для вычисления уровней необходимо использовать подход модифицирующего фактора при любой возможности. Такой подход объединяет использование факторов неопределенности, которые устанавливаются на основе профессионального мнения, для предоставления приемлемых границ безопасности против наиболее опасных неблагоприятных эффектов.
Формула для вычисления значений ТИ, в миллиграммах на килограмм массы тела в день, используя подход модифицирующего фактора, показана в уравнении (1) ниже.
![]() , (1)
, (1)
где - модифицирующий фактор
![]() (см. 5.4.2 для описания факторов неопределенности
(см. 5.4.2 для описания факторов неопределенности ,
и
).
Необходимо установить допустимые уровни, основанные на использовании наиболее широким сегментом ожидаемой группы пользователей. Например, если пользователями являются преимущественно здоровые взрослые мужчины, предварительные расчеты должны основываться на воздействии на взрослых мужчин; если изделие предназначено для особой группы населения, такой как беременные женщины или новорожденные, расчеты должны опираться на такую группу. Типичные допущения по частоте дыхания, массе тела, и т.д., которые должны быть использованы в таком подсчете, приведены в приложении А.
5.4.2 Установление факторов неопределенности
5.4.2.1 Общие положения
Приблизительная оценка факторов неопределенности включает в себя многие разнообразные аспекты. Эти факторы принимают во внимание неопределенность, свойственную оценке потенциальных эффектов химических веществ на людях на основе результатов, полученных в группах населения или суррогатных видах. Эти аспекты трудно вычислить при анализе риска. Фактор неопределенности, использующийся в данных, полученных на человеке, ниже, чем в данных, полученных на животных. При использовании хронических данных для определения уровней постоянного применения фактор неопределенности ниже, чем при использовании субхронических данных. Он также ниже при использовании
![]() , чем при
, чем при ![]() . Значение или степень воздействия, придаваемые каждому фактору неопределенности, должны быть отражены документально с обоснованием выбора. Некоторые аспекты при выборе подходящих факторов неопределенности включают вариации от человека к человеку, видовые экстраполяции и другие неопределенности, описанные ниже.
. Значение или степень воздействия, придаваемые каждому фактору неопределенности, должны быть отражены документально с обоснованием выбора. Некоторые аспекты при выборе подходящих факторов неопределенности включают вариации от человека к человеку, видовые экстраполяции и другие неопределенности, описанные ниже.
5.4.2.2 Фактор неопределенности 1 ()
отвечает за индивидуальные вариации между особями человека. Необходимо учитывать
при вычислении значения
. Для оценки вариации между особями человека всегда предпочтительнее опираться на реальные данные. При отсутствии экспериментальных данных для характеристики индивидуальной вариабельности человеческого ответа на токсичный агент по умолчанию исторически использовался фактор неопределенности со значением 10 для обеспечения полного диапазона человеческой вариабельности, если оценка безопасности основывалась на эффектах, наблюдаемых на животных. Как следствие, значительно сниженный фактор неопределенности, возможно даже со значением 1, может быть более подходящим при изучении неблагоприятного эффекта в той группе пациентов, которая будет подвергнута воздействию.
Если вариация от человека к человеку признана минимальной, нужно выбрать фактор неопределенности, приближающийся к 1. Если вариация от человека к человеку признана значительной, нужно выбрать фактор неопределенности с другим значением или приближающийся к 10. Если человеческая вариация признана промежуточной, нужно взять промежуточный фактор неопределенности. Идиосинкратическая гипервосприимчивость обычно не должна служить основой значения . В результате фактор неопределенности для индивидуальной вариабельности человека не обязательно будет учитывать особо чувствительные подгруппы населения. Способ введения материала в тело также должен быть учтен при установлении релевантности и значимости любого фактора неопределенности.
5.4.2.3 Фактор неопределенности 2 ()
относится к экстраполяции данных, полученных от видов, помимо человека.
должен учитывать врожденные различия между другими видами и человеком. Всегда предпочтительно иметь данные и детальное знание соотношений между человеком и подопытным видом.
Десятикратный фактор безопасности может быть уместен при отсутствии детальных знаний межвидовых различий по токсичности. Если токсичность и токсикокинетика субстанции хорошо известны и схожи на человеке и экспериментальной модели, нужно использовать более низкий фактор неопределенности. Также, если признано, что различия имеют токсикологическое значение, необходимо использовать более высокие факторы неопределенности. Способ введения материала в тело также должен быть учтен при установлении релевантности и значимости любого фактора неопределенности.
5.4.2.4 Фактор неопределенности 3 ()
, фактор неопределенности между 1 и 100, относится к качеству и соответствию данных исследований. Если данные хорошего качества и релевантные, используется значение 1. Фактор (
) должен основываться на профессиональном мнении, учитывающем качество данных и построение исследования.
Это необходимо учитывать при неопределенности в следующих ситуациях, не ограничиваясь таковыми:
a) использование краткосрочных исследований для экстраполяции более длительного воздействия или эффекта;
b) наличие только данных ![]() вместо данных
вместо данных ![]() ;
;
c) отсутствие подтверждающих исследований;
d) использование несоответствующих животных моделей;
e) неподходящий путь введения;
f) степень воздействия;
g) уверенность в базе данных.
При установлении также необходимо рассмотреть степень обеспечения безопасности, признанную приемлемой в свете серьезности опасности для здоровья. При опасностях для здоровья, таких как смерть, очень серьезный вред или необратимое воздействие на поражаемый орган в ожидаемом или конечном результате, необходимо рассмотреть дополнительное допущение. Также, если результат несет ограниченное токсикологическое значение, необходимо рассмотреть снижение допущения. Необходимо также рассмотреть способ введения материала в тело для установления существенности и масштабов любого фактора неопределенности.
Если количество или качество подходящих данных ограничено, необходимо выбрать значение фактора, приближающееся или равное 100. Если исследования, служащие основой для , признаны хорошо спланированными и правильно проведенными, необходимо выбрать значение фактора, приближающееся или равное 1. Промежуточные ситуации означают выбор промежуточных факторов. Верхняя граница фактора может превышать 100, если данные, полученные в остром опыте на животных, служат единственной основой вычисления значений
для постоянного воздействия.
5.4.3 Определение модифицирующего фактора
Модифицирующий фактор (), таким образом, должен быть вычислен как произведение факторов неопределенности (
![]() ) [см. уравнение (2) ниже]. Этот модифицирующий фактор послужит основанием определения
) [см. уравнение (2) ниже]. Этот модифицирующий фактор послужит основанием определения и, в свою очередь, переносимого воздействия (
) для каждой категории применения.
![]() . (2)
. (2)
В большинстве случаев модифицирующий фактор между 10 и 1000 должен быть достаточно обоснован. В некоторых случаях, особенно при наличии только неудовлетворительных или неподходящих данных и установлении значительных факторов опасности, может потребоваться такой высокий модифицирующий фактор как 10000. В некоторых случаях модифицирующий фактор менее 10 может быть обусловлен наличием достаточных клинических данных или достаточно стандартных результатов. При наличии только данных смертности в остром опыте для установления постоянного контакта может потребоваться модифицирующий фактор выше 10000. Любая ситуация, приводящая к модифицирующему фактору выше 10000, указывает на высокую степень неточности анализа, и в таких случаях необходимо принять во внимание острую потребность в дополнительных данных. Как альтернативу к использованию значений
по умолчанию, можно применить фармакокинетическое моделирование на физиологической основе (ПБПК) для учета индивидуальных вариаций от человека к человеку (
) и для проведения межвидовой экстраполяции (
) в рамках вида. Использование моделей ПБПК может снизить неопределенность и привести к другому
.
5.5 Установление  для вымываемых субстанций, считающихся канцерогенными
для вымываемых субстанций, считающихся канцерогенными
5.5.1 Процедура для канцерогенных вымываемых субстанций
После установления для рака ее необходимо рассмотреть вместе с другими значениями
для нераковых конечных точек для определения подходящей
постоянного контакта для использования в вычислениях
.
Для вымываемых субстанций, считающихся канцерогенными, необходимо применить исследование совокупности доказательств для определения подходящего метода установления на основе рака. Исследование совокупности доказательств подразумевает ответы на следующие вопросы:
- Является ли материал генотоксичным канцерогеном?
- Релевантны ли виды опухолей для человека?
- Возможна ли экстраполяция на человека существующих данных локализации в организме?
- Релевантна ли эпидемиологическая информация для человека?
5.5.2 Варианты для субстанций, прошедших исследование совокупности доказательств
Если исследование совокупности доказательств показывает, что материал является генотоксичным канцерогеном, виды опухолей, наблюдаемых в раковых биопробах, существенны для человека, а локализация в организме и/или эпидемиологическая информация подтверждают релевантность для человека, необходимо использовать один из двух следующих подходов.
a) Определить канцерогенную , основываясь на процедурах оценки количественного риска, с использованием статистических моделей с уровнем значимости риска 10
или
Примечание - При использовании линейной многоступенчатой модели необходимо рассмотреть возможную нелинейность малых доз и даже возможные биологические пороги, возникающие из-за присутствия механизмов восстановления ДНК и других гомеостатических процессов.
b) Не определять канцерогенную . Снизить воздействие на пациента до наиболее низкого разумного применения и активно контролировать риск рака, используя процедуры управления риском.
Примечание - Для дополнительной информации см. ИСО 14971.
5.5.3 Процедура при безрезультативном или неопределенном исследовании совокупности доказательств
Если исследование совокупности доказательств безуспешно, необходимо применить подход модифицирующего фактора. Если исследование совокупности доказательств неоднозначно, необходимо применить методы как модифицирующего фактора, так и количественной оценки риска для определения канцерогенной . При использовании подхода модифицирующего фактора необходимо применить методы, описанные в 5.3 для туморогенных (опухолевых) ответов.
При любой возможности необходимо использовать фармакокинетическое моделирование на физиологической основе (ПБПК) для расчета дозы, доставляемой в рассматриваемый орган-мишень, в отличие от применяемой дозы. В свою очередь, при расчете риска в вычислении используется доставляемая, а не применяемая доза.
5.6 Установление переносимых уровней контакта ( )
)
5.6.1 Общие положения
Обзор данных по раздражению предоставляет информацию, необходимую для решения, нужен ли учет раздражения, и, если необходимо, для установления нераздражающего уровня (НИЛ). После решения, что НИЛ должен быть вычислен, используется подход модифицирующего фактора для разработки уровня переносимого контакта. Ожидается, что уровни будут нужны только для некоторых вымываемых субстанций, причем только в некоторых изделиях, используемых при определенном применении. В таких ситуациях уровни
при использовании станут двойными обязательными ограничениями вместе с допустимыми уровнями. Кроме того, возможны ситуации, при которых предотвращение раздражения является настолько ограничивающим, что допустимые уровни, основанные на системной токсичности, не являются необходимыми.
Данный подход не предназначается для вычисления значений на основании аллергического контактного дерматита или местных эффектов, за исключением раздражения в анатомически или фармакокинетически изолированных органах (например, мозг, глаза).
5.6.2 Учет воздействия при вычислении
Переносимые уровни контакта () могут потребоваться для любой вымываемой субстанции, которая вызывает раздражение в результате прямого контакта с тканями тела, например, кожей, глазами, слизистыми оболочками или поверхностями, поврежденными в результате способа применения определенного изделия. Необходимо принять во внимание группу населения пациентов.
Переносимые уровни контакта () могут потребоваться для многократного применения при контакте с тканями. Например, материал может не являться раздражителем в данной концентрации при однократном применении, но может стать раздражителем после повторного применения.
5.6.3 Установление при раздражении
5.6.3.1 Общие положения
Для каждой соответствующей контактирующей ткани необходимо вычислить исходя из нераздражающего уровня (
), минимально раздражающего уровня (
![]() ) или другого аналогичного уровня. Каждое вычисление
) или другого аналогичного уровня. Каждое вычисление должно учитывать степень раздражения при многократном воздействии нераздражающих концентраций, если такие данные существуют. Для вычисления
необходимо использовать подход модифицирующего фактора. Такой подход включает в себя использование факторов неопределенности, которые устанавливаются на основе профессионального мнения, для предоставления приемлемых границ безопасности от раздражения. Ниже приведена формула для вычисления
, в миллиграммах на квадратный сантиметр, с использованием подхода модифицирующего фактора:
![]() , (3)
, (3)
где ![]() - модифицирующий фактор (
- модифицирующий фактор (![]() );
);
- нераздражающий уровень, в миллиграммах;
![]() - минимально раздражающий уровень, в миллиграммах;
- минимально раздражающий уровень, в миллиграммах;
- площадь поверхности контакта с телом, в квадратных сантиметрах.
Границы раздражения должны быть установлены, основываясь на самом широком сегменте определенной группы пользователей. Если назначением не является широкое употребление, используют подгруппу населения, для которой предназначается изделие.
5.6.3.2 Определение факторов неопределенности
Методы, используемые для определения риска биологического раздражения, отличаются от методов, используемых для системной токсичности. Главным отличием является степень неопределенности. Обычно, если в соответствующей опытной модели не получено раздражения, оно не произойдет при использовании человеком. Таким образом, использование нескольких факторов неопределенности более ограничено, а границы безопасности увеличены. Тем не менее, при выборе следует рассматривать несколько факторов неопределенности.
- Фактор неопределенности 4 ()
отвечает за индивидуальные вариации от человека к человеку.
должен приниматься во внимание при вычислении значения
. Для оценки вариации от человека к человеку всегда предпочтительнее опираться на реальные клинические данные. При отсутствии экспериментальных данных для характеристики индивидуальной вариабельности клинического ответа на раздражающую вымываемую субстанцию необходимо использовать фактор неопределенности в диапазоне от 3 до 10.
- Фактор неопределенности 5 ()
отвечает за экстраполяцию данных, полученных от экспериментальных животных.
должен учитывать врожденные различия между животными и человеком. Всегда предпочтительно иметь данные и детальное знание соотношений между человеком и экспериментальным видом животного. При отсутствии такого детального знания необходимо использовать фактор неопределенности межвидовой вариации (
) со значением 3.
- Фактор неопределенности 6 ()
отвечает за качество и релевантность опытных данных. Использование уровней
![]() вместо
вместо может потребовать фактор неопределенности (
) со значением 3 или выше. Также
до 3 может быть применен, если выводы делаются на основании неудовлетворительно спланированного или выполненного исследования или если количество подходящих данных было ограниченным. Таким образом,
может быть 9 или более, если и соответствие, и качество данных неудовлетворительны.
5.6.3.3 Определение модифицирующего фактора
Таким образом, модифицирующий фактор (
![]() ) должен вычисляться как произведение факторов неопределенности (
) должен вычисляться как произведение факторов неопределенности (![]() ), как приведено в уравнении (3). Этот модифицирующий фактор послужит основой для
), как приведено в уравнении (3). Этот модифицирующий фактор послужит основой для . В большинстве случаев общий модифицирующий фактор со значением 30 или менее должен быть достаточным, но он может быть и выше, если нераздражающие концентрации не были установлены или при наличии только низкокачественных или несоответствующих данных.
5.7 Оценка риска смесей
Настоящий стандарт предназначен для определения пороговых значений для отдельных вымываемых субстанций, выделяемых медицинскими изделиями. Тем не менее, пациент редко входит в контакт с одной отдельной субстанцией. Гораздо вероятнее ситуации контакта с несколькими соединениями, одновременно выделяемыми изделием. Это воздействие нескольких соединений может потенциально увеличить или понизить токсичность любой рассматриваемой субстанции. Тем не менее, при уровне выделения соединений из медицинского изделия значительно ниже соответствующих значений для этих соединений вероятность возникновения синергических эффектов среди составных смесей мала. Методы проведения оценки риска смесей приведены в приложении В.
6 Вычисление переносимого воздействия ( )
)
6.1 Общие положения
Воздействие какой-либо вымываемой субстанции может произойти в результате использования ряда медицинских изделий. После разработки уровней для вымываемой субстанции, необходимо откорректировать соответствующие
для определения возникающего воздействия, которое было бы переносимым, учитывая способ применения изделия и потенциал воздействия других источников вымываемой субстанции из медицинского изделия.
Необходимо оценить следующие факторы для определения нужной массы тела и коэффициента использования (), применяемых для вычисления переносимого воздействия (
):
a) определенная группа населения, использующая изделие;
b) преобладающая масса тела группы пользователей;
c) предполагаемая схема использования изделия;
d) возможность воздействия на пациента той же вымываемой субстанции из нескольких изделий.
не корректируется для применения, так как это местный эффект, который обычно не повышается или снижается в связи с применением изделия. Скорее
будет применяться как переносимое воздействие для таких комбинаций остаток/изделие, в которых раздражение является фактором при установлении допустимого уровня. При применении
обычно считается взаимно обязательным
. В случаях, когда раздражение представляет обязательное ограничение,
становится
, но выражается в миллиграммах на изделие, так как неприемлемое раздражение не должно быть допущено даже на один день.
Факторы использования должны отражать обычные пути остаточного воздействия изделия или класса изделий на пациента. Если одно значение было выбрано, представляя все
для категории применения, необходимо допустить определенную свободу при вычислении факторов использования для изделий со специфичным путем. Если одно значение
использовалось для всех путей ввода в данной категории длительности, может быть вычислено отдельное значение
для пути ввода, специфичного для изделия, и использовано как основа для коэффициента использования для данного изделия или категории изделий.
6.2 Группа пользователей
6.2.1 Масса тела
Большинство медицинских изделий применяется на взрослых. Таким образом, для вычисления применяется масса тела 70 кг, кроме случаев, когда изделие предназначается к применению на другой группе населения. В таком случае необходимо основывать
на массе тела, выведенной из схемы преобладающего применения, обращая особое внимание на изделия, предназначенные конкретно для применения в особо чувствительных группах, таких как новорожденные. См. приложение А для различных масс тела, возможных к применению.
6.2.2 Изделия, специально предназначенные к использованию у новорожденных и детей
Для новорожденных необходимо рассмотреть потенциальную незрелость основных путей удаления материала и возможность более высокой аккумуляции. Для вычисления уровней для медицинских изделий, предназначенных к применению у новорожденных, предпочтительны данные, полученные из исследований, в которых новорожденные входили в контакт с опасным материалом. При отсутствии таких данных для вычисления уровней
уровни
, вычисленные по данным взрослых, могут использоваться для вычисления
.
Вычисления следует проводить с использованием массы тела 3,5 кг для новорожденных и 10 кг для детей, как массы тела человека для данного изделия.
6.3 Вычисление коэффициента использования от предполагаемого применения
6.3.1 Общая часть
Произведение переносимого потребления и массы тела корректируется умножением на коэффициент использования (
).
Схема обычного применения медицинского изделия, включая его применение в рамках системной терапии, должна быть определена для данной группы населения. Вычисление коэффициента использования должно, по возможности, учитывать ожидаемую схему применения медицинских изделий. Это подразумевает вычисление фактора сопутствующего воздействия () и фактора пропорционального контакта (
). Эти факторы перемножают для получения коэффициента использования (
), как показано в уравнении (4)
![]() . (4)
. (4)
6.3.2 Фактор сопутствующего воздействия ()
Определяют степень воздействия конкретной вымываемой субстанции в результате использования нескольких изделий. Определяют фактор сопутствующего воздействия () значением между 0,2 и 1,0 на основе этой оценки, руководствуясь следующими принципами:
a) используют со значением 0,2, если фактор амортизации неизвестен;
b) если несколько медицинских изделий (т.е., по меньшей мере, 5% изделий, проданных за календарный год, или более чем пять изделий в любой отдельной медицинской процедуре) могут выделять вымываемую субстанцию, вычисляют следующим образом:
1) произведение и массы тела (
), разделенное на общее количество вымываемой субстанции, которую медицинские изделия ожидаемо выделят во время процедуры, как приведено в уравнении (5)
![]() , (5)
, (5)
где - толерантная доза, в миллиграммах на килограмм массы тела в день;
- масса тела, в килограммах;
- общая масса вымываемой субстанции, выделенной во время процедуры, в миллиграммах в день;
2) произведение и
, поделенное на ожидаемое среднее ежедневное воздействие вымываемых субстанций из всех изделий в течение жизни на обычного пользователя, как приведено в уравнении (6)
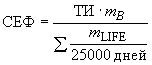 , (6)
, (6)
где - толерантная доза, в миллиграммах на килограмм массы тела в день;
- масса тела, в килограммах;
![]() - масса вымываемой субстанции, выделенной в течение жизни, выраженной в виде среднего ежедневного воздействия в миллиграммах.
- масса вымываемой субстанции, выделенной в течение жизни, выраженной в виде среднего ежедневного воздействия в миллиграммах.
3) значение по умолчанию 0,2;
с) если несколько применяемых изделий способны выделять вымываемые субстанции (т.е. менее чем 5% изделий, проданных за календарный год, или менее чем пять изделий в любой отдельной медицинской процедуре) необходимо использовать со значением 1,0.
6.3.3 Фактор пропорционального контакта ()
Коэффициент использования () может быть откорректирован в восходящем направлении для учета ситуации, при которой устройство не используется в течение всей длительности категории воздействия. Для этого необходимо вычислить фактор пропорционального контакта (
) как пропорцию категории воздействия, во время которого ожидается реальный контакт с изделием. Таким образом, как показано в уравнении (7),
равняется числу дней в категории воздействия, разделенному на число дней использования изделия до его удаления.
![]() , (7)
, (7)
где - число дней в категории воздействия;
- число дней использования изделия.
Если число дней использования изделия варьируется, необходимо использовать разумный верхний предел. Если разумный верхний предел невозможно определить, используют значение , равное 1, по умолчанию.
6.4 Переносимое воздействие
корректируется для учета способа использования изделия. Переносимое воздействие
является произведением переносимого потребления, массы тела и фактора амортизации.
![]() , (8)
, (8)
где - переносимое воздействие после учета массы тела пациента и амортизации изделия. Обычно выражается в миллиграммах в день;
- толерантная доза после модификации, основанной на оценке изделия. Обычно выражается в миллиграммах на килограмм массы тела в день;
- масса тела, присущая предполагаемой группе пациентов. При отсутствии точной информации используют
70 кг;
- коэффициент использования, применяемый для учета частоты использования изделия и использовании в сочетании с другими медицинскими изделиями, в которых можно обоснованно предположить наличие той же вымываемой субстанции.
7 Оценка выполнимости
7.1 Выполнимость относится к способности изготовителем или переработчиком достичь уровня переносимого воздействия. Выполнимость состоит из двух компонентов:
a) техническая выполнимость и
b) экономическая выполнимость.
Техническая выполнимость обозначает способность достижения переносимого воздействия для изделия или класса изделий вне зависимости от затрат.
Экономическая выполнимость обозначает способность соответствовать переносимому воздействию, не превращая процесс предоставления изделия в невыгодное экономическое предприятие. При выборе допустимых уровней необходимо рассмотреть аспекты стоимости и доступности в той степени, в которой таковые влияют на охрану, поддержание и улучшение здоровья человека.
7.2 Если достижение переносимого воздействия выполнимо, не следует проводить оценку полезности, фактор полезности становится 1 по умолчанию, а допустимый предел - таким же, как переносимое воздействие. Если достижение переносимого воздействия невыполнимо технически или экономически, необходимо провести оценку полезности. Обоснование рассмотрения полезности должно быть отражено документально.
8 Оценка полезности
8.1 Степень гарантии безопасности, считающаяся соответствующей для медицинских изделий, признает тот факт, что использование всех медицинских изделий имеет пользу для здоровья. Чем больше польза здоровью, ожидаемая от применения изделия, тем выше приемлемый риск для здоровья. Тем не менее, в целях настоящего стандарта ИСО 10993 польза рассматривается в каждом индивидуальном случае только при превышении переносимого воздействия. Только в этом случае может быть введен учитывающий пользу для здоровья фактор для коррекции переносимого воздействия (), притом, что токсичность, возникающая в результате вымываемых субстанций, присутствующих в изделии, признана приемлемой при сопоставлении с определенной пользой для здоровья, ожидаемой от терапии, и что вымываемые субстанции были сокращены до наиболее возможного минимума в соответствии с охраной, поддержанием и улучшением здоровья человека в целом.
8.2 Применяя оценку риска к медицинскому изделию, необходимо сделать допущение на то, что не существует медицинской процедуры без риска для здоровья и что риск, связанный с применением медицинских изделий, находится в соотношении с пользой для здоровья в результате их использования.
8.3 В случаях, когда вымываемых субстанций, являющихся токсичными соединениями в результате материалов или процессов, невозможно с легкостью избежать путем использования альтернативных материалов или методов обработки, необходимо рассмотреть значительность пользы, происходящей от применения изделия. Обоснование необходимости и значимости фактора полезности, использованного при вычислении пороговых значений, должно быть отражено документально. В таких случаях пороговое значение является произведением и фактора полезности (
).
9 Допустимые уровни
9.1 После вычисления всех и их модификаций, основываясь на целесообразности и полезности, допустимый уровень вычисляется для каждого
. Соответствие всем допустимым уровням необходимо.
9.2 Каждый допустимый уровень вычисляется, используя следующую общую формулу:
![]() , (9)
, (9)
где - наибольшее количество вымываемой субстанции, признанное допустимым при поступлении ежедневно в тело путем воздействия медицинского изделия (см. 3.1), выражаемое в миллиграммах в день.
Примечание 1 - Если основано на
,
равно
, а допустимый уровень выражается в миллиграммах на квадратный сантиметр;
- переносимое воздействие, в миллиграммах в день.
Примечание 2 - Если основано на
, выражается в миллиграммах на квадратный сантиметр;
- фактор полезности.
9.3 Допустимые уровни также можно выразить в миллиграммах на изделие. Методы конверсии для допустимых уровней в выражении массы на изделие (mdev), основанных либо на системных ограничениях, в миллиграммах в день, либо ограничениях контакта с поверхностью тела для раздражающих субстанций, приведены в приложении С.
10 Требования к отчетности
Основные рассмотренные данные и обоснование выбора всех факторов должны быть отражены документально. См. приложение D.
Приложение А
(справочное)
Некоторые типичные допущения биологических параметров
А.1 Общая часть
В данном приложении приведены средние параметры для использования при оценке риска. Оно обозначает продолжительность жизни, ежедневное потребление воды, ежедневное потребление воздуха, массу тела и период беременности человека, крысы, мыши, хомяка, морской свинки, собаки и кролика. Это наиболее распространенные виды, для которых существуют данные. Эти данные по умолчанию могут использоваться как основа для межвидовых сравнений, если не доказано, что другие данные являются более подходящими. В реальности конкретные данные по видам могут незначительно отличаться.
А.2 Допущения
А.2.1 Человек
Средние параметры человека:
- продолжительность жизни 70 лет;
- потребление питьевой воды 2 л/сут;
- потребление воздуха 20 м/24 ч; 10 м
/сут за 8-часовой рабочий день;
- масса тела для взрослых мужчин 70 кг; для взрослых женщин - 58 кг; для детей - 10 кг; для новорожденных до 1 года 3,5 кг;
- период беременности 9 мес.
А.2.2 Крыса
Средние параметры крысы:
- продолжительность жизни 2 года;
- потребление питьевой воды 0,025 л/сут для самцов; 0,020 л/сут - для самок;
- потребление воздуха 0,29 м/24 ч;
- масса тела для взрослых самцов 0,5 кг; для взрослых самок - 0,35 кг;
- период беременности 22 сут.
А.2.3 Мышь
Средние параметры мыши:
- продолжительность жизни 2 года;
- потребление питьевой воды 0,005 л/сут;
- потребление воздуха 0,043 м/24 ч;
- масса тела для взрослых самцов 0,03 кг; для взрослых самок - 0,025 кг;
- период беременности 20 сут.
А.2.4 Хомяк
Средние параметры хомяка:
- продолжительность жизни 2 года;
- потребление питьевой воды 0,015 л/сут;
- потребление воздуха 0,086 м/24 ч;
- масса тела для взрослых самцов 0,125 кг; для взрослых самок - 0,110 кг;
- период беременности 15 сут.
А.2.5 Морская свинка
Средние параметры морской свинки:
- продолжительность жизни 3 года;
- потребление питьевой воды 0,085 л/сут;
- потребление воздуха 0,043 м/24 ч;
- масса тела 0,5 кг;
- период беременности 68 сут.
А.2.6 Собака
Средние параметры собаки:
- продолжительность жизни 11 лет;
- потребление питьевой воды 0,5 л/сут;
- потребление воздуха 7,5 м/24 ч;
- масса тела 16 кг;
- период беременности 63 сут.
А.2.7 Кролик
Средние параметры кролика:
- продолжительность жизни 7 лет;
- потребление питьевой воды 0,33 л/сут;
- потребление воздуха 1,44 м/24 ч;
- масса тела 3 кг;
- период беременности 31 сут.
Приложение В
(справочное)
Оценка риска для смесей вымываемых субстанций
Если соединения, вымываемые из изделия, оказывают эффект путем известного токсикологического механизма действия или структурно схожи между собой (например, эфир фталевой кислоты, акрилаты, метакрилаты), а доза этих соединений, получаемая пациентом, значительно ниже соответствующих значений для каждого соединения, можно предположить, что любые эффекты произойдут кумулятивно; то есть общий эффект двух или более агентов будет равен сумме эффектов каждого агента поодиночке. В результате для оценки вероятности того, что воздействие соединения вызовет неблагоприятный эффект, можно использовать подход индекса опасности (
).
вычисляют следующим образом:
![]() , (В.1)
, (В.1)
где - число соединений в смеси;
- доза каждого соединения, получаемая пациентом, в миллиграммах в день;
- переносимое потребление, в миллиграммах в день, каждого соединения.
Приложение С
(справочное)
Преобразование пороговых значений при системном воздействии и контакте с поверхностью тела в максимальную дозу для пациента при применении медицинских изделий
С.1 Введение
Данное приложение описывает метод вычисления максимального количества, т.е. максимальной дозы пациенту, выражаемой как масса субстанции, вымываемой из медицинского изделия, основываясь на пороговом значении (допустимом уровне) ИСО для вымываемой субстанции.
Вымываемая субстанция может иметь несколько допустимых уровней. Существуют пороговые значения для системного воздействия, которые включают допустимые уровни для некоторых или всех трех категорий применения по ИСО 10993-1, а именно, кратковременный контакт, длительный контакт и постоянный контакт. В рамках каждой из этих категорий применения могут быть допустимые уровни для определенных групп пациентов в дополнение к допустимому уровню для взрослых. Различные уровни могут существовать для специфических путей введения. Наконец, также могут быть и допустимые уровни для вымываемых субстанций, раздражающих ткани организма.
Пороговые значения для системного применения выражаются в единицах массы в день (миллиграммы в день). Пороговые значения для контакта с поверхностью тела выражаются в массе на площадь поверхности (миллиграммы на квадратный сантиметр).
С.2 Вычисление максимальной дозы субстанции, вымываемой из медицинских изделий, при системном воздействии на пациента
С.2.1 Изделия постоянного применения
Медицинские изделия в категории постоянного применения могут использоваться от 31 до 25000 сут.
Ниже приведена формула для вычисления максимального количества субстанции, которая может вымываться из медицинского изделия в категории постоянного применения
![]() , (C.1)
, (C.1)
где ![]() - масса на изделие, т.е. максимальная доза пациенту в миллиграммах;
- масса на изделие, т.е. максимальная доза пациенту в миллиграммах;
![]() - допустимый уровень для категории постоянного применения, в миллиграммах в день.
- допустимый уровень для категории постоянного применения, в миллиграммах в день.
С.2.2 Изделия длительного применения
Медицинские изделия категории длительного применения могут использоваться от 2 до 30 сут.
Ниже приведена формула для вычисления максимальной дозы субстанции, вымываемой из медицинского изделия в категории длительного применения
![]() , (C.2)
, (C.2)
где ![]() - масса на изделие, т.е. максимальная доза пациенту в миллиграммах;
- масса на изделие, т.е. максимальная доза пациенту в миллиграммах;
![]() - допустимый уровень для категории длительного применения, в миллиграммах в день.
- допустимый уровень для категории длительного применения, в миллиграммах в день.
С.2.3 Изделия кратковременного применения
Для медицинских изделий в категории кратковременного применения, т.е. до 24 ч (одни сутки), допустимый уровень для вымываемой субстанции в миллиграммах в день становится максимальной дозой вымываемой субстанции на пациента в миллиграммах (на изделие).
![]() , (C.3)
, (C.3)
где ![]() - масса на изделие, т.е. максимальная доза пациенту в миллиграммах;
- масса на изделие, т.е. максимальная доза пациенту в миллиграммах;
![]() - допустимый уровень для категории кратковременного применения, в миллиграммах в день.
- допустимый уровень для категории кратковременного применения, в миллиграммах в день.
С.3 Вычисление максимальной дозы субстанции, вымываемой из медицинских изделий, при контакте с поверхностью тела пациента
Ниже приведена формула для вычисления
![]() , (С.4)
, (С.4)
где ![]() - масса на изделие, т.е. максимальная доза в миллиграммах на пациента;
- масса на изделие, т.е. максимальная доза в миллиграммах на пациента;
- переносимый уровень контакта, в миллиграммах на квадратный сантиметр;
- площадь поверхности медицинского изделия в контакте с телом, в квадратных сантиметрах.
Приложение D
(справочное)
Отчет по оценке риска
D.1 Общая часть
Любого комплекта документации с информацией и обоснованием использованных для установления пороговых значений (допустимых уровней) для субстанций, вымываемых из медицинских изделий, будет достаточно. Ниже приведен возможный отчет. Отчет может быть сделан по каждому изделию, по каждой субстанции или по другой форме в зависимости от конкретного случая. Желательна минимизация документации, по возможности.
D.2 Содержание
Отчет должен содержать следующую информацию:
a) сущность вымываемой субстанции(й);
b) краткое описание рассматриваемого изделия(й);
c) основные ![]() (ы),
(ы), ![]() (ы),
(ы), (ы) и/или
![]() (ы) либо другие результаты по вымываемой субстанции. Каждое значение должно сопровождаться ссылками, выбранным модифицирующим фактором и его обоснованием (т.е. обоснования для
(ы) либо другие результаты по вымываемой субстанции. Каждое значение должно сопровождаться ссылками, выбранным модифицирующим фактором и его обоснованием (т.е. обоснования для ,
,
, и т.д.);
d) неканцерогенные ;
e) канцерогенные , если применимо;
f) , если применимо;
g) УТФ и его обоснование (т.е. обоснования для и
);
h) и его обоснование;
i) обзор оценки целесообразности со ссылками на все ключевые использованные данные;
j) если применимо, выбранная и ее обоснование со ссылками на все ключевые использованные данные;
k) допустимые уровни для осадка;
I) заявление, что допустимые уровни были вычислены с использованием методов, описанных в настоящем стандарте.
Приложение Е
(справочное)
Сведения о соответствии национальных стандартов Российской Федерации ссылочным международным стандартам
Таблица Е.1
Обозначение ссылочного международного стандарта | Обозначение и наименование соответствующего национального стандарта |
ИСО 10993-1:2003 | Р ИСО 10993-1-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1: Оценка и исследования |
Библиография
[1] ИСО 10993-7 | Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этилен-оксида после стерилизации ISO 10993-7, Biological evaluation of medical devices - Part 7: Ethylene oxide sterilization residuals | |
[2] ИСО 14971 | Устройства медицинские. Применение управления рисками к медицинским устройствам ISO 14971, Medical devices - Application of risk management to medical devices | |
[3] | LEHMAN, A.J. and FITZHUGH, O.G. (1954). 100-Fold margin of safety. Association of Food and Drug Officials. U.S.Q. Bull. 18, pp.33-35 | |
[4] | MUMTAZ, M.M. and HERTZBERG, R.C. (1993). The status of interactions data in risk assessment of chemical mixtures. In J. Saxena, ed. Hazard Assessment of Chemicals, Vol. 8, pp.47-79. Hemisphere, Washington, D.C. | |
[5] | MUMTAZ, M.M., SIPES, I.G., CLEWELL, H.J. and YANG, R.S.H. (1993). Risk assessment of chemical mixtures: Biologic and toxicologic issues (symposium overview). Fund. Appl. Toxicol. 21, pp.258-269 | |
[6] | Pharmaceutical Manufacturers Association (PMA) (1989). Procedures for setting limits for volatile organic solvents with methylene chloride as an example of the process. Committee on Rational Specification for Impurities in Bulk Drug Substances. PMA, Washington, DC. Pharmacopeial Forum 15(6), pp.5748-5759 | |
[7] | Pharmaceutical Manufacturers Association (PMA) (1990). Procedures for setting limits for volatile organic solvents with chloroform, 1,4-dioxane, ethylene oxide and trichloroethylene as examples of the process. Committee on Rational Specification for Impurities in Bulk Drug Substances. PMA, Washington, DC. Pharmacopeial Forum 16(3), pp.541-582 | |
[8] | Pharmaceutical Manufacturers Association (PMA) (1991). Procedures for setting limits for volatile organic solvents with benzene as an example of the process. Committee on Rational Specification for Impurities in Bulk Drug Substances. PMA, Washington, DC. Pharmacopeial Forum 17(1), pp.1441-1458 | |
[9] | United States Pharmacopeial Convention (USP) (2000) Vol. 24, pp.1877-1878. <467> Organic volatile impurities. USP, Rockville, Maryland | |
[10] | BASKETTER, D.A. (1996). Individual ethnic and seasonal variability in irritant susceptibility of skin: The implications for a predictive human patch test. Contact Dermatitis 35, pp.208-213 | |
[11] | CONINE, D., NAUMANN, B. and HECKER, L. (1992). Setting Health-Based Residue Limits For Contaminants in Pharmaceuticals and Medical Devices. Quality Assurance: Good Practice, Regulation, and the Law. 1(3), pp.171-180 | |
[12] | Committee on Carcinogenicity of Chemicals in Food, Consumer Products and the Environment, Guidelines for the evaluation of chemicals for carcinogenicity, Department of Health Report on Health and Social Subjects No. 42, HMSO, London, 1991 | |
[13] | DOURSON, M. and STARA, J. (1983). Regulatory history and experimental support for uncertainty (safety) factors. Reg. Toxicol. Pharmacol. 3 pp.224-238 | |
[14] | CRUMP, K. (1984). A new method for determining allowable daily intakes. Fund. Appl. Toxicol. 4, pp.854-871 | |
[15] | JUDGE, M.R. (1996). Variation in response of human skin to irritant challenge. Contact Dermatitis 34, pp.115-117 | |
[16] | LEWIS, S., LYNCH, J. and NIKIFOROV, A. (1990). A new approach to deriving community exposure guidelines from no-observed-adverse-effect level. Reg. Toxicol. Pharmacol. 11, pp.314-330 | |
[17] | KADRY, A., SKOWRONSKI, G. and ABEL-RAHMAN, M. (1995). Evaluation of the Use of Uncertainty Factors in Deriving RfDs for Some Chlorinated Compounds. J. Toxicol. Environ. Health 45, pp.83-95 | |
[18] | SEED, J., BROWN, R.P. OLIN, R.P. and FORAN, J.A. (1995). Chemical mixtures: Current risk assessment methodologies and future directions. Reg. Toxicol. Pharmacol. 22, pp.76-94 | |
[19] | World Health Organization (WHO) (1994). Environmental Health Criteria 170. Assessing Human Health Risks of Chemicals: Derivation of Guidance Values for Health-Based Exposure Limits. World Health Organization. Geneva, Switzerland | |
Электронный текст документа
и сверен по:
, 2011