ГОСТ Р 52770-2020
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские
СИСТЕМА ОЦЕНКИ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ
Часть 1
Общие требования биологической безопасности
Medical devices. Evaluation system of biological effects. Part 1. General requirements for biological safety
ОКС 11.100.20
Дата введения 2021-03-01
Предисловие
1 РАЗРАБОТАН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий (АНО "ИМБИИТ")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 17 ноября 2020 г. N 1101-ст
4 ВЗАМЕН ГОСТ Р 52770-2016
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Соблюдение положений стандартов серии "Система оценки биологического действия" позволит обеспечить системный подход к оценке биологического действия медицинских изделий (далее - МИ).
Настоящий стандарт является руководством по оценке биологического действия применения МИ и предназначен для применения исследователями (испытателями), разработчиками и изготовителями МИ при проведении токсикологических исследований, экспертизы, контроля качества, эффективности и безопасности МИ, при их регистрации, производстве, подтверждении соответствия и государственном контроле (надзоре).
Целью настоящего стандарта является установление общих требований биологической безопасности МИ с учетом потенциального риска для здоровья и подходов к исследованиям и испытаниям.
Настоящий стандарт является основополагающим. При применении стандартов на конкретные виды продукции следует учитывать требования настоящего стандарта.
Настоящий стандарт не заменяет стандарты серии ГОСТ ISO 10993, но разъясняет и дополняет некоторые положения, не учтенные в данных стандартах, содействует сотрудничеству между лабораториями и другими органами, обмену информацией и опытом, гармонизации стандартов и процедур.
В серию стандартов "Изделия медицинские. Система оценки биологического действия", входят следующие части:
- Часть 1. Общие требования биологической безопасности;
- Часть 2. Применение уровня предельно допустимого токсикологического воздействия для оценки биосовместимости компонентов медицинских изделий;
- Часть 3. Методы исследований (испытаний).
При формировании подхода к исследованиям следует учитывать новизну МИ (при выведении на рынок нового продукта) или опыт применения МИ в клинической практике (при изменении МИ с целью оценки рисков этих изменений).
Содержание в МИ лекарственного средства (ЛС) или другого биологически активного компонента является важным аспектом, который следует учитывать.
Для деградируемых/резорбируемых МИ важно учитывать время и степень деградации/резорбции, а также оценить степень опасности продуктов деградации/резорбции во временном аспекте.
МИ отнесены к социально значимой продукции, поэтому оценка риска их применения основана на критериях, отражающих непосредственное влияние компонентов конечного продукта на здоровье наиболее чувствительных групп населения, что требует обеспечения значительного запаса надежности допустимых показателей.
Ухудшение экологической среды привело к повышенному содержанию тяжелых металлов как в почве, так и в воде, что не могло не отразиться на биологической безопасности материалов природного происхождения, что потребовало введения дополнительных требований.
1 Область применения
Настоящий стандарт распространяется на медицинские изделия (далее - МИ) и материалы, применяемые для их изготовления, при использовании их по назначению в надлежащих условиях, а также на МИ, находящиеся в обращении.
Настоящий стандарт устанавливает общие требования биологической безопасности МИ и материалов, применяемых для их изготовления, контактирующих непосредственно или опосредованно с организмом человека при использовании их по назначению.
Настоящий стандарт является руководством для планирования исследований (испытаний) по показателям биологического действия.
Настоящий стандарт устанавливает общие требования к проведению исследований (испытаний) по определению санитарно-химических/физико-химических показателей, показателей биологического действия и микробиологических показателей с целью подтверждения безопасности МИ при использовании его по назначению в надлежащих условиях.
В настоящем стандарте приведены допустимые количества миграции химических веществ в экстракт некоторых потенциально опасных химических соединений для материалов и МИ.
В настоящем стандарте приведены подходы к исследованиям (испытаниям) материалов/МИ и установлены требования к выбору образца МИ для проведения исследований (испытаний), общие требования к приготовлению экстрактов из исследуемых образцов, к методам (методикам) определения показателей биологического действия, приведены значения допустимых количеств экстрагируемых/выщелачиваемых веществ из материалов/МИ.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 23932 Посуда и оборудование лабораторные стеклянные. Общие технические условия
ГОСТ 31209 Контейнеры для крови и ее компонентов. Требования химической и биологической безопасности и методы испытаний
ГОСТ 31214 Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогенность
ГОСТ 31576 Оценка биологического действия медицинских стоматологических материалов и изделий. Классификация и приготовление проб
ГОСТ 31814 Оценка соответствия. Общие правила отбора образцов для испытаний продукции при подтверждении соответствия
ГОСТ EN 556-1 Стерилизация медицинских изделий. Требования к медицинским изделиям категории "стерильные". Часть 1. Требования к медицинским изделиям, подлежащим финишной стерилизации
ГОСТ ISO 10993-1 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ГОСТ ISO 10993-4 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4. Исследования изделий, взаимодействующих с кровью
ГОСТ ISO 10993-5 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro
ГОСТ ISO 10993-6 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации
ГОСТ ISO 10993-7 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации
ГОСТ ISO 10993-9 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деструкции
ГОСТ ISO 10993-10 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследование раздражающего и сенсибилизирующего действия
ГОСТ ISO 10993-11 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследование общетоксического действия
ГОСТ ISO 10993-12 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы
ГОСТ ISO 10993-13 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественное определение продуктов деградации полимерных медицинских изделий
ГОСТ ISO 10993-14 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 14. Идентификация и количественное определение продуктов деградации изделий из керамики
ГОСТ ISO 10993-15 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 15. Идентификация и количественное определение продуктов деградации из металлов и сплавов
ГОСТ ISO 10993-16 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 16. Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ
ГОСТ ISO 10993-17 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ
ГОСТ ISO 10993-18 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов
ГОСТ ISO/TS 10993-19 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 19. Исследования физико-химических, морфологических и топографических свойств материалов
ГОСТ ISO/TS 10993-20 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 20. Принципы и методы исследования иммунотоксичности медицинских изделий
ГОСТ ISO/TR 10993-22 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 22. Руководство по наноматериалам
ГОСТ ISO 14971 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
ГОСТ ISO/IEC 17000 Оценка соответствия. Словарь и общие принципы
ГОСТ ISO/IEC 17025 Общие требования к компетентности испытательных и калибровочных лабораторий
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ ISO/IEC 17000, ГОСТ ISO 14971 (см. также [1]*), а также следующие термины с соответствующими определениями:
________________
* Поз. [1]-[14] см. раздел Библиография, здесь и далее по тексту. - .
3.1 безопасность МИ: Состояние, при котором отсутствует недопустимый риск причинения вреда жизни или здоровью граждан при использовании МИ в условиях, предусмотренных изготовителем.
Примечание - Безопасность МИ должна обеспечиваться сохранением его эксплуатационных свойств в течение установленного изготовителем срока службы или срока годности.
3.2 биологическая безопасность МИ: Состояние МИ/материала при использовании по назначению в надлежащих условиях, при котором МИ/материал не оказывает вредного воздействия на организм человека по санитарно-химическим/физико-химическим показателям, показателям биологического действия, микробиологическим показателям.
3.3 оценка биологического действия МИ: Анализ и оценка существующих данных биологической безопасности применения МИ, а также исследования/испытания, проводимые в целях определения соответствия МИ общим требованиям безопасности.
3.4 исследуемый материал: Материал, изделие, часть изделия или его компонент или его типичный образец, изготовленный и обработанный эквивалентными методами, пробу или экстракт которых отбирают для биологического или химического исследования или оценки.
3.5 интегральные показатели: Обобщенные показатели качества материала/МИ (восстановительные примеси, ультрафиолетовое поглощение, изменение величины рН).
3.6 пирогенность: Способность химического агента или другого вещества вызывать лихорадочное состояние организма.
3.7 допустимое количество миграции химических веществ; ДКМ: Допустимое количество миграции химических веществ в экстракт.
3.8 санитарно-химические/физико-химические испытания: Испытания, проводимые с целью определения интегральных показателей, количественного определения компонентов, мигрирующих в экстракт из МИ, и материалов, применяемых для их изготовления, а также индивидуальных потенциально опасных соединений (составляющих веществ, технологических добавок, стерилизующих агентов, примесей и т.п.).
3.9 скрининговые исследования (испытания): Исследования (испытания), проводимые с целью предварительной характеристики возможных источников и уровней рисков.
3.10 экстракт: Раствор, полученный в результате экстракции исследуемого материала или контрольного материала.
3.11 экстрагирующая жидкость: Модельная среда, применяемая для приготовления экстракта.
3.12 компонент: Химическое вещество или соединение, присутствующее в готовом МИ или материалах изготовления.
Примечания
1 Компоненты могут присутствовать преднамеренно (например, добавка, такая как антиоксидант) или непреднамеренно (например, примесь).
2 При применении уровня предельно допустимого токсикологического воздействия к экстрагируемому или выщелачиваемому веществу сущность экстрагируемого/выщелачиваемого вещества представляет собой компонент, который может оказывать потенциальное воздействие на человека при использовании медицинского изделия.
3.13 экстрагируемое вещество: Компонент, высвобождаемый при экстрагировании или из материала изготовления при использовании условий лабораторной экстракции и модельный* среды.
_______________
* Текст документа соответствует оригиналу. - .
Примечание - При применении уровня предельно допустимого токсикологического воздействия к экстрагируемому веществу предполагается, что экстрагированное количество потенциально контактирует с пользователями МИ во время клинического применения, см. ГОСТ ISO 10993-17.
3.14 выщелачиваемое вещество: Компонент, высвобождаемый из МИ и потенциально контактирующий с организмом при клиническом применении.
Примечание - При применении уровня предельно допустимого токсикологического воздействия к выщелачиваемому веществу предполагается, что выщелоченное количество потенциально контактирует с пользователями МИ во время его клинического применения, см. стандарты серии ГОСТ ISO 10993.
3.15 уровень предельно допустимого токсикологического воздействия/порог токсикологической опасности: Уровень воздействия для компонентов, ниже которого не существует значимого риска для здоровья человека.
4 Общие требования
4.1 Оценка биологического действия МИ включает в себя проведение комплекса исследований (испытаний) с целью качественного и количественного определения биологической безопасности, в т.ч. санитарно-химических/физико-химических показателей (интегральных и специфических) и микробиологических показателей в рамках менеджмента риска.
4.2 Для проведения исследований (испытаний) представляют образцы МИ, контактирующие непосредственно или опосредованно с организмом человека при использовании его в соответствии с назначением (образцы готового изделия, единообразные по характеру и качеству, изготовленные в определенном цикле производства, прошедшие все производственные этапы, установленные изготовителем).
4.3 При выборе материалов, применяемых для изготовления МИ, необходимо оценивать их биологическую безопасность. Для проведения исследований (испытаний) могут быть представлены как опытные образцы МИ, так и материалы, из которых они изготовлены.
Выбор и оценка любого материала для МИ, предназначенного для применения в медицинской практике, требуют системного подхода к оценке преимуществ/недостатков физических и химических характеристик в рамках анализа и оценки риска (см. ГОСТ ISO 14971).
4.4 МИ должны соответствовать требованиям биологической безопасности по санитарно-химическим/физико-химическим показателям.
4.5 МИ должны соответствовать требованиям биологической безопасности по показателям биологического действия, см. стандарты серии ГОСТ ISO 10993, [2].
4.6 МИ, поставляемые в стерильном состоянии, должны сохранять стерильность до вскрытия защитной упаковки в течение срока годности.
4.7 Программу исследования составляют с учетом назначения МИ, вида и продолжительности контакта с организмом человека, свойств материалов, из которых оно изготовлено, современных методов исследования (испытания), а также информации из литературных источников о применяемых материалах, их рецептурном составе, способах предстерилизационной очистки, дезинфекции и стерилизации.
4.8 Программа исследований (испытаний) МИ должна учитывать требования стандартов и нормативных документов (далее - НД) изготовителя.
4.9 Во избежание недостаточных или избыточных требований внешних экспертов, программу исследований (испытаний) составляют и документально оформляют компетентные специалисты (в соответствии с требованиями ГОСТ ISO/IEC 17025), имеющие необходимый опыт работы в области оценки биологического действия МИ.
4.10 Для МИ, в состав которых входит вещество, представляющее собой лекарственный препарат или другое биологически активное средство и воздействующее на человеческий организм в дополнение к воздействию МИ, оценку биологического действия МИ проводят с учетом действия (свойств) данного вещества.
4.11 Исследование (испытание) МИ, содержащего активные источники излучения, проводят на неактивных ("холодных") исследуемых образцах.
4.12 При оценке биологического действия МИ, содержащего биологические ткани и их компоненты, учитывают требования соответствующих НД.
4.13 МИ, содержащие ткани животного происхождения, оценивают с учетом требований соответствующих стандартов (см. также [3]).
4.14 МИ, содержащие ткани человеческого происхождения, оценивают с учетом требований соответствующих стандартов (см. также [4]).
4.15 МИ, контактирующие с системой кровообращения, кровью и ее компонентами, препаратами для внутрисосудистого введения, подвергают испытаниям на гемосовместимость по ГОСТ ISO 10993-4.
4.16 МИ, контактирующие с системой кровообращения, кровью и ее компонентами, препаратами для внутрисосудистого введения, испытывают на пирогенность.
4.17 МИ из материалов природного происхождения испытывают на наличие свободного белка.
4.18 Скрининговые исследования (испытания) проводят с целью предварительного установления показателей (характеристик) биологической безопасности при контрольных испытаниях.
4.19 При контрольных испытаниях МИ, находящихся в обращении (изъятых из обращения), за исключением случаев, повлекших угрозу нанесения вреда здоровью и жизни человека, допустимо применение реперных точек оценки их биологического действия, руководствуясь составом материала и назначением МИ, установленным изготовителем. Реперными точками в санитарно-химических/физико-химических испытаниях являются интегральные показатели в экстрактах из материала/МИ: восстановительные примеси, ультрафиолетовое поглощение, изменение значения рН (если в НД на изделие не предусмотрено иное); содержание формальдегида, мономера исходного полимерного материала. Определение остаточных количеств растворителей, стерилизующих агентов, тяжелых металлов проводят с учетом анализа риска. При необходимости рекомендуется руководствоваться соответствующими стандартами (см. стандарты серии ГОСТ ISO 10993, [2], [5]).
4.20 Повторные исследования (испытания) по показателям биологического действия проводят при изменении:
- источника поступления или любой характеристики материалов, применяемых при изготовлении МИ;
- упаковки (барьерная система для стерилизации);
- способа или условия проведения стерилизации МИ;
- назначения МИ, предусмотренного инструкций изготовителя.
5 Общие требования биологической безопасности по санитарно-химическим/физико-химическим показателям
5.1 Общие положения
Санитарно-химические/физико-химические испытания проводят в целях качественного и количественного определения мигрирующих в экстракт компонентов композиции, остаточных количеств химических соединений, используемых в технологическом процессе синтеза некоторых композиций и изготовления МИ остаточных количеств стерилизующих агентов исследуемого (испытуемого) МИ.
Санитарно-химические/физико-химические испытания являются обязательными для всех групп МИ и предваряют исследования (испытания) на биологических тест-объектах. Испытаниям подлежат как экстракты из материалов/МИ, так и МИ жидких, в том числе в форме геля. Условия приготовления экстрактов (виды экстрагирующей жидкости (среды)), температура и продолжительность экстракции, соотношение поверхности или массы исследуемого материала к объему экстрагирующей жидкости (среды) выбирают в зависимости от категории МИ (см. приложения А, Б, В).
В ходе санитарно-химических/физико-химических испытаний с помощью интегральных и специфических (селективных) методов анализа экстрактов из исследуемого материала оценивают химическую стабильность материала и характеристику мигрирующих в экстракт веществ, что дает представление о природе высвобождающихся из изделий химических соединений и их потенциальной опасности. С этой целью используют такие высокочувствительные, эффективные и селективные методы анализа, как спектрофотометрия, высокоэффективная жидкостная хроматография, газовая и жидкостная хроматографии, масс-спектрометрия, атомно-абсорбционная спектрометрия и др. (см. ГОСТ ISO 10993-9).
Результаты санитарно-химических/физико-химических испытаний могут служить основанием для прекращения дальнейших исследований (испытаний) материала/МИ в случае обнаружения миграции веществ с известной токсикологической характеристикой в количествах, превышающих допустимые значения (см. приложение Г), осуществления коррекции в подборе материалов и оптимизации технологического процесса изготовления МИ, включая способ и режим стерилизации, что позволит создать продукт, отвечающий требованиям биологической безопасности. Остановить испытания или продолжить решает компетентный специалист, руководствуясь оценкой полученных результатов и анализом риска, который должен быть обоснован и подкреплен научными данными.
Если для материалов/МИ с биологически активными добавками (ЛС, антисептики, аппретирующие вещества и др.) интегральные показатели: восстановительные примеси, ультрафиолетовое поглощение, изменение значения рН, превышают допустимые (см. приложение Д, таблица Д.1), то решение об их соответствии требованиям биологической безопасности принимают по результатам исследований (испытаний) на биологических тест-объектах.
Наименование и допустимые значения некоторых санитарно-химических/физико-химических показателей с учетом природы и назначения материалов/МИ, вида и степени опасности приведены в приложениях Г, Д.
5.2 Общие требования к выбору образца для исследования (испытания)
Правила отбора образцов приведены в ГОСТ 31214, ГОСТ 31814 и других НД на конкретный вид МИ или метод испытаний.
5.3 Общие требования к приготовлению экстрактов из исследуемых материалов
Основные требования к приготовлению экстрактов установлены в ГОСТ ISO 10993-12.
При приготовлении экстрактов следует учитывать требования, установленные в стандартах на конкретные МИ. Следует выбирать более "жесткие" условия экстракции.
В процедуре пробоподготовки должны быть учтены все процедуры обращения с образцом, предусмотренные инструкцией по применению МИ. Выбор экстрагирующей жидкости следует проводить с учетом методики испытаний. Как правило, санитарно-химические/физико-химические испытания МИ, изготовленных из полимерных материалов, экстракцию проводят на дистиллированной воде. Экстрагирующая жидкость для МИ из металлов и керамики - 0,9%-ный раствор хлорида натрия, если в НД изготовителя не установлены другие требования (см. приложение А).
Примечание - Водные экстракты готовят с использованием дистиллированной воды или воды для лабораторного анализа (см. [6]).
Принципы экстракции исследуемого материала приведены в ГОСТ ISO 10993-12.
Жидкие формы (растворы) МИ испытывают "в чистом виде".
Если значение рН экстракта из испытуемого материала или самой жидкой формы менее либо равно 2,0, либо равно или более 11,5, то материал признают потенциальным раздражителем и дальнейшие исследования его не проводят (см. ГОСТ ISO 10993-10).
Посуда и оборудование лабораторное стеклянное должны соответствовать требованиям ГОСТ 23932.
При выборе материалов для имплантатов, разработке новых МИ, отсутствии информации о характеристиках в отношении безопасности экстракты готовят в соотношении между массой испытуемого материала и объемом модельной среды по формуле
![]() , (1)
, (1)
где М - максимально возможное количество имплантируемого материала (в граммах);
V - объем крови в организме человека (5 л);
K - коэффициент аггравации, равный 10.
Сроки экспозиции экстрактов определяются природой материала/МИ, продолжительностью контакта с организмом человека, применяемостью методик. При применении динамического режима приготовления экстракта необходимо регламентировать сроки обновления модельной среды и проводить анализ полученных экстрактов на каждом этапе. При контрольных исследованиях режимы экстракции могут быть изменены в сторону уменьшения времени и увеличения температуры, если данные изменения обоснованы.
5.4 Общие требования к методам (методикам) определения санитарно-химических/ физико-химических показателей
Средства измерений и оборудование, применяемое для исследований (испытаний), должны быть откалиброваны и/или аттестованы и/или поверены в установленном порядке с учетом требований НД на методы исследований (испытаний).
Методики выполнения измерений, применяемые при исследованиях (испытаниях), должны быть аттестованы или стандартизованы в соответствии с установленными требованиями.
Для надлежащего осуществления лабораторной деятельности испытательная лаборатория должна иметь эталоны, стандартные образцы согласно ГОСТ ISO 10993-12 (см. также [7]-[9]).
6 Общие требования биологической безопасности по показателям биологического действия
6.1 Общие положения
Оценка биологического действия МИ - это исследования, проводимые для выявления биологического действия материала/МИ in vitro и in vivo с целью дальнейшей экстраполяции полученных результатов на человека.
Основные подходы к исследованиям биологического действия приведены в соответствующих стандартах серии ГОСТ ISO 10993, [2].
6.2 Общие требования к выбору образца для исследования (испытания)
Общие требования к выбору образцов для исследований (испытаний) установлены в ГОСТ ISO 10993-12.
Число образцов, предоставляемых на исследования (испытания), должно быть таким, чтобы можно было провести статистическую обработку результатов и провести повторные исследования для исключения возможной ошибки или проверки атипичных результатов.
Исследуемые материалы и контрольные образцы следует обрабатывать в условиях, исключающих контаминацию.
Изучению подлежит такое количество материала, которое рассчитано по формуле
![]() , (2)
, (2)
где М - максимальное количество материала (в граммах), имплантируемое человеку;
Р - масса тела человека (70 кг);
K - коэффициент аггравации, равный 20.
Образцы для исследований (испытаний) имплантируемых МИ отбирают в соответствии с ГОСТ ISO 10993-6.
6.3 Общие требования к приготовлению экстрактов из исследуемых материалов
Общие требования к приготовлению экстрактов, используемых для оценки биологического действия материалов/МИ, установлены в ГОСТ ISO 10993-12. Условия приготовления экстрактов для конкретных групп материалов/МИ приведены в приложении А.
Примечание - Экстракты для исследования на лабораторных животных, в том числе и для испытания на пирогенность, готовят на 0,9%-ном стерильном апирогенном растворе хлорида натрия.
6.4 Общие требования к методам (методикам) оценки биологического действия
Методики исследования биологического действия изложены в соответствующих стандартах серии ГОСТ ISO 10993.
Специалист, планирующий исследования и составляющий их программу по испытаниям, вправе выбрать альтернативный метод испытаний, соответствующий применению МИ при условии его валидации.
6.5 Испытания на пирогенность, вызванную материалом
Испытание на пирогенность, вызванную материалом/МИ, на кроликах основано на измерении температуры тела до и после внутривенной инъекции растворов, полученных в результате экстракции исследуемого материала и контрольного материала.
Испытание на пирогенность следует проводить для материалов/МИ, контактирующих с системой кровообращения в одной точке и служащих для входа в кровеносную систему (см. ГОСТ ISO 10993-1, ГОСТ ISO 10993-11), контактирующих с циркулирующей кровью (см. ГОСТ ISO 10993-1, ГОСТ ISO 10993-11), контактирующих с кровью, ее компонентами, кровозаменяющими растворами (см. ГОСТ ISO 10993-11, ГОСТ 31209).
Примечание - Экстракты для испытания на пирогенность готовят на 0,9%-ном стерильном апирогенном растворе хлорида натрия с использованием апирогенной посуды, в асептических условиях.
7 Общие требования биологической безопасности по микробиологическим показателям
7.1 Общие положения
Целью микробиологических исследований является обнаружение микроорганизмов, их идентификация и изучение свойств (при необходимости) (см. [10]).
7.2 Испытания на стерильность
Одним из критериев биологической безопасности МИ является их стерильность.
Требования к МИ, прошедшим финишную стерилизацию, которые будут отнесены к категории "СТЕРИЛЬНЫЕ", установлены в ГОСТ EN 556-1.
Стерильность МИ подтверждают:
а) предварительной валидацией процесса стерилизации и последующими валидациями, показывающими, что данный процесс приемлем (см. [11]-[13]);
б) информацией, собранной во время текущего контроля стерильности и мониторинга процесса, показывающей, что валидированный процесс эффективно применен.
Требования к разработке, валидации и текущему контролю процесса стерилизации МИ изложены в соответствующих стандартах.
7.3 Микробиологическая чистота
Испытаниям на микробиологическую чистоту подвергают нестерилизуемые МИ с определяемыми микробиологическими характеристиками, например: МИ в форме исполнения крем или гель, руководствуясь НД изготовителя.
7.4 Антимикробные свойства
Антимикробные свойства МИ исследуют, оценивая антибактериальную способность (активность) на стандартных штаммах микроорганизмов.
Данные исследования проводят, руководствуясь соответствующими стандартами или НД на конкретный материал/МИ.
Методы (методики) исследования антимикробных свойств приведены в соответствующих стандартах.
7.5 Испытания на пирогенность, вызванную эндотоксинами
Описание теста лизата амебоцитов мечехвоста (ЛАЛ-тест) для определения эндотоксина in vitro в образцах материалов/МИ при использовании клеточных биологических систем см. в [14]. Испытание на бактериальные эндотоксины основано на специфической реакции реактива, представляющего собой лизат клеток крови (амебоцитов) мечехвоста с бактериальными эндотоксинами. В результате ферментативной реакции происходит изменение реакционной смеси, пропорциональное концентрации эндотоксина.
Следует учитывать, что использование ЛАЛ-реактива имеет ограничение и применимо не для всех МИ (например, биополимерные гели).
Другим методом in vitro является исследование активации моноцитов, количественный метод, который использует естественный человеческий механизм повышения температуры и может быть применен для теста на эндотоксины, связанные с материалами/МИ, а также на другие биологические пирогены (например, дрожжевые, паразитические и вирусные пирогены) (см. ГОСТ ISO 10993-11).
Так как результаты исследований могут значительно отличаться в зависимости от применяемого метода, то изготовитель МИ должен в документации на изделие привести валидированную методику определения концентрации бактериального эндотоксина.
8 Представление отчетов о результатах
Результаты исследований (испытаний) должны быть представлены точно, четко, недвусмысленно и объективно (см. ГОСТ ISO/IEC 17025).
Выводы, содержащиеся в протоколах, должны быть однозначными и понятными.
Протоколы с результатами исследований (испытаний) МИ могут сопровождаться экспертными заключениями, отчетами, пояснительными записками в зависимости от требований организации, в которую предоставляются результаты.
Приложение А
(рекомендуемое)
Условия приготовления экстрактов для определения санитарно-химических/физико-химических показателей
Таблица А.1 - Условия приготовления экстрактов для групп изделий из полимеров (экстрагирующая жидкость - вода дистиллированная)
Категория изделия | Соотно- | Соотно- | Соотно- | Темпе- | Продол- | Приме- |
Изделия поверхностного контакта | ||||||
Средства перевязочные, контактирующие с неповрежденной кожей: | 1/1 | - | - | 37±1 | 24±2 | - |
- вата медицинская гигроскопическая | - | 1/500 | - | 37±1 | 24±2 | - |
- гипсовые бинты | 1/1 | - | - | 37±1 | 24±2 | - |
Средства перевязочные, контактирующие с поврежденными кожей и слизистыми оболочками: | 1,6/1 | - | - | 37±1 | 24±2 | - |
- клеи, сорбенты, гемостатические порошки | - | М/250 | - | 37±1 | 24±2 | М - максимальная разовая доза |
- средства перевязочные пластырного типа | 1,6/1 | - | - | 37±1 | 24±2 | - |
Гели для УЗИ | - | 5/100 | - | 37±1 | 2,0±0,1 | - |
Линзы очковые для коррекции зрения | 1/1 | - | - | 37±1 | 24±2 | - |
Оправы очковые | - | - | 3/500 | 37±1 | 24±2 | - |
Протезы глазные | - | - | 1/50 | 37±1 | 24±2 | - |
Одежда и белье для пациентов, персонала | 1/1 | - | - | 37±1 | 8±1 | - |
Хирургическая одежда и белье, применяемые как МИ для пациентов, хирургического персонала | 1/1 | - | - | 37±1 | 24±2 | - |
Изделия рентгенозащитные (фартуки, нагрудники, перчатки, бахилы) | 1/10 | - | - | 37±1 | 2,0±0,1 | - |
Медицинские гигиенические прокладки, подгузники, пеленки | 1/1 | - | - | 37±1 | 24±2 | После полного водопогло- |
Презервативы | - | - | 1/50 | 37±1 | 8±1 | - |
Перчатки медицинские | 1/1 | - | - | 37±1 | 8±1 | - |
Перчатки медицинские из латекса натурального каучука | 1/1 | - | - | 37±1 | 2,0±0,1 | - |
Спринцовки, кружки Эсмарха, клизменные наконечники | - | - | 1/V | 37±1 | 2,0±0,1 | Заполняют номинальным объемом |
Молокоотсосы | - | - | 1/V | 37±1 | 24±2 | Заполняют номинальным объемом |
Моче- и калоприемники, подкладные судна, грелки, пузыри для льда | 1/5 | - | - | 37±1 | 2,0±0,1 | - |
Экзопротезы грудной железы, изделия протезно-ортопедические и полуфабрикаты к ним | 1/2 | - | - | 37±1 | 24±2 | - |
Внутриматочные контрацептивы, кольца | - | - | 1/50 | 37± 1 | 72±2 | - |
Линзы контактные | 1/1 | - | - | 37±1 | 24±2 | - |
Гинекологические инструменты: | ||||||
- зеркало по Куско | - | - | 1/500 | 37±1 | 2,0±0,1 | - |
- шпатель, ложка Фолькмана, цервикальная щетка | - | - | 1/100 | 37±1 | 2,0±0,1 | - |
Датчики, электроды и др. устройства, контактирующие с кожей | - | - | 1/250 | 37±1 | 2,0±0,1 | - |
Камеры неонатальных инкубаторов | 1/1 | - | - | 37±1 | 24±2 | - |
Ингаляторы | - | - | 1/V | 37±1 | 24±2 | Заполняют номинальным объемом |
Слуховые аппараты | - | - | 1/50 | 37±1 | 24±2 | - |
Криопакеты | - | - | 1/250 | 37±1 | 2,0±0,1 | - |
Микросферы для противоожоговых кроватей | - | 0,1/1 | - | 37±1 | 72±2 | - |
Изделия, присоединяемые извне | ||||||
Устройства комплектные эксфузионные, инфузионные и трансфузионные | - | - | 3/250 | 37±1 | 2,0±0,1 | По приложению Б |
Аппараты и устройства для замещения функций органов и систем организма: | ||||||
- аппараты искусственного кровообращения, искусственной почки, для гемосорбции в комплекте с магистралями или без них и их функциональные элементы | - | - | 1/500 | 37±1 | 2,0±0,1 | По приложению Б |
Катетеры внутрисосудистые, трубки медицинские для переливания крови, препаратов из крови, кровезаменителей и инфузионных растворов | - | - | 1/250 | 37±1 | 24±2 | - |
Шприцы инъекционные однократного применения | - | - | 1/V | 37±1 | 24±2 | Заполняют через иглу номинальным объемом |
Контейнеры для крови, препаратов из крови, кровезаменителей и инфузионных растворов: | ||||||
- 500 мл | - | - | 1/100 | 70±2 | 24±2 | По ГОСТ 31209 |
- 300 мл | - | - | 1/50 | 70±2 | 24±2 | По ГОСТ 31209 |
Катетеры, зонды, дренажи, бужи различных типов | - | - | 1/250 | 37±1 | 24±2 | - |
Имплантируемые изделия | ||||||
Клапаны сердца, перикарда, опорные кольца, кардио- и нервно-мышечные стимуляторы; протезы кровеносных сосудов, грудной железы, гортани, яичка, фаллопротезы; имплантаты для челюстно-лицевой хирургии, протезы мягких тканей, имплантируемые датчики и устройства для постоянного дозируемого введения лекарственных веществ | - | - | 1/500 | 37±1 | 72±2 | - |
Костные цементы, имплантируемые гели | - | М/500 | - | 37±1 | 72±2 | М - максимальная разовая доза |
Нити хирургические | - | - | - | 37±1 | 24±2 | Отношение длины нити (см) к объему дистиллирован- |
Имплантаты для офтальмохирургии | - | 1/1 | - | 37±1 | 72±2 | М - максимальная разовая доза |
Интраокулярные линзы | - | - | 1,0/0,3 | 37±1 | 72±2 | - |
Изделия офтальмологические вискохирургические | - | 1/1 | - | 37± 1 | 8±1 | М - максимальная разовая доза |
Упаковка | ||||||
Пробки для укупоривания сосудов с кровью, препаратов из крови, кровезаменителей и инфузионных растворов | 1/2 | - | - | 121±1 | 1,0±0,1 | Автоклавирова- |
Емкости для хранения ЛС | 1/V | - | - | 37±1 | 24±2 | Заполняют номинальным объемом |
Материалы для упаковки ЛС | 1/1 | - | - | 37±1 | 24±2 | - |
Материалы для упаковки МИ | 1/10 | - | - | 37±1 | 24±2 | - |
Медицинские стоматологические изделия и материалы | ||||||
Медицинские стоматологические изделия и материалы | - | - | - | - | - | По ГОСТ 31576 |
Таблица А.2 - Условия приготовления экстрактов для групп изделий из металлов, сплавов, керамики и стекла
Категория изделия | Экстрагирующая жидкость (среда) | Соотно- | Соотно- | Соотно- | Темпе- | Продол- | Приме- |
Изделия поверхностного контакта | |||||||
Оправы очковые | Вода дистиллированная | - | - | 3/500 | 37±1 | 24±2 | - |
Линзы очковые | Вода дистиллированная | - | - | 3/500 | 37±1 | 24±2 | - |
Пипетки глазные | Вода дистиллированная | - | - | 1/V | 37±1 | 2,0±0,1 | Заполняют номиналь- |
Датчики, электроды, контактирующие с кожей, слизистыми | 0,9%-ный раствор хлорида натрия | - | - | 1/150 | 37±1 | 2,0±0,1 | - |
Изделия, присоединяемые извне | |||||||
Шприцы медицинские инъекционные многократного применения | Вода дистиллированная | - | - | 1/V | 37±1 | 24±2 | Заполняют номиналь- |
Иглы инъекционные, скарификаторы | 0,9%-ный раствор хлорида натрия | - | - | 1/5 | 37±1 | 2,0±0,1 | - |
Автономные желудочно- | 0,9%-ный раствор хлорида натрия | - | - | 1/100 | 37±1 | 24±2 | - |
Иглы атравматические без нитей | 0,9%-ный раствор хлорида натрия | - | - | 1/5 | 37±1 | 2,0±0,1 | - |
Хирургические, гинекологические и др. инструменты: | |||||||
- многократного применения | 0,9%-ный раствор хлорида натрия | - | - | 1/150 | 37±1 | 24±2 | - |
- однократного применения | 0,9%-ный раствор хлорида натрия | - | - | 1/150 | 37±1 | 2,0±0,1 | - |
Кардиостимулято- | 0,9%-ный раствор хлорида натрия | - | - | 1/500 | 37±1 | 336±2 | - |
Имплантируемые изделия | |||||||
Нейрохирурги- | 0,9%-ный раствор хлорида натрия | - | - | 1/50 | 37±1 | 336±2 | - |
Материалы хирургические шовные (нити металлические) | 0,9%-ный раствор хлорида натрия | - | - | - | 37±1 | 336±2 | Отношение длины нити (см) к объему экстрагиру- |
Автономные желудочно- | 0,9%-ный раствор хлорида натрия | - | - | 1/100 | 37±1 | 24±2 | - |
Упаковка | |||||||
Тара для ЛС, контактирующих с внутренними средами организма, а также ЛС наружного применения | Вода дистиллированная | - | - | 1/V | 37±1 | 72±2 | Заполняют номиналь- |
Медицинские стоматологические изделия и материалы | |||||||
Медицинские стоматологи- | - | - | - | - | - | - | По ГОСТ 31576 |
Примечания | |||||||
Приложение Б
(обязательное)
Методика приготовления экстракта с использованием стенда
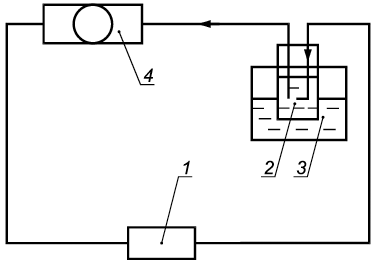
Б.1 Назначение стенда
Стенд предназначен для приготовления экстракта, применяемого при санитарно-химических/физико-химических испытаниях и оценке биологического действия МИ: устройств комплектных эксфузионных, инфузионных и трансфузионных, аппаратов и устройств для замещения функций органов и систем организма (аппаратов искусственного кровообращения, искусственной почки, аппаратов для гемосорбции в комплекте с магистралями или без них и их функциональных элементов, а также магистралей к перечисленным аппаратам).
Б.2 Описание стенда
Функциональная схема стенда должна соответствовать схеме, приведенной на рисунке Б.1.
|
1 - испытуемое МИ (при испытании эксфузионных, инфузионных и трансфузионных устройств последовательно соединяют три МИ); 2 - стеклянная емкость, заполненная 500 мл дистиллированной воды для всех видов МИ (для эксфузионных, инфузионных и трансфузионных устройств - 250 мл, для оксигенаторов - 1000 мл); 3 - термостат, поддерживающий температуру дистиллированной воды в испытательном контуре (37±1)°С; 4 - перистальтический насос, подключенный к испытательному контуру через инертную силиконовую трубку минимально возможной длины и обеспечивающий циркуляцию дистиллированной воды в контуре со скоростью потока 1 л/ч для эксфузионных, инфузионных и трансфузионных устройств, для остальных МИ скорость потока указана в инструкции по применению
Рисунок Б.1 - Функциональная схема стенда для приготовления экстракта
Б.3 Приготовление экстракта
Через замкнутый контур в режиме рециркуляции в течение 2 ч с указанной скоростью потока пропускают соответствующий объем дистиллированной воды при температуре (37±1)°С. Через 2 ч, не нарушая герметичности контура, извлекают колбу из термостата, охлаждают до комнатной температуры. В первую очередь непосредственно из контура проводят отбор проб для определения этиленоксида, циклогексанона и тетрагидрофурана методами хроматографии путем прокола иглой шприца полимерной трубки устройства. Остальную часть вытяжки сливают в стеклянную емкость со шлифом.
В качестве контрольного раствора используют соответствующий объем дистиллированной воды, пропущенной через замкнутый контур в тех же условиях, но без присоединения испытуемых МИ.
Приложение В
(рекомендуемое)
Показатели (характеристики), определяемые в экстрактах из исследуемых материалов в зависимости от их природы
Таблица В.1
Наименование исследуемых материалов в зависимости от их природы | Наименование показателя (характеристики) |
1 Материалы полимерные синтетические, в зависимости от состава | |
Материалы полимерные синтетические, общие показатели | Восстановительные примеси |
Полиэтилен, полипропилен и другие материалы на основе полиолефинов | Ацетальдегид |
Полистирол и сополимеры на основе стирола | Стирол |
Поливинилхлорид | Ацетальдегид |
Полиорганосилоксаны (силиконы) | Ацетальдегид |
Полиакрилаты | Акрилонитрил |
Полиамиды: | |
- капрон (полиамид 6, поликапроамид); | е-капролактам |
- нейлон (полиамид 66, полигексаметиленадипамид); | Гексаметилендиамин |
Акриламид | |
Полиуретан | Ацетальдегид |
Полиэфиры: | Ацетальдегид |
- поликарбонат; | Фенол |
- полисульфон | Дифенилолпропан |
- эпоксидные смолы | Дифенилолпропан |
Фторопласт (фторопласт-3, фторопласт-4, тефлон) | Формальдегид |
2 Резины и латексы синтетические, в зависимости от состава | |
Восстановительные примеси | |
Ацетальдегид | |
3 Материалы природного происхождения, в зависимости от состава | |
Биологические ткани и их производные человеческого происхождения в нежизнеспособном состоянии, в зависимости от способа обработки, состава. | Восстановительные примеси |
- ртуть (Hg), | |
Агидол-2 (2,2-метилен-бис (4-метил-6-трет-бутил-фенол) | |
4 Металлы и сплавы, в зависимости от состава | |
Изменение значения pH | |
5 Стекло и керамика, в зависимости от состава | |
Изменение значения рН | |
6 Агенты, стерилизующие и консервирующие, пластификаторы, рентгеноконтрастные вещества | |
Барий (Ва) | |
7 Растворители для склеивания деталей и узлов изделий | |
Ацетон | |
________________ | |
Приложение Г
(обязательное)
Допустимое количество экстрагируемых/выщелачиваемых веществ в экстрактах из исследуемых материалов с учетом анализа биологических рисков
Таблица Г.1
Определяемый показатель | Массовая концентрация ДКМ, мг/дм |
Тяжелые металлы: | |
- ванадий (V) | 0,10 |
- висмут (Bi) | 0,10 |
- железо (Fe) | 0,30 |
- кадмий (Cd) | 0,001 |
- кобальт (Co) | 0,10 |
- марганец (Mn) | 0,10 |
- медь (Cu) | 0,10 |
- мышьяк (As) | 0,05 |
- никель (Ni) | 0,10 |
- олово (Sn) | 1,0 |
- ртуть (Hg) | 0,005 |
- свинец (Pb) | 0,030 |
- хром (Cr) | 0,10 |
Органические вещества | - |
Ацетон | 0,10 |
Глутаровый альдегид | 0,05 |
Диоктилфталат (ДОФ) | 0,05 |
Бутан-2-он (метилэтилкетон) | 1,0 |
Тетрагидрофуран | 20,0 |
Формальдегид | 0,10 |
Циклогексанон | 2,50 |
Этиленоксид | - |
| |
Приложение Д
(рекомендуемое)
Санитарно-химические/физико-химические показатели
Таблица Д.1 - Интегральные показатели
Определяемый показатель | Допустимое значение, не более |
Восстановительные примеси, мл 0,02 Н раствора | 1,0 |
Изменение значения рН, ед. рН | ±1,0 |
Ультрафиолетовое поглощение, ед. О.П. в диапазоне длин волн, нм: | |
- от 220 до 360 включ. | 0,30 |
- от 230 до 360 включ. | 0,20 |
- от 250 до 320 включ. | 0,10 |
| |
Таблица Д.2 - Допустимое количество миграции химических веществ (ДКМ)
Определяемый показатель | Массовая концентрация ДКМ, мг/дм |
Алюминий (Al) | 0,50 |
Барий (Ba) | 0,10 |
Бор (B) | 0,50 |
Вольфрам (W) | 0,050 |
Молибден (Mo) | 0,25 |
Олово (Sn) | 2,0 |
Серебро (Ag) | 0,050 |
Титан (Ti) | 0,10 |
Цинк (Zn) | 0,01 |
Агидол-2 (2,2-метилен-бис (4-метил-6-трет-бутил-фенол) | 2,0 |
Акрилонитрил | 0,050 |
Альтакс (2,2-дибензтиазолдисульфид) | 0,5 |
0,4 | |
Ацетальдегид | 0,20 |
Бензол | 0,010 |
Бутилакрилат | 0,010 |
Винилхлорид | 0,010 |
Гексаметилендиамин | 0,010 |
Дифенилгуанидин | 0,5 |
0,15 | |
Дифенилолпропан | 0,010 |
е-капролактам | 0,01 |
Каптакс (2-меркаптобензтиазол) | 0,4 |
Метилакрилат | 0,020 |
Метилметакрилат | 0,250 |
Неозон Д (нафтам-2, | 0,2 |
Изопропанол | 0,10 |
Метанол | 0,20 |
Пропанол | 0,10 |
Стирол | 0,010 |
Сульфенамид Ц (циклогексил-2-бензтиазолсульфенамид) | 0,4 |
Тиурам Д (тетраметилтиурамдисульфид) | 0,05 |
Фенол | 0,050 |
Эпихлоргидрин | 0,10 |
Этиленгликоль | 1,0 |
Этилацетат | 0,10 |
Этилцимат (диэтилдитиокарбамат цинка) | 0,05 |
| |
Библиография
[1] | Руководство ИСО/МЭК 51:2014* | Аспекты безопасности. Руководящие указания по их включению в стандарты (Safety aspects - Guidelines for their inclusion in standards) |
________________ * Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - . | ||
[2] | ИСО 10993 (все части) | Оценка биологическая медицинских изделий (Biological evaluation of medical devices) |
[3] | ИСО 22442 (все части) | Изделия медицинские, использующие ткани животных и их производные (Medical devices utilizing animal tissues and their derivatives) |
[4] | ИСО 13022:2012 | Медицинская продукция, содержащая жизнеспособные человеческие клетки. Применение менеджмента риска и требования к методикам обработки (Medical products containing viable human cells - Application of risk management and requirements for processing practices) |
[5] | ISO/TS 21726:2019 | Оценка биологического действия медицинских изделий. Применение уровня предельно допустимого токсикологического воздействия (TTC) для оценки биосовместимости компонентов медицинских изделий [Biological evaluation of medical devices - Application of the threshold of toxicological concern (TTC) for assessing biocompatibility of medical device constituents] |
[6] | ИСО 3696:1987 | Вода для лабораторного анализа. Технические требования и методы испытаний (Water for analytical laboratory use; Specification and test methods) |
[7] | ИСО 17034:2016 | Общие требования к компетентности производителей стандартных образцов (General requirements for the competence of reference material producers) |
[8] | Руководство ИСО 33:2015 | Стандартные образцы. Надлежащая практика применения стандартных образцов (Reference materials - Good practice in using reference materials) |
[9] | Руководство ИСО 80:2014 | Руководство по внутрилабораторному изготовлению материалов для контроля качества (МКК) [Guidance for the in-house preparation of quality control materials (QCMs)] |
[10] | ИСО 11737-2:2019 | Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продукции (Sterilization of medical devices - Microbiological methods - Part 2: Tests of sterility performed in the definition, validation and maintenance of a sterilization process) |
[11] | ИСО 17665-1:2006 | Стерилизация медицинской продукции. Стерилизация паром. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий (Sterilization of health care products - Moist heat - Part 1: Requirements for the development, validation and routine control of a sterilization process for medical devices) |
[12] | ИСО 11135:2014 | Стерилизация медицинской продукции. Этиленоксид. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий (Sterilization of health-care products - Ethylene oxide - Requirements for the development, validation and routine control of a sterilization process for medical devices) |
[13] | ИСО 11137-1:2006 | Стерилизация медицинской продукции. Облучение. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских приборов (Sterilization of health care products - Radiation - Part 1: Requirements For development, validation and routine control of a sterilization process for medical devices) |
[14] | ИСО 29701:2010 | Нанотехнологии. Испытания эндотоксинов на образцах наноматериалов для систем in vitro. Испытание Limulus amebocyte lysate (LAL) [Nanotechnologies - Endotoxin test on nanomaterial samples for in vitro systems - Limulus amebocyte lysate (LAL) test] |
УДК 615.46:006.354 | ОКС 11.100.20 |
Ключевые слова: медицинские изделия, система оценки соответствия в области безопасности, общие требования биологической безопасности, физико-химические исследования, санитарно-химические испытания, токсикологические испытания | |
Электронный текст документа
и сверен по:
, 2020