ГОСТ ISO 10993-18-2022
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Изделия медицинские
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 18
Исследование химических свойств материалов в рамках процесса менеджмента риска
Medical devices. Biological evaluation of medical devices. Part 18. Chemical characterization of medical device materials within a risk management process
МКС 11.100.20
Дата введения 2023-07-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий" (АНО "ИМБИИТ") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 31 октября 2022 г. N 155-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 21 ноября 2022 г. N 1323-ст межгосударственный стандарт ГОСТ ISO 10993-18-2022 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2023 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10993-18:2020* "Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов в рамках процесса менеджмента риска" ("Biological evaluation of medical devices - Part 18: Chemical characterization of medical device materials within a risk management process", IDT), включая изменение Amd.1:2022.
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Изменение к указанному международному стандарту, принятое после его официальной публикации, внесено в текст настоящего стандарта и выделено двойной вертикальной линией, расположенной на полях напротив соответствующего текста, а обозначение и год принятия изменения приведены в скобках после соответствующего текста.
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВЗАМЕН ГОСТ ISO 10993-18-2011
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
ISO (Международная организация по стандартизации) является федерацией национальных органов по стандартизации (органов - членов ISO). Работу по подготовке международных стандартов проводят через технические комитеты ISO. Каждая организация-член, заинтересованная в области деятельности, для которой создан технический комитет, имеет право быть представленной в данном комитете. Международные правительственные и неправительственные организации также принимают участие в работе ISO. ISO тесно сотрудничает с Международной электротехнической комиссией (IEC) по вопросам стандартизации электротехнической продукции.
Процедуры, примененные при разработке настоящего стандарта, а также процедуры, предназначенные для его дальнейшей поддержки, приведены в Директивах ISO/IEC, часть 1. Следует отметить необходимость различных критериев утверждения для различных видов документов ISO. Настоящий стандарт подготовлен в соответствии с редакционными правилами Директив ISO/IEC, часть 2 (www.iso.org/directives).
Следует учитывать, что элементы настоящего стандарта могут быть предметом патентных прав. ISO не несет ответственности за идентификацию таких прав частично или полностью. Сведения о патентных правах, идентифицированных при разработке настоящего стандарта, указаны во введении и/или в перечне полученных ISO деклараций о патентном праве (см. www.iso.org/patents).
Любая информация о торговой марке продукции, указанной в настоящем стандарте, является информацией, приведенной для удобства пользования.
Для разъяснения добровольного характера стандартов, значений конкретных терминов ISO и понятий, связанных с оценкой соответствия, а также информации о приверженности ISO принципам ВТО по техническим барьерам в торговле (ТБТ) см. следующий URL: www.iso.org/iso/foreword.html.
Международный стандарт разработан Техническим комитетом ISO/TC 194 "Биологическая и клиническая оценка медицинских изделий".
Второе издание международного стандарта отменяет и заменяет первое издание ISO 10993-18:2005, в которое внесены следующие изменения:
- настоящий стандарт в большей степени увязан и гармонизирован с ISO 10993-1, ISO 10993-12 и ISO 10993-17;
- пересмотрена и расширена блок-схема процесса исследования химических свойств материалов медицинских изделий;
- приведено подробное обоснование того, что применение аналитических методов для исследований медицинских изделий является необязательным;
- дополнительно включены несколько терминов (например, "конфигурация медицинского изделия", "конструкционный материал" и "композиционный состав материала");
- приведены рекомендации по применению специфических методов исследования химических свойств материалов медицинских изделий (например, по применению методов рассасывания и растворения для идентификации опасности);
- приведены рекомендации по валидации аналитического метода;
- дополнительно включены справочные приложения, содержащие рекомендации по проведению исследований химических свойств материалов методами экстракции и определению порога предельно допустимой концентрации (порог концентрации вещества в материале, ниже которого идентификация экстрагируемых или выщелачиваемых веществ не требуется).
Перечень стандартов серии ISO 10993 приведен на официальном сайте ISO.
Замечания и предложения к настоящему стандарту следует направлять в национальные органы по стандартизации пользователей. Перечень национальных органов по стандартизации приведен по адресу: www.iso.org/members.html.
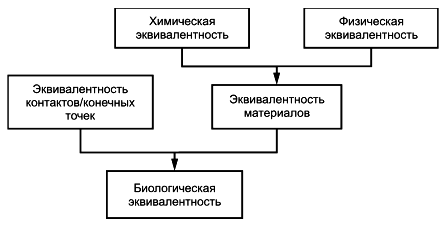
Стандарт ISO 10993-1 является основным стандартом для планирования оценки биологического действия, при которой следует учитывать научные данные об основных механизмах реакций тканей, а также возможность применения экспериментальных животных и выполнения манипуляций сними в минимальных количествах. В рамках процесса оценки риска рекомендуется проводить исследования химических/физических свойств материалов медицинских изделий методами in vitro, но при условии, что информативность результатов, полученных этими методами, сопоставима с результатами на моделях in vivo. При этом результаты исследований методами in vitro должны быть сопоставимы с результатами, полученными методами in vivo.
Исследования химических свойств материалов медицинских изделий и связанная с ними система блок-схем основаны на положениях ISO 10993-1, а именно оценка биологического действия и процесс оценки риска являются наиболее эффективными, если они основаны на минимальном количестве приемлемой и необходимой информации о химических свойствах материалов медицинского изделия, из которой можно сделать вывод о том, что медицинское изделие будет безопасным.
В ISO 10993-1:2018, подраздел 4.2, установлено, что при выборе материалов для изготовления медицинского изделия следует руководствоваться данными о его назначении и соответствии этому назначению характеристик материалов, включая химические, токсикологические, физические, электрические, морфологические и механические свойства. В ISO 10993-1:2018, подраздел 6.1, указано, что сбор информации о физических и химических характеристиках медицинского изделия или его компонентов является первым основным этапом процессов оценки биологического действия медицинского изделия и определения химических свойств материалов.
В ISO 10993-1:2018 и ISO 14971 указано, что процесс анализа биологического риска зависит от наличия информации о составе материала, неклинических и клинических данных о безопасности и токсикологии, а также от категории и продолжительности контакта медицинского изделия с организмом пациента.
Требования, установленные в настоящем стандарте, предназначены для получения следующей информации, которая необходима для оценки биологической реакции на материалы, из которых изготовлен конечный продукт:
- наименование и количество (если применимо) конструкционных материалов медицинского изделия (конфигурация медицинского изделия);
- наименование и количество (если применимо) химических веществ, содержащихся в каждом конструкционном материале (композиционный состав материала);
- наименование и количество (если применимо) химических веществ, используемых при производстве медицинского изделия, включая технологические добавки и их остаточные количества;
- способность медицинского изделия и/или конструкционных материалов к высвобождению химических веществ, которые могут потенциально воздействовать на человека при клиническом применении.
Как правило, композиционный состав материалов для производства медицинского изделия устанавливает изготовитель этих материалов. Композиционный состав материалов может меняться в процессе изготовления медицинского изделия. Другие характеристики медицинского изделия в основном устанавливает поставщик компонентов или изготовитель медицинского изделия для обеспечения соответствия готового медицинского изделия установленным требованиям к функциональным характеристикам и качеству, а также к процессам изготовления, хранения и транспортирования медицинского изделия.
1 Область применения
Настоящий стандарт распространяется на медицинские изделия (МИ) и материалы, применяемые для их изготовления, и устанавливает требования к проведению исследований химических свойств материалов МИ (алгоритм исследований), включая идентификацию и количественную оценку компонентов с целью идентификации/выявления биологической опасности, оценки и контроля биологических рисков, связанных с конструкционными материалами. При исследовании химических свойств материалов МИ используют, как правило, поэтапный подход (алгоритм исследований), который включает:
- идентификацию конструкционных материалов (конфигурацию МИ);
- характеристику конструкционных материалов путем идентификации и количественной оценки их химических составляющих (состав материала);
- характеристику МИ на наличие содержания химических веществ, добавленных в процессе производства (например, антиадгезивные агенты, технологические примеси, стерилизующие агенты);
- оценку (используя лабораторные условия экстракции) способности МИ или их конструкционных материалов к высвобождению химических веществ в условиях клинического применения (экстрагируемых веществ);
- количественное определение химических веществ, высвобождаемых из МИ в условиях клинического применения (выщелачиваемых веществ).
Настоящий стандарт также применяют для характеристики химических свойств МИ (например, при идентификации и/или количественной оценке продуктов деградации). Информация по другим аспектам оценки деградации МИ приведена в ISO 10993-9, ISO 10993-13, ISO 10993-14 и ISO 10993-15.
Серию стандартов ISO 10993 применяют к материалам или МИ прямого или опосредованного контакта с организмом человека (см. в ISO 10993-1 классификацию МИ по категориям контакта).
Настоящий стандарт предназначен для поставщиков материалов и изготовителей МИ как руководство для подтверждения биологической безопасности продукции.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения)]:
ISO 10993-1, Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process (Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска)
ISO 10993-17, Biological evaluation of medical devices - Part 17: Establishment of allowable limits for leachable substances (Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений выщелачиваемых веществ)
ISO 14971, Medical devices - Application of risk management to medical devices (Изделия медицинские. Применение менеджмента риска к медицинским изделиям)
3 Термины и определения
В настоящем стандарте применены термины по ISO 10993-1, а также следующие термины с соответствующими определениями.
ISO и IEC поддерживают терминологическую базу данных, используемую в целях стандартизации по следующим адресам:
- Электропедия IEC: доступна по адресу http://www.electropedia.org/;
- платформа онлайн-просмотра ISO: доступна по адресу http://www.iso.org/obp.
3.1 ускоренная экстракция (accelerated extraction): Экстракция, длительность которой менее длительности клинического применения МИ, но условия которой не приводят к химическим изменениям экстрагируемых веществ.
Примечание 1 - См. также приложение D.
3.2 порог предельно допустимой концентрации; ППДК (analytical evaluation threshold, АЕТ): Порог концентрации выщелачиваемого или экстрагируемого вещества, ниже которого не требуется его идентифицировать или количественно определять либо предоставлять о нем сведения для последующей оценки токсикологического риска.
Примечание 1 - См. также приложение Е.
3.3 соответствующий аналитический метод (analytically expedient): Общедоступный метод с необходимой чувствительностью и избирательностью, в котором применен конкретный экстрагент для непосредственного определения, например ППДК.
3.4 метод аналитического скрининга (analytical screening method): Метод, используемый для обнаружения, идентификации и полуколичественной оценки концентрации всех соответствующих анализируемых компонентов исследуемого образца, которые превышают установленный ППДК.
3.5 специфический аналитический метод (analytical targeting method): Метод, применяемый для количественной оценки с заданной достоверностью и точностью конкретных анализируемых веществ в образце в определенном диапазоне концентраций.
3.6 исследование химических свойств (chemical characterization): Процесс получения информации о химических характеристиках материала/МИ, осуществляемый либо путем сбора сведений, например, из научно-технической литературы, либо по результатам проведенных исследований химических свойств материала/МИ.
3.7 информация о химических характеристиках [свойствах] (chemical information): Качественная и количественная (если применимо) информация о конфигурации, составе и процессе изготовления МИ и/или его конструкционных материалов, содержащая сведения о свойствах и количествах химических компонентов, содержащихся в материалах и МИ.
Примечание 1 - См. также 5.2.1, 5.2.2, 5.2.3 и приложение B.
Примечание 2 - Информация о химических характеристиках может быть использована для установления предположительного наихудшего профиля высвобождаемых из МИ химических веществ при условии, что все химические вещества, находящиеся в нем, выделяются в условиях клинического применения.
3.8 клинически безопасное изделие (clinically established): МИ, компонент или конструкционный материал, предназначенный для конкретного и заданного клинического применения, с установленной биосовместимостью.
3.9 компонент (component): Предмет, представляющий собой часть МИ и не являющийся самостоятельным МИ.
3.10 химический компонент [составляющая] (constituent): Химическое вещество, содержащееся в готовом МИ или его конструкционных материалах.
Примечание 1 - Составляющие могут содержаться в МИ преднамеренно (например, такая добавка, как антиоксидант) или непреднамеренно (например, примесь или продукт деградации).
3.11 изготовитель компонентов (convertor): Физическое или юридическое лицо, которое перерабатывает исходный материал или изготавливает из него полуфабрикаты-заготовки (например, изготовитель отрезков стержней, трубок или пластиковых компонентов), применяемые для производства МИ.
3.12 рассасывание (digestion): Процесс полного растворения МИ, одного или более его компонентов либо одного или более его конструкционных материалов в организме путем его разрушения до основных структурных единиц, в том числе элементарные составляющие или мономерные единицы.
3.13 растворение (dissolution): Процесс полной солюбилизации МИ, одного или более его компонентов либо одного или более его конструкционных материалов в организме, как правило, с сохранением молекулярных структур его составляющих.
3.14 преувеличенная экстракция (exaggerated extraction): Экстракция, в процессе которой происходит высвобождение из МИ химических составляющих в большем количестве по сравнению с количеством, полученным при его клиническом применении.
Примечание 1 - Следует убедиться, что преувеличенная экстракция не приводит к изменению химического состава экстрагируемого материала или вещества.
3.15 исчерпывающая экстракция (exhaustive extraction): Экстракция, проводимая поэтапно до тех пор, пока количество вещества, экстрагируемого из МИ, на последнем этапе не станет менее 10% от количества вещества, измеренного (гравиметрическим или другими методами) на начальном этапе экстракции.
3.16 экстрагируемое вещество (extractable): Вещество, высвобождаемое из МИ или конструкционного материала при экстракции в лабораторных условиях с использованием экстрагентов.
3.17 экстрагирующая способность (extraction power): Свойство экстрагента извлекать (или выщелачивать) вещества из МИ, компонента или конструкционного материала.
Примечание 1 - На экстрагирующую способность экстрагента влияют его физико-химические характеристики, включая полярность, рН и диэлектрическую постоянную, но не ограничиваясь таковыми.
3.18 экстрагент (extraction vehicle): Среда (раствор или растворитель), применяемая для экстракции (или выщелачивания) из исследуемого образца в целях установления профиля экстрагируемых или выщелачиваемых веществ.
Примечание 1 - В соответствующих аналитических методах рекомендуется применять конкретные экстрагенты.
Примечание 2 - Для некоторых МИ (например, инфузионных систем), предназначенных для использования с лекарственным средством, наиболее подходящим экстрагентом является данное лекарственное средство или его растворитель.
3.19 идентификация (identification): Процесс присвоения молекулярной структуры и химического наименования органическому соединению или присвоения составляющих элементов или молекулярной структуры (если применимо), а также химического наименования неорганическому соединению.
3.20 сбор информации (information gathering): Процесс формирования набора данных о химических свойствах материала, включая доступные результаты исследований, относящихся к химическим характеристикам исследуемого образца.
3.21 получение информации (information generation): Процесс сбора данных о химических свойствах исследуемого образца по результатам исследований.
3.22 выщелачиваемое вещество (leachable): Вещество, высвобождаемое из МИ или материала при его клиническом применении.
Примечание 1 - Для многих МИ исследование выщелачиваемых веществ не проводят вследствие невозможности воспроизведения реальных клинических условий. Исследование выщелачиваемых веществ таких МИ выполняют методом моделируемой экстракции (см. определение термина "моделируемая экстракция").
3.23 изготовитель (manufacturer): Физическое или юридическое лицо, осуществляющее производство или окончательную сборку МИ либо осуществляющее разработку, производство, окончательную сборку и продажу данного МИ под своим торговым наименованием или торговой маркой.
3.24 композиционный состав материала (material composition): Перечень составляющих, содержащихся в материале (качественный состав), и количество каждого химического вещества в материале (количественный состав).
Примечание 1 - При проведении исследований по определению композиционного состава материала предполагают высвобождение всех химических веществ, содержащихся в нем, при клиническом применении МИ. Количества этих химических веществ получают из данных о составе материала или по результатам исследований методами рассасывания, растворения и исчерпывающей экстракции.
3.25 конструкционный материал (material of construction): Конкретное сырье, используемое для изготовления компонента МИ.
Пример - Синтетические резины.
3.26 конфигурация медицинского изделия (medical device configuration): Перечень компонентов МИ (качественная конфигурация), включая перечень конструкционных материалов компонента (качественная конфигурация) и долю каждого материала в конкретном компоненте (количественная конфигурация) МИ.
Примечание 1 - К конфигурации МИ относят форму, размеры и относительное расположение компонентов МИ, а также характеристики поверхности (топографические и химические свойства).
3.27 пациент (potentially affected individual): Человек, имеющий прямой или опосредованный контакт с МИ.
Примечание 1 - Категории контакта МИ приведены в ISO 10993-1.
3.28 валидация аналитического метода (qualification): Процесс установления пригодности аналитического метода для исследования конкретного МИ.
3.29 качественный анализ (qualitative analysis): Аналитический метод, предназначенный для обнаружения исследуемого вещества по отклику модельного(ых) вещества (веществ), выбранного(ых) без специальной оценки или по результатам сравнения откликов исследуемого и модельного веществ.
3.30 количественная оценка (quantification): Определение концентрации исследуемого вещества, содержащегося в образце.
Примечание 1 - Количественную оценку подразделяют на несколько видов, см. 3.31, 3.32 и 3.33.
3.31 оценочный количественный анализ (estimated quantitative analysis): Аналитический метод, в котором концентрацию исследуемого вещества определяют по отклику модельного вещества, выбранного без специальной оценки или результатов сравнения откликов исследуемого и модельного веществ.
3.32 полуколичественный анализ (semi-quantitative analysis): Аналитический метод, в котором концентрацию исследуемого вещества определяют по отклику модельного(ых) вещества (веществ), выбранного(ых) по результатам сравнения откликов исследуемого и модельного веществ.
3.33 количественный анализ (quantitative analysis): Аналитический метод, в котором концентрацию исследуемого вещества определяют с высокой точностью по функции отклика (калибровочная кривая), построенной для конкретного исследуемого вещества с использованием стандартного образца.
Примечание 1 - Из указанных в 3.31, 3.32 и 3.33 методов наименее точным является оценочный количественный анализ, наиболее точным - количественный анализ.
3.34 порог относительной безопасности; ПОБ (safety concern threshold, SCT): Предел воздействия выщелачиваемого (или экстрагируемого как вероятное выщелачиваемое) вещества в дозе, не представляющей значительную опасность для здоровья человека в части канцерогенных и неканцерогенных токсических эффектов.
Примечание 1 - См. [27].
3.35 моделируемая экстракция (simulated-use extraction): Экстракция, выполняемая методом, имитирующим клиническое применение МИ.
Примечание 1 - Моделируемую экстракцию применяют для оценки типа и количества веществ, которые, ожидаемо, будут высвобождаться из МИ при его клиническом применении. Моделируемая экстракция предназначена для определения профиля экстрагируемых веществ, который представляет собой наихудший профиль выщелачиваемых веществ, так как все выщелачиваемые вещества также являются экстрагируемыми и содержание всех отдельных экстрагируемых веществ, по меньшей мере, равно содержанию всех отдельных выщелачиваемых веществ.
3.36 солюбилизация (solubilisation): Процедура или процесс растворения отдельного компонента или всего исследуемого образца в специальной среде.
Примечание 1 - Выщелачивание, экстракция, растворение и рассасывание являются подкатегориями солюбилизации.
3.37 организатор испытаний (sponsor): Физическое или юридическое лицо, планирующее, заказывающее и принимающее на себя ответственность за испытание/исследование МИ.
3.38 поставщик (supplier): Физическое или юридическое лицо, изготавливающее или предоставляющее конструкционные материалы или компоненты, используемые для производства МИ.
3.39 порог токсической опасности; ПТО (threshold of toxicological concern, TTC): Предел воздействия химических компонентов (веществ), ниже которого не существует значимого риска для здоровья человека.
Примечание 1 - Полная информация о ПТО приведена в ISO/TS 21726.
3.40 оценка токсикологического риска (toxicological risk assessment): Процесс определения вероятности возникновения определенной степени нежелательной реакции организма, происходящей в ответ на определенный уровень воздействия конкретного химического вещества.
4 Сокращения
В настоящем стандарте применены сокращения наименований аналитических методов исследований и относящихся к ним понятий, приведенные в таблице 1.
Таблица 1 - Сокращения наименований аналитических методов исследований и относящихся к ним понятий
Сокращение | Аналитический метод |
ДПГЭ (2D PAGE) | Двухмерный полиакриламидный гелевый электрофорез |
АЭС (AES) | Атомно-эмиссионная спектроскопия |
ППДК (AET) | Порог предельно допустимой концентрации |
ДМТА (DMTA) | Динамический механический термический анализ |
ДСК (DSC) | Дифференциально-сканирующая колориметрия |
ПИД (FID) | Пламенно-ионизационный детектор |
Фурье-ИКС (FTIR) | Инфракрасная спектроскопия с преобразованием Фурье |
ГХ (GC) | Газовая хроматография |
ГПХ/ЭХ (GPC/SEC) | Гель-проникающая хроматография/эксклюзионная хроматография (хроматография на молекулярных ситах) |
ВЭЖХ или ЖХ (HPLC or LC) | Высокоэффективная жидкостная хроматография или жидкостная хроматография |
ОСП (HS) | Отбор проб в свободном пространстве |
ИХ (IC) | Ионная хроматография |
ИСП (ICP) | Индуктивно связанная плазма |
ИКС (IR) | Инфракрасная спектроскопия |
МС (MS) | Масс-спектрометрия |
ЯМР-спектроскопия (NMR) | Спектроскопия ядерного магнитного резонанса |
НЛОС (NVOC) | Нелетучее органическое соединение |
НЛО (NVR) | Нелетучий остаток |
РЭМ-ЭДРС (SEM-EDS или SEM-EDX) | Растровая электронная микроскопия - энергодисперсионная рентгеновская спектроскопия |
ПЛОС (SVOC) | Полулетучее органическое соединение |
ООУ (TOC) | Общий органический углерод |
УФ-спектроскопия (UV) | Ультрафиолетовая спектроскопия |
ЛОС (VOC) | Летучее органическое соединение |
РФЭС (XPS) | Рентгеновская фотоэлектронная спектроскопия |
PФ(XRF) | Рентгеновская флуоресценция |
| |
5 Алгоритм исследования химических свойств медицинских изделий/ материалов
5.1 Общие положения
Информацию о химических свойствах материала, собранную, полученную и дополненную какими-либо второстепенными данными (если требуется), применяют для различных целей, например:
- для подтверждения общей биологической безопасности МИ (см. ISO 10993-1 и ISO 14971);
- подтверждения биологической безопасности готового МИ;
- определения количеств химических веществ, которые могут выщелачиваться из МИ в условиях клинического применения, с целью обоснования проведения оценки токсикологического риска (ISO 10993-17);
- подтверждения эквивалентности исследуемого МИ серийно выпускаемому изделию, используемому для того же типа клинического применения, в части его конфигурации или профилей экстрагируемых/выщелачиваемых веществ, либо для проведения других соответствующих исследований;
- подтверждения эквивалентности исследуемого МИ серийно выпускаемому изделию, используемому для того же типа клинического применения, после изменений в производственном процессе (включая изменения в процессе стерилизации, но не ограничиваясь таковыми), производственных площадках, поставщиках материалов или компонентов и т.д.;
- подтверждения эквивалентности исследуемого конструкционного материала серийно выпускаемому конструкционному материалу в части его композиционного состава или профиля экстрагируемых веществ либо для проведения других соответствующих исследований;
- подтверждения эквивалентности готового МИ его прототипу для оценки учета в готовом изделии соответствующих характеристик, таких как композиционный состав, конфигурация и профиль экстрагируемых веществ, полученный от МИ или от материалов его компонентов;
- скрининга новых материалов с целью выявления их химической стабильности при клиническом применении МИ.
Следует учитывать, что исследование химических свойств может быть недостаточным для подтверждения эквивалентности или биосовместимости материалов и МИ и не может заменять биологические исследования. При этом исследование химических свойств в сочетании с оценкой риска необходимо для оценки эквивалентности химических свойств и биосовместимости материалов/МИ и, в случае надлежащего проведения, может быть применено вместо некоторых биологических испытаний.
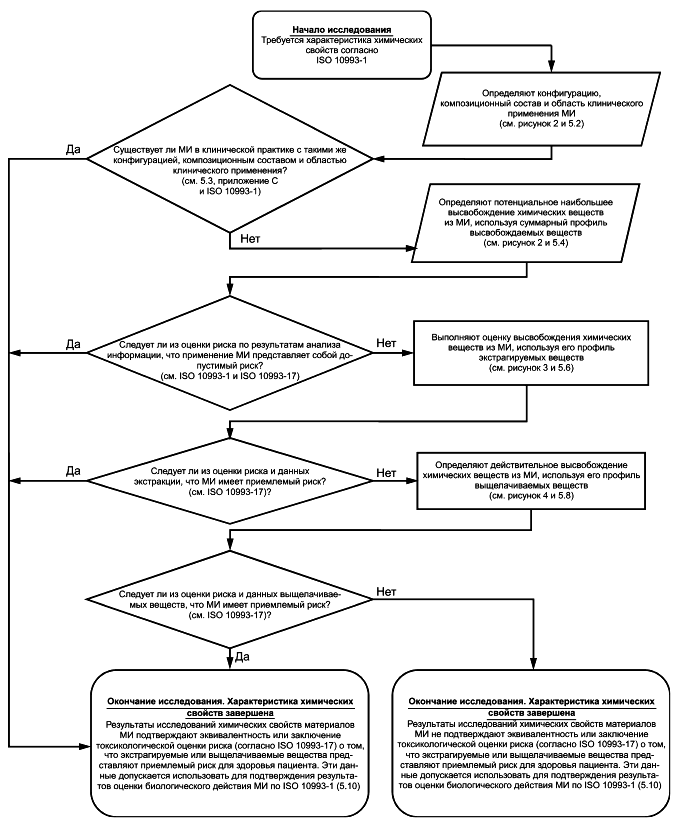
Результаты исследований химических свойств материалов необходимы для оценки биологического действия и токсикологического риска МИ (см. ISO 10993-1 и ISO 10993-17). Общая блок-схема процесса исследования химических свойств материалов МИ приведена на рисунке 1, представляет собой часть общей биологической оценки МИ, требования к которой установлены в ISO 10993-1. Данная блок-схема предназначена для иллюстрации процесса поэтапного исследования химических свойств материалов/МИ. Общая блок-схема дополнена блок-схемами (см. рисунки 2-4), на которых представлены конкретные этапы общего процесса исследования химических свойств МИ.
Требования и руководство для каждого этапа исследования химических свойств МИ установлены в 5.2-5.10. Если в применяемой блок-схеме приведен этап сбора информации, то квалифицированные специалисты должны получить и обобщить имеющиеся данные, относящиеся к химическим свойствам материала/МИ (сбор информации), оценить их адекватность для использования в качестве основы оценки токсикологического риска материала/МИ. Если имеющейся информации недостаточно для полной оценки, то следует собрать дополнительную информацию или получить необходимые данные путем проведения испытаний (получения информации) для оценки токсикологического риска материала/МИ.
Следует проводить оценку токсикологического риска каждого конструкционного материала прямого или опосредованного контакта, входящего в состав МИ, в дополнение к исследованиям химических свойств готового МИ. Поскольку на химические свойства МИ может влиять обработка в процессе его производства (например, стерилизация), то это необходимо учитывать при планировании исследования химических свойств и интерпретации результатов.
На каждом этапе исследования химических свойств необходимо установить адекватность имеющихся данных, применяемых в качестве основы для проведения оценки риска МИ. Имеющиеся данные допускается считать адекватными, если они отражают или превышают условия клинического применения МИ и на их основе можно выполнить полную оценку риска. Недостающие данные могут быть получены из существующей информации (например, на основе анализа литературы) и/или путем проведения дополнительных лабораторных исследований.
В системе блок-схем приведены следующие этапы: начало/окончание, принятие решения, сбор и оценка информации, а также этап лабораторного исследования. Каждый этап обозначен соответствующей геометрической фигурой. Этапы начала/окончания обозначены овалами, этап принятия решения - ромбом, этап сбора и оценки информации - параллелограммом, этап лабораторного исследования - прямоугольником.
Этапы и действия, указанные в 5.4.2, 5.7 и 5.9, являются частью процесса оценки риска и представляют собой точки, в которых требуется предоставление соответствующей информации о химических свойствах материалов МИ. Как правило, данные этапы выходят за рамки исследования химических свойств МИ, требования к которым установлены в настоящем стандарте. Эти этапы включены в блок-схемы для обозначения связи между исследованием химических свойств МИ и оценкой риска (см. ISO 10993-1, ISO 10993-17 и ISO 14971).
Исследование химических свойств и система блок-схем основаны на принципах, приведенных в ISO 10993-1. Процессы оценки биологического действия и токсикологического риска являются наиболее продуктивными и эффективными, если они основаны на надлежащем (минимальном) количестве приемлемой и необходимой информации о химических свойствах, устанавливающей, что МИ представляет собой допустимый риск для здоровья пациента. Таким образом, первым этапом исследования является определение конфигурации МИ и композиционного состава его конструкционных материалов для сравнения с клинически используемым материалом/МИ или оценки предположительного общего высвобождения химических веществ из МИ. В данную оценку включают потенциальные контаминанты, продукты деградации, технологические добавки и примеси, которые могут быть привнесены производственным процессом. Если результаты оценки, основанной на предположительном общем высвобождении химических веществ, свидетельствуют о наличии допустимого токсикологического риска МИ, то этап может быть завершен путем сбора или получения минимального объема информации. Если вывод о допустимом риске МИ после определения и оценки предположительного общего высвобождения химических веществ из МИ по сравнению с фактическим высвобождением в клинических условиях его использования не обоснован, то необходимо собрать дополнительные данные. В любом случае собранная информация должна отражать (либо превышать) условия клинического применения МИ, ее оценку следует выполнять в соответствии с условиями клинического применения МИ.
При использовании системы блок-схем выполнение всех этапов в строгой последовательности не всегда является обязательным. Система блок-схем имеет несколько точек выхода (завершения исследования). Например, если по результатам оценки предположительного общего воздействия химических составляющих МИ сделан вывод о том, что применение МИ представляет собой допустимый риск для здоровья пациента, то дополнительное исследование его химических свойств можно не проводить. Таким образом, определение химических свойств МИ в соответствии с блок-схемой завершено. Далее выполняют оценку биологического действия МИ в соответствии с ISO 10993-1.
|
Примечание - Вход и выход из блок-схемы возможны в нескольких точках.
Рисунок 1 - Общая блок-схема процесса исследования химических свойств материалов МИ
В дополнение к нескольким точкам выхода система блок-схем также имеет несколько точек входа. Следует учитывать, что действия, выполненные на первых этапах в соответствии с блок-схемой, могут способствовать выполнению действий, выполняемых на других этапах, при этом эти действия могут не выполняться последовательно друг за другом. Например, на основании сведений о конфигурации МИ и композиционном составе его материалов (включая потенциальные контаминации) можно установить профиль выщелачиваемых веществ, при этом профиль выщелачиваемых веществ можно сформировать, не используя информацию о конфигурации МИ и композиционном составе его материалов. Если для установления токсикологического риска МИ организатором испытаний принято решение о проведении оценки выщелачиваемых из МИ веществ (например, при исследовании МИ, не контактирующего с организмом пациента), то допускается не определять профиль экстрагируемых веществ. При наличии данных о композиционном составе материала МИ, на основе которых можно сделать вывод о том, что содержания экстрагируемых веществ превышают предельно допустимые значения, допускается не проводить исследования экстрагируемых веществ и сразу приступить к исследованию выщелачиваемых веществ.
Данный подход применения нескольких точек входа и выхода при проведении исследований химических свойств материалов МИ является оптимальным, так как система блок-схем построена таким образом, что результат, полученный при выполнении действий на каждом последующем этапе, способствует получению данных о воздействии выщелачиваемых веществ в условиях клинического применения МИ и, следовательно, установлению реального риска. При входе в процесс исследований химических свойств материалов МИ в промежуточной точке можно получить точные данные о воздействии высвобождаемых из МИ веществ для оценки токсикологического риска МИ, при этом данное решение должно быть обосновано.
Дополнительные сведения для проведения исследований химических свойств материалов МИ представлены в приложении A.
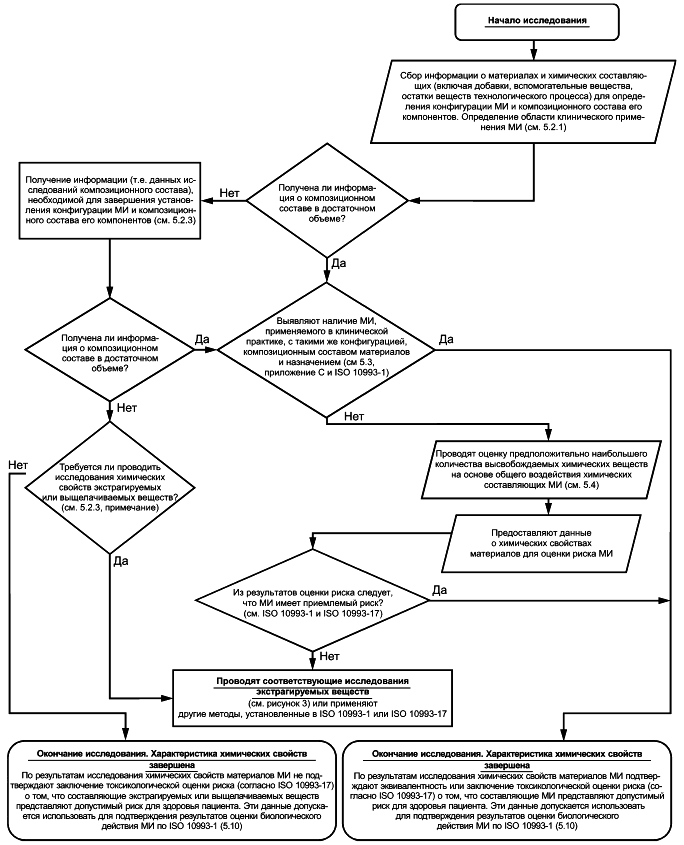
5.2 Определение конфигурации и композиционного состава медицинского изделия
5.2.1 Общие положения
Для взаимодействия МИ с пациентом требуется его контакт с организмом пациента (см. ISO 10993-1). Допускается не определять химические свойства материалов МИ (или компонентов), не имеющего прямого или опосредованного контакта с организмом пациента. Предположительное наибольшее высвобождение из МИ химических веществ определяют по данным о конфигурации МИ и композиционном составе его материалов. Таким образом, на первом этапе осуществляют сбор всей необходимой информации о конфигурации МИ и композиционном составе его конструкционных материалов. Данную информацию получают либо из соответствующего источника (например, от поставщика материала), либо по результатам исследований.
В отчете приводят описание МИ, данные о его конфигурации, назначении и области клинического применения. Задокументированные данные должны содержать сведения о конкретных конструкционных материалах МИ, их содержании в МИ (например, по площади поверхности или массе), а также о его структурных свойствах (включая топографические или химические характеристики поверхности), если требуется. Также в отчете должна быть приведена информация о геометрических параметрах каждого компонента МИ (конфигурация МИ) для определения категории контакта, при его наличии, между отдельными компонентами МИ и пациентом.
После определения конфигурации МИ в отчете приводят данные о каждом его компоненте, находящемся в прямом или опосредованном контакте с организмом пациента, включая сведения о композиционном составе и предполагаемом взаимодействии с тканями и жидкостями организма пациента. В отчете приводят качественные данные о композиционном составе каждого материала МИ, добавках и количествах остаточных веществ, использованных в процессе производства МИ. Рекомендации по подготовке, сбору и анализу качественных данных о МИ приведены в ISO 10993-1 и приложении В. Объем требуемых качественных и/или количественных данных о композиционном составе материалов МИ (например, о содержании добавок и количествах остаточных веществ производственного процесса) должен быть достаточным для оценки потенциального риска и безопасности МИ и его материалов (см. ISO 10993-1:2018, подраздел 6.1). Например, для МИ длительного контакта требуется более подробный анализ данных о конфигурации МИ и композиционном составе материалов, чем для МИ кратковременного контакта, так же как для имплантируемых МИ по сравнению с МИ, контактирующими с кожей. Количество и детализация предоставленных данных о композиционном составе материала МИ должны быть обоснованы. Влияние производственного процесса (включая стерилизацию) на материалы и МИ должно быть учтено и задокументировано.
Качественные данные о каждом материале должны содержать подробное торговое наименование или номер спецификации, наименование поставщика и спецификацию материала (например, химический состав, сертификат соответствия, карта технических данных, паспорт безопасности). Качественные данные должны быть надежными и релевантными. Стандартизованные материалы, соответствующие, например, стандартам серии ISO 5832, отвечают данным требованиям.
5.2.2 Сбор информации
Изготовители МИ, как правило, должны получать количественные и качественные данные о материалах от поставщика сырья. Качественные данные о каких-либо дополнительных технологических добавках, например антиадгезивных смазках, также должны быть предоставлены соответствующими соисполнителями производственного процесса, включая поставщиков и изготовителей компонентов. При отсутствии достаточной информации от поставщика необходимые данные получают путем проведения химического анализа (например, исследование состава экстрагируемых или выщелачиваемых веществ). Полученная информация должна быть достаточной для определения всех биологических опасностей, связанных с химическими составляющими материала, для включения в оценку токсикологического риска (см. ISO 10993-1). Информация о наличии в материале веществ, относящихся к группам опасных соединений (см. Е.6), необходима при планировании исследований экстрагируемых веществ методами с применением ПТО (см. ISO/TS 21726).
Оценку биологического действия МИ проводят с учетом нескольких наборов данных вместе с результатами, полученными при исследовании химических свойств материалов. Таким образом, отсутствие необходимой информации от поставщиков материалов не препятствует проведению оценки биологического действия МИ. При этом при выявлении токсикологической опасности МИ недостающую информацию, отсутствие которой может препятствовать проведению оценки токсикологического риска, необходимо восполнить любым доступным способом.
Композиционный состав материалов, используемых в МИ, должен быть задокументирован на основе сведений из соответствующих стандартов или данных, представленных изготовителем МИ.
Примечание - Рекомендуется использовать информацию о композиционном составе материала МИ, предоставленную поставщиком. При отсутствии каких-либо исходных данных о композиционном составе материала следует провести анализ научной литературы для установления химического состава исходного материала и любых добавок.
5.2.3 Получение информации по результатам исследований медицинских изделий/материалов
Для получения необходимой количественной информации о композиционном составе материалов при отсутствии соответствующей информации следует провести исследование МИ и/или его конструкционных материалов.
Примечание - Как указано в ISO 10993-1:2018 (подраздел 6.1), "объем требуемой информации о физических и/или химических свойствах зависит от наличия данных о композиционном составе материала, его неклинической и клинической токсикологической безопасности, а также от категории и длительности контакта МИ с организмом пациента. Как минимум, в данных о характеристике материала МИ должны быть указаны химические вещества, входящие в его состав, и возможные остаточные технологические добавки или добавки, используемые при его изготовлении".
|
Рисунок 2 - Блок-схема процесса определения композиционного состава материалов МИ
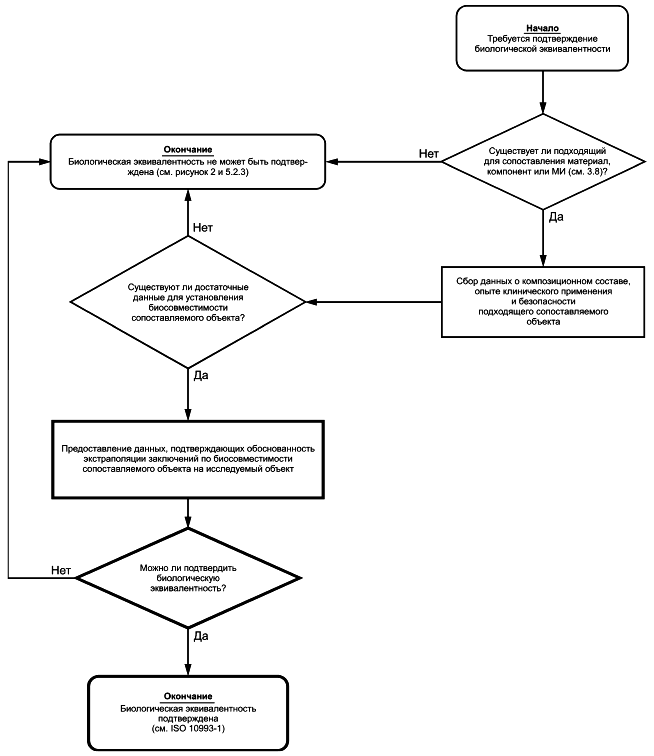
5.3 Подтверждение эквивалентности материала по составу и химических свойствам материалу медицинского изделия, применяемого в клинической практике
Как показано в блок-схемах, информацию, собранную в соответствии с 5.2, следует использовать для сравнения исследуемого МИ и МИ, применяемого в клинической практике. Информацию используют для определения того, является ли исследуемое МИ эквивалентным МИ, применяемому в клинической практике, по конфигурации, составу, изготовлению, обработке и назначению.
В приложении C и ISO 10993-1 приведены рекомендации по подтверждению эквивалентности исследуемого МИ изделию, применяемому в клинической практике.
В некоторых случаях (например, при смене поставщика материала) допускается подтверждать эквивалентность материала имеющейся информацией. Для этого необходимо получить достаточный объем качественных и количественных данных о подтверждении того, что исследуемый материал является эквивалентным по составу (включая наличие загрязнений), физическим и химическим свойствам, обработке и назначению материалу МИ, применяемого в клинической практике. Если установлено, что МИ/материал является эквивалентным МИ/материалу, применяемому в клинической практике, то такое подтверждение должно быть обосновано и задокументировано.
Если подтверждена и обоснована эквивалентность исследуемого материала МИ материалу МИ, применяемого в клинической практике, то процесс описания химических свойств материала считают завершенным. Если невозможно подобрать для сопоставления эквивалентное МИ, применяемое в клинической практике, то следует использовать другие способы оценки биологического действия в соответствии с ISO 10993-1, включая проведение дополнительных исследований химических свойств в соответствии с системой блок-схем.
Подтверждение эквивалентности материала может быть основано на данных о композиционном составе материала или об экстрагируемых веществах при сравнении с материалом МИ, применяемого в клинической практике, при условии, что аналитические методы, используемые для получения данных, являются пригодными для этих целей.
Физические, химические, морфологические и топографические характеристики (см. ISO/TS 10993-19 и ISO/TR 10993-22, если применимо) следует учитывать при подтверждении эквивалентности материала.
5.4 Определение предполагаемого наибольшего высвобождения химических веществ на основе оценки общего воздействия химических составляющих медицинского изделия
5.4.1 Определение потенциальной возможности наибольшего высвобождения химических веществ
Наибольшее химическое воздействие МИ на пациента может быть в случае, если все химические вещества, входящие в состав МИ, будут воздействовать на пациента при клиническом применении МИ. Такое может произойти, например, если имплантируемое МИ рассасывается в течение клинического применения или если МИ, присоединяемое извне, при клиническом применении полностью выщелачивается. Соответственно, качественные и количественные данные, собранные в соответствии с 5.2, относящиеся к материалу или конфигурации МИ, конструкционным материалам, остаткам веществ вследствие обработки МИ и полученные от поставщика материалов, следует использовать для установления предполагаемого случая наибольшего высвобождения химических веществ, даже если это маловероятно в условиях клинического применения материала/МИ. При установлении предполагаемого случая наибольшего высвобождения из МИ химических веществ необходимо учитывать дополнительные факторы, такие как размер МИ и возможное клиническое применение нескольких МИ.
5.4.2 Оценка предполагаемого наибольшего высвобождения химических веществ
Воздействие на здоровье пациента отдельных химических составляющих МИ оценивают как предполагаемое наибольшее высвобождение химических веществ (см. 5.4.1) для определения потенциального неблагоприятного воздействия, которое химические компоненты могут оказать на здоровье пациента, в соответствии с ISO 10993-1 и ISO 10993-17.
Если установлено допустимое воздействие всех химических веществ, входящих в состав МИ [например, путем сравнения воздействия с ППДК (см. 5.5)], то процесс характеристики химических свойств материалов МИ считают законченным. В таком случае оценку биологического действия МИ в соответствии с ISO 10993-1 завершают. Если установлено потенциально недопустимое воздействие всех химических веществ, входящих в состав МИ, то процесс характеристики химических свойств материалов продолжают и переходят к следующему этапу (см. 5.5, 5.6 и рисунок 3). Если полученной информации о химических характеристиках материалов МИ недостаточно, то в качестве альтернативы рекомендуется продолжить оценку биологического действия МИ в соответствии с ISO 10993-1:2018 с применением конечных точек.
Примечание 1 - В некоторых случаях определения предполагаемого композиционного состава материала может быть недостаточно (например, при вероятном наличии продуктов деградации и случайных загрязнений в процессе изготовления).
Примечание 2 - Допускается оценивать биологическую безопасность МИ с низким риском воздействия (например, при воздействии на неповрежденную кожу пациента) на основе качественных данных о композиционном составе материала при условии, что МИ изготовлено из серийно выпускаемых материалов, применяемых в клинической практике в течение длительного времени, и с использованием тех же методов (например, нержавеющая сталь марки ISO с пассивированной и/или перепассивированной поверхностью). В этих случаях допускается не проводить исследование химических свойств материалов и оценку токсикологического риска МИ.
5.5 Установление порога предельно допустимой концентрации
Необходимо определить и обосновать значение ППДК (см. приложение E). Рекомендуется устанавливать значение ППДК на основе значений ПТО. Если это выполнить невозможно, то допускается устанавливать значение ППДК на основе значения предела количественного определения (LOQ). При оценке токсикологического риска МИ следует учитывать разницу между ППДК и LOQ и приводить соответствующее обоснование.
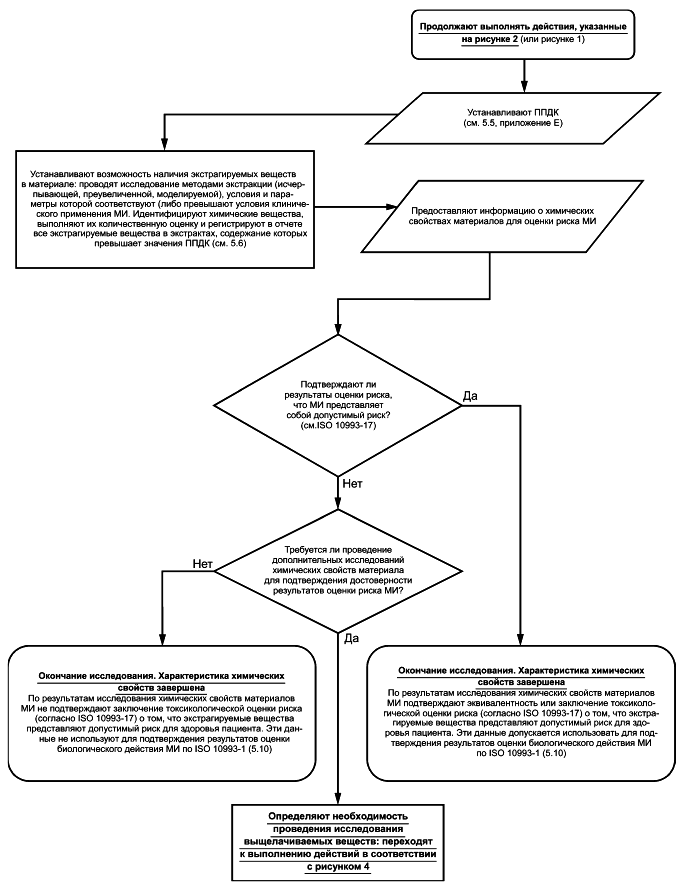
5.6 Определение высвобождаемых химических веществ. Проведение исследования экстрагируемых веществ
Исследование материала МИ методами экстракции проводят для идентификации и количественного определения экстрагируемых веществ с целью оценки токсикологического риска МИ по ISO 10993-17. В некоторых случаях (например, в методе исчерпывающей экстракции) требуется наличие информации о кинетике высвобождения экстрагируемых химических веществ. В отчете приводят сведения об используемом методе экстракции (исчерпывающая, преувеличенная или моделируемая) и обоснование его применения. Рекомендации по проведению исследований химических свойств материалов МИ методами экстракции приведены в приложении D.
Для некоторых видов МИ (например, МИ, не контактирующих с организмом пациента, таких как пакеты для капельного введения физиологического раствора) допускается не проводить исследования экстрагируемых веществ, так как условия их применения, связанные с максимальным воздействием на человека выщелачиваемых веществ, могут быть воспроизведены, а растворы для клинического применения - проанализированы простым способом. В таких случаях исследование экстрагируемых веществ рекомендуется заменить исследованием выщелачиваемых веществ.
Примечание 1 - Наличие экстрагируемых веществ в некоторых материалах (например, материалах, о композиционном составе которых получены подтвержденные данные) можно спрогнозировать с помощью научных и вычислительных методов, а также определить эмпирически.
Примечание 2 - В соответствии с ISO 10993-1 при наличии затруднений в определении химических свойств материалов МИ рекомендуется дополнительно проводить биологические испытания или исследования с применением аналитических методов.
При планировании исследований материалов МИ с применением методов экстракции следует учитывать категорию контакта МИ с потенциальным пациентом, а также влияние (или взаимодействие) других веществ, таких как лекарственные средства в МИ, предназначенном для их введения в организм пациента.
Таблица 2 - Рекомендуемые условия экстракции
Категория контакта МИ | Условия экстракции | Альтернативные условия экстракции |
МИ кратковременного контакта | Моделируемые условия | Преувеличенные условия |
МИ длительного контакта | Исчерпывающие условия | Преувеличенные условия |
МИ долгосрочного контакта | Исчерпывающие условия | Преувеличенные условия |
| ||
Основной целью исследований методами экстракции является определение профиля экстрагируемых веществ МИ, который, по меньшей мере, такой полный, как и профиль выщелачиваемых веществ, т.е. профиль экстрагируемых веществ включает все выщелачиваемые вещества в качестве экстрагируемых, при этом концентрации экстрагируемых веществ не менее концентраций выщелачиваемых веществ. При оценке токсикологического риска применение профиля экстрагируемых веществ, превышающего профиль выщелачиваемых веществ вследствие содержания экстрагируемых веществ в более высоких концентрациях по сравнению с концентрациями выщелачиваемых веществ, вносит в результаты исследования дополнительные неопределенности. При выборе условий экстракции следует учитывать, что применение чрезмерно агрессивных условий экстракции при исследовании материалов МИ может привести к изменению профиля экстрагируемых веществ.
Применение рекомендуемых условий экстракции, приведенных в таблице 2, обеспечивает получение требуемого профиля экстрагируемых веществ. При этом следует учитывать, что рекомендуемые исчерпывающие условия экстракции не пригодны для исследования некоторых МИ. Для МИ всех категорий рекомендуется применять альтернативные условия экстракции, если они являются приемлемыми для исследования конкретного материала МИ. Применение альтернативных условий экстракции следует задокументировать и обосновать. Для исследований методами экстракции, проводимых в конкретных целях, отличающихся от целей идентификации и количественной оценки экстрагируемых веществ (например, определение кинетики высвобождения химических веществ из материала), допускается применять другие условия экстракции.
Учитывая возможность проведения исследований одного образца путем выполнения нескольких экстракций, следует обеспечить минимальную вариабельность композиционного состава образца и результатов измерений при осуществлении повторных экстракций с применением разных экстрагентов, а также соответствующую репрезентативность исследуемого образца и процесса экстракции. Если представлены другие данные (например, результаты технических испытаний) о значительной вариабельности результатов процесса экстракции одного или нескольких образцов, отобранных из одной партии МИ, или образцов, отобранных из разных партий МИ, то следует проводить несколько (например, две или три) экстракций. Несколько экстракций также следует проводить при отсутствии данных о композиционном составе исследуемого образца и/или вариабельности результатов экстракции. При этом число полученных экстрактов должно быть обосновано независимо от числа проведенных экстракций.
Примечание - Проведение нескольких (например, не менее трех) экстракций с применением одного экстрагента требуется:
- для абсорбируемых (деградируемых) МИ, МИ, полимеризующихся in situ, комбинированных МИ, которые объединены физическим или химическим способом. Для таких видов МИ вариабельность результатов измерений может быть значительной даже при небольших изменениях в химическом составе при производстве, в течение срока хранения или во время использования;
- МИ, на которые распространяются конкретные стандарты или документы, устанавливающие требования к числу проводимых экстракций.
|
Рисунок 3 - Блок-схема процесса исследования экстрагируемых веществ
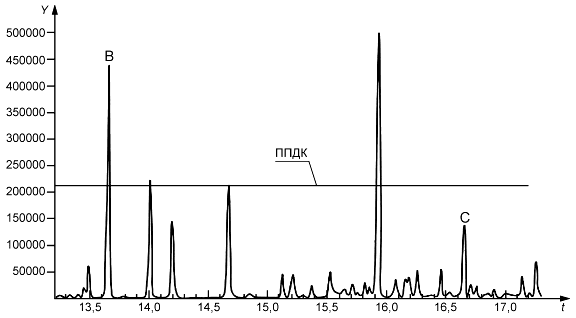
Экстракты исследуют с применением чувствительных и избирательных методов скрининга на наличие экстрагируемых веществ, концентрация которых превышает установленное значение ППДК (см. 5.5 и приложение Е). Такие выявленные экстрагируемые вещества идентифицируют и выполняют их количественную оценку. Для выявления в материале МИ исследуемых экстрагируемых веществ рекомендуется применять методы хроматографии и оборудование с требуемым разрешением. В отчете об исследовании регистрируют сведения о примененных аналитических методах и полученные результаты с указанием соответствующего значения ППДК. В таблице 4 приведены основные аналитические методы, применяемые для исследований экстрагируемых веществ. (Amd. 1:2022).
При проведении исследования следует проанализировать несколько аликвот экстракта для определения и учета аналитической вариабельности. Рекомендуется анализировать не менее трех аликвот экстракта, но при наличии соответствующего обоснования допускается анализировать меньшее число аликвот.
Результаты данного исследования используют для определения риска, связанного с предполагаемым количеством высвобожденных из МИ химических веществ. Если по результатам оценки токсикологического риска МИ установлено, что химическое вещество или вещества представляют потенциальный риск для пациента, то для более точной оценки количества химического вещества (веществ), выделяемого(ых) из МИ при клиническом применении, следует провести моделируемую экстракцию, параметры и условия которой соответствуют параметрам и условиям клинического применения МИ (см. 5.8). Если проведение моделируемой экстракции нецелесообразно, то допускается использовать другие методы исследований и способы снижения риска МИ, такие как исследование конкретных экстрагируемых веществ специфическими аналитическими методами, биологические испытания, уменьшение количества химического вещества в МИ и, в отдельных случаях, применение маркировки в соответствии с ISO 14971, ISO 10993-1 и ISO 10993-17.
5.7 Результаты высвобождения химических веществ (профиль экстрагируемых веществ)
В отчет следует включать результаты исследования материалов МИ, проведенного методами экстракции, с целью проведения оценки риска каждого идентифицированного экстрагируемого вещества в соответствии с ISO 10993-17, ISO 10993-1 и ISO 14971.
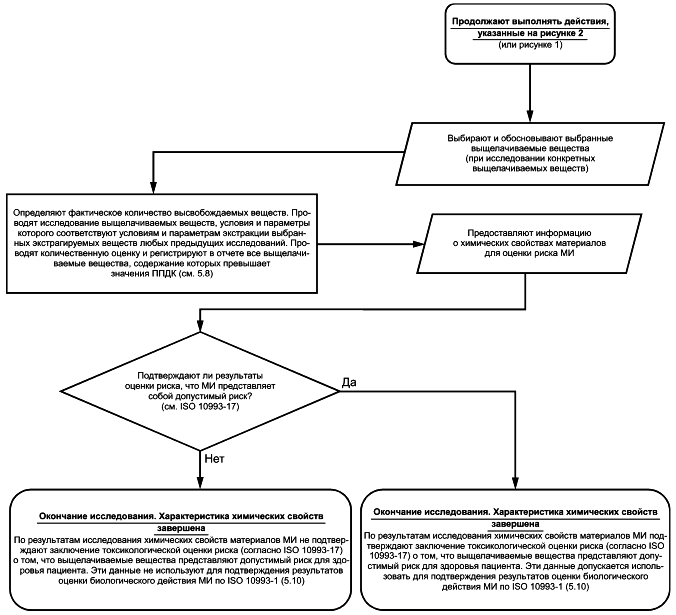
5.8 Определение фактического высвобождения химических веществ. Проведение исследований выщелачиваемых веществ
Если количество любого экстрагируемого вещества, высвобождаемого из МИ, представляет потенциальную опасность, связанную с его предполагаемым высвобождением при клиническом применении МИ, то для более точной оценки фактического воздействия и фактического высвобождения этого химического вещества следует провести исследование выщелачиваемых из МИ веществ с использованием моделируемых или ускоренных условий экстракции (например, при повышенной температуре), как показано на рисунке 4. Если исследование выщелачиваемых веществ проводят после выявления в образце экстрагируемых веществ, относящихся к группе опасных соединений, то его целью является определение химических свойств данных веществ. Дальнейшее исследование экстрагируемых веществ, не представляющих потенциальную токсикологическую опасность при предполагаемом высвобождении в условиях клинического применения МИ и которые признаны безопасными, проводить не требуется. Если предполагается наличие в материале МИ дополнительных выщелачиваемых веществ, которые не были обнаружены в качестве экстрагируемых веществ, то в исследование выщелачиваемых веществ включают проведение скрининга материала МИ на наличие этих веществ.
|
Рисунок 4 - Блок-схема процесса исследования выщелачиваемых веществ
В качестве альтернативы организатор испытаний может принять решение о проведении исследования выщелачиваемых веществ без предварительного выполнения других этапов процесса исследования химических свойств материалов МИ (такого, как определение профиля экстрагируемых веществ). Например, провести исследование выщелачиваемых веществ с использованием специфического экстрагента в моделируемых или ускоренных условиях экстракции, соответствующих условиям клинического применения МИ (например, МИ, предназначенного для введения жидких лекарственных средств в организм пациента). В данном случае полученный экстракт проверяют на наличие выщелачиваемых веществ методом, аналогичным методу исследования экстрагируемых веществ с такими же условиями и параметрами экстракции (см. 5.6).
Исследование выщелачиваемых веществ включает два действия: получение продукта выщелачивания и исследование продукта выщелачивания. На данном этапе процесса определения химических свойств материала условия выщелачивания должны быть ускоренными или соответствовать условиям клинического применения МИ. В любом случае условия выщелачивания, используемые для получения продукта выщелачивания, должны быть задокументированы и обоснованы.
Для исследования продукта выщелачивания следует использовать методы с соответствующей чувствительностью, селективностью и возможностью количественного определения концентраций исследуемых или отобранных выщелачиваемых веществ. В таблице 4 приведены аналитические методы, как правило, применяемые для количественной оценки выщелачиваемых веществ.
Следует выполнить валидацию аналитических методов, используемых для количественной оценки выщелачиваемых веществ, в установленном порядке (см. 6.5 и приложение F). Исследование выбранных конкретных выщелачиваемых веществ и применение аналитических методов, валидация которых проведена в установленном порядке, для их количественной оценки обеспечивают получение более точных данных о воздействии МИ на пациента по сравнению с результатами, полученными при скрининге экстрагируемых веществ.
5.9 Результаты фактического высвобождения химических веществ (профиль выщелачиваемых веществ)
Результаты исследований выбранных конкретных выщелачиваемых веществ и выщелачиваемых веществ, выявленных скринингом, концентрации которых превышают ППДК, регистрируют в отчете с целью проведения оценки потенциальных рисков, связанных с каждым высвобождаемым из МИ веществом, в соответствии с ISO 10993-17, ISO 10993-1 и ISO 14971.
5.10 Окончание процесса исследования химических свойств материалов медицинских изделий
Если результаты исследований химических свойств подтверждают эквивалентность МИ или заключение оценки токсикологического риска (согласно ISO 10993-17) о том, что экстрагируемые или выщелачиваемые вещества представляют допустимый риск для здоровья пациента, то процесс исследования химических свойств материалов МИ завершают и полученные данные используют для подтверждения результатов оценки биологического действия МИ по ISO 10993-1.
Если результаты исследований химических свойств материалов МИ не подтверждают заключение оценки токсикологического риска (согласно ISO 10993-17) о том, что экстрагируемые или выщелачиваемые вещества представляют допустимый риск для здоровья пациента, то процесс исследования химических свойств материалов МИ завершают, при этом полученные данные не используют для подтверждения результатов оценки биологического действия МИ. Решение о необходимости проведения дальнейших исследований (например, биологических испытаний) или принятии мер, минимизирующих негативное воздействие МИ на здоровье пациента, принимают в соответствии с ISO 10993-1 и ISO 10993-17.
6 Методы исследований химических свойств материалов медицинских изделий
6.1 Общие положения
В разделе 5 приведен поэтапный процесс получения качественных и количественных данных о химических свойствах материалов МИ с целью их применения для оценки риска МИ. При исследовании необходимо использовать параметры, соответствующие характеристикам материалов МИ, применяемого в клинической практике. Следует учитывать, что вследствие разнообразия МИ для исследования потребуются характеристики материала МИ, применяемого в клинической практике. Объем данных о характеристиках и параметрах, необходимых для исследования химических свойств материала, определяют в зависимости от инвазивности и длительности воздействия МИ на организм пациента при клиническом применении МИ (см. ISO 10993-1:2018, 6.1). Вид и объем данных о характеристиках материалов должны соответствовать всем параметрам, необходимым для оценки риска МИ, и учитывать условия клинического применения МИ.
Данные о химических свойствах материалов МИ получают посредством сбора информации от поставщика или анализа научных данных, а также получения информации путем исследования МИ или непосредственно материала в его исходном состоянии (например, определение характеристик пленки методом ИКС). В некоторых случаях для проведения исследования необходимо перевести в растворимую форму весь исследуемый образец или его часть. Тип и степень солюбилизации должны соответствовать задачам и цели исследования. Например, если целью исследования является:
- получение информации о композиционном составе материала (например, о наличии добавок, примесей, остатков веществ), то рекомендуется выполнять солюбилизацию, представляющую собой полное растворение или исчерпывающую экстракцию исследуемого образца;
- установление наличия в материале примесей химических элементов, то рекомендуется применять метод рассасывания материала;
- определение профиля экстрагируемых веществ исследуемого образца, при этом если выполнить полное растворение образца невозможно, то рекомендуется применять методы экстракции, такие как исчерпывающая, преувеличенная, ускоренная или моделируемая.
Следует учитывать, что экстрагенты/среды, используемые для солюбилизации, необходимо выбирать в зависимости от методов, применяемых для исследования экстрактов. При появлении во время проведения экстракции нерастворяемых видимых частиц или преципитата их также необходимо проанализировать, используя применяемый метод.
Следует учитывать, что из-за разнообразия МИ, их конструкционных материалов и условий клинического применения условия и параметры методов экстракции (моделируемой, ускоренной или преувеличенной) могут значительно отличаться. В приложении D приведены рекомендации по выбору и применению параметров и условий различных методов экстракции для исследования типичных МИ, включая выбор экстрагента, исходя из категории контакта и длительности биологического действия МИ.
В 6.2 и 6.3 приведены примеры качественных и количественных параметров экстракции (характеристик материалов МИ), которые рекомендуется применять для определения структурных характеристик и композиционного состава материалов МИ, и примеры конкретных аналитических методов исследований.
6.2 Методы исследований композиционного состава материала
Данные о композиционном составе материалов МИ необходимы для установления его биосовместимости, поэтому следует определить и учесть характеристики МИ, относящиеся к его составу. В таблице 3 приведены некоторые характеристики материалов МИ и соответствующие аналитические методы исследований.
Таблица 3 - Характеристики материалов МИ и соответствующие аналитические методы исследований
Тип материала | Характеристика | Аналитический метод исследования | Получение качест- венных данных | Получение количест- венных данных | ||
Синтетические и полимерные материалы | Количество остаточного мономера | ГХ, ЖХ (*) | X | X | ||
Состав поверхности | Фурье-ИКС | X | X | |||
РФЭС | X | X | ||||
Количество остаточного катализатора, инициаторов | Атомная спектроскопия | X | X | |||
ЖХ(*) | X | X | ||||
Количество добавок, остатков веществ технологического процесса, микропримесей | ГХ, ЖХ, ИХ (*) | X | X | |||
Примеси | Методы, основанные на дифракции рентгеновского излучения | X | - | |||
Метод определения зольности | X | X | ||||
РФ | X | X | ||||
ГХ, ЖХ, ИХ (*) | X | X | ||||
Химическая структура | Фурье-ИКС | X | X | |||
ЯМР-спектроскопия (определение содержания | X | X | ||||
Металлы и сплавы | Композиционный состав | РФ | X | X | ||
РЭМ-ЭДРС, РФЭС | X | X | ||||
Методы, основанные на сжигании пробы (определение содержания C, S) | X | X | ||||
Атомная спектроскопия | X | X | ||||
Методы газового анализа (определение содержания N, O, H) | X | X | ||||
Титрометрические методы | X | X | ||||
Гравиметрические методы | - (Amd. 1:2022) | X | ||||
Композиционный состав | Электролитический метод | X | X | |||
Колориметрический метод | X | - | ||||
Распределение вещества между | РЭМ-ЭДРС, РФЭС | X | X | |||
фазами | Электронная микроскопия | X | X | |||
Фаза или химический состав поверхности | РЭМ-ЭДРС, РФЭС | X | X | |||
Керамические материалы | Количество микропримесей, | РФ | X | X | ||
включая добавки | Атомная спектроскопия | X | X | |||
ЖХ, ГХ (*) | X | X | ||||
Содержание анионов | ИХ | X | X | |||
Композиционный состав | Методы, основанные на дифракции рентгеновского излучения | X | - | |||
Природные макромолекулы | Идентификация | Колориметрический метод | X | - | ||
ДПГЭ (*) | X | X | ||||
ГПХ/ЭХ | X | X | ||||
Химическая структура | Методы секвенирования аминокислот | X | X | |||
Фурье-ИКС | X | X | ||||
ЯМР-спектроскопия (определение содержания | X | X | ||||
| ||||||
6.3 Методы исследований экстрагируемых и выщелачиваемых веществ
Аналитические методы, которые рекомендуется применять для скрининговых исследований экстрагируемых и выщелачиваемых веществ, приведены в таблице 4.
При исследовании экстрагируемых или выщелачиваемых веществ анализу подлежат как органические, так и неорганические вещества.
Экстрагируемые органические вещества подразделяют на три класса в зависимости от их свойств летучести: ЛОВ, ПЛОС и НЛОС. Аналитические методы, применяемые для скрининга этих классов экстрагируемых органических веществ, как правило, различаются. При этом одно и то же химическое вещество можно обнаружить различными методами, например, методы ОСП-ГХ, как правило, применяют для анализа ЛОС, методы ГХ - для анализа ПЛОС, методы ЖХ - для анализа НЛОС. Методы хроматографии, предназначенные для скрининга, применяют совместно с другими методами с соответствующей чувствительностью для идентификации и концентрации экстрагируемых веществ. Экстракты, как правило, содержат смеси химических веществ, поэтому в методах хроматографии применяют различные детекторы для обнаружения конкретных веществ. Например, в методах ГХ используют ПИД и МС-детекторы, методы ЖХ применяют совместно с методом УФ-спектроскопии и МС-детекторами.
Таблица 4 - Аналитические методы исследований экстрагируемых и выщелачиваемых веществ
Тип материала | Характеристика | Аналитический метод исследования | Получение качественных данных | Получение количест- венных данных | ||
Все типы материалов | Концентрация экстрагируемых | ОСП-ГХ или ГХ с ПИД и/или МС* | X | X | ||
органических ЛОС | Методы определения ООУ | - | X | |||
Концентрация экстрагируемых | ОСП-ГХ или ГХ с ПИД и/или МС* | X | X | |||
органических ПЛОС | ВЭЖХ с УФ-спектроскопией, компьютерным моделированием, испарительным детектором светорассеяния и/или МС* | X (Amd.1:2022) | X (Amd.1:2022) | |||
Методы определения ООУ | - | X | ||||
ЯМР-спектроскопия | X | X | ||||
Концентрация экстрагируемых органических НЛОС | ВЭЖХ с УФ-спектроскопией, компьютерным моделированием, испарительным детектором светорассеяния и/или МС* | X | X | |||
ЯМР-спектроскопия | X | X | ||||
Методы определения ООУ | - | X | ||||
Методы определения НЛО* | - | X | ||||
Все типы материалов | Концентрация экстрагируемых химических элементов | ИСП-АЭС, ИСП-МС* | X | X | ||
Содержание анионов и катионов | Ионная хроматография | X | X | |||
| ||||||
Исследуемый экстракт может содержать соединения всех трех классов (ЛОС, ПЛОС и НЛОС), поэтому скрининг экстрагируемых органических веществ проводят с применением различных методов хроматографии и стратегий для обнаружения органических соединений всех трех классов. Применение конкретного сочетания методов и стратегий отделения и обнаружения, используемых для проведения скрининга, зависит от свойств экстрагируемого органического вещества, так как отсутствует такой метод хроматографии, который можно применять для одновременного исследования различных потенциально экстрагируемых органических веществ.
ГХ-МС и ЖХ-МС являются основными методами, используемыми для скрининга материала МИ на наличие экстрагируемых органических веществ, при этом по необходимости допускается применять другие аналитические методы исследований. Например, метод определения НЛО рекомендуется применять для идентификации экстрагируемых органических веществ.
Методы хроматографии применяют для скрининга экстрактов на наличие экстрагируемых органических веществ, методы атомной спектроскопии, включая атомно-абсорбционную спектроскопию, ИСП-АЭС или ИСП-МС, - для анализа экстрагируемых органических и неорганических веществ. Следует учитывать, что методы с ИСП применяют не только для анализа экстрагируемых неорганических веществ, так как некоторые химические элементы, исследуемые методами с ИСП, могут находиться как в органической, так и не в органической форме (например, S, Si, Zn).
Недостаток методов с ИСП: данными методами невозможно выявить форму, в которой химический элемент существует, поэтому это может осложнить оценку токсикологического риска МИ с применением методов с ИСП в отдельных (но не всех) случаях. Например, серу можно экстрагировать как элементарную серу или сульфат-ион либо как часть экстрагируемого органического вещества (например, меркаптобензотиазола). Данные о химической форме серы, обнаруженной методом с ИСП, требуются для проведения оценки токсикологического риска МИ, так как токсикологические характеристики серы зависят от ее формы.
Метод ИХ рекомендуется применять для скрининга экстрагируемых веществ с целью оценки экстрагированных неорганических анионов (например, фторидов, хлоридов, сульфатов) и низкомолекулярных органических кислот (например, уксусной и муравьиной кислот).
Общими методами, такими как методы определения НЛО и ООУ, оценивают общее количество экстрагируемых веществ, при этом ими невозможно выполнить идентификацию экстрагируемых веществ или определить концентрацию конкретных экстрагируемых веществ.
Дополнительная информация о применении соответствующих стратегий и аналитических методов для скрининга и определения профилей экстрагируемых и потенциально выщелачиваемых веществ приведена в [34] и [48].
Определение профиля выщелачиваемых веществ включает общую количественную оценку выявленных выщелачиваемых веществ и количественную оценку каждого конкретного выщелачиваемого вещества. Для этих целей необходимо разработать соответствующие аналитические методы и выполнить ихвалидацию. Во многих случаях те же аналитические методы, которые применяют для скрининга экстрагируемых веществ, допускается применять для исследования выщелачиваемых веществ после их соответствующей оптимизации.
6.4 Определение характеристик химических структур материалов
Характеристики химических структур материалов, входящих в состав МИ, могут влиять на биосовместимость МИ. Данные об этих характеристиках материалов требуются для обоснования использования модельных МИ и проведения оценки биологического действия МИ. В таблице 5 приведены некоторые характеристики химических структур материалов, применяемых для изготовления МИ, и соответствующие аналитические методы исследований.
Таблица 5 - Характеристики химических структур материалов, применяемых для изготовления МИ, и соответствующие аналитические методы исследований
Тип материала | Характеристика | Аналитический метод исследования | Получение качествен- ных данных | Получение количест- венных данных |
Синтетические и полимерные материалы | Химическая структура составляющих | Фурье-ИКС, спектроскопия комбинационного рассеяния света | X | X |
Кристалличность | ДСК, методы, основанные на дифракции рентгеновского излучения, спектроскопия комбинационного рассеяния света | X | X | |
Конфигурация, | Методы титрования | - | X | |
анализ боковых групп | ЯМР-спектроскопия | X | X | |
Конфигурация, наличие двойных | ИК-спектроскопия, УФ-спектроскопия | X | X | |
связей | Метод определения йодного числа | - | X | |
Конфигурация, характеристика сополимеров | ИК-спектроскопия, ЯМР-спектроскопия | X | X | |
Конфигурация цепи, активность | ЯМР-спектроскопия (определение | X | X | |
ДСК, термогравиметрический анализ | X | - | ||
Конфигурация | Золь-гель экстракция | X | - | |
цепи, наличие сшивок | ДМТА | - | X | |
Разветвление цепи | ЯМР-спектроскопия | X | X | |
Конфигурация | Реологические методы исследования | X | X | |
Молекулярная | ГПХ | - | X | |
масса и/или молекулярно- | Анализ концевых групп | - | X | |
массовое | Метод осмометрии | - | X | |
распределение | Метод статического светорассеяния | - | X | |
Метод вискозиметрии | - | X | ||
Методы седиментации | - | X | ||
МС | X | X | ||
Металлы и сплавы | Кристалло- графические фазы | Методы, основанные на дифракции рентгеновского излучения | X | - |
Микро/ макроструктура | Методы, основанные на дифракции электронов | X | - | |
Керамические материалы | Валентность | Колометрический метод | X | - |
Фазы | Методы, основанные на дифракции рентгеновского излучения | X | X | |
Микроструктура | Методы микроскопии | - | X | |
Природные | Конфигурация, | Методы титрования | - | X |
макромолекулы (см. | анализ боковой группы | Методы спектроскопии | X | X |
примечания) | Конфигурация цепи, тактичность | ЯМР-спектроскопия (определение | X | X |
ДСК | X | - | ||
Конфигурация | Золь-гель экстракция | X | - | |
цепи, наличие сшивок | Анализ дисульфидной связи | - | X | |
Природные | Конфигурация | ДМТА | - | X |
макромолекулы (см. примечания) | цепи, разветвление | Методы спектроскопии | X | X |
| ||||
6.5 Аналитические методы
Аналитические методы, используемые при исследовании химических свойств материалов/МИ, как правило, применяют для скрининга образцов на наличие химических веществ, не указанных в спецификации материала, и конкретных химических веществ, подлежащих исследованию. Целью скрининга является обнаружение исследуемых веществ, содержащихся в образце и концентрация которых превышает установленное пороговое значение (например, ППДК). Целью применения специфических аналитических методов является точное и достоверное определение концентрации выявленных и идентифицированных исследуемых веществ в образце.
Для этой цели необходимо разработать соответствующие аналитические методы и выполнить их валидацию, при этом валидация метода - это процесс подтверждения пригодности метода для конкретного применения. До разработки нового аналитического метода необходимо проанализировать действующие стандарты, монографии, научные статьи и другие источники информации для выявления подходящих методов исследований/испытаний. Перед применением аналитических методов из научной литературы их следует адаптировать и провести их валидацию в установленном порядке. Если подходящие аналитические методы не выявлены, то необходимо разработать новые соответствующие методы.
Как правило, химических веществ, подлежащих исследованию аналитическими методами, достаточно много. В связи с этим невозможно применять единственный метод для всех потенциальных исследуемых веществ, также, используя единственный метод, невозможно получить точные и достоверные значения их концентраций. Таким образом, валидацию аналитических методов для скрининга следует выполнять, по возможности, с применением набора модельных веществ, соответствующих всем исследуемым веществам. Например, если аналитический метод применяют для скрининга экстракта на наличие экстрагируемых веществ, концентрации которых превышают значения ППДК, то валидацию метода проводят с использованием набора потенциальных экстрагируемых веществ в качестве модельных веществ. Обоснование выбора модельных веществ необходимо задокументировать. В такое обоснование следует включать следующие возможные сведения: данные о веществах, указанных в композиционном составе материала, информацию о функциональных группах, полученную методами МС или хроматографии (например, сходство значений времени удерживания).
Допускается адаптировать метод, используемый для исследования образца, с целью определения концентраций конкретных химических веществ. Это может сократить число измеряемых веществ (что критично в методах скрининга), но улучшить эффективность метода, включая точность и прецизионность получаемых результатов. Специфический аналитический метод применяют для исследования небольшого числа конкретных химических веществ, поэтому валидацию метода проводят с целью установления его пригодности для исследования этих веществ.
Рекомендации по валидации аналитических методов, применяемых для исследования экстрагируемых/выщелачиваемых веществ, приведены в приложении F.
7 Отчет об исследовании химических свойств материалов медицинских изделий
Отчет об исследовании химических свойств материалов МИ оформляют с целью предоставления информации для анализа данных о химических характеристиках МИ и подтверждения (или неподтверждения) результатов оценки токсикологического риска данного МИ. В отчете указывают цель и задачи проведенного исследования химических свойств материалов МИ и приводят описание и обоснование:
a) образца исследуемого объекта (материала или МИ) и процедур его подготовки;
b) аналитических методов, условий и параметров экстракции (например, применяемого экстр-агента, длительности и числа повторных экстракций, температуры экстракции, соотношения параметров экстракции/параметров образца, метода перемешивания и скорости экстракции);
c) пригодности применяемых методов и приемлемости результатов исследований с приложением подтверждающих документов;
d) пороговых значений (например, ППДК);
e) полученных качественных данных (например, об идентификации экстрагируемых веществ, включая описание процедуры идентификации);
f) полученных количественных данных (например, значений концентраций экстрагируемых веществ, включая описание процедур и метода количественной оценки и представление данных как результатов оценочного количественного анализа, полуколичественного анализа или количественного анализа);
g) полученных данных, необходимых для оценки воздействия химических веществ материалов при клиническом применении МИ (например, количеств исследуемых веществ, выраженных в мкг/МИ).
При необходимости и целесообразности допускается идентифицированные вещества, выявленные в исследуемых экстрактах, сгруппировывать в классы химических соединений, основываясь на сходстве структурных или функциональных групп, для удобства проведения оценки токсикологического риска МИ.
Данные о химических свойствах или композиционном составе либо данные, полученные без проведения исследований организатором испытаний (например, данные, предоставленные поставщиком материала или полученные по результатам анализа источников информации по химии), рекомендуется включать в отчет, если это уместно и целесообразно. Данные, полученные из дополнительных источников информации, следует представлять в отчете по пунктам, указанным выше, и сопровождать обоснованием их применения для оценки токсикологического риска МИ.
В дополнение к данным, приведенным по пунктам, указанным выше, и относящимся к планированию и процедурам проведения исследования, а также результатам определения химических свойств материалов, необходимым для оценки токсикологического риска МИ, отчет должен содержать информацию о валидации примененных аналитических методов. Такая информация требуется для подтверждения пригодности аналитических методов для их надлежащего применения в конкретных целях.
Для упрощения оценки токсикологического риска МИ и анализа полученных результатов исследований в отчет рекомендуется включать дополнительные данные, приведенные в приложении G.
Приложение A
(справочное)
Основные принципы исследования химических свойств материалов медицинских изделий
A.1 Процесс определения химических свойств
Исследование химических свойств материала МИ является процессом получения информации, необходимой для оценки биологического действия МИ, любого токсикологического риска его компонентов или конструкционных материалов, и включает различные действия, в том числе сбор и получение информации:
- для установления композиционного состава и конфигурации МИ;
- идентификации и количественного определения экстрагируемых и/или выщелачиваемых из МИ веществ. Исследование химических свойств МИ и/или его компонентов и конструкционных материалов является обязательным этапом оценки биологической безопасности данного МИ.
A.2 Применение данных о химических свойствах
Данные о химических свойствах материала способствуют процессу оценки биологической безопасности МИ одним из трех способов, предоставляя:
- информацию о химических свойствах, которая позволяет сравнить исследуемое МИ с применяемыми в клинической практике МИ (для подтверждения эквивалентности);
- основные химические характеристики исследуемого МИ для сравнения с характеристиками, установленными в соответствующем стандарте на материал (для подтверждения соответствия);
- информацию о химических свойствах, служащую основой для оценки токсикологического риска (подтверждения безопасности).
Токсикологические проявления, связанные с применением МИ, допускается оценивать сравнением данного МИ с аналогичным изделием, используемым в клинической практике. В таком случае данные о химических свойствах используют для подтверждения эквивалентности, например:
- между исследуемым образцом (материалы, компонент или МИ) и МИ, применяемым в клинической практике (см. приложение С);
- между МИ, готовым и пригодным к продаже, и прототипом МИ;
- материала, компонента или МИ после изменения технологии обработки, исходного материала, процесса производства или применения.
На некоторые материалы МИ распространяются стандарты, устанавливающие требования к их композиционному составу (например, стандарты серии ISO 5832). Как правило, не требуется проводить исследования химических свойств материала, соответствующего такому стандарту, для подтверждения его токсикологической или биологической безопасности. При этом следует учитывать, что в процессе переработки материала и изготовления МИ может произойти проникновение в него загрязнений или остаточных технологических примесей, которые могут выщелачиваться из МИ и быть причиной проявления токсичности. При оценке готового МИ необходимо учитывать и исследовать такие выщелачиваемые вещества. Кроме того, может потребоваться оценка физических, химических, морфологических и топографических характеристик МИ, изготовленного из данного материала, для определения его общей безопасности.
При разработке нового МИ и отсутствии эквивалентного МИ, используемого в клинической практике, допускается проводить оценку токсичности МИ, обусловленной его применением, включая его компоненты или конструкционные материалы, с помощью алгоритма (процедуры) исследования химических свойств. Такой метод включает сбор, получение (например, формирование профилей экстрагируемых или выщелачиваемых веществ) и интерпретацию данных.
Алгоритм исследований химических свойств МИ (далее - алгоритм) в рамках оценки риска приведен в разделе 5. Алгоритм предусматривает выполнение следующих действий:
a) установление категории контакта МИ с организмом пациента по ISO 10993-1 (на первом этапе исследования химических свойств материалов);
b) оценка информации о химических свойствах МИ (например, достаточность собранной информации; наличие плана исследований методами экстракции, если таковые проводились), которая должна содержать следующие данные:
1) характеристику и длительность клинического воздействия МИ,
2) физическую форму используемых материалов (например, жидкая, гелеобразная, пастообразная, твердая форма или материал биологического происхождения),
3) о клиническом применении материалов.
Следует учитывать, что полученные данные должны быть достаточными для подтверждения биологической безопасности МИ;
c) определение конфигурации МИ путем описания его конструкционных материалов, которое является необходимым первым этапом при подтверждении биосовместимости изделия, так как (а) применение соответствующих конструкционных материалов увеличивает вероятность того, что МИ будет биосовместимым, и (b) наличие данных о конструкционных материалах может быть начальной точкой для установления эквивалентности МИ клинически применяемому изделию по химическим характеристикам.
Для некоторых МИ информация о конфигурации компонентов и композиционном составе материала может быть предоставлена изготовителем МИ как часть спецификации изделия или по запросу. Для других МИ такая информация может быть получена по результатам соответствующего исследования образцов. В любом случае данные о наличии в МИ технологических вспомогательных веществ и добавок [см. таблицу 3, сноски b) и d)] должны быть включены в информацию о композиционном составе материалов МИ;
d) определение композиционного состава конструкционных материалов МИ является необходимым этапом при установлении его биосовместимости, так как (а) данные о составе его отдельных материалов могут служить основой для подтверждения эквивалентности МИ клинически применяемому изделию по химическим характеристикам и (b) химические вещества, содержащиеся в конструкционном материале, могут быть экстрагируемыми и выщелачиваемыми веществами. Информация о композиционном составе материала должна включать:
1) качественные данные, описывающие его состав и устанавливающие, какие химические вещества содержатся в нем, а также количественные данные о концентрации химических составляющих материала. Количественные данные необходимы для оценки биологической безопасности МИ, так как на основе результатов идентификации и определения количеств составляющих конструкционных материалов МИ можно провести исследования токсичности каждой составляющей. Полученные данные предназначены для использования изготовителем МИ для подтверждения результатов оценки биологического действия МИ,
2) данные, приведенные в спецификации материала. Так как некоторые материалы, например полимеры, могут иметь сложные составы, то подробную информацию о составе следует запрашивать у поставщика материала. Кроме того, часть необходимой информации может быть доступна в опубликованной научно-технической литературе по химии (например, в статьях о типичной вариабельности состава или справочниках по возможным исследуемым веществам). При отсутствии таких подробных сведений о материале допускается применять соответствующие аналитические методы для получения данных о его составе;
e) определение способности МИ к высвобождению химических веществ в условиях его клинического применения для учета и оценки потенциального влияния химического состава на безопасность МИ. Любые вещества в материале или добавки, используемые при изготовлении МИ, могут выщелачиваться из него, оказывая таким образом биологическое действие на организм пациента, поэтому необходимо получить информацию о количестве выщелачиваемого вещества из МИ для оценки риска в условиях клинического применения готового МИ. Данную информацию можно получить путем проведения исследований методами экстракции МИ. Следует установить, обосновать и применять соответствующие условия и параметры экстракции для обеспечения того, что любое вещество, которое может экстрагироваться/выщелачиваться из готового МИ при его использовании, будет выделяться в среду экстракции (см. также приложение D). Исследования МИ методами экстракции проводят с целью определения общего количества экстрагируемых веществ, содержащихся в МИ/материале (исчерпывающая экстракция), или общего возможного количества экстрагируемого вещества (преувеличенная или моделируемая экстракция) для выполнения полной оценки токсикологического риска МИ. Исследования методом исчерпывающей экстракции, как правило, проводят с целью получения данных о МИ длительного или долгосрочного контакта; исследования методом преувеличенной экстракции проводят только для МИ долгосрочного контакта при соответствующем обосновании.
Вне зависимости от методов получения экстракта его количественный анализ проводят для сбора данных с целью их применения для оценки токсикологического риска МИ (см. ISO 10993-17).
В зависимости от особенностей и источников собираемой информации для успешного завершения исследований химических свойств МИ в соответствии с настоящим стандартом может потребоваться наличие специалистов со знаниями и опытом в области материаловедения или аналитической химии для получения и проведения анализа необходимых качественных и количественных данных, применяемых для оценки безопасности МИ. Также необходимы знания и опыт в области токсикологии для анализа химических соединений различных типов, которые могут представлять токсикологическую опасность, и для того, чтобы специалисты в области материалов и химии могли планировать соответствующие исследования.
Исследование химических свойств МИ, алгоритм которого представлен в настоящем стандарте, проводят в рамках первоначальной оценки биосовместимости МИ. Следует учитывать, что МИ, находящееся на рынке, является биологически безопасным только до тех пор, пока конструкционные материалы и технология его изготовления остаются неизменными. Необходимо установить контроль за тем, чтобы поставщик материалов не мог вносить изменения в состав материала, поставляемого под конкретным коммерческим наименованием или по договорам о поставках без предварительного уведомления изготовителя МИ. Изготовитель МИ должен оценить и задокументировать последствия любых заявленных изменений для биологической безопасности МИ.
A.3 Порог предельно допустимой концентрации
Важным этапом исследований экстрагируемых/выщелачиваемых веществ является анализ жидкого образца (например, экстракта, гидролизата) для обнаружения, идентификации и количественного определения солюбилизированных (экстрагируемых или выщелачиваемых) веществ. Для токсикологической оценки следует применять аналитические методы, которыми можно обнаруживать, идентифицировать и количественно определять вещества, солюбилизированные в экстракте и потенциально воздействующие на здоровье пациентов, контактирующих с МИ. Следует учитывать, что не все действия по определению химических свойств веществ, например идентификация, могут быть выполнены. При отсутствии достоверных данных об идентификации или достаточной токсикологической информации для исследуемых химических веществ допускается проводить оценку вероятного риска с применением токсикологических порогов. Для веществ, концентрации которых ниже заданного порогового значения, не требуется проводить дополнительное исследование химических свойств, включая идентификацию и количественную оценку. Следует учитывать, что пороговые значения не допускается применять для оценки веществ из групп веществ с установленной высокой токсичностью.
Если пороговое значение выражено дозой вещества, то его не применяют в аналитических методах исследований жидкого образца. При этом допускается преобразовывать такие пороговые значения в значения концентраций соответствующими математическими методами с учетом клинического применения МИ и экспериментальных условий получения жидкого образца. Значение ППДК является тем порогом, при превышении которого химик-аналитик должен предоставить информацию (о концентрации вещества и его идентификации), необходимую для оценки токсикологического риска МИ/материала (например, см. ISO 10993-17). Вещество, содержащееся в жидком образце концентрацией ниже ППДК, относят к веществам, имеющим допустимый токсикологический риск, и его не подвергают дополнительной оценке, т.е. количественной оценке или идентификации.
ППДК не применяют при исследовании МИ специфическими аналитическими методами, в которых анализируемые вещества являются химическими соединениями, данные о токсикологической безопасности которых достаточны для проведения оценки биологического действия МИ по ISO 10993-17.
Рекомендации по определению и применению ППДК приведены в приложении E.
A.4 Исследование химических свойств в рамках оценки биологического действия медицинских изделий
Основной целью стандартов серии ISO 10993 является обеспечение защиты людей от потенциальных биологических рисков, возникающих при применении МИ. Данную цель достигают путем проведения биологической оценки МИ, которая включает средства получения биологических данных [методы испытаний (исследований)] и их интерпретации в рамках оценки риска.
Как правило, информацию о биосовместимости МИ получают по результатам проведения исследований двух видов: (1) исследований химических свойств с учетом соответствующих токсикологических данных и (2) биологических испытаний. В оценку риска МИ следует включать необходимое сочетание химических и биологических данных, которое может варьироваться в зависимости от особенностей МИ. Если результаты исследований обоих видов сопоставимы и относятся к одной и той же биологической конечной точке, то допускается применять результаты одного из исследований (испытаний) для решения задач в этой конечной точке. При этом, насколько это возможно, рекомендуется применять методы in vitro (см. ISO 10993-2). При получении противоречивых результатов в двух видах исследований in vitro для оценки биосовместимости МИ следует использовать результаты биологических испытаний методами in vivo (при условии соответствующей чувствительности), так как они предназначены непосредственно для биологических систем.
Общую оценку биологического действия МИ методами in vivo можно разделить на две категории исследований: исследования, по результатам которых оценивают системное воздействие МИ на организм человека (т.е. зависящее от распределения в организме человека экстрагируемых или выщелачиваемых веществ), и местные воздействия (т.е. воздействия, происходящие в конкретном месте контакта МИ с организмом человека). Данные о химических свойствах МИ/материалов в наибольшей степени необходимы для методов исследований, применяемых для оценки системных эффектов или конечных точек (например, системной токсичности), чем для методов исследований местного воздействия МИ на организм человека (например, раздражение кожи и имплантация). Конечные точки местного и системного воздействия (например, сенсибилизацию) допускается рассматривать при исследовании химических свойств МИ при наличии надежных и достаточных данных токсикологии.
Обоснование проведения исследований химических свойств МИ/материала вместо биологических испытаний должно быть задокументировано.
Приложение B
(справочное)
Источники информации для определения химических свойств материалов
B.1 Общие положения
Сведения о составе МИ являются основой оценки биологического действия и токсикологического риска изделия (см. ISO 10993-1 и ISO 10993-17). В соответствии с ISO 10993-1:2018, 6.1 тип материала и количественные данные о его химических свойствах должны соответствовать всем параметрам, которые необходимы для оценки риска МИ, и учитывать клиническое применение МИ. Для сбора данных о химических свойствах материала МИ может потребоваться анализ большого числа источников информации (см. B.2-B.4), в том числе опубликованной научно-технической литературы по химии.
B.2 Информация от поставщика материала
Следующая информация, при ее наличии, необходима для четкой идентификации материала, применяемого для изготовления МИ (например, сырье и основные исходные материалы, технологические добавки), при этом наличие информации о химическом составе материала является обязательным при проведении количественной оценки риска:
a) наименование изготовителя или поставщика материала;
b) торговое наименование материала;
Примеры - Силастик®, Дакрон®, Теторон®, Пеллетан®, Нейлон, Тефлон®*.
_______________
* Силастик®, Дакрон®, Теторон®, Пеллетан®, Нейлон, Тефлон® являются примерами коммерчески доступных материалов. Данная информация приведена для удобства пользователей настоящего стандарта и не является рекламой ISO данных продуктов.
c) идентификационные данные химического вещества [например, номер Химической реферативной службы (Chemical Abstracts Service, CAS)] или наименование по номенклатуре Международной организации по теоретической и прикладной химии (IUPAC)/наименования лекарственных средств, зарегистрированных в США (USAN) (см. В.5);
d) код и номер продукта;
Пример - Пеллетан 2393-80АЕ, метилвинилполисилоксан 0215.
e) спецификация материала, включающая, например, чистоту, содержание и количество примесей, молекулярную массу, распределение молекулярной массы, термические свойства, предел прочности при растяжении, твердость по Роквеллу, модуль изгиба, электропроводность и другие свойства в дополнение к общим характеристикам, описанным в 5.2;
f) сведения о композиционном составе и рецептуре материала (см. 5.2), например номер CAS (см. В.5.2), массовая доля в процентах (%) каждого химического вещества в материале, функция каждой химической составляющей, структура и формула каждого химического вещества.
Примечание - Характеристики компонентов, наиболее часто применяемых для изготовления МИ, приведены в стандартах (например, ASTM F136-13), стандартные спецификации для ELI (ультрамелкозернистого) сплава ковкого титана-6 алюминия-4 ванадия, применяемого для изготовления хирургических имплантатов, - в фармакопеях;
g) сертификаты соответствия региональным руководствам и международным нормативам (например, Регламент регистрации и оценки химических веществ Европейского союза (REACH), непрямые пищевые добавки).
B.3 Методы исследований химических свойств
B.3.1 Общие положения
В дополнение к разделу 6 в B.3.2-B.3.5 приведено несколько примеров методов исследований химических свойств материалов.
B.3.2 Общепринятые методы химических исследований, направленные на оценку биологического действия МИ
Данные методы, установленные в международных стандартах и национальных руководствах или стандартах, предназначенных для обеспечения безопасности МИ, как правило, используют для предварительной оценки химической опасности МИ. При этом их применение для прогнозирования возможной биологической опасности МИ ограничено. Ниже приведены примеры из таких документов:
Пример 1 - Международный документ OECD Test N 120 [17].
В данном документе [17] приведена процедура исследования химических свойств полимеров в растворе/экстракте в воде при температуре 20°C (pH = 2 и pH = 9) и при температуре 37°C (pH = 7). Для определения общей концентрации полимеров в водной среде рекомендуется измерить ООУ. Также в указанном документе приведены другие более точные методы.
Пример 2 - JP XVII [21], USP 41 [22] или Ph. Eur. Ed. 9 [20].
В документах [21] и [20] описаны методы определения зольности тяжелых металлов экстрагируемых веществ, таких как содержание перманганата калия и определение остатка при выпаривании, в [22] - методы исследований для определения кислотности/щелочности, УФ-поглощения, ООУ, концентраций экстрагируемых металлов и полимерных добавок, биосовместимости материалов.
B.3.3 Качественный анализ
Если требуется информация о составе и/или рецептуре материала, при этом имеющиеся качественные данные являются неполными или недоступны, то следует провести исследование его химических свойств. В зависимости от потребности в информации следует получить качественные или количественные данные.
Многие аналитические методы, используемые для определения химических свойств материалов, применяют как для количественного, так и качественного анализа. Целью качественного анализа является идентификация химических составляющих образца. Целью количественного анализа является установление содержания или количества каждой отдельной химической составляющей в образце, независимо оттого, идентифицирован этот компонент или нет. Так как оценка токсикологического риска МИ/материала, как правило, основана как на идентификации (определении токсического потенциала составляющей), так и на концентрации (определении воздействия), то проведение качественного и количественного анализов является обязательным.
Примечание - Полуколичественный анализ может быть достаточным для предварительной оценки риска МИ/материала, а количественный анализ может потребоваться для определения конкретного риска (например, при выявлении низкого уровня безопасности после проведения полуколичественного анализа).
B.3.4 Количественный анализ конкретных токсичных химических веществ для оценки воздействия
Если в результате количественного анализа материала в нем выявлены химические вещества, представляющие токсикологическую опасность, то следует провести качественный и специфический анализ. Специфичность, чувствительность и количественный предел применяемого аналитического метода должны быть достаточными для требуемого уровня оценки риска.
B.3.5 Качественные и количественные аналитические методы
Для определения композиционного состава и рецептуры материала рекомендуется применять ЯМР-спектроскопию с ослабленным полным отражением Фурье-ИКС и пиролитическую ГХ/МС, для идентификации и количественного определения экстрагируемых веществ в экстрактах МИ или материала - методы хроматографии с надлежащими методами обнаружения (например, ГХ и ЖХ в сочетании с МС), для определения содержания химических веществ в экстрактах или продуктах кипячения МИ/материалов - методы с применением ИСП, при этом следует учитывать, что данными методами не устанавливают форму химического элемента. Такие аналитические методы следует применять для получения недостающих надлежащих и адекватных данных о составе и/или рецептуре материала МИ.
B.4 Национальные и международные стандарты на материалы и/или медицинские изделия
В большинстве стандартов на материалы или МИ установлены требования к качеству материалов в зависимости от клинического применения МИ. Если материал, используемый в МИ, соответствует такому стандарту и категория и длительность контакта данного МИ с пациентом сопоставимы с требованиями стандарта, то допускается указывать наименования и обозначения стандарта для подтверждения свойств материала. Применимость данных стандартов для подтверждения химических свойств материалов зависит от следующих факторов.
a) Распространяется ли стандарт на конкретное МИ, указаны ли в стандарте категория и длительность контакта МИ с пациентом?
b) С какой степенью конкретности стандарт определяет материал (например, конкретный материал, тип материала)? Какие характеристики материала в нем установлены?
c) Устанавливает ли стандарт предельно допустимые значения содержания конкретных химических веществ в материале? Являются ли эти предельно допустимые значения исчерпывающими, конкретными, общими или совокупными?
d) Существует ли опыт безопасного клинического применения стандартизованного МИ или материала?
Чем больше этих факторов отражено в стандарте, тем надежнее будут подтверждены химические свойства материала МИ.
Примечание - Следует учитывать, что применение стандартов на материал может быть недостаточным, так как при изготовлении, обработке и включении материалов в конечное МИ может произойти изменение их химических характеристик. Например, производственный процесс МИ, изготовленных из металлических материалов, требования к которым установлены в национальных или международных стандартах, может оказать негативное воздействие на биосовместимость МИ, так как остатки смазочных жидкостей, применяемых в процессе резания на станках с числовым программным управлением (ЧПУ), могут быть не полностью удалены.
B.5 Представление описания химических свойств материалов
B.5.1 Общее наименование материала
Приводят общее наименование материала, при этом следует указывать его конкретное химическое наименование.
Примечание - Общие наименования материалов могут вводить в заблуждение. Например, общее наименование материала "полиэстер", его относят к классу полимеров, состоящих из эфирных связей, но, как правило, его применяют для полиэтилентерефталата.
B.5.2 Другие системы классификации и описания химических свойств материалов
B.5.2.1 Общие положения
Для идентификации материала рекомендуется использовать официальные системы классификации.
B.5.2.2 Номенклатура и структурная формула полимерных химических веществ IUPAC
Комиссией по макромолекулярной номенклатуре IUPAC опубликованы правила обозначения полимеров [37]. Обозначения и описание полимеров, согласно этим правилам, должны содержать точные характеристики, включая структурные формулы, полимерных веществ в соответствии с их определением. При этом следует учитывать, что для коммерчески доступных полимеров не всегда приводят информацию о примесях, которые они содержат.
B.5.2.3 Регистрационный номер/наименование CAS, USAN, REACH
CAS и USAN присваивают номер и наименование новым разработанным полимерным материалам, например материалам для контактных линз. Если применяемому материалу присвоен номер CAS и/или наименование USAN, то его легко отличить от схожих, но не идентичных материалов. Подробную информацию о химических составляющих/ингредиентах материала можно получить в USAN.
Регистрационный номер REACH, как правило, обозначает регистрацию REACH, при этом он предоставляет ссылку на базу данных Европейского агентства по химическим веществам (ЕСНА), содержащую необходимую информацию, такую как сведения об идентификации вещества, его чистоте, идентификации и содержании примесей.
B.6 Общая информация о химическом составе материала
Как правило, для описания химического состава используемого материала применяют несколько характеристик. Эти характеристики отличаются в зависимости от категорий материалов. Для описания синтетических полимеров применяют такие характеристики, как молекулярная масса и распределение по молекулярным массам, температура стеклования, точка плавления, плотность, растворимость и набухание.
Примечание - Для описания синтетических полимеров допускается применять международный документ OECD, Test N 118:1996, Section 1 [16].
B.7 Мастер-файл материала
При рассмотрении заявления на разрешение на реализацию конкретного МИ рекомендуется применять соответствующий защищенный мастер-файл. Как правило, такой мастер-файл содержит подробную информацию о рецептуре конкретного материала, используемого в МИ, или о его обработке. Мастер-файл также является источником информации, предоставляемой третьими лицами. Мастер файл следует использовать при подтверждении соответствия материала или его пригодности для конкретного клинического применения. Содержание мастер-файла является коммерческой тайной или коммерческой конфиденциальной информацией.
Приложение C
(справочное)
Подтверждение биологической эквивалентности материалов
C.1 Общие положения
Как указано в 5.3, может потребоваться сравнить новое или модифицированное МИ/материал с серийно выпускаемым и применяемым в клинической практике МИ/материалом. В настоящем приложении к термину "МИ" относят также и материалы. Цель сравнения - установление биологической эквивалентности нового или модифицированного МИ серийно выпускаемому МИ, т.е. возможность распространения подтвержденных результатов оценки биосовместимости серийно выпускаемого МИ на новое или модифицированное МИ.
C.2 Понятие "биологическая эквивалентность"
Понятие "биологическая эквивалентность" состоит из следующих понятий (см. рисунок С.1):
- "химическая эквивалентность", т.е. два МИ/материала имеют приблизительно одинаковые химические характеристики, при этом их состав и переработка (производственный процесс) не приводят к появлению новых дополнительных или отличающихся токсикологических показателей;
- "физическая эквивалентность", т.е. два МИ/материала имеют приблизительно одинаковые физические характеристики, при этом их конфигурация, морфологические, топографические (согласно ISO/TS 10993-19) и трибологические свойства не приводят к появлению новых дополнительным или отличающихся показателей биосовместимости;
- "эквивалентность материалов", т.е. химическая эквивалентность и физическая эквивалентность двух МИ/ материалов подтверждены;
- "эквивалентность контактов", т.е. два МИ/материала предназначены для приблизительно одинакового клинического применения, при этом конечные точки оценки биологического действия, установленные в ISO 10993-1:2018, A.1, совпадают;
- "биологическая эквивалентность", т.е. эквивалентность материалов и эквивалентность контактов двух МИ/материалов подтверждены.
|
Рисунок C.1 - Схема понятия "биологическая эквивалентность"
C.3 Процесс подтверждения биологической эквивалентности
На рисунке C.2 приведена блок-схема процесса подтверждения биологической эквивалентности двух МИ.
|
Рисунок C.2 - Блок-схема процесса подтверждения биологической эквивалентности двух МИ
Если биологическая эквивалентность подтверждена, то оценку биологического риска нового или модифицированного МИ завершают, а результат этой оценки считают положительным.
Если биологическая эквивалентность не подтверждена, то биосовместимость нового или модифицированного МИ может быть установлена только на основе анализа категории контакта МИ, химических, физических, токсикологических и биологических характеристик.
C.4 Примеры подтверждения химической эквивалентности
Ниже приведен перечень примеров для подтверждения химической эквивалентности (в соответствии с 5.3) при условии, что соблюдены требования химической эквивалентности:
a) состав или профиль экстрагируемых веществ исследуемого материала МИ эквивалентен (т.е. в его состав входят такие же химические вещества, их содержание такое же или менее и в нем отсутствуют новые химические вещества) материалу МИ, серийно выпускаемого и применяемого в клинической практике, а также отсутствуют значительные различия в физических, химических, морфологических и топографических характеристиках, влияющих на биологическую безопасность МИ.
Примечание - Если выявлено незначительное увеличение содержаний каких-либо химических веществ, то допускается обосновывать химическую эквивалентность в рамках статистической вариабельности используемых полуколичественных методов. Для этих целей рекомендуется применять калибровочные стандарты для определения различных химических веществ и их концентраций;
b) в качестве сопоставимого объекта применен материал МИ, прошедшего клинические испытания при более инвазивном воздействии, но при сопоставлении он рассмотрен как объект с менее инвазивным воздействием, т.е. менее инвазивное воздействие согласно ISO 10993-1 - это более краткосрочный контакт или категория контакта, соответствующая наименьшему числу конечных точек;
c) химический компонент или остаточные количества химических веществ в материале МИ, применяемого в клинической практике, заменяют химическим компонентом или остаточными химическими веществами исследуемого материала, при этом уровень токсикологической безопасности этих веществ должен быть не хуже, чем у химического компонента или остаточных химических веществ, которые они заменяют, при условии аналогичного воздействия МИ на организм пациента;
d) единственным отличием между исследуемым материалом и материалом МИ, применяемого в клинической практике, является то, что у исследуемого материала отсутствуют добавки/загрязнения/остатки или их уровень менее, чем у материала МИ, применяемого в клинической практике;
e) единственным отличием между исследуемым материалом и материалом МИ, применяемого в клинической практике, является то, что исследуемый материал изготавливают в условиях, сохраняющих либо сокращающих количество и/или концентрации экстрагируемых веществ по сравнению с материалом МИ, применяемого в клинической практике;
f) исследуемый материал используют в МИ, применяемом в клинической практике, и это МИ устанавливают в то место, в котором предполагается использование нового МИ, при этом продолжительность контакта между пациентом и МИ сокращают;
g) исследуемый материал и материал МИ, применяемого в клинической практике, соответствуют актуальным и установленным требованиям к композиционному составу.
Приложение D
(справочное)
Рекомендации по проведению исследований химических свойств материалов методами экстракции
D.1 Общие положения
Получение информации при исследовании химических свойств МИ и/или его конструкционных материалов, как правило, представляет собой двухэтапный процесс, при проведении которого МИ или материал экстрагируют, и затем экстракт подвергают химическому анализу для определения экстрагируемых веществ. Экстракцию выполняют с целью формирования профиля экстрагируемых веществ, который равен или превышает профиль выщелачиваемых веществ, образующихся при клиническом применении МИ, при этом не вызывая негативных последствий для материала (таких как деградация) или профиля экстрагируемых веществ (таких как изменение химического состава экстрагируемых веществ). Определяют профиль экстрагируемых веществ, который, по меньшей мере, такой же, как и профиль выщелачиваемых веществ МИ, и учитывают выщелачиваемые вещества и их концентрации. При определенных условиях (например, при выполнении исчерпывающей экстракции) в профиле экстрагируемых веществ может быть сильно преувеличено фактическое высвобождение химических веществ из материала, т.е. экстрагируемые вещества представляют все возможные выщелачиваемые вещества при их максимально возможной концентрации. При этом следует учитывать, что все выщелачиваемые вещества необязательно будут присутствовать в профиле экстрагируемых веществ. Условия и параметры методов исследования экстрагируемых веществ значительно отличаются от условий и параметров моделируемой экстракции, включая применяемые растворители и методы экстракции, поэтому ими невозможно полностью выявить каждое выщелачиваемое вещество, наблюдаемое при проведении исследования методом моделируемой экстракции. Это необходимо учитывать при планировании анализа экстрагируемых веществ и определении точки завершения процесса исследования химических свойств материала (согласно рисунку 1).
Исследование химических свойств материала МИ является общим термином, представляющим несколько отдельных действий с различными целями (например, анализ композиционного состава, формирование профиля экстрагируемых веществ), поэтому применяют различные методы проведения экстракции, средства осуществления которых зависят от целей исследования. Таким образом, методы экстракции, применяемые для определения композиционного состава материалов МИ, отличаются от методов экстракции, используемых для определения свойств экстрагируемых веществ МИ в условиях его клинического применения.
Характеристику химических свойств МИ/материала проводят со следующими целями:
- определение конфигурации МИ или композиционного состава конструкционных материалов (методами рассасывания, растворения или исчерпывающей экстракции);
- определение наихудшего профиля экстрагируемых веществ МИ/материала, общего количества экстрагируемых веществ (при выполнении исчерпывающей экстракции) либо максимального количества веществ, которые могут быть экстрагированы при заданных условиях исследования, превышающих клинические условия применения МИ (метод преувеличенной или ускоренной экстракции);
- определение профиля экстрагируемых веществ МИ/материала в условиях клинического применения (при выполнении моделируемой экстракции);
- корреляции результатов исследований химических свойств МИ/материала с результатами биологических испытаний, проведенных по стандартам серии ISO 10993.
Далее в настоящем приложении приведены рекомендации по условиям и параметрам проведения экстракции, необходимым для достижения указанных целей.
Вне зависимости от типа экстракция является сложным процессом, на который влияют различные факторы, включая время, температуру, соотношение площади поверхности образца и объема экстрагента, свойства экс-трагента и распределения веществ в пробе. Как правило, условия экстракции не должны изменять объект исследования, если это не обосновано, так как эти изменения могут повлиять на количество и/или тип экстрагируемых веществ, высвобождаемых из исследуемого МИ. Таким образом, при выборе экстрагента следует учитывать химические свойства исследуемого материала для того, чтобы избежать или усилить (например, при исследованиях растворимости) солюбилизацию основного материала.
В соответствии с ISO 10993-12:2012, 3.8, условия экстракции должны быть, по меньшей мере, такими же агрессивными, как условия клинического применения МИ. При этом для исследований экстрагируемых и выщелачиваемых веществ следует избегать применения в качестве экстрагента таких растворителей, которые могут вызвать значительное набухание и/или нарушить целостность исследуемого МИ/материала. Значительное набухание МИ/материала может привести к уменьшению количества экстрагента, что может повлиять на концентрацию экстрагируемых веществ и привести к неточным результатам исследований. Следует учитывать, что во время экстракции может произойти уменьшение количества экстрагента вследствие его испарения. При этом не рекомендуется компенсировать количество испарившегося экстрагента путем добавления новых порций экстрагента после завершения экстракции, а рекомендуется применять соответствующие меры по предотвращению испарения экстрагента (например, закрыть контейнеры с образцами) или измерить конечный объем экстракта для дальнейшего выполнения расчетов на устройстве, применяемом для определения экстрагируемых веществ. Результат измерения объема экстрагента с целью учета компенсации его потери при экстракции вследствие набухания МИ/материала может быть недостоверным, так как количество экстрагента, повлиявшее на набухание МИ/материала, неизвестно и его трудно определить. В любом случае следует измерить окончательный объем экстракта и включить эти данные в отчет для выполнения дальнейших вычислений на устройстве, применяемом для определения экстрагируемых веществ. Также следует учитывать, что чрезмерное набухание МИ/материала может вызвать его разрушение, образование твердых частиц, экстрагируемых и выщелачиваемых веществ, которых в другом случае не было бы. Поэтому чрезмерное набухание МИ/материала при экстракции может привести к получению недостоверных результатов измерений.
Выбор экстрагента зависит от конкретных целей исследований методами экстракции. Для исследования имплантатов долгосрочного контакта, как правило, применяют в качестве экстрагентов как минимум два растворителя различной полярности, например полярный и неполярный растворители, соответствующие ISO 10993-12. Для исследований МИ/материала, не контактирующего с организмом пациента, допускается применять один экстрагент, характеристики которого подобны характеристикам среды, в которой предполагается клиническое применение МИ. В любом случае выбор экстрагента для исследований должен быть обоснован и задокументирован.
Примечание - В некоторых странах, таких как США, для исследований имплантатов долгосрочного контакта рекомендуется использовать в качестве экстрагентов растворители трех видов (например, полярный, неполярный и полуполярный), если требуется.
Перечень растворителей, применяемых в качестве экстрагентов для исследований МИ/материалов, приведен в таблице D.1. Растворители, приведенные в таблице D.1, являются рекомендуемыми, их применение в качестве экстрагентов не является обязательным.
МЕРЫ БЕЗОПАСНОСТИ - При использовании опасных растворителей необходимо соблюдать требования охраны труда.
Таблица D.1 - Перечень растворителей, применяемых в качестве экстрагентов для исследований МИ/материалов
Растворитель | Индекс полярности | Точка кипения, °C | |
Полярный | Вода | 10,2 | 100 |
Полуполярный | Диметилсульфоксид | 7,2 | 189 |
Ацетонитрил | 5,8 | 82 | |
Метанол | 5,1 | 65 | |
Ацетон | 5,1 | 56 | |
Этанол | 4,3 | 78 | |
Тетрагидрофуран | 4,0 | 65 | |
Полуполярный | n-пропиловый спирт | 4,0 | 97 |
i-пропиловый спирт | 3,9 | 82 | |
Дихлорметан | 3,1 | 41 | |
Неполярный | Толуол | 2,4 | 111 |
Циклогексан | 0,2 | 81 | |
Гептан | 0,1 | 98 | |
n-Гексан | 0,1 | 69 | |
| |||
Индекс полярности, разработанный Снайдером, был эмпирически выведен из данных о растворителях, как правило, используемых в методах хроматографии (неподвижные фазы в ГХ и подвижные фазы в ЖХ) [49]. Были предложены другие схемы классификации для определения экстрагирующей способности растворителей. Например, Хансен (Hansen) расширил параметр растворимости Гильдебранда '![]() ' [36] с учетом эффекта дисперсионных сил, дипольных моментов и водородных связей. Если известны параметры растворимости Хансена как для материалов, так и для растворителей, то можно выполнить оценку взаимодействия между материалами и растворителями; материалы с аналогичными параметрами растворимости могут взаимодействовать друг с другом, что приводит к сольватации, взаимному проникновению или набуханию. Любое из этих свойств материалов и растворителей допускается использовать для обоснования выбора экстрагента для исследований. Stults и др. (см. [52]) собрана информация о совместимости пластиков и эластомеров с некоторыми используемыми растворителями.
' [36] с учетом эффекта дисперсионных сил, дипольных моментов и водородных связей. Если известны параметры растворимости Хансена как для материалов, так и для растворителей, то можно выполнить оценку взаимодействия между материалами и растворителями; материалы с аналогичными параметрами растворимости могут взаимодействовать друг с другом, что приводит к сольватации, взаимному проникновению или набуханию. Любое из этих свойств материалов и растворителей допускается использовать для обоснования выбора экстрагента для исследований. Stults и др. (см. [52]) собрана информация о совместимости пластиков и эластомеров с некоторыми используемыми растворителями.
Индекс полярности бинарных смесей вычисляют на основе индекса полярности (Р) и объемной доли (Ф) каждого растворителя смеси [49] по формуле
![]() , (D.1)
, (D.1)
где
|
D.2 Подходы к определению конфигурации медицинского изделия или композиционного состава конструкционных материалов
Термины "композиционный состав", применяемый к материалу, и "конфигурация", применяемый к МИ, являются синонимами, так как они оба означают, какие химические вещества содержатся в исследуемом МИ и в каких количествах. Как правило, применяют методы неразрушающего контроля для определения композиционного состава и конфигурации МИ, для этого выполняют солюбилизацию исследуемого образца и проводят химический анализ полученного раствора. Солюбилизацию образца, если необходимо, проводят несколькими методами, включая рассасывание или растворение.
Для определения элементного состава керамических, металлических или полимерных материалов рекомендуется применять метод рассасывания образца с использованием соответствующего химического вещества (например, сильной кислоты, основания или фермента). При рассасывании образца химическая форма его составляющих, как правило, нарушается, и составляющие переходят в свою элементарную форму. Метод рассасывания образца, как правило, не применяют для оценки экстрагируемых веществ, при этом данным методом можно получить информацию о композиционном составе материала и установить абсолютное и максимальное общее количество элементарных веществ, содержащихся в образце.
Метод растворения, как правило, применяют для определения химического состава полимерных материалов или природных макромолекул с использованием соответствующего органического растворителя и установления неповрежденных органических и/или неорганических составляющих в образце. После растворения исследуемого образца с применением подходящего экстрагента проводят анализ экстракта. Анализ экстракта рекомендуется проводить, выполнив повторную преципитацию самого полимера антирастворителем и фильтрацию. Метод растворения, как правило, не применяют для оценки клинического действия МИ (за исключением тех случаев, в которых МИ/материал растворяется при клиническом использовании), при этом данным методом можно получить информацию о композиционном составе материала и установить абсолютное и максимальное общее количество составляющих в образце. Если применение данного метода предусмотрено в исследовании, то следует рассмотреть возможность проведения совместной преципитации химических компонентов (составляющих), отличных от основного полимера.
Комбинации растворителей/антирастворителей для исследования полимеров приведены в таблице D.2 (см. также [28]-[31], [33], [43]).
Таблица D.2 - Комбинации растворителей/антирастворителей для исследования полимеров
Полимер | Растворитель | Антирастворитель | ||
Полиэтилен (высокой плотности) | Ксилол | Ацетон, метанол, эфир | ||
Полиэтилен (низкой плотности) | Толуол | Метанол, ацетонитрил | ||
Полипропилен (общий) | Толуол | Метанол, ацетонитрил | ||
Полипропилен (атактический) | Общие углеводороды | Этилацетат, изопропиловый спирт | ||
Полипропилен (изотактический) | Ксилол | Ацетон, метанол, эфир | ||
Полибутадиен | Углеводороды, бензол | Бензин, спирты, эфиры, кетоны | ||
Полиизопрен | Бензол | Бензин, спирты, эфиры, кетоны | ||
Полиамиды | Гексафторизопропанол, муравьиная кислота, диметилформамид, м-крезол | Метанол, ацетонитрил | ||
Полиуретаны | Диметилформамид | Метанол, эфир | ||
Полиэстеры (за исключением полиэтилентерафталата) | Толуол, хлороформ, бензол | Метанол, этанол, изопропиловый спирт, эфир | ||
Политилентерафталат* | Тетрагидрофуран, м-крезол, о-хлорофенол | Метанол, ацетон | ||
Поликарбонат | тетрагидрофуран, дихлорметан | Метанол, этанол, ацетонитрил | ||
Поли(метил метакрилат) | Толуол, хлороформ, ацетон, тетрагидрофуран | Метанол, этанол, ацетонитрил, петролейный эфир | ||
Поли(винил хлорид) | Толуол, тетрагидрофуран, дихлорметан | Метанол, этанол, гексан, ацетонитрил | ||
Поли(винилиден хлорид) | Тетрагидрофуран, диоксан, кетоны, бутилацетат | Углеводороды, спирты, фенолы | ||
Поли(виниловый спирт) | Вода, формамид | Бензин, ароматические углеводороды, спирты | ||
Полистирол | Толуол, хлороформ, циклогексанон, дихлорметан | Метанол, этанол, ацетонитрил (Amd.1:2022) | ||
Поли(акрилонитрил-бутадиен-стирол) | Толуол, ацетон | Метанол, этанол, ацетонитрил (Amd.1:2022) | ||
Полисульфон | Тетрагидрофуран | Градиент тетрагидрофуран - вода | ||
Резины | Толуол, хлорированные углеводороды | Метанол, ацетонитрил кетоны, эфиры | ||
Эфиры целлюлозы | Ацетон, эфиры | Алифатические углеводороды | ||
| ||||
ACN = ацетонитрил;
| ||||
| ||||
________________
* Текст документа соответствует оригиналу. - .
В настоящем приложении не приведены дополнительные сведения о методах рассасывания и растворения, так как эти методы значительно отличаются при применении к каждому конкретному материалу.
Рекомендации по проведению исчерпывающей экстракции приведены в ISO 10993-12:2012, приложение D. Методом исчерпывающей экстракции определяют максимальные количества экстрагируемых веществ, которые могут быть высвобождены (экстрагированы) из МИ/материала, таким образом устанавливают верхнюю границу количества выщелачиваемых веществ, которые потенциально могут быть высвобождены из МИ/материала при клиническом применении/в течение срока службы. Во многих случаях методом исчерпывающей экстракции можно получить такие же результаты, что и методами рассасывания и растворения, при этом не выполняя солюбилизацию МИ.
Для исследования имплантируемых МИ долгосрочного контакта рекомендуется применять метод исчерпывающей экстракции. Применение метода преувеличенной экстракции необходимо обосновать. Следует учитывать, что если общее количество экстрагируемых веществ после исчерпывающей экстракции (или обоснованной преувеличенной экстракции) имплантируемого МИ долгосрочного контакта превышает допустимую дозу суточной экспозиции, то необходимо выполнить, например, следующее: оценить проведением повторного анализа методом моделируемой экстракции кинетику экстракции для определения максимального количества вещества, высвобождаемого в сутки, или провести исследование выщелачиваемых веществ, если это возможно. Для получения конкретных данных о кинетике экстракции, необходимых для оценки риска МИ/материала, рекомендуется проконсультироваться с токсикологом.
Метод исчерпывающей экстракции (см. 3.15) заключается в проведении последовательной экстракции образца в соответствующих условиях и с применением соответствующего экстрагента до тех пор, пока количество вещества, экстрагируемого из МИ/материала, на следующем этапе экстракции, определяемое гравиметрическим или другим методом, составит менее 10% от количества экстрагируемого вещества в исходном экстракте. Получение требуемого 10%-ного количества для каждого отдельного экстрагируемого вещества может быть затруднено с аналитической и практической точки зрения (например, если 10%-ный уровень менее значения стандартной неопределенности в LOQ методе). Таким образом, может возникнуть необходимость определения 10%-ного уровня альтернативными способами (например, по общей площади пика, общей концентрации ООУ, НЛО). Применение альтернативных способов должно быть обосновано. В некоторых случаях 10%-ный уровень невозможно получить при проведении допустимого числа последовательных экстракций. В этих случаях допускается использовать альтернативные способы экстракции (например, с применением экстрагента с большей экстрагирующей способностью) для того, чтобы получить 10%-ный уровень после проведения допустимого числа последовательных экстракций. Также рекомендуется определить воздействие МИ на организм пациента в течение срока службы МИ на основе последовательно экстрагируемых веществ в заданных количествах, даже если 10%-ный уровень не получен.
В ISO 10993-12:2012, приложение D, приведен перечень экстрагентов [метанол, ацетон, изопропанол-гексан (50:50) и гексан], которые рекомендуется применять, если необходимо, в предварительных исследованиях с целью оптимизации числа последовательных экстракций, а также установлены условия экстракции и тип экстрагента (включая указанные выше), в которых не происходит изменение химических свойств образца и экстрагируемого вещества. Вне зависимости от конкретных выбранных параметров экстракции, на каждом этапе исчерпывающей экстракции следует применять единые параметры экстракции.
Для выполнения отдельных этапов последовательной исчерпывающей экстракции применяют различные методы и оборудование. Методы жидкой экстракции, применяемые для исследований полимеров, разделены на две категории - "традиционные" и "современные". Традиционные методы, включая экстракцию Сокслета, кипячение с использованием обратного холодильника, экстракцию при встряхивании и обработке ультразвуком, являются простыми методами, в которых применяют стандартное лабораторное оборудование. Так как традиционные методы применяют в течение продолжительного времени, их возможности и эффективность подтверждены и задокументированы. При этом данные методы имеют существенные недостатки, включая низкую эффективность и длительность проведения экстракций, а также применение больших количеств вредных веществ в качестве экстрагентов. Данные недостатки отсутствуют у современных методов экстракции, включая микроволновую экстракцию, экстракцию при высоком давлении и экстракцию сверхкритическими флюидами, в которых, как правило, используют оборудование для повышения температуры и/или давления до заданных значений, необходимых для проведения экстракции или улучшения экстрагирующей способности экстрагента [26], [51]. При этом следует учитывать, что современные методы не обязательно лучше традиционных. При использовании традиционного или современного метода необходимо учитывать их технические и практические особенности и соответствие клиническому применению МИ.
Рекомендуется проводить минимальное число последовательных экстракций с применением добавок и ингредиентов, не подверженных деградации.
Методами исчерпывающей экстракции определяют составляющие образца и количества этих составляющих. При проведении исчерпывающей экстракции экстрагируемые и выщелачиваемые вещества рассматривают как общее выщелачивание, т.е. в профиль исчерпывающих экстрагируемых веществ включают "все составляющие (экстрагируемые вещества) МИ, являющиеся полностью выщелачиваемыми веществами" в условиях клинического применения. Профиль исчерпывающих экстрагируемых веществ необходим для оценки токсикологического риска в условиях клинического применения только конкретных МИ (например, имплантатов долгосрочного контакта, как указано ранее). При этом во многих случаях выщелачивание МИ в условиях клинического применения не является исчерпывающим, и, таким образом, по результатам исследований альтернативными методами экстракции, такими как преувеличенная или моделируемая экстракция, можно сформировать соответствующий профиль экстрагируемых веществ для оценки токсикологического риска других МИ. Следует учитывать, что в условиях клинического применения некоторые МИ (такие, как рассасывающиеся МИ) могут способствовать химическому преобразованию составляющих в другие вещества, например в продукты деградации или побочные продукты. Если такое же химическое преобразование не происходит во время исследования образца методами экстракции (например, исчерпывающей экстракцией/растворением), то результаты, полученные методом исчерпывающей экстракции, не являются точными и не отражают в полной мере воздействие химических веществ на пациента во время клинического применения МИ. В таких случаях для оценки безопасности МИ могут потребоваться данные о потенциальных промежуточных и окончательных химических продуктах, включая продукты деградации, в сочетании сданными о химических свойствах материалов и процессе имплантации. Информацию о процессе/продуктах деградации следует включать в оценку токсикологического риска любого МИ, даже если продукты деградации в экстрактах не обнаружены.
D.3 Метод преувеличенной экстракции для определения наихудшего профиля экстрагируемых веществ
В соответствии с 3.16 экстрагируемые вещества определяют как вещества, высвобождаемые из МИ или конструкционного материала с применением экстрагентов и/или в лабораторных условиях. При этом условия экстракции для определения конфигурации МИ и композиционного состава материала, как правило, являются более жесткими, чем условия клинического применения МИ, поэтому экстрагируемые вещества, выявляемые в исследованиях, не обязательно будут определены в качестве выщелачиваемых веществ из МИ в условиях клинического применения. В разделе 5 приведены рекомендации по проведению оценки МИ с наихудшим профилем выщелачиваемых веществ, т.е. полного выщелачивания из МИ всех ингредиентов и добавок. Если по результатам оценки токсикологического риска посредством моделирования наихудшего профиля выщелачивания веществ из МИ установлено, что риск, связанный с общим количеством ингредиентов и добавок, является приемлемым, то оценку риска завершают и МИ считают пригодным для клинического применения без проведения дополнительных исследований его химических свойств.
Если по результатам оценки токсикологического риска МИ методом исчерпывающей экстракции установлено, что МИ с наихудшим профилем выщелачиваемых веществ не является безопасным, то следует провести менее жесткую и более соответствующую клиническому применению МИ преувеличенную экстракцию для определения профиля выщелачиваемых из МИ веществ. Условия преувеличенной экстракции наиболее точно отражают условия клинического применения МИ. При этом метод преувеличенной экстракции рекомендуется применять для исследований МИ с ограниченным и длительным сроком службы.
Метод преувеличенной экстракции применяют с целью получения профиля экстрагируемых веществ из МИ, который, по меньшей мере, является настолько же полным и сложным, как и наихудший профиль выщелачиваемых веществ. Это означает, что профиль экстрагируемых веществ включает все выщелачиваемые вещества и количества экстрагируемых веществ соответствуют или превышают наибольшие количества выщелачиваемых веществ. Методом преувеличенной экстракции определяют в рамках одной экстракции наибольшее количество экстрагируемых веществ, которые потенциально могут высвобождаться из МИ/материала как выщелачиваемые вещества во время клинического применения. Преувеличенную экстракцию проводят в условиях, в которых один или более параметров экстракции превышен(ы) по сравнению с условиями клинического применения. Например, преувеличенную экстракцию рекомендуется проводить с применением одного или более условия(ий), приведенного(ых) ниже:
- температура экстракции превышает температуру клинического применения МИ (т.е. ускоренная экстракция, см. D.4);
- длительность экстракции превышает длительность клинического применения МИ;
- у применяемого экстрагента экстрагирующая способность превышает экстрагирующую способность раствора, который опосредует контакт между пациентом и МИ при его клиническом применении;
- соотношение "площадь поверхности МИ/объем контактного раствора" при проведении экстракции превышает соотношение "площадь поверхности МИ/объем контактного раствора", воздействующее на пациента в условиях клинического применения;
- проведение исчерпывающей (последовательной) экстракции МИ кратковременного или длительного контакта.
Для планирования и обоснования условий и параметров преувеличенной экстракции необходимо применять достоверные и точные данные. Следует учитывать, что условия и параметры преувеличенной экстракции, выбранные для исследования одних МИ/материалов, могут быть неприменимы для исследований других МИ/материалов.
Если применение преувеличенной экстракции невозможно обосновать или невозможно экспериментально подтвердить ее результаты, то данный метод не рекомендуется применять для получения информации о химических свойствах материала с целью проведения оценки токсикологического риска МИ.
При применении метода преувеличенной экстракции необходимо учитывать эффект преувеличения как при планировании исследования, так и при интерпретации результатов. Одним из способов учета преувеличения является применение коэффициента преувеличения (значение, на которое в методе преувеличенной экстракции увеличивают значения параметров клинического применения МИ). При этом допускается применять другие способы. Коэффициент преувеличения устанавливают на основе оценки условий и параметров экстракции, а также условий и параметров клинического применения МИ. Коэффициент преувеличения следует использовать для корректировки результатов исследований методом преувеличенной экстракции для оценки токсикологического риска экстрагируемых веществ. Если количество экстрагируемых из образца веществ в два раза превышает количество веществ, экстрагируемых из клинически применяемого МИ, или соотношение площади контактной поверхности образца и объема контактного раствора при экстракции увеличено в два раза по сравнению с клинически применяемым МИ, то необходимо учитывать данное преувеличение при предоставлении данных об экстрагированных веществах для оценки токсикологического риска МИ. Следует учитывать, что при значительном преувеличении соотношения "площадь поверхности образца/объем контактного раствора" невозможно выполнить пропорциональное преувеличение профиля экстрагируемых веществ и сложно вычислить коэффициент преувеличения. Также при количественной оценке преувеличения условий и параметров экстракции следует контролировать получение равновесных концентраций экстрагируемых веществ (т.е. поддержание условий достаточного разбавления исследуемых растворов).
В настоящем стандарте не приведены рекомендации по проведению преувеличенной экстракции для исследования конкретных МИ вследствие большого разнообразия МИ и их назначения. При этом ниже приведены некоторые рекомендации, которые следует учитывать при выборе условий и параметров преувеличенной экстракции МИ/материалов.
При выборе и обосновании экстрагента для проведения преувеличенной экстракции следует учитывать pH (для водных сред) и полярность (для органических и модельных органических сред). Показатель pH является параметром преувеличенной экстракции только для кислотных или щелочных экстрагируемых веществ (т.е. показатель pH экстрагента не влияет на экстракцию нейтральных или неионизируемых экстрагируемых веществ). Для исследования экстрагируемых кислотных веществ (например, стеариновой кислоты) методом преувеличенной экстракции рекомендуется использовать экстрагент со значением pH более значения pH раствора, применяемого для обеспечения контакта МИ с пациентом при клиническом применении. Для исследования экстрагируемого щелочного вещества (например, дибензиламина) методом преувеличенной экстракции рекомендуется использовать экстрагент со значением pH менее значения pH раствора, применяемого для обеспечения контакта МИ с пациентом при клиническом применении. Показатель pH не влияет на уровень аккумуляции нейтрального экстрагируемого вещества при условии, что данное нейтральное соединение не является реактивным в зависимости от значения pH.
Полярность экстрагента является параметром преувеличенной экстракции при исследовании нейтральных экстрагируемых веществ. Например, при проведении преувеличенной экстракции рекомендуется использовать экстракт со значительным содержанием спирта по сравнению с раствором, применяемым для обеспечения контакта МИ с пациентом при клиническом применении.
Одним из параметров преувеличенной экстракции является температура (см. D.4).
Условия и параметры преувеличенной экстракции не должны изменять профиль экстрагируемых веществ. Например, проведение преувеличенной экстракции при максимальных значениях температуры может привести к распаду экстрагируемых веществ или изменению материалов МИ (например, отверждение, сшивка или деградация полимерных конструкционных материалов МИ, изменение физического состояния материала при температуре стеклования), любое из которых может привести к измененному профилю экстрагируемых веществ.
Если в методе экстракции преувеличены несколько параметров (например, температура и площадь поверхности), то необходимо учесть и обосновать возможность одновременного выполнения нескольких измерений.
Так как при значительно преувеличенных условиях и параметрах экстракции могут быть получены измененные профили экстрагируемых веществ, то рекомендуется при необходимости минимизировать преувеличения, уменьшая потенциальные осложняющие эффекты, такие как деградация. Коэффициент преувеличения условий и параметров экстракции зависит от конкретного МИ и условий его клинического применения, поэтому для каждого конкретного МИ/материала в отчете об исследовании следует представить заключение о том, является ли преувеличение условий и параметров экстракции обоснованным или чрезмерным. Следует учитывать, что чрезмерное преувеличение условий и параметров экстракции может привести к получению профиля экстрагируемых веществ, корреляцию которого с профилем экстрагируемых веществ, получаемым в условиях клинического применения МИ, невозможно выполнить. Изменение характеристик и свойств образца и/или экстрагируемых веществ в процессе экстракции не допускается, поэтому в отчете об исследовании следует привести обоснование преувеличения любых условий и параметров экстракции с учетом возможности изменений физических и химических характеристик образца и/или экстрагируемых веществ в процессе исследований.
При проведении оценки токсикологического риска МИ применение параметров и условий преувеличенной экстракции должно быть обосновано и задокументировано. В обоснование применения параметров и условий преувеличенной экстракции, приведенное на основе научных данных, рекомендуется включать сведения о проведенных соответствующих исследованиях.
В отчете следует приводить подробное описание любых преувеличений параметров и условий, происходящих в процессе экстракции или исследования экстрактов, для обеспечения получения надлежащих и точных результатов оценки риска и безопасности МИ, а также для подтверждения того, что преувеличенные параметры и условия экстракции должным образом учтены при оценке риска и безопасности МИ.
D.4 Методы моделируемой и ускоренной экстракции для определения профиля экстрагируемых веществ
Метод преувеличенной экстракции применяют для определения наихудшего профиля выщелачиваемых из МИ веществ. Если при оценке токсикологического риска (см. раздел 5) установлено, что риск применения МИ с наихудшим профилем экстрагируемых веществ является допустимым, то оценку риска завершают, МИ признают пригодным для клинического применения по назначению и исследования его химических свойств дополнительно не проводят.
Если при оценке токсикологического риска подтвержден риск применения МИ с наихудшим профилем экстрагируемых веществ, то далее определяют профиль выщелачиваемых из МИ веществ. Профиль выщелачиваемых веществ определяют методом моделируемой экстракции, условия проведения которой приблизительно одинаковы с условиями клинического применения МИ или условиями ускоренной экстракции, длительность которой менее длительности клинического применения МИ.
Метод моделируемой экстракции применяют для определения профиля экстрагируемых веществ, который совпадает с профилем выщелачиваемых веществ при клиническом применении МИ. Методом моделируемой экстракции устанавливают фактическое количество экстрагируемых веществ, которые будут высвобождаться как выщелачиваемые вещества из МИ/материала во время клинического применения/срока службы. Моделируемую экстракцию проводят в тех случаях, когда условия клинического применения невозможно обеспечить в лаборатории или в условиях потенциального клинического применения образец невозможно исследовать аналитическими методами на выщелачиваемые вещества. Если условия клинического применения можно смоделировать в лаборатории и полученный экстракт исследовать аналитическими методами на выщелачиваемые вещества, то допускается не проводить моделируемую экстракцию, а рекомендуется выполнить исследование выщелачиваемых веществ.
Моделируемую экстракцию проводят при параметрах и условиях (т.е. температуре и длительности), имитирующих условия клинического применения МИ. Моделируемую экстракцию допускается проводить с применением экстрагента, экстрагирующая способность которого приблизительно одинакова с экстрагирующей способностью раствора, используемого для обеспечения контакта между пациентом и МИ в условиях клинического применения. Рекомендации по применению условий, параметров и экстрагентов в методе преувеличенной экстракции приведены в D.3, их допускается использовать в методе моделируемой экстракции с учетом места и категории контакта МИ с организмом пациента. Например, если при клиническом применении МИ предполагается:
- контакт с кровью пациента, то в качестве экстрагента рекомендуется применять раствор этанола в воде. Если применяют раствор "этанол/вода", то необходимо подтверждение сопоставимости количеств целевых выщелачиваемых веществ по отношению к крови (например см. [38]). Допускается в качестве экстрагента применять другие растворы, если требуется;
- использование водного раствора для обеспечения контакта МИ с организмом пациента, то соответствующим (оптимальным) имитирующим экстрагентом является физиологический раствор с заданным значением pH или солевой раствор с заданными значением pH и химическим составом. Если при клиническом применении для обеспечения контакта МИ с организмом пациента предполагается использование нескольких растворов с различными значениями рН (например, наборы инфузионных растворов), то следует применять два экстрагента с заданными значениями pH, например раствор со значением pH, равным 2, и буферный раствор со значением pH, равным 10 (см [40]). Если в клинической практике применяют растворы, у которых диапазон значений pH менее указанного диапазона, то в качестве экстрагентов для моделируемой экстракции допускается использовать растворы с диапазоном меньших значений рН;
- использование липофильного раствора (например, липидных эмульсий, лекарственных средств, содержащих такие агенты, как полисорбат 80) для обеспечения контакта МИ с организмом пациента, то необходимо определить и обосновать применение соответствующего экстрагента для проведения исследований методом моделируемой экстракции. Во многих случаях в качестве экстрагента рекомендуется использовать раствор с заданным соотношением "спирт/вода". С целью определения и обоснования количественного соотношения "спирт/вода" в органоподобных растворах рекомендуется использовать соответствующую информацию, например [38].
Информация о растворителях, которые рекомендуется использовать для имитации биологических жидкостей, приведена в [24], [44], [47]. В настоящем стандарте не приведены рекомендации по применению в методе моделируемой экстракции в качестве экстрагентов растворов, подходящих для МИ, контактирующих с кожными покровами или тканью/костью/дентином. Применение любого раствора в качестве экстрагента в методе моделируемой экстракции должно быть установлено и обосновано для каждого конкретного МИ/материала.
В план исследований методом моделируемой экстракции следует включать условия и параметры, соответствующие условиям и параметрам клинического применения МИ. Например, в моделируемой экстракции используемое соотношение "площадь поверхности образца/объем экстрагента", по возможности, должно соответствовать соотношению "площадь поверхности МИ/объем контактного раствора", применяемому в клинической практике. Например, для инфузионных систем рекомендуется применять площадь поверхности МИ и объем инфузата. При этом невозможно обосновать соотношение "площадь поверхности имплантируемых МИ/объем контактного раствора", так как сложно установить объем физиологической жидкости, которая будет контактировать с МИ на протяжении всего периода его нахождения в организме пациента. Следует учитывать, что моделируемую экстракцию не выполняют последовательно, за исключением МИ повторного или многократного применения.
Исследование некоторых МИ (например, МИ долгосрочного контракта) рекомендуется проводить методом ускоренной моделируемой экстракции. Например, ускоренную экстракцию проводят при температуре, превышающей температуру клинического применения МИ, и с длительностью менее длительности клинического применения. Ускоренную экстракцию следует проводить в условиях теплового воздействия на образец, аналогичных условиям теплового воздействия на МИ при клиническом применении (т.е. передача тепловой энергии должна быть одинакова). Дополнительно ускорению процесса экстракции способствует взбалтывание образца или применение рециркулирующих или текучих растворов в качестве экстрагентов. При этом параметры указанных ускорителей процесса экстракции при проведении количественной оценки учесть невозможно.
Если метод ускоренной экстракции необходимо осуществить путем моделирования условий и параметров длительного и инвазивного контакта МИ с организмом пациента, то для подтверждения и обоснования применения данного метода требуется наличие данных о кинетике экстракции.
Ускоренную экстракцию длительностью менее 24 ч нецелесообразно применять для исследования МИ кратковременного контакта, для исследования таких МИ используют условия и параметры их клинического применения. Ускоренную экстракцию длительностью менее трех дней нецелесообразно применять для исследования МИ, длительность контакта которых составляет три дня или менее, для исследования таких МИ используют условия и параметры их клинического применения. Метод ускоренной экстракции целесообразно применять для исследования МИ, длительность контакта которых составляет более трех дней.
Условия и параметры ускоренной экстракции должны быть полностью и четко обоснованы. Следует учитывать, что одинаковое обоснование использования условий и параметров ускоренной экстракции может быть неприемлемо для исследования различных МИ/материалов.
В настоящем стандарте не приведены общие для всех МИ/материалов рекомендации для разработки и обоснования применения условий и параметров ускоренной экстракции, а также коэффициентов их ускорения. Для разработки и обоснования применения условий и параметров ускоренной экстракции, а также коэффициентов их ускорения для конкретных МИ/материалов следует использовать данные, полученные при анализе источников информации в области химии.
При выборе условий и параметров, а также при проведении ускоренной экстракции следует учитывать воздействие высоких температур и других параметров на кинетику экстракции и обеспечить идентичность исследуемых экстрагируемых веществ экстрагируемым веществам МИ, применяемого в клинической практике. Оптимальными условиями и параметрами ускоренной экстракции являются такие, которые сокращают длительность экстракции до значения, меньшего, чем продолжительность клинического применения МИ, при этом не приводят к изменению химических характеристик самого МИ или профиля и количества экстрагируемых веществ. Модель или принцип, применяемая(ый) для установления коэффициентов ускорения или преувеличения, следует обосновать и задокументировать.
D.5 Экстракции, проводимые для установления корреляции между результатами исследований химических свойств и результатами биологических исследований
Как правило, корреляцию между результатами исследований химических свойства МИ/материала и результатами биологических испытаний проводят с целью:
- установления причины получения конкретного результата биологического испытания по определению химического вещества;
- подтверждения точности результата биологического испытания по определению химического вещества или набора химических веществ.
Коэффициент корреляции между значениями химических характеристик МИ/материала [как правило, это профиль экстрагируемых веществ (качественное и/или количественное содержание экстрагируемых веществ)] и результатами биологического испытания будет лучше, если исследование химических свойств материала и биологическое испытание проведены с применением одного и того же экстракта. Для получения приемлемых результатов корреляции исследования следует проводить методами экстракции, установленными в ISO 10993-12:2012 (раздел 10, приложение C). По возможности, необходимо применять одинаковые условия и параметры получения экстракта в биологическом испытании и исследовании химических свойств материала. Данное требование, как правило, выполнимо для таких параметров экстракции, как соотношение "площадь поверхности образца/объем экстрагента", время экстракции и длительность экстракции. При выборе экстрагента, пригодного как для одного, так и для другого исследования (испытания), могут возникнуть трудности. В ISO 10993-12:2012, C.7, установлено, что растворители, выбранные для экстракции (для биологического испытания), должны быть пригодными для использования в определенных биологических тест-системах. При этом следует учитывать, что данное требование может затруднить проведение исследования химических свойств конкретного МИ/материала, так как экстрагент, подходящий для биологического испытания, может быть неприемлемым для исследования химических свойств. В таких случаях следует применять модельный экстрагент для проведения исследования химических свойств МИ/материала или скорректировать экстракт для биологического испытания таким образом, чтобы он стал приемлемым для проведения исследования химических свойств МИ/материала аналитическими методами. При этом модельный экстрагент должен иметь экстрагирующую способность, аналогичную экстрагирующей способности экстрагента, использованному в биологическом испытании. Если применяют химическую обработку экстракта (например, дериватизацию), то необходимо соблюдать осторожность во избежание изменения химических свойств одного или более экстрагируемых веществ.
В ISO 10993-12:2012, 10.3.5, приведены следующие экстрагенты, подходящие для биологического испытания, включая:
- полярные растворители, такие как вода, физиологический раствор, культуральная среда, не содержащая сыворотку;
- неполярные растворители, такие как свежее рафинированное растительное масло;
- дополнительные растворители, такие как этанол/вода, этанол/физиологический раствор, полиэтиленгликоль 400 (разбавленный до физиологического осмотического давления), диметилсульфоксид и культуральная среда с сывороткой.
Экстракты, полученные с применением указанных экстрагентов, используют как для исследования химических свойств, так и биологических испытаний МИ/материалов, поэтому необходимо установить корреляцию между результатами этих исследований (испытаний). Такие экстракты могут содержать воду, физиологический раствор, этанол/воду, этанол/физраствор и диметилсульфоксид.
Другие экстрагенты, приведенные ранее, могут быть пригодными или непригодными для применения в исследовании химических свойств МИ/материалов аналитическими методами. Если установлено, что экстрагент пригоден для применения в исследовании химических свойств МИ/материалов аналитическими методами, то этот экстрагент следует применять и для биологического испытания, и для исследования химических свойств. Если экстракт, полученный с применением экстрагента, невозможно исследовать аналитическими методами, то для исследования химических свойств МИ/материала необходимо использовать модельный экстрагент.
Так как модельный экстрагент применяют для обнаружения химических агентов, ответственных за результат биологического исследования, то любой модельный экстрагент, обеспечивающий достижение этой цели, является пригодным. Растворители, которые рекомендуется применять в качестве модельных экстрагентов для исследования химических свойств материалов МИ, соответствующие требованиям по своим экстрагирующим способностям и пригодные для проведения исследований аналитическими методами, приведены в таблице D.3. Следует учитывать, что применение данных модельных экстрагентов не гарантирует получение требуемых результатов исследования, при этом их использование обеспечивает возможность проведения исследования и, как правило, получение положительных результатов. При применении выбранных модельных экстрагентов следует предоставлять обоснование с результатами биологических испытаний, подтверждающими, что данные химические вещества не оказывают биологического действия на образец. Также для этих целей в обосновании допускается приводить сведения из научной литературы.
Данные рекомендации по применению модельных экстрагентов относятся исключительно к установлению корреляции результатов биологического испытания и исследования химических свойств МИ/материалов и могут быть не пригодны при формировании профиля экстрагируемых веществ для оценки токсикологического риска МИ/ материалов. Так как релевантность модельных экстрагентов может варьироваться в зависимости от целей исследований, то допускается применять другие модельные экстрагенты, если они соответствуют двум требованиям: экстракт, полученный с применением таких экстрагентов, можно исследовать аналитическими методами, и экстрагирующие способности этих экстрагентов аналогичны экстрагирующим способностям заменяемых экстрагентов.
Таблица D.3 - Растворители, рекомендуемые в качестве модельных экстрагентов для применения при корреляции результатов исследования химических свойств и биологического испытания МИ/материалов
Растворитель, применяемый в качестве модельного экстрагента в биологическом испытании | Растворитель, применяемый в качестве модельного экстрагента в исследовании химических свойств |
Вода | Вода |
Физиологический раствор | Физиологический раствор |
Этанол/вода | Этанол/вода |
Этанол/физиологический раствор | Этанол/физиологический раствор |
Диметилсульфоксид | Диметилсульфоксид |
Культуральная среда, не содержащая сыворотку | 1/9 (объем/объем) этанол/физраствор |
Растительное масло | 1/1 (объем/объем) этанол/вода |
Полиэтиленгликоль 400 | 1/3 (объем/объем) этанол/вода |
Культуральная среда, содержащая сыворотку | 2/3 (объем/объем) этанол/физраствор |
| |
В ISO 10993-12:2012, 10.3.5 примечание 1, указано, что для биологического исследования МИ/материалов "можно использовать другие экстрагенты, соответствующие свойствам и применению изделия или методам определения опасности, при наличии сведений об их действии на материал и биологическую систему". Если эти "другие экстрагенты" пригодны как для биологического испытания, так и для исследования химических свойств МИ/ материала, то такие экстрагенты допускается применять для проведения данного исследования (испытания). Если эти "другие экстрагенты" не пригодны для исследования химических свойств МИ/материала аналитическими методами, то следует определить и обосновать применение модельного экстрагента.
Вследствие различной чувствительности методов, применяемых для биологических испытаний и исследований химических свойств МИ/материала, для установления корреляции может потребоваться выполнить корректировку некоторых параметров экстракции, таких как отношение экстрагируемой площади поверхности МИ/матери-ала к объему экстрагента.
Приложение E
(справочное)
Определение порога предельно допустимой концентрации и его применение
E.1 Общие положения
Аналитические методы, используемые для скрининга экстракта на наличие экстрагированных веществ, предназначены:
a) для обнаружения экстрагируемых веществ;
b) различения экстрагируемых веществ таким образом, чтобы каждое экстрагируемое вещество предоставляло уникальный отклик;
c) получения идентификационных данных о конкретном экстрагируемом веществе;
d) определения концентрации экстрагируемого вещества.
При применении методов хроматографии для скрининга экстрактов на экстрагируемые органические вещества следует учитывать, что данные методы являются более эффективными для обнаружения экстрагируемых веществ и менее эффективными для точной идентификации или количественной оценки экстрагируемых веществ.
При исследовании экстрагируемого вещества необходимо учитывать опасность для организма пациента, которую экстрагируемое вещество может представлять в качестве выщелачиваемого вещества. Если экстрагируемое вещество невозможно идентифицировать, то оценку токсикологического риска по ISO 10993-17 не проводят. Также, если количественная оценка экстрагируемого вещества выполнена недостаточно точно, то результаты любой оценки токсикологического риска будут недостоверными.
В настоящем приложении приведены рекомендации по применению количественной оценки для исследования экстрагируемых из МИ/материалов веществ, основываясь на ППДК.
Пороговые значения, такие как уровень ПТО, устанавливают дозу выщелачиваемого вещества (и других потенциально токсичных компонентов) из МИ, т.е. то количество, менее которого вещество не является токсичным для организма пациента независимо от своих свойств. Следует учитывать, что высокотоксичные вещества (например, группа особо опасных веществ) необходимо исключить из исследований с применением ПТО, в том числе до применения ППДК, так как их содержание в МИ не допускается (см. ISO 10993-17). Также следует выполнить оценку любых компонентов конкретного МИ по отдельности независимо от ППДК.
Выщелачиваемые вещества, содержащиеся в МИ в количестве менее значения ПТО, соответственно считают безопасными, поэтому их дополнительную оценку (идентификацию и количественную оценку) проводить не требуется. Пороговые значения (например, ПТО) с учетом факторов неопределенности аналитического метода являются предельными значениями для обоснования необходимости проведения идентификации, так как вещества, доза которых соответствует пороговому значению или превышает его, следует идентифицировать для оценки их безопасности. Вещества, доза которых менее порогового значения, считают безопасными с допустимо низким токсикологическим риском без проведения их идентификации.
Методы исследований с использованием пороговых значений допускается применять к экстрагируемым веществам в том случае, если экстрагируемые вещества предназначены для определения наихудшего профиля выщелачиваемых веществ из МИ.
При применении пороговых значений требуется преобразовать пороговое значение, основанное на ПТО, в пороговое значение, основанное на ППДК, так как, выполнив такое преобразование, можно будет оценить токсикологический риск экстрагируемого вещества на основе его концентрации.
Таким аналитическим порогом для оценки токсикологического риска экстрагируемых или выщелачиваемых веществ является ППДК. Следует провести идентификацию и количественную оценку экстрагируемых веществ, концентрация которых превышает значения ППДК, в качестве предварительной оценки их токсикологического риска, так как данные экстрагируемые вещества, возможно, могут быть токсичными. Идентификацию или количественную оценку экстрагируемых веществ, концентрация которых не превышает значения ППДК, для оценки их токсикологического риска не проводят.
Допустимая суточная доза (ДСД) вещества - наименьшая доза, оказывающая выраженный негативный эффект на организм человека, установлена для отдельных металлов [19], при этом пороговое значение на основе дозы - порога допустимой дозы (ПДД), применимой ко всем металлам, не установлен. В связи с этим ППДК применим только к экстрагируемым или выщелачиваемым органическим веществам.
Взаимосвязь между ППДК и аналитическими пределами, такими как предел обнаружения (LOD) и LOQ, заключается в следующем. В связи с тем, что ППДК является порогом, для которого требуется выполнить идентификацию и количественную оценку вещества, ответственного за отклик, аналитический отклик должен быть различим на фоне аналитического шума (обнаружения) до идентификации исходного химического соединения. Значение ППДК должно превышать или быть равным LOD, иначе если ППДК будет менее LOD, то аналитическим методом невозможно будет получить отклик при необходимых уровнях концентрации соответствующих химических соединений. Если LOD невозможно определить для соединений, обнаруженных во время процесса скрининга, то допускается применять LOD для исследования одного или более соответствующих модельных веществ или внутренних стандартов, а также для всех химических соединений, для исследования которых данный метод является подходящим. Если одной из целей аналитического исследования является количественная оценка, то значение ППДК должно превышать или быть равным LOQ. Результаты полуколичественного анализа концентрации, полученные при скрининге, могут не соответствовать требованиям достоверности и точности LOQ, и в этом случае значение ППДК будет менее определенного значения LOQ. Результаты определения концентрации вещества менее установленного LOQ могут быть недостаточно точными для подтверждения обоснованности оценки токсикологического риска МИ/материала. Следует учитывать, что ППДК является порогом, для которого требуется выполнить идентификацию таким образом, чтобы полученные результаты содержали более сложную и/или расширенную информацию, чем результаты количественной оценки (т.е. количество вещества определяют, как правило, при концентрациях, значения которых менее значений, необходимых для идентификации). В таком случае значение ППДК может быть более значения LOQ, но при этом все равно будет невозможно идентифицировать исследуемый компонент в образце при данном значении ППДК.
E.2 Определение порога предельно допустимой концентрации
Для преобразования ПТО в ППДК требуется наличие данных:
- о частоте и длительности клинического применения МИ;
- параметрах и условиях экстракции, использованных для формирования профиля экстрагируемых веществ;
- неопределенности аналитического метода.
По длительности клинического применения МИ определяют фактическое значение, используемое для порога, основанного на дозе (например, поэтапный ПТО, основанный на длительности применения МИ) [18], при этом по частоте клинического применения МИ устанавливают значение клинического воздействия. ППДК, мкг/см![]() , вычисляют по формуле
, вычисляют по формуле
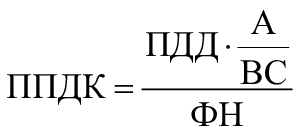 , (E.1)
, (E.1)
где A - число МИ, экстрагированных для получения экстракта;
B - объем экстракта, см![]() ;
;
C - клиническое воздействие МИ (число МИ, воздействующих на пациента в течение суток в условиях стандартной клинической практики);
ПДД - например, ПТО или порог относительной безопасности ПОБ, мкг/сут (при выборе конкретного порога, необходимого для оценки риска МИ, требуется проконсультироваться с токсикологом);
ФН - фактор неопределенности, который рекомендуется применять для учета аналитической неопределенности методов скрининга, используемых для расчета концентраций экстрагируемых веществ в экстракте (в E,3 приведены рекомендации по определению соответствующего значения ФН).
Обработку экстракта (например, любые этапы разбавления или концентрирования) следует учитывать при расчете аналитической концентрации и соответственно корректировать значения ППДК при вычислении.
Примеры определения ППДК в различных условиях экстракции приведены для иллюстрации в Е.4, но не являются обязательными для применения. В примерах использованы различные значения данных, необходимых для расчета ППДК (например, ФН).
Примечание - При вычислении ППДК имплантатов долгосрочного контакта по формуле (Е.1) рекомендуется учитывать данные и кинетические свойства исследуемых компонентов.
E.3 Определение фактора неопределенности
Количественную оценку профиля экстрагируемых веществ выполняют разными методами, которые различаются по уровню достоверности расчетной и полученной концентрации. Значение ФН может значительно варьироваться в зависимости от применяемого метода количественной оценки. Например, в некоторых случаях при проведении количественной оценки используют внутренний стандарт для нормализации откликов, полученных для всех значимых исследуемых веществ, и определения концентрации каждого исследуемого вещества, допуская предположение о том, что исследуемые вещества реагируют одинаково между собой и по отношению к внутреннему стандарту. В зависимости от обоснованности данного предположения полученные таким образом результаты оценки концентрации химических веществ могут иметь значительно различающиеся неопределенность и точность. Если предположение верно и реакции постоянны, то результаты оценки концентрации всех исследуемых веществ будут точными. Если предположение неверно и реакции сильно различаются, то результаты оценки концентрации исследуемых веществ будут неточными. В других случаях уровень неопределенности может быть низким. Например, если результаты количественной оценки получены за счет применения подтвержденных стандартов, используемых в аналитических методах, валидация которых выполнена в установленном порядке, то полученные результаты оценки концентраций химических веществ будут точными. Если количественную оценку выполняют с применением внутреннего стандарта (при условии, что предположение, указанное выше, верно и реакции постоянны), то результаты оценки концентраций всех исследуемых веществ также будут достаточно точными для оценки токсикологического риска МИ. | |
Другими методами количественной оценки можно получить значения концентраций, уровень неопределенности которых ниже, чем уровень неопределенности результатов определения концентраций, полученных с использованием внутреннего стандарта, и выше, чем уровень неопределенности результатов определения концентраций, полученных с использованием калибровочной кривой, сгенерированной с применением эталонного стандарта. Например, относительная чувствительность может быть получена для экстрагируемых веществ, если она представляет собой отношение отклика экстрагируемого вещества к отклику внутреннего стандарта при равных концентрациях экстрагируемого вещества и внутреннего стандарта. При проведении количественной оценки рекомендуется применять относительные коэффициенты отклика вследствие отличия откликов экстрагируемых веществ от откликов внутренних стандартов. Точность и неопределенность полученных результатов оценки концентраций экстрагируемых веществ могут варьироваться, поэтому при вычислении ППДК добавляют ФН для учета аналитической неопределенности, возникающей из-за переменной точности. Использование ФН - это тот же принцип, который применяют при вычислении конечного ППДК из расчетного ППДК (например, см. [45]). ФН применяют для корректировки ППДК до более низкого значения, тем самым обеспечивая выявление и регистрацию химических веществ со слабым откликом, концентрации которых соответствуют или превышают значение ППДК. Если известно, что аналитическая неопределенность является приемлемо низкой, то допускается применять значение ФН, равное единице. Примерами таких случаев являются методы (валидация которых выполнена для целевых экстрагируемых веществ) с сопоставимыми коэффициентами отклика между ожидаемыми экстрагируемыми веществами и применяемыми внутренними стандартами. В других случаях значение коэффициента неопределенности зависит от применяемых аналитических методов, в которых используют ППДК. Например, применено значение ФН, равное 2 (см. [39], [45]), как подходящее значение для скрининга экстрактов на наличие полулетучих экстрагируемых веществ с помощью ГХ-ПИД или ГХ-МС, так как аналитическая чувствительность ПИД МС для экстрагируемых веществ постоянна от экстрагируемых веществ к экстрагируемым. Чувствительность других альтернативных методов, используемых для скрининга экстрагируемых веществ, таких как ВЭЖХ-МС (который, как правило, применяют для исследования нелетучих экстрагируемых веществ), может быть выше, учитывая наличие значительных различий в реакциях экстрагируемых веществ. При этом общие рекомендации по применению конкретных значений ФН в данных методах отсутствуют. Одним из подходов к установлению и обоснованию конкретного значения ФН является статистический анализ базы данных коэффициентов отклика, специфичных для рассматриваемого аналитического метода, и совокупности экстрагируемых веществ, для исследования которых применим этот метод. В одном из возможных подходов значение ФН связано с относительным стандартным отклонением коэффициентов отклика в соответствии с формулой (Е.2)
где RSD - это относительное стандартное отклонение коэффициентов отклика от референтной базы данных. Формулу (E.2) применяют, предполагая более или менее нормальное распределение коэффициентов отклика, при этом такое распределение наблюдают не во всех методах хроматографии. Базу данных коэффициентов отклика, используемую для вычисления ФН в соответствии с формулой (E.2), следует описать и просмотреть, чтобы установить, является ли полученное значение ФН достаточно объективным для надлежащего выявления в образце исследуемых веществ с низким коэффициентом отклика. В отдельных случаях допускается применять альтернативные способы установления ФН с соответствующим обоснованием. Формула (E.2) эквивалентна формуле, предложенной PQRI и Jordi (см. [41] и [46]). Если разброс коэффициентов отклика достаточно большой по сравнению со средним коэффициентом отклика (например, std = 0,9 X среднее значение), то разброс коэффициентов отклика настолько значителен, что научная обоснованность рассчитанного значения ФН становится недостоверной. Например, если можно вычислить ФН, и при этом он будет равен 10 или более, то применяемый метод количественной оценки является неточным и, следовательно, не подходит для целей оценки токсикологического риска МИ. Также следует учитывать, что использование большого значения ФН может привести к получению настолько малого скорректированного значения ППДК, что его невозможно будет определить указанным аналитическим методом. В этих случаях, даже при возможности определения скорректированного значения ППДК, проводить исследования методом с применением ППДК нецелесообразно. Такие методы необходимо доработать с учетом их применения для целей количественной оценки и оценки токсикологического риска МИ. | |
Если стандартное отклонение более или равно среднему значению (т.е. RSD>1), то ФН не может быть вычислен, так как результатом является либо бесконечность, либо отрицательное число. Таким образом, аналитический метод с таким большим разбросом коэффициентов отклика не подходит для целей оценки токсикологического риска. Если невозможно установить различия в коэффициентах отклика среди экстрагируемых веществ или если установлено, что различия достаточно значимые, то значение ФН может быть настолько большим (например, значение ФН, равное 10 или более), при этом значение ППДК становится настолько низким, что применение ППДК становится нецелесообразным (например, в аналитических методах LOD или LOQ больше, чем ППДК). В таком случае ППДК применять не следует. При этом может потребоваться проведение идентификации и количественной оценки всех химических соединений, связанных с наблюдаемыми аналитическими откликами, полученными методами скрининга, так как все аналитические отклики могут превышать значения ППДК. В этом случае рекомендуется рассмотреть возможность оптимизации метода для уменьшения разброса коэффициентов отклика. Скрининг экстрагируемых веществ, как правило, проводят с использованием ортогональных и дополнительных аналитических методов, например, ГХ-МС и ЖХ-МС. Рекомендуется применять несколько аналитических методов для уменьшения разброса коэффициентов отклика и определения необходимого значения ФН, которое затем используют во всех дополнительных методах (см. [56] и [57]). В любом случае использование ФН и значение используемого ФН всегда должны быть обоснованы. (Amd. 1:2022) |
E.4 Примеры определения порога предельно допустимой концентрации химических веществ
Пример А
МИ кратковременного контакта (например, баллонный катетер), при лечении используют одно МИ не более 1 сут При исследовании одного МИ методом экстракции применен экстрагент объемом 9,0 см![]() . Полученный экстракт не был разбавлен или концентрирован. В качестве аналитического метода применен метод ГХ-ПИД; следовательно, ФН равен 2. В данном случае значение ПДД для исследуемого МИ установлено равным значению ПТО для потенциально мутагенных примесей в соответствии с руководством ICH М7* (см. [18]), и ПДД = ПТО = 120 мкг/сут (длительность воздействия - 24 ч).
. Полученный экстракт не был разбавлен или концентрирован. В качестве аналитического метода применен метод ГХ-ПИД; следовательно, ФН равен 2. В данном случае значение ПДД для исследуемого МИ установлено равным значению ПТО для потенциально мутагенных примесей в соответствии с руководством ICH М7* (см. [18]), и ПДД = ПТО = 120 мкг/сут (длительность воздействия - 24 ч).
_______________
* Руководство ICH М7 по оценке и контролю ДНК-реактивных (мутагенных) примесей в фармацевтических препаратах для ограничения потенциального канцерогенного риска. ICH М7 - Рабочая группа Международного совета по гармонизации технических требований к фармацевтическим препаратам для человека.
- A=1 МИ;
- B = 9,0 см![]() ;
;
- C = 1 МИ/сут;
- ФН=2
и значение ППДК вычислено по формуле (E.1):
ППДК (мкг/см![]() ) = {120 мкг/сут·[1 МИ/(1 МИ/сут·9,0 см
) = {120 мкг/сут·[1 МИ/(1 МИ/сут·9,0 см![]() )]}: 2;
)]}: 2;
ППДК (мкг/см![]() ) = 6,6 мкг/см
) = 6,6 мкг/см![]()
Пример B
МИ длительного контакта, используемое в терапии в течение 7 сут. Для лечения пациента применяют по два изделия каждый день. Для экстрагирования четырех МИ применен экстрагент объемом 100 см![]() . Полученный экстракт не был разбавлен или концентрирован. В аналитическом методе применено программное обеспечение с базой данных коэффициентов отклика химических веществ, с помощью которой определены исследуемые экстрагируемые вещества. В данном случае:
. Полученный экстракт не был разбавлен или концентрирован. В аналитическом методе применено программное обеспечение с базой данных коэффициентов отклика химических веществ, с помощью которой определены исследуемые экстрагируемые вещества. В данном случае:
- ПДД = ПТО = 120 мкг/сут (значение ПТО для потенциально мутагенных примесей установлено в соответствии с руководством ICH М7, длительность воздействия 1 мес),
- A = 4 МИ;
- B = 100 см![]() ;
;
- C = 2 МИ/сут;
- ФН = 1
и значение ППДК вычислено по формуле (E.1):
ППДК (мкг/см![]() ) = {120 мкг/сут·[4 МИ/(2 МИ/сут·100 см
) = {120 мкг/сут·[4 МИ/(2 МИ/сут·100 см![]() )]}: 1;
)]}: 1;
ППДК (мкг/см![]() ) = 2,4 мкг/см
) = 2,4 мкг/см![]() .
.
Пример C.1
Имплантируемое МИ долгосрочного контакта (например, сердечно-сосудистый стент). Для лечения пациента применяют одно МИ. Так как это МИ долгосрочного контакта, то исследование проведено методом исчерпывающей экстракции. Для экстрагирования 20 МИ применен экстрагент объемом 33,3 см![]() . Исчерпывающая экстракция проведена последовательно в два этапа, т.е. количество экстрагируемых веществ в экстракте на втором этапе было менее 10% от количества экстрагируемых веществ, измеренного на первом этапе экстракции. Полученный экстракт не был разбавлен или концентрирован. В аналитическом методе применено программное обеспечение с базой данных коэффициентов отклика химических веществ, с помощью которой установлено, что полученное RSD составляет 25% при значении ФН, равном 2.
. Исчерпывающая экстракция проведена последовательно в два этапа, т.е. количество экстрагируемых веществ в экстракте на втором этапе было менее 10% от количества экстрагируемых веществ, измеренного на первом этапе экстракции. Полученный экстракт не был разбавлен или концентрирован. В аналитическом методе применено программное обеспечение с базой данных коэффициентов отклика химических веществ, с помощью которой установлено, что полученное RSD составляет 25% при значении ФН, равном 2.
Пример C.2
В данном примере основной трудностью является определение соответствующего ПДД. Для имплантируемого МИ долгосрочного контакта предполагается выщелачивание всех экстрагируемых веществ, содержащихся в МИ, в течение всего периода контакта МИ/пациент, поэтому исследование проведено методом исчерпывающей экстракции. Независимо от кинетики выщелачивания (как указано далее) и с учетом потенциальной мутагенности экстрагируемых из МИ веществ для исследования установлено значение ПДД, равное 120 мкг/сут.
После проведения исследования МИ методом исчерпывающей экстракции обнаружено мутагенное вещество количеством 120 мкг/сут, что соответствует результату исследования одного МИ (количество выщелачиваемого вещества составляет 120 мкг/МИ), пример которого приведен выше:
- если вещество количеством 120 мкг/МИ выщелачивается за 1 сут, то количество выщелачиваемого вещества составляет 120 кг/сут, что соответствует значению ПТО, установленному для МИ данной категории контакта согласно руководству ICH М7;
- если вещество количеством 120 мкг/МИ выщелачивается за 31 сут (1 мес), то количество выщелачиваемого вещества составляет 120/31 = 3,9 мкг/сут, что менее значения ПТО, равного 20 мкг/сут, установленного для МИ данной категории контакта согласно руководству ICH М7;
- если вещество количеством 120 мкг/МИ выщелачивается за 365 сут (1 год), то количество выщелачиваемого вещества составляет 120/365 = 0,33 мкг/сут, что менее значения ПТО, равного 10 мкг/сут, установленного для МИ данной категории контакта согласно руководству ICH М7;
- если вещество количеством 120 мкг/МИ выщелачивается за 3650 сут (10 лет), то количество выщелачиваемого вещества составляет 120/3650 = 0,033 мкг/сут, что менее значения ПТО, равного 1,5 мкг/сут, установленного для МИ данной категории контакта согласно руководству ICH М7.
Если вещество количеством 20 мкг/сут выщелачивается за 31 сут, то воздействующая на организм пациента доза вещества составляет 620 мкг, если вещество количеством 10 мкг/сут выщелачивается за 365 сут, то воздействующая на организм пациента доза вещества составляет 3650 мкг, если вещество количеством 1,5 мкг/сут выщелачивается за 3650 сут, то воздействующая на организм пациента доза вещества составляет 5 475 мкг. Таким образом, каждый из этих методов определения значения ПДД является приемлемым. (Amd. 1:2022) |
В данном случае вычисление значения ППДК выполнено следующим образом:
- ПДД = ПТО = 120 мкг/сут, данное значение ПДД "распределено" на два этапа экстракции; таким образом значение ПДД на каждом этапе экстракции составляет 120 мкг/сут : 2 экстракта = 60 мкг/сут);
- A = 20 МИ;
- B = 33,3 см![]() ;
;
- C = 1 МИ/сут;
- ФН=2
и значение ППДК вычислено по формуле (Е.1):
ППДК (мкг/см![]() ) = {60 мкг/сут·[20 МИ/(1 МИ/сут·33,3 см
) = {60 мкг/сут·[20 МИ/(1 МИ/сут·33,3 см![]() )]}: 2;
)]}: 2;
ППДК (мкг/см![]() ) = 18 мкг/см
) = 18 мкг/см![]() .
.
Пример C.3
МИ подвергнуто исчерпывающей экстракции для скрининга с целью выявления в нем токсичных химических веществ, оказывающих негативное воздействие на организм пациента. Количество вещества 1,5 мкг/сут без модификации является наиболее приемлемой дозой для исследования с целью идентификации/количественной оценки всех токсичных химических веществ, содержащихся в/на МИ и оценки токсикологического риска МИ. В данном методе ожидаемое значение ПДД соответствует значению ПТО, равному 1,5 мкг/сут, при этом значение ППДК вычисляют следующим образом:
- ПДД = ПТО = 1,5 мкг/сут (данное значение "распределено" на два этапа экстракции; таким образом, значение ПДД на каждом этапе экстракции составляет 1,5 мкг/сут : 2 экстракта = 0,75 мкг/сут);
- A = 20 МИ;
- B = 33,3 см![]() ;
;
- C = 1 МИ/сут;
- ФН=2
и значение ППДК вычислено по формуле (E.1):
ППДК (мкг/см![]() ) = {0,75 мкг/сут·[20 МИ/(1 МИ/сут·33,3 см
) = {0,75 мкг/сут·[20 МИ/(1 МИ/сут·33,3 см![]() )]}: 2;
)]}: 2;
ППДК (мкг/см![]() ) = 0,23 мкг/см
) = 0,23 мкг/см![]() .
.
Примечание - Данные, полученные при исследовании фактической кинетики высвобождения из МИ выщелачиваемых веществ, необходимы для установления приемлемого значения ПДД. Если при исследовании фактической кинетики высвобождения из МИ выщелачиваемых веществ установлено, что воздействие экстрагируемых веществ на пациента составляет менее 10 лет, то на основе результатов этих исследований будет установлено более высокое значение ПДД (см. ISO/TS 21726).
Е.5 Применение порога предельно допустимой концентрации
Выполнив преобразование ПДД в ППДК, можно сделать вывод о необходимости идентификации и определении количества конкретного экстрагируемого из МИ вещества. При этом с помощью аналитических методов не получают значения концентраций, а регистрируют отклики конкретных химических веществ в относительных единицах, которые далее преобразовывают в значения концентраций. Например, результатом хроматографического анализа образца является хроматограмма, на которой экстрагируемые вещества изображены в виде пиков (см. рисунок Е.1). В данном случае пик А соответствует исследуемому веществу, содержащемуся в образце, концентрация которого соответствует значению ППДК. Таким образом, на хроматограмме можно обозначить значение ППДК в виде горизонтальной линии, используя вершину пика А как точку отсчета. Химические вещества, соответствующие пикам, вершины которых выше данной линии (например, пик В), содержатся в образце в количествах, превышающих значение ППДК, поэтому такие вещества идентифицируют и сведения о них регистрируют в отчете для дальнейшего проведения оценки токсикологического риска МИ. Химические вещества, соответствующие пикам, вершины которых ниже данной линии (например, пик С), содержатся в образце в количествах, не превышающих значение ППДК, поэтому такие вещества не подлежат идентификации для оценки токсикологического риска МИ.
|
Рисунок Е.1 - Пример применения ППДК в хроматографическом анализе
На рисунке Е.1 приведен пример применения ППДК для сравнения высоты пика, при этом ППДК можно использовать для сравнения площади пика, так как при исследовании отдельных экстрагируемых веществ этот способ их идентификации и количественного определения может быть более подходящим. Данные пример и рисунок относятся к хроматографическому анализу, при этом применение ППДК для исследования экстрагируемых из МИ веществ используют во многих аналитических методах.
Е.6 Применение порога предельно допустимой концентрации при исследовании химических веществ из групп опасных соединений
Термин "группа опасных соединений" применяют к группам химических веществ, обладающих такой высокой биологической активностью, что их воздействие в концентрациях менее значения ПТО будет представлять значительный риск для пациента, включая канцерогенный риск, но не ограничиваясь им. Сведения о группах опасных соединений приведены в ISO/TS 21726. Некоторые красители также могут представлять потенциальный риск для организма человека, поэтому их следует исключить из исследований с применением ППДК (см. [42] и ISO 10993-17).
Экстрагируемые вещества концентрацией менее значения ППДК считают токсикологически безопасными, при этом данное правило не применимо к химическим веществам, относящимся к группам опасных соединений, так как такие группы веществ в концентрациях менее ППДК представляют риск для организма человека. ППДК является как порогом идентификации, так и порогом количественной оценки выщелачиваемых и экстрагируемых из МИ веществ, поэтому не рекомендуется использовать методы с применением ППДК для исследований групп опасных соединений. Если химическое вещество концентрацией менее значения ППДК точно не идентифицировано, т.е. не установлена его молекулярная структура для проведения оценки токсикологического риска, то невозможно определить, относится ли это вещество к группе опасных соединений. Разработано несколько методов с применением ППДК для исследований групп потенциально опасных соединений, но использовать их для оценки токсикологического риска МИ нецелесообразно. Не рекомендуется принимать решение о неиспользовании методов с применением ППДК для исследования экстрагируемых или выщелачиваемых веществ, если они предположительно относятся к группе опасных соединений. В этом случае необходимо провести исследование, применив ППДК к полученным аналитическим откликам, или выявить наличие или отсутствие в материале МИ химических веществ из группы опасных соединений. Решение о возможности проведения исследований материала МИ методами с применением ППДК необходимо принимать с учетом следующих рекомендаций:
- если представлены данные исследований или данные о композиционном составе материала МИ, на основе которых можно предположить наличие в материале МИ химических веществ из группы опасных соединений, то необходимо либо установить отсутствие таких соединений путем сбора информации и соответствующих подтверждающих документов, либо выполнить скрининг экстрактов с целью выявления наличия или отсутствия в материале МИ химических веществ из групп опасных соединений. При отсутствии в материале МИ химических веществ из групп опасных соединений определяют профиль экстрагируемых или выщелачиваемых веществ методами с применением ППДК для получения соответствующих аналитических откликов. При наличии в материале МИ химических веществ из групп опасных соединений ППДК применяют только к полученным аналитическим откликам веществ, которые не относятся к группам опасных соединений. Полученные аналитические отклики оценивают с целью подтверждения безопасности вещества на основе данных о его концентрации в материале МИ и данных его токсикологической безопасности;
- если отсутствуют данные исследований или данные о композиционном составе материала, подтверждающие наличие в нем химических веществ из групп опасных соединений, то при исследовании допускается применять ППДК к аналитическим откликам всех химических веществ.
Приложение F
(справочное)
Валидация аналитических методов, применяемых для исследования экстрагируемых/выщелачиваемых веществ
Для подтверждения пригодности аналитического метода для целей конкретного исследования следует выполнить его валидацию. Для исследований экстрагируемых/выщелачиваемых веществ применяют аналитические методы, предназначенные для двух различных целей: скрининга образцов на предполагаемое наличие исследуемых веществ и определения содержания в образцах конкретных исследуемых веществ (специфические аналитические методы). В зависимости от цели исследования используют соответствующий способ валидации метода.
Результаты валидации аналитического метода регистрируют в протоколе валидации, в котором приводят следующую информацию:
- соответствующие параметры валидации;
- оборудование и средства измерений, используемые для оценки параметров валидации;
- установленное значение каждого параметра. Параметры валидации методов скрининга:
- чувствительность, предположительно значение LOQ менее или равно значению ППДК (подробные сведения приведены в приложении Е).
Примечание 1 - Следует учитывать, что при низких значениях ППДК получить значение LOQ, менее или равное значению ППДК, может быть невозможно. В этом случае следует применять минимальное значение LOQ, при этом данные о всех исследуемых веществах, содержание которых в образце более LOQ, необходимо регистрировать в протоколе. Если значение LOQ более значения ППДК, то в протоколе должны быть приведены соответствующие объяснения и обоснования;
- специфичность, т.е. пригодность метода для выявления в образце конкретного вещества среди других компонентов и его количественной оценки;
- точность, т.е. степень близости результата измерений к принятому опорному значению (например, значение концентрации вещества в экстракте приблизительно соответствует тому количеству вещества, которое добавили в экстракт); точность методов скрининга, как правило, обеспечивают применением модельных веществ, которые являются репрезентативными для экстрагируемых веществ;
- прецизионность, т.е. степень близости друг к другу результатов повторных измерений одного и того же экстракта или стандартного раствора, содержащего экстрагируемые или выщелачиваемые вещества;
- динамический диапазон, т.е. диапазон значений концентрации, в котором определены наличие и концентрация исследуемого вещества. Динамический диапазон может быть установлен путем анализа модельных или стандартных растворов различных концентраций.
Примечание 2 - Данный параметр валидации метода рекомендуется определять при установлении LOQ и подтверждении приемлемости результатов исследования.
Примечание 3 - Если исследуемое вещество содержится в экстракте и его количество находится вне пределов установленного динамического диапазона, то рекомендуется выполнить корректировку экстракта, например, путем разбавления.
Параметры валидации специфических аналитических методов:
- чувствительность, значимая при условии, что диапазон измеряемых значений в методе включает значение LOQ или приближается к нему;
- специфичность (см. параметры валидации методов скрининга);
- точность (см. параметры валидации методов скрининга); при этом в отличие от методов скрининга точность специфических аналитических методов обеспечивают применением конкретных веществ, выбранных для исследований.
Примечание 4 - Для определения высвобождаемых веществ специфическими аналитическими методами рекомендуется применять стандартные растворы;
- прецизионность (см. параметры валидации методов скрининга);
- динамический диапазон, т.е. диапазон значений концентраций, в котором определены наличие и концентрация исследуемого вещества. Динамический диапазон может быть установлен путем анализа стандартных растворов различных концентраций;
- степень соответствия, в которой взаимосвязь между концентрацией исследуемого вещества в стандартном растворе и откликом, полученными при анализе стандартного раствора, выражена простой математической функцией. Данная математическая функция, как правило, является линейной функцией, при этом допускается использовать простые нелинейные функции, если они соответствуют критериям соответствия.
Валидация метода является подтверждением надежности как для методов скрининга, так и для специфических методов.
Для валидации методов допускается использовать дополнительные параметры, при этом должно быть представлено соответствующее обоснование. К таким дополнительным параметрам валидации относят: надежность, эффективность (включая разрешение для методов хроматографии), матричные эффекты, стабильность образца и стандартного раствора.
Учитывая различные цели и функции указанных методов, процессы валидации методов скрининга и специфических аналитических методов будут отличаться друг от друга при похожих критериях валидации. Например, валидацию метода скрининга и специфического аналитического метода осуществляют по параметру "точность", при этом используют различные процессы валидации. Для валидации специфического аналитического метода параметр "точность" устанавливают для конкретного исследуемого вещества, а для валидации метода скрининга параметр "точность" устанавливают для группы модельных веществ. При валидации методов скрининга применяют менее строгие требования к параметру "точность", так как данными методами получают сведения о наличии исследуемого вещества в образце, в отличие от специфических аналитических методов, с помощью которых получают данные о количественном содержании исследуемого вещества в образце.
При валидации специфических аналитических методов применяют более строгие требования к параметру "прецизионность", чем при валидации методов скрининга.
Параметр "специфичность" применяют при валидации методов скрининга для упрощения процесса идентификации отдельных экстрагируемых веществ, например, хроматографический пик, связанный с экстрагируемым веществом, формируется только этим экстрагируемым веществом. Параметр "специфичность" применяют при валидации специфических аналитических методов для подтверждения чистоты хроматографического пика исследуемого вещества, что необходимо для обеспечения требуемых показателей точности и прецизионности. Так как исследуемое вещество выбирают до начала измерений, то параметр "специфичность" для специфического аналитического метода рекомендуется устанавливать до проведения валидации. Параметр "специфичность" для методов скрининга рекомендуется устанавливать в процессе валидации, так как невозможно заранее определить, какие вещества будут выявлены в образце. Таким образом, параметр валидации "специфичность" определяют и устанавливают по-разному для методов скрининга и специфических аналитических методов.
Результат валидации метода считают положительным, т.е. метод признан пригодным для исследований, если установлено его соответствие:
- параметрам валидации в соответствии с протоколом;
- требованиям по применению для исследования конкретных материалов МИ.
Аналитические методы, валидация которых выполнена, должны соответствовать следующим дополнительным требованиям (но не ограничиваясь таковыми):
- документирование метода должно осуществляться в форме стандартной операционной процедуры (СОП) в рамках системы управления документацией;
- объем исследований должен быть четко определен, утвержден и зафиксирован в СОП метода;
- должно быть приведено подробное научное описание и обоснование применения метода с подтверждением его пригодности для исследования конкретного материала МИ;
- персонал, выполняющий исследования, должен иметь соответствующие навыки и квалификацию;
- применяемое оборудование должно быть аттестовано/откалибровано в установленном порядке.
Валидацию аналитического метода также подтверждают в течение периода непосредственного применения путем оценки его соответствия трем следующим критериям:
a) метод соответствующим образом утвержден и внедрен в установленном порядке;
b) внедренный метод обеспечивает выполнение процедур исследования на таком же уровне, как и при проведении его валидации;
c) метод обеспечивает получение приемлемых результатов на протяжении всего его применения.
В период применения метода его валидацию подтверждают оценкой по минимальному числу рабочих параметров, по каждому из которых отдельно и в совокупности устанавливают соответствие метода трем указанным критериям. Параметры и критерии, которые применяют для подтверждения валидации метода при его применении, должны быть достаточно точными, чтобы этим методом обеспечивалось получение данных установленного качества, но не настолько, чтобы происходило отклонение потенциально приемлемых результатов. По данным о валидации метода, собранным в период его применения и статистически обработанным, можно сделать окончательный вывод о пригодности или непригодности метода для исследования конкретного материала МИ.
Информация о планировании и проведении процедур валидации аналитических методов приведена в [23]. В приложении G приведены сведения о валидации аналитических методов, которые рекомендуется включать в отчет об исследовании химических свойств материалов МИ.
Приложение G
(справочное)
Дополнительные данные, включаемые в отчет об исследовании химических свойств материалов медицинских изделий
G.1 Общие положения
В разделе 7 приведены рекомендации по предоставлению информации о химических свойствах и композиционном составе материалов, которую следует включать в отчет об исследовании химических свойств материалов с целью ее дальнейшего использования при оценке токсикологического риска МИ. В отчет рекомендуется включать дополнительные данные, необходимые при проведении контроля уполномоченными организациями и для подтверждения результатов исследования химических свойств материалов МИ. Такие данные приведены ниже.
G.2 Данные, полученные по результатам исследований с применением аналитических методов, необходимые для оценки токсикологического риска медицинского изделия
Данные, полученные по результатам исследований с применением аналитических методов, необходимые для оценки токсикологического риска МИ:
- качественные данные (например, результаты идентификации экстрагируемых веществ);
- количественные данные (например, концентрации экстрагируемых веществ, включая обоснование применения и описание метода количественной оценки и представление данных как результатов оценочного количественного анализа, полуколичественного анализа или количественного анализа);
- предельно допустимые пороговые значения (например, пороги безопасности) с соответствующим обоснованием;
- перечень химических соединений, концентрации которых в материале МИ превышают установленные пороговые значения. Такой перечень рекомендуется приводить в отчете в виде таблицы, содержащей наименование химического соединения, его массу, предполагаемую структуру, химическую формулу, химическое наименование IUPAC, общее применяемое химическое наименование и сокращение, регистрационный номер CAS, статус его идентификации (например, подтвержденный, достоверный, предварительный, предположительный) и их измеренные концентрации в соответствующих образцах. В таблицу допускается включать дополнительную информацию, такую как химическая структура вещества. При выявлении нескольких возможных вариантов идентификации веществ (например, класс соединений, статус идентификации которых предварительный) информацию об этих веществах необходимо включать в отчет;
- информация о клиническом применении МИ, на основе которой в сочетании с данными о химических свойствах его материалов можно определить количество конкретного химического вещества в наихудшем случае его высвобождения из МИ в соответствующих единицах измерения (например, мкг/МИ) для оценки токсикологического риска МИ (определение ежедневной дозы воздействия на пациента);
- соответствующие рисунки, диаграммы и т.д., которые иллюстрируют полученные данные и/или необходимы для пояснения и интерпретации результатов (например, хроматограммы, кривые миграции);
- данные о веществах из группы опасных химических соединений и обоснование необходимости проведения их исследования (см. приложение E, E.5).
Указанные в отчете данные необходимы для определения воздействий на организм пациента исследуемых химических веществ при клиническом применении МИ, что является основной частью оценки токсикологического риска МИ. При этом в отчет допускается не включать результаты определения воздействий на организм пациента исследуемых химических веществ.
Данные, приведенные выше, являются достаточными для проведения оценки токсикологического риска, при этом, как правило, их недостаточно для выбора и обоснования применения экспериментальных и аналитических методов, использованных для проведения исследования конкретного материала/вещества с целью получения соответствующей информации. Указанные выше основные данные, приводимые в отчете, требуются для разработки и обоснования плана исследований, подтверждения применимости и пригодности специфических аналитических методов для конкретной цели, например при контроле уполномоченными организациями. В отчет следует включать следующие данные, относящиеся к процедурам подготовки к исследованию и применяемым методам исследований.
G.3 Данные о подготовке образца и приготовлении экстракта
Данные о подготовке образца и приготовлении экстракта:
- надлежащее и полное описание исследуемого МИ, включая соответствующие стадии производственного процесса (например, стерилизация, промывание), и удаленных компонентов МИ, при их наличии;
- способ проведения экстракции с обоснованием (например, кипячение с обратным холодильником, экстракция с применением герметично укупоренного сосуда);
- перечень экстрагентов с обоснованием;
- соотношение "экстрагент/образец" (например, соотношение площади экстрагируемой поверхности образца и объема применяемого экстрагента);
- время и температура экстракции;
- число этапов экстракции (например, однократная или исчерпывающая);
- методы определения достижения конечных точек исчерпывающей экстракции (если применимо);
- описание изменений в экстракте или образце (например, МИ) после завершения процесса экстракции, включая физическое состояние, внешний вид, цвет, прозрачность или наличие частиц;
- при наличии частиц в экстракте - описание обращения с ними (если проводилось), включая средства, которыми они были отделены от экстракта перед исследованием, и оборудование, с помощью которого проведены исследования их химических свойств.
G.4 Данные о подготовке экстракта к исследованию
Данные о подготовке экстракта к исследованию:
- описание любого процесса обработки экстракта, включая разбавление, концентрирование и др. (например, замена экстрагента);
- обоснование всех основных этапов обработки экстракта;
- описание любого процесса фильтрования образца/частиц образца;
- описание условий и длительность хранения экстракта до начала проведения исследования.
G.5 Данные об аналитических методах исследования
Данные об аналитических методах исследования:
- обоснование выбора метода;
- рабочие условия и параметры измерений (например, мобильная фаза метода хроматографии, применяемые способы, скорость потока, время разделения, температура колонки);
- параметры аналитической колонки, включая размеры и неподвижную фазу;
- сведения об оборудовании, включая наименование изготовителя, модель, основные компоненты;
- данные методов МС:
- метод ионизации (ионизация при атмосферном давлении (APCI), ионизация электрораспылением (ESI)),
- режим полярности (положительная, отрицательная),
- диапазон измеряемых масс веществ (или массы конкретных веществ, исследуемых методом ИСП-МС),
- номинальное разрешение по массе;
- длина волны УФ-излучения (для методов УФ-спектроскопии);
- основные рабочие параметры (для других аналитических методов);
- применяемые модельные вещества и стандартные растворы с соответствующим обоснованием, коэффициентами отклика (для полуколичественного анализа);
- данные методов количественного анализа с обоснованием:
- аналитическая конечная точка, применяемая для количественной оценки (например, сигнал масс-спектрометра или отклик в УФ-области),
- описание процесса применения модельных веществ и внутренних стандартов для количественной оценки конкретных исследуемых веществ (например, точное время удерживания, сходство химических свойств стандартного раствора и исследуемого вещества, минимальное или среднее значение коэффициента отклика в условиях "наихудшего случая высвобождения вещества из материала");
- описание процесса идентификации и подтверждения достоверности ее результатов (например, определение наименование химического вещества по соответствующей классификации или результаты оценки соответствия материала) с обоснованием;
- методы получения недостающих сведений (например, дополнительные испытания или способы уменьшения риска МИ в соответствии с ISO 10993-1);
- определение, обоснование и применение пороговых значений (таких, как ППДК).
G.6 Данные о валидации аналитического метода
Данные о валидации аналитического метода (в соответствии с протоколом валидации по приложению F):
- значения LOD и LOQ (включая описание процесса определения LOQ);
- линейность [калибровочная(ые) кривая(ые)];
- специфичность;
- подтверждение пригодности метода;
- достоверность (точность);
- прецизионность;
- динамический диапазон;
- другие значимые параметры, при необходимости.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 10993-1 | IDT | ГОСТ ISO 10993-1-2021 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска" |
ISO 10993-17 | IDT | ГОСТ ISO 10993-17-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ" |
ISO 14971:2007 | IDT | ГОСТ ISO 14971-2011 "Изделия медицинские. Применение менеджмента риска к медицинским изделиям" |
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов:
| ||
Библиография
[1] | ISO 5725-1, Accuracy (trueness and precision) of measurement methods and results - Part 1: General principles and definitions [Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Общие принципы и определения] | ||
[2] | ISO 5832-1, Implants for surgery - Metallic materials - Part 1: Wrought stainless steel (Имплантаты для хирургии. Металлические материалы. Часть 1. Деформируемая нержавеющая сталь) | ||
[3] | ISO 10993-2, Biological evaluation of medical devices - Part 2: Animal welfare requirements (Оценка биологическая медицинских изделий. Часть 2. Требования к охране здоровья животных) | ||
[4] | ISO 10993-9, Biological evaluation of medical devices - Part 9: Framework for identification and quantification of potential degradation products (Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деградации) | ||
[5] | ISO 10993-12:2012, Biological evaluation of medical devices - Part 12: Sample preparation and reference materials (Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и стандартные образцы) | ||
[6] | ISO 10993-13, Biological evaluation of medical devices - Part 13: Identification and quantification of degradation products from polymeric medical devices (Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественная оценка продуктов деградации в медицинских изделиях из полимерных материалов) | ||
[7] | ISO 10993-14, Biological evaluation of medical devices - Part 14: Identification and quantification of degradation products from ceramics (Оценка биологического действия медицинских изделий. Часть 14. Идентификация и количественная оценка продуктов деградации керамики) | ||
[8] | ISO 10993-15, Biological evaluation of medical devices - Part 15: Identification and quantification of degradation products from metals and alloys (Оценка биологического действия медицинских изделий. Часть 15. Идентификация и количественная оценка продуктов деградации медицинских изделий из металлов и сплавов) | ||
[9] | EN 455-3, Medical gloves for single use - Part 3: Requirements and testing for biological evaluation (Медицинские перчатки одноразового использования. Часть 3. Требования и испытания для оценки биологического действия) | ||
[10] | ISO 22442-1, Medical devices utilizing animal tissues and their derivatives - Part 1: Application of risk management (Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 1. Применение менеджмента риска) | ||
[11] | ISO 22442-2, Medical devices utilizing animal tissues and their derivatives - Part 2: Controls on sourcing, collection and handling (Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 2. Контроль отбора, сбора и обработки) | ||
[12] | ISO 22442-3, Medical devices utilizing animal tissues and their derivatives - Part 3: Validation of the elimination and/or inactivation of viruses and transmissible spongiform encephalopathy (TSE) agents (Медицинские изделия, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или инактивации вирусов и агентов заразной спонгиозной) | ||
[13] | USP 41, 2018, [1663] Assessment of Extractables Associated with Pharmaceutical Packaging/Delivery Systems | ||
[14] | USP 41, 2018, [1664] Assessment of Drug Product Leachables Associated with Pharmaceutical Packaging/Delivery Systems | ||
[15] | Use of International Standard ISO 10993-1, Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process - Guidance for Industry and Food and Drug Administration Staff [viewed 2019-01-29]. Available from: https://www.fda.gov/downloads/medicaldevices/deviceregulationandguidance/ guidancedocuments/ucm348890.pdf | ||
Документы, цитируемые в стандарте | |||
[16] | OECD, 1996, Test No. 118: Determination of the Number-Average Molecular Weight and the Molecular Weight Distribution of Polymers using Gel Permeation Chromatography, OECD Guidelines for the Testing of Chemicals, Section 1, OECD Publishing, Paris. | ||
[17] | OECD, 2000, Test No. 120: Solution/Extraction Behaviour of Polymers in Water, OECD Guidelines for the Testing of Chemicals, Section 1, OECD Publishing, Paris. | ||
[18] | ICH Technical Requirements for Registration of Pharmaceutical for Human Use Draft Consensus Guideline, M7. Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk. Current Step 2 version; 6 February 2013. | ||
[19] | ICH Guideline for Elemental Impurities [viewed 2019-01-29]. Available from: https://www.ich.org/fileadmin/Public_ Web_Site/ICH_Products/Guidelines/Quality/Q3D/Q3DStep2b.pdf | ||
[20] | Eur Ph., Ed. 9, 2016, Section 2.2.28, and Chapters 3.1 and 3.2. | ||
[21] | JP XVII 2017 General tests/plastic containers | ||
[22] | USP 41, 2018, [661] Plastic packaging systems and their materials of construction | ||
[23] | USP 41, 2018, [1058] Analytical instrument qualification | ||
[24] | ASTM F2129-17b, Standard Test Method for Conducting Cyclic Potentiodynamic Polarization Measurements to Determine the Corrosion Susceptibility of Small Implant Devices | ||
[25] | Guidance for Industry: Preparation of Premarket Submissions for Food Contact Substances: Chemistry Recommendations. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Food Safety and Applied Nutrition. April 2002; December 2007 | ||
[26] | Arias M., Penichet I., Ysambertt F. et al. Fast supercritical fluid extraction of low- and high-density polyethylene additives: comparison with conventional reflux and automatic Soxhlet extraction. Journal of Supercritical Fluids. 2009; 50(1): 22-28 | ||
[27] | Ball D., Blanchard J., Jacobson-Kram D. et al. Development of Safety Qualification Thresholds and Their Use in Orally Inhaled and Nasal Drug Product Evaluation. Toxicological Sciences. 2007; 97: 226-236 | ||
[28] | Bart J.C.J. Additives in Polymers - Industrial Analysis and Applications, John Wiley & Sons, Inc., New York, (2005). (ISBN 0-470-85062-0) | ||
[29] | Bataillard P., Evangelista L., Thomas M., in Plastics Additive Handbook, Zweifel E. (ed), Hanser Publishers, Munich pp. 1047-1083(2000) | ||
[30] | Brandrup J., Immergut E.H., Grulke E.A. (eds). Polymer Handbook, John Wiley & Sons, Inc., New York, (1999) | ||
[31] | Braun D. Simple Methods for Identification of Plastics, Hanser Publishers, Munich (1996) | ||
[32] | Burdick & Jackson Laboratories, Solvent guide. Published by Burdick and Jackson Laboratories; McGaw Park, IL (1986) | ||
[33] | Freitag W., in Kunststoff-Additive, Gachter R., Muller H. (eds). Hanser Publishers, Munich, pp. 909-946 (1990) | ||
[34] | Gad-McDonald S., Gad C.S. Leachables and Extractables from Medical Devices, in Biomaterials, Medical Devices, and Combination Products, CRC Press: 41968 (2015) | ||
[35] | Hansen CM. Hansen Solubility Parameters: A User's Handbook, 2nd edn. CRC Press, Taylor and Francis Group, Boca Raton Florida (2007) | ||
[36] | Hildebrand J.H., Scott R.L. The solubility of nonelectrolytes. New York: Dover Publications (1964) | ||
[37] | International Union of Pure and Applied Chemistry - Macromolecular division - Commission on macromolecular nomenclature: compendium of macromolecular nomenclature, Prepared for publication by W V. Metanomski, Blackwell Scientific Publications Ltd., Oxford (1991) | ||
[38] | Jenke D., Liu N., Hua Y. et al. A means of establishing and justifying binary ethanol/water mixtures as simulating vehicles in extractables studies. PDA J Pharm SciTechnol. 2015; 69(3): 366-382. Doi: 10.5731/pdajpst.2015.01046 | ||
[39] | Jenke D., Odufu A. Utilization of internal standard response factors to estimate the concentration of organic compounds leached from pharmaceutical packaging systems and application of such estimated concentrations to safety assessment. J. Chromatogr. Sci. 2012; 50: 206-212 | ||
[40] | Jenke D. Establishing the proper pH of simulating solvents used in organic extractables assessments for packaging systems and their materials of construction used with aqueous parenteral drug products. Pharm Outsourcing. 2014; 15(4): 20, 22, 24-27 | ||
[41] | Jordi M.A., Khera S., Roland K. et al. Qualitative assessment of extractables from single-use components and the impact of reference standard selection. J. Pharmaceutical and Biomedical Analysis. 2018; 150: 368-376 | ||
[42] | Koster S. et al. Food and ChemTox. 2011; 49: 1643-1660 | ||
[43] | Krause A., Lange A., Ezrin M. Plastics Analysis Guide. Chemical and Instrumental Methods, Hanser Publishers, Munich (1983) | ||
[44] | Marques M.R.C., Loebenberg R., Almukainzi M. Simulated Biological Fluids with Possible. Dissolution Technologies [посещена 2019-01-29] Доступна по: http://www.dissolutiontech.com/DTresour/201108Articles/DT201108 A02. pdf | ||
[45] | Mullis J.О., Granger A., Quin C., Norwood D.L. The analytical evaluation threshold (AET) concept, sensitivity and analytical uncertainty. Conference Proceedings, Leachables and Extractables. Smithers Rapra, Dublin, Ireland, March, 2008 | ||
[46] | Norwood D.L., Nagao L.M., Stults C.L.M. Perspectives on the PQRI Extractables and Leachables "Safety Thresholds and Best Practices" Recommendations for Inhalation Drug Products, PDA J PharmSci and Tech 2013, 67: 413-429 | ||
[47] | Oyane A., Kim H-M., FuruyaT et al. Preparation and assessment of revised simulated body fluids, J Biomed Mater Res, 2003; 65A: 188-195 | ||
[48] | Safety Thresholds and Best Practices for Extractables and Leachables in Orally Inhaled and Nasal Drug Products PQRI Leachables and Extractables Working Group, September 9, 2006 [посещена 2019-01-29] Available from: http://pqri.org/wpcontent/uploads/2015/08/pdf/LE_Recommendations_to_FDA_09-29-06.pdf | ||
[49] | Snyder L.R. Chapter 1. Theory of chromatography. Editor(s): E. Heftmann. In Journal of Chromatography Library Elsevier, Volume 51, Part A, 1992, Pages A1-A68 | ||
[50] | Snyder L.R. Classification of the solvent properties of common liquids. J ChromatogrSci 1978: 16; 223-234 | ||
[51] | Strandberg D., Albertsson A.C. Chromatographic analysis of antioxidants in polymeric materials and their migration from plastics into solution. Adv Poly Sci. 2007; 211: 117-157 | ||
[52] | Stults C.L.M., Creasey J.M. Development, optimization, and validation of methods for routine testing, Editors: DJ Ball, DL Norwood, CLM Stults, LM Nagao in Leachables and Extractables Handbook, John Wiley & Sons, Pages 449-506(2012) | ||
[53] | ISO/TS 10993-19, Biological evaluation of medical devices - Part 19: Physico-chemical, morphological and topographical characterization of materials (Оценка биологического действия медицинских изделий. Часть 19. Исследования физико-химических, морфологических и топографических свойств материалов) | ||
[54] | ISO/TR 10993-22, Biological evaluation of medical devices - Part 22: Guidance on nanomaterials (Оценка биологического действия медицинских изделий. Часть 22. Руководство по наноматериалам) | ||
[55] | ISO/TS 21726, Biological evaluation of medical devices - Application of the threshold of toxicological concern (TTC) for assessing biocompatibility of medical device constituents (Оценка биологического действия медицинских изделий. Применение уровня предельно допустимого токсикологического воздействия для оценки биосовместимости компонентов медицинских изделий) | ||
[56] | Jenke D., Christiaens P., Beusen J.M., Verlinde P., Baeten J. A practical derivation of the uncertainty factor applied to adjust the extractables/leachables analytical evaluation threshold (AET) for response factor variation. PDA J Pharm Sci Technol. 2021 [Online ahead of print] Available from https://iournal.pda.ora/ content/earlv/2021/11/15/ pdaipst.2021.012692 (Amd.1:2022) | ||
[57] | Jordi M.A., Rowland K., Liu W., Cao X., Zong J., Ren Y, Liang Z., Zhou X., Louis M., Lerner K. Reducing relative response factor variation using a multidetector system forextractables and leachables (E&L) analysis to mitigate the need for uncertainty factors. J. Pharm. Biomed. Anal. 2020: 186:1-14 Available from https://www.sciencedirect.com/ science/article/pii/S073170 8520304283?via%3Dihub (Amd. 1:2022) | ||
УДК 615.46:002:006.354 | МКС 11.100.20 | IDT |
Ключевые слова: оценка биологического действия медицинских изделий, исследование химических свойств материалов, менеджмент риска, ускоренная экстракция, преувеличенная экстракция, композиционный состав материала, количественная оценка | ||
Электронный текст документа
и сверен по:
М.: ФГБУ "РСТ", 2022