ГОСТ Р ЕН 12297-2012
Группа Т58
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
БИОТЕХНОЛОГИЯ. ОБОРУДОВАНИЕ
Методы контроля приспособленности к стерилизации
Biotechnology. Equipment. Guidance on testing procedures for sterilizability
ОКС 07.080
07.100.01
Дата введения 2013-12-01
Предисловие
1 ПОДГОТОВЛЕН Общероссийской общественной организацией "Ассоциация инженеров по контролю микрозагрязнений" (АСИНКОМ) на основе собственного аутентичного перевода на русский язык европейского регионального стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 184 "Обеспечение промышленной чистоты"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 8 ноября 2012 г. N 697-ст
4 Настоящий стандарт идентичен европейскому региональному стандарту ЕН 12297:1998* "Биотехнология. Оборудование. Методы контроля приспособленности к стериализации" (EN 12297:1998 "Biotechnology - Equipment - Guidance on testing procedures for sterilizability")
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (gost.ru)
1 Область применения
Настоящий стандарт представляет собой руководство, предусматривающее общие процедуры для оценки приспособленности к стерилизации оборудования (отдельных компонентов и агрегатов оборудования), используемого в биотехнологических процессах.
Настоящий стандарт содержит руководство по оценке приспособленности к стерилизации биотехнологического оборудования с учетом возможного выделения в процессе работы микроорганизмов, способных представлять угрозу безопасности работающему персоналу (нарушить правила гигиены труда) и/или окружающей среде.
Настоящий стандарт применим к установкам или их компонентам, таким как клапаны и запорная арматура, емкости, насосы, сепарирующие и наполнительные устройства, а также измерительная аппаратура, находящаяся в контакте с рабочими жидкостями.
Настоящий стандарт применим также и в том случае, если оборудование содержит опасные или потенциально опасные микроорганизмы.
Настоящий стандарт не применим для оценки стерильности питательной среды и оборудования перед проведением процесса.
Примечания
1 При проведении дезинфекции наружных поверхностей, таких как стены, рабочие столы, полы, следует применять национальные и европейские стандарты.
2 При стерилизации оборудования и питательных сред следует руководствоваться национальными и европейскими стандартами, такими как ЕН 285 и ЕН 554 (см. приложение С [21], [22]).
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 компонент оборудования (component of equipment): Технический объект, являющийся частью установки.
Примечание - Примерами компонентов являются сосуды, клапаны и датчики.
2.2 прямой метод испытаний (в биотехнологии) (direct test method (in biotechnology)): Метод испытаний с использованием микроорганизмов для количественной оценки.
2.3 косвенный метод испытаний (в биотехнологии) (indirect test method (in biotechnology)): Метод испытаний, использующий для количественной оценки физические и/или химические средства.
2.4 микроорганизм (micro-organism): Любая микробиологическая сущность, клеточная или бесклеточная, способная к размножению или передаче генетического материала [ЕН 1619].
Примечание - В настоящем стандарте термин "микроорганизм" подразумевает биологический агент в соответствии с Директивой 90/679/ЕЕС: микроорганизмы, включая генно-модифицированные, клеточные культуры и человеческие эндопаразиты, способные вызывать инфекцию, аллергию и обладающие токсическими свойствами.
2.5 технологический микроорганизм (process micro-organism): Микроорганизм, используемый в производственных целях в биотехнологических процессах или составляющий сам продукт (или часть продукта).
2.6 стерильный (sterile): Состояние, при котором отсутствуют жизнеспособные микроорганизмы.
Примечания
1 На практике доказать абсолютное отсутствие жизнеспособных микроорганизмов невозможно. Однако стерильными условиями могут считаться те, которые соответствуют принятым или признанным методам стерилизации.
2 Процесс инактивации живых микроорганизмов в процессе стерилизации обычно описывается эмпирической математической функцией, в большинстве случаев экспоненциальной функцией. В соответствии со свойствами экспоненциальных функций их численное значение может быть очень мало, но никогда не равно нулю. Тем не менее эти экспериментальные функции могут быть применены для контроля и оценки параметров процесса стерилизации для обеспечения желаемой степени инактивации жизнеспособных микроорганизмов.
2.7 приспособленность к стерилизации (sterilizability): Способность компонентов, узлов оборудования или установок становиться стерильными.
2.8 стерилизация (sterilization): Процесс, используемый для достижения стерильности.
2.9 стерилизация на месте (sterilization in place - SIP): Стерилизация без открывания или без разборки компонентов оборудования и/или узлов оборудования.
2.10 целевой микроорганизм (target micro-organism): Технологический микроорганизм и/или иные микроорганизмы, относящиеся к специфической технологии.
Примечание - Для испытаний, касающихся безопасности, насколько это возможно, следует использовать непатогенные микроорганизмы.
2.11 комплект оборудования (unit of equipment): Комплекс компонентов, используемый для выполнения одной или более единичных операций.
3 Испытания
3.1 Общие положения
Испытания на приспособленность к стерилизации необходимы для того, чтобы убедиться в том, стерилизуемо ли оборудование и в какой степени может быть устранен потенциальный риск для здоровья работающего персонала и/или для окружающей среды. В частности, необходимо установить, что режим работы оборудования обеспечивает инактивацию используемых микроорганизмов до такой степени, что обслуживающему персоналу и окружающей среде остаточное количество микроорганизмов не будет представлять вреда. Методика испытаний должна предусматривать получение уместной информации о том, что соответствующая приспособленность к стерилизации может быть достигнута.
3.2 Методология
Чтобы определить приспособленность к стерилизации установки или оборудования, необходимо выбрать и указать соответствующий метод испытаний или комбинацию методов испытаний (см. приложения А и В):
a) определить соответствующий индикатор, касающийся предполагаемого использования оборудования;
b) выбрать аналитический метод для количественной оценки критерия, относящегося к данной установке или оборудованию. Предпочтительно, чтобы соответствующий биологический индикатор был безвредным для работника и/или окружающей среды;
c) составить протокол стерилизации, включающий как минимум спецификацию на стерилизующий агент и способ его применения.
Примечания
1 Должна быть оценена опасность для оператора в процессе проведения стерилизации.
2 В протокол также должны быть включены продолжительность процесса, температура и доза стерилизующего агента.
3.3 Методика испытаний
Проводить испытания необходимо следующим образом:
a) поместить индикатор внутрь оборудования или установки, чтобы он находился там в условиях, соответствующих данному процессу;
b) пользуясь аналитическим методом, указанным в 3.2, определить количество субстанции индикатора и время стерилизации, соответствующие данному процессу;
c) в соответствии с 3.2 составить протокол испытаний установки и оборудования, испытуемых на приспособленность к стерилизации;
d) используя аналитический метод, выбранный в соответствии с 3.2, определить количество индикатора, находящегося в оборудовании или установке после проведения процесса стерилизации;
e) пользуясь полученными данными, вычислить показатели приспособленности к стерилизации оборудования или установки;
f) установить класс приспособленности к стерилизации испытуемого оборудования в соответствии со стандартом на оборудование с учетом выбранного индикатора и данных протокола стерилизации.
3.4 Выбор метода испытаний
Если результаты метода испытаний должны быть получены быстро и имеются ограничения в объеме работы, необходимой для демонстрации приспособленности к стерилизации, следует использовать косвенные методы испытаний. Однако непрямые методы можно использовать, если доказана действительная корреляция между измеряемым эффектом и желаемыми показателями работы.
Если используют прямые методы испытаний, они должны быть проведены при соответствующем контроле в целях исключения ложноположительных результатов, являющихся следствием некорректного отбора проб. Это означает, что параллельно с подготовкой пробы должна быть подготовлена пробирка с тестовой культурой, соответствующей той, которую использовали для испытаний, но которая не была подвергнута инокуляции, также должны быть подготовлены пробы питательной среды, которые стерилизуют в соответствии с утвержденным методом.
3.5 Прямые методы испытаний
Эффективность стерилизационного цикла может быть показана анализом неразбавленных проб питательной среды, подвергнутых стерилизации, и проведением микробиологического анализа этих проб. Микробиологические контрольные пробы обычно делают путем внесения в исследуемое оборудование или его компоненты репрезентативного количества соответствующей питательной среды с добавлением в нее индикаторных микроорганизмов. Такой способ испытаний следует применять, если индикаторные или производственные микроорганизмы, которые нужно обнаружить, определяются в количестве, близком или даже ниже установленного предела для выбранного метода испытаний. Надежная величина скорости гибели микроорганизмов может быть установлена, если только число колониеобразующих единиц, которые определяются в эксперименте, достаточно велико, чтобы установить статистически надежную кинетику инактивации, например, в зависимости от метода оценки от 100 до 1000 колониеобразующих единиц на 1 мл.
Примечание - Предпочтительно использование иммобилизованных микроорганизмов.
Эффективность тепловой стерилизации может быть подтверждена отсутствием индикаторных или производственных микроорганизмов. Примеры соответствующих индикаторных микроорганизмов приведены в приложении С ([1]-[4], [9]-[12], [14]). Класс микроорганизма, выбранного в качестве индикатора, зависит от характеристик производственного микроорганизма и должен быть соответствующим для худших условий.
Выбор специфического индикаторного микроорганизма должен гарантировать, что степень стерилизации будет измерима в течение некоторого периода времени процесса стерилизации. Чтобы выполнить эти граничные условия для процедур газовой стерилизации, например, с помощью окиси этилена или формальдегида, должен быть выбран соответствующий индикаторный микроорганизм (см. приложение С [3], [4], [14]).
Пробы с иммобилизованными индикаторными микроорганизмами, которые могут быть приготовлены в лаборатории или приобретены в торговых фирмах, должны быть расположены в соответствующих местах внутри оборудования. Места расположения проб с индикаторными микроорганизмами должны быть определены либо экспериментально, либо методом оценки риска, методом анализа критических контрольных точек риска (HACCR) и методом исследования опасности и удобства использования (HAZOP).
3.6 Косвенные методы испытаний
Косвенные методы испытаний используют, когда прямые методы неприменимы или являются неподходящими. Они могут быть подтверждены прямым методом испытаний с учетом двух основных физических и/или химических параметров, которыми являются время обработки и требуемая температура или доза. Эти два параметра должны контролироваться внутри определенных блоков оборудования в местах, которые считаются наихудшими с точки зрения условий стерилизации и определяемыми либо прямыми методами испытаний, либо расчетом по методу анализа риска.
4 Документация
Производитель/поставщик и/или пользователь должны разработать и документально оформить методы испытаний, используемые для оценки приспособленности к стерилизации компонентов или отдельных блоков оборудования. Такая документация должна включать применяемые условия испытаний (метод испытания, индикатор и аналитическую процедуру) и результаты испытаний.
Приложение А
(справочное)
Методы контроля приспособленности к стерилизации
На рисунке А.1 приведено руководство по принятию решения о приспособленности оборудования к стерилизации.
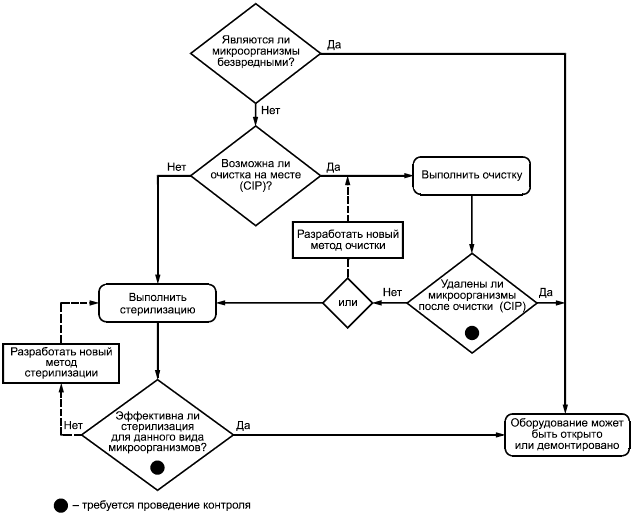
Рисунок А.1 - Схема принятия решения о приспособленности оборудования к стерилизации и проверке ее эффективности стандартными методами
На рисунке А.2 приведено руководство по выбору подходящего метода испытания. Эти методы приведены в таблицах А.1 и А.2.
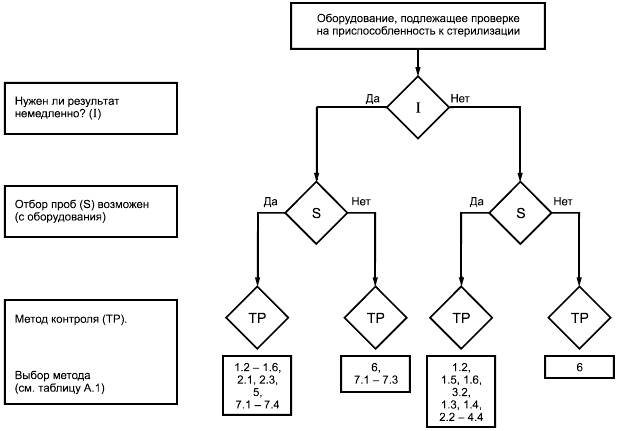
Рисунок А.2 - Порядок выбора метода испытаний на приспособленность к стерилизации
Таблица А.1 - Прямые методы контроля приспособленности к стерилизации
N п/п | Методы контроля | Замечания | Требуется ли отбор проб | Немедленные результаты | Ссылки (см. приложение С) |
1 | Индикаторные микроорганизмы (суспендированные) | ||||
1.1 | Мутность | Включая слипшиеся/ инактивированные | Да | Нет | [3], [4], [5], [7], [11], [12], [13], [14], [16] |
1.2 | Полимеразноцепная реакция ДНК/иммунологические методы | Да | (Да) | [18] | |
1.3 | Посев на чашки Петри | Да | Нет | [3], [4], [5], [7], [11], [12], [13], [14] | |
1.4 | Микроскопические (эпифлуоресцентные) | Да | Нет | [3], [4], [5], [7], [11], [12], [13], [14] | |
1.5 | Мониторинг субстрата/продукта | Да | (Да) | ||
1.6 | Микрокалориметры | Да | (Да) | [17] | |
2 | Индикаторные микроорганизмы (иммобилизованные) | ||||
2.1 | Полимеразноцепная реакция ДНК/иммунологические методы | Флаконы/полоски/ пробирки | Да | (Да) | [20] |
2.2 | Визуальные/изменение цвета | Да | Нет | [5], [11], [12], [13], [14] | |
2.3 | Микроскопические | Да | Нет | [5], [11], [12], [13], [14] | |
3 | Взятие мазков | ||||
3.1 | Посев на чашки Петри | Да | Нет | [17], [18] | |
3.2 | Визуальный | Да | Нет | [17], [18] | |
4 | Контроль питательной среды | ||||
4.1 | Мутность | Да | Нет | [3] | |
4.2 | Посев на чашки Петри | Да | Нет | [3] | |
4.3 | Микроскопические | Да | Нет | [3] | |
4.4 | Мониторинг субстрата/продукта | Да | Нет | [3] | |
Таблица А.2 - Косвенные методы контроля приспособленности к стерилизации
N п/п | Методы контроля | Замечания | Требуется ли отбор проб | Немедленные результаты | Ссылки (см. приложение С) |
5 | Температура/ продолжительность пробы | (Да) | Да | [4], [5], [7], [8] | |
6 | Температура/ продолжительность ультрафиолетового облучения | Да | [6] | ||
7 | Стерилизующий агент | ||||
7.1 | р | Да | Да | [3], [5], [13] | |
7.2 | Мутность | Нет | Да | [3], [5], [13] | |
7.3 | Проводимость | Нет | Да | [3], [5] | |
7.4 | Анализ газа | Формальдегид, окись этилена, перекись водорода | Да | Да | [5] |
Приложение В
(справочное)
Информация о методах контроля приспособленности к стерилизации
В.1 Введение
Обязательными условиями, влияющими на выбор метода выявления и/или определения (показателей эффективности приспособленности к стерилизации), являются: минимальный требуемый объем пробы, необходимые асептические условия, позволяющие избежать вторичного инфицирования, способного повысить вероятность получения ложноположительных результатов, питательные среды, необходимые для эксперимента, и время инкубирования проб.
Четкое понимание приспособленности к стерилизации требует глубоких знаний микробиологии и выполнения определенных условий испытаний, включая питательную среду, температуру и время инкубации, а также составление протокола испытаний. Основанная на группе факторов, например на микроскопировании или визуальной оценке, эта работа может потребовать нескольких дней, пока будут получены надежные результаты.
Как бы то ни было, прямые и непрямые методы испытаний дополняют друг друга.
Поскольку на эффект стерилизации оказывает влияние остаточное количество загрязнений после начала процесса стерилизации, то способность к очистке оборудования может быть важным критерием эффективности стерилизации. Таким образом, технические меры по повышению способности оборудования к очистке в большинстве случаев могут способствовать увеличению способности этого оборудования к стерилизации.
В.2 Информация о прямых испытаниях
В.2.1 Общая информация и определение пределов индикаторных микроорганизмов
Непосредственное определение клеток методом микроскопирования возможно только в том случае, если число клеток выше 1000-10000 клеток в 1 мл (см. приложение С [1]). Погибшие или инактивированные в результате процесса стерилизации питательной среды, например кукурузного экстракта, клетки могут препятствовать интерпретации результатов таких испытаний. Определение колониеобразующих единиц на чашках с агаром требует лишь небольшого количества вносимой пипеткой жидкости, что обеспечивает низкий предел чувствительности метода.
Твердые питательные среды не позволяют концентрировать загрязнители с помощью фильтрации. Поэтому требуемый объем пробы находится в пределах от 1 до 10 мл, и предел определения микроорганизмов составляет от 0,1 до 1 колониеобразующей единицы на миллилитр (см. приложение С [1]). Из практических соображений существенно, чтобы для серии объемом 100000 л число колониеобразующих единиц достигало 10000000, чтобы их обнаружение было возможно. Соответственно для серии объемом 30 л минимальный предел обнаружения составит 3000 колониеобразующих единиц. Таким образом, контаминация только одной живой клеткой (со временем роста 1 ч) должна дать рост 12 поколениям, пока будет достигнута достаточно высокая вероятность обнаружения специфической контаминации.
Обычно температура стерилизации составляет от 121°С (20 мин) до 125°С (10 мин). Однако при непрерывном процессе стерилизации температура выше (от 2 до 5 мин при 140°С и 130°С соответственно).
В.2.2 Пример микробиологического тестирования
Испытание процесса стерилизации биотехнологического оборудования с использованием в качестве индикаторного микроорганизма Вас. stearothermophilus в соответствии с приложением С может быть проведена при соблюдении следующих условий:
- отбор проб после 0, 24 и 48 ч;
- требуемый объем пробы от 20 до 50 мл;
- питательная среда - на основе гидролизата казеина;
- необходимые условия инкубации: от 2 до 3 сут при температуре 55°С;
- техника проведения опыта: в колбу к 20 мл пробы добавить 200 мл питательной среды, перемешать и плотно закрыть стерильной крышкой;
- оценка результата: наличие спор (±/-1) осуществляют путем определения оптической плотности пробы.
Подобные методы приведены также в приложении С [2], [3], [5].
В.2.3 Примеры использования тестовых полосок и споровых индикаторов
До начала испытаний помещения, в которых они будут проведены, должны быть подготовлены для осуществления химической стерилизации. Спецификация помещений, где проводят испытания, может быть осуществлена с меньшими усилиями, если применить комбинацию прямых и непрямых методов.
Для определения стерилизующего эффекта полоски со спорами помещают в пробирки с определенной питательной средой (например, триптический перевар соево-казеиновой среды). Инкубация в течение 7 сут при температуре 37°С. После истечения этого времени измеряют мутность проб. В результате выясняют, есть ли рост микроорганизмов или нет. Количество клеток после стерилизации может быть рассчитано с использованием модели кинетики роста.
В.3 Информация о косвенных испытаниях
В.3.1 Контроль распределения температур или химического стерилизующего агента
При условии, что тестовый микроорганизм определен, для оценки стерилизующего эффекта важны два физических параметра: время стерилизации или выдержки и температура или доза. В то время как общее время стерилизации одинаково для всех компонентов частей оборудования, эффективная температура стерилизации зависит от теплопередачи к различным компонентам оборудования и их теплоемкости или от дозы химического стерилизующего агента и соответственно от их однородности. Таким образом, распределение температур и времени, необходимого для достижения гомогенных температур, является ключом для решения задач подобного вида.
При разработке оборудования и его компонентов внутри конкретного оборудования должны быть определены критические зоны с учетом приспособленности к стерилизации. Для термической стерилизации распределение температур внутри исследуемого оборудования обеспечивает основную информацию о приспособленности к стерилизации в конкретных условиях. Серия температурных измерений будет использоваться для определения мест с наименьшей температурой во время тестового цикла или самого длительного времени прогрева до достижения требуемой температуры. Данные о распределении температуры могут быть получены путем установки множественных одинаковых проб или использованием малой серии проб или увеличенного числа серий проб. Возможно получить одноразовую пробу температуры с помощью термоиндикаторных цветных полосок или с помощью множества электрических датчиков температуры, которые могут или не могут быть размещены внутри испытуемого оборудования. Термопары или термопары с суммируемыми данными представляют собой два различных инструмента. Исследовательские задачи требуют определить соответствующий интервал времени стерилизации для данной величины тепловой энергии. Корреляция между временем стерилизации и равномерным распределением температуры должна быть установлена для каждой части оборудования или его компонентов, которые подлежат аттестации.
Кроме того, могут быть взяты пробы температуры конденсата путем измерения температуры в каждой конденсатной линии, чтобы по полученным данным можно было судить о температуре внутри определенных частей оборудования.
Также должно быть получено распределение параметров химических инактивирующих агентов внутри частей оборудования (например, распределение рН в одной, по крайней мере, главной линии сброса жидких отходов) или должны быть сделаны анализы стерилизующего агента путем взятия проб в определенных местах демонтированных частей оборудования, которое подлежит изучению.
В.3.2 Инфракрасный анализ
Распределение температуры в биотехнологическом оборудовании может быть проведено непрямым методом с помощью инфракрасного анализа без демонтажа части оборудования (см. приложение С [6]).
В.4 Периодичность контроля стерильности
Продолжительный срок работы биотехнологического предприятия с соблюдением стерильности требует различных периодов контроля в зависимости от типа культуры (времени роста микроорганизмов), которые должны составлять (см. приложение С [1]):
Микробиологическая ферментация:
- ферментация бактериальных культур - 1 сут;
- ферментация дрожжей - 3 сут;
- ферментация грибов - 7 сут;
- выращивание клеток млекопитающих - 28 сут;
- выращивание растительных клеток - 28 сут.
Процессы ферментации некоторых бактериальных культур могут потребовать более длительного периода выращивания в силу низкой скорости роста, как, например, Xanthomonassp., или если применяется непрерывный процесс ферментации (см. приложение С [1]).
Приложение С
(справочное)
Библиография
[1] | DECHEMA; Steriltests, in Standardisierungs-und | |
[2] | F.A.Majoor and H.L. M Lelieveld. Proposal of a test procedure: Standardization of methods for testing of the hygienic characteristics of food processing equipment. 1 October 1984 CEN TC233/WG4Doc. N 60 | |
[3] | K.H. | |
[4] | Principles and Practice of Disinfection, Preservation and Sterilization. A.D. Russell (ed.). Blackwell Scientific Publications. Oxford | |
[5] | NF X42-101 | Biotechnology - Procedure for testing the capability for a fermentation plant under sterile conditions |
[6] | The Assessment of Risks in Scaled-Up Biotechnological Processes. J. Kastelein and T. Logtenberg; Progress Report 3: Containment Validation of a Continuous Centrifuge. TNO-Report 898-376, Apeldoorn/NL, 1989 | |
[7] | A method for the assessment of in-line steam sterilizability of processing equipment. A. W. Timperley et al. Trends in Food Science & Technology, 4 (1993) 3, 80-82 | |
[8] | EG-Leitfaden einer Guten Herstellungspraxis | |
[9] | Die Validierung mikrobiologischer Untersuchungsmethoden. Pharm. Ind. 54 (1992), 58 | |
[10] | Komittee | |
[11] |
| |
[12] | United States Pharmacopeia, (USP XXI), US Pharmacopeial Convention, Maryland, 1990 | |
[13] | Methods of testing of sterility, p.11-48.A. Beloian. In S.S. Block (ed.), Disinfection, sterilization and preservation, 2nd Edition, Lea & Febiger, Philadelphia, 1997 | |
[14] | Manual of Methods for general Bacteriology, chapter 23. Ph. Gerhardt (ed.). American Society for Microbiology, Washington D.C., 1981 | |
[15] | Cleaning Validation and Residue Limits: a contribution to current discussions. A.O. Zeller. Phar. Techn. Eur. p.18-27. November 1993 | |
[16] | Some techniques involved in study of adsorption of micro-organisms to surfaces. J. W. Costerton. In: Attachment of Micro-organisms to living and detrital surface, (p.403-423). John Wiley & Sons, Inc. USA | |
[17] | Microcalorimetry as a tool in microbiology and microbial ecology. Gustafsson L, In: Microbes in the Sea, Sleigh (ed.), Ellis Horwood Ltd, Chichester, England, 1987 | |
[18] | Gene Probes for Bacteria. A.J.L. Macario, E.C. de Macario, Academic Press inc. San Diego, 1990 | |
[19] | Council Directive 90/219/EEC of 23 April 1990 on the contained use of genetically modified micro-organisms. OJEC 08.05.1990, n° L 117 p 1 | |
[20] | Council Directive 90/679/EEC of 26 November 1990 on the protection of workers from risks related to exposure to biological agents at work (seventh individual Directive within the meaning of Article 16 (1) of Directive 89/391/EEC. OJEC 31.12.1990, n° L 374, p 1 | |
[21] | EN 285 | Sterilization - Steam sterilizers - Large sterilizers |
[22] | EN 554 | Sterilization of medical devices - Validation and routine control of sterilization by moist heat |
[23] | EN 1619 | Biotechnology - Large-scale process and production - General requirements for management and organization for strain conservation procedures |
__________________________________________________________________________
УДК 658.513:006.354 ОКС 07.080 Т58
07.100.01
Ключевые слова: биотехнология, стерилизация, методика, испытания, стерильность, микроорганизмы
__________________________________________________________________________
Электронный текст документа
и сверен по:
, 2014
