ГОСТ Р 59781-2021/ISO/TR 22758:2020
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
БИОТЕХНОЛОГИЯ
Биобанкинг. Руководство по внедрению ИСО 20387
Biotechnology. Biobanking. Implementation guide for ISO 20387
ОКС 07.080
Дата введения 2022-03-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Российский институт стандартизации" (ФГБУ "РСТ") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 326 "Биотехнологии"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 21 октября 2021 г. N 1234-ст
4 Настоящий стандарт идентичен международному документу ISO/TR 22758:2020* "Биотехнология. Биобанкинг. Руководство по внедрению ИСО 20387" (ISO/TR 22758:2020 "Biotechnology - Biobanking - Implementation guide for ISO 20387", IDT).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
Введение
Настоящий стандарт разработан с целью расширения аспектов ИСО 20387.
В отношении содержания настоящего стандарта необходимо отметить следующее:
- стандарт изложен таким образом, чтобы избежать предписаний и не содержит требований, так как они отсутствуют в техническом отчете;
- в настоящем стандарте не рассматриваются те разделы и подразделы ИСО 20387, которые не требуют пояснений (например, ИСО 20387:2018, разделы 1, 2 и 3, а также приложения А, В и С и т.д.);
- в разделах 4, 5, 6 и 7 настоящего стандарта рассматриваются общие аспекты, лежащие в основе требований ИСО 20387;
- в разделе 8 настоящего стандарта изложены отдельные требования ИСО 20387, как указано выше;
- по тексту настоящего стандарта приведены примеры для иллюстрации перечня возможностей, который не является исчерпывающим;
- для упрощения текста используют сокращения:
1) BMaD: ИСО 20387 определяет биологический материал (ИСО 20387:2018, 3.7) и связанные с ним данные (ИСО 20387:2018, 3.3). В настоящем стандарте термины объединены как "биологические материалы и/или связанные данные" (BMaD). Для отдельных положений стандарта, где указаны ссылки либо на биологический материал, либо на связанные с ним данные, приводят разъяснение термина.
2) FIP: Пригодность для предполагаемой области применения (ИСО 20387:2018, 3.24) также определяется ИСО 20387. В настоящем стандарте этот термин обозначается как FIP.
Для термина "биобанк" ранее существовали различные определения, и до сих пор ни одно определение не было общепринято научным сообществом.
ИСО 20387 определяет биобанк (ИСО 20387:2018, 3.5) как юридическое лицо или структурное подразделение юридического лица, которое осуществляет биобанкинг, а термин "биобанкинг" (ИСО 20387:2018, 3.6), как процесс приобретения и хранение биологического материала, включая конкретные действия или все действия, связанные со сбором, подготовкой, сохранением, испытанием, анализом и передачей определенного биологического материала, а также соответствующей информации и данных. В настоящем стандарте термин "биобанк" включает в себя как персонал, выполняющий деятельность в сфере биобанкинга от имени биобанка, так и саму организацию.
Биобанки имеют существенные различия в зависимости:
- от области распространения, которая может включать в себя один объект, например человек, животные, грибы, микробы и/или растения и т.д., или несколько объектов;
- типа биологического материала и данным, например нуклеиновые кислоты, ткани и т.д.;
- видов деятельности;
- типов вовлеченных в биобанкинг организаций; а также
- структуры, управления, контроля и функционирования.
Одновременно с приобретением биобанки могут выполнять сбор, обработку и хранение BMaD для неопределенного в настоящий момент будущего(их) использования(ий). В этих случаях биобанк может приобрести BMaD в соответствии со стандартными операционными процедурами (SOP), подходящими для предполагаемого конечного использования. В качестве альтернативы биобанки могут приобретать BMaD в ответ на запрос пользователя. Пользователь может указать критерии для BMaD и/или SOP, разработанных или примененных для конкретного использования.
Биобанки могут приобрести BMaD для исследователей, изучающих новые методы сбора, хранения или обработки биологических материалов и их влияние на различные образцы. В этих случаях биобанк может адаптировать процедуры в целях удовлетворения конкретной потребности исследователя, а не следовать общепринятым SOP по обращению с BMaD.
Биобанки различают по видам деятельности, которые они выполняют. Они могут либо выполнять полный спектр действий, включенных в определение биобанков в ИСО 20387, то есть сбор/приобретение, подготовку, сохранение, испытание, хранение, анализ и распространение BMaD либо часть этих действий, например сбор/приобретение и распространение.
Биобанки могут представлять собой различные типы организаций. Они могут быть независимыми юридическими лицами или принадлежать государственным учреждениям, академическим учреждениям, больницам, некоммерческим или коммерческим организациям.
Биобанки могут располагать несколькими местами осуществления деятельности, а иногда включать в себя стороны из комплексных учреждений или организаций. Кроме того, они могут осуществлять деятельность в разных регионах, а иногда в разных странах.
Биобанк должен установить сферу деятельности биобанка, для которой он хочет внедрить ИСО 20387.
1 Область применения
Настоящий стандарт устанавливает руководство для биобанков по внедрению менеджмента качества, менеджмента и технических требований в соответствии с ИСО 20387. Настоящий стандарт расширяет аспекты ИСО 20387 и для наглядности приводит примеры. Целью настоящего стандарта является оказание помощи биобанкам в решении вопросов профессиональной компетентности персонала, надлежащего качества биологического материала, а также сбора данных. Настоящий стандарт применим как к вновь создаваемым, так и существующим биобанкам.
Настоящий стандарт применим ко всем организациям, осуществляющим биобанкинг, включая биобанкинг биологических образцов многоклеточных организмов (например, человека, животных, грибов и растений) и микроорганизмов, предназначенных для исследований и разработок.
Настоящий стандарт не распространяется на биологический материал, предназначенный для производства пищевой/кормовой продукции, для лабораторий, проводящих исследования пищевой/кормовой продукции и/или для терапевтического использования.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения)]:
ISO 20387:2018, Biotechnology - Biobanking - General requirements for biobanking (Биотехнология. Биобанкинг. Общие требования)
3 Термины и определения
В настоящем стандарте применены термины и определения по ИСО 20387.
ISO и IEC ведут терминологические базы данных для использования в области стандартизации по следующим адресам:
- ISO онлайн-платформа для просмотра: доступна по http://www.iso.org/obp
- IEC Electropedia: доступно по http://www.electropedia.org/
4 Дополнительная информация о применении ИСО 20387
4.1 Общие положения
Требования ИСО 20387 предназначены для применения биобанками независимо от их размера, вида деятельности, ресурсов, а также уровней развития и/или сложности, в соответствии с областью применения.
Стимулом к разработке ИСО 20387 послужила необходимость установления обязательств по обеспечению устойчивости и надежности исследований, проводимых с BMaD, в целях поддержания надлежащего качества и воспроизводимости исследований и разработок. Реализация установленных положений может, в свою очередь, способствовать все более широкому распространению биологических материалов и связанных данных. Предполагается, что соответствие требованиям ИСО 20387 поможет демонстрировать приверженность профессионализму в сфере биобанкинга, укрепив доверие ключевых заинтересованных сторон, таких как общественность, доноры, пациенты, пользователи или спонсоры. Такие преимущества, как увеличение эффективности деятельности биобанков и возможности их взаимодействия, а также повышение конкурентоспособности, могут быть результатом соблюдения требований ИСО 20387. Эти преимущества также могут способствовать обеспечению устойчивости в условиях увеличивающейся степени сложности требований к научным исследованиям.
4.2 Целевая аудитория ИСО 20387 и настоящего стандарта
Целевая аудитория настоящего стандарта достаточно широкая, поскольку ИСО 20387 охватывает большой спектр биобанков. Настоящий стандарт служит инструментом, способствующим внедрению ИСО 20387 в сфере деятельности целого ряда биобанков, таких как:
a) биобанки многоклеточных организмов (например, человека, животных, растений) и микроорганизмов (для практической реализации и самостоятельной оценки);
b) биобанки с широким спектром процессов, таких как сбор/заготовка и/или приобретение и получение, маркировка, инвентаризация/регистрация, каталогизация/классификация, экспертиза, подготовка, сохранение, хранение, управление данными, уничтожение, упаковывание, а также обеспечение безопасности, распространение и транспортирование (ИСО 20387:2018, 4.1.1);
c) биобанки специализирующиеся на отдельных из вышеперечисленных видов деятельности, например приобретение и хранение;
d) биобанки, находящиеся на разных этапах практической реализации, например вновь создаваемые и действующие;
e) биобанки, расположенные в странах с разными уровнями экономического развития, например в странах с высоким, средним или низким уровнем доходов;
f) биобанки, оценщики, а также другие лица, являющиеся участниками схем оценки соответствия биобанкинга, как например оценка первой стороной (декларирование), второй стороной (на основании контракта/соглашения) и третьей стороной (сертификация/аккредитация);
g) биобанки, имеющие намерение использовать инновационные подходы, такие как репозиторий данных биологических материалов (виртуальный биобанкинг).
Общие требования по реализации положений ИСО 20387 применительно к биологическому материалу многоклеточных организмов и микроорганизмов во многом схожи, но каждая из этих областей имеет свои собственные потребности. Специфика предметной области может влиять на биобанкинг, следовательно, на менеджмент качества из-за разной природы биологического материала, специальных правил, этических принципов, процедурных или научных требований и требований пользователей. Конкретные стандарты, связанные с биобанками, в настоящее время разрабатываются в ИСО/ТК 276 "Биотехнология".
4.3 Внедрение требований ИСО 20387
Внедрение требований ИСО 20387 и методологических принципов, приведенных в настоящем стандарте, может обеспечить доверие к качеству образцов и результатам последующего анализа данных. Однако для внедрения стандарта потребуются ресурсы. Анализ несоответствия существующей практики биобанков представленным стандартным требованиям может быть полезным и может привести к разработке плана практической реализации требований. Это может быть реализовано поэтапно и занять некоторое время, особенно для небольших организаций с ограниченными ресурсами.
Каждый биобанк может идентифицировать и реализовать соответствующие требования в соответствии с тем, как он определил и задокументировал свою деятельность (ИСО 20387:2018, 5.7). ИСО 20387, как стандарт, позволяющий проводить оценку соответствия установленным требованиям, содержит три типа требований: общие требования, требования к СМК и к компетентности:
a) общие требования содержатся во всех стандартах применительно к указанному объекту. Если подтверждено, что продукт или услуга соответствует определенным требованиям стандарта, потенциальный пользователь получает основу для оценки продукта пригодности для предполагаемой области применения;
b) система менеджмента качества QMS (СМК) учитывает политику и цели в области обеспечения качества в своих процессах, что позволяет продемонстрировать эффективное использование ресурсов, оптимизировать риск менеджмент и увеличить надежность практической деятельности планов и записей, что способствует дальнейшему повышению доверия пользователей;
c) техническая компетентность представляет собой оценку персонала в части проверки профессиональных знаний и обеспечивает средства демонстрирования того, что предприятие обладает способностью применять знания и навыки для успешного достижения намеченного результата, включая выполнение требований стандарта. Техническая компетентность дает возможность биобанку продемонстрировать не только соответствие требованиям, но и то, что квалификация персонала обеспечивает возможность постоянно поддерживать качественную среду для дальнейшего повышения доверия пользователей.
Комплексная реализация всех трех перечисленных элементов может обеспечить повышение надежности и доверия к деятельности биобанка и, как следствие, результатов биобанкинга. Общепризнанным является тот факт, что реализация всех этих элементов может быть сложной и дорогостоящей, и выполнение всех трех элементов не всегда может иметь достаточное коммерческое обоснование с точки зрения биобанка. Учитывая вышеприведенное, может быть рассмотрено поэтапное внедрение ИСО 20387. В связи с этим, в качестве шага к реализации некоторых частей или всего стандарта, биобанк может выполнить определенные требования ранее других, например:
- новые биобанки имеют возможность сначала внедрить только определенные разделы ИСО 20387, а позже внедрить остальные;
- специализированные биобанки могут принять решение о внедрении только техчастей ИСО 20387 (ИСО 20387:2018, 5.7), которые имеют отношение к их деятельности;
- биобанки, которые уже внедрили надежную СМК, могут дополнить свою деятельность требованиями ИСО 20387.
Биобанки могут дифференцировать себя от конкурентов путем демонстрации технической компетентности (например, посредством оценки соответствия третьей стороной или аккредитации).
Следует обратить внимание, что требования к технической компетентности не могут быть реализованы отдельно от двух других элементов, поскольку оценка компетентности может быть проведена только при оценке выполнения остальных требований.
5 Пригодность для предполагаемой области применения (FIP) (ИСО 20387:2018, 3.24) биобанкинга
5.1 Основные положения
Непосредственной причиной разработки ИСО 20387 была востребованность BMaD надлежащего качества для предполагаемой области применения, обеспечивающих устойчивость и надежность исследований и разработок. Хотя понятие "пригодность для предполагаемой области применения" (FIP) является относительно новым, оно лежит в основе многих требований ИСО 20387. Качество часто является ключевой целью для конкретных результатов деятельности биобанков. В то время как пригодность для предполагаемой области применения является более широким понятием, так как включает в себя менеджмент качества и контроль качества, ориентированные на предполагаемую область применения или конечное использование. Оно может распространяться на юридические или этические требования, доступность ресурсов, биологические характеристики BMaD, а также другие аспекты.
По мере наращивания понимания ресурсного потенциала FIP, биобанк может также определить направление обращения с BMaD, тем самым повышая ценность предполагаемой области применения. Пользователь, если он известен, также может предоставить информацию.
Определение термина "соответствие целевому назначению" или "пригодность для предполагаемой области применения" приведено в ИСО 20387:2018 (3.24).
5.2 Пригодность для предполагаемой области применения и жизненный цикл биологического материала и/или связанных с ним данных (BMaD)
Сведения, относящиеся к FIP, играют важную роль при планировании, а также на различных этапах функционирования биобанкинга. На рисунке 1 приведена последовательность прохождения этапов BMaD, включающая возможность постоянной актуализации определенной FIP. На всех этапах жизненного цикла важны обработка и анализ, поскольку они вносят вклад в критерии FIP. На всех этапах должно быть обеспечено поддержание соответствующей документированной информации.
Несмотря на то, что на рисунке 1 изображена линейная последовательность прохождения этапов, их можно повторять, пропускать или располагать в разной последовательности. Такой индивидуальный выбор BMaD и их предполагаемое конечное использование может в дальнейшем поддерживаться путем совершенствования FIP как биобанком, так и пользователем (или прогнозируемой областью распространения, ориентированной на конечного пользования, в случае если пользователь не определен).
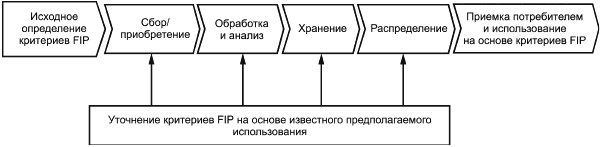 |
Рисунок 1 - Схематичное изображение последовательности этапов BMaD и связанных с ними критериев FIP в течение их жизненного цикла
Биологические материалы и связанные с ними данные со временем подвергают исследованию, обработке и/или другим формам использования. Область применения зависит от установленных и документально подтвержденных характеристик биологических материалов и связанных с ними данных. Пользователи BMaD и биобанки могут играть взаимодополняющие роли в течение жизненного цикла.
Биобанки обычно охватывают только часть жизненного цикла BMaD, но вместе с пользователями BMaD вносят значительный вклад в увеличение продолжительности их исследований и использования. Участие каждого биобанка в жизненном цикле BMaD индивидуально.
Пока BMaD находятся под контролем биобанка, существует возможность поддерживать и повышать их эффективность, как посредством строгого контроля условий окружающей среды, пополнения данных и их анализа, обеспечения сохранности и сведения к минимуму деградации материала за счет использования соответствующей длительной консервации и хранения. Увеличение эффективности таких действий может продлить срок полезного использования BMaD и расширить диапазон потенциальных возможностей целевого использования, то есть повысить пригодность BMaD для предполагаемой области применения. Независимо от того, известно или неизвестно конкретное конечное использование и/или пользователь, биобанк по-прежнему может устанавливать и уточнять критерии и/или действия FIP с течением времени, уделяя особое внимание BMaD и диапазону потенциального конечного использования.
С точки зрения пользователя, жизненный цикл BMaD может охватывать широкий круг различных направлений, но зачастую его началом служит идентификация или поиск материалов в соответствии с конкретной научно-исследовательской целью или предполагаемым применением, которые приводят к конкретному использованию BMaD - критерию, связанному с пригодностью для предполагаемой области применения. Пользователь может разработать свой план исследования, чтобы связать требования с предполагаемым конечным использованием, а затем оценить как соблюдение установленных требований, так и соответствие BMaD таким установленным требованиям, как пригодность для предполагаемой области конечного применения.
Долгосрочное и/или многократное сотрудничество между биобанком и конечным пользователем часто может привести к созданию BMaD, оптимально подходящего для предполагаемого конечного использования.
Примеры возможных заранее подготовленных оговоренных требований для обеспечения соответствия целевому назначению пригодности для предполагаемой области применения изложены в ИСО 20387:2018 (приложения А и В), и могут предусматривать возможность выбора BMaD (включая выбор конкретных переменных данных), методов испытаний, условий хранения, обращения, выбор расходных материалов и т.д.
5.3 Факторы, влияющие на пригодность для предполагаемой области применения
Учитывая большое разнообразие биобанков, их особенность и назначение, а также находящиеся в них биологические материалы и связанные с ними данные, факторы, влияющие на FIP, будут зависеть от конкретных условий. Требования (или предполагаемые требования), гарантирующие, что на FIP могут повлиять планы исследования, аналитические методы, этические/юридические и другие факторы.
Пример 1 - Если целью биобанка является предоставление биологического материала, из которого можно выделить ДНК для молекулярного анализа, то обращение с биологическим материалом в соответствии с международными стандартами [ИСО 20166-3, CEN/TS 16826-3 (проект ИСО 20184-3), ИСО 20186-3, CEN/TS 17305] или накопленный опыт молекулярных методов могут помочь обеспечить соответствие целевому назначению (если конечное использование не включает в себя оценку исследовательских подходов к выделению ДНК).
Сведения по определению FIP для конкретного использования могут включать в себя преаналитические переменные, характеристику биологического материала, уровень понимания происхождения образца и его данных и/или другие факторы, при необходимости.
Пригодность биологического материала для одного применения не означает пригодности для других.
Пример 2 - Биологический материал, зафиксированный в формалине, может обладать надлежащим качеством для гистологической оценки и иммуногистохимического окрашивания. Однако некоторые данные свидетельствуют о том, что из-за деградации РНК эти образцы не всегда могут подходить (соответствовать назначению) для анализа РНК.
Качество BMaD - это только одна составляющая FIP. Другие компоненты, которые позволяют удовлетворить конкретную цель или потребности пользователя, включают в себя достаточное количество BMaD для удовлетворения предполагаемой потребности; политик и процедур доступа и распределения; этических или юридических требований и т.д.
5.4 Определение предварительных требований к FIP
Биобанк и его пользователь (если он известен) независимо или совместно могут влиять на выбор требований в целях обеспечения FIP Это может быть основано на области деятельности и особенностях биобанка, а также на критериях оценки доказательств, если они имеются, для предполагаемого анализа. В тех случаях, когда пользователь не был идентифицирован до сбора/приобретения BMaD, выбор может оставаться за биобанком. Распределение этих обязанностей зависит от многих факторов, включая тип биобанка, размер, функцию, базу пользователей, менеджмент и т.д., и может варьироваться в зависимости от коллекции и от проекта к проекту.
BMaD может быть получен для заранее идентифицированного пользователя. В таких случаях пользователь определяет комплекс заранее оговоренных требований, часто во взаимодействии с биобанком, включая потенциально приемлемые характеристики BMaD и приемлемый диапазон качества, связанные с целью исследования и различными испытаниями, которые необходимо провести. И наоборот, когда пользователи не были заранее идентифицированы, BMaD допускается собирать и хранить для предполагаемых будущих практических применений, как во многих классических моделях биобанков. В таких случаях заранее устанавливают совокупность требований к сбору, хранению, распределению и использованию биологических материалов и связанных с ними данных на основе предполагаемых потребностей пользователей. В этом смысле биобанк может прогнозировать и заранее определять требования для FIP.
5.5 Решение о пригодности биологического материала и связанных с ним данных для предполагаемой области применения
В конечном итоге пользователь принимает решение о пригодности BMaD для предполагаемого применения, но это решение также может быть принято совместно с биобанком. Пригодность предполагаемой области применения со временем может меняться; такие факторы, как длительное хранение, развитие технологий, углубление понимания требований к конкретному применению и изменение первоначального целевого использования, могут влиять на пригодность BMaD для конкретного применения. Этому может способствовать тесное и постоянное взаимодействие между биобанком и его пользователем. В конечном итоге пользователь принимает решение об использовании BMaD для предусмотренного назначения.
6 Карта процессов
В то время как жизненный цикл охватывает ряд ключевых действий в рамках функционирования BMaD, карты процессов представляют собой процессно-ориентированный взгляд на сферы деятельности биобанка и обеспечивают обзор его основных процессов и их взаимосвязи. Они позволяют всем участвующим сторонам понять функции/полномочия биобанка и способы поддержания биобанком участвующих сторон для получения доступа к биологическому материалу и связанным с ним данным, пригодных для предполагаемой области применения.
Каждая фаза жизненного цикла биологического материала и связанных с ним данных характеризуется конкретными процессами, как показано на рисунке 2. Эти процессы могут быть организованы в иерархическом порядке таким образом, что определенные области процесса могут быть разделены на подробные процедуры и требования. Перечень процессов биобанка обычно подразделяют на три типа:
a) основные процессы биобанкинга напрямую создают и/или повышают эффективность для пользователей. Они отражают жизненный цикл биологического материала и связанных с ним данных от сбора, анализа, сохранения и хранения до распределения;
b) вспомогательные процессы биобанкинга дополняют и используют в основных процессах. Типичные примеры включают в себя контроль качества, управление информацией, контроль несоответствий, транспортирование и прослеживаемость;
c) процессы менеджмента применительно к биобанкингу обеспечивают методами корпоративного управления путем определения структурных требований, управления ресурсами, создания отчетов и документации и обеспечения беспристрастности и конфиденциальности.
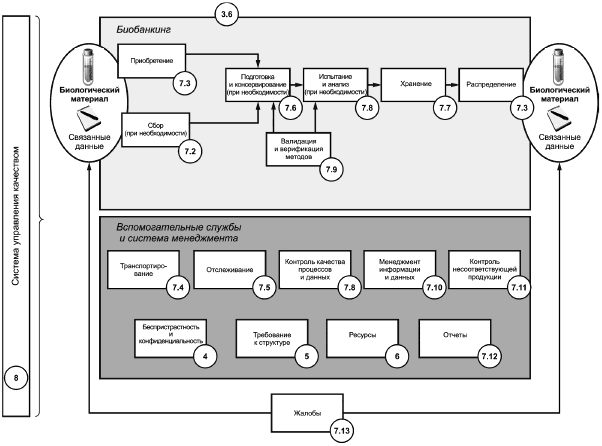 |
Рисунок 2 - Схематичное изображение элементов процесса биобанкинга, вспомогательных процессов и менеджмента, с номерами в кружках, соответствующими разделам ИСО 20387:2018
Модель карты процессов (см. рисунок 2) иллюстрирует общие требования ИСО 20387 и определяет разделы с соответствующими отдельными процессами. Указанный подход реализуется совместно с применением системы менеджмента качества, установленной в соответствии с ИСО 20387. Биобанк по своему усмотрению определяет последовательность работ с использованием направлений, соответствующих его видам деятельности и включает свои процессы в соответствующую систему менеджмента.
Любой биобанк может оценить свою систему менеджмента качества, охватывающую разные требования к биобанку, обеспечивающую пригодность BMaD для предполагаемой(ых) цели(ей). Руководство биобанка может сделать первый шаг в построении системы менеджмента качества, ведущей к соответствию ИСО 20387, установив соответствующие приоритеты, исходя из потребностей провайдеров и пользователей их ресурсов, а также местных, региональных и национальных требований.
Общепризнано, что в определенных географических точках могут существовать особые правила или требования, применимые к персоналу, их деятельности и обязанностям в этой области. Если биобанкинг требует соблюдения определенных стандартов (например, ИСО 15189, ИСО/МЭК 17020) или конкретных правил (например, Нагойского протокола [16]), биобанк, заинтересованный в таком признании, может получить дополнительные рекомендации, касающиеся этих стандартов и/или правил. Международные, национальные или региональные руководящие документы также помогают биобанку соответствовать как местным требованиям, так и требованиям ИСО 20387.
7 Соответствие ИСО 20387
7.1 Область соответствия
7.1.1 Общие положения
Оценка соответствия предполагает необходимость наличия установленной области применения с соответствующими актуальными целями, направленными на решение процессных задач и используемых методов. Каждый биобанк определяет процессы или действия, которые выполняют для обеспечения FIP BMaD в соответствии с требованиями ИСО 20387. Этот набор совместимых процессов составляет область применения или область соответствия биобанка ИСО 20387. Эта область может различается для каждого биобанка и относится:
a) к области распространения BMaD, относящейся к биобанку. Она может включать в себя BMaD из многоклеточных организмов и микроорганизмов, таких как ДНК, клеточные культуры, ткани, вирусы, кровь, костный мозг, моча, живые культуры, семена, растения и/или данные, такие как характеристика и целевое назначение;
b) различные виды деятельности биобанка, такие как приобретение, сбор, подготовка, хранение, испытание, анализ, хранение и распространение;
c) процедура(ы), соответствующие деятельности биобанка, включая собственный метод, стандартизованный и/или указанный метод, например мгновенное замораживание, сублимационная сушка глубоким замораживанием или другие методы сохранения, выделение, секвенирование, STR-типирование ДНК, ELISA, ПЦР, микроскопия, испытания на стабильность.
Примечание - Процедуры могут включать в себя оборудование/метод исследования, тип испытания/ анализа или параметры испытания/анализа.
Для классификации биологического материала биобанк может использовать глобальные уникальные идентификаторы, такие как медико-биологические идентификаторы [17], или другой подходящий источник, чтобы облегчить взаимодействие между областями применения. Аналогичным образом, для связанных данных биобанки могут выбрать использование международно-признанных онтологий, таких как "Минимум информации о совместном использовании данных биобанка" (MIABIS).
На рисунке 3 показана реализация этого на практике на примере биобанка.
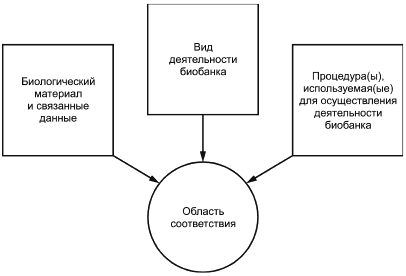 |
Рисунок 3 - Область соответствия
7.1.2 Определение области соответствия
В соответствии с требованиями ИСО 20387 оценка соответствия дает возможность продемонстрировать компетентность в определенной области. Область определяется биобанком и включает в себя все виды деятельности, которые биобанк планирует оценить.
Ниже приведен пример области соответствия биобанка, работающего с микроорганизмами:
a) приобретение;
b) подготовка и тестирование:
1) посев;
2) секвенирование;
3) микроскопия;
c) консервация и длительное хранение:
1) сублимационная сушка;
2) жидкий азот;
3) сверхнизкая температура;
d) распространение.
7.2 Оценка соответствия (ОС) (общие аспекты и применимость для биобанков)
Существует три уровня аттестации или демонстрации соответствия, которые приведены в таблице 1. Требования ИСО 20387 допускается использовать в качестве инструмента для аттестации на всех трех уровнях оценки соответствия (ОС). Есть ряд источников, в которых приведены рекомендации по применению оценки соответствия, некоторые из них можно найти в CASCO Toolbox [18].
Таблица 1 - Уровни аттестации ОС в соответствии с требованиями ИСО 20387
Тип | Сторона, проводящая ОС | Примеры свидетельств аттестации |
ОС первой стороной | Производитель или провайдер услуг (например, биобанк) | Декларирование |
ОС второй стороной | Покупатель или пользователь (например, медик-исследователь) | Отчет об оценке соответствия |
ОС третьей стороной | Орган по аккредитации | Сертификация/аккредитация |
Аккредитация - форма ОС третьей стороной. | ||
Оценка технической компетентности третьей стороной, которая включает в себя оценку объективным и независимым органом, является аккредитацией. В этом случае выдается сертификат соответствия, дающий письменное заверение в том, что продукт, процесс или услуга соответствуют установленным требованиям.
Ссылки на дополнительные ресурсы, в том числе на международные и национальные стандарты и на документы органов по аккредитации, приведены в библиографии.
8 Руководство по интерпретации отдельных частей ИСО 20387:2018
8.1 Общие требования (ИСО 20387:2018, раздел 4)
8.1.1 Общие положения
Раздел 4 ИСО 20387:2018 содержит ряд общих требований. Настоящий стандарт содержит дополнительные сведения и разъясняет основные понятия, рассматриваемые в разделе 4 ИСО 20387:2018.
8.1.2 Беспристрастность (ИСО 20387:2018, 4.2)
ИСО 20387 определяет беспристрастность как наличие объективности (в соответствии с требованиями ИСО/МЭК 17021-1:2015, 3.2).
Биобанки должны удовлетворять требования к беспристрастности, основывая свои действия на объективных критериях, тем самым избегая любой потенциальной предвзятости, предубеждения и/или конфликта интересов. Конфликт интересов может возникнуть в ситуации, когда интересы одной из сторон могут поставить под угрозу независимое, беспристрастное и объективное осуществление той или иной деятельности.
Предотвратить возникновение конфликтов интересов в биобанке, где довольно часто проекты основаны на научном сотрудничестве, бывает достаточно сложно.
В большинстве случаев главный исследователь собирает биоматериал и связанные с ним данные (BMaD) для исследовательского проекта, соавторами которого являются сотрудники биобанка. В таких случаях беспристрастность биобанкинга может быть подкреплена соблюдением политики и инструкций, обеспечивающих справедливый и равноправный доступ к биологическим ресурсам.
Механизмы смягчения последствий могут включать в себя надзор со стороны консультативных советов, таких как научно-консультативные коллегии, комитеты по доступу к биологическим материалам и т.д. Кроме этого, данная политика обеспечивает прозрачность.
8.1.3 Конфиденциальность (ИСО 20387:2018, 4.3)
Требование защиты конфиденциальной информации, касающейся BMaD и участвующих сторон, является частью юридической и этической обязанности биобанка. Типы конфиденциальной информации и управление ею могут варьироваться в зависимости от конкретного BMaD. Надлежащее обращение с конфиденциальной информацией может быть определено посредством сотрудничества с соответствующими заинтересованными сторонами с учетом любых юридических и/или этических ограничений.
8.2 Структурные требования (ИСО 20387:2018, раздел 5)
8.2.1 Общие положения
Организационные, финансовые, управленческие и другие структурные элементы биобанка часто взаимосвязаны. В разделе 5 ИСО 20387:2018 рассматриваются требования, связанные с этими компонентами. Настоящий стандарт содержит разъяснения по отдельным подпунктам, рассматриваемым в разделе 5 ИСО 20387:2018.
8.2.2 ИСО 20387:2018, 5.1
При условии соблюдения соответствующих применимых требований законодательства биобанк может быть:
a) государственным, частным или иным юридическим лицом;
b) самостоятельным или не выходящим за рамки государственного, частного или другого юридического лица подразделением. Биобанк может быть частью одной или нескольких следующих организаций: государственные учреждения, научные, образовательные организации, лечебные учреждения или неправительственные организации и т.д.
8.2.3 ИСО 20387:2018, 5.3
Сложность биобанка часто отражается на составе и сфере деятельности органа управления или консультативного совета.
8.2.4 ИСО 20387:2018, 5.5
В этом контексте ответственность является юридическим последствием деятельности биобанка.
Примерами возможных вариантов действий являются:
a) создание заявления/соглашения о пределах ответственности;
b) консультации с соответствующими юристами; или
c) разработка положения в договоре, регулирующего вопросы ответственности.
Системы внутреннего аудита способствуют снижению рисков. Страховка юридической ответственности или наличие управленческой поддержки в части ответственности может быть целесообразна.
Биобанк, который использует внешние процедуры, продукты и услуги для осуществления любой части своей деятельности, также может рассмотреть вопрос о том, как предусмотреть потенциальные последствия, связанные с ответственностью.
См. ИСО 20387:2018, 6.4 для внешних процессов, продуктов и услуг.
8.2.5 ИСО 20387:2018, 5.7
Биобанк не обязан включать весь спектр направлений работы в область деятельности, для которой заявляют соответствие ИСО 20387. Как правило, биобанк определяет конкретные виды деятельности, по которым заявляет о соответствии требованиям ИСО 20387; то есть область соответствия. Например, биобанк выполняет виды деятельности A, B и C; однако он может принять решение только о том, чтобы претендовать на соответствие требованиям ИСО 20387 для вида деятельности A. Область соответствия рассматривается во введении к настоящему стандарту.
8.2.6 ИСО 20387:2018, 5.8а
Научное руководство, разработка и реализация политики, принятие решений, спонсорство и надзор являются примерами, которые могут помочь определить структуру управления. Компоненты структурной организации и менеджмента иллюстрируют, как функции и обязанности биобанка распределяются, контролируются и координируются. Положение биобанка в головной/принимающей/управляющей организации (например, в больнице или университете), если это применимо, является важной частью этого определения. Определение структуры может включать в себя партнерство и взаимоотношения между партнерами, в частности, когда политические обязанности распределяются. Организационная схема и/или матрица могут помочь биобанку проиллюстрировать и описать его структуру.
8.2.7 ИСО 20387:2018, 5.9
В зависимости от организационной структуры биобанка и/или имеющихся ресурсов (таких как время, доступ к соответствующей информации, инструментам и менеджменту) обязанности могут распределяться между коллективом, а не быть закреплены за одним лицом.
Если обязанности, изложенные в ИСО 20387:2018, 5.7, выполняются более чем одним лицом, во избежание погрешностей и дублирования функций, которые могут угрожать стабильности, влияющей на качество и менеджмент качества, необходимо обеспечить согласованность действий между уполномоченными лицами.
Биобанк также может рассмотреть для дальнейшего применения 4.2 "Беспристрастность" и 6.2 "Персонал" ИСО 20387:2018.
Раздел касается необходимости обеспечения того, чтобы такие инструменты, как процессный подход или цикл "Планируй - Делай - Проверяй - Действуй" [Plan-Do-Check-Act (PDCA)] (см. ИСО 20387:2018, 8.2-8.9), последовательно применялись для достижения постоянного совершенствования и соответствия требованиям ИСО 20387.
В соответствии с ИСО 9001:2015 цикл PDCA можно кратко описать следующим образом:
- планируй - разработка целей системы и ее процессов, а также определение ресурсов, необходимых для достижения результатов в соответствии с требованиями потребителей и политикой организации, определение и рассмотрение рисков и возможностей;
- делай - выполнение того, что было запланировано;
- проверяй - мониторинг и (там, где это применимо) измерение процессов, продукции и услуг в сравнении с политикой, целями, требованиями и запланированными действиями и сообщение о результатах;
- действуй - принятие мер по улучшению результатов деятельности в той степени, насколько это необходимо.
Предвидение и учет рисков и возможностей является неотъемлемой частью планирования системы менеджмента качества (т.е. постановки целей, определения процессов). Примеры:
a) направление усилий на риски.
Пример - Нестабильность РНК при комнатной температуре требует хранения при низких температурах, например в морозильной камере при температуре минус 80°С. Риск при хранении связан с выходом из строя оборудования (например, из-за отключения питания или поломки). Следовательно, внедряют такие меры, как контроль температуры и системы сигнализации;
b) направление усилий на возможности.
Пример - Нестабильность РНК при комнатной температуре побудила исследователей разработать методы стабилизации. Использование стабилизаторов дает возможность продлить время между сбором образца и началом обработки (при комнатной температуре) без ущерба для качества РНК.
Подход, основанный на оценке риска, предназначен для систематического определения суммарных факторов рисков и возможностей планирования процессов с учетом их связи с ожидаемыми количественными или качественными характеристиками результатов процесса. Это может привести к тому, что некоторые виды деятельности в процессе менее подвержены негативному влиянию на результат процесса, чем другие; следовательно, они подвергаются меньшему контролю, чем другие. Также можно обнаружить, что конкретный шаг в процессе чрезвычайно важен для достижения предполагаемого качества образца, поэтому в данном случае используют только обученный персонал и валидированное оборудование.
8.3 Требования к ресурсам (ИСО 20387:2018, раздел 6)
8.3.1 Общие требования
Раздел 6 ИСО 20387:2018 включает в себя ряд требований к ресурсам, включая персонал, его обучение и соответствие профессиональным требованиям, помещения, оборудование, а также процессы, продукты и услуги, поставляемые внешними провайдерами. Настоящий стандарт обеспечивает дальнейшее разъяснение некоторых основных положений, изложенных в ИСО 20387:2018, раздел 6.
Необходимые ресурсы могут различаться в зависимости от типа BMaD, типа исследования и других видов деятельности, выполняемых биобанком.
8.3.2 ИСО 20387:2018, 6.1.2
В соответствии с требованиями ИСО 20387 для обеспечения финансовой устойчивости биобанку следует четко документировать свою стратегию. Это может включать в себя как отдельные, так и все нижеперечисленные типы планирования:
a) стратегический план;
b) бизнес-план;
c) соглашение между биобанком и его спонсорами;
d) перечень актуальных потребностей;
e) план устойчивого развития.
Периодические пересмотры стратегии дают возможность оценить и конкретизировать потребности биобанка в контексте его текущей и планируемой деятельности.
Для оптимальной реализации стратегии биобанк может разработать план. Примеры включают:
- разработку стратегии возмещения издержек на предоставление услуг;
- разработку плана диверсификации источников финансирования; или
- пересмотр масштабов деятельности с учетом доступности ресурсов в динамике и внесение соответствующих корректировок.
Общепризнанным является факт, что с течением времени происходят изменения. Такие изменения могут коснуться доступности ресурсов, источников финансирования, области применения, а также потребности пользователей. В таких случаях биобанк может соответствующим образом скорректировать свою деятельность (например, сократить масштаб деятельности, провести корректировки в части хранения и управления).
8.3.3 ИСО 20387:2018, 6.2.1.2
Конфиденциальность в контексте биобанкинга определена в пункте 4.3 ИСО 20387:2018. В целях ее обеспечения может являться обязательным требование к персоналу биобанка о подписании соглашения о конфиденциальности или соглашения о неразглашении.
8.3.4 ИСО 20387:2018, 6.2.1.4
Персонал биобанка должен быть в полной мере информирован об ответственности, а также обязанностях и полномочиях. Биобанк может рассмотреть возможность разделения перечня должностных обязанностей между своим персоналом.
8.3.5 ИСО 20387:2018, 6.2.2.1
Компетентный персонал способствует квалифицированному выполнению задач биобанкинга, что включает в себя также дополнительные функции (например, ИТ, поддержание инфраструктуры объектов, человеческие ресурсы, юридические вопросы). Описание должности или задачи может касаться любой общей, управленческой и операционной деятельности, для которой требуется определенная квалификация. Конкретные описания могут включать в себя обязанности и полномочия персонала биобанка, а также компетенции или навыки, необходимые для выполнения этих действий. Также могут быть приняты во внимание любые нормативные или законодательные требования к соответствующим компетенциям (например, профессиональная сертификация для патологоанатомов или ветеринарных патологов).
Описание задач или должностей следует регулярно анализировать и обновлять по мере необходимости.
8.3.6 ИСО 20387:2018, 6.2.2.3
Документальное подтверждение квалификации персонала должно включать в себя должностные инструкции, сертификаты об обучении и декларации компетентности.
Матрица данных о персонале и пройденном обучении может быть полезна для демонстрации компетентности (см. ИСО 20387:2018, 6.2.3.1). Необходимо учитывать, что часть информации может быть конфиденциальной (например, персональные данные). Однако в случае аудита может потребоваться доступ даже к конфиденциальной информации.
8.3.7 ИСО 20387:2018, 6.2.3
Для компетентности биобанка могут быть полезны планы обучения, согласованные с потребностями организации. Планы обучения могут быть составлены как для всего персонала биобанка, так и для отдельных лиц. Выявленная потребность в обучении может быть реализована путем внутреннего обучения, которое проводится собственным персоналом организации, или сторонними организациями, занимающимися обучением. Биобанк может периодически оценивать эффективность обучения, например с помощью тестов или аттестаций.
8.3.8 ИСО 20387:2018, 6.2.3.3
Новый персонал проходит поэтапный инструктаж, часть которого является общей для всех сотрудников (например, знакомство с организацией, принципами конфиденциальности и объективности, использованием информационных и коммуникационных инструментов), другие разделы специфичны для определенных работ (например, требования к гигиене и технике безопасности, функции и инструменты для конкретной должности). Этот инструктаж может завершиться подтверждением компетентности обучаемого и официальным разрешением на выполнение работ, которые соответствуют его квалификации (см. ИСО 20387:2018, 6.2.3.2). В зависимости от критериев компетентности биобанка одобрение может быть предварительным, и квалификация работника будет подлежать дальнейшей оценке во время работы. Для конкретных технических задач (например, тестов контроля качества) может быть полезно позволить работнику выполнить тест, а затем сравнить полученные результаты с ожидаемыми.
8.3.9 ИСО 20387:2018, 6.3
Объекты биобанка и условия окружающей среды могут оказать значительное влияние на качество, целостность, безопасность FIP и BMaD, а также на здоровье и безопасность персонала. Некоторые из них показаны на рисунке 4.
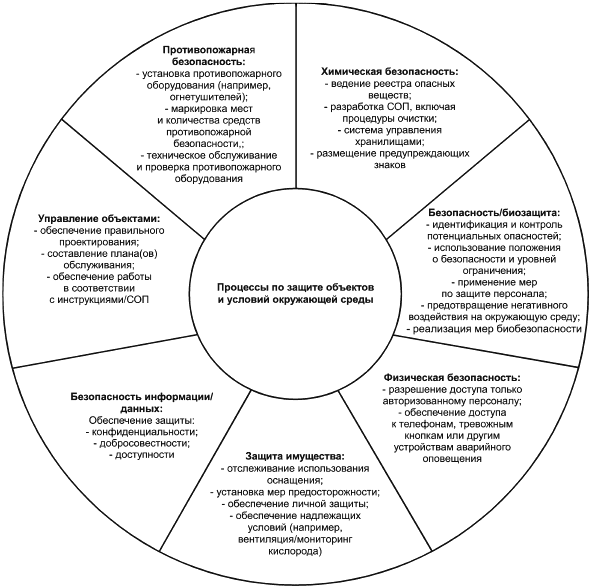 |
Рисунок 4 - Аспекты, касающиеся процессов по защите объектов и условий окружающей среды
Объекты/специально выделенные зоны и условия окружающей среды могут включать в себя ряд конструкционных и организационных элементов, таких как здания, инженерные сети и рабочие места, используемые для работы биобанка, а также программы и методы, используемые биобанком. Кроме того, они включают в себя техническое оснащение, такое как техническое и программное обеспечение, информационные и коммуникационные технологии, службы безопасности и другие услуги (мониторинг окружающей среды, контроль и учет доступа, удаленный контроль и т.д.). Любые необходимые резервы (например, резервные хранилища, альтернативные источники энергии), также могут быть включены в независимости от того, являются ли они исключительной собственностью биобанка.
8.3.10 ИСО 20387:2018, 6.3.2
Для обеспечения соответствия определенным критериям контроля качества биобанку необходимо обеспечить наличие плана эксплуатационного обслуживания.
Политика биобезопасности при необходимости может включать ограничение и контроль доступа к критически важным зонам, биологическим ресурсам и конфиденциальной информации. Процедура доступа биобанка может опираться на контроль списков сторонних посетителей и их соответствующей защите.
Дополнительная информация о "пригодности для предполагаемой области применения" представлена в разделе 5 настоящего стандарта.
8.3.11 ИСО 20387:2018, 6.3.3
Несовместимые виды деятельности включают в себя всякие действия, предпринимаемые персоналом, или действия, отрицательно влияющие на качество BMaD в биобанке, например перекрестное загрязнение. Необходимо оценивать и устранять любое возникновение несовместимого вида деятельности в каждом конкретном случае.
Разделение несовместимых видов деятельности может быть достигнуто путем:
a) выполнения таких действий в разных или специально выделенных зонах;
b) выполнение таких действий в разное время с надлежащей подготовкой (например, уборка помещений, маркировка и т.д.); и/или
c) определение способов, которые позволят избежать пересечения несовместимых BMaD.
Если производственно-техническая база биобанка находится в совместном пользовании с другими организациями, то особенно важно оценить возможную несовместимость их видов деятельности. В дополнение к мерам, упомянутым выше, может быть установлена политика безопасности, такая как четкое указание инфекционных рисков, соответствующих режимов дезактивации, стерильности и изоляции и т.д. Взаимодействие между биобанком и сторонами, с которыми он разделяет производственно-техническую базу может регулироваться соглашением о сотрудничестве или порядком эксплуатации.
8.3.12 ИСО 20387:2018, 6.3.5
Условия окружающей среды могут влиять на результаты деятельности биобанка и пригодность BMaD для предполагаемой области применения и/или на здоровье и безопасность персонала. Биобанку следует осуществлять наблюдение и контроль за условиями окружающей среды своей инфраструктуры.
Для определения условий окружающей среды (например, температуры, влажности, давления воздуха и т.д.), влияющих на BMaD и/или здоровье и безопасность персонала, биобанк может использовать подход, основанный на оценке риска, учитывая при этом спецификации поставщиков, соответствующие нормативные акты, передовой опыт или другие источники, в том числе опубликованные в литературе.
Кроме того, биобанк может разработать и внедрить план мониторинга и контроля выявленных условий окружающей среды. Мониторинг допускается выполнять и регистрировать на постоянной основе или через заданные интервалы времени. Относительно условий окружающей среды, превышающих установленный уровень, биобанк должен документировать предпринятые действия.
8.3.13 ИСО 20387:2018, 6.3.7
Биобанк должен оценить риск возможной порчи BMaD. План действий в чрезвычайных ситуациях, разработанный на основе этой оценки рисков, обеспечивает снижение отрицательных последствий. Примеры снижения отрицательных последствий, поддерживающие план действий в чрезвычайных ситуациях, могут включать в себя альтернативные места хранения, недопущение мест хранения в подвальных, полуподвальных (цокольных) этажах зданий и на доступных поверхностях, а также мероприятия, проводимые после аварийных ситуаций, такие как дезинфекция рабочей зоны и т.д. Также может быть рассмотрено снижение риска отрицательных последствий от потери данных (например, система резервного копирования информации). См. также ИСО 20387:2018, 7.7.1, 7.7.2 и 8.5.2.
Дополнительные ссылки приведены в 4-м издании ISBER Best Practices B5, B7, B8, C9, I2 и I12 [19].
8.3.14 ИСО 20387:2018, 6.4.1.1
Процессы, продукты и услуги, поставляемые внешними провайдерами, определяются как поставляемые юридическим лицом (или его частью), не являющимся биобанком. Соглашение между провайдером и биобанком должно способствовать соблюдению требований, описанных в ИСО 20387:2018, 6.4.
8.3.15 ИСО 20387:2018, 6.4.1.5
Верификация может выполняться внешним провайдером в соответствии с согласованными процедурами и/или биобанком на основе заранее определенных мер контроля качества. Примеры того, как можно проверить внешних провайдеров:
a) анализ внутреннего аудита внешнего провайдера (аудиты первой стороной); и/или
b) аудиты внешнего провайдера, проводимые биобанком (аудиты второй стороной).
8.3.16 ИСО 20387:2018, 6.4.1.6
Для внешней деятельности, приведенной в 6.4.1.6, валидация рассматривается в ИСО 20387:2018, 7.9.2.
8.3.17 ИСО 20387:2018, 6.5.1
Цель контролируемого доступа предусматривает возможность использовать оборудование контролируемым образом в то время, когда это необходимо.
Перед использованием оборудование можно проверить на соответствие назначению. Это может быть достигнуто, например, за счет гарантии стабильности оборудования в отношении любых характеристик, которые могут повлиять на качество BMaD.
Если биобанк не полностью владеет оборудованием, необходимым для выполнения его задач, ему необходимо иметь доступ к оборудованию, не принадлежащему ему. В таких случаях биобанк должен обладать знаниями надлежащего уровня об условиях его эксплуатации, например путем верификации.
8.3.18 ИСО 20387:2018, 6.5.3
Инструкции производителя могут представлять собой только инструкцию по эксплуатации.
8.3.19 ИСО 20387:2018, 6.5.6
Данную задачу может выполнить поставщик, сервисный подрядчик или биобанк.
8.3.20 ИСО 20387:2018, 6.5.10
Метрологическая прослеживаемость обеспечивает сопоставимость результатов измерения между биобанками. Например, многим биобанкам необходима достоверность в результатах измерения температуры во время транспортирования и хранения. Достоверность может быть установлена и количественно определена путем сравнения результата измерения с результатом стандартного образца с известным ("истинным") значением и связанной с ним неопределенностью.
Для измерений, основанных на единицах СИ или производных единицах СИ, это сравнение достигается с помощью международно-признанных (стандартных или сертифицированных) эталонных материалов (например, калибровки весов с помощью эталонной гири или датчика температуры, откалиброванного по международному или национальному эталону).
В случае измерений, основанных не на системе СИ или производных единицах СИ (например, флюометрических единицах), как правило отсутствуют стандарты, либо результаты не признаны на международном уровне. В таких случаях биобанк может разрабатывать и использовать свои собственные стандарты или справочные материалы для обеспечения внутренней уверенности в неизменно надежных измерениях.
Также может быть целесообразным участие в программах внешней оценки качества или программах проверки квалификации.
Примечание - Дополнительную информацию можно найти в ИСО 9001, ИСО/МЭК 17025 и Руководстве ИСО/МЭК 99:2007.
8.3.21 ИСО 20387:2018, 6.5.11
Биобанк может назначить лицо, ответственное за оборудование, которое было признано несовместимым. Назначенное(ые) лицо(а) может (могут) маркировать такое оборудование как несоответствующее и принять надлежащие меры.
8.3.22 ИСО 20387:2018, 6.5.12
Например, во время калибровки персонал обнаружил неисправность работы термометра. Это означает, что измерения температуры, выполненные до обнаружения неисправности, могут быть ошибочные, и требуют дальнейшего изучения базы данных результатов измерений температуры прошлых лет.
8.4 Требования к технологическим процессам (ИСО 20387:2018, раздел 7)
8.4.1 Общие положения
В разделе 7 ИСО 20387:2018 приведены технические требования к биобанкингу и дальнейшие разъяснения основных понятий, рассматриваемых в ИСО 20387:2018, раздел 7.
8.4.2 ИСО 20387:2018, 7.1.1
Биобанк может обеспечить эту серию требований путем описания всех процессов, происходящих в течение жизненного цикла BMaD, которые потенциально влияют на его FIP.
Этапы жизненного цикла обычно включают сбор/приобретение, анализ, обработку, хранение, доступ и распространение и могут варьироваться от биобанка к биобанку. Жизненный цикл BMaD обычно зависит от сферы деятельности биобанка, требований к контролю качества и соглашений с пользователями.
Ответственность биобанка ограничивается этапами жизненного цикла BMaD, находящимися под его контролем, и включает в себя как внутренние процессы, так и внешние - взаимодействие с субподрядчиками (там, где это применимо). Принципиальная схема рабочего процесса предусматривает краткое описание процессов биобанка и их последовательности от сбора до утилизации.
Более подробная информация приведена в 5.2.
8.4.3 ИСО 20387:2018, 7.2.1.1
В процессе сбора и/или приобретения биобанк определяет и приобретает всю соответствующую информацию, которая считается необходимой для достижения целей биобанка. Это может включать в себя информацию, которая поддерживает достижение пригодности для предполагаемой области применения.
Такая информация, как таксономические данные, временная метка, дата, место и процедура сбора или распространения, предусмотрена в ИСО 20387:2018 и задокументирована в приложении А с примерами, приведенными в приложении В. Следует обратить внимание, что дата и временная метка документируются в стандартном формате в соответствии с ИСО 8601-1 (там, где это применимо).
8.4.4 ИСО 20387:2018, 7.2.3.4
К биобанкам может применяться широкий спектр этических требований в зависимости от характера и типа биобанка, BMaD и любых применимых международных, национальных и местных нормативных актов и политик. Этические требования, непосредственно относятся к биобанкингу BMaD человека и могут включать в себя следующее:
a) рассмотрение(я) и утверждение(я) комитетом по этике;
b) информированное согласие пациента/донора/законного представителя или отказ от информированного согласия при определенных обстоятельствах.
Кроме того, к соответствующим данным допускается применять и другие требования, касающиеся неприкосновенности частной жизни, соблюдения врачебной тайны и защиты персональных данных, а также конкретные данные, такие как медицинская карта, генетические и геномные данные.
Перед сбором BMaD биобанки могут проконсультироваться с соответствующими регулирующими и должностными лицами для установления любых соответствующих этических требований.
8.4.5 ИСО 20387:2018, 7.3.1.1
В установление принципов, регулирующих доступ к BMaD и их распространению, могут быть вовлечены разные стороны, и в соответствии с установленным планом управления могут включать в себя следующее:
- менеджера биобанка и/или менеджера конкретной коллекции BMaD;
- доверенное лицо или физическое лицо, уполномоченное принимать решения от имени биобанка;
- внутриорганизационное руководство; и/или
- лица, участвующие в управлении биобанком.
При разработке политики и процедур доступа и распределения BMaD следует учитывать важные принципы, включающие прозрачность, подотчетность, свободу от конфликтов интересов и ответственное использование ресурсов.
Правила, регулирующие доступ к BMaD и их распределению, могут включать в себя следующие научно-обоснованные аспекты, которые необходимо учитывать:
a) целесообразность использования биологических материалов;
b) научную ценность и возможные последствия использования;
c) схему проведения исследования;
d) наличие финансирования, опыта и квалификации исследователей;
e) наличие и достаточность исследовательских центров и оборудования и т.д.
Этические и правовые аспекты и требования также могут определять доступ к BMaD и их распространению. Они могут включать:
- соблюдение этических и нормативных требований (таких как субъект-человек, правила конфиденциальности и защиты данных или Конвенция о биологическом разнообразии - Нагойский протокол [16]);
- выгоды и риски для доноров, населения и общества в целом;
- защита частной жизни доноров и конфиденциальности их данных;
- согласованность права использования исследования с информированным согласием (в соответствующих случаях);
- любые договорные обязательства, связанные с использованием материалов; и
- документальное подтверждение необходимых разрешений регулирующих органов.
Правила, регулирующие доступ к BMaD и их распределению, могут быть задокументированы разными способами, например с использованием SOP, государственного управления или опекунства, описание которых может быть приведено и опубликовано на веб-сайте биобанка или в других соответствующих средствах массовой информации, особенно если целью биобанка является предоставление BMaD для исследовательских целей, выходящих за рамки местного (т.е. внутриорганизационного) использования.
Биобанки могут использовать разные способы обеспечения соответствия документированных требований, установленных с заинтересованными сторонами, этим принципам. Это может быть достигнуто с помощью соглашений о передаче материалов или использовании данных, а также других договорных или внедоговорных соглашений, описывающих обязательства пользователя BMaD.
8.4.6 ИСО 20387:2018, 7.3.2.4
Разделение BMaD может происходить в установленных и/или четко выраженных областях. Это разделение может быть физическим или виртуальным, если его можно идентифицировать. Соответствие требованиям качества дополнительно рассматривается в ИСО 20387:2018, 7.8.
8.4.7 ИСО 20387:2018, 7.3.2.5
Характеристики BMaD, связанные с пригодностью для использования по назначению, устанавливаются и документируются биобанком и, если требуется, рассматриваются получателем/пользователем.
8.4.8 ИСО 20387:2018, 7.3.3.2
Эти соглашения могут оговаривать условия для каждой вовлеченной стороны, связанные с предоставлением и использованием BMaD, и могут включать:
a) определение BMaD и его предполагаемого назначения, включая любые границы использования (например, совместное использование с третьими лицами, запрет использования in vivo для людей, биологическая опасность и меры предосторожности и т.д.);
b) правовые и этические требования к поставляемому BMaD (например, условия конфиденциальности, защита персональных данных, интеллектуальной собственности и прав на публикацию и т.д.);
c) другие положения, касающиеся BMaD и/или вовлеченных сторон (например, подтверждение биобанка о публикациях, отчет о результатах исследований и/или BMaD в биобанке, распоряжение о BMaD).
Эти документы могут принимать форму договорных соглашений, таких как соглашение о передаче материалов (Material Transfer Agreement, МТА) или другие юридически обязательные внедоговорные документы.
8.4.9 ИСО 20387:2018, 7.4.2
Цепочка обеспечения сохранности установлена в 3.12 ИСО 20387:2018 как ответственность и контроль BMaD по мере их прохождения через каждый этап процесса. Информация, относящаяся к событиям и условиям транспортирования, которые потенциально могут повлиять на качество биологического материала, может регистрироваться персоналом в каждом подразделении, осуществляющем обработку соответствующего биологического материала. Примеры цепочки хранения при транспортировании могут включать в себя транспортирование внутри биобанка, доставку между биобанками и получателями, прием биологического материала в принимающем биобанке и т.д. и могут включать в себя процессы, используемые соответствующими сторонами, включая отправителей груза. Биобанк может вести учет критических цепочек хранения, включая отклонения от ранее определенных параметров.
Цепочка поставок во время транспортирования является частью соглашений или юридически обязательных документов между отправителем и получателем.
8.4.10 ИСО 20387:2018, 7.4.5
На требуемую компетентность влияет тип биологического материала, договорные и правовые требования к отгрузке и применимые процедуры отправки. Компетентность персонала, участвующего в подготовке биологического материала к отправке, может быть обеспечена с учетом положений ИСО 20387:2018, 6.2.2.
8.4.11 ИСО 20387:2018, 7.6.2
Подход, основанный на оценке риска, может помочь в определении критических видов деятельности, а также соответствующих параметров мониторинга и мер процедуры подготовки и/или сохранения. Документация по этим процедурам может быть разработана в соответствии с ИСО 20387:2018, приложение А.4.
Документирование каждого этапа подготовки и сохранения позволяет отслеживать заранее определенные критические виды деятельности, например, для анализа, включая предварительные аналитические переменные, контроль качества и/или демонстрацию соответствия назначению.
8.4.12 ИСО 20387:2018, 7.7.1
В случае стихийного бедствия (например, пожара, землетрясения, наводнения, отказа критических систем, таких как электроснабжение и т.д.) обычные методы защиты биологического материала, вероятно, будут недоступны и/или неэффективны. Могут потребоваться альтернативные/дополнительные методы. Разработка и реализация плана защиты от стихийных бедствий может помочь снизить риск повреждения или потери BMaD во время стихийного бедствия. Этот план может определять действия и обязанности и может включать в себя альтернативные/дополнительные методы, системы, инфраструктуру и/или оборудование.
8.4.13 ИСО 20387:2018, 7.7.3
Биобанк в соответствии с ИСО 20387:2018, 7.1.1, 7.8.2.7 и приложениями A и B должен определить, какие виды деятельности являются критическими и какие параметры являются важными в течение жизненного цикла каждого типа биологического материала, с которым он работает. Определение термина "критический" приведено в ИСО 20387:2018, 3.16.
Когда биобанк не может записать параметр, считающийся критическим по согласованию с коллегами, запросу пользователя или нормативным требованиям (для одного биологического материала или для всей коллекции), биобанк может записать параметр как отсутствующий/недоступный, минус 1 (или другой соответствующий термин), но не оставлять значение незаполненным. Неизвестные данные в метках даты/времени могут быть записаны как в следующем примере: "9999/12/31".
Желательно, чтобы дата и время в биобанках форматировались в соответствии с ИСО 8601-1, но также признается, что общепринятая местная практика может отличаться, или отправитель не может внедрить положения ИСО 8601-1. Общий формат может поддерживать взаимодействие.
8.4.14 ИСО 20387:2018, 7.7.5
В качестве примеров руководств биобанк может обратиться к руководствам по передовой практике, таким как лучшие практики Международного общества биологических и экологических хранилищ (ISBER) (см. B9 и C8 [19]), лучшие практики Национального института онкологии США (NCI) для ресурсов биопрепаратов [20], Рекомендации ОЭСР по передовой практике для центров биологических ресурсов [22] или другие руководства, приведенные в библиографии ИСО 20387:2018 и настоящего стандарта.
8.4.15 ИСО 20387:2018, 7.7.7
Биобанк может определить необходимые элементы для завершения инвентаризации. Затем биобанк может определить процедуры периодической оценки инвентаризации. Эта оценка может быть основана на общих принципах и неотъемлемых рисках, связанных с BMaD (например, здоровье и безопасность, биобезопасность, целостность BMaD и т.д.), их обращении и хранении. Биобанк может определять подходящие интервалы и методы (например, случайный отбор проб, анализ данных оперативного отбора проб и распределения), отражающие оценку риска и влияние оценки на биологический материал.
8.4.16 ИСО 20387:2018, 7.8.1.2
Контроль качества (QC) в биобанках обычно включает в себя выявление и оценку показателей качества стадий жизненного цикла BMaD, относящихся к пригодности для предполагаемой области применения. Эти этапы могут включать в себя сбор, проведение испытаний, транспортирование, хранение, обработку, аннотацию и распределение. Биобанк может определять, применять и оценивать показатели контроля качества, относящиеся к любым внутренним процессам и процессам, поставляемым внешними провайдерами. Если процедуры контроля качества могут привести к повреждению или неприемлемому уничтожению BMaD (например, в случае редких или устаревших материалов), биобанк может выразить желание соответствующим образом скорректировать процедуры контроля качества. Одним из возможных подходов к определению показателей QC является разработка диаграммы "рыбья кость", также известной как причинно-следственная диаграмма или диаграмма Исикавы. Другие формы анализа первопричин также могут быть полезны.
Процедуры контроля качества, выполняемые для BMaD на всех этапах жизненного цикла, имеют решающее значение для демонстрации того, что BMaD подходит для предполагаемой цели.
QC на каждом этапе жизненного цикла BMaD основан:
a) на технических характеристиках BMaD, основанных на (предполагаемом) конечном использовании;
b) протоколах контроля качества QC;
c) оценке показателей QC;
d) поддержании цепочки прослеживаемости.
Невозможность завершить процедуры QC, например в случае редких или устаревших BMaD может быть частично устранена путем ссылки на другие данные, по мере их поступления, и может поддержать оценку FIP пользователями, например, обратной связью от предыдущих пользователей.
8.4.17 ИСО 20387:2018, 7.9.1.1
Валидация направлена на демонстрацию того, что продукт или процесс пригодны для предполагаемой области применения. Основные исходные данные для валидации метода включают в себя формулировку о цели, спецификации, которые должны быть достигнуты, и процедуру(ы), которая(ые) необходимо соблюдать во время критической деятельности. Валидация может быть достигнута с помощью разных средств, включая испытания, рецензируемые исследования, моделирование и т.д., чтобы обеспечить необходимые доказательства для достижения пригодности для намеченной цели. Такие доказательства обычно включают в себя спецификации для таких параметров, как идентичность, эффективность, чистота, амплификация, точность и воспроизводимость.
Валидация может предоставить документальное подтверждение того, что рассматриваемая процедура или процесс последовательно дает правильный продукт или результат процесса, то есть продукт или процесс пригоден для предполагаемой области применения.
Верификация показывает, что продукт или процесс соответствуют заранее определенным спецификациям и могут быть результатом проверки (ИСО 9000:2015, 3.11.7) или других форм определения (ИСО 9000:2015, 3.11.1), таких как альтернативные расчеты или обзор документации (ИСО 9000:2015, 3.8.5). ИСО 9000:2015 определяет эти термины как:
- контроль (inspection): Определение соответствия установленным требованиям (ИСО 9000:2015, 3.11.7);
- определение (determination): Деятельность по выявлению одной или нескольких характеристик (ИСО 9000:2015, 3.10.1) и значений этих характеристик.
8.4.18 ИСО 20387:2018, 7.10.5
Доступ к каталогу доступных BMaD биобанка может быть предоставлен заинтересованным сторонам с помощью электронных и/или неэлектронных инструментов (например, базы данных, электронного каталога, электронных файлов, печатного каталога). Сети биобанков могут разрабатывать общие каталоги. Содержание и формат таких каталогов определяет биобанк. Процесс каталогизации может соответствовать требованиям конфиденциальности (ИСО 20387:2018, 4.3), функциональной совместимости (ИСО 20387:2018, 7.10) и принципам доступа (ИСО 20387:2018, 7.3.1.1).
8.4.19 ИСО 20387:2018, 7.12.2.1
Этот пункт в ИСО 20387 касается двух понятий - определения действительных причин не включать тот или иной пункт в отчет, как это приведено в перечислениях a)-I), и средств документирования этих действительных причин. В каждом конкретном случае может быть приведено обоснование уважительных причин. Эти причины могут быть включены в процедуру или доведены до сведения пользователей посредством соглашений или определенных технических условий/договоренностей (например, непрерывная передача данных независимо от передачи биологического материала).
8.4.20 ИСО 20387:2018, 7.13.2
Биобанк может разработать краткое изложение процесса рассмотрения жалобы или SOP биобанка для обмена с заявителями и/или другими заинтересованными сторонами.
8.5 Требования к системе менеджмента качества (ИСО 20387:2018, раздел 8)
8.5.1 Общие положения
Раздел 8 ИСО 20387:2018 содержит требования к системе менеджмента качества (СМК). В настоящем стандарте приведены основные положения раздела 8 ИСО 20387:2018.
8.5.2 ИСО 20387:2018, 8.1.1, 8.1.2 и 8.1.3
В ИСО 20387 предусмотрены два варианта реализации СМК биобанком. Оба варианта направлены на достижение одного и того же результата оценки менеджмента качества и требуют соблюдения положений разделов 4-7 ИСО 20387:2018.
Вариант A позволяет биобанку продемонстрировать его соответствие требованиям СМК путем прямого выполнения требований 8.2-8.9 ИСО 20387:2018. Если ИСО 9001 уже внедрен или планируется его внедрение, вариант В предоставляет биобанку возможность использовать соответствующие части ИСО 9001 для облегчения демонстрации вышеизложенного. В этом случае биобанк подтверждает, что вся его деятельность в предполагаемой области аккредитации охвачена и что СМК способна поддерживать и демонстрировать соответствие целям ИСО 20387:2018, 8.2-8.9.
8.5.3 ИСО 20387:2018, 8.3.1
Термин документ в ИСО 9000:2015 в 3.8.5 определен как информация (ИСО 9000:2015, 3.8.2) и носитель, на котором эта информация представлена.
Пример - Запись (ИСО 9000:2015, 3.8.10), спецификация (ИСО 9000:2015, 3.8.7), метод, документ, чертеж, отчет, стандарт.
Примечание 1 - Носитель может быть бумажным, магнитным, электронным или оптическим компьютерным диском, фотографией или эталонным образцом или их комбинацией.
Примечание 2 - Набор документов, например спецификации и записи, как правило, называют "документацией".
Примечание 3 - Некоторые требования (ИСО 9000:2015, 3.6.4) (например, требование к читаемости) относятся ко всем типам документов. Однако могут существовать разные требования к спецификациям (например, требование о контроле за изменениями) и к записям (например, требование о возможности восстановления).
8.5.4 ИСО 20387:2018, 8.4.1, 8.4.2 и 8.4.3
Термин запись в ИСО 9000:2015, 3.8.10 определен как документ (ИСО 9000:2015, 3.8.5), содержащий достигнутые результаты или свидетельства осуществленной деятельности.
Примечание 1 - Записи могут использоваться, например, для оформления прослеживаемости (ИСО 9000:2015, 3.6.13) и для представления свидетельств проведения верификации (ИСО 9000:2015, 3.8.12), предупреждающих действий (ИСО 9000:2015, 3.12.1) и корректирующих действий (ИСО 9000:2015, 3.12.2).
Примечание 2 - Записи, как правило, не требуют контроля изменений.
Принимая во внимание, что запись - это тип документа, управление записями охватывает методы идентификации, хранения, защиты, доступности и удаления записей. Биобанк может разработать и внедрить процедуру, обеспечивающую прослеживаемость записей.
Записи, производимые биобанком, могут включать в себя, но не ограничиваются:
a) исходные данные, необработанные данные, вычисления, результаты испытаний, данные прослеживаемости оборудования;
b) результаты испытаний, проведенных во время установки оборудования, технического обслуживания и контроля, включая калибровку оборудования;
c) документы, подтверждающие квалификацию персонала и участия в курсах по повышению квалификации (например, название курса, программа, дата, продолжительность и идентификация руководителя обучения) и полученные в результате компетенции и полномочия;
d) отчеты об аудитах;
e) анализ системы менеджмента качества;
f) отчет(ы) о несоответствиях (включая жалобы) и любых действиях, предпринятых для исправления и предотвращения повторения несоответствий (см. ИСО 20387:2018, 8.7.3).
Биобанк определяет правила управления записями, чтобы обеспечить их сохранность, конфиденциальность, надлежащую защиту от уничтожения и легкий доступ к ним. Кроме того, можно отслеживать изменения в записях. Методы архивирования и уничтожения зависят от характера записей. Доступ к конфиденциальным записям может быть обеспечен с помощью надлежащей маркировки и ограничения доступа для уполномоченного персонала в соответствии с мерами конфиденциальности.
8.5.5 ИСО 20387:2018, 8.5.1, 8.5.2 и 8.5.3
Биобанк должен определить метод(ы) выявления, оценки и минимизации/принятия рисков и возможностей.
Биобанк может периодически переоценивать риски и возможности. Подходы, основанные на оценке риска, или другие методы, применяемые в процессе планирования и/или принятия решений, могут помочь осуществить распределение ограниченных ресурсов, таких как персонал и средства, в зависимости от величины риска и/или возможностей. Такой подход может помочь минимизировать риск критически важных видов деятельности биобанка.
Эти концепции подробно рассмотрены в ИСО 31000, ИСО 9001 и ИСО 35001.
8.5.6 ИСО 20387:2018, 8.6.1
Улучшение СМК - динамичный и важный процесс. Биобанк может собирать, пересматривать и анализировать информацию о работе своей СМК и использовать эту информацию в качестве основы для улучшения. Собранная информация может включать в себя следующее:
a) результаты внутренних аудитов (см. ИСО 20387:2018, 8.8 Внутренний аудит);
b) анализ показателей качества выполнения задач СМК;
c) оценка операционных, вспомогательных и управленческих процессов;
d) результаты оценки рисков (см. ИСО 20387:2018, 8.5 Действия по устранению рисков и потенциальные возможности);
e) несоответствия (см. ИСО 20387:2018, 7.11 Несоответствующие выходные данные);
f) корректирующие действия (см. ИСО 20387:2018, 8.7 Корректирующие действия);
g) результаты проверки квалификации и т.д. (см. ИСО 20387:2018, 7.8.2 Контроль качества процессов);
h) обратная связь, например оценка пользователем соответствия BMaD предполагаемому назначению (см. ИСО 20387:2018, 8.6.2).
Кроме того, цикл "Планируй - Делай - Проверяй - Действуй" (PDCA) (см. 8.2.7) также может быть использован для улучшения СМК.
8.5.7 ИСО 20387:2018, 8.8.1 и 8.8.2
Внутренний аудит может проводиться персоналом биобанка, внешними подрядчиками или посредством сочетания участия обеих сторон. ИСО 20387:2018, 6.2.2 применяют к любому персоналу, участвующему в проведении аудита. Если внутренний аудит или любая его часть выполняются внешним подрядчиком, применяют 6.4 ИСО 20387:2018.
Концепция беспристрастности является требованием в соответствии с принципами аудита, предусмотренными ИСО 19011, например аудитор независим от деятельности, подлежащей аудиту.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 20387:2018 | IDT | ГОСТ Р ИСО 20387-2021 "Биотехнология. Биобанкинг. Общие требования" |
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: - IDT - идентичный стандарт. | ||
Библиография
[1] | ISO 8601-1, Date and time - Representations for information interchange - Part 1: Basic rules (Дата и время. Представления для обмена информацией. Часть 1. Основные правила) |
[2] | ISO 9000:2015, Quality management systems - Fundamentals and vocabulary (Системы менеджмента качества. Основные положения и словарь) |
_______________ Действует ГОСТ Р ИСО 9000-2015 "Системы менеджмента качества. Основные положения и словарь". | |
[3] | ISO 9001, Quality management systems - Requirements (Системы менеджмента качества. Требования) |
_______________ Действует ГОСТ Р ИСО 9001-2015 "Системы менеджмента качества. Требования". | |
[4] | ISO 15189, Medical laboratories - Requirements for quality and competence (Лаборатории медицинские. Частные требования к качеству и компетентности) |
_______________ Действует ГОСТ Р ИСО 15189-2015 "Лаборатории медицинские. Частные требования к качеству и компетентности". | |
[5] | ISO 19011, Guidelines for auditing management systems (Руководящие указания по аудиту систем менеджмента) |
_______________ Действует ГОСТ Р ИСО 19011-2021 "Оценка соответствия. Руководящие указания по проведению аудита систем менеджмента". | |
[6] | ISO 20166-3, Molecular in vitro diagnostic examinations - Specifications for pre-examination processes for formalin-fixed and paraffin-embedded (FFPE) tissue - Part 3: Isolated DNA (Молекулярная диагностика in vitro. Требования к процессам предварительного исследования зафиксированных в формалине и залитых парафином образцов тканей. Часть 3. Изолированные DNA) |
[7] | ISO 20186-3, Molecular in vitro diagnostic examinations - Specifications for pre-examination processes for venous whole blood - Part 3: Isolated circulating cell free DNA from plasma (Исследования в области молекулярной диагностики in vitro. Требования к предварительному обследованию венозной цельной крови. Часть 3. Выделенная из плазмы ДНК без циркулирующих клеток) |
[8] | ISO 31000, Risk management - Guidelines (Менеджмент риска. Принципы и руководство) |
_______________ Действует ГОСТ Р ИСО 31000-2019 "Менеджмент риска. Принципы и руководство". | |
[9] | ISO 35001, Biorisk management for laboratories and other related organisations (Менеджмент биорисков для лабораторий и других родственных организаций) |
[10] | ISO/IEC 17020, Conformity assessment - Requirements for the operation of various types of bodies performing inspection (Оценка соответствия. Требования к работе различных типов органов инспекции) |
_______________ Действует ГОСТ Р ИСО/МЭК 17020-2012 "Оценка соответствия. Требования к работе различных типов органов инспекции". | |
[11] | ISO/IEC 17021-1:2015, Conformity assessment - Requirements for bodies providing audit and certification of management systems - Part 1: Requirements (Оценка соответствия. Требования к органам, проводящим аудит и сертификацию систем менеджмента. Часть 1. Требования) |
_______________ Действует ГОСТ Р ИСО/МЭК 17021-1-2017 "Оценка соответствия. Требования к органам, проводящим аудит и сертификацию систем менеджмента. Часть 1. Требования". | |
[12] | ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories (Общие требования к компетентности испытательных и калибровочных лабораторий) |
_______________ Действует ГОСТ ISO/IEC 17025-2019 "Общие требования к компетентности испытательных и калибровочных лабораторий". | |
[13] | ISO/IEC Guide 99:2007, International vocabulary of metrology - Basic and general concepts and associated terms (VIM) [Международный словарь по метрологии. Основные и общие понятия и соответствующие термины (VIM)] |
[14] | CEN/TS 16826-3, Molecular in vitro diagnostic examinations - Specifications for pre-examination processes for snap frozen tissue - Part 3: Isolated DNA (will be replaced by ISO 20184-3) [Молекулярные лабораторные диагностические исследования. Технические условия для процессов предварительного исследования мгновенно (импульсно) замороженного образца ткани. Часть 3. Изолированная ДНК (будет заменен ИСО 20184-3)] |
[15] | CEN/TS 17305, Molecular in vitro diagnostic examinations - Specifications for pre-examination processes for saliva - Isolated human DNA (Исследования в области молекулярной диагностики in vitro. Спецификация на процессы предварительного исследования слюны. Выделенная ДНК человека) |
[16] | Nagoya Protocol on Access to Genetic Resources and the Fair and Equitable Sharing of Benefits Arising from Their Utilization 2010 (Нагойский протокол регулирования доступа к генетическим ресурсам и совместного использования на справедливой и равной основе выгод от их использования, 2010 г.) |
[17] | Jones A., White R., Orme E., Identifying and relating biological concepts in the Catalogue of Life. J. Biomed semantics, 2, 7, 2011 |
[18] | https://www.iso.org/sites/cascoregulators/02_casco_toolbox.html |
[19] | ISBER Best practices for repositories, 4th Edition, 2018 (ISBER Лучшие практики для хранилищ, 4-е издание, 2018 г.) |
[20] | National Cancer Institute Best practices for biospecimen resources, 2012 (Национальный институт онкологических заболеваний. Лучшие практики для ресурсов биологических образцов, 2012 г.) |
[21] | Convention on Biological Diversity, 1992 (Конвенция о биологическом разнообразии 1992 г.) |
[22] | ECD Best practice guidelines for Biological resources centres, 2007 (Рекомендации ОЭСР по наилучшим методам для центров биологических ресурсов, 2007 г.) |
[23] | OECD Guidance for the operation of biological resources centres, 2008 (Руководство ОЭСР по работе центров биологических ресурсов, 2008 г.) |
[24] | www.ariscommunity.com/process-landscape |
УДК 601:006.354 | ОКС 07.080 |
Ключевые слова: биотехнология, биобанкинг, компетентность, беспристрастность и согласованная работа биобанков | |
