ФЕДЕРАЛЬНОЕ АГЕНТСТВО
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ

НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТ Р
70468—
2022
МАТЕРИАЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИЗГОТОВЛЕНИЯ МЕДИЦИНСКОЙ ОДЕЖДЫ
Стандартный метод определения устойчивости материалов к проникновению переносимых кровью патогенов с использованием в качестве тест-системы бактериофага Phi-X174
Издание официальное
Москва Российский институт стандартизации 2022
ГОСТ Р 70468—2022
Предисловие
1 РАЗРАБОТАН Ассоциацией специалистов и организаций лабораторной службы «Федерация лабораторной медицины» (Ассоциация «ФЛМ») и Федеральным бюджетным учреждением науки «Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 «Клинические лабораторные исследования и диагностические тест-системы ин витро»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 10 ноября 2022 г. № 1269-ст
4 В настоящем стандарте учтены положения стандарта АСТМ Ф1671/Ф1671М—2013 «Стандартный метод тестирования устойчивости материалов, используемых в медицинской одежде, к проникновению патогенов, передающихся с кровью, с использованием проникновения бактериофага Phi-X174 в качестве тестовой системы» (ASTM F1671/F1671M—2013 «Standard Test Method for Resistance of Materials Used in Protective Clothing to Penetration by Blood-Borne Pathogens Using Phi-X174 Bacteriophage Penetration as a Test System»)
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
© Оформление. ФГБУ «РСТ», 2022
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
ГОСТ Р 70468—2022
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения...............................................................2
4 Сущность метода.....................................................................3
5 Общие требования...................................................................3
6 Средства измерений, испытательное оборудование и материалы.............................4
7 Требования безопасности..............................................................6
8 Отбор и подготовка образцов, контрольных материалов.....................................6
9 Приготовление испытательной суспензии бактериофага.....................................7
10 Проведение испытания...............................................................8
11 Проведение количественной оценки результата испытания................................11
12 Обработка результатов..............................................................11
13 Протокол проведения испытаний......................................................12
Библиография........................................................................13
III
ГОСТ Р 70468—2022
Введение
Специалисты, в первую очередь медицинские работники, занимающиеся лечением и уходом за ранеными или больными, могут подвергаться воздействию биологических жидкостей и инфицированию. Заболевания, которые могут быть вызваны различными микроорганизмами, представляют значительный риск для жизни и здоровья. В первую очередь, это значимо в отношении вирусов, переносимых кровью и вызывающих такие заболевания как гепатит [вирус гепатита В (HBV) и вирус гепатита С (HCV)] и синдром приобретенного иммунодефицита (СПИД) (вирус иммунодефицита человека (ВИЧ)). Поскольку физические методы контроля не могут исключить все возможные риски, необходимо минимизировать возможность непосредственного контакта с кожей за счет использования защитной одежды, которая препятствует проникновению патогенных микроорганизмов. Приведенный метод испытания в условиях непрерывного контакта с использованием модельного вируса, содержащегося в среде, имитирующей биологическую жидкость, был разработан для оценки того, насколько эффективно материалы, используемые для создания медицинской одежды, защищают человека от контакта с переносимыми кровью патогенами.
IV
ГОСТ Р 70468—2022
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
МАТЕРИАЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИЗГОТОВЛЕНИЯ МЕДИЦИНСКОЙ ОДЕЖДЫ
Стандартный метод определения устойчивости материалов к проникновению переносимых кровью патогенов с использованием в качестве тест-системы бактериофага Phi-X174
Materials used for the manufacture of medical clothing. Standard method for determining the resistance of materials to the penetration of blood-borne pathogens using Phi-X174 bacteriophage as a test system
Дата введения — 2023—10—01
1 Область применения
Настоящий стандарт распространяется на материалы, используемые для изготовления медицинской одежды, предотвращающей заражение переносимыми кровью патогенами, и устанавливает метод испытания с использованием модельного вируса в условиях непрерывного жидкостного контакта (далее — метод испытаний). Устойчивость к проникновению вируса указывает, выполняет ли материал, из которого изготовлена защитная одежда, защитное назначение или нет.
Настоящий метод испытания не всегда эффективен, если материал для медицинской одежды имеет толстый слой внутренней подкладки, который легко впитывает испытательную суспензию.
Метод испытания применим не ко всем формам или условиям воздействия патогенов, переносимых через кровь. Специалисты, проводящие испытание, должны определить, в каких условиях происходит воздействие патогенов на сотрудников/одежду, и оценить целесообразность использования этого метода испытания в конкретном случае.
Настоящий метод был специально разработан для моделирования проникновение вирусов гепатитов В и С и иммунодефицита человека, передаваемых через кровь и другие потенциально инфекционные биологические жидкости. Бактериофаг Phi-X174, используемый в настоящем методе испытания имеет размер и форму, аналогичные вирусу гепатита С (ВГС), но также служит имитацией вируса гепатита В (ВГВ) и вируса иммунодефицита человека (ВИЧ). Наличие защиты от других патогенов необходимо оценивать в каждом конкретном случае.
Метод испытания определяет только то, насколько хорошо материалы или определенные конструкции материалов (например, швы), используемые в медицинской одежде, выполняют заявленную функцию устойчивости к проницаемости вирусом. Метод испытаний не учитывает внешний вид, общую конструкцию и детали одежды, а также то, в какой степени тело покрыто одеждой, и другие факторы, от которых может зависеть общая степень защиты, обеспечиваемая медицинской одеждой.
2 Нормативные ссылки
В настоящем стандарте использована нормативная ссылка на следующий стандарт:
ГОСТ Р ИСО 2859-1 Статистические методы. Процедуры выборочного контроля по альтернативному признаку. Часть 1. Планы выборочного контроля последовательных партий на основе приемлемого уровня качества
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт,
Издание официальное
1
ГОСТ Р 70468—2022
на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 асептические условия: Условия при которых исключается загрязнение жизнеспособными микроорганизмами рабочих зон проведения испытаний.
3.2 бактериофаг: Вирус, обладающий специфической способностью к избирательному инфицированию бактериальных клеток с последующим лизисом (вирулентные фаги) или интегрированием в бактериальный геном (умеренные фаги).
Примечание — В данном методе испытания применяют бактериофаг Phi-X174, который не представляет опасности для человека, но служит для имитации вирусов, которые для человека являются патогенными.
3.3 биологическая жидкость: Любая жидкость, выделяемая человеческим организмом или выводимая из него.
Примечание — В данном методе испытания рассматриваются биологические жидкости, которые потенциально могут быть инфицированы патогенами, включая кровь, сперму, вагинальные выделения, спинномозговую жидкость, синовиальную жидкость, перитонеальную жидкость, околоплодную жидкость, слюну при стоматологических процедурах, любую жидкость организма, которая явно загрязнена кровью, и все другие жидкости организма (в ситуациях, когда трудно или невозможно провести различие между жидкостями организма).
3.4 бляшка (в вирусологии): Ясно видимая область, которая теоретически является результатом инфицирования и лизиса клеток бактерии-хозяина одиночным жизнеспособным вирусом.
Примечание — В данном методе испытания термин «бляшка» используют для описания ясно видимой области на газоне E.coli С в верхнем агаровом слое, которая является проявлением присутствия одной жизнеспособной частицы бактериофага Phi-X174.
3.5 вирус: Инфекционный агент, не обладающий собственным метаболизмом и способный размножаться только в пределах живой клетки-хозяина.
Примечание — Размеры вирусов от 18 до 400 нм.
3.6 вирусное проникновение: Проникновение вируса через материал.
Примечание — В данном методе испытания термин «проникновение» используется для описания физического прохождения бактериофага Phi-X174 через застежки, швы, поры, точечные отверстия или другие несовершенства в материалах, используемых для создания медицинской одежды.
3.7 газон (в микробиологии): Сплошной равномерный рост бактерий на поверхности плотной питательной среды.
Примечание — В данном методе испытания в качестве бактерии, используемой для посева, выбрана Е. coli С.
3.8 испытательная суспензия: Жидкость, содержащая агент, который используют для проверки проницаемости материалов для вирусов.
Примечание — В данном методе испытательная суспензия — буферный раствор с бактериофагом Phi-X174.
3.9 лизис: Разрушение цельных бактериальных клеток.
Примечание — В данном методе испытания бактериофаг Phi-X174 вызывает лизис бактерии-хозяина Е. coli С.
3.10 модельный вирус: Микроорганизм, который используют для имитации других микроорганизмов, патогенных для человека.
2
ГОСТ Р 70468—2022
Примечание — В данном методе испытания имитатором является бактериофаг Phi-X174, используемый в качестве модели ВГС и имитирующий и ВГВ, и ВИЧ.
3.11 патоген, переносимый с кровью: Инфекционная бактерия или вирус, или другая инфекция (в том числе микроб), которая может передаваться через кровь или другие биологические жидкости.
Примечание — Применительно к данному методу испытания, основными патогенами, переносимыми через кровь, являются ВГВ, ВГС и ВИЧ. Другие микроорганизмы должны рассматриваться в каждом конкретном случае.
3.12 питательный агар: Полужидкая питательная среда, используемая для поддержки роста бактерий и других микроорганизмов.
3.13 проникновение жидкости: Движение жидкости через застежки, проницаемые материалы, швы, точечные отверстия или другие дефекты в медицинской одежде на немолекулярном уровне.
3.14 среда: Питательная система для культивирования клеток или организмов, в частности бактерий.
Примечание — В данном методе испытания термин «среда» используют для описания смесей, созданных для поддержки роста специфических микроорганизмов, например питательный агар для культивирования Е. coli С.
3.15 титр: Количество активных частиц бактериофага, содержащихся в одном сантиметре (миллилитре) исследуемой жидкости, измеряемой в бляшкообразующих единицах на кубический сантиметр (миллилитр) [БОЕ/см3(мл)].
3.16 устойчивость материала к вирусам: Характеристика материалов, препятствующих проникновению вируса при определенных условиях лабораторных испытаний и методах обнаружения.
Примечание — В данном методе испытания устойчивыми к вирусам считаются материалы для создания защитной одежды, прошедшие испытания.
4 Сущность метода
Сущность метода основана на оценке проникновения буферного раствора с бактериофагом Phi-X174 через испытуемый образец материала.
4.1 Образец подвергается воздействию буферного раствора, содержащего бактериофаг Phi-X174, в течение определенного времени и при определенном давлении испытательной суспензии.
4.2 Визуальное обнаружение проникновения дополняется количественным анализом, позволяющим обнаружить жизнеспособный бактериофаг Phi-X 174, проникший через материал, даже тогда, когда проникновение жидкости не определяется визуально. Любое доказательство проникновения бактериофага Phi-X174 через исследуемый образец является отрицательным результатом испытания.
5 Общие требования
5.1 Данный метод испытания обычно применяют для оценки образцов готовых изделий медицинской одежды и образцов материалов, которые планируют использовать для изготовления медицинской одежды.
5.1.1 Готовыми предметами медицинской одежды могут быть перчатки, щитки для рук, фартуки, халаты, комбинезоны, капюшоны и ботинки.
5.1.2 К образцам готового изделия могут быть отнесены швы и другие нетканые зоны, а также обычные зоны непрерывного полотна предметов медицинской одежды.
5.2 Биологические жидкости, проникающие сквозь материалы медицинской одежды могут нести микробиологические загрязнения; однако визуальные методы определения недостаточно чувствительны для обнаружения микрочастиц жидкости, содержащих микроорганизмы. В данном методе используют буферный раствор, содержащий бактериофаг Phi-X174, который не представляет опасности для человека, но служит для имитации патогенных вирусов.
5.3 Метод испытания, позволяющий проводить проверку материалов для изготовления медицинской одежды на устойчивость к проникновению синтетической крови в качестве испытательной жидкости и метод испытания для исследования устойчивости к проникновению возможно проводить по единой технологии с использованием единого испытательного оборудования. Материалы, прошедшие
3
ГОСТ Р 70468—2022
испытания методом на устойчивость к проникновению синтетической крови, могут (при необходимости) впоследствии быть проверены на проникновение бактериофагов с использованием данного метода испытания для верификации их эксплуатационных характеристик.
5.4 Имитатор-бактериофаг Phi-X174, используемый в данном методе, по размеру и форме соответствует ВГС, но также служит имитатором и для ВГВ, и для ВИЧ. Наличие защиты от других патогенов должно оцениваться в каждом конкретном случае.
5.5 Образцы материала для изготовления медицинской одежды должны быть помещены для воздействия испытательной суспензии бактериофага Phi-X174 в испытательную камеру под давление 13,8 кПа. Это гидростатическое давление принято для того, чтобы сопоставить результаты испытания с результатами визуального определения проникновения, полученными при клинических исследованиях. Вместе с тем, в реальных условиях механическое давление может превышать 345 кПа, поэтому важно понимать, что данный метод испытания не моделирует все физические нагрузки и режимы давления, которые могут быть оказаны на материал, из которого изготовлена медицинская одежда.
5.6 Материалы, из которых изготавливают медицинскую одежду, предназначены для того, чтобы служить барьером для крови, биологических жидкостей и других потенциально инфекционных веществ. Многие факторы могут влиять на характеристики смачивания и способность к проникновению биологических жидкостей, такие как: поверхностное натяжение, вязкость, полярность жидкостей, а также структура и относительная гидрофильность или гидрофобность материалов. Поверхностное натяжение биологических жидкостей (исключая слюну) может составлять приблизительно 0,042—0,060 Н/м. Для моделирования процессов смачивания кровью и биологическими жидкостями поверхностное натяжение испытательной суспензии бактериофага Phi-X174 регулируется таким образом, чтобы приблизиться к нижней границе вышеуказанного диапазона поверхностного натяжения. Это достигается путем добавления поверхностно-активного вещества в питательный бульон бактериофага Phi-X174. Результирующее поверхностное натяжение испытательной суспензии бактериофага Phi-X174 составляет приблизительно (0,042 ± 0,002) Н/м.
5.7 Результатом испытаний, проведенных до изменения характеристик под воздействием физических, химических и термических нагрузок, т. е. до воздействия факторов, которые могут неблагоприятно отразиться на характеристиках медицинского материала, может быть ложный вывод о безопасности его использования. Необходимо предусматривать проведение дополнительных испытаний, оценивающих влияние условий и срока хранения на характеристики одноразовых изделий, а также влияние стирки и стерилизации на характеристики многоразовых изделий. Барьерная функция материала также может быть нарушена во время использования из-за таких эффектов, как сгибание и трение. Агенты, предотвращающие смачивание, например спирт, и загрязняющие агенты, такие как пот, также могут нарушить барьерную функцию. Если эти условия при эксплуатации медицинского изделия могут присутствовать, то эффективность материалов защитной одежды должна быть оценена на предмет проникновения бактериофага Phi-X174 после соответствующих испытаний в ожидаемых условиях использования образцов материала.
5.8 В метод испытаний включена чувствительная аналитическая процедура, позволяющая оценить стойкость материала медицинской одежды к проникновению вируса-имитатора. Данный метод требует для его проведения больших временных затрат, что может не подойти для обеспечения контроля качества материала или готовой медицинской одежды в процессе производства медицинского изделия или в рамках системы обеспечения качества производителя, а подойти только в рамках выбора материала для производства и периодических квалификационных испытаний.
5.9 Если метод испытаний используют для контроля качества или для подтверждения устойчивости материалов, используемых в медицинской одежде, к проникновению вирусов, следует выполнить статистический расчет и анализ в соответствии с ГОСТ Р ИСО 2859-1.
5.10 Настоящий метод испытания требует практического знания основных микробиологических методов.
6 Средства измерений, испытательное оборудование и материалы
6.1 Толщиномер с точностью 0,02 мм для определения толщины каждого испытуемого образца материала медицинской одежды (при необходимости).
6.2 Камера для испытания на проницаемость, в которую помещают испытуемый образец во время контакта с находящейся под давлением испытательной суспензией бактериофага Phi-X174. Общая схема камеры приведена на рисунке 1.
4
ГОСТ Р 70468—2022
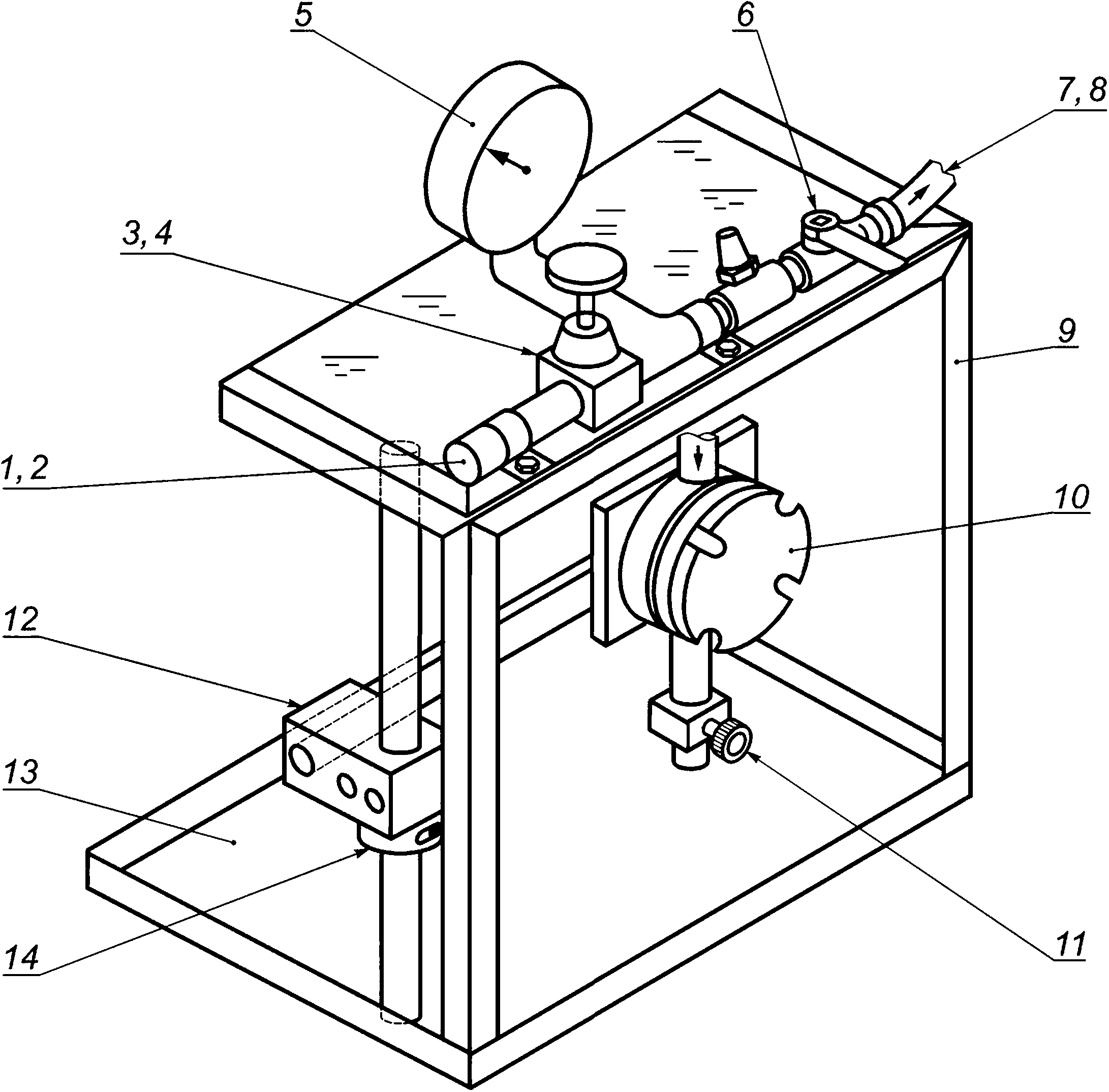
1 — сжатый воздух или азот; 2 — соединитель воздуховода; 3 — регулятор давления воздуха; 4 — регулируемый воздушный клапан; 5 — датчик давления; 6 — воздуховыпускной клапан ячейки; 7 — внутренняя резьба; 8 — резиновый шланг для воздуха с наружной резьбой для подключения к 7 и внутренней резьбой для подключения к 10; 9 — защитный экран; 10 — ячейка для испытания на проницаемость; 11 — сливной клапан; 12 — шарнирный зажим; 13 — поддон; 14 — воротник вала из двух частей
Рисунок 1 — Общая схема камеры для испытания на проницаемость (трехмерный вид сбоку)
Примечание — В настоящее время имеется испытательное оборудование, выпускаемое в промышленных условиях, для обеспечения выполнения настоящего метода.
6.3 Весы с точностью до 0,001 г.
6.4 Вирус-имитатор — бактериофаг Phi-X174*.
Примечание — Бактериофаг Phi-X174 был выбран в качестве наиболее подходящей модели для переносимых кровью патогенов из-за его небольших размеров (0,027 мкм в диаметре), устойчивости к воздействию окружающей среды, инфекционной безопасности для человека и того, что количественный анализ с его применением отличает высокая чувствительность, скорость и высокий титр. Бактериофаг Phi-X174 используют, если титр, который необходимо определять, составляет не менее 1,0 х ю8 БОЕ/см3(мл).
6.5 Бактерии, Е. coli С** используют для наработки биомассы бактериофага Phi-X174, а также для его идентификации и количественного определения.
* Регистрационный номер РН-1055 коллекции национального биоресурсного центра Всероссийской коллекции промышленных микроорганизмов НИЦ «Курчатовский институт» (ВКПМ).
** Например, регистрационный номер В-3240 коллекции ВКПМ.
5
ГОСТ Р 70468—2022
6.6 Среды питательные для испытаний. Могут быть самостоятельно приготовлены в лаборатории из коммерческих питательных сред или могут быть использованы готовые питательные среды, расфасованные в чашки производителем питательных сред.
6.7 Бульон питательный.
6.8 Раствор фосфатный буферный (PBS).
6.9 Материалы из политетрафторэтилена (ПТФЭ) прокладочные.
6.10 Парафин или клеевая пена.
7 Требования безопасности
7.1 Работы с бактериофагом Phi-X174 должны быть проведены в микробиологических лабораториях в соответствии с [1].
7.2 К работе в микробиологической лаборатории допускается персонал, подготовленный в соответствии с [1], [2].
7.3 Для проведения настоящего метода, в том числе в части обеспечения требований биологической безопасности [1], лаборатория должна быть оснащена в соответствии с порядками оснащения микробиологических лабораторий [2].
7.4 До и после проведения испытания все оборудование и материалы, контактирующие с бактериофагом Phi-X174, стерилизуют автоклавированием при температуре от 121 °C до 123 °C и абсолютном давлении от 207 до 221 кПа в течение 15 мин. Могут быть использованы и другие методы стерилизации, если они не подавляют исследуемые организмы в ходе последующего проведения испытания. Чтобы избежать загрязнения лабораторных помещений, соблюдают крайнюю осторожность: все приборы и расходные материалы подвергают полной стерилизации или дезинфекции высокого уровня. Это снизит вероятность контаминации лаборатории.
7.5 Испытуемые образцы стерилизуют в соответствии с рекомендациями производителя. При необходимости выбранные методы стерилизации валидируют.
8 Отбор и подготовка образцов, контрольных материалов
8.1 Отобранные из отдельных частей материала или отдельных предметов медицинской одежды образцы состоят из одного слоя либо из комбинации нескольких слоев, что соответствует структуре материала, используемой на практике медицинской одежды или конструкции со всеми слоями, расположенными в соответствующем порядке.
8.1.1 Если конструкцией медицинской одежды предусмотрены различные материалы или различная толщина материала в разных частях, образцы выбирают из каждой такой части.
8.1.2 Если заявлено, что швы, предусмотренные конструкцией предмета медицинской одежды, обеспечивают такую же защиту, как и материал, проводят испытания дополнительных образцов, содержащих такие швы. Образцы со швами подготавливают таким образом, чтобы вся конфигурация шва (профиль) соответствовала внутреннему диаметру испытательной камеры. Между корпусом камеры и испытуемым образцом, а также между крышкой с фланцем или задерживающим фильтром и образцом помещают прокладочные материалы из ПТФЭ, чтобы предотвратить утечку.
8.1.3 Необходимо убедиться, что по обе стороны испытуемого образца материала отсутствуют посторонние вещества (например, известно, что на бактериофаг воздействуют некоторые красители).
8.2 Размер каждого образца материала, подлежащего испытанию, должен составлять минимум 70 мм. Предпочтительно, чтобы материал представлял собой квадрат со стороной 75 мм.
8.3 Из каждого испытуемого материала, комбинации материалов, части (в случае конструкции, в которой части различаются между собой по характеристикам) вырезают образцы случайным образом. Выборку проводят в соответствии с ГОСТ Р ИСО 2859-1. Необходимо предусмотреть наличие материала для повторного испытания при подозрении на ложноположительный результат.
8.4 Из-за просачивания по краям вполне вероятны ложноположительные результаты для материалов медицинской одежды, включающих непроницаемый слой между двумя слоями ткани. Края испытуемых образцов герметизируют, чтобы предотвратить просачивание опасных веществ. Перед испытанием испытуемые образцы запечатывают парафином или клеевой пеной.
Герметизируют только края испытуемых образцов, оставляя для испытания центральную область размером 57 мм открытой. Герметики не должны проникать в структуру испытуемого образца в испы-6
ГОСТ Р 70468—2022
тательной зоне, блокировать или закупоривать ее, так как это сделает процедуру испытания неточной. Герметики и методы герметизации выбирают так, чтобы они были совместимы с материалами медицинской одежды и методами стерилизации.
8.5 Испытуемые образцы стерилизуют, если стерилизация является частью процесса подготовки медицинской одежды. Выбирают метод стерилизации, не влияющий непреднамеренно на характеристики испытуемого образца. Испытуемые образцы стерилизуют в соответствии с рекомендациями производителя.
8.6 Для оценки достоверности проведенных испытаний одновременно с испытанием каждого материала медицинской одежды используют контрольные материалы (образцы), а именно: контрольный образец нестерильного материала, отрицательный контрольный образец, положительный контрольный образец.
8.6.1 Контрольный образец нестерильного материала
При испытании нестерильных образцов в программу испытаний может быть включен дополнительный контроль заготовки нестерильного материала, чтобы продемонстрировать, что испытуемые материалы не загрязнены бактериофагом Phi-X174 до начала испытания. Этот образец выбирают из тех нестерильных материалов, которые предполагается подвергнуть испытанию, и проводят с ним те же процедуры обработки и воздействия, что и с другими испытуемыми образцами, за исключением того, что в качестве испытательной суспензии стерильный питательный бульон используют с полисорбатом 80.
8.6.2 Отрицательный контрольный образец
Отрицательный контрольный образец не должен пропускать бактериофаг Phi-X174 и должен быть изготовлен из толстой монолитной пленки (с диаметром пор менее 0,02 мкм). Одним из видов отрицательного контрольного образца является медицинская упаковка из полиэфирной пленки.
8.6.3 Положительный контрольный образец
Положительный контрольный образец должен пропускать бактериофаг Phi-X174. Он может быть изготовлен из микрофильтрационного материала с размером пор больше среднего диаметра бактериофага Phi-X174 (0,027 мкм). Одним из видов положительного контрольного образца является микропористая нейлоновая пленка размером 0,04 мкм.
8.7 Требования к условиям внешней среды
Место проведения испытаний не должно иметь аэрозольного/воздушного загрязнения. При необходимости определение фонового количества возможного загрязнения бактериофагом Phi-X174 проводят с использованием валидированной лабораторной методики.
8.8 Подготовка образца
8.8.1 Каждый образец медицинской одежды подготавливают в течение не менее 24 ч при температуре (21 ± 5) °C и относительной влажности воздуха от 30 % до 80 %.
8.8.2 Для оценки возможных механизмов деградации материалов медицинской одежды могут быть проведены другие варианты предварительной подготовки, отличные от приведенных в 8.8.1.
9 Приготовление испытательной суспензии бактериофага
9.1 Для проведения настоящего метода используют бактериофаг, полученный в жидкой питательной среде [2] или на плотной питательной среде.
Для получения на плотной питательной среде бактериофага, активного в отношении Е. coli С, бактериальную культуру непатогенного штамма-хозяина в титре 109 КОЕ/мл засевают в сосуд для культивирования на скошенную плотную питательную среду с толщиной слоя от 10 до 25 мм.
Штамм-хозяин культивируют в течение 3,5 ч при оптимальной температуре для его роста 37 °C, затем на полученный газон культуры Е. coli С засевают маточный бактериофаг в титре 106 БОЕ/мл, герметично закрывают сосуд для культивирования (стеклянный микробиологический матрац) и культивируют бактериофаг в течение 14 ч при оптимальной температуре для роста культуры штамма бактериофага 37 °C и толщине слоя воздуха над поверхностью плотной питательной среды от 25 до 40 мм.
Фаголизат получают при суспендировании бактериофага с поверхности плотной питательной среды буферным раствором pH 7,0 в количестве 0,042 мл на 1 см2 поверхности плотной питательной среды.
7
ГОСТ Р 70468—2022
Затем собирают фаголизат в стерильную емкость, добавляют хлороформ, выдерживают в течение 40 мин при непрерывном шуттелировании с последующим центрифугированием в течение 40 мин при 5000 мин-1 .
Надосадочную жидкость стерилизуют фильтрацией через фильтр диаметром пор 0,22 мкм и пропускают полученный фильтрат через колонку, содержащую агент, аффинный к эндотоксину.
Полученный фаголизат содержит эшерихиозный бактериофаг в титре 1010 БОЕ/мл при отсутствии бактерий, ингредиентов использованной питательной среды и при концентрации эндотоксина менее 50 ЕЭ/мл.
9.2 Провокационную суспензию бактериофага приготавливают, разбавляя бактериофаг, подготовленный в соответствии с 9.1 буферным раствором до требуемой концентрации не менее (1,0 • 108) БОЕ/см3(мл). Конечную концентрацию бактериофага контролируют с помощью процедуры количественного анализа (см. раздел 11).
10 Проведение испытания
10.1 Толщину каждого образца материала измеряют с точностью до 0,02 мм (при необходимости).
10.2 Определяют массу каждого образца (при необходимости).
10.3 Размер образца должен соответствовать размеру испытательной камеры используемого испытательного оборудования.
10.4 Определяют совместимость каждого испытуемого материала (при необходимости).
10.4.1 Некоторые испытуемые материалы могут искажать результаты исследования на проникновение вируса, тем самым делая их недействительными. Результаты испытания на проникновение вируса могут быть искажены в следующих случаях:
- инактивация бактериофага Phi-X174 или бактерии-хозяина Е. coli. С.;
- компонентами, содержащимися в исследуемых материалах или задерживающих фильтрах (если они используются);
- связывание бактериофага Phi-X174 с испытуемыми материалами или задерживающими фильтрами (если они используются);
- высыхание бактериофага Phi-X174.
Должна быть определена совместимость испытательных материалов, задерживающих фильтров (если они используются) и микроорганизмов, используемых в испытании.
10.4.2 Определение содержания ингибирующих веществ в испытуемом материале (или задерживающем фильтре, если он используется)
10.4.2.1 Проверяют три образца, представляющих каждый материал, подлежащий испытанию.
10.4.2.2 После того, как стерильную камеру размещают горизонтально на лабораторном столе, образец помещают внешней поверхностью в резервуар камеры.
10.4.2.3 Стерильные части камеры собирают, как показано на рисунке 1.
10.4.2.4 Болты в испытательной камере закручивают до 13,6 Н • м каждый.
10.4.2.5 В испытательную камеру, расположенную горизонтально на лабораторном столе, помещают образец, на который наносят 2,0 мкл аликвоты бактериофага Phi-X174, содержащей в общей сложности от 900 до 1200 БОЕ.
Через 60 мин проводят количественный анализ, как описано в разделе 11.
10.4.2.6 Готовят контрольный образец, добавляя 0,002 см3 (мл) аликвоты из той же суспензии бактериофага Phi-X174 в 5,0 см3 (мл) буферного раствора.
10.4.3 Отношение С титра в контрольном образце к титру в анализируемом материале вычисляют по формуле
С = —
S' (1)
где А — титр бактериофага в контрольном образце, БОЕ/см3 (мл);
В — титр бактериофага в анализируемом образце, БОЕ/см3(мл).
Пример: А — 5,0 ■ 108 БОЕ/см3(мл)
В —2,0- 108 БОЕ/см3(мл).
Следовательно, С равно 2,5.
8
ГОСТ Р 70468—2022
10.4.4 Титр суспензии бактериофага Phi-X174, Тф, БОЕ/см3(мл), используемой в испытании с учетом потери от испытуемого материала вычисляют по формуле
Тф = СТф1, (2)
где С — отношение титра в контрольном образце к титру в анализируемом материале;
Тф1 —титр испытательной суспензии бактериофага Phi-X174, приготовленной в разделе 11, БОЕ/см3(мл).
Пример: 2,5 • 1 ■ 108 - 2,5 • 108, таким образом, титр испытательной суспензии бактериофага при соотношении, равном 2,5, составляет 2,5 ■ 108 БОЕ/см3(мл).
10.5 Камеру, используемую в испытании на проницаемость, автоклавируют при температуре от 121 °C до 123 °C и абсолютной температуре от 207 до 221 кПа в течение 15 мин. Испытательной камере дают остыть до комнатной температуры.
10.6 После того, как стерильная камера помещена горизонтально на лабораторный стол, образец помещают внешней поверхностью в резервуар камеры, который будет заполнен испытательной суспензией бактериофага Phi-X174.
10.6.1 Стерильные части камеры собирают следующим образом: прокладки размещают между испытательной камерой и испытуемым образцом, между образцом и задерживающим фильтром (если он используется), а также между задерживающим фильтром и крышкой с фланцем, как показано на рисунке 2. Испытательную камеру закрывают крышкой с фланцем и прозрачной крышкой. Между корпусом камеры и испытуемым образцом, а также между крышкой с фланцем или задерживающим фильтром и образцом помещают прокладочные материалы из ПТФЭ, чтобы предотвратить утечку.
Примечание — Вместо прозрачной крышки можно использовать стерильную прозрачную пластиковую пленку.
10.7 Болты в испытательной камере закручивают до 13,6 Н • м каждый.
10.8 Испытательную камеру устанавливают в вертикальном положении, как показано на рисунке 1 (сливной клапан опущен), но не подсоединяют к ней воздушный трубопровод.
10.9 Сливной клапан закрывают.
10.10 Испытательную камеру осторожно заполняют через верхний порт примерно 60 мл испытательной суспензии бактериофага Phi-X174 (используют стерильный шприц или воронку). Если во время испытания возникает подозрение, что через испытуемый образец проникает жидкость, испытание прекращают.
10.11 Наблюдают в течение 5 мин.
10.12 В случае исключения проникновения жидкости (см. 10.10) воздушный трубопровод подсоединяют к испытательной камере (см. рисунок 2).
10.13 Сжатый воздух подают через верхний порт испытательной камеры. Давление медленно поднимают до 13,8 кПа по манометру со скоростью не выше 3,5 кПа/с.
10.14 Давление поддерживают постоянным (13,8 ± 1,38) кПа в течение 1 мин, и видимую сторону образца контролируют на предмет появления жидкости.
10.15 Воздействие давления прекращают и переводят клапан камеры в положение сброса.
10.16 Если проникновение жидкости в этот момент не видно, наблюдение за образцом продолжают еще после 54-й минуты.
10.17 По прошествии этого времени сливной клапан открывают и сливают из испытательной камеры испытательную суспензию бактериофага.
10.18 Суспензию бактериофага Phi-X174, собранную как минимум из последней серии испытаний, анализируют, чтобы убедиться в том, что концентрация суспензии бактериофага во время испытания не снизилась (см.12.6).
10.19 С камеры, расположенной горизонтально на лабораторном столе, снимают прозрачную крышку.
9
ГОСТ Р 70468—2022
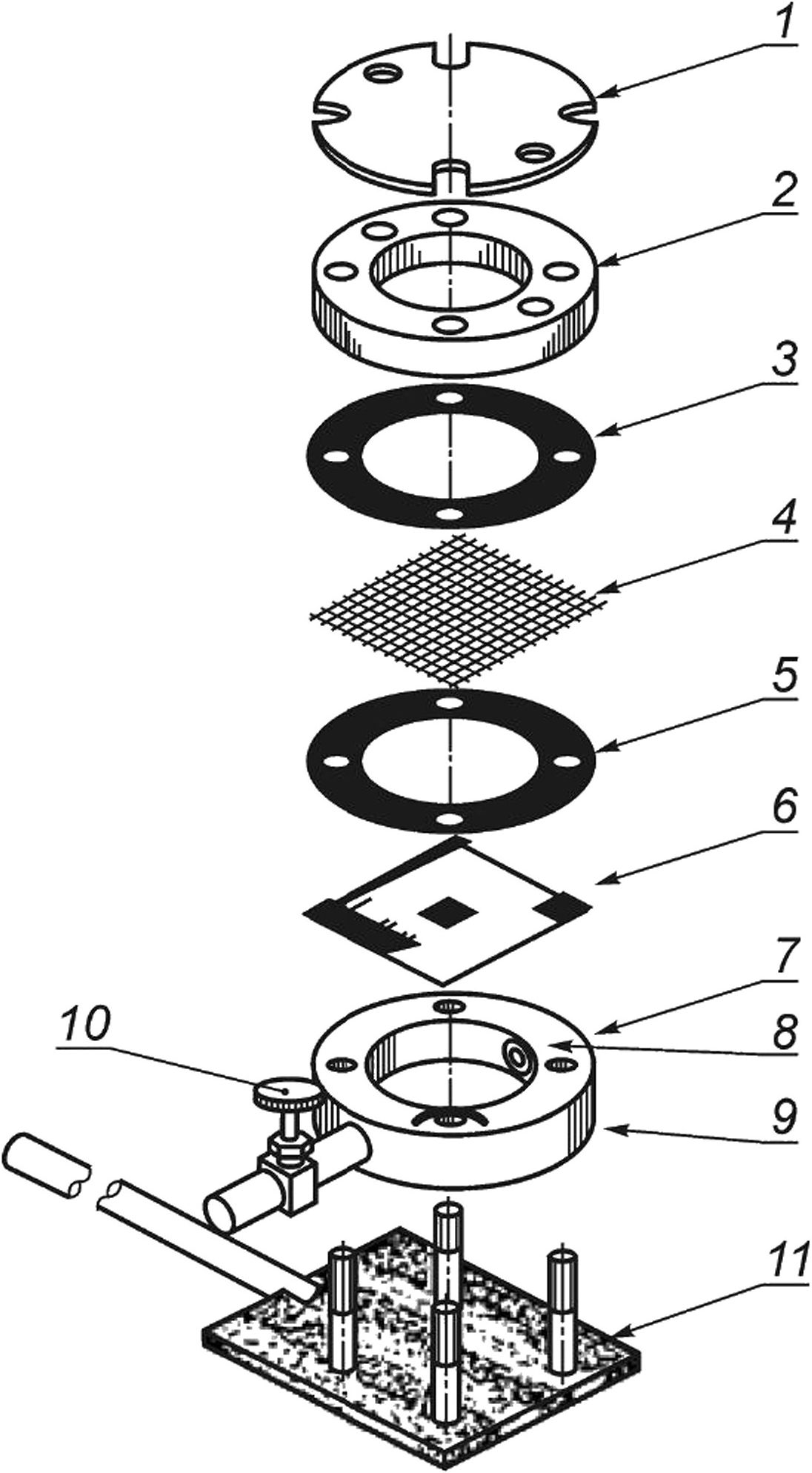
1 — прозрачная крышка; 2 — крышка с фланцем; 3 — прокладка (для процедур воздействия на испытуемый образец); 4 — задерживающий фильтр (для процедур воздействия на испытуемый образец); 5 — прокладка; 6 — испытуемый образец; 7 — отверстие в верхней части камеры; 8 — растянутый прокладочный материал из ПТФ; 9 — корпус камеры; 10 — сливной клапан; 11 — опора камеры
Рисунок 2 — Камера для испытания на проницаемость с задерживающим фильтром (схема конструкции)
10.20 Сразу после снятия крышки медленно добавляют 5,0 мл стерильного питательного бульона с 0,01 %-ным поверхностно-активным веществом (аналитическая жидкость) на внутреннею поверхность образца. Испытательную камеру осторожно вращают или раскачивают в течение примерно 1 мин, чтобы обеспечить контакт аналитической жидкости со всей рабочей поверхностью испытуемого образца. Аналитическую жидкость как можно скорее собирают с помощью стерильной пипетки в стерильный флакон. Некоторые материалы впитывают аналитическую жидкость, поэтому необходима промывка большим объемом. Если необходим объем аналитической жидкости больше 5,0 мл, необходимо скорректировать расчет концентрации аналитической жидкости в бляшкообразующих единицах на кубический сантиметр (миллилитр).
10.21 После сбора аналитической жидкости в течении 15 мин проводят ее количественный анализ, как описано в разделе 11.
Между сбором аналитической жидкости и фактическим анализом может пройти более длительный период, если возможно продемонстрировать стабильность бактериофага в аналитической жидкости.
10.22 Испытательное оборудование разбирают, испытательную камеру очищают. Воздушный трубопровод периодически дезинфицируют, чтобы предотвратить загрязнение.
Камеру, используемую в испытании на проникновение, промывают водой и затем автоклавируют при температуре от 121 °C до 123 °C и давлении от 207 до 221 кПа в течение 15 мин.
10.23 Для каждого последующего испытания процесс сборки, разборки, дезинфекции испытательного оборудования повторяют.
10
ГОСТ Р 70468—2022
10.24 Проводят испытания остальных образцов, а затем по одному отрицательному и положительному контролям — для каждого испытуемого материала.
11 Проведение количественной оценки результата испытания
11.1 Для количественной оценки результата испытания используют определение титра бактериофага Phi Х174 методом агаровых слоев по Грациа [3].
11.2 За 12 ч до проведения испытания готовят питательные среды:
- 1,5 % мясо-пептонного агара (МПА), стерильно разлитого на чашки Петри по 25 мл;
- стерильные пробирки с разлитым мясо-пептонным бульоном (МПБ) по 4,5 мл в каждой;
- 0,7 % МПА в пробирках по 2,5 мл.
В день проведения испытания из жидкости, содержащей титруемый бактериофаг, готовят в пробирках с жидкой средой ряд последовательных разведений. Затем в пробирку с 0,7 % МПА, расплавленным и остуженным до 45 °C — 50 °C, вносят 1 мл соответствующего разведения исследуемого бактериофага, слегка перемешивают, добавляют 0,1—0,2 мл 1-миллиардной взвеси Е. coli С, чувствительной к бактериофагу, опять слегка перемешивают и содержимое пробирки выливают в чашку с МПА (вторым слоем). После остывания среды чашки инкубируют в термостате при температуре 37 °C в течение 18—20 ч. Титр фага определяют путем подсчета количества негативных колоний на параллельных чашках и умножением полученного среднеарифметического значения на показатель разведения.
11.3 Результаты интерпретируют/обрабатывают, как описано в разделе 12.
12 Обработка результатов
12.1 При наличии аэрозольного/воздушного загрязнения, если наблюдаются какие-либо фоновые показатели (выше нуля), испытание считается недействительным.
12.2 При испытаниях отрицательных контрольных образцов не должен обнаруживаться перенос бактериофага Phi-X174 в количестве < 1 БОЕ/см3 (мл).
12.3 При испытаниях положительных контрольных образцов должен обнаруживаться перенос бактериофага Phi-X174 в количестве > 1 БОЕ/см3(мл).
12.4 Дополнительную пробу нестерильного материала, испытываемую в форме бланковой пробы для подтверждения того, что материалы не были загрязнены бактериофагом Phi-X174 до начала испытания, учитывают, но не анализируют.
12.5 Критерии приемлемости испытания
12.5.1 Образцы материала медицинской одежды, в которых отсутствуют негативные частицы бактериофага Phi-X174 после проведения количественного анализа, проходят испытание.
12.5.2 Возможность ложноположительных результатов при соблюдении соответствующих мер предосторожности и надлежащих асептических методов при проведении испытания будет сведена к минимуму. При наличии сомнения повторяют испытания на выборке, сделанной статистически достоверным методом по ГОСТ Р ИСО 2859-1.
12.5.3 С помощью этого метода испытания получают количественную оценку проницаемости материала, которая подтверждает приемлемость проведенного испытания и получение положительного или отрицательного результата по обеспечению барьерных функций материала, однако количество бляшкообразующих единиц на кубический сантиметр (миллилитр) не должно использоваться для межлабораторного сравнения.
Примечание — Высокая точность метода достижима при подтверждении в процессе испытания критериев приемлемости испытания.
12.6 Снижение определяемого титра бактериофага Phi-X174
Титр испытательной суспензии бактериофага определяют до и после испытания. Для титрования после испытания используют слитую из испытательной камеры испытательную суспензию бактериофага. Если титр испытательной суспензии бактериофага Phi-X174 во время испытания стал ниже (1,0 • 108) БОЕ/см3(мл), испытание признают неприемлемым и повторяют его с таким начальным титром, чтобы обеспечить его значение (1,0 • 108) БОЕ/см3(мл) в конце 60-минутного испытания.
11
ГОСТ Р 70468—2022
13 Протокол проведения испытаний
13.1 Протокол результатов испытания должен содержать следующие сведения:
13.1.1 Ссылку на настоящий стандарт.
13.1.2 Описание испытуемого материала. Если материал был взят из рулонной ткани, то указывают тип (состав волокна и покрытия), производителя, номер партии и дату получения испытуемого материала. Если материал был взят из предметов одежды, то приводят описание каждого предмета, его конструкцию, типы швов или другие особенности, их положение на предмете одежды.
13.1.3 Толщину каждого образца материала и среднюю толщину испытанных материалов (если она измерена).
13.1.4 Массу каждого образца материала и среднюю массу испытанных материалов, если она определена при необходимости.
13.1.5 Метод стерилизации образцов материалов, если она проводится в лаборатории в соответствии с инструкцией производителя.
13.1.6 Коэффициент, вычисленный при испытании на совместимость.
13.1.7 Тип и характеристики задерживающего фильтра, если он используется.
13.1.8 Сведения о приемлемости испытания каждого из аналогичных образцов, каждого повторно испытанного образца и, если выбрано, количество проникающего Phi-X174 в бляшкообразующих единицах на кубический сантиметр (миллилитр) для каждого из аналогичных образцов и каждого повторно испытанного образца.
13.1.9 Если испытания проводят для контроля качества с целью подбора материала для изготовления медицинского изделия или для проверки максимальных требований к материалу (изделию), то должен быть проведен статистический расчет и анализ большего количества данных, чем предложено в этом методе испытаний. Такой анализ может включать в себя в числе прочего увеличение количества отдельных испытуемых образцов, средний процент приемлемости испытания с указанием стандартного отклонения. При анализе можно использовать среднее число проникающих Phi-X174 и стандартное отклонение, определенное при валидации методики в каждой конкретной лаборатории. Также могут быть указаны доверительные интервалы для каждой лаборатории.
13.1.10 Для каждого из аналогичных образцов, каждого повторно испытанного образца и для каждого отрицательного и положительного контроля указывают, было ли испытание прекращено из-за видимого проникновения жидкости («да» или «нет»).
12
ГОСТ Р 70468—2022
Библиография
[1] СанПиН 3.3686-2021 Санитарно-эпидемиологические требования по профилактике инфекционных болезней (утверждены Постановлением Главного государственного санитарного врача Российской Федерации от 28 января 2021 г. № 4)
[2] Приказ Министерства здравоохранения Российской Федерации от 18 мая 2021 г. № 464н «Об утверждении Правил проведения лабораторных исследований»
[3] Фармакопея XIV, том II. ОФС.1.7.1.0002.15 Бактериофаги, с. 2522, 2528—2529
13
ГОСТ Р 70468—2022
УДК 614.75:006.354
ОКС 13.340.10
Ключевые слова: материалы, используемые для изготовления медицинской одежды, стандартный метод, устойчивость материалов, кровь, патогены, переносимые с кровью, биологические жидкости, тест-система, бактериофаг Phi-X174, вирусное проникновение
14
Редактор Н.А. Аргунова
Технический редактор И.Е. Черепкова
Корректор И.А. Королева
Компьютерная верстка И.А. Налейкиной
Сдано в набор 11.11.2022. Подписано в печать 21.11.2022. Формат 60*84%. Гарнитура Ариал.
Усл. печ. л. 2,32. Уч.-изд. л. 2,10.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «РСТ» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.
