ГОСТ Р ИСО 17734-2-2017
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
АНАЛИЗ АЗОТОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В ВОЗДУХЕ МЕТОДОМ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ И МАСС-СПЕКТРОМЕТРИИ
Часть 2
Определение аминов и аминоизоцианатов по их дибутиламиновым и этилхлорформиатным производным
Determination of organonitrogen compounds in air using liquid chromatography and mass spectrometry. Part 2. Amines and aminoisocyanates using dibutylamine and ethyl chloroformate derivatives
ОКС 13.040.30
Дата введения 2018-12-01
Предисловие
1 ПОДГОТОВЛЕН Открытым акционерным обществом "Научно-исследовательский центр контроля и диагностики технических систем" (АО "НИЦ КД") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 457 "Качество воздуха"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 14 сентября 2017 г. N 1120-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 17734-2:2013* "Анализ азоторганических соединений в воздухе методом жидкостной хроматографии и масс-спектрометрии. Часть 2. Определение аминов и аминоизоцианатов по их дибутиламиновым и этилхлорформиатным производным" (ISO 17734-2:2013 "Determination of organonitrogen compounds in air using liquid chromatography and mass spectrometry - Part 2: Amines and aminoisocyanates using dibutylamine and ethyl chloroformate derivatives", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный стандарт разработан Техническим комитетом ТС 146/SC 2.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВЗАМЕН ГОСТ Р ИСО 17734-2-2009
6 ПЕРЕИЗДАНИЕ. Август 2019 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
В случаях, если изоцианаты рассматривают в качестве загрязнителей воздуха рабочей зоны, необходимо исследовать воздух на присутствие аминоизоцианатов и аминов. В процессе термической деструкции полиуретанов (ПУ) образуются не только изоцианаты, но и амины и аминоизоцианаты [1]-[6].
Определение изоцианатов в воздухе рабочей зоны с использованием ди-н-бутиламина (ДБА) в качестве реагента представляется достаточно надежным методом анализа [20]. Использование метода с применением ДБА и получение производных с этилхлорформиатом при последующей подготовке пробы позволяет проводить определение при совместном содержании аминов, аминоизоцианатов и изоцианатов [6, 7].
Для количественного определения производных аминов и аминоизоцианатов необходимы стандартные соединения, однако они доступны только для небольшого числа диаминов. Аминоизоцианаты не могут быть проанализированы напрямую, поскольку они взаимодействуют друг с другом. В настоящем стандарте установлен метод количественного определения производных аминов и аминоизоцианатов в растворах сравнения с использованием хемилюминесцентного детектора. Показано, что применение этого метода совместно с масс-спектрометрическим исследованием значительно облегчает процесс приготовления стандартных растворов [6].
1 Область применения
Настоящий стандарт устанавливает общие положения по отбору и анализу проб на содержание аминов и аминоизоцианатов, присутствующих в воздухе рабочей зоны. Рекомендуется определять амины и аминоизоцианаты совместно с изоцианатами с использованием ди-н-бутиламина (ДБА) в качестве реагента [20].
Метод, установленный настоящим стандартом, применяют для совместного определения аминов - 4,4'-метилендифенилдиамина (4,4'-МДА), 2,4- и 2,6-толуолдиамина (2,4-, 2,6-ТДА) и 1,6-гексаметилендиамина (1,6-ГДА) и соединений, содержащих изоцианатную и аминную группы, - 4,4'-метилендифениламиноизоцианата (4,4'-МАИ), 2,4-, 4,2- и 2,6-толуоламиноизоцианата (2,4-, 4,2-, 2,6-ТАИ), 1,6-гексаметиленаминоизоцианата (1,6-ГАИ). Метод пригоден для улавливания аминов и аминоизоцианатов в газообразном состоянии и в виде твердых частиц. Предел обнаружения для аминов составляет около 50 нмоль, для аминоизоцианатов - приблизительно 3 нмоль. При объеме пробы воздуха 15 дм для ТДА и ТАИ эти значения соответствуют 0,4 нг/м
и 0,03 нг/м
.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ISO 16200-1 Workplace air quality - Sampling and analysis of volatile organic compounds by solvent desorption/gas chromatography - Part 1: Pumped sampling method (Качество воздуха рабочей зоны. Отбор проб летучих органических соединений с последующей десорбцией растворителем и газохроматографическим анализом. Часть 1. Отбор проб методом прокачки)
ISO 5725-2 Accuracy (trueness and precision) of measurement methods and results - Part 2: Basic method for the determination of repeatability and reproducibility of a standard measurement method [Точность (правильность и прецизионность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерений]
3 Основные положения
Метод позволяет проводить отбор и совместный анализ проб на содержание аминов, аминоизоцианатов и изоцианатов. В настоящем стандарте изложен метод определения аминов и аминоизоцианатов, а метод определения только изоцианатов приведен в ИСО 17334-1.
Пробы отбирают путем прокачивания известного объема воздуха через портативную импинджерную колбу, за которой расположен фильтр. Используют импинджер с 10 см раствора ди-н-бутиламина (ДБА) в толуоле концентрацией 0,01 моль/дм
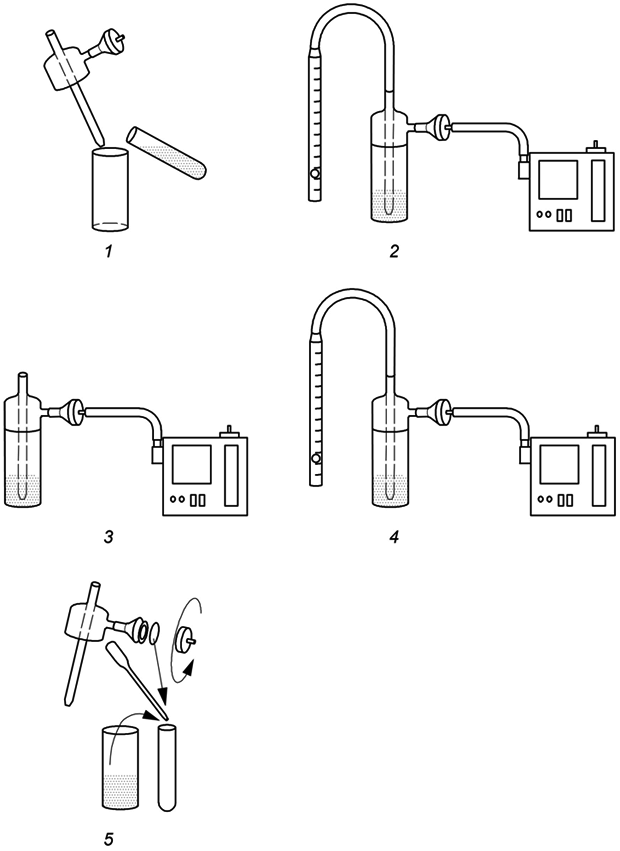
и фильтр из стекловолокна без держателя. После отбора проб к растворам проб добавляют дейтерированные этилхлорформиатные производные аминов (ЭХФ-производные) и ДБА-производные изоцианатов (используемые в качестве внутреннего стандарта). Избыток реактива и растворителя выпаривают, а пробы растворяют в ацетонитриле. Пробы анализируют методом жидкостной хроматомасс-спектрометрии (ЖХ-МС) с обращенной фазой с электрораспылительной ионизацией (ЭРИ) в режиме регистрации положительно заряженных ионов. Количественное определение проводят путем регистрации избранных ионов.
|
Рисунок 1 - Основные этапы описанного метода
Количественное определение и качественные оценки могут быть выполнены с использованием различных методик ЖХ-МС. Для определения изоцианатов с высокими концентрациями допускается использовать методику ЖХ-ХЛД (хемилюминесцентный детектор азота), а для ароматических изоцианатов, аминоизоцианатов и аминов - ЖХ-УФД (ультрафиолетовый детектор). Стандартные соединения могут быть проанализированы методами ЖХ-МС/ХЛД. Для идентификации летучих соединений может быть использован газохроматографический термоионный детектор (ТИД).
4 Реагенты и материалы
4.1 Реагент ДБА
Серийно выпускаемый ди-н-бутиламин (ДБА), ч.д.а.
4.2 Этилхлорформиат
Серийно выпускаемый этилхлорформиат (ЭХФ), ч.д.а.
4.3 Раствор реагента
В мерной колбе вместимостью 1 дм растворяют 1,69 см
ДБА в толуоле и доводят объем раствора до метки. Раствор стабилен, и не обязательно при хранении принимать специальные меры.
4.4 Гидроксид натрия, 5 моль/дм
В лабораторном стаканчике в воде растворяют 200 г NaOH, переносят раствор в мерную колбу вместимостью 1 дм и доводят объем раствора до метки.
4.5 Пиридин
Пиридин, ч.д.а.
4.6 Растворители
Растворитель для реагента, как правило толуол и другие растворители - ацетонитрил и метанол - должны быть класса чистоты для жидкостной хроматографии.
4.7 Муравьиная кислота
Концентрированная муравьиная кислота, ч.д.а.
4.8 Этанол
Безводный этанол, ос.ч., с содержанием основного вещества 99,5%.
4.9 Подвижные фазы для ВЭЖХ
4.9.1 ЖХ-МС
Слабая подвижная фаза (подвижная фаза А) представляет собой смесь воды/ацетонитрила (с отношением по объему 95/5) и 0,05% муравьиной кислоты. Сильная подвижная фаза (подвижная фаза В) представляет собой смесь воды/ацетонитрила/метанола (с отношением по объему 5/70/25) и 0,05% муравьиной кислоты. Перед использованием подвижные фазы дегазируют.
4.9.2 ЖХ-ХЛД
Слабая подвижная фаза (подвижная фаза C) представляет собой смесь воды/метанола (с отношением по объему 95/5) и 0,05% муравьиной кислоты. Сильная подвижная фаза (подвижная фаза D) представляет собой смесь воды/метанола (с отношением по объему 5/95) и 0,05% муравьиной кислоты. Перед использованием подвижные фазы дегазируют.
5 Стандартные растворы
5.1 Стандартные соединения
Стандартные соединения необходимы для определения соединений методом ЖХ-МС. Для серийно выпускаемых аминов этилхлорформиатные (ЭХФ) производные для использования в качестве градуировочных стандартов легко приготовить путем прямого получения производных по реакции с ЭТ. Производные аминоизоцианатов получают по реакции одной из изоцианатных групп с ДБА, а другой - с этанолом. Перед использованием в качестве градуировочных стандартов должен быть проведен качественный и количественный анализ образовавшихся смешанных производных. Производные изоцианатов, аминоизоцианатов и аминов для соединений, не имеющиеся в продаже, могут быть приготовлены на основе технических изоцианатов или продуктов термической деструкции полиуретанов (ПУ). В качестве альтернативы могут быть использованы покупные стандартные растворы.
5.2 Производные аминов и дейтерированные производные аминов
Стандартные растворы для градуировки приготавливают путем введения точно взвешенных количеств (приблизительно 0,1 ммоль) аминов в 100 см толуола. Раствор затем разбавляют до концентрации приблизительно 0,01 мкмоль/см
. В полученные в толуоле растворы объемом 5 см
вводят растворы аминов таких объемов, чтобы получить соответствующую градуировочную кривую. Процедуру подготовки проб на этом заканчивают; аналогичная методика приведена в 8.2.
Синтез производных заключается в следующем:
- растворяют аликвоты, содержащие 10 ммоль аминов и дейтерированных аминов, в 20 см толуола. Добавляют к ним 150 мм
пиридина и 40 см
NaOH концентрацией 5 моль/дм
. Затем при постоянном помешивании добавляют по капле 1,5 см
ЭХФ;
- по истечении 10 мин отделяют фракцию толуола;
- выпаривают реакционную смесь до сухого остатка в роторном испарителе и сушат остаток под вакуумом.
5.3 Производные аминоизоцианатов
5.3.1 Приготовление растворов производных аминоизоцианатов
Для насыщения различных смешанных производных аминоизоцианатов используют две методики - A и B. Изоцианатные группы, например, в 2,4-ТДТ имеют различную реакционную способность, и может быть образовано два различных производных.
По методике A: растворяют аликвоты, содержащие 0,5 ммоль изоцианатов (ГДИ, 2,4- и 2,6-ТДИ, 4,4'-МДИ), в 50 см изооктана. К растворам изоцианатов при постоянном помешивании добавляют аликвоту, содержащую 0,5 ммоль ДБА в изооктане. По истечении 30 мин к растворам добавляют избыток этанола. Оставляют смесь на 16 ч для протекания реакции. Выпаривают растворы до сухого остатка и растворяют его в метаноле.
По методике B: растворяют аликвоты, содержащие 0,5 ммоль изоцианатов (2,4-ТДИ), в 50 см изооктана; при постоянном помешивании добавляют аликвоту, содержащую 0,5 ммоль этанола в изооктане, к раствору изоцианата. По истечении 16 ч к раствору добавляют избыток ДБА в изооктане. Раствор оставляют на 1 ч для протекания реакции. Раствор выпаривают в слабом потоке азота. Осадок растворяют в метаноле.
Идентификацию растворов проводят в соответствии с 5.3.2.
5.3.2 Идентификация
Разбавляют растворы метанолом до соответствующих концентраций, идентифицируют их методом ЖХ-МС и проводят количественную оценку методом ЖХ-ХЛД. Метод является специфичным по отношению к азоту, и в качестве внутреннего стандарта может быть использовано любое азотсодержащее соединение, например кофеин. Подобный метод для других аналитических задач приведен в [8], [9], [10].
5.4 Продукты термической деструкции полиуретанов
5.4.1 Приготовление смешанных производных изоцианатов, аминов и аминоизоцианатов
В процессе термической деструкции, например ПУ, образуются изоцианаты, аминоизоцианаты и амины, не выпускаемые серийно. Материалы на основе ПУ могут разлагаться при соответствующей температуре. Продукты термического разложения улавливают в импинджере (непосредственно за которым расположен фильтр), содержащем раствор ДБА концентрацией 0,5 моль/дм, и впоследствии их подвергают процедуре, описанной в 7.2. Раствор идентифицируют в соответствии с 5.3.2.
5.4.2 Идентификация
Количественные данные получают методом ЖХ-МС. Данные по структуре соединений вместе с данными, полученными с применением ЖХ-ХЛД, используют для вычисления концентраций различных компонентов раствора. Этот разбавленный раствор пробы с известным качественным и количественным составом используют как градуировочный стандарт для ЖХ-МС.
5.5 Стабильность производных аминов и аминоизоцианатов
Показано, что растворы ЭТ-производных аминов и ЭТ-ДБА-производных аминоизоцианатов (МДА, 2,4- и 2,6-ТДА, ГДА, МАИ, 2,4-, 4,2- и 2,6-ТАИ и ГАИ) в толуоле, ацетонитриле и метаноле стабильны в течение 6 мес.
6 Аппаратура
6.1 Устройство отбора проб
Пробу воздуха отбирают с помощью импинджерной колбы, непосредственно за которой расположен фильтр.
6.1.1 Фильтр
Используют фильтр из стекловолокна диаметром 13 мм (без связующего вещества) с размером пор 0,3 мкм.
6.1.2 Фильтродержатель
Используют фильтродержатель, изготовленный из полипропилена, диаметром 13 мм с наконечником Люэра.
6.1.3 Миниатюрный импинджер
Миниатюрный импинджер состоит из колбы и конусообразной входной трубки. Соединяют две части таким образом, чтобы расстояние между входным отверстием и дном приемника составляло от 1 до 2 мм. Держатель фильтра подсоединяют в выходному отверстию импинджера с использованием импинджера с наконечником Люэра на выходном отверстии. В иных случаях держатель фильтра подсоединяют к выходному отверстию импинджера гибкой трубкой.
6.1.4 Насос для отбора проб, соответствующий требованиям [19], способный к поддержанию расхода 1 дм/мин для отбора проб с использованием импинджера с фильтром и 0,2 дм
/мин для отбора проб без растворителя в течение периода отбора проб.
6.1.5 Трубки
Используют резиновые соединительные трубки подходящей длины и соответствующего диаметра, обеспечивающие герметичное подсоединение к насосу и к выходному отверстию устройства отбора проб.
6.1.6 Ловушка паров
Используют ловушку внутренним диаметром 17 мм и длиной 140 мм, заполненную активированным углем (со средним размером частиц не более 3 мм), размещенную между устройством для отбора проб и насосом для отбора проб.
6.2 Расходомер
Используют портативный расходомер, обеспечивающий измерение соответствующего расхода с приемлемой точностью.
6.3 Жидкостный хроматограф
Для повышения чувствительности метода, сокращения времени технического обслуживания масс-спектрометра и сведения к минимуму расхода подвижной фазы используют жидкостный микрохроматограф. Описание используемого жидкостного микрохроматографа приведено ниже. При необходимости данный прибор может быть заменен на жидкостный хроматограф стандартного типа.
6.3.1 Автоматический дозатор
6.3.1.1 ЖХ-МС
Фокусировка пробы в колонке осуществляется с помощью петель с частичным заполнением (как правило, общей вместимостью 10 мм) путем дозирования 2 мм
анализируемого раствора в промежутках между впрыскиванием 4+4 мм
смеси вода/ацетонитрил/метанол с отношением компонентов по объему 50/30/20. Могут быть использованы любые автоматические дозирующие устройства, выпускаемые серийно, обеспечивающие впрыскивание раствора с частичным заполнением петли и впрыскивание пробы с приемлемой точностью и прецизионностью.
6.3.1.2 ЖХ-ХЛД
Фокусировка пробы в колонке осуществляется с помощью петель с частичным заполнением (как правило, общей вместимостью 10 мм) путем дозирования 2 мм
анализируемого раствора в промежутках между впрыскиванием (4+4) мм
смеси метанол/вода с отношением по объему компонентов 50/50. Могут быть использованы любые автоматические дозирующие устройства, выпускаемые серийно, обеспечивающие впрыскивание раствора с частичным заполнением петли и впрыскивание пробы с приемлемой погрешностью и прецизионностью.
6.3.2 Система насосов (ЖХ-МС и ЖХ-ХЛД)
Используют насос для высокоэффективной жидкостной хроматографии (ВЭЖХ), позволяющий проводить градиентное элюирование с расходом 100 мм/мин.
6.3.3 Аналитическая колонка (ЖХ-МС и ЖХ-ХЛД)
Используют колонку для ВЭЖХ, обеспечивающую разделение различных аналитов.
Пример - Подходящей колонкой является колонка РерМар
(размером 50
1,0 мм и частицами наполнителя размером 3 мкм).
________________
РерМар
- пример серийно выпускаемой продукции. Информация приведена для удобства пользователей настоящего стандарта и не служит рекламой данной продукции со стороны ИСО.
6.3.4 Капиллярные трубки
Используют короткие (не более 40 см) трубки с небольшим внутренним диаметром (как правило, не более 0,1 мм).
6.3.5 Детекторы
6.3.5.1 Масс-спектрометр для жидкостного хроматографа
Любой современный МС, оборудованный надежной и стабильно работающей системой управления электрораспыления, обеспечит необходимые характеристики. Детектирование с помощью МСД осуществляется посредством регистрации положительно заряженных ионов при ионизации в условиях атмосферного давления. Для количественного определения проводят мониторинг выбранных ионов. Полные спектры получают в режиме непрерывного сканирования (как правило, в диапазоне от 50 до 1500 а.е.м.) для идентификации неизвестных аналитов. При желании может быть использован УФД, установленный перед МСД. УФД должен быть снабжен проточной микрокюветой (как правило, вместимостью 0,3 мм) для сведения к минимуму уширения пиков.
6.3.5.2 Хемилюминесцентный детектор для жидкостного хроматографа
Используют детектор, специфический по отношению к связанному азоту.
6.4 Ультразвуковая ванна
Воздействие на пробу ультразвуком необходимо для того, чтобы удостовериться, что ДБА-производные изоцианатов растворились в растворе для экстракции и что проба, остающаяся после выпаривания, должным образом растворилась в добавляемом растворителе.
6.5 Испаритель
Необходимо использовать оборудование для выпаривания растворителя пробы, предпочтительно вакуумную центрифугу. Приемлемой считают методику мягкого выпаривания, поскольку существует риск, что жесткое выпаривание может привести к потерям наиболее летучих ДБА-производных изоцианатов.
6.6 Стеклянная посуда
Стеклянная посуда, стеклянные мензурки и мерные колбы (мерные колбы должны соответствовать [18]).
7 Отбор проб воздуха
7.1 Подготовка к отбору проб в условиях лаборатории
7.1.1 Очистка оборудования для отбора проб
Импинджеры разбирают на части и помещают в раствор щелочного моющего средства минимум на 2 ч. Верхнюю часть промывают раствором щелочного моющего средства, затем чистой водой и в заключение деионизированной водой. Насадку при ее закупорке помещают в ультразвуковую ванну, а затем продолжают очистку. Нижнюю часть очищают в лабораторной посудомоечной машине. Обе части сушат в сушильном шкафу.
Кассеты фильтров и прокладки погружают в стеклянный лабораторный стакан с этанолом, обрабатывают ультразвуком в течение по крайней мере 15 мин, промывают деионизированной водой и сушат в сушильном шкафу.
7.1.2 Приготовление раствора реагента и пробирок с раствором для экстракции
Подготавливают пробирки с раствором реагента для импинджеров, содержащие 10 см раствора ДБА концентрацией 0,01 моль/дм
. Если амины и аминоизоцианаты в газообразном и твердом состояниях улавливают раздельно, то подготавливают пробирки с раствором для экстракции фильтров, содержащие 10 см
раствора ДБА концентрацией 0,01 моль/дм
.
7.2 Подготовка к отбору проб в условиях применения
Собирают систему отбора проб, присоединяя к выходу импинджера кассету с фильтрами из стекловолокна. Переносят раствор реагента в импинджер.
Насосы с подсоединенной системой отбора проб, содержащей импинджер с фильтром, калибруют с помощью портативного расходомера. На время градуировки заполняют импинджер раствором реагента соответствующего объема. Расход при отборе проб должен составлять 1 дм/мин.
7.3 Отбор проб воздуха
7.3.1 Отбор проб
Для соотнесения результатов измерений с предельно допустимыми уровнями профессионального воздействия пробы отбирают в зоне дыхания работника. Для определения риска для работника быть подвергнутым воздействию изоцианатов отбирают стационарные пробы на любом участке рабочего места, где возможно их выделение в воздух и воздействие на работников. Также важно учитывать процедуры, выполняемые нечасто, например техническое обслуживание или ремонт. Различия материалов и партий материалов также следует учитывать при отборе проб. Отбирают достаточное число проб, чтобы провести представительную оценку воздействия.
Стационарные пробы могут быть отобраны как фоновые пробы или пробы, отражающие наихудший источник выбросов. Фоновые пробы обычно отбирают на уровне головы, принимая во внимание уровень головы рабочих при выполнении рабочих задач. Пробы для обнаружения источников выбросов или наихудших источников часто отбирают близко к рабочему процессу, и они не обязательно должны быть представительными для определения воздействия на рабочих, но являющихся представительными для идентификации "горячих точек", в которых в течение рабочего процесса выделяются вредные вещества.
7.3.2 Отбор проб с использованием импинджера и фильтра
Устанавливают систему отбора проб, прикрепляя оборудование к одежде работника так, чтобы входное отверстие находилось в зоне дыхания, при персональном отборе проб, или стационарно при отборе проб в конкретной зоне. Подсоединяют насос к системе отбора проб и размещают ловушку для паров с активированным углем на линии между насосом и системой отбора проб для защиты насоса от паров растворителя. Убеждаются в том, что оборудование для отбора проб не нарушает нормальный ход работы, и что импинджер может удерживаться в вертикальном положении во время всего периода отбора проб.
При готовности к отбору проб включают насос. Записывают время начала отбора проб. По окончании периода отбора проб измеряют расход. Ополаскивают импинджер 0,01-молярным раствором ДБА в толуоле. Переносят раствор для ополаскивания и раствор из импинджера в пробирку и, взяв фильтр из стекловолокна пинцетом, погружают его в пробирку с раствором пробы или в пробирку с раствором для экстракции. При перенесении фильтра в раствор для экстракции может быть определено количество изоцианатов в твердом состоянии, проходящих через импинджер (т.е. частицы диаметром приблизительно от 0,01 до 1,5 мкм) отдельно от изоцианатов в газообразном состоянии и крупных частиц (более 1,5 мкм), уловленных в импинджере. Иллюстрация процедуры отбора проб приведена на рисунке 2. Вычисляют объем воздуха, пропущенного через устройство отбора проб, по времени отбора проб и среднему значению расхода во время отбора проб. Общее время отбора проб ограничено (приблизительно 30 мин), если только во время отбора проб в импинджер не добавляют раствор реагента.
7.4 Холостые пробы
В каждой серии проб должно быть соответствующее число, например три холостых пробы, полученных в условиях применения, холостых лабораторных проб и холостых проб реактивов.
Холостые пробы для условий применения - это пробы, с которыми обращаются так же, как и с другими пробами на месте применения, за исключением собственно процесса отбора проб (не прокачивают воздух). Холостые лабораторные пробы необходимы для определения в случае наличия загрязнения, если оно имело место в лаборатории или в полевых условиях.
Холостые пробы реактивов представляют собой пробы чистого толуола, в которые в процессе подготовки не был добавлен внутренний стандарт.
|
1 - раствор для импинджера переносят в импинджерную склянку; 2 - измеряют расход и калибруют насос для отбора проб на расход м/мин; 3 - отбор пробы воздуха; 4 - измеряют расход; 5 - переносят раствор пробы из импинджера в пробирку; фильтр переносят в эту или в другую пробирку с раствором для экстракции
Рисунок 2 - Схема процедуры отбора проб
7.5 Исходные материалы
На каждом рабочем месте желательно отбирать пробы исходных материалов при подозрении, что в процессе работы они выделяют амины, аминоизоцианаты и изоцианаты. Отбор проб и дальнейшее исследование материалов в лаборатории проводят для оценки воздействия, если известно или если есть подозрение, что они могут выделять амины, аминоизоцианаты и изоцианаты. Исследование может состоять из экстракции, нагревания или другой их обработки, выполненной по возможности так же, как и в процессе рабочей операции.
7.6 Транспортирование проб
Пробирки с растворами проб ДБА в толуоле транспортируют в индивидуальных футлярах предпочтительно в вертикальном положении. Пробирки с растворами проб должны быть размещены вдали от любых отобранных исходных материалов. Соответствующим образом следует соблюдать правила транспортировки вредных (опасных) материалов.
8 Подготовка проб в лаборатории
8.1 Серия проб
Каждая серия проб (как правило, 50 проб) включает в себя некоторое число холостых проб для условий применения, две холостые пробы реактивов, две холостые пробы внутренних стандартов и соответствующее число стандартных растворов. Холостые пробы внутренних стандартов представляют собой растворы реагента из той же партии, что и раствор реагента, используемый для отбора проб, в которые в процессе подготовки был добавлен внутренний стандарт. Холостые пробы реактивов - это пробы чистого толуола, в которые в процессе подготовки не был добавлен внутренний стандарт.
8.2 Процедура подготовки проб
Для приготовления стандартных растворов в аликвоты растворов ДБА в толуоле концентрацией 0,01 моль/дм и объемом 10 см
вводят соответствующие количества производных аминов и аминоизоцианатов для построения градуировочной кривой. При совместном определении изоцианатов в стандартные растворы вводят также ДБА-производные изоцианатов (см. ИСО 17334-1).
После получения проб воздуха, отобранных в условиях применения, дейтерированные производные аминов (внутренние стандарты) добавляют в растворы проб воздуха, в стандартные растворы, в растворы холостых проб для условий отбора и в холостые пробы внутренних стандартов. При совместном определении изоцианатов к этим растворам добавляют также дейтерированные производные изоцианатов (см. ИСО 17334-1). Помещают растворы в ультразвуковую ванну на 15 мин. Если в растворе пробы присутствуют фильтры, то их помещают в центрифугу на 10 мин (3000 об/мин). Переносят пипеткой растворы проб, смытые с фильтров, в чистые пробирки. Эфиры карбаминовой кислоты образуются в результате двухэтапной дериватизации при добавлении 3 см NaOH концентрацией 5 моль/дм
, 10 мм
пиридина и 50 мм
ЭХФ. Пробы встряхивают в течение 15 мин и органическую фазу отделяют и выпаривают досуха. Остатки растворяют в 0,5 см
ацетонитрила и помещают в ультразвуковую ванну на 15 мин.
9 Настройка приборов
9.1 Программа для высокоэффективной жидкостной хроматографии с использованием масс-спектрометра (ВЭЖХ-МС)
Для одновременного определения производных аминов, аминоизоцианатов и изоцианатов может быть использована подвижная фаза при следующих условиях:
- расход: 100 мм/мин;
- 0-20 мин: линейный градиент, от 40% до 80% подвижной фазы B;
- 20-25 мин: повторно приводят в равновесие при 40% подвижной фазы B.
Если определяют одно или несколько производных, то хроматограмма может быть получена в режиме изократического элюирования или градиентного элюирования с подвижной фазой подходящего состава.
9.2 Программа для высокоэффективной жидкостной хроматографии с использованием хемилюминесцентного детектора (ВЭЖХ-ХЛД)
Для определения количества ДБА-производных в стандартных растворах, подготовленных в лаборатории, обычно при более высоких концентрациях, может быть использована подвижная фаза при следующих условиях:
- расход: 100 мм/мин;
- 0-20 мин: линейный градиент, от 40% до 100% подвижной фазы D;
- 20-25 мин: повторно приводят в равновесие при 40% подвижной фазы D.
В зависимости от свойств аналита, содержащегося в пробе, может быть проведено элюирование при более сильном или слабом градиенте подвижной фазы или изократическое элюирование.
9.3 Масс-спектрометр
Настройки масс-спектрометра зависят в большой степени от типа используемого прибора. Оптимизацию режима работы, как правило, выполняют при подаче подвижной фазы, содержащей производные ароматических и алифатических аминов и аминоизоцианатов при расходе 100 мм/мин. Для конкретных аналитов и определяемых ионов оптимальные настройки различны. Фактические настройки не являются оптимальными для всех исследуемых соединений.
Для количественного определения проводят регистрацию избранных ионов, например молекулярных ионов [МН], но также могут быть использованы и другие типичные ионы:
- для ДБА-производных типично образование молекулярных ионов [MH], [(ДБА)Н]
(m/z
=130), [(ДБА)СО]
(m/z=156), [МН-129]
и [MNa]
;
________________
m/z - - отношение массы заряженного фрагмента молекулы к его заряду.
- для производных аминов типичными являются [MH], [MNa]
, [М-46]
и [М-92]
;
- для производных аминоизоцианатов типичными являются [MH], [MNa]
, [М-46]
, [М-129]
, [(ДБА)Н]
(m/z=130) и [(ДБА)СО]
(m/z=156) (см. приложение В).
Для идентификации неизвестных изоцианатов регистрируют масс-спектры в режиме непрерывного сканирования (как правило, от 50 до 1500 а.е.м.).
10 Обработка данных
10.1 Идентификация
Для идентификации изоцианатов время удерживания избранных ионов на хроматограммах, полученное для проб, сравнивают со временем удерживания, полученным для стандартных растворов и внутренних стандартов.
10.2 Градуировочные кривые
Измеряют площади пиков, соответствующих производным аминов и аминоизоцианатов и внутреннему стандарту, и вычисляют их отношение. Затем строят график зависимости полученного отношения от концентрации. Коэффициент корреляции должен составлять не менее 0,98. Значения коэффициента ниже 0,98 увеличат неопределенность, как приведено в 11.2.
Иногда в случае большого динамического диапазона может применяться квадратичная аппроксимация градуировочных кривых. Тип и условия использования измерительной аппаратуры могут затронуть линейность градуировки. В некоторых случаях может быть достаточно квадратичных калибровочных кривых. Однако следует осторожно использовать квадратичную аппроксимацию, чтобы она не повлияла на эффективность метода.
10.3 Количественное определение
Количественно соединения определяют по градуировочной кривой на основе отношения площадей пиков пробы и внутреннего стандарта.
11 Определение рабочих характеристик
11.1 Общие положения
Измерение содержания изоцианатов в воздухе рабочей зоны имеет связанную с этим неопределенность, которая может быть выражена как суммарная неопределенность или расширенная неопределенность (см. [11] или [12]). Поэтому оценку неопределенности необходимо выполнять в соответствии с одним из этих двух способов ее выражения. В обоих случаях эта оценка включает в себя определение вкладов в неопределенность, выполненное при лабораторных испытаниях или испытаниях, воспроизводящих условия применения, или на основе имеющейся информации. Полученные значения неопределенности измерения затем могут быть сравнены с предварительно установленными критериями, например установленными в [11], или предусмотренными национальным или международным законодательством.
11.2 Соответствующие вклады в неопределенность и их критерии
Таблица 1 - Соответствующие вклады в неопределенность и их критерии
Вклады в неопределенность | Обозна- | Подпункт | Критерий |
Объем пробы | 11.3.2 | ||
Расход при отборе проб - калибровка | Относительная неопределенность <2% | ||
Расход при отборе проб - разброс | <5% | ||
Время отбора проб | Относительная неопределенность <0,1% | ||
Температура во время отбора проб | Относительная неопределенность <4% | ||
Давление во время отбора проб | Относительная неопределенность <2% | ||
Масса аналита | 11.3.3 | ||
Стабильность аналита во время хранения | Не наблюдается существенной разницы между результатами измерений для проб, полученными до и после хранения | ||
Эффективность реакции/экстракции | Более 90% при предельном значении с относительной неопределенностью <3% | ||
Масса изоцианата в градуировочных растворах | 11.3.3 | Относительная неопределенность <2% | |
Несоответствие градуировочного графика | LOF | Относительные разности в пределах диапазона градуировки <3%; при предельном значении концентрации изоцианата в стандартном растворе <2% | |
Дрейф выходного сигнала в промежутках между градуировками | 11.3.3 | 3% | |
Прецизионность аналитической процедуры | <1% | ||
Селективность | Разрешение >1 | ||
Уровень холостых показаний | 11.3.4 | <50 нг при относительной неопределенности <5% | |
Межлабораторные вариации | bl | 11.3.5 | Относительная неопределенность <7,5% |
11.3 Оценка метрологических характеристик в соответствии с подходом, детально описанным в [12]
11.3.1 Эффективность улавливания в зависимости от распределения частиц по размеру
Подробное описание требований и методов определения данной характеристики приведено в [12].
11.3.2 Отбор проб воздуха
11.3.2.1 Объем пробы воздуха
Отобранный объем воздуха вычисляют на основе расхода воздуха, измеренного до и после отбора проб, как установлено в ИСО 16200-1, по формуле
![]() , (1)
, (1)
где - отобранный объем воздуха (как правило, см
);
- расход в начале периода отбора пробы (как правило, см
/мин);
- расход в конце периода отбора пробы (как правило, см
/мин);
- продолжительность отбора проб, мин.
Неопределенность результатов измерения объема отобранного воздуха складывается из неопределенностей, связанных:
- с измерениями расхода до и после отбора проб;
- с измерениями времени отбора проб;
- с изменениями расхода во время отбора проб.
Такая неопределенность может быть вычислена по формуле
 , (2)
, (2)
в которой последний член представляет собой вклад в неопределенность, связанный с изменениями расхода во время периода отбора проб.
11.3.2.2 Время отбора проб
Время отбора проб может быть измерено с погрешностью в пределах ±0,5 мин. Для продолжительности отбора проб 8 ч относительная неопределенность измерений
составляет приблизительно 0,1%, и ею можно пренебречь.
11.3.2.3 Изменения расхода во время отбора проб
Расход во время отбора проб неизвестен. Неопределенность, обусловленная изменениями расхода во время отбора проб, , может быть оценена на основе предположения о равномерном распределении по формуле
![]() . (3)
. (3)
11.3.2.4 Приведение значений объема пробы к заданным температуре и давлению
Для приведения значений объема пробы к заданным температуре и давлению необходимо знать действительные средние значения температуры и давления во время отбора проб. Значения неопределенностей, обусловленных характеристиками средств измерений температуры и давления
, используемых для приведения к заданным условиям, могут быть получены на основе:
- результатов реальных измерений с учетом неопределенности, обусловленной градуировкой датчиков температуры и давления, по формуле
![]() , (4)
, (4)
где - неопределенность, обусловленная градуировкой датчиков;
- стандартное отклонение результатов измерений температуры/давления;
- число результатов измерений температуры/давления;
- информации о предельных значениях температуры и давления во время отбора проб в предположении их равномерного распределения.
Например, если предельные значения температуры и
известны, то неопределенность, обусловленную изменением температуры
, вычисляют по формуле
![]() . (5)
. (5)
Как правило, первый член в формуле незначителен по сравнению со вторым.
11.3.2.5 Суммарная неопределенность объема пробы
Представленные выше вклады в неопределенность суммируют и неопределенность объема пробы, приведенного к заданным условиям, вычисляют по формуле
 , (6)
, (6)
где - среднее значение температуры во время отбора проб;
- среднее значение давления во время отбора проб.
11.3.3 Анализ
11.3.3.1 Масса аналита в пробе
Массу изоцианата в пробе воздуха вычисляют по формуле
![]() , (7)
, (7)
где - эффективность улавливания;
- нестабильность устройства отбора проб;
- стабильность аналита в пробе;
- эффективность реакции/экстракции;
- масса изоцианата в пробе без учета поправки.
11.3.3.2 Стабильность аналита
Стабильность аналита должна быть установлена экспериментально для условий хранения (время, температура и другие окружающие условия), типичных для конкретной лаборатории. Испытания необходимо проводить при уровне содержания изоцианата, соответствующем концентрации, эквивалентной предельно допустимому значению.
При времени t=0 и времени t должен быть проанализирован ряд проб (n=6) в условиях повторяемости. Для обоих значений времени пробы следует выбирать случайным образом из партии репрезентативных проб, чтобы свести к минимуму возможные систематические изменения содержаний. Для проверки стабильности используют t-критерий Стьюдента (двусторонний критерий при уровне доверительной вероятности 95%). Неопределенность определения стабильности состоит из вкладов, обусловленных:
- десорбцией (случайная составляющая эффективности десорбции);
- градуировкой (случайная составляющая градуировки);
- прецизионностью, относящейся к аналитической процедуре;
- неоднородностью партии проб.
По существу, вклад в неопределенность, обусловленный определением , уже включен в другие вклады в неопределенность и нет необходимости его учитывать.
11.3.3.3 Эффективность реакции/экстракции
Значения эффективности реакции/экстракции изоцианата и ее неопределенность, как правило, получают на основе повторных измерений аттестованных образцов сравнения (АОС) изоцианата или продукта(ов) его реакции. Неопределенность, обусловленную неполнотой реакции/экстракции, для уровня содержания изоцианата, соответствующего предельно допустимому значению, вычисляют на основе вкладов:
- неопределенности концентрации стандартного раствора;
- стандартного отклонения среднего извлечения;
- смещения средней массы изоцианата в пробе по отношению к массе изоцианата в АОС.
Неопределенность вычисляют по формуле
 , (8)
, (8)
где ![]() - аттестованная масса изоцианата в АОС;
- аттестованная масса изоцианата в АОС;
![]() - неопределенность аттестованной массы изоцианата в АОС;
- неопределенность аттестованной массы изоцианата в АОС;
- средняя масса изоцианата, определенная при анализе;
![]() - стандартное отклонение средней массы, полученной на основе результатов повторных измерений.
- стандартное отклонение средней массы, полученной на основе результатов повторных измерений.
Последним членом в формуле, представляющим собой неопределенность, обусловленную значимым систематическим смещением значения измеренной массы от аттестованного значения, можно пренебречь, если:
- смещение статистически незначимо при уровне доверительной вероятности 95%;
- введена поправка на смещение.
Если АОС нет в наличии, то следует использовать материал наивысшего метрологического качества.
11.3.3.4 Нескорректированная масса аналита
Неопределенность нескорректированной массы аналита обусловлена:
- неопределенностью концентрации соединения в используемых стандартных растворах;
- несоответствием градуировочной функции;
- дрейфом выходного сигнала детектора между градуировками;
- прецизионностью анализа;
- селективностью хроматографической системы.
11.3.3.5 Градуировочные стандартные растворы
Неопределенность содержания изоцианата в используемых стандартных растворах зависит от типа стандартного раствора.
Для стандартных растворов в толуоле или ацетонитриле неопределенность будет состоять из следующих вкладов:
- неопределенности чистоты изоцианата , известной из сопроводительной документации изготовителя, как правило, представляемой как минимальный уровень чистоты,
, например
- =99%, относительная неопределенность, обусловленная наличием примесей, задаваемая как (100-P)%, или
- 99%, относительная неопределенность, оцениваемая в предположении равномерного распределения, по формуле
![]() ; (9)
; (9)
- неопределенности взвешиваний веществ и растворов, т.е. погрешности используемых весов ![]() .
.
При получении результатов по разности взвешиваний вклад неопределенности результата взвешивания, как правило, вычисляют по формуле
![]() , (10)
, (10)
где - погрешность используемых весов.
Если метод, установленный настоящим стандартом, применяют для определения других соединений, кроме изоцианатов, то концентрация изоцианата в используемых реактивах и ее неопределенность должны быть установлены и использованы при оценке неопределенности, описанной в настоящем пункте.
11.3.3.6 Несоответствие градуировочной функции
Неопределенность, обусловленную несоответствием градуировочной функции, вычисляют для концентрации (соответствующей массе изоцианата, отобранного при предельном значении) по отклонениям от градуировочной функции, полученной методом наименьших квадратов для линейной регрессии, деленным на концентрацию в стандартном растворе, по формуле
 , (11)
, (11)
где - масса изоцианата, вычисленная по уравнению линейной регрессии, при уровне концентрации стандартного раствора, наиболее точно соответствующем массе изоцианата в пробе при предельном значении концентрации;
- масса изоцианата, присутствующего в соответствующем стандартном растворе;
- относительная разность для заданного уровня массовой концентрации.
Примечание - Несоответствие градуировочной характеристики будет вносить вклад в неопределенность, обусловленную неполнотой экстракции или реакции, если эффективность реакции/экстракции значительно отличается от 1. В этом случае независимо от того, была ли введена поправка на неполноту реакции/экстракции, неопределенность, обусловленную несоответствием градуировочной характеристики, не следует учитывать при оценке неопределенности.
11.3.3.7 Дрейф выходного сигнала детектора
Неопределенность, обусловленную дрейфом выходного сигнала детектора , оценивают на основе относительных разностей выходных сигналов между последовательными градуировками по формуле
 , (12)
, (12)
где - выходной сигнал детектора для стандартного раствора, наиболее точно соответствующий массе изоцианата при его предельном содержании в пробе;
- число повторных анализов.
11.3.3.8 Прецизионность анализа
Неопределенность, обусловленную недостаточной прецизионностью анализа , оценивают проведением анализа стандартных растворов одного и того же состава в условиях повторяемости. При этом проводят не менее шести повторных анализов. Неопределенность вычисляют по формуле
![]() , (13)
, (13)
где - стандартное отклонение выходных сигналов при повторных анализах;
- среднее значение выходного сигнала.
При оценке неопределенности данный вклад уже включен во вклады в неопределенность при определении эффективности десорбции, поэтому нет необходимости его учитывать.
11.3.3.9 Селективность анализа
Используемая система разделения (колонка для ВЭЖХ, градиентная программа) должна быть оптимизирована для сведения к минимуму неопределенности, обусловленной (незамеченным) совместным элюированием потенциальных мешающих веществ.
Разрешение используемой ВЭЖХ системы вычисляют по формуле
![]() , (14)
, (14)
где - разность времени удерживания аналита и мешающего вещества, с;
- ширина пика изоцианата на полувысоте, с; индекс В относится к изоцианату;
- ширина пика мешающего вещества на полувысоте, с; индекс
относится к мешающему веществу.
Разрешение R должно быть более 1. В этом случае максимальная неопределенность, обусловленная совместным элюированием, составляет 2,5%. Типичный вклад в неопределенность составит ±0,7%.
11.3.3.10 Суммарная неопределенность измерения массы изоцианата
Приведенные выше вклады в неопределенность объединяют и неопределенность измерения массы соединения, исключая неопределенность, обусловленную недостаточной прецизионностью, вычисляют по формуле
 . (15)
. (15)
11.3.3.11 Суммарная неопределенность измерения массы изоцианатов в пробе
Вклады в неопределенность, приведенные в 11.3.3.4-11.3.3.8 и в 11.3.3.10, объединяют и неопределенность измерения массы соединения в пробе воздуха ![]() вычисляют по формуле
вычисляют по формуле
 . (16)
. (16)
11.3.4 Масса соединения в холостой пробе
Массу изоцианата в холостой пробе определяют проведением анализа ряда холостых проб в условиях повторяемости; необходимо провести не менее шести повторных анализов. Неопределенность вычисляют с использованием углового коэффициента градуировочной функции, экстраполированной в точку, соответствующую уровню сигнала холостой пробы, по формуле
![]() , (17)
, (17)
где - стандартное отклонение результатов повторных анализов холостых проб;
- угловой коэффициент градуировочного графика, экстраполированного к уровню холостых показаний.
Если сигнал холостого опыта в три раза меньше уровня шумов детектора при времени удерживания изоцианата, то уровень сигнала холостого опыта и его неопределенность следует вычислять на основе уровня шумов детектора с использованием коэффициента градуировочной функции, экстраполированной к нулевому уровню выходного сигнала, учитывая его равномерное распределение, по формулам
![]() , (18)
, (18)
![]() , (19)
, (19)
где - уровень шумов;
- угловой коэффициент градуировочной функции при нулевом уровне выходного сигнала.
11.3.5 Межлабораторные вклады в неопределенность
Возможно отступление от установленной процедуры проведения анализа, описанного в настоящем стандарте, при применении его в различных лабораториях. Окончательная оценка дополнительных вкладов в неопределенность может быть определена количественно проведением межлабораторных сличений, охватывающих:
- всю процедуру измерений, включая отбор проб;
- аналитическую часть процедуры измерений.
Межлабораторные сличения должны быть организованы в соответствии с ИСО 5725-2 с использованием образцов достаточной однородности для обеспечения того, чтобы вклад в межлабораторную неопределенность, обусловленный неоднородностью, был незначительным. На практике, как правило, достаточно, чтобы неопределенность из-за неоднородности была <2%.
11.3.6 Суммарная неопределенность
Суммарную неопределенность измерения содержания изоцианата в пробе воздуха ![]() получают объединением вкладов в неопределенность, вычисленных по формулам (6), (14), (18) и (19), прибавляя (при необходимости) межлабораторную неопределенность, по формуле
получают объединением вкладов в неопределенность, вычисленных по формулам (6), (14), (18) и (19), прибавляя (при необходимости) межлабораторную неопределенность, по формуле
![]() , (20)
, (20)
где - межлабораторный вклад в неопределенность.
11.3.7 Расширенная неопределенность
Расширенную неопределенность измерений содержания изоцианата при уровне доверительной вероятности 95% получают умножением
![]() на коэффициент охвата 2.
на коэффициент охвата 2.
11.3.8 Неопределенность исходя из критериев эффективности
Объединение неопределенностей, установленных для рабочих характеристик (11.2), приведет к наихудшему случаю. Полученная суммарная относительная неопределенность, вычисленная по 11.3.6, будет составлять около 10%. Расширенная неопределенность - 20%.
Приложение A
(справочное)
Рабочие характеристики
A.1 Оценки неопределенности на основании литературных данных
Данные по вкладам в неопределенность, приведенные в таблице A.1, взяты из [6], [13]-[17] и получены при валидации метода, установленного настоящим стандартом, и по результатам оценок.
Таблица A.1 - Вклады в неопределенность
Вклады в неопределенность | Неопреде- | Комментарий |
Объем пробы | 4 | Для пробы воздуха, отобранной в течение 15 мин при расходе 1 дм |
Расход при отборе проб - калибровка | 2 | Инструкции по калибровке прибора |
Расход при отборе проб - разброс | 3 | Оценка |
Время отбора проб | 0,2 | - |
Температура во время отбора проб | 1 | Оценка |
Давление во время отбора проб | 1 | Оценка |
Масса аналита (определенная путем взвешивания) | 3 | Содержание амина в стандартных градуировочных растворах, определенное путем взвешивания соединений |
Масса аналита (по результатам анализа с ХЛД) | 11 | Содержание аминоизоцианата, определенное методом ЖХ-ХЛД |
Стабильность аналита во время хранения | Пренебрежимо мала | См. [13], [14] и [15] |
Эффективность реакции/экстракции | 6 | Оценка, данных нет |
Масса аминов в стандартных градуировочных растворах (определенная путем взвешивания) | 1 | Содержание амина в стандартных градуировочных растворах, определенное путем взвешивания соединений. |
Масса аминоизоцианатов в стандартных градуировочных растворах (определенная по результатам анализа с ХЛД) | 10 | Содержание аминоизоцианата, определенное методом ЖХ-ХЛД [16] |
Несоответствие градуировочной характеристики | 1 | - |
Дрейф выходного сигнала в промежутках между градуировками | Пренебрежимо мал | Поправка на дрейф прибора введена с использованием внутренних стандартов [6], [17] |
Прецизионность аналитической процедуры | 2 | - |
Селективность | Пренебрежимо мала | Использование метода ЖХ-МС обеспечивает высокоселективное определение |
Уровень холостых показаний | Пренебрежимо мал | - |
Межлабораторные вариации | 10 | Оценка, данных нет |
A.2 Суммарная неопределенность
Оценка суммарной неопределенности массовой концентрации амина составляет 12%. Оценка суммарной неопределенности массовой концентрации аминоизоцианата составляет 16%.
A.3 Расширенная неопределенность
При коэффициенте охвата, равном 2, расширенная неопределенность при определении содержания аминов составит 24%, аминоизоцианатов - 32%. В этом случае будет дополнительный вклад в неопределенность (до тех пор, пока его не учитывают), связанный с эффективностью улавливания, если необходимое улавливание проведено в соответствии с условиями отбора проб.
Приложение B
(справочное)
Примеры
B.1 Пример 1: стандартный раствор
На рисунке B.1 представлена ЖХ-МС хроматограмма раствора, содержащего различные ДБА-производные изоцианатов.
|
- время удерживания
, мин
Рисунок В.1 - ЖХ-МС хроматограмма раствора, содержащего 0,15 мкг/см различных ДБА-производных изоцианатов, ЭХФ-ДБА-производных аминоизоцианатов и ЭХФ-производных аминов
Примечания
1 При анализе выбран режим регистрации отдельных ионов для 22 различных молекулярных ионов [МН] и ионов с отношениями массы к заряду m/z=130 и 156 а.е.м.
2 Высота пиков, как функция времени удерживания принята за 100% (в произвольном масштабе).
B.2 Пример 2: сварка металлических листов, покрытых ПУ, используемых в конструкции автомашин
Проба воздуха была отобрана в авторемонтной мастерской во время сварки металлическим электродом в среде газа металлических листов, покрытых ПУ. Отбор проб проводили на расстоянии 20 см от места сварки в течение 2 мин при расходе 1 дм/мин.
В пробе воздуха были обнаружены следующие изоцианаты, аминоизоцианаты и амины (см. рисунок B.2):
- изоциановая кислота (ИЦК): 700 мкг/м;
- метилизоцианат (МИЦ): 67 мкг/м;
- фенилизоцианат (ФИЦ): 11 мкг/м;
- 2,6-толуолдиизоцианат (ТДИ): 120 мкг/м;
- 2,4-ТДИ: 190 мкг/м;
- 2,6-толуоламиноизоцианат (ТАИ): 540 мкг/м;
- 2,4-ТАИ: 390 мкг/м;
- 4,2-ТАИ: 820 мкг/м;
- 2,6-толуолдиамин (ТДА): 67 мкг/м;
- 2,4-ТДА: 270 мкг/м.
|
- время удерживания
, мин
Рисунок В.2 - ЖХ-МС хроматограмма, полученная в режиме регистрации избранных ионов, для пробы воздуха, описанной в примере 2
Примечание - Высота пиков, как функция времени удерживания , принята за 100% (в произвольном масштабе).
В.3 Пример 3: сварка труб, покрытых ПУ
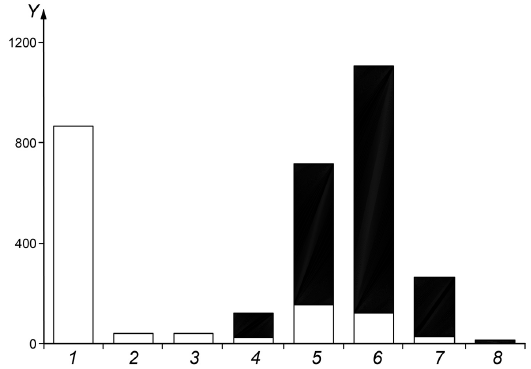
Проба воздуха была отобрана на открытом воздухе во время сварки труб централизованного теплоснабжения, покрытых пенополиуретаном на основе МДИ. Две трубы были соединены друг с другом, и с конца каждой трубы длиной приблизительно 20 см перед сваркой было снято пенополиуретановое покрытие. Проба была отобрана на расстоянии 20-40 см от места сварки вблизи зоны дыхания работника.
В пробе воздуха были обнаружены следующие изоцианаты, аминоизоцианаты и амины (см. рисунок В.3):
- изоциановая кислота (ИЦК): 870 мкг/м;
- метилизоцианат (МИЦ): 42 мкг/м;
- фенилизоцианат (ФИЦ): 42 мкг/м;
- 4,4'-метилендифенилдиизоцианат (4,4'-МДИ): 1100 мкг/м;
- 2,4'-МДИ: 260 мкг/м;
- трициклический МДИ: 3 мкг/м;
- метилендифенилдиамин (МДА): 120 мкг/м;
- метилендифениламиноизоцианат (МАИ):720 мкг/м;
|
![]() , мкг/м
, мкг/м, 1 - изоциановая кислота (ИЦК); 2 - метилизоцианат (МИЦ); 3 - фенилизоцианат (ФИЦ); 4 - метилендифенилдиамин (МДА); 5 - метилендифениламиноизоцианат (МАИ); 6 - 4,4'-метилендифенилдиизоцианат (4,4'-МДИ); 7 - 2,4'-МДИ; 8 - трициклический МДИ;
- доля массовой концентрации соединения, отобранного в импинджерной колбе;
- доля массовой концентрации соединения, отобранного на фильтре из стекловолокна
Рисунок В.3 - Массовая концентрация изоцианатов, аминоизоцианатов и аминов в пробе воздуха с указанием доли массовой концентрации, приходящейся на импинджер и фильтр
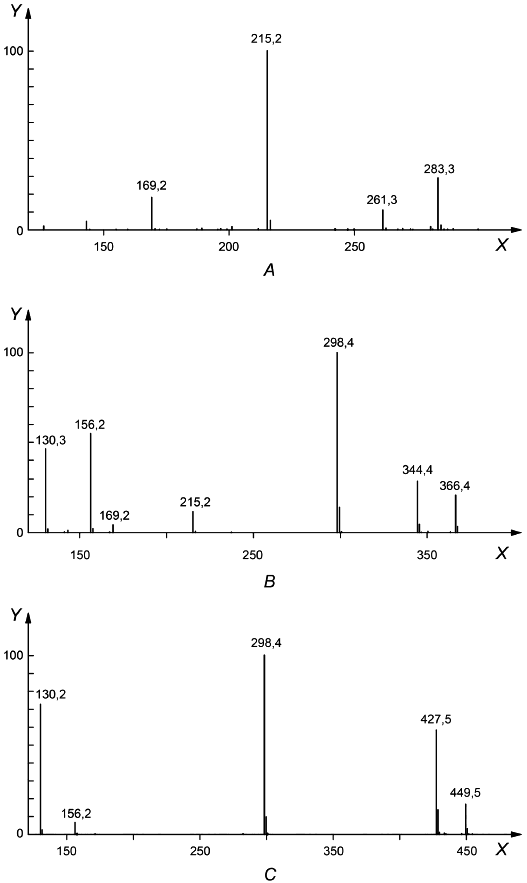
В.4 Пример 4: масс-спектры ЭХФ-производных аминов, ЭХФ-ДБА-производных аминоизоцианатов и ДБА-производных изоцианатов
С помощью масс-спектрометрии может быть получена важная информация о соединениях, присутствующих в пробе. Идентификация производных возможна благодаря наличию библиотеки спектров для характеристических фрагментов молекул. Для ДБА-производных типично образование молекулярных ионов [MH] и заряженных частиц [(ДБА)Н]
(m/z=130), [(ДБА)СО]
(m/z=156), [MH-129]
и [MNa]
.
Для ЭХФ-производных аминов типично образование молекулярных ионов [MH], [MNa]
, [M-46]
и [M-92]
.
Для ЭХФ-ДБА-производных аминоизоцианатов типично образование молекулярных ионов [МН], [MNa]
, [M-46]
, [M-129]
, [(ДБА)Н]
(m/z=130) и [(ДБА)СО]
(m/z=156) (см. рисунок В.4).
|
- m/z;
- относительная интенсивность, %
Рисунок В.4 - Масс-спектры с указанием относительной интенсивности для ЭТ-производного ГДА (А), ЭХФ-ДБА-производного ГАИ (В) и ДБА-производного ГДИ (С), полученные методом жидкостной хроматомасс-спектрометрии (ЖХ-МС) с обращенной фазой с электрораспылительной ионизацией (ЭРИ)
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 16200-1 | IDT | ГОСТ Р ИСО 16200-1-2007 "Качество воздуха рабочей зоны. Отбор проб летучих органических соединений с последующей десорбцией растворителем и газохроматографическим анализом. Часть 1. Отбор проб методом прокачки" |
ISO 5725-2 | IDT | ГОСТ Р ИСО 5725-2-2002 "Точность (правильность и прецизионность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерений" |
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: | ||
Библиография
[1] | Skarping G., Dalene M., Mathiasson L., Trace analysis of airborne 1,6-hexamethylenediisocyanate and the related aminoisocyanate and diamine by glass capillary gas chromatography. J. Chromatogr., 435, 1988, p.453-468 |
[2] | Tinnerberg H., Spanne M., Dalene M., Skarping G., Determination of Complex Mixtures of Airborne Isocyanates and Amines - Part 3. Methylenediphenyl Diisocyanate, Methylenediphenylamino Isocyanate and Methylenediphenyldiamine and Structural Analogues after Thermal Degradation of Polyurethane. Analyst, 122 (3), 1997, p.275-278 |
[3] | Tinnerberg H., Karlsson D., Dalene M., Skarping G., Determination of toluene diisocyanate in air using di-n-butylamine and 9-N-methylaminomethyl-antracene as derivatization reagents. J. Liq. Chrom. Rel. Technol., 20 (14), 1997, p.2207-2219 |
[4] | Renman L., |
[5] | Rosenberg C., Direct determination of isocyanates and amines as degradation products in the industrial production of polyurethane-coated wire. Analyst, 109, 1984, p.859-866 |
[6] | Karlsson D., Dahlin J., Skarping G., Dalene M., Determination of isocyanates, aminocyanates and amines in air formed during the thermal degradation of polyurethane. J. Environ. Monit., 4, 2002, p.216-222 |
[7] | Tinnerberg H., Spanne M., Dalene M., Skarping G., Determination of Complex Mixtures of Airborne Isocyanates and Amines - Part 2. Toluene Diisocyanate and Aminoisocyanate and Toluenediamine After Thermal Degradation of a Toluene Diisocyanate-Polyurethane. Analyst, 121 (8), 1996, p.1101-1106 |
[8] | ASTM D4629-02 Standard Test Method for Trace Nitrogen in Liquid Petroleum Hydrocarbons by Syringe/Inlet Oxidative Combustion and Chemiluminescence Detection, American Society for Testing and Materials |
[9] | ASTM D5762-05 Standard Test Method for Nitrogen in Petroleum and Petroleum Products by Boat-Inlet Chemiluminescence, American Society for Testing and Materials |
[10] | ENV 12260:2003 Water quality - Determination of nitrogen - Determination of bound nitrogen (TN |
[11] | EN 482:1995 Workplace atmospheres - General Requirements for performance of procedures for the measurement of chemical agents |
[12] | Guide to the expression of uncertainty in measurement (GUM), BIPM, IEC, IFCC, ISO, IUPAC, IUPAP, OIML, 1993, corrected and reprinted in 1995 |
[13] | Karlsson D., Spanne M., Dalene M., Skarping G., Determination of Complex Mixtures of Airborne Isocyanates and Amines - Part 4. Determination of Aliphatic Isocyanates as Dibutylamine Derivatives Using Liquid Chromatography and Mass Spectrometry. Analyst, 123 (1), 1998, p.117-123 |
[14] | Karlsson D., Dalene M., Skarping G., Determination of Complex Mixtures of Airborne Isocyanates and Amines - Part 5. Determination of low molecular weight aliphatic isocyanates as dibutylamine derivatives. Analyst, 123, 1998, p.1507-1512 |
[15] | Karlsson D., Dalene M., Skarping G., Marand A., Determination of isocyanic acid in air. J. Environ. Monitor., 3, 2001, p.432-436 |
[16] | Taylor E.W., Qian M.G., Dollinger G.D., Simultaneous On-Line Characterization of Small Organic Molecules Derived from Combinatorial Libraries for Identity, Quantity, and Purity by Reversed-Phase HPLC with Chemiluminescent Nitrogen, UV, and Mass Spectrometric Detection. Anal. Chem. 70 (16), 1998, p.3339-3347 |
[17] | Karlsson D., Spanne M., Dalene M., Skarping G., Airborne thermal degradation products of polyurethane coatings in car repair shops. J. Environ. Monit., 2 (5), 2000, p.462-469 |
[18] | ISO 1042 Laboratory glassware - One-mark volumetric flasks |
[19] | ISO 13137 Workplace atmospheres - Pumps for personal sampling of chemical and biological agents - Requirements and test methods |
[20] | ISO 17734-1 Determination of organonitrogen compounds in air using liquid chromatography and mass spectrometry - Part 1: Isocyanates using dibutylamine derivatives |
УДК 504.3:006.354 | ОКС 13.040.30 | |
Ключевые слова: воздух рабочей зоны, отбор проб, анализ, азоторганические соединения, метод жидкостной хроматографии и масс-спектрометрии, определение аминов и аминоизоцианатов, дибутиламиновые и этилхлорформиатные производные | ||
Электронный текст документа
и сверен по:
, 2019