ГОСТ Р ИСО 16000-17-2012
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ВОЗДУХ ЗАМКНУТЫХ ПОМЕЩЕНИЙ
Часть 17
Обнаружение и подсчет плесневых грибков. Метод культивирования
Indoor air. Part 17. Detection and enumeration of moulds. Culture-based method
ОКС 13.040.20
Дата введения 2013-12-01
Предисловие
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Научно-исследовательский центр контроля и диагностики технических систем" (АНО "НИЦ КД") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 457 "Качество воздуха"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 19 ноября 2012 г. N 936-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 16000-17:2008* "Воздух замкнутых помещений. Часть 17. Обнаружение и подсчет плесневых грибков. Метод культивирования" (ISO 16000-17:2008 "Indoor air - Part 17: Detection and enumeration of moulds - Culture-based method", IDT)
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
5 ВВЕДЕН ВПЕРВЫЕ
6 ПЕРЕИЗДАНИЕ. Август 2019 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Плесень - общее название нитевидных грибков, принадлежащих к различным таксономическим группам (Зигомицеты, Аскомицеты [отдел Аскомикота], Дейтеромицеты). Они образуют мицелий (гифы) и споры, а именно конидиоспоры (конидии), спорангиоспоры или аскоспоры, по которым их можно визуально обнаружить с помощью микроскопа. Диаметр большинства спор составляет от 2 до 10 мкм, некоторые имеют размер до 30 мкм, и совсем небольшое число достигает в диаметре 100 мкм. Споры грибков некоторых видов малы и очень легко попадают в воздух (например, аспергилл, пенициллин), а других - имеют большие размеры и/или покрыты слизью (стахиботрикс, фузариум) и не так подвижны.
Споры грибков широко распространены в окружающей среде, и поэтому в различном количестве они также встречаются в замкнутых помещениях. Рост плесени в замкнутых помещениях следует рассматривать как проблему, касающуюся здоровья граждан. Результаты эпидемиологических исследований подтвердили тесную взаимосвязь между влажностью и/или ростом плесени в домах и ухудшением здоровья их обитателей.
Стандартизованные методы отбора проб, обнаружения и подсчета числа плесневых грибков, в том числе стандарты на методологию отбора проб, необходимы для сравнительной оценки проблем с плесневыми грибками в замкнутых помещениях. Перед проведением любых измерений необходимо разработать их методологию.
Методика, установленная в настоящем стандарте, основана на VDI 4252-2 [7] и VDI 4300-10 [6].
1 Область применения
В настоящем стандарте установлен метод обнаружения и подсчета плесневых грибков путем культивирования после отбора проб методом осаждения по ИСО 16000-18 или фильтрования по ИСО 16000-16. Метод также подходит для культивирования плесневых грибков из суспензий или прямым посевом.
Предупреждение - При применении настоящего стандарта может потребоваться использование опасных материалов, процедур и оборудования. В настоящем стандарте не рассмотрены требования безопасности, связанные с его применением. Обязанностью пользователя настоящего стандарта является установление подходящих методик и определение применимости инструкций по безопасности перед его использованием.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие международные стандарты:
ISO 8199, Water quality - General guidance on the enumeration of micro-organisms by culture (Качество воды. Общее руководство по подсчету числа микроорганизмов культивированием)
ISO 16000-16, Indoor air - Detection and enumeration of moulds - Sampling by filtration (Воздух замкнутых помещений. Часть 16. Обнаружение и подсчет плесневых грибков. Отбор проб фильтрованием)
ISO 16000-18, Indoor air - Detection and enumeration of moulds - Sampling by impaction (Воздух замкнутых помещений. Часть 18. Обнаружение и подсчет плесневых грибков. Отбор проб методом осаждения)
3 Термины и определения
_______________
Термины 3.3, 3.5, 3.7, 3.9 установлены для целей настоящего стандарта, т.е. для оценки качества воздуха замкнутых помещений.
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 нитевидный грибок (filamentous fungus): Грибок, растущий в форме нитевидных клеток, называемых гифами.
Примечания
1 Гифы, соединенные в пучки, называются мицелиями.
2 Термин "нитевидные грибки" необходим для различения грибков с гифальным ростом и дрожжевых грибков.
[ИСО 16000-16]
3.2 фильтрование (filtration): Улавливание частиц, взвешенных в потоке газа или жидкости, при пропускании через пористый материал.
[ЕН 13098] [6]
Примечание - В настоящем стандарте под фильтрованием следует понимать отделение микроорганизмов или плесневых грибков от воздуха определенного объема с помощью фильтров.
3.3 косвенный метод (indirect method): Повторное суспендирование микроорганизмов, осевших на фильтре, с последующим посевом аликвот на подходящую питательную среду, культивированием и подсчетом колоний, растущих в заданных условиях.
3.4 колониеобразующая единица; КОЕ (colony forming unit; cfu): Единица, с помощью которой выражают число микроорганизмов, способных к образованию культур.
[ЕН 13098] [4]
Примечания
1 Одна колониеобразующая единица может происходить от одного отдельного микроорганизма, агрегатов нескольких микроорганизмов, а также от одного или нескольких микроорганизмов, присоединившихся к частице.
2 Число колоний может зависеть от условий культивирования.
3.5 культивирование (cultivation): Выращивание микроорганизмов на питательной среде.
3.6 микроорганизм (microorganism): Любая микробиологическая форма, клеточная или неклеточная, способная к размножению или переносу генетического материала, или формы, утратившие эту способность.
[ЕН 13098] [4]
3.7 индикатор влажности (moisture indicator): Плесневый грибок в воздухе замкнутого помещения, растущий преимущественно при относительно высокой влажности, наличие которого является показателем повышенной влажности.
3.8 вторичная колония (secondary colony): Колония, развивающаяся не из "первичных" спор в пробе воздуха, а из спор, образованных колонией, выросшей на агаровой среде.
3.9 плесневые грибки (mould): Нитевидные грибки, принадлежащие нескольким таксономическим группам, а именно Зигомицеты, Аскомицеты (Аскомикота) и Дейтеромицеты (несовершенные грибы).
Примечание - Плесневые грибки образуют споры различного вида в зависимости от того, к какой таксономической группе они принадлежат, а именно конидиоспоры (конидии), спорангиоспоры и аскоспоры.
[ИСО 16000-16]
4 Общие положения
Чашки с агаром (Агар DG18, агар на основе солодового экстракта или картофельный агар с декстрозой), полученные при отборе проб методом осаждения, помещают в инкубатор для культивирования напрямую при (25±3)°С.
Фильтры, полученные при отборе проб методом фильтрования, повторно суспензируют в солевом растворе (с массовой долей 0,9%) с массовой долей полисорбата 80
0,01%. Десятикратно разбавляют суспензию и аликвоты наносят на агар DG18, а также на агар на основе солодового экстракта или картофельный агар с декстрозой (непрямой метод). Чашки Петри с агаром помещают в инкубатор для культивирования при температуре (25±3)°С. При проведении измерений с особой целью чашки Петри могут быть помещены в инкубатор при температуре (36±2)°С (например, в случае теплостойкого Aspergillus spp.) или (45±2)°С в случае Aspergillus fumigatus.
_______________
Полисорбат 80 эквивалентен полиоксиэтиленсорбит моноолеату или полиэтиленгликольсорбит моноолеату. Твин-эмульгатор является примером подходящей продукции, выпускаемой серийно. Информация приведена для удобства пользователей настоящего стандарта и не устанавливает рекламу ИСО данного продукта.
После культивирования колонии плесневых грибков идентифицируют и подсчитывают. Объем идентификации зависит от целей исследования.
5 Оборудование и материалы
Используют оборудование, имеющееся в лаборатории микробиологического анализа, в частности следующее.
5.1 Инкубатор, безвибрационный, термостатируемый при температуре (25±3)°С.
5.2 Инкубатор, безвибрационный, термостатируемый при температуре (36±2)°С.
5.3 Инкубатор, безвибрационный, термостатируемый при температуре (45±2)°С.
5.4 Холодильник, с контролем температуры/термостатируемый при температуре (5±3)°С.
5.5 рН-метр, с погрешностью ±0,1 единицы рН.
5.6 Бокс микробиологической безопасности, класс II, для защиты лаборанта и материала.
5.7 Водяная баня, обеспечивающая поддержание постоянной температуры от 35°С до 40°С, с мешалкой.
5.8 Лабораторная мешалка для пробирок, например встряхиватель типа "Vortex" (Вортекс).
_______________
Пример подходящей продукции, выпускаемой серийно. Информация приведена для удобства пользователей настоящего стандарта и не устанавливает рекламу ИСО данного продукта. Можно использовать эквивалентную продукцию, если доказано, что с ее помощью могут быть получены аналогичные результаты.
5.9 Чашки Петри, с вентиляционным отверстием, стерильные, диаметром ~90 мм.
5.10 Автоклав, обеспечивающий работу при (115±3)°С и (121±3)°С.
6 Питательная среда для культур и растворители
Используют реактивы известной аналитической чистоты или другой степени чистоты, если может быть доказано, что при их применении будут получены аналогичные результаты, и только дистиллированную или деоионизированную воду или воду эквивалентной чистоты.
Рекомендуется использовать серийно выпускаемые обезвоженные подложки при условии, что они соответствуют требованиям настоящего стандарта. Их приготовляют в соответствии с инструкциями изготовителя.
6.1 18%-ный дихлоран-глицериновый агар
Состав агара приведен в таблице 1.
Таблица 1 - Состав 18%-ного дихлоран-глицеринового агара (агар DG18)
Компонент | Количество |
Пептон | 5,0 г |
Глюкоза | 10,0 г |
Дигидрофосфат калия ( | 1,0 г |
Семиводный сульфат магния ( | 0,5 г |
Раствор дихлорана (2,6-дихлоро-4-нитроанилин) в этаноле с объемной долей 0,2% | 1,0 мл |
Хлорамфеникол | 0,1 г |
Глицерин | 220 г |
Агар | 15,0 г |
Вода | 1000 мл |
| |
_______________
Разные изготовители применяют различные пептоны (например, казеиновый или микологический). Обычно это не влияет на количественные результаты измерений, но может влиять на внешний вид колоний. Поэтому необходим положительный контроль для сравнения извлечения и морфологического вида колоний.
Добавляют вспомогательные ингредиенты и агар к ~800 мл воды и растворяют при кипячении. Доводят водой до 1000 мл и добавляют 220 г глицерина. Стерилизуют в автоклаве при (121±3)°С в течение (15±1) мин. После стерилизации рН должен составлять (5,6±0,2) при 25°С. Переносят аликвоты объемом приблизительно 20 мл в чашки Петри.
Чашки Петри с агаром DG18, упакованные в пакеты, можно хранить в темном месте при температуре (5±3)°С в течение недели.
Агар DG18 имеет определенную пониженную активность воды. Следят за тем, чтобы предотвратить большее снижение активности воды из-за испарения влаги, поскольку оно может препятствовать росту грибков на этом агаре.
Примечание - Агар DG18 подходит для обнаружения широкого спектра ксерофильных грибков (т.е. грибков, предпочитающих сухость). Глицерин понижает активность воды, , до 0,95. Хлорамфеникол подавляет деятельность бактерий, особенно грамм-отрицательных. Дихлоран подавляет распространение быстрорастущих колоний плесневых грибков, тем самым обеспечивая возможность для роста медленно растущих колоний.
6.2 Агар на солодовом экстракте
Состав агара приведен в таблице 2.
Таблица 2 - Состав агара на солодовом экстракте
Компонент | Количество |
Солодовый экстракт | 30,0 г |
Соевый пептон | 3,0 г |
Агар | 15,0 г |
Вода | 1000 мл |
Примечание - При необходимости может потребоваться добавление хлорамфеникола (0,05 г/л), если пробы содержат большое число бактерий. Обычно для воздуха замкнутых помещений это не наблюдается, но бактерии в большом количестве могут присутствовать в образцах материала и пыли.
Добавляют все компоненты и агар в воду и растворяют при кипячении. Стерилизуют в автоклаве при (115±3)°С в течение (10±1) мин. После стерилизации рН должен составлять (5,5±0,2) при 25°С. Переносят аликвоты объемом приблизительно 20 мл в чашки Петри.
Чашки Петри с агаром на солодовом экстракте, упакованные в пакеты, можно хранить в темном месте при температуре (5±3)°С в течение месяца.
Серийно выпускаются агары на солодовом экстракте различного состава. Убеждаются в том, что их состав соответствует вышеуказанному.
6.3 Картофельный агар с декстрозой
Состав агара приведен в таблице 3.
Таблица 3 - Состав картофельного агара с декстрозой
Компонент | Количество |
Картофельный экстракт | 4,0 г |
Глюкоза | 20,0 г |
Агар | 15,0 г |
Вода | 1000 мл |
Примечание - При необходимости может потребоваться добавление хлорамфеникола (0,05 г/л), если пробы содержат большое число бактерий.
Добавляют все компоненты и агар в воду и растворяют при кипячении. Стерилизуют в автоклаве при (115±3)°С в течение (10±1) мин. После стерилизации рН должен составлять (5,6±0,2) при 25°С. Переносят аликвоты объемом приблизительно 20 мл в чашки Петри.
Чашки Петри с картофельным агаром с декстрозой, упакованные в пакеты, можно хранить в темном месте при температуре (5±3)°С в течение месяца.
6.4 Солевой раствор
Состав солевого раствора приведен в таблице 4.
Таблица 4 - Состав солевого раствора
Компонент | Количество |
Хлорид натрия | 8,5 г |
Вода | 1000 мл |
Растворяют в воде и стерилизуют в автоклаве при (121±3)°С в течение (15±1) мин.
6.5 Солевой раствор с полисорбатом 80
Состав солевого раствора с полисорбатом 80 приведен в таблице 5.
Таблица 5 - Состав солевого раствора с полисорбатом 80
Компонент | Количество |
Хлорид натрия | 8,5 г |
Полисорбат 80 | 0,1 г |
Вода | 1000 мл |
Растворяют в воде и стерилизуют в автоклаве при (121±3)°С в течение (15±1) мин. Дают раствору остыть и добавляют полисорбат 80.
7 Методика
7.1 Основные положения
Пробы для анализа могут быть получены методом осаждения спор на чашки Петри с агаром по ИСО 16000-18 или на фильтры при отборе проб методом фильтрования по ИСО 16000-16. С пробами, полученными путем прямого посева или на основе суспензий спор грибков, можно обращаться соответствующим образом.
7.1.1 Пробы, полученные методом осаждения
Чашки Петри с агаром напрямую помещают в инкубатор для культивирования (см. 7.3).
7.1.2 Пробы, полученные методом фильтрования
Пробы с фильтров экстрагируют, аликвоты переносят в чашки Петри с агаром (см. 7.2), а затем помещают в инкубатор для культивирования (см. 7.3).
Пробы обрабатывают в лаборатории предпочтительно без задержек и не позднее чем через 48 ч после окончания отбора проб. Хранят пробы в лаборатории при температуре, не превышающей температуру культивирования (<25°С), в темном месте, защищенном от неблагоприятных воздействий (влажность, пересушивание, загрязнение). Регистрируют условия окружающей среды в месте хранения.
Все операции выполняют в условиях, исключающих возможность загрязнения проб. Проверяют асептические условия регулярно с помощью средств контроля, а результаты оформляют документально.
7.2 Обработка фильтров
7.2.1 Основные положения
Плесневые грибки, осажденные на фильтры из воздуха, анализируют методом непрямого посева.
Примечание - Агрегаты спор или агрегаты частиц могут быть переведены в раствор посредством суспендирования или растворения, в результате подсчет может показать наличие большего числа колоний после культивирования. В таких случаях из агрегата, состоящего из 30 спор, может вырасти 30 колоний. С другой стороны, может произойти уменьшение числа колоний, например из-за неполного извлечения спор плесневых грибков с фильтров или повреждения клеток грибков при обращении с ними в лаборатории.
7.2.2 Экстракция
В асептической атмосфере бокса микробиологической безопасности (см. 5.6) стерильным пинцетом переносят фильтры (желатиновый фильтр на поликарбонатном фильтре) в стерильные контейнеры, содержащие 5 мл соляного раствора с полисорбатом 80 (см. 6.5).
Интенсивно встряхивают (см. 5.8) фильтры в контейнерах, следя за тем, чтобы они оставались погруженными в раствор в горизонтальном положении, на водяной бане при температуре от 35°С до 40°С (см. 5.7) в течение 15 мин. Убеждаются в том, что загруженная спорами поверхность фильтра лежит ровно, обращена вверх и легко перемещается в суспензии при встряхивании.
Обрабатывают пробу в соответствии с 7.2.3 в течение 1 ч после суспендирования.
7.2.3 Растворение
На основе исходной суспензии приготовляют серию разбавленных.
Непосредственно перед разбавлением встряхивают суспензию в течение 1 мин с помощью шейкера для пробирок (см. 5.8). Добавляют 1 мл суспензии к 9 мл соляного раствора (см. 6.4) стерильной одноразовой пипеткой или стеклянной пипеткой с хлопковым фильтром. Аналогичным образом проводят дальнейшее разбавление до 1:10, 1:100 и 1:1000.
Число этапов разбавления и коэффициенты разбавления должны быть подобраны в соответствии с ожидаемым содержанием спор плесневых грибков и конкретной целью измерений. Могут потребоваться дополнительные этапы разбавления.
7.2.4 Посев
Делают параллельный посев 0,1 мл исходной суспензии и разбавленных суспензий (см. 7.2.3) на агар DG18 (см. 6.1), агар на солодовом экстракте (см. 6.2) или на картофельный агар с декстрозой (см. 6.3). Параллельно приготовляют по крайней мере две чашки Петри для каждого этапа разбавления и температуры в инкубаторе (см. 7.3).
Если в соответствии с протоколом отбора проб ожидается низкое содержание спор плесневых грибков, то может быть сделан посев 1 мл исходной суспензии в четыре чашки Петри с разной агаровой питательной средой (250 мкл суспензии на каждую чашку) для повышения чувствительности метода.
На всех этапах разбавления отбирают лабораторную холостую пробу.
7.3 Культивирование
Загруженные чашки Петри с агаром помещают в инкубаторы верхней стороной вверх на семь суток при температуре (25±3)°С. Для чашек Петри с агаром DG18 может потребоваться более длительное время инкубации - до 10 дней, особенно если ожидается наличие грибков разных видов.
С особой целью (например, в случае теплостойкого Aspergillus spp.) чашки Петри с агаром на солодовом экстракте или картофельном агаре с декстрозой могут быть дополнительно помещены в инкубатор при температуре (36±2)°С. Для селективного культивирования Aspergillus fumigatus необходима температура (45±2)°С.
Предупреждение - При температурах культивирования выше 25°С следят за тем, чтобы предотвратить пересушивание агара в чашках Петри.
Культивирование в чашках Петри с агаром осуществляют таким образом, чтобы в них попадало достаточное количество кислорода, обеспечивающее оптимальные условия роста колоний, например не помещают чашки Петри в плотные полиэтиленовые пакеты. Инкубатор для чашек Петри с агаром должен быть безвибрационным для сведения к минимуму вероятности вторичного внесения посевного материала из-за рассеяния спор. Также предотвращают воздействие интенсивных потоков воздуха на агаровую среду, чтобы не допустить ее пересушивание.
7.4 Анализ и подсчет
Осматривают чашки Петри с агаром первый раз через два-три дня после посева и затем через равные промежутки времени в течение по крайней мере семи дней.
Подсчитывают теплоустойчивые плесневые грибки (растущие при температуре от 36°С до 45°С) по истечении одного-трех дней, поскольку они растут очень быстро.
При обращении с чашками Петри с агаром может произойти рассеяние спор на питательной среде и рост вторичных колоний в процессе культивирования. Следят за тем, чтобы осуществлялся подсчет только первичных колоний.
При использовании стандартной чашки Петри диаметром 90 мм для идентификации и количественного определения оптимальное число колоний рода/вида составляет от 20 до 40. Для получения количественных результатов на чашке Петри должно вырасти по крайней мере 10 колоний соответствующего рода/вида и не более 100 колоний в целом. Некоторые плесневые грибки могут рассеиваться очень быстро, подавляя при этом рост других колоний (например, Rhizopus, Chrysonilia, Mucor, Botrytis), - даже на чашках Петри с дихлораном - и емкость питательной среды в чашке может уменьшиться, даже при низких отсчетах по колониям.
Записывают максимальное число колоний, подсчитанных за семь дней культивирования для каждой чашки Петри с агаром и для каждого объема пробы (при отборе проб методом осаждения) или коэффициента разбавления (при отборе проб методом фильтрования) соответственно.
7.5 Идентификация видов плесневых грибков
Идентификация плесневых грибков, растущих на питательной агаровой среде, необходима для разрешения большинства вопросов, касающихся проблем наличия грибков в воздухе замкнутых помещений. Идентификация основана на макроскопических и микроскопических морфологических характеристиках. Эти характеристики обычно лучше идентифицировать при культивировании на агаре на солодовом экстракте или на картофельном агаре с декстрозой по сравнению с агаром DG18.
Примечание - Было показано, что при использовании агара на солодовом экстракте и картофельного агара с декстрозой получают сопоставимые результаты для идентификации родов и видов плесневых грибков.
Степень идентификации зависит от целей исследования.
Для обнаружения источников роста плесневых грибков в замкнутом помещении важно выявить разницу видового/родового состава грибков в воздухе замкнутого помещения и атмосферном воздухе, а также индикаторы влажности, например Aspergillus versicolor или Chaetomium spp.
Для этой цели не рекомендуется проводить идентификацию на уровне вида в пределах некоторых родов (например, Phialophora, Trichoderma, Acremonium, Chaetomium, Penicillium и Fusarium), поскольку это очень трудоемко и практически неосуществимо в рамках рутинного анализа.
Однако подробная идентификация видов грибков может быть необходима для исследования проблем здоровья населения. В этом случае идентификацию видов проводят даже для родов, указанных в предыдущем абзаце.
Для идентификации большинства видов из колоний, выращенных на изолированной питательной среде, берут чистые культуры и переносят на специальную питательную среду для идентификации.
Идентификацию видов плесневых грибков проводят в лабораториях, имеющих разрешение на микологическую экспертизу и опыт по идентификации микрогрибков, или проверяют результаты для обеспечения их достоверности. Аккредитация лаборатории на проведение микологической экспертизы и опыт по идентификации плесневых грибков в замкнутом помещении должны быть проверены при проверке квалификации персонала таких лабораторий.
Рекомендуемые литературные источники, которые можно использовать при идентификации плесневых грибков в замкнутых помещениях приведены в [7]-[15]. Идентификация на уровне родов и видов основана на характеристиках фенотипа, например спорулирующих структурах, цвете колонии и поведении при росте. Морфологические характеристики должны быть дополнены биохимическими и молекулярными характеристиками для идентификации видов, принадлежащих к некоторым родам.
7.6 Вычисление и представление результатов измерений
7.6.1 Основные положения
Вычисление содержания плесневых грибков в воздухе замкнутых помещений главным образом основано на подсчете колоний, выросших в чашках Петри с агаром DG18. При использовании агара на солодовом экстракте или картофельного агара с декстрозой подсчитывают только те виды плесневых грибков, которые не могут быть выращены из спор на агаре DG18 (например, Chaetomium, Stachybotrys). Результаты, полученные для агара DG18, агара на солодовом экстракте, или картофельном агаре с декстрозой, не объединяют, а вычисление проводят на основе отсчетов колоний на агаре, где наблюдается наиболее интенсивный рост грибков, принадлежащих к соответствующим видам/родам.
Вычисляют содержание грибков каждого идентифицированного вида или рода. Грибки, вид которых не идентифицирован, относят к группе "грибки других видов". Однако необходимо стремиться к идентификации большинства видов грибков, по крайней мере, на уровне рода (см. 7.5). Стерильные мицелии подсчитывают отдельно. Общее содержание грибков вычисляют как сумму содержаний всех видов/родов грибков, включая не идентифицированные и стерильные колонии.
Результаты подсчета округляют до двух значащих цифр.
Примечание - Дрожжевые грибки нельзя количественно определить данным методом. Колонии дрожжевых грибков, появляющиеся на питательной среде, тем не менее, могут быть включены в протокол измерений в качестве отдельного пункта.
7.6.2 Отбор проб методом осаждения
Обычно для каждой отдельной пробы и питательной среды подготавливают по крайней мере четыре чашки Петри (две пробы воздуха разного объема, анализируемые параллельно).
Содержание плесневых грибков в воздухе замкнутого помещения, характеризуемое числом колоний, образуемых из кубического метра воздуха , м
, вычисляют по формуле
![]() , (1)
, (1)
где - общее число колониеобразующих единиц на чашках Петри;
- общий объем отбираемого воздуха, м.
Пример - Для подсчета колоний на одной питательной среде были отобраны и проанализированы параллельно две пробы разного объема: 100 и 200 л. Были получены следующие отсчеты по колониям:
Объем пробы, л (м | Число колоний |
15 | |
100 (0,1) | |
23 | |
29 | |
200 (0,2) | |
35 |
Отсюда:
=15+23+29+35=102,
=0,1+0,1+0,2+0,2=0,6
и
![]() .
.
Примечание - При большом числе колоний изготовители импакторов рекомендуют использовать поправочный коэффициент на перекрытие. Он представляет собой статистическую величину, с помощью которой можно вычислить вероятный отсчет на основе общего исходного отсчета принимая во внимание, что на одном и том же месте может осесть несколько частиц. По этой причине сумма вычисленных отсчетов может оказаться меньше общего отсчета с учетом поправочного коэффициента на перекрытие. Если исходные отсчеты достигают 80% значения с поправкой на перекрытие, то скорректированные отсчеты следует рассматривать как оценку. Скорректированный отсчет по колониям, , для распылительного импактора с
каналами, может быть вычислен по формуле
![]() для
для ![]() ,
,
где - число колониеобразующих единиц или заполненных пластин импактора;
-
![]() .
.
Статистическая корректировка результатов с использованием положительного поправочного коэффициента на перекрытие обычно не нужна при применении настоящего стандарта, поскольку:
1) поправочный коэффициент не действителен в диапазоне числа колоний грибков, наилучшим образом подходящем для их идентификации и вычисления результатов измерений (от 20 до 40 колоний, максимум 100 колоний); 2) общее число колоний вычисляют суммированием числа колоний грибков идентифицированного рода/вида, обычно составляющего значительно меньше 100 колоний и 3) в большинстве случаев емкость питательной среды в чашке Петри уменьшается при небольшом числе колоний грибков из-за их размера.
7.6.3 Отбор проб методом фильтрования
Количественное определение колоний плесневых грибков часто затруднено из-за преобладающего роста грибков конкретных видов. Поэтому, если применяется десятикратное разбавление исходной суспензии спор грибков, то обычно подсчитывают колонии только на чашках Петри с агаром, полученных на основе однократно разбавленной суспензии. Для вычисления результата выбирают чашки Петри с агаром, в которых наблюдается наименьшее искажения между колониями, но содержащие колонии в числе, достаточном для их надежного количественного определения (см. 7.4). Если для количественного определения можно использовать несколько чашек Петри, то вычисляют среднее взвешенное значение (см. ИСО 8199).
Содержание плесневых грибков в исходной суспензии , мл
, вычисляют по формуле
![]() , (2)
, (2)
где - общее число колоний на чашках Петри, полученное при соответствующем разбавлении исходной суспензии;
- общий объем исходной суспензии, мл, потребовавшейся для приготовления разбавленной тестовой суспензии для переноса в чашки Петри, вычисленный по формуле
![]() , (3)
, (3)
где - число чашек Петри, на которых ведут подсчет колоний при соответствующем разбавлении исходной суспензии;
- объем тестовой суспензии, переносимой в чашки Петри с агаром, мл;
- коэффициент разбавления исходной суспензии (
1 для исходной суспензии;
0,1 при разбавлении 1:10 и т.д.).
Пример 1 - Для подсчета колоний на одной питательной среде при каждом соответствующем разбавлении использовали две чашки Петри с агаром, на который наносили 0,1 мл тестовой суспензии. Были получены следующие отсчеты по колониям:
Коэффициент разбавления | Число колоний |
26 | |
10 | |
33 |
Затем вычисляют
![]() ,
,
![]()
и
![]() .
.
Содержание плесневых грибков в пробе воздуха, м
, вычисляют по формуле
![]() , (4)
, (4)
где - содержание плесневых грибков в исходной суспензии, мл
;
- объем соляного раствора, израсходованного при повторном суспендировании частиц с фильтра, мл;
- объем пробы воздуха, м
.
Пример 2 - Объем пробы воздуха составил 0,8 м. Частицы с фильтра были суспендированы 5 мл соляного раствора.
Таким образом:
![]()
Результат: содержание колониеобразующих единиц составило
1,8х10 м
.
7.6.4 Холостые пробы для условий применения
Содержание плесневых грибков в холостых пробах определяют в целях контроля качества результатов. Обычно в холостых пробах не находят колонии. Наличие более двух колоний в чашке Петри с холостой пробой, полученной методом осаждения или нанесением неразбавленной суспензии (приготовленной на основе чистого фильтра), указывает на погрешности отбора проб и необходимость внимательной интерпретации результатов измерений. В результаты измерений не вводят поправки по данным анализа холостых проб для условий применения.
8 Протокол измерений
Протокол измерений должен содержать по крайней мере следующую информацию:
a) ссылку на настоящий стандарт;
b) ссылку на стандарт по отбору проб: ИСО 16000-16 - по отбору проб методом фильтрования или ИСО 16000-18 - по отбору проб методом осаждения;
c) подробную информацию, необходимую для полной идентификации пробы;
d) время анализа;
e) продолжительность периода между окончанием отбора проб и началом анализа;
f) продолжительность культивирования;
g) объем и число анализируемых проб, по возможности;
h) результаты, приведенные в соответствии с 7.6, в том числе с указанием соответствующей питательной среды для культивирования и температуры инкубации;
i) по возможности данные о погрешности и/или точности измерений;
j) любую дополнительную информацию, относящуюся к методу.
Приложение А
(справочное)
Характерные свойства спор плесневых грибков
В природе плесневые грибки встречаются повсеместно и выполняют важную функцию при разложении и минерализации органических веществ в круговороте питательных веществ в природе. Грибки некоторых видов вызывают заболевания у человека и животных.
Особенно хорошо плесневые грибки приспособлены к переносу по воздуху. Они образуют споры, выполняющие не только функцию переноса по воздуху, но и долговременного сохранения в стадии покоя. В различных таксонах выделяют различные морфологические виды спор (конидии, аскоспоры, хламидоспоры), каждая из которых предназначена для выполнения одной из вышеуказанных биологических функций. Диаметр спор различен в зависимости от вида, но для большинства спор плесневых грибков, находящихся в воздухе, он составляет от 2 до 10 мкм. В некоторых случаях диаметр спор достигает 30 мкм или более (геометрический диаметр). Фрагменты гифов могут иметь толщину до 10 мкм, но могут быть и значительно длиннее 30 мкм. Статистическая вероятность того, что отдельная гифальная клетка представляет колониеобразующую единицу, пренебрежима мала.
В воздухе грибки могут распространяться как индивидуальные споры или конидии, так и агрегаты спор или фрагменты гифов; они могут находиться в свободном состоянии, прикрепленными к частицам пыли или удерживаться в каплях жидкости.
Споры плесневых грибков имеют толстые хитиновые клеточные стенки, что делает их очень устойчивыми к высыханию. В мембранах клеток многих плесневых грибков накапливается меланин, защищающий споры от повреждения под действием ультрафиолетового излучения. Благодаря этим свойствам плесневые грибки с одной стороны могут длительно сохранять жизнеспособность в условиях повышенной сухости, а с другой - могут быть перенесены на большие расстояния по воздуху (межконтинентальное распространение спор).
Конидии (споры) плесневых грибков некоторых родов, например PeniciIlium и Aspergillus, гидрофобны и их нелегко суспендировать в водной среде. Это необходимо учитывать при работе в лаборатории. Водные суспензии конидий всегда приготовляют с добавлением поверхностно-активных веществ.
Таблица А.1 - Содержание грибков некоторых видов в атмосферном воздухе, воздухе рабочей зоны предприятий по ликвидации отходов и сельскохозяйственных предприятий
Типичные виды грибков | Содержание | |||||
Вид | Размер частиц, спор или конидий, мкм | Значения | В воздухе замкнутых помещений, КОЕ·м | В воздухе рабочей зоны предприятий по ликвидации отходов, КОЕ·м | В атмосферном воздухе | |
КОЕ·м | % | |||||
В атмосферном воздухе | ||||||
Alternaria alternate | 18-23 | 0,85-0,88 | 10 | Нет риска | 10 | - |
7-18 | [17] | 10 | ||||
[17] | ||||||
Aureobasidium pullulans | 7,5-16 | - | <5 [19] | Нет риска | <5 [21] | - |
3,5-7 | ||||||
[17] | ||||||
Botrytis cinerea | 8-14 | 0,93-0,95 | <5 [20] | Нет риска | <10 [20] | - |
6-9 | [17] | |||||
[17] | ||||||
Cladosporium spp. | 3-11 | - | 10 | - | 10 | До 90 [18] |
С. herbarum | 5,5-13 | 0,85-0,88 | 10 | 10 | 10 | До 60 |
4-6 | [16] | |||||
[16] | ||||||
С. cladosporioides | 3-7 (11) | 0,86-0,88 | 10 | 10 | 10 | До 30 |
2-4 (5) | [16] | |||||
[16] | ||||||
Epicoccum nigrum | 16-25 [16] | 0,86-0,90 | 10 | Нет риска | 10 | - |
[16] | ||||||
В воздухе рабочей зоны предприятий по ликвидации отходов и сельскохозяйственных предприятий | ||||||
Absidia corymbifera | 3,4-4,6 | - | Нет риска | - | Нет риска | - |
2,8-3,8 [10] | ||||||
Aspergillus spp. | 2,5-5 | 0,71-0,95 | 10 | - | <10 | <3 |
[16] | [20] | [18] | ||||
A. candidus | 2,5-4 | 0,75-0,78 | <5 | 10 | - | + |
[16] | [16] | |||||
A. flavus | 3,6 | 0,78-0,80 | <5 | 10 | - | - |
[16] | [16] | |||||
A. fumigatus | 2,5-3 | 0,85-0,94 | Обнаруживаются редко | 10 | До 20 | - |
[16] | [16] | |||||
A. nidulans | 3-3,5 | 0,85 [17] | <5 | 10 | - | - |
[16] | ||||||
A. niger | 3,5-5 | 0,92-0,95 | Обнаруживаются редко | 10 | - | - |
[16] | [17] | |||||
A. parasiticus | 3,5-5,5 | 0,78-0,82 | - | 10 | - | - |
[16] | [16] | |||||
A. versicolor | 2-3,5 | 0,78 [16] | <5 [21] | 10 | <5 [21] | - |
[16] | ||||||
Eurotium herbariorum | 4,5-7 (8) | - | <5 [21] | Нет риска | <10 | - |
[16] | [21] | |||||
F. graminearum | 41-60 (80) | 0,89 [16] | Преимущественно нелетучие | Нет риска | - | - |
(4-5,5) | ||||||
[16] | ||||||
Mucor hiemalis | 3,5-5,2 | - | - | Нет риска | - | - |
2,5-3,7 | ||||||
[10] | ||||||
M. racemosus | 5,5-8,5 (10) | 0,94 [16] | - | Нет риска | - | - |
4-7 | ||||||
[10] | ||||||
Paecilomyces variotii | 3-5 | 0,79-0,84 | - | 10 | - | - |
2-4 | [16] | |||||
[16] | ||||||
Penicillium spp. | - | 0,78-0,98 | 10 | - | 10 | От 2,5 до 13 [18] |
P. brevicompactum | 3-4,5 | 0,78-0,82 [16] | 10 | 10 | <10 [20] | + |
P. chrysogenum | 3-4 | 0,78-0,81 | До 10 | 10 | До 10 | + |
2,8-3,8 | [16] | [21] | ||||
[16] | ||||||
В воздухе рабочей зоны предприятий по ликвидации отходов и сельскохозяйственных предприятий | ||||||
P. corylophilum | 2,5-3,2 | - | - | Нет риска | - | + |
2,5-3,0 | ||||||
P. crustosum | 3-4 | - | - | 10 | - | - |
[16] | ||||||
P. expansum | 3-3,5 | 0,82-0,85 | - | 10 | - | - |
2,5-3 | [16] | |||||
[16] | ||||||
P. glabrum | 3-3,5 | - | <10 [20] | 10 | <5 [20] | - |
[16] | ||||||
P. lanosum | 2,5-3,0 | - | Обнаруживаются редко | Нет риска | - | + |
P. roqueforti | 4-6(8) | 0,83 [16] | - | 10 | - | - |
[16] | ||||||
Rhizopus oligosporus | (4)9-10(15) | - | - | 10 | - | - |
(4)7-10(11) | ||||||
[10] | ||||||
Sporobolomyces spp. | 2-12 | - | - | - | До 10 | - |
3-35 | [18] | |||||
Stachybotrys chartarum | 7-12 | 0 94 [16] | - | - | - | - |
4-6 | ||||||
[10] | ||||||
Trichoderma harzianum | 2,8-3,2 | - | Обнаруживаются редко | - | - | - |
2,5-2,8 | ||||||
[16] | ||||||
T. citrinoviride | 2,2-3,7 | - | - | 10 | - | - |
1,5-2,1 | ||||||
Обозначения: (+) - грибки данного вида обычно присутствуют, хотя и в небольшом количестве. Нет риска - обнаруживается очень небольшое число грибков данного вида, поэтому они не представляют интереса для гигиены. (-) - литературные данные отсутствуют. Примечания 1 Количественные данные без ссылки на литературный источник - это неопубликованные данные, полученные с использованием агара DG18 и метода осаждения в Институте гигиены и охраны окружающей среды в больнице при университете города Аахена, Германия. 2 В качестве примера приведено очень небольшое число результатов. Содержание может значительно изменяться в зависимости, например, от местоположения здания и времени года.
| ||||||
Приложение В
(справочное)
Обмен пробами для валидации метода культивирования
Для проверки применяемости метода культивирования, установленного в настоящем стандарте, было проведено три испытания: i) испытание 1 с использованием пробы пыли, ii) испытание 2 с использованием загрязненного материала и iii) испытание 3 с использованием чашек Петри, полученных методом осаждения. Все пробы для испытаний были подготовлены одной референтной лабораторией и отосланы с курьером в лаборатории, участвующие в испытании. В испытании участвовали семь референтных лабораторий, персонал которых был подробно ознакомлен с методом культивирования. Персонал других 25-30 лабораторий, участвующих в испытании, был в большей или меньшей степени ознакомлен с методом культивирования.
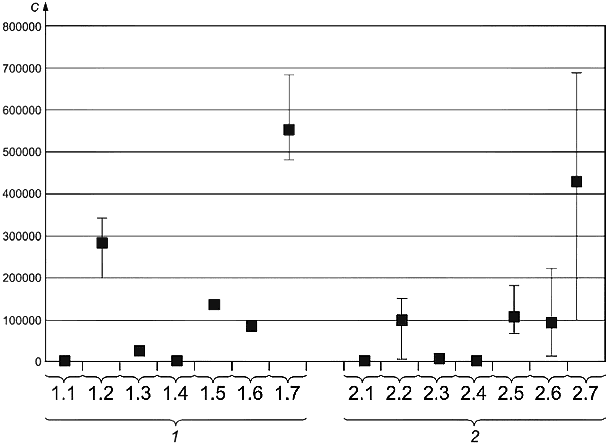
При испытании 1 проба пыли была разделена на фракции, и ее порции с размером частиц 100 мкм были отправлены в лаборатории, участвующие в испытании. Культивирование осуществляли на агаре DG18 и агаре на солодовом экстракте в соответствии с настоящим стандартом. Результаты приведены на рисунке В.1.
Результаты, полученные в семи референтных лабораториях, хорошо согласуются. Однако для других лабораторий стандартное отклонение результатов анализа было значительно больше. Разнообразие видов в пробе пыли было очень высоким, что не позволило провести подробный статистический анализ результатов измерений. Таким образом, результаты измерений приведены только для видов грибков.
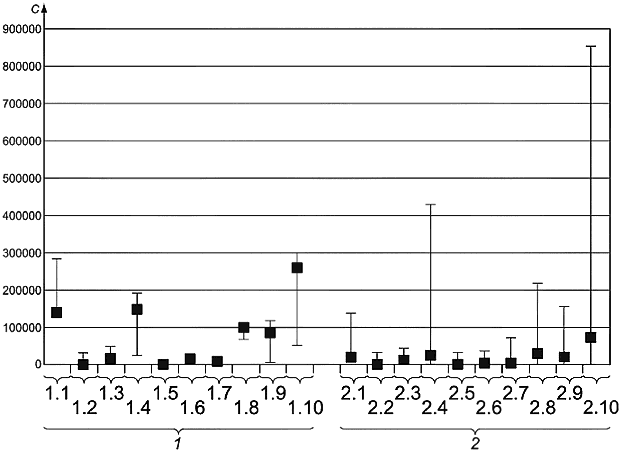
Испытание 2 проводили путем культивирования грибков шести различных видов на образце материала (древесина) для уменьшения разнообразия видов в пробе. Использовали грибки следующих видов: Aspergillus restricts, Aspergillus sydowii, Aspergillus versicolor, Penicillium brevicompactum, Penicillium expansum и Acremonium strictum. Образец древесины был гомогенизирован и разослан на анализ в лаборатории, участвующие в испытании. Культивирование осуществляли на агаре DG18 и агаре на солодовом экстракте в соответствии с настоящим стандартом. Результаты измерений приведены на рисунке В.2.
Результаты, полученные в семи референтных лабораториях, также хорошо согласовывались. Стандартное отклонение результатов, полученных другими лабораториями, участвовавшими в испытании, снова было значительно выше. В большинстве лабораторий были проблемы с определением вида главным образом Aspergillus restrictus и Acremonium strictum.
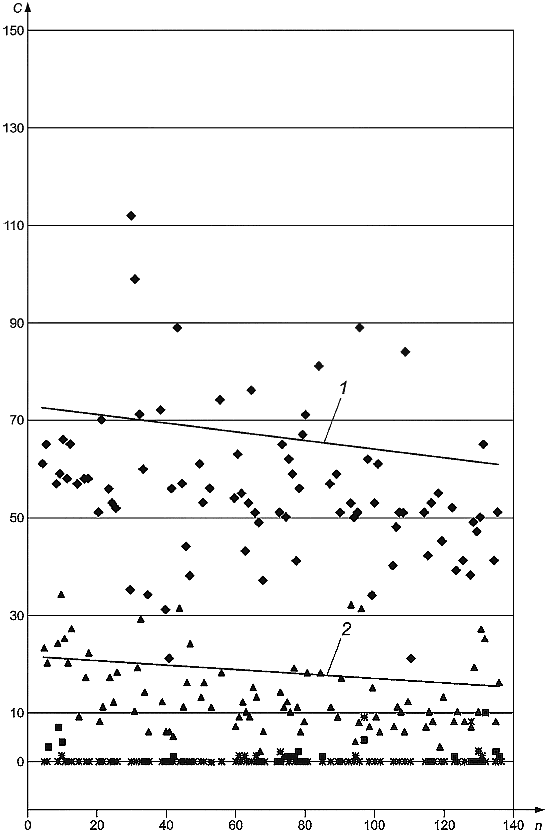
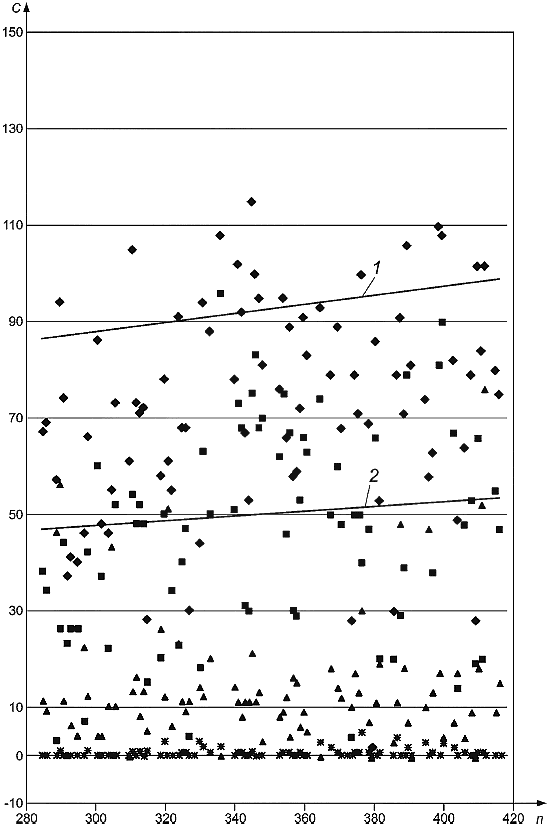
В испытании 3 использовали пробы, отобранные методом осаждения на чашки Петри с агаром из воздуха замкнутого помещения и соответствующего атмосферного воздуха. Все пробы воздуха объемом 100 л были отобраны одной реферетной* лабораторией в течение одного дня с использованием пяти импакторов одновременно. Сначала были отобраны пробы атмосферного воздуха (чашки Петри с номерами от 1 до 140 включительно), а затем воздуха замкнутого помещения (чашки Петри с номерами от 280 до 420 включительно). В замкнутом помещении находился источник выделения Aspergillus versicolor. По две чашки Петри с агаром DG18 и по две чашки Петри с агаром на солодовом экстракте, полученные для воздуха замкнутого помещения и атмосферного воздуха, были отправлены в каждую лабораторию, участвующую в испытаниях, для культивирования и обнаружения грибков. Каждая лаборатория получила набор чашек Петри, полученных в начале отбора проб, и одну чашку Петри, полученную в конце отбора проб. Результаты приведены на рисунках В.3а) и В.3b).
________________
* Текст документа соответствует оригиналу. - .
|
- число колониеобразующих единиц в кубическом метре; 1 - референтные лаборатории (1.1 - Alternaria spp., 1.2 - Cladosporium spp., 1.3 - Aspergillus spp., 1.4 - Eurotium spp., 1.5 - Penicillium spp., 1.6 - другие виды, 1.7 - общее число колоний); 2 - другие лаборатории (2.1 - Alternaria spp., 2.2 - Cladosporium spp., 2.3 - Aspergillus spp., 2.4 - Eurotium spp., 2.5 - Penicillium spp., 2.6 - другие виды, 2.7 - общее число колоний)
Примечание - Отдельно приведены результаты, полученные в семи референтных лабораториях и других лабораториях, участвующих в исследовании. Медиана и 25%-ная и 75%-ная процентиль приведены для каждого рода и общего числа колоний/
Рисунок В.1 - Результаты подсчета колоний в пробе пыли
|
- число колониеобразующих единиц в кубическом метре; 1 - референтные лаборатории (1.1 - Aspergillus restrictus, 1.2 - Aspergillus sydowii, 1.3 - Aspergillus versicolor, 1.4 - общее число Aspergillus spp., Eurotium spp., 1.5 - Penicillium brevicompactum, 1.6 - Penicillium expansum, 1.7 - общее число Penicillium spp., 1.8 -Acremonium spp., 1.9 - другие виды, 1.10 - общее число колоний), 2 - другие лаборатории (2.1 - Aspergillus restrictus, 2.2 - Aspergillus sydowii, 2.3 - Aspergillus versicolor, 2.4 - общее число Aspergillus spp., 2.5 - Penicillium brevicompactum, 2.6 - Penicillium expansum, 2.7 - общее число Penicillium spp., 2.8 - Acremonium spp., 2.9 - другие виды, 2.10 - общее число колоний)
Примечание - Отдельно приведены результаты, полученные в семи референтных лабораториях и других лабораториях, участвующих в исследовании. Медиана и 5%-ная и 95%-ная процентиль приведены для каждого вида, рода и общего числа колоний.
Рисунок В.2 - Результаты подсчета колоний на образце материала
|
1 - ![]() ,
, 0,0021; 2 -
![]() ,
, 0,0029;
- число колониеобразующих единиц в кубическом метре;
- число чашек Петри с агаром;
- общее число колоний;
- Aspergillus spp.;
- Eurotium spp.;
- Penicillium spp
Примечание - С графика были удалены четыре предельных значения (от 200 до 600). Линиями показан ход времени.
а)
Рисунок В.3, лист 1 - Результаты подсчета колоний на чашках Петри с агаром, полученных при отборе проб методом осаждения в воздухе замкнутого помещения
|
1 - ![]() ,
, 0,0008; 2 -
![]() ,
, 0,001;
- число колониеобразующих единиц в кубическом метре;
- число чашек Петри с агаром;
- общее число колоний;
- Aspergillus spp.;
- Eurotium spp.;
- Penicillium spp
Примечание - С графика были удалены шесть предельных значений (от 200 до 1000). Линиями показан ход времени.
b)
Рисунок В.3, лист 2
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 8199 | - | * |
ISO 16000-16 | IDT | ГОСТ Р ИСО 16000-16-2012 "Воздух замкнутых помещений. Часть 16. Обнаружение и подсчет числа плесневых грибков. Отбор проб фильтрованием" |
ISO 16000-18 | IDT | ГОСТ Р ИСО 16000-18-2013 "Воздух замкнутых помещений. Часть 18. Обнаружение и подсчет плесневых грибков. Отбор проб осаждением" |
* Соответствующий национальный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта.
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
Библиография
[1] | ISO 12219-1 | Indoor air - Road vehicles - Part 1: Whole vehicle test chamber - Specification and method for the determination of volatile organic compounds in car interiors |
(ИСО 12219-1) | (Воздух замкнутых помещений. Дорожные транспортные средства. Часть 1. Испытательная камера, вмещающая все транспортное средство. Технические характеристики и метод определения летучих органических соединений в воздухе кабин автомобилей) | |
[2] | ISO 16017-1 | Indoor, ambient and workplace air - Sampling and analysis of volatile organic compounds by sorbent tube/thermal desorption/capillary gas chromatography - Part 1: Pumped sampling |
(ИСО 16017-1) | (Воздух атмосферный, рабочей зоны и замкнутых помещений. Отбор проб летучих органических соединений при помощи сорбционной трубки с последующей термодесорбцией и газохроматографическим анализом на капиллярных колонках. Часть 1. Отбор проб методом прокачки) | |
[3] | ISO 16017-2 | Indoor, ambient and workplace air - Sampling and analysis of volatile organic compounds by sorbent tube/thermal desorption/capillary gas chromatography - Part 2: Diffusive sampling |
(ИСО 16017-1*) | (Отбор проб летучих органических соединений при помощи сорбционной трубки с последующей термодесорбцией и газохроматографическим анализом на капиллярных колонках. Часть 2. Диффузионный метод отбора проб) | |
________________ * Нумерация соответствует оригиналу. - . | ||
[4] | EN 13098 | Workplace atmospheres - Guidelines for measurement of airborne micro-organisms and endotoxins |
(EH 13098) | (Воздух рабочей зоны. Руководство по определению содержания взвешенных в воздухе микроорганизмов и эндотоксинов) | |
[5] | VDI 4252-2 | Measurement of airborne microorganisms and viruses in ambient air - Active sampling of bioaerosols - Separation of airborne mould on gelatine/polycarbonate filters |
(VDI 4252-2) | (Определение содержания взвешенных в атмосферном воздухе микроорганизмов и вирусов. Активный отбор проб биоаэрозолей. Осаждение взвешенных в воздухе плесневых грибков на желатиновые/поликарбонатные фильтры) | |
[6] | VDI 4300-10 | Measurement of indoor air pollution - Measurement strategies for determination of mould fungi in indoor environment |
(VDI 4300-10) | (Количественная оценка загрязненности воздуха замкнутых помещений. Планирование измерений при определении содержания плесневых грибков в воздухе замкнутого помещения) | |
[7] | Samson R.A., Hoekstra E.S., Frisvand J.C., editors. Introduction to food- and airborne fungi, 7th edition. Centraal-bureau voor Schimmelcultures, Utrecht, 2004, p.389 | |
[8] | De Hoog G.S., Guarro J., | |
[9] | Flannigan В., Samson R.A., Miller J.D., editors. Microorganisms in home and indoor work environments (diversity, health impacts, investigation and control). Taylor and Francis, 2001, p.490 | |
[10] | Domsch K.H., Gams W., Anderson Т.Н., editors. Compendium of soil fungi, Vols 1 and 2. Academic Press, London, 1980 | |
[11] | Klich M.A. (ed.) Identification of common Aspergillus species. Centraalbureau voor Schimmelcultures, Utrecht, 2002, p.116 | |
[12] | Pitt J.I., editor. The genus Penicillium and its teleomorphic states, Eupenicillium and Talaromyces. Academic Press, London, 1979, p.634 | |
[13] | Nelson P.E., Toussoun Т.А., Marasas W.F.O., editors. Fusarium species: An illustrated manual for identification. Pennsylvania State University Press, University Park, 1983, p.193 | |
[14] | Samson R.A., Frisvad J.C., editors. Penicillium subgenus Penicillium: New taxonomic schemes, mycotoxins and other extrolites. Centraalbureau voor Schimmelcultures, Utrecht, 2004, p.260 (Studies in mycology, Vol. 49) | |
[15] | Samson R.A., Pitt J.I., editors. Integration of modern taxonomic methods for Penicillium and Aspergillus classification. Harwood, Amsterdam, 2000, p.510 | |
[16] | Samson R.A., Hoekstra E.S., Frisvad J.C., Filtrenborg O. Introduction to food- and airborne fungi, 6th edition, (2000), Centraalbureau voor Schimmelcultures, Utrecht, 2000, p.389 | |
[17] |
| |
[18] | Lacey J. Spore dispersal: Its role in ecology and disease: the British contribution to fungal aerobiology. Mycol. Res. 1996, 100, pp.641-660 | |
[19] | Fischer G. Comparison of microbiological and chemical methods for assessing the exposure to airborne fungi in composting plants - Shaker, Aachen, 2000, p.245 (Akademische Edition Umweltforschung, Vol. 10) | |
[20] | Verhoeff A.P., van Wijnen J.C., Brunekreef, В., Fischer P, van Reenen-Hoekstra, E.S., Samson, R.A. Presence of viable mould propagules in indoor air in relation to house damp and outdoor air. Allergy 1992, 47, pp.83-91 | |
[21] | Fradkin A., Tarlo S.M., Tobin R.S., Tucic-Poretta M., Malloch D. Species identification of airborne molds and its significance for the detection of indoor pollution. J. Air Pollut. Control Aso с.1987, 37, pp.51-53 | |
УДК 504.3:006.35 | ОКС 13.040.20 |
Ключевые слова: воздух, помещения замкнутые, отбор проб, плесневые грибки, обнаружение, подсчет, метод культивирования, фильтрование, осаждение | |
Электронный текст документа
и сверен по:
, 2019