ФЕДЕРАЛЬНОЕ АГЕНТСТВО
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ ГОСТ Р
стандарт 70413-
РОССИИСКОИ < v-r IV
ФЕДЕРАЦИИ
2022/
ISO/TS 20914:2019
ЛАБОРАТОРИИ МЕДИЦИНСКИЕ
Практическое руководство по оценке неопределенности измерений
(ISO/TS 20914:2019, IDT)
Издание официальное
Москва Российский институт стандартизации 2022
ГОСТ Р 70413—2022
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией специалистов и организаций лабораторной службы «Федерация лабораторной медицины» (Ассоциация «ФЛМ») и Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт метрологии им. Д.И. Менделеева» (ФГУП «ВНИИМ им. Д.И. Менделеева») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 «Клинические лабораторные исследования и диагностические тест-системы ин витро»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 21 октября 2022 г. № 1175-ст
4 Настоящий стандарт идентичен международному документу ISO/TS 20914:2019 «Медицинские лаборатории. Практическое руководство по оцениванию неопределенности измерения» (ISO/TS 20914:2019 «Medical laboratories — Practical guidance for the estimation of measurement uncertainty», IDT).
Международный документ разработан Техническим комитетом ISO/TC 212 «Клинические лабораторные исследования и диагностические тест-системами ин витро».
Дополнительные сноски в тексте стандарта, выделенные курсивом, приведены для пояснения текста оригинала
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
© ISO, 2019
© Оформление. ФГБУ «РОТ», 2022
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
ГОСТ Р 70413—2022
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения................................................................1
4 Обозначения........................................................................10
5 Неопределенность измерения для медицинских лабораторий...............................11
6 Шаги по оцениванию неопределенности значений измеряемых величин.......................17
Приложение А (справочное) Примеры оценивания неопределенности измерения................25
Приложение В (справочное) Пример применения неопределенности измерения к интерпретации результата................................................52
Приложение С (справочное) Дополнительная информация по некоторым аспектам неопределенности........................................................54
Библиография........................................................................63
III
ГОСТ Р 70413—2022
Введение
В условиях глобальной экономики пациенты и специалисты в сфере здравоохранения часто пользуются разными системами здравоохранения, поэтому обществу необходимо повсеместное совершенствование стандартов и гармонизация практик медицинских лабораторий. Для достижения цели совершенствования стандартизации среди медицинских лабораторий в ИСО 15189 сфокусировано внимание на применении подхода систем качества в медицинской лаборатории. С момента публикации в 2003 г. первой версии ИСО 15189 данный стандарт все чаще применяют во всем мире в качестве добровольного (а в некоторых случаях в качестве обязательного) стандарта системы качества для медицинских лабораторий.
Для обеспечения пригодности и надежности результатов измерений в медицинской практике, а также для обоснованного сопоставления с порогами принятия медицинских решений и предыдущими результатами, аналогичными результатам исследований у одного и того же пациента, медицинским лабораториям необходимо проведение оценки общей изменчивости значений, полученных с помощью методик измерений. Для этого ИСО 15189:2012, 5.5.1.4 требует, чтобы «... (медицинские лаборатории) ... определяли неопределенность измерения для каждой методики измерения в аналитической фазе, использованной для отчета о значениях измеренной величины в пробах пациента». Кроме того, указано, что «по запросу пользователя лаборатория может представлять оценки неопределенности измерения».
Для медицинских лабораторий и медицинских учреждений оценки неопределенности измерения (MU):
- указывают, что для данного измерения возможно наличие нескольких значений;
- предоставляют доказательства того, что термин «истинное значение» величины является теоретическим понятием;
- количественно оценивают качество результата в отношении его пригодности для использования при принятии медицинских заключений;
- считают, что смещение, значимое с медицинской точки зрения, устранено;
- определяют технические шаги по снижению MU;
- допускают суммирование различных источников неопределенности;
- могут быть использованы для определения возможности достижения требований к аналитическим характеристикам, допустимых с клинической точки зрения;
- способствуют интерпретации результатов анализов пациентов, близких к пределам медицинских заключений.
Для обеспечения выполнения требования ИСО 15189 при оценке MU необходимо, чтобы медицинские лаборатории были обеспечены согласованным, стандартизованным и актуальным подходом к терминологии, принципам и статистическим методам, применяемым при оценке MU. JCGM 100:2008* «Оценивание данных измерений. Руководство по выражению неопределенности измерения (GUM)» — исчерпывающее руководство по теме MU, предоставляющее подробную информацию относительно математических и метрологических основ, требуемых для подробной оценки составляющих, которые должны быть учтены при оценке MU для широкого диапазона измерительных систем во многих дисциплинах науки и техники. В GUM* (1.2) указано, что «настоящее руководство в первую очередь рассматривает выражение неопределенности измерения четко определенной величины, характеризуемой единственным значением». В GUM* (1.4) указано, что «...настоящее руководство устанавливает общие правила оценивания и выражения неопределенности измерения и не содержит подробных указаний для конкретных измерений. В нем также не рассмотрен вопрос, каким образом полученная оценка неопределенности результата конкретного измерения может быть использована в дальнейшем, например: для вывода о сопоставимости данного результата с результатами аналогичных измерений, для установления допусков в технологическом процессе, для заключения о соблюдении или несоблюдении установленных требований безопасности. Подобные вопросы, связанные со специфическими областями измерений или с конкретным использованием количественных оценок неопределенности, могут рассматриваться в других стандартах, основанных на данном руководстве. Такие стандарты могут представлять собой упрощенные версии настоящего руководства, но они должны содержать в себе все необходимые сведения, исходя из требуемого уровня точности и сложности измерений, на которые они распространяются».
Соответственно в настоящем стандарте представлены практические подходы к оценке MU, которые следует применять в медицинских лабораториях с целью оценивания MU значений, полученных с помощью методик измерений, предназначенных для измерения широкого диапазона биологических
* В Российской Федерации действует ГОСТ 34100.1—2017/ISO/IEC Guide 98-1:2009 «Неопределенность измерения. Часть 1. Введение в руководства по выражению неопределенности измерения».
IV
ГОСТ Р 70413—2022
измеряемых величин. Измеряемые величины, представляющие наибольший интерес, обычно присутствуют в сложных биологических жидкостях и тканевых матрицах, и они подлежат измерению с целью предоставления диагностической информации практикующим врачам. В современных медицинских лабораториях подавляющее большинство измерений выполняют с помощью оборудования, включая автоматизированные приборы и готовые наборы реагентов. Определение характеристик методик измерений в условиях лаборатории конечного пользователя обычно ограничено сбором эмпирических данных о характеристиках с использованием образцов сравнения для контроля качества*, предназначенных для имитации предполагаемых клинических образцов. Такие данные, известные как данные внутреннего контроля качества (IQC), могут быть целесообразны для оценивания характеристики повторяемости и долговременной непрецизионности данной методики измерений. Дополнительная информация о неопределенности, касающаяся элементов более высоких уровней в иерархии калибровки для данной методики измерения, должна быть предоставлена производителем и учтена медицинской лабораторией в процессе оценки MU. По существу, этому соответствует нисходящий подход GUM, а конкретное применение для использования в медицинских лабораториях приведено в разделе 6.
Суррогатных проб.
V
ГОСТ Р 70413—2022/ISO/TS 20914:2019
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЛАБОРАТОРИИ МЕДИЦИНСКИЕ
Практическое руководство по оценке неопределенности измерений
Medical laboratories. Practical guidance for the estimation of measurement uncertainty
Дата введения — 2023—10—01
1 Область применения
Настоящий стандарт представляет собой практическое руководство по оцениванию и выражению неопределенности измерения (MU) количественных значений измеряемой величины, полученных в медицинских лабораториях. Количественные значения измеряемой величины, полученные вблизи порогового значения медицинского решения системами тестирования в местах оказания медицинской помощи, также включены в эту область. Настоящий стандарт также применяют для оценивания MU для результатов, полученных качественными (номинальными) методами, включающими процедуру измерения. Оценки неопределенности не требуется представлять каждый раз с результатами пациентов, но они должны быть доступны по запросу.
Примечание — См. приложение В в качестве примера применения MU.
2 Нормативные ссылки
В настоящем стандарте нормативные ссылки отсутствуют.
3 Термины и определения
Для целей настоящего стандарта применяют следующие термины.
Терминологические базы данных ИСО и МЭК доступны по следующим адресам:
- платформа онлайн-просмотра ИСО, доступная по адресу: http://www.iso.org/obp;
- Электропедия МЭК, доступная по адресу: http://www.electropedia.org/.
3.1 аналит (analyte): Компонент пробы, представленный в наименовании измеряемой величины.
Примечание 1 — Составляющая пробы с измеряемым свойством.
Пример — В измеряемой величине «масса белка в 24-часовой моче» белок является аналитом; в «молярной концентрации глюкозы в плазме» глюкоза —аналитом, а молярная концентрация — это свойство.
[ИСО 18113-1:2009, модифицированный]
Примечание 2 — В JCGM 200:2012, 5.4, приведена информация о том, что первичный эталон может быть «...приготовлен путем растворения молярной концентрации химического компонента в определенном объеме раствора».
3.2 калибровка (calibration): Операция, в ходе которой при заданных условиях на первом этапе устанавливают соотношение между значениями величин с неопределенностями измерений, которые обеспечивают эталоны, и соответствующими показаниями с присущими им неопределенностями, а на втором этапе на основе этой информации — соотношение, позволяющее получать результат измерения исходя из показания.
Издание официальное
1
ГОСТ Р 70413—2022
Примечание 1 — Калибровка может быть выражена как утверждение, функция калибровки, диаграмма калибровки, калибровочная кривая или таблица калибровки. В некоторых случаях она может включать аддитивную или мультипликативную поправку к показаниям с соответствующей неопределенностью.
Примечание 2 — Калибровку не следует путать ни с регулировкой измерительной системы, часто ошибочно называемой «автоматическая калибровка», ни с верификацией калибровки.
Примечание 3 — Часто только первый шаг в приведенном выше определении понимают как калибровку.
[JCGM 200:2012, 2.39, модифицированный]
3.3 калибратор (calibrator): Эталон, используемый при калибровке.
[JCGM 200:2012, 5.12]
Примечание 1 — В настоящем стандарте калибратор является синонимом калибровочного материала.
Примечание 2 — Калибратор — это эталон, используемый при калибровке измерительной системы в соответствии с определенной методикой измерения.
3.4 коммутативность стандартного образца* (commutability of a reference material): Свойство стандартного образца, характеризующееся близостью соотношения между результатами измерений определенной величины для этого образца, полученными по двум методикам измерений, к такому же соотношению результатов, полученных для других образцов.
Примечание 1 — Стандартный образец в данном случае обычно является калибратором, а другие образцы — рядовыми пробами.
[JCGM 200:2012, 5.15]
Примечание 2 — Как правило, доступно более двух методик измерений, и предпочтительно сличение всех применяемых методик измерений.
Примечание 3 — Требование близости соотношения должно соответствовать предполагаемому использованию стандартного образца.
Примечание 4 — Заявление о коммутативности ограничено методиками измерения, указанными в конкретном сличении.
3.5 компонент (component): Составляющая смеси, количество или концентрация которой может изменяться независимо.
[International Union of Pure and Applied Chemistry (IUPAC) Compendium of Chemical Terminology (Gold Book) Version 2.3.3 2014-02-24, модифицированный]
Примечание 1 — См. также аналит (3.1).
3.6 коэффициент охвата к (coverage factor к): Число более чем один, на которое умножают суммарную стандартную неопределенность измерений и для получения расширенной неопределенности измерений U (см. 3.9).
Примечание 1 — Коэффициент охвата обычно обозначают к.
[JCGM 200:2012, 2.38, модифицированный]
3.7 интервал охвата (coverage interval): Интервал, содержащий совокупность истинных значений измеряемой величины с заданной вероятностью и определяемый на основе имеющейся информации.
Примечание 1 — Центр интервала охвата не обязательно будет совпадать с измеренным значением величины (см. JCGM 101:2008).
Примечание 2 — Интервал охвата не следует называть доверительным интервалом во избежание путаницы сданным статистическим понятием (см. GUM:1995, 6.2.2).
Примечание 3 — Интервал охвата может быть выведен из расширенной неопределенности измерений (см. GUM:1995, 2.3.5).
[JCGM 200:2012, 2.36]
Примечание 4 — Согласно GUM термин «истинный» избыточен. В настоящем стандарте использован термин «значение измеряемой величины».
3.8 калибратор конечного пользователя; калибратор конечного пользователя медицинского изделия in vitro диагностики; IVD MD [end-user calibrator; end-user in vitro diagnostic medical device (IVD MD) calibrator]: Стандартный образец, используемый в качестве эталона (калибратора) для одной или более методик измерения, предназначенных для исследования конкретной измеряемой величины в клинических образцах (образцах биологического материала человека).
* В соответствии с ГОСТ Р ИСО 11095—2007 «Статистические методы. Линейная калибровка с использованием образцов сравнения» для обозначения стандартных образцов, не имеющих метрологической прослеживаемости, иногда используют термин «образец сравнения».
2
ГОСТ Р 70413—2022
3.9 расширенная неопределенность измерения U; расширенная неопределенность (expanded measurement uncertainty, U; expanded uncertainty): Произведение суммарной стандартной неопределенности и коэффициента (охвата) к большего, чем число «1».
[JCGM 200:2012, 2.35, модифицированный]
Примечание 1 — Измеренное значение х ±[к ■ и(у)] с коэффициентом охвата к = 2 означает, что в лаборатории предполагают (уровень доверия =95 %), что значение измеряемой величины находится в интервале значения, вычисляемого по формуле
Х±[к' u(/)L
где х — измеряемая величина;
к — коэффициент охвата (обычно равный 2 для уровня доверия =95 %);
и(у) — стандартная неопределенность измеренного значения у.
3.10 внешняя оценка качества; EQA (external quality assessment; EQA): Международная, национальная региональная программа, разработанная для обеспечения регулярной, внешней, независимой оценки качества аналитической работы медицинской лаборатории и помощи в выявлении смещения предоставленных результатов по сравнению с другими лабораториями.
Примечание 1 — Также известна как проверка квалификации (РТ) [19]—[21].
Примечание 2 — EQA — термин, используемый в настоящем стандарте.
3.11 показание (indication): Значение величины, полученное с помощью средства измерения или измерительной системы.
Примечание 1 — Показание может быть представлено в визуальной или звуковой форме или передано на другое устройство. Показание часто приводят в виде позиции указателя на дисплее для аналоговых выходов, отображенного или напечатанного числа для цифровых выходов, а также кодовой комбинации для кодовых выходных сигналов или приписанного значения для мер физических величин.
[JCGM 200:2012, 4.1]
3.12 условия промежуточной прецизионности измерений (intermediate precision condition of measurement): Один из наборов условий измерений, включающий применение одной методики измерений, одно местоположение и выполнение повторных измерений на одном или подобных объектах в течение продолжительного периода времени, а также другие условия, которые могут изменяться.
Примечание 1 — Изменения могут включать новые калибровки, калибраторы, измерительные системы, а также новых операторов.
Примечание 2 — Спецификация должна включать все условия, изменяемые и неизменяемые, насколько это оправдано практически.
[JCGM 200:2012, 2.22]
Примечание 3 — Для настоящего стандарта термин «долговременная прецизионность uRw» используют в значении информации о прецизионности для данной методики измерения, полученной в течение длительного периода времени, в некоторый момент, включающий эффекты всех или большинства изменений в условиях измерения, например изменения набора расходных материалов, повторная калибровка и т. д. Такие изменения должны быть определены для каждой методики измерения [см. 3.33 условие повторяемости измерения (JCGM 200:2012, 2.20); см. 3.40 составляющая неопределенности в условиях внутрилабораторной прецизионности uRw].
Примечание 4 — Измененные условия могут включать техническое обслуживание прибора, если это необходимо.
Примечание 5 — Зачастую uRw вносит основной вклад в суммарную стандартную неопределенность результата измерения в медицинской лаборатории.
3.13 внутренний контроль качества; ЮС (internal quality control; ЮС): Совокупность методов и определенных материалов, используемых сотрудниками лаборатории для повторного наблюдения за аналитическими характеристиками измерительных систем.
3.14 долговременная прецизионность Upw (long-term precision; uRw): См. 3.12, 3.40.
Примечание 1 — Термин «долговременная прецизионность» и символ uRw используют в настоящем стандарте тогда, когда рассматривают оценку неопределенности, основанную на данных, наблюдаемых в условиях промежуточной прецизионности измерения.
3.15 максимально допустимая неопределенность измерения; целевая неопределенность измерения (maximum allowable measurement uncertainty; target measurement uncertainty): Неопределенность, максимально отвечающая требованиям к MU результатов измерений, полученных с помощью данной методики измерения, и указанная как верхний предел на основе анализа медицинских требований.
[JCGM 200:2012, 4.26 и 2.34, модифицированный]
3
ГОСТ Р 70413—2022
Примечание 1 — JCGM 200:2012,4.26, определяет максимально допускаемую погрешность измерения. В английском языке разница между терминами «допущено» и «разрешено» является аналогом разнице между понятиями допуска (допущено) и разрешением (разрешено). Разрешение подразумевает законодательное, обязательное или юридическое требование. Для большинства измеряемых величин в лабораторной медицине отсутствуют регламентированные характеристики, поэтому предпочтительным прилагательным в контексте этого определения является «допустимый».
Примечание 2 — Считается, что максимально допустимая MU представляет характеристику, основанную на целевом использовании результата измерения для принятия медицинского решения.
3.16 измеряемая величина (measurand): Величина, подлежащая измерению.
Примечание 1 — Детальное описание измеряемой величины (спецификация) требует знания рода величины, описания явления, тела или вещества, которым присуща эта величина, включая любые существенные составляющие, в том числе и химические.
Примечание 2 — Во 2-м издании VIM и в МЭК 60050-300:2001 измеряемая величина определена как «величина, являющаяся объектом измерения».
Примечание 3 — Измерение, включая измерительную систему и условия, при которых оно выполняется, может изменить явление, тело или вещество таким образом, что измеренная величина может отличаться от измеряемой величины согласно ее определению. В этом случае необходимо вводить соответствующую поправку.
Пример — Длина стального стержня в состоянии теплового равновесия с окружающей средой при температуре 23 °C будет отличаться от длины при заданной температуре 20 °C, которая и является измеряемой величиной. В этом случае необходимо вводить соответствующую поправку.
Примечание 4 — В химии для «измеряемой величины» иногда используют термин «аналит» либо наименование вещества или соединения. Такое использование является ошибочным, потому что эти термины не имеют отношения к величинам.
[JCGM 200:2012, 2.3]
Примечание 5 — В лабораторной медицине определение измеряемой величины включает наименование величины (например, молярная концентрация вещества), компонент/аналит (например, p-D-глюкоза) и биологическую систему, в которой он находится (например, плазма крови).
[ИСО 18113-1:2009, 3.39]
3.17 измерение (measurement): Процесс экспериментального получения одного или более значений величины, которые могут быть обоснованно приписаны величине.
Примечание 1 — Измерение не применяют в отношении качественных свойств.
Примечание 2 — Измерение подразумевает сравнение величин или подсчет объектов.
Примечание 3 — Измерение предусматривает описание величины в соответствии с предполагаемым использованием результата измерения, методику измерений и откалиброванную измерительную систему, функционирующую в соответствии с регламентированной методикой измерений и с учетом условий измерений.
[JCGM 200:2012, 2.1]
Примечание 4 — Измеряемая величина — это величина, предназначенная для измерения в медицинской лаборатории (см. 3.17).
3.18 смещение (при измерении) (measurement bias): Оценка систематической погрешности измерения.
[JCGM 200:2012, 2.18]
Примечание 1 — Разница между принятым значением коммутативного стандартного образца и средним значением повторных измерений, проведенных в условиях повторяемости с помощью методики измерения в медицинской лаборатории.
Примечание 2 — Разница между средним значением повторных измерений, проведенных с помощью референтной методики измерения, и средним значением повторных измерений, выполненных в условиях повторяемости посредством медицинской лабораторной методики измерения.
Примечание 3 — Из-за непрецизионности измерения не представляется возможным точно узнать значение смещения измерения.
3.19 погрешность измерения (measurement bias): Разность между измеренным значением величины и опорным значением величины.
[JCGM 200:2012, 2.16]
4
ГОСТ Р 70413—2022
Примечание 1 — Как правило, измерение несовершенно, что приводит к погрешности в результате измерения. Обычно считают, что погрешность состоит из двух составляющих: случайной составляющей и систематической составляющей.
Примечание 2 — Погрешность — идеализированное понятие, и погрешности не могут быть точно известными.
[JCGM 100:2008; 3.2.1, примечания 1 и 2]
3.20 метод измерений (measurement method): Общее описание логической последовательности операций при измерении.
Примечание 1 — Методы измерений могут быть следующих видов:
- метод измерений замещением;
- дифференциальный метод измерений;
- нулевой метод измерений;
- метод прямых измерений;
- метод косвенных измерений.
Примечание 2 — См. IEC 60050-300:2001.
[JCGM 200:2012, 2.5]
3.21 прецизионность измерений; прецизионность (measurement precision; precision): Близость между показаниями или измеренными значениями величины, полученными при повторных измерениях для одного или аналогичных объектов при заданных условиях.
Примечание 1 — Прецизионность измерений обычно выражена численно через показатели непрецизионности, такие как стандартное отклонение, дисперсия или коэффициент вариации при заданных условиях измерений.
Примечание 2 — Заданные условия могут быть, например, условиями повторяемости измерений, условиями промежуточной прецизионности измерений или условиями воспроизводимости измерений (см. ИСО 5725-3:1994).
Примечание 3 — Понятие «прецизионность измерений» используют для определения повторяемости измерений, промежуточной прецизионности измерений и долговременной непрецизионности измерения.
[JCGM 200:2012, 2.15]
Примечание 4 — Непрецизионность означает статистическую меру или показатель, относящийся к степени близости или дисперсии, например SD, CV, диапазон и т. д. В данном контексте методика измерения имеет хорошую прецизионность, когда неточность низкая, и плохую прецизионность, когда непрецизионность высока по сравнению с прецизионностью, необходимой для принятия медицинских решений на основе значения измеряемой величины.
3.22 методика измерений (measurement procedure): Детальное описание измерения в соответствии с одним или более принципами измерений и данным методом измерений, которое основано на модели измерений и включает вычисления, необходимые для получения результата измерения.
Примечание 1 — Методику измерений обычно описывают достаточно подробно и представляют в виде стандарта, позволяющего компетентному оператору выполнить измерение.
[Изменено — добавлено слово «компетентный»]
Примечание 2 — Методика измерений может включать информацию о целевой неопределенности измерений.
Примечание 3 — Методику измерений иногда называют стандартной операционной процедурой (СОП) (standard operating procedure, SOP).
[JCGM 200:2012, 2.6]
Примечание 4 — Целевая неопределенность приведена в примечании 2 JCGM 200:2012, 2.6, в настоящем стандарте упоминается в качестве максимально допускаемой неопределенности измерения (см. 3.15).
3.23 повторяемость измерений (precision): Прецизионность измерений в условиях повторяемости измерений.
[JCGM 200:2012, 2.21]
Примечание 1—См. 3.33.
3.24 результат измерения (measurement result): Набор значений величины, приписываемых измеряемой величине вместе с другой доступной и существенной информацией.
5
ГОСТ Р 70413—2022
Примечание 1 — Как правило, результат измерения содержит существенную информацию о наборе значений величины, такую, что некоторые из этих значений могут в большей степени представлять измеряемую величину, чем другие. Это может быть выражено плотностью распределения вероятностей (probability density function, PDF).
Примечание 2 — Как правило, результат измерения выражается одним измеренным значением величины и неопределенностью измерений. Если неопределенность измерений можно считать пренебрежимой для заданной цели измерения, то результат измерения может выражаться как одно измеренное значение величины. Во многих областях это является обычным способом выражения результата измерения.
[JCGM 200:2012, 2.9]
3.25 эталон (measurement standard): Реализация определения данной величины с установленным значением и связанной с ним неопределенностью измерений, используемая в качестве основы для сравнения.
Пример 1 — Эталон массы 1 кг со стандартной неопределенностью измерений 3 мкг.
Пример 2 — Набор эталонных растворов кортизола в сыворотке крови человека, имеющих аттестованное значение величины и неопределенность измерений для каждого раствора.
Пример 3 — Стандартный образец, обеспечивающий значения величины с неопределенностями измерений массовой концентрации каждого из десяти различных белков.
Примечание 1 — «Реализация определения данной величины» может обеспечиваться измерительной системой, материальной мерой или стандартным образцом.
Примечание 2 — Эталон часто используют как основу для сравнения при установлении измеренных значений других величин того же рода и связанных с ними неопределенностей измерений и, таким образом, для установления метрологической прослеживаемости через калибровку других эталонов, средств измерений или измерительных систем.
Примечание 3 — Термин «реализация» использован в настоящем стандарте в общем смысле. Он означает три процедуры реализации. Первая состоит в физической реализации единицы измерения исходя из ее определения и является реализацией в буквальном смысле. Вторая, называемая «репродукция», состоит не в реализации единицы измерения из ее определения, а в установлении высокостабильного эталона, основанного на физическом явлении, как, например, в случае использования стабилизированных по частоте лазеров для установления эталона метра, эффекта Джозефсона для вольта, квантового эффекта Холла для ома. Третья процедура состоит в принятии материальной меры в качестве эталона. Это имеет место, например, в случае эталона 1 кг.
Примечание 4 — Стандартная неопределенность измерений, связанная с эталоном, всегда является составляющей суммарной стандартной неопределенности измерений (см. ISO/IEC Guide 98-3:2008, 2.3.4) для результата измерения, полученного с помощью методики, для калибровки которого используют этот эталон. Часто такая составляющая мала по сравнению с другими составляющими суммарной стандартной неопределенности измерений.
Примечание 5 — Значение величины и неопределенность измерений следует определять для времени использования эталона.
Примечание 6 — Несколько величин одного или разного родов могут быть реализованы в одном устройстве, которое обычно также называют эталоном.
Примечание 7 — Иногда вместо слова «realization» (реализация) в английском языке используют слово «embodiment» (воплощение).
Примечание 8 — В науке и технике английское слово «standard» (стандарт) используют по крайней мере в двух различных значениях: как спецификация, техническая рекомендация или подобный нормативный стандарт (во французском языке слово «погте») и как измерительный эталон (во французском языке слово «etalon»). В данном словаре рассматривается только второе значение.
[JCGM 200:2012, 5.1]
3.26 неопределенность измерения; MU (measurement uncertainty; MU): Неотрицательный параметр, характеризующий рассеяние значений величины, приписываемых измеряемой величине на основании используемой информации.
Примечание 1 — Неопределенность измерений включает составляющие, обусловленные систематическими эффектами, в том числе составляющие, связанные с поправками и приписанными значениями эталонов, а также дефинициальную неопределенность. Иногда поправки на оцененные систематические эффекты не вводят, а вместо этого последние рассматривают как составляющие неопределенности измерений.
Примечание 2 — Параметром может быть, например, стандартное отклонение, называемое стандартной неопределенностью измерений (или кратное ему число), или половина ширины интервала с установленной вероятностью охвата.
Примечание 3 — В общем случае неопределенность измерений включает в себя много составляющих. Некоторые из этих составляющих могут быть оценены по типу А неопределенности измерений на основании статистического распределения значений величины из серий измерений и могут характеризоваться стандартными
6
ГОСТ Р 70413—2022
отклонениями. Другие составляющие, которые могут быть оценены по типу В, также могут характеризоваться стандартными отклонениями или оцениваться через функции плотности вероятностей на основании опыта или другой информации.
Примечание 4 — В целом, при данном объеме информации подразумевается, что неопределенность измерений связывают с определенным значением, приписываемым измеряемой величине. Изменение этого значения приводит к изменению связываемой с ним неопределенности.
[JCGM 200:2012, 2.26]
Примечание 5 — Все измерения имеют смещение и непрецизионность. Например, при повторных измерениях образца, выполненных в условиях повторяемости, как правило, получают разные значения для одной измеряемой величины. Поскольку все различные значения можно отнести к одному количеству измеряемой величины, существует неопределенность в отношении того, какое значение следует указывать в качестве значения измеряемой величины.
Примечание 6 — Основываясь на доступных данных об аналитических характеристиках данной методики измерения, оценка MU обеспечивает интервал значений, который, как предполагается, включает фактическое значение измеряемой величины с установленным уровнем доверия.
Примечание 7 — Доступные данные об аналитических характеристиках данной методики измерения обычно включают неопределенность значений, присвоенных калибратору, и долговременную непрецизионность IQC материалов.
Примечание 8 — В медицинских лабораториях большинство измерений выполняется однократно, и они принимаются в качестве приемлемой оценки значения измеряемой величины, в то время как интервал MU показывает другие результаты, которые также возможны.
3.27 измерительная система* (measuring system): Совокупность средств измерений, а также других устройств, включая реактивы и источники питания, функционирующих как единое целое, для получения информации об измеренных значениях величин в пределах установленных интервалов для величин указанного рода.
Примечание 1 — Измерительная система может состоять только из одного средства измерения.
[JCGM 200:2012, 3.2]
3.28 метрологическая прослеживаемость (metrological traceability): Свойство результата измерения, в соответствии с которым результат может быть соотнесен с основой для сравнения через документированную непрерывную цепь калибровок, каждая из которых вносит вклад в неопределенность измерений.
Примечание 1 — В этом определении основой для сравнения может быть определение единицы измерения через ее практическую реализацию или методика измерений, включающая единицу измерения для величин, отличных от порядковых, или эталона.
Примечание 2 — Метрологическая прослеживаемость требует наличия установленной иерархии калибровки.
Примечание 3 — Описание основы для сравнения должно включать время, в течение которого она использована в данной иерархии калибровки, вместе с другой существенной метрологической информацией, например, о том, когда была выполнена первая калибровка в иерархии калибровки.
Примечание 4 — Для измерений с более чем одной входной величиной в модели измерений каждое из значений входных величин должно быть метрологически прослеживаемо, а иерархия калибровки может иметь форму разветвленной структуры или сети. Усилия, связанные с установлением метрологической прослеживаемости для каждого значения входной величины, должны быть соизмеримы с ее относительным вкладом в результат измерения.
Примечание 5 — В JCGM 200:2012, 2.50, входная величина в измерительной модели определена как величина, которая должна быть измерена, или величина, значение которой может быть получено иным способом для вычисления измеренного значения измеряемой величины. Например, если измеряемой величиной является длина стального стержня при заданной температуре, то действительная температура, длина при этой действительной температуре и температурный коэффициент линейного расширения стержня являются входными величинами в модели измерений.
Примечание 6 — Метрологическая прослеживаемость результата измерения не гарантирует, что неопределенность измерений соответствует заданной цели или отсутствуют ошибки.
Примечание 7 — Сличение между двумя эталонами может быть рассмотрено как калибровка, если это сличение используют для проверки и, при необходимости, для корректировки значения величины и неопределенности измерений, приписываемых одному из эталонов.
* Измерительная система — совокупность средств измерений и других средств измерительной техники, размещенных в разных точках объекта измерения, функционально объединенных с целью измерений одной или нескольких величин, свойственных этому объекту (см. РМГ 29—2013, статья 6.3).
7
ГОСТ Р 70413—2022
Примечание 8 — Международное сотрудничество по аккредитации лабораторий (ILAC) рассматривает элементы для подтверждения метрологической прослеживаемости как непрерывную цепь метрологической прослеживаемости к международному эталону или национальному эталону, документированной неопределенности измерений, стандартизованной методики измерений, аккредитованной технической компетентности, метрологической прослеживаемости к международным системам единиц (СИ) и интервалы между калибровками (см. ILAC Р-10:2002).
Примечание 9 — Сокращенный термин «прослеживаемость» иногда используют для обозначения метрологической прослеживаемости, а также и для других понятий, таких как «прослеживаемость пробы», «прослеживаемость стандарта», «прослеживаемость прибора» или «прослеживаемость материала», где частью слова является корень «слеж» от слова «след». Вследствие этого предпочтительнее использовать полный термин «метрологическая прослеживаемость».
[JCGM 200:2012, 2.41]
3.29 проверка квалификации; PT (proficiency testing; РТ): Также известна как внешняя оценка качества (EQA).
Примечание 1—См. 3.10.
3.30 свойство (property): Признак вещества, тела или явления, например: цвет, нуклеотидная последовательность, длина, масса, длина волны излучения света.
3.31 величина (quantity): Свойство явления, тела или вещества, которое может быть выражено количественно в виде числа с указанием отличительного признака как основы для сравнения.
Примечание 1 — Предпочтительным форматом IUPAC-IFCC для обозначения величин в лабораторной медицине является «система — компонент; род величины».
Пример 1 — «Плазма (крови) — ион натрия; молярная концентрация, равная 143 ммоль/л для данного человека в данный момент времени».
[JCGM 200:2012, 1.1]
Пример 2 — Счетная концентрация эритроцитов в образце крови (Whole Blood— эритроциты; счетная концентрация, равная 5 ■ 106/мкл у данного человека в данный момент времени).
Примечание 2 — Количество не следует путать с аналитом (см. 3.1).
Примечание 3 — Методики измерения, для которых измерение выражено качественной оценкой (например, «присутствует» или «отсутствует») на основе шкал отношений или подсчета с заранее определенным порогом принятия решения, согласованы сданным определением термина «величина».
3.32 относительная стандартная неопределенность* ure| (relative standard measurement uncertainty; ure|): Стандартная неопределенность измерений и, деленная на абсолютное значение — измеренное значение величины*.
[JCGM 200:2012, 2.32]
Примечание 1 — Данный общий расчет обычно называют коэффициентом вариации (Су).
Примечание 2 — В настоящем стандарте относительную стандартную неопределенность измерения ure| используют для того, чтобы отличить ее от других применений Су.
3.33 условия повторяемости измерений (repeatability condition of measurement): Один из наборов условий измерений, включающий применение одной и той же методики измерений, того же средства измерений, участие тех же операторов, те же рабочие условия, то же местоположение и выполнение повторных измерений на одном и том же или подобных объектах в течение короткого промежутка времени.
[JCGM 200:2012, 2.20]
Примечание 1 — Исследование повторяемости обычно проводят при верификации аналитических характеристик методики измерения перед вводом в эксплуатацию, что указывает на наилучшую прецизионность, достижимую персоналом данной лаборатории. Исследование повторяемости также может быть выполнено, если выявляется смещение методики измерения в процессе эксплуатации, основанное на минимальном числе повторов, что требует дальнейшей оценки.
3.34 избирательность измерительной системы (selectivity of a measuring system): Свойство измерительной системы, применяемой согласно установленной методике измерений, когда система дает измеренные значения величины для одной или нескольких измеряемых величин, при которых значения каждой измеряемой величины независимы от других измеряемых величин или других величин в явлении, теле или веществе в процессе исследования.
Относительная стандартная неопределенность измерений — стандартная неопределенность измерений, деленная на модуль измеренного значения величины (см. РМГ 29-2013, статья 5.46).
8
ГОСТ Р 70413—2022
Пример 1 — Способность измерительной системы измерять молярную концентрацию креатинина в плазме крови без влияния других компонентов, присутствующих в образце.
Примечание 1 — В химии избирательность измерительной системы обычно получают для величин и определенных компонентов, концентрации которых находятся в установленных интервалах.
Примечание 2 — Понятие «избирательность», применяемое в физике, близко к понятию «специфичность», иногда используемому в химии.
[JCGM 200:2012, 4.13, модифицированный]
Пример 2 — Способность измерительной системы измерять молярную концентрацию креатинина в плазме крови по Яффе без влияния концентраций глюкозы, уратов, кетонов и белка.
3.35 стандартное отклонение; SD (standard deviation; SD)-. Величина для серии ее измерений, характеризующая разброс результатов.
[JCGM 100:2008, В.2.17, модифицированный]
Примечание 1 — Мера изменчивости (дисперсия или разброс) любого набора числовых значений относительно их среднего арифметического (среднего), определяемого как положительный квадратный корень из дисперсии.
Примечание 2 — Количественная характеристика изменчивости или рассеяния значений одного и того же процесса относительно истинного, но неизвестного значения.
Примечание 3 — SD в настоящем стандарте означает долговременную прецизионность (см. 3.21).
Примечание 4 — SD используют во многих различных ситуациях для количественной оценки рассеяния значений различных типов наборов данных. В контексте MU стандартное отклонение SD, определяющее количественную оценку рассеяния значений величин, полученных в результате исследований прецизионности в условиях повторяемости или долговременной прецизионности, называют стандартной MU (и) для того, чтобы отличать ее от других применений SD.
Примечание 5 — SD не допускается складывать или вычитать. Такие расчеты требуют использования дисперсии (см. 3.39).
3.36 стандартная погрешность; SE (standard error; SE)-. Количественная мера вариации или дисперсии средних значений выборки или выборочного среднего.
Примечание 1 — Иногда называют SD среднего.
Примечание 2 — Значение измеряемой величины, например в стандартном образце, требует вычисления среднего значения с использованием небольшого числа измеренных значений, полученных в условиях повторяемости. Если бы исследование повторяемости проводилось много раз, были бы получены немного отличающиеся средние значения, так что среднее значение также имеет MU. Вместо проведения нескольких исследований повторяемости и среднего значения, полученной в результате одного исследования повторяемости, можно количественно определить, вычислив среднее значение SD (SDmean) по формуле
SD
^^теап г~1
ЧП
где SDmean вычисляют путем деления стандартного отклонения п наблюдений в серии (из исследования повторяемости) на квадратный корень из п.
Пример — Для оценки смещения методики измерения сывороточного креатинина стандартный образец для сывороточного креатинина измеряли 20 раз в условиях повторяемости.
Среднее значение - 122,0 мкмоль/л, SD 0,63 мкмоль/л; п = 20;
SDmean = 0,63^20 - и =0,15 мкмоль/л, U = 0,30, к = 2.
Примечание 3 — Расширенная неопределенность U для концентрации креатинина в стандартном образце (со средним значением 122,0 мкмоль/л), измеренная с помощью методики измерения конечного пользователя, составляет (122,0 ± 0,30) мкмоль/л (уровень доверия =95 %). Следует отметить, что значения измеряемой величины, присвоенные стандартным образцам более высокого порядка, также имеют заявленные неопределенности (указанные в их сертификатах), которые должны быть объединены с и среднего значения, полученного, как описано выше, для правильной оценки MU методики измерения конечного пользователя.
Примечание 4 — С увеличением п значение SDmean уменьшается, обеспечивая более надежную оценку среднего значения измеряемой величины в стандартном образце.
3.37 стандартная неопределенность измерений и; стандартная неопределенность (standard measurement uncertainty; и; standard uncertainty): Неопределенность измерений, выраженная в виде стандартного отклонения.
[JCGM 200:2012, 2.30]
Примечание 1 — Значение и положительное, т. е. указано без знака, например 0,14 ммоль/л (см. также 3.40).
9
ГОСТ Р 70413—2022
3.38 правильность измерений (measurement trueness): Близость среднего арифметического бесконечно большого числа повторно измеренных значений величины к опорному значению величины.
[JCGM 200:2012, 2.14]
3.39 дисперсия (variance): Квадрат стандартного отклонения (SD2, и2).
Примечание 1 — Достаточное количество результатов измерений, полученных в результате исследований прецизионности, рассредоточены таким образом, который, в целом, приближается к распределению Гаусса. Как и SD, дисперсия (SD2, и2) — это статистический параметр, показывающий, как далеко отдельные значения расходятся от среднего значения всех учитываемых результатов. В то время как SD — это среднее расстояние от среднего значения, дисперсия — это среднее значение квадрата расстояния к среднему значению. Малая дисперсия означает, что учитываемые значения близки к среднему и к друг другу, в то время как большая дисперсия означает, что значения далеки от среднего и друг от друга.
Примечание 2 — Разброс значений, обычно получаемых при выполнении повторных измерений при исследованиях повторяемости или промежуточной прецизионности с использованием материалов IQC, может быть охарактеризован дисперсией. Дисперсию вычисляют как сумму квадратов разницы каждого отдельного значения от среднего значения, деленную на степени свободы (общее количество значений минус «один»), по формуле
п
Примечание 3 — Единица измерения дисперсии нецелесообразна для лабораторного использования, потому что ее единица измерения является квадратом единицы измерения, применяемой к данным (см. 3.35). Для целей лабораторных вычислений дисперсия должна быть сначала преобразована либо в SD, либо в стандартную неопределенность и, а затем вычислена по формуле
SD = ^SD2 или и = у[й^.
Таким образом, разброс значений измеряемой величины может быть выражен в одной единице измерения.
Примечание 4 — Значения SD или и не допускается складывать или вычитать. Такие вычисления с использованием независимых стандартных неопределенностей и или относительных стандартных неопределенностей иге/ требуют, чтобы значения сначала были преобразованы в соответствующие дисперсии (SD2, CV2), а затем просуммированы по формуле
оценивание суммарной дисперсии = (и^ + и^ +...и2). (1)
После того как суммарная дисперсия вычислена по формуле (1), оцененную общую (суммарную) стандартную неопределенность и(у) вычисляют по формуле
и(у) = ^/суммарной дисперсии [по формуле (1)]. (2)
Аналогичным образом суммарную относительную дисперсию можно вычислить по формуле суммарная относительная дисперсия = (u^value^2 + (u2/value2)2 +...(un/valuen)2 (3)
и суммарную относительную стандартную неопределенность urei вычисляют по формуле
иге/ = ^/суммарной относительной дисперсии. (4)
Рабочие примеры приведены в А.2.4.
3.40 составляющая неопределенности в условиях внутрилабораторной прецизионности uRw (uncertainty component under conditions of within-laboratory precision; uRw): Оценка стандартной неопределенности для данной измерительной системы в той же лаборатории в течение длительного периода времени, которая включает рутинные изменения условий измерения, например смену партии реагентов, калибраторов, технического обслуживания прибора.
Примечание 1 — Также называется долговременной прецизионностью, используемая в настоящем стандарте (см. 3.12, 3.21, 3.23).
4 Обозначения
В настоящем стандарте применены следующие обозначения:
к — коэффициент охвата, применяемый к неопределенности измерения и для нахождения расширенного доверительного интервала U;
SDmean — стандартное отклонение от среднего значения измеряемой величины, найденное путем проведения повторных измерений. Принимается за неопределенность измеренного значения у измеряемой величины У;
10
ГОСТ Р 70413—2022
и — неопределенность измерения, выраженная в виде стандартного отклонения;
ubias— неопределенность измерения и смещения значения;
иса1— значения, приписанные калибратору конечного пользователя;
uref— значения, приписанные стандартному образцу;
uRw— неопределенность измерения и для долговременной непрецизионности измеренных значений, полученных в определенных условиях в одной и той же лаборатории в течение периода, достаточного для учета всех рутинных изменений условий измерения, например различных партий реагентов, операторов и условий окружающей среды;
иге/(у) — относительная неопределенность измерения и измеренного значения у
иМ
---- , также
У
выраженная в процентах %urei(y). Используется в настоящем стандарте для отличия от других вариантов использования CV;
Ure/(y) — относительная расширенная неопределенность измеренного значения у измеряемой величины Y;
%Ure[y) — относительная расширенная неопределенность измеренного значения у измеряемой величины Y, выраженная в процентах;
иг(у) — неопределенность измерения и среднего значения повторных измерений Y, проведенных в условиях повторяемости г;
ШУ) — расширенная неопределенность измеренного значения у измеряемой величины У;
и(у) — стандартная неопределенность измеренного значения у измеряемой величины У;. х— среднее значение.
5 Неопределенность измерения для медицинских лабораторий
5.1 Концепция неопределенности измерения
Все результаты измерений содержат погрешность. Вследствие непрецизионности измерения величина погрешности для каждого отдельного результата не может быть достоверно установлена. Согласно концепции неопределенности измерения MU однократный результат измерения является наилучшим доступным значением для измеряемой величины и другие значения являются возможными, если измерения будут повторно проведены на тех же образцах.
На основе установленных аналитических характеристик используемой методики измерения результат измерения х единиц может быть заявлен как имеющий неопределенность и единиц.
Это может быть выражено в виде интервала возможных значений для измеряемой величины (см. 5.4) с интервалом, определенным как (х ± и) единиц. В условиях лаборатории предполагается, что значение измеряемой величины лежит в пределах интервала от х- и до х + и единиц, с установленным уровнем доверия.
Методики измерений медицинских лабораторий применяют для использования данных внутреннего контроля качества (IQC) и других доступных данных для оценки MU без необходимости задействования моделей измерения и сложной статистики. В нижеприведенных разделах представлен практический метод оценки и медицинскими лабораториями при применении их методик измерений, который использует доступные данные ЮС в дополнение к неопределенности, связанной с приписанным значением калибраторов и с неопределенностью любых представленных поправок на смещение.
На рисунке 1 представлена блок-схема, иллюстрирующая общий процесс, которому должна следовать медицинская лаборатория при оценке MU, и определяющая взаимосвязи между основными источниками MU, которые должны быть учтены лабораторией при оценке MU для данной измерительной системы.
MU рассматривает только неопределенности, возникающие от источников, находящихся в пределах технических ограничений измерительной системы, и предполагает, что:
- неопределенности, связанные с пре- и постаналитическими этапами, минимизируются за счет стандартизации этих процессов;
- измеренные клинические образцы являются типичными и не имеют необычных специфических факторов (например, внешних воздействий), влияющих на методики измерения.
11
ГОСТ Р 70413—2022
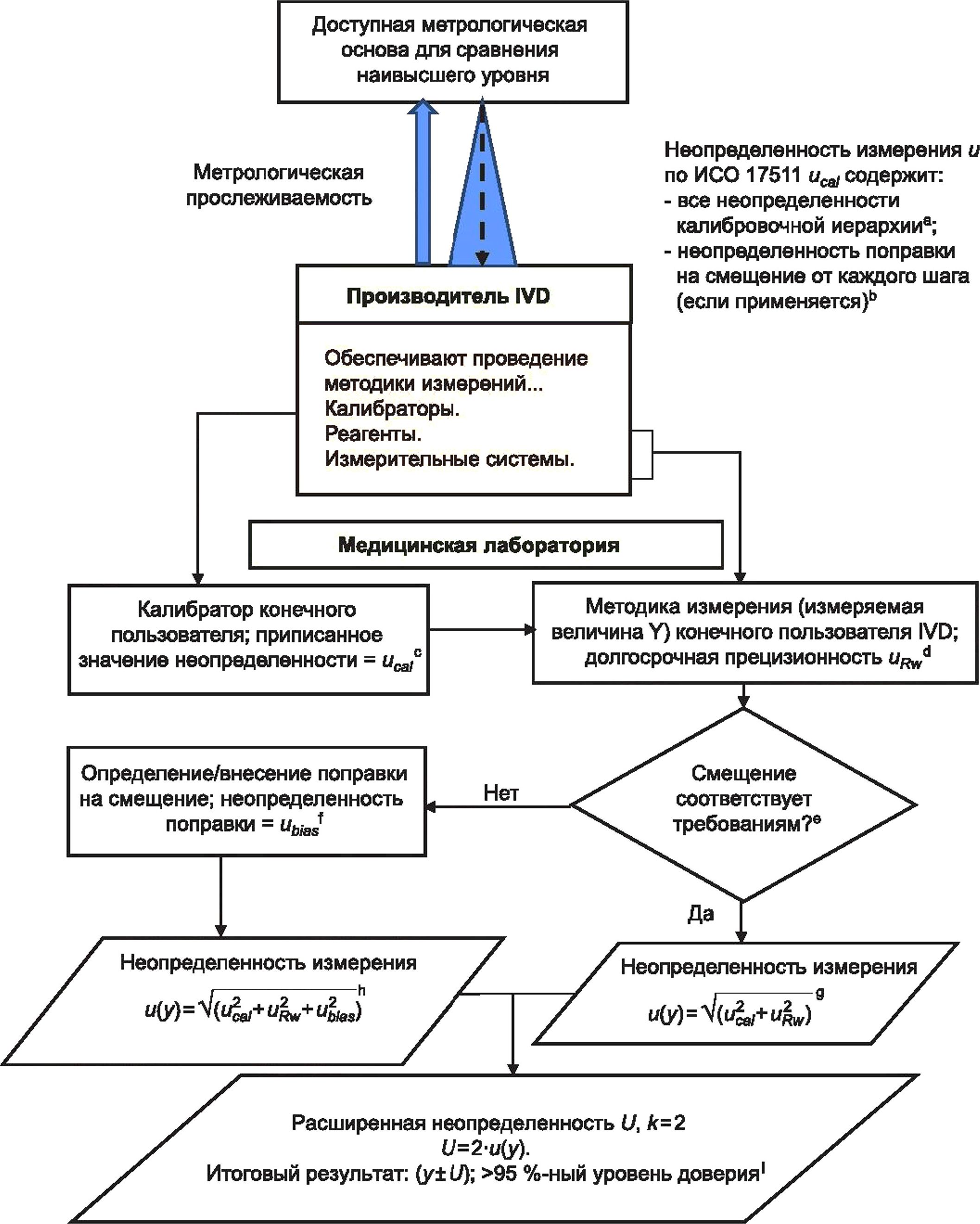
а Неопределенность калибровочной иерархии: в зависимости от измеряемой величины может быть несколько этапов присвоения значений и связанных неопределенностей от калибратора конечного пользователя до наиболее высокой по уровню доступной основы для сравнения (см. ИСО 17511).
ь Неопределенность поправки на смещение калибратора: необходимо учитывать, что процесс производства калибратора конечного пользователя уже включает в себя поправку любого значимого с медицинской точки зрения смещения относительно используемой основы для сравнения высшего порядка, и поэтому оценка смещения лабораторией конечного пользователя и последующая оценка ubjas требуются редко. Если медицинской лаборатории конечного пользователя требуется дополнительная поправка на смещение, то неопределенность поправки на смещение ubias следует объединить с оценкой производителя иса1 перед вычислением и(у) (см. 6.6, С.6 примечания 5, 6 и 8).
с Неопределенность значения, приписанного калибратору конечного пользователя: производители калибраторов должны предоставлять свои оценки иса1 конечным пользователям по запросу.
d Вычисление долговременной непрецизионности uRw. краткосрочные оценки непрецизионности измерительной системы могут недооценить и, поскольку требуемая информация может отсутствовать. Долговременные оценки непрецизионности на основе данных IQC, собранных при существенных изменениях в условиях измерения, обычно являются более полными. Время, необходимое для сбора достаточного количества данных, в основном зависит от конкретных факторов измерительной системы, таких как частота измерений, частота калибровки, частота смены партий реагентов и калибраторов, от срока годности расходных материалов, переменных условий окружающей среды, а также от процедуры технического обслуживания оборудования (см. 5.3).
Рисунок 1 — Процесс оценивания неопределенности измерения для типовой измерительной системы диагностики in vitro, лист 1
12
ГОСТ Р 70413—2022
е Верификация смещения измерения: лаборатория должна гарантировать, что величина смещения любого измерения не превышает установленные требования для применения в медицинской сфере. Для этой цели часто используют внешнюю оценку качества (EQA), но следует проявлять осторожность. В дополнение к учету коммутативности материала EQA целевое значение EQA может быть смещенным в зависимости от того, каким образом значение присваивают материалу. Если возникает неуверенность относительно достоверности смещения, наблюдаемого для материала EQA, лаборатории необходимо рассмотреть возможность оценки смещения на биологических пробах.
f Поправка на смещение: появление неприемлемого с медицинской точки зрения смещения может быть обнаружено с помощью наблюдения EQA при условии, что схемы EQA удовлетворяют некоторым обязательным требованиям, как описано в [20], [21]. Если решение со стороны производителя отсутствует, то лаборатория может ввести поправочный коэффициент. В этом случае необходимо оценить неопределенность поправочного коэффициента ubias и включить в вычисление и(у). Использование поправочных коэффициентов на смещение не разрешено некоторыми национальными правилами.
9 Вычисление MU итогового результата и(у); смещение в требуемых пределах: данное вычисление учитывает неопределенность значения, приписанного калибратору, иса/и долговременную прецизионность uRw.
h Вычисление MU итогового результата и(у); смещение превышает требуемые пределы: данное вычисление учитывает неопределенность значения, приписанного калибратору, иса1, долговременную прецизионность uRw и неопределенности любой поправки на смещение ubias, представленной медицинской лабораторией конечного пользователя.
' Результаты клинических образцов: обычной практикой является расширение и путем ее умножения на коэффициент охвата к, равный 2, для того, чтобы получить расширенную неопределенность U с уровнем доверия, приблизительно равным 95 %, сопровождая результаты клинического образца. Регулярно сообщать практикующим врачам о неопределенностях вместе с результатами не требуется, но они должны быть доступны по запросу (см. 5.4.6).
Рисунок 1, лист 2
5.2 Максимально допускаемая неопределенность измерения
Величина MU должна соответствовать результату, который будет использован при принятии медицинского решения, и в идеале должна быть минимальной, насколько это технически возможно. Для данной измерительной системы оценивание расширенной неопределенности полученных результатов имеет предельно ограниченное значение, если ее недопустимо сравнивать с верхним пределом допустимой расширенной неопределенности, основанной на требованиях к качеству результатов, необходимых для медицинского использования.
Такие пределы должны быть основаны на моделях, определенных конференцией по достижению консенсуса Европейской федерации клинической химии и лабораторной медицины (EFLM) в 2014 г. [22], включая модели, основанные на исследованиях клинических результатов, на выбранной доле биологических вариаций или при недостаточности информации, полученной от первых двух моделей, на современной методике измерения. Указанный подход определен такими факторами, как биологическое поведение измеряемой величины, медицинское применение результатов и аналитические характеристики доступных методик измерения. Если методика измерения превышает верхний допустимый предел неопределенности, можно уменьшить неопределенность путем определения и изменения этапа, который вносит относительно большой вклад в общую неопределенность результатов. Если неопределенность не может быть уменьшена в достаточной степени, необходимо принять решение о том, следует ли изменить методику измерения или пересмотреть установленные требования к качеству.
В лаборатории выбирают значение для максимально допускаемой MU, и ее обоснование является частью составления отчета MU для методики измерения.
5.3 Источники неопределенности измерения
Для каждой методики измерения следует определить момент, начиная с которого должна быть проведена оценка неопределенности. Как правило, это процесс измерения материалов IQC. Если процедура требует предварительной подготовки образца перед измерением и материалы ЮС также проходят эту стадию, в лаборатории должны подтвердить, что клинические образцы и материалы IQC ведут себя одинаково. Если материал ЮС не проходит данный этап или подвергается этапу подготовки образца перед измерением, но реагирует иначе, чем клинические образцы, лаборатории следует разработать процедуру оценки типичной неопределенности, связанной с процессом подготовки образцов, и объединить его с неопределенностью этапа измерения.
Источники неопределенности могут возникать из-за мешающих веществ, которые изменяют взаимодействие аналита с измерительной системой, и/или сигнала, генерируемого в процессе измерения. Примеры включают антитела пациента к аналиту или реагенту, спектрофотометрическую интерференцию свободного гемоглобина или перекрестную реактивность структурно связанных молекул. Эти источники неопределенности «до измерения» обычно индивидуальны для каждого конкретного образца и не включаются в оценку MU для типичных клинических образцов.
13
ГОСТ Р 70413—2022
Распространенными источниками неопределенности являются:
- неоднородность образца;
- процедуры восстановления лиофилизированных материалов, например калибратор и реагенты;
- неопределенность значений калибратора, повторной калибровки;
- оборудование, например, вызывающее электромеханические колебания, обслуживание, замена деталей;
- нестабильность реагента и калибратора;
- изменчивость реагента и калибратора от партии к партии;
- изменение лабораторных условий;
- смещение, обусловленное оператором, при считывании показаний аналоговых приборов;
- изменчивость для ручных и полуавтоматических методов, обусловленная человеческим фактором;
- смещение в сравнении с принятой схемой иерархии калибровки;
- формулы измерения, например аппроксимации, а также предположения, неточные значения констант, округление цифр;
- более одной системы измерения для одной и той же измеряемой величины;
- более одной методики измерения для одной и той же измеряемой величины, которая может иметь разные аналитические характеристики.
Для большинства измерительных систем в медицинских лабораториях наиболее значительный вклад неопределенности в общую MU фиксируют посредством:
- данных о долговременной непрецизионности, полученных для материалов IQC за период, достаточный для включения всех изменений условий измерения uRw;
- неопределенности значений калибратора конечного пользователя иса/, которая может быть предоставлена производителем или установлена лабораторией, которая разрабатывает собственную измерительную систему.
Время от времени значимое с медицинской точки зрения смещение может быть скорректировано (если это разрешено национальными правилами), и в этом случае необходимо учитывать неопределенность применяемого поправочного коэффициента ubias. Руководство по учету неопределенности, связанной с поправкой на смещение, приведено в 6.6, С.5 и С.6.
Настоящий стандарт не предназначен для описания рекомендаций по выполнению исчерпывающего учета всех возможных неопределенностей. Основное внимание уделено прогнозируемым источникам MU для измерительных систем, используемых в медицинских лабораториях, с целью предоставить практические оценки MU, гарантирующие пригодность результатов пациента для последующего применения в медицине. Запись неопределенностей, применяемых к полученным результатам от каждого использования измерительной системы, должна поддерживаться медицинскими лабораториями, включая источники данных, предположения и статистические процессы, используемые в расчетах, максимально допускаемые MU и общие действия, которые необходимо предпринять, если максимально допускаемая MU превышена (см. 5.2).
5.4 Выражение неопределенности измерения
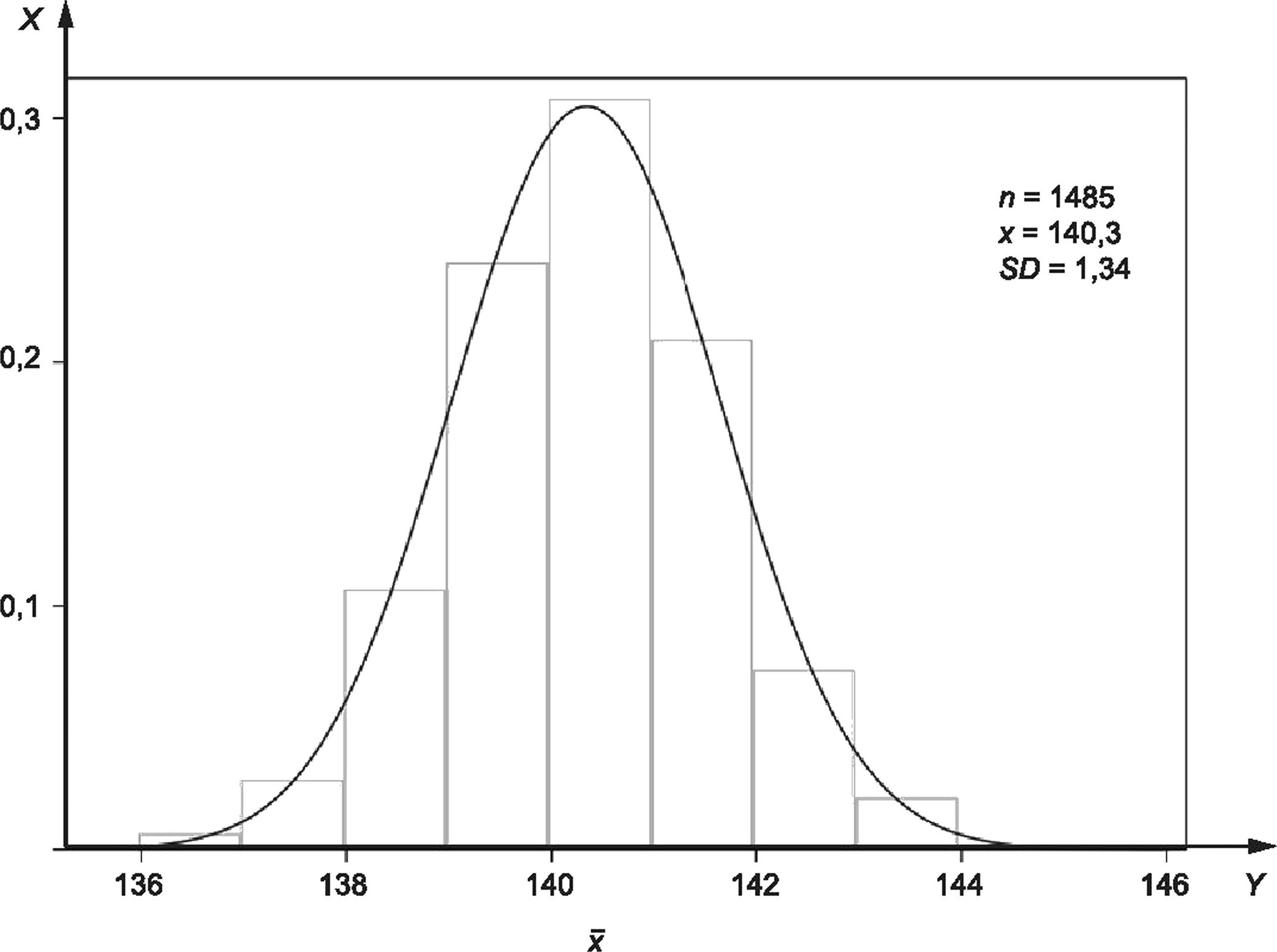
На рисунке 2 представлена гистограмма 1485 последовательных зарегистрированных значений концентрации ионов натрия в сыворотке, измеренных в материале внутреннего контроля качества ЮС, исследуемых в одной лаборатории с использованием единой системы измерения в течение периода времени, достаточного для включения всех ожидаемых рутинных изменений в условия измерения. Рассчитанное среднее от полученных значений (х = 140,3 ммоль/л) считают наилучшей доступной оценкой измеряемой величины (молярная концентрация ионов натрия) в данном материале ЮС. Все записанные индивидуальные значения ЮС представляют собой возможные значения измеряемой величины в данном материале, но с меньшей вероятностью, чем вычисленное х.
Когда данные повторяемости или долговременной прецизионности для тщательно контролируемой процедуры измерения отражаются на гистограмме, как показано на рисунке 2, разброс значений близок к Гауссову распределению (нормальный). При Гауссовом распределении данных величина дисперсии значений вокруг среднего значения х может быть количественно определена путем вычисления стандартного отклонения SD, в данном случае ±1,34 ммоль/л. Стандартное отклонение, полученное из таких данных долговременной прецизионности, называют стандартной неопределенностью и, чтобы отличать SD от других вариантов его использования. Если данные получены за период, достаточный для включения всех рутинных изменений условий измерения, стандартная неопределенность и обозначается как uRw или стандартная неопределенность во внутрилабораторных условиях.
14
ГОСТ Р 70413—2022
uRw(^ SD)
x±U, к=2 («95 %-ный уровень доверия)
X — частота; Y — натрий, ммоль/л
Рисунок 2 — Частота представленных значений измеряемой величины (концентрация ионов натрия в сыворотке, ммоль/л) в материале внутреннего контроля качества IQC
Стандартная неопределенность и всегда является положительным значением и имеет такие же единицы измерения, как и измеряемая величина. Когда она относится к результату измерения, то имеет знак «±» для определения интервала возможных представленных значений измеряемой величины с заданным уровнем доверия. Интервал (х ± uRw) определяет диапазон возможных значений измеряемой величины, распределенных вокруг среднего значения, включая приблизительно 68 % возможных значений измеряемой величины. Стандартная неопределенность и может быть умножена на коэффициент охвата к, обычно равный 2 для получения расширенной неопределенности U. Таким образом, (х ± U) обеспечивает интервал охвата, который включает примерно 95 % возможных значений измеряемой величины в данном материале IQC при указанной измерительной системе.
SD может быть выражено в процентах относительно среднего значения в виде коэффициента вариации (%С0. На практике также стандартную неопределенность и выражают в процентах по отношению к среднему значению (%иге/) и расширенную неопределенность U — как процент относительной расширенной неопределенности (%Ure/).
Неопределенность методики измерения обусловлена количеством значащих цифр в представленных значениях измеряемой величины. Неопределенность методики измерения должна соответствовать медицинским требованиям. Во всех случаях количество значащих цифр в сообщаемых значениях для данной методики измерения не должно подразумевать неопределенность меньшую, чем гарантируется неопределенностью методики измерения.
При выполнении статистических вычислений, таких как оценивание неопределенности измерения, часто возникает необходимость в округлении числа, поскольку может быть практически невозможным записать все числа, вычисленные до последней имеющейся цифры. Для того чтобы упростить
15
ГОСТ Р 70413—2022
представление, статистические серии часто округляют, чтобы сделать информацию более понятной и сопоставимой с другими данными. В данном контексте округление данных допустимо при условии, что сохраняется требуемый уровень точности, а также устанавливается и последовательно применяется свод правил округления.
При выполнении ряда последовательных вычислений, что характерно для оценки стандартной неопределенности измерения, расширенной неопределенности и относительной неопределенности, округление следует выполнять только для окончательных вычисленных оценок, а не для промежуточных вычисленных значений, которые используют для последующих и окончательных вычислений.
Для упрощения представления данных специалисты по биостатистике рекомендуют соблюдать нижеприведенные правила в отношении представления значащих цифр [23].
а) При вычислении среднего значения используют только количество десятичных знаков в окончательном установленном значении плюс одну дополнительную десятичную цифру.
Пример — Приведенные значения (концентрации ионов натрия в сыворотке) для пяти повторных определений одного и того же образца приведены только целыми числами, такими как 122, 123, 124, 122, 125. Расчетное среднее значение (п = 5) равно 123,2 (т. е. среднее значение приводят на одну значащую цифру больше, чем отдельные сообщаемые значения).
Ь) Для отчетности о вычисленных SD используют количество десятичных знаков в сообщаемых значениях «плюс» два. Для %CV достаточно одного десятичного знака (например, 3,1 %).
Существует три общепринятых подхода, применяемых к округлению данных [24] и включающих нижеприведенные варианты.
Вариант А (четный/нечетный метод) позволяет избежать смещения средних значений в долговременной перспективе.
Пример 1 — 1,35 округлено до 1,4; 1,25 округлено до 1,2.
Вариант В (компьютерная/автоматизированная таблица, например Microsoft Excel).
Самая правая цифра, подлежащая округлению, не изменяется, если за ней следует цифра менее 5. Если за самой правой цифрой, подлежащей округлению, следует цифра более или равная 5, она увеличивается на единицу. Этот подход также известен как обычное округление.
Пример 2 — 1,25 округлено до 1,3; 1,35 округлено до 1,4; 1,23 округлено до 1,2.
Вариант С (метод округления) — наиболее консервативный подход; имеет преимущества для оценивания соответствия неопределенностей максимально допускаемым погрешностям, допускам или оценкам риска.
Пример 3 — 1,23 округлено до 1,3.
Так как большинство медицинских лабораторий, вероятнее всего, будут использовать автоматизированные электронные таблицы для выполнения видов вычислений, описанных в настоящем стандарте, рекомендуется, чтобы в лабораториях руководствовались вариантом В в качестве выбранного правила округления при вычислении неопределенности измерения. Независимо от того, какой вариант округления выбран, в каждой лаборатории должны задокументировать метод округления данных, который использован для выполнения вычислений оцененных неопределенностей измерений.
Пример 4 — Для данных частот IQC, показанных на рисунке 2, измерительная система представляет значения в виде целых чисел с тремя значащими цифрами и без десятичных знаков; применяемыми единицами являются миллимоли в литрах. Среднее арифметическое (натрий) 1485 последовательных представленных значений составляет 140,3 ммоль/л. Исходя из этих данных и для натрия составляет 1,34 ммоль/л. Таким образом, при коэффициенте охвата к = 2 расширенная неопределенность U составляет два раза по 1,34 ммоль/л или 2,68 ммоль/л. Интервал охвата (x±U) составляет от (140,3 - 2,68) ммоль/л до (140,3 + 2,68) ммоль/л; или (х±Ц) = от 137,62 до 142,98 ммоль/л.
Так как для оценки расширенной неопределенности применен коэффициент охвата к = 2, истинное среднее значение находится в интервале от 137,62 до 142,98 ммоль/л с 95 %-ным уровнем доверия.
С учетом округления до одной значащей цифры справа от десятичной точки 95 %-ный интервал охвата для точной записи содержания натрия в клинических образцах следует изменить — с 137,6 до 143,0 ммоль/л. Или, признавая, что сообщаемые значения сывороточного натрия предоставлены измерительной системой только с тремя значащими цифрами и без десятичных знаков, интервал охвата ~ 95 % для описания общей точности сообщаемого значения натрия сыворотки с указанной системой измерения может быть округлен (согласно правилам округления варианта В, как указано выше) до 138—143 ммоль/л.
16
ГОСТ Р 70413—2022
Вместо 95 %-ного интервала охвата как диапазона абсолютных значений, интервал охвата может быть представлен как относительная расширенная неопределенность в процентах (7oUrel). Используя абсолютное значение расширенной неопределенности (2,68 ммоль/л) на основе к - 2 и среднее значение для материала IQC (140,3 ммоль/л), %UomH вычисляют по формуле
%Urel = (URw/x) ■ 100 = [(2,68 ммоль/л)/(140,3 ммоль/л)] ■ 100 = 1,91 % (округляется до 1,9 %) или, x±%Urel = x±1,9%, к = 2, ~95 %-ный уровень доверия.
При этом рекомендуется, чтобы во все представления данных, в которых округление данных может привести к расхождениям между вычислениями, выполняемыми с округлением и без него, было включено пояснение [25].
Пример (пояснение) — Округление данных: цифры, представленные в таблицах, округлены, в связи с чем могут возникать расхождения между суммами компонентов и итоговыми значениями. Все проценты рассчитаны с использованием неокругленных цифр.
5.5 Использование относительной стандартной неопределенности для вычисления оценок неопределенности
Неопределенность может быть оценена с использованием абсолютного SD(u), относительного стандартного отклонения (urei) или %Cv(%urel) значений IQC при конкретной концентрации. Выбор между %СуИли SD обусловлен информацией о неопределенности, необходимой для определения конкретного результата испытания.
Относительные неопределенности следует применять, если:
а) %Су приблизительно постоянен на значительной части интервала измерения, то оцененная MU может быть экстраполирована на все концентрации в данной части интервала измерения (см. А.8);
Ь) вычисляют измеряемую величину, то результат и составляющие вычисления складывают или вычитают (см. А.2.4, правило 2, примеры 1 и 2).
Так как MU может быть оценена только при концентрациях, при которых доступны значения ЮС, экстраполяция имеющихся оценок MU на другие концентрации требует предположения, что неопределенность или относительная неопределенность приблизительно постоянны на всем измерительном интервале или на его части. Для построения профиля прецизионности может быть необходимо дополнить рутинные ЮС образцы дополнительными ЮС образцами при других концентрациях для нахождения оценок %Су или SD по всему измерительному интервалу.
Имея данные, достаточные для построения профиля прецизионности для измерительной системы, вопрос о том, являются ли %Су или SD постоянными на всем интервале концентрации, может быть оценен при использовании одного из двух возможных методов. В методе по перечислению а) данные сличения могут быть нанесены на график с использованием разностей, как описано в [12]. В методе по перечислению Ь) данные исследования непрецизионности могут быть использованы для создания профиля прецизионности, как описано в [12].
5.6 Отчет о неопределенности измерения
Оценки MU предусматривают количественные показатели надежности результатов для клинических образцов, основанных на доступной информации. Результаты MU, как правило, не предоставляют с результатами анализов пациента, но информация о MU должна быть доступна пользователям лаборатории по запросу. В некоторых случаях для лаборатории может быть важно сообщить степень MU, связанную с результатом медицинского исследования.
6 Шаги по оцениванию неопределенности значений измеряемых величин
6.1 Определение измеряемой величины
Для определения измеряемой величины необходимы по крайней мере три части информации:
- система, содержащая аналит, например цельная венозная кровь, моча, эритроциты, почечный камень;
- идентификация аналита, например: антитела к краснухе, дигоксин, субъединица хорионического гонадотропина человека, РНК ВИЧ-1, тринуклеотид CCG;
- величина, например: молярная концентрация, число, массовая концентрация, счетная концентрация, числовая доля, количество вещества, уровень молярной концентрации.
Примером измеряемой величины является счетная концентрация лейкоцитов в цельной венозной крови. Дополнительные примеры определений измеряемых величин приведены в таблице 1.
17
Таблица 1 — Пример определений измеряемых величин с ключевыми элементами
Биологическая система | Аналит | Величина | Наименование измеряемой величины | Единица измерения |
Сыворотка | Аланинаминотрансфераза | Концентрация каталитической активности | Концентрация каталитической активности аланинаминотрансферазы в сыворотке крови; X Pty.Ltd методика измерения | мккат/л |
Артериальная кровь | Ион кальция (свободный) | Молярная концентрация | Молярная концентрации ионов кальция при pH 7,40 в артериальной крови; X Pty. Ltd. Электрод для анализатора газов крови с ионами кальция | ммоль/л |
Моча | Кальций | Молярная концентрация | Количество кальция в суточном сборе мочи; X Pty.Ltd методика измерения общего кальция | ммоль/л (условная единица: моль/24 ч) |
Ткань печени | Железо | Масса | Массовая доля железа в сухой массе ткани печени; валидированная внутренняя методика измерения | мкг/г |
Сыворотка | Парапротеин IgG | Массовая концентрация | Массовая концентрация парапротеинов IgG в сыворотке, определенная с помощью электрофореза в агарозном геле. Методика измерения X Pty.Ltd | г/л |
Сыворотка | Специфические IgE к авокадо | Активность | Активность авокадо-специфического IgE в сыворотке крови (XYZ IRP 76/50) X Pty.Ltd методика измерения | кЕдА/л |
Сыворотка | Антитела к вирусу краснухи (IgG) | Активность антител IgG в сыворотке крови к антигену вируса краснухи | Активность антител IgG в сыворотке крови к антигену вируса краснухи. X Pty Ltd. Методика измерений | кЕд/л |
Плазма | HIV-1 | Счетная концентрация | Концентрация РНК ВИЧ-1 в плазме; X Pty.Ltd методика измерения | копий/мл |
Общий анализ мочи | Лейкоциты | Счетная концентрация | Счетная концентрация лейкоцитов в моче; вну-трилабораторная ручная методика № 39 | клеток/мкл |
Венозная кровь | CD4 положительные клетки | Счетная концентрация | Счетная концентрация CD4 клеток в венозной крови; внутрилабораторная проточная цитометрия (см. руководство по методу) | клеток/л |
Костный мозг | В-лимфоциты (незрелые) | Число | Доля незрелых В-лимфоцитов в костном мозге; внутрилабораторная проточная цитометрия (см. руководство по методу) | Безразмерный |
ГОСТ Р 70413—2022
со
Окончание таблицы 1
Биологическая система | Аналит | Величина | Наименование измеряемой величины | Единица измерения |
Венозная кровь | Гемоглобин | Массовая концентрация | Концентрация гемоглобина в венозной крови; X Pty.Ltd методика измерения | г/л |
Плазма | Биологическая активность факторов свертывания VII, X, V, II, фибриногена | Международное нормализованное отношение (INR) | Индуцированное тканевым фактором относительное время образования сгустка в цитратной плазме; X Pty.Ltd методика измерения | Безразмерная |
Материнская цельная кровь | Эритроциты плода | Число | Доля эритроцитов плода в цельной венозной крови матери. Тест на разведение кислоты; вну-трилабораторная проточная цитометрия | Безразмерная |
ГОСТ Р 70413—2022
ГОСТ Р 70413—2022
Биологические аналиты могут быть сложными (изоформы, фрагменты), поэтому определение измеряемой величины может также зависеть от конкретной применяемой методики измерения. Например, на концентрацию каталитической активности сывороточного фермента влияют изменения температуры, pH и кофакторов, используемых при измерении. В таких случаях идентификация методики измерения должна быть включена в определение измеряемой величины.
Пример 1 — Таблица 1: фермент сыворотки — аланинаминотрансфераза: концентрация каталитической активности по референтной методике измерения IFCC.
Пример 2 — Таблица 1: сывороточный парапротеин IgG: производитель набора реагентов Y.
Другим примером является разная селективность антител к эпитопам, используемым в различных коммерческих методиках измерения для измерения одного и того же гликопротеинового гормона, например: разные антитела могут распознавать разные изоформы или связывать их в разной степени. Различия в измеряемой величине могут быть зафиксированы путем указания конкретной используемой методики измерения, в частности онкомаркер X, измеренный по методике производителя Y.
Хотя это не является частью формального определения измеряемой величины, как правило, принято указывать единицу измерения.
6.2 Прецизионность измерения
В теории, условия измерений должны всегда оставаться постоянными, но на практике изменения неизбежны. Внутрилабораторная непрецизионность в течение периода, достаточного для учета большинства изменений в условиях измерения uRvv, в большинстве случаев вносит наибольший вклад в неопределенность результатов измерений.
Материалы IQC, по возможности, должны быть использованы для сбора данных о непрецизионности. Применение данных EQA для вычисления uRw не рекомендовано в связи с относительно небольшим числом значений, которые можно получить в типичном цикле EQA. Протоколы IQC фиксируют намного больше значений и более широкий диапазон событий неопределенности для того, чтобы меньше событий неопределенности было упущено, особенно при тестировании с большой нагрузкой. Данные IQC должны быть собраны в течение достаточно длительного интервала времени для отражения наиболее значимых источников вариабельности, отраженных в 5.3. В дополнение данные IQC должны быть разделены и обработаны по отдельности во избежание включения вариабельности, которая влияет только на результаты IQC и не отражает типичную ожидаемую вариабельность результатов для биологических проб.
Как правило, предполагается, что для данной методики измерений величина непрецизионности одинаковая как для IQC, так и для типичных биологических образцов. Таким образом, стандартную неопределенность, вычисленную для материалов IQC, считают применимой к биологическим образцам с аналогичными измеренными значениями. Данное предположение должно быть подтверждено путем проведения исследования прецизионности репрезентативных клинических образцов и соответствующего(их) материала(ов) IQC и сравнения их дисперсий (F-тест). Если статистически значимые различия не обнаружены, то их эквивалентность подтверждена. Рекомендовано использование материалов ЮС для оценивания долговременной непрецизионности.
Следует также внимательно рассмотреть предположение о том, что ЮС и типичные клинические образцы ведут себя одинаково в отношении прецизионности измерения, когда этап предварительной обработки требуется только для клинических образцов, а не для материалов ЮС, например: исследования гемоглобина А1с, при которых клинические образцы требуют гемолиза, а материал ЮС может быть предоставлен в виде гемолизата.
Примечание 1 — MU с большей достоверностью оценивают с использованием материалов IQC со средними значениями измеряемой величины, близкими к пределам принятия значимых медицинских решений.
Примечание 2 — Вычисление MU с использованием только данных IQC выполняют, когда измерительная система соответствует аналитическим критериям эффективности. Данные IQC, полученные в условиях технической ошибки или отклонения от SOP, необходимо исключить.
Примечание 3 — Для мониторинга прецизионности в пределах диапазона измерений могут быть использованы IQC более одного уровня, в таком случае неопределенность для каждого уровня необходимо вычислять и сравнивать для принятия решения о том, являются ли неопределенности по сути одинаковыми в пределах диапазона измерений или разными, чтобы их можно было применить только к интервалу результатов, отслеживаемых каждым уровнем концентрации IQC. Относительная неопределенность иге/ может лучше согласовываться в интервалах концентраций, чем абсолютная неопределенность и.
Примечание 4 — Растворение лиофилизированного материала IQC вносит ложный вклад в оценку MU. Лаборатории следует внедрять соответствующие процедуры для минимизации этого вклада неопределенности. 20
ГОСТ Р 70413—2022
Дополнительные признаки, которые следует учитывать при выборе подходящих материалов IQC для оценки uRw, включают, но не ограничиваются:
- материалом, предпочтительно предоставленным третьей стороной (т. е. отличным от материала, используемого для проверки настройки измерительной системы);
- материалом, который имеет значительное сходство с подлинными клиническими образцами (например, коммутативный материал);
- материалом(ами) с молярной концентрацией (концентрации измеряемой величины), подходящей для предполагаемого медицинского применения аналита.
6.3 Влияние реагента и изменений в партии внутреннего контроля качества на оценивание неопределенности
Предположение, что клинические образцы и материалы IQC ведут себя одинаково в измерительной системе с каждой различной партией реагентов, не всегда является достоверным. Различия обычно вызваны изменениями в матрично-связанном влиянии ЮС с различными наборами реагентов, которые не наблюдаются у клинических образцов [27]. В дополнение, различные наборы ЮС, обусловленные процессами производства ЮС, могут иметь разное количество измеряемой величины.
Смена партии как материалов ЮС, так и реагента, вызывающая значительный сдвиг в абсолютных значениях ЮС без соответствующего изменения результатов в клинических образцах, может привести к переоценке MU, не применимой к клиническим образцам. В этом случае переоценивание происходит, если значения ЮС, найденные до или после такого количества изменений, обрабатывают в качестве одиночного набора данных для вычисления uRw. В данном случае значения ЮС, найденные ранее и полученные после такого набора изменений, должны быть собраны независимо и uRw должна быть вычислена отдельно для каждого значения ЮС, и, только если они оценены как совместные, они могут быть объединены для нахождения общей uRw (см. А.З). Поэтому следует продемонстрировать, что и ЮС, и результаты клинических образцов ведут себя одинаково после смены партии реагента. Дальнейшее руководство по верификации результатов анализа клинических образцов после изменения партий реагентов приведено в [10] и [14].
MU обычно оценивают для прецизионности:
- в условиях повторяемости ur при проведении верификации аналитических характеристик, заявляемых производителем IVD, или валидации характеристик для измерительной системы, разработанной в лаборатории, и документируют наименьшую неопределенность, достигаемую для измерительной системы при ее эксплуатации в лаборатории (см. А.2.3). Эта неопределенность является недооцененной для фактических MU, ожидаемых при ежедневном или регулярном использовании измерительной системы;
- поддерживаемой внутри лаборатории за период времени, достаточный для того, чтобы включить большую часть изменений условий измерения uRw, также называемой долговременной прецизионностью. Такая неопределенность будет подходящей оценкой неопределенности, ожидаемой при ежедневном или регулярном использовании измерительной системы. Может потребоваться некоторое время, чтобы накопить достаточное количество данных ЮС, чтобы зафиксировать влияние неопределенности от большинства изменений в условиях измерения. В таких случаях уместны промежуточные оценки, но они потребуют повторного расчета по мере появления дополнительных данных (см. А.2.2).
6.4 Использование лабораториями нескольких измерительных систем для одной и той же измеряемой величины
Лаборатория, работающая под большой нагрузкой, может использовать более одной измерительной системы одного типа для одной и той же измеряемой величины, то есть клинические образцы человека могут быть проанализированы любой из этих систем. Целесообразно оценить среднюю и, которая может быть применима к результатам независимо от используемой системы измерения. Для данной цели и^^ должна быть оценена независимо для каждой измерительной системы, а после может быть рассчитано объединенное среднее значение (см. А.З). Значимое с медицинской точки зрения систематическое смещение в результатах клинических образцов между несколькими измерительными системами должно быть устранено, а неопределенность среднего остаточного смещения должна быть объединена с неопределенностью непрецизионности (см. С.6, а также С.5 и С.6).
21
ГОСТ Р 70413—2022
6.5 Неопределенность значений калибратора конечного пользователя ucat
Значения калибратора конечного пользователя имеют неопределенность иса/, поскольку их определение требует использования методик измерений (см. С.4). Значения для иса/должны быть доступны по запросу от производителя в области in vitro диагностики IVD. Если лаборатория является производителем IVD, она несет ответственность за определение иса/.
Если производитель предоставляет значение для иса1, то оно должно быть суммой всех неопределенностей, предложенных выбранной калибровочной иерархией для измеряемой величины, начиная с наивысшей доступной основы (калибратора или методики измерений) до значения, приписанного калибратору для медицинского оборудования конечного пользователя IVD.
Замена партии калибратора медицинского устройства IVD может систематически изменять средние значения ЮС из-за вариабельности от партии к партии значения, приписанного калибратору, что приводит к увеличению суммарной MU, которая должна быть зафиксирована с помощью uRw. Как правило, значения, полученные для клинических образцов, аналогичным образом изменяются при замене партии калибраторов для медицинских устройств IVD, что приводит к изменению значений IQC. иса/, представленная производителем, обычно не включает в себя вариабельность от партии к партии, как следствие, значения ЮС, полученные до и после нескольких замен партии калибратора, должны быть обработаны в качестве одного набора данных для подтверждения того, что оценка uRw включает составляющую неопределенности калибратора «от партии к партии». В некоторых случаях единичный набор калибратора может быть использован для расширенного временного интервала и первоначальной оценки l/^ для методики измерения, основанной на доступных данных ЮС без учета смены партии калибратора. В таких случаях значение uRw может быть недооценено и должно быть пересмотрено после одной или более замен партии калибратора, в которых отражены аналогично смещенные результаты для клинических образцов.
Примечание 1 — Если вариабельность калибратора от партии к партии включена в значение иса/, предоставленное производителем, тогда MU может быть вычислена по примеру А.З.
Примечание 2 — Для некоторых калибраторов комплексная оценка иса/ технически недоступна. В частности, некоторые международные биологические стандартные образцы охарактеризованы определенной биологической активностью, а их приписанные значения выражены в произвольных единицах измерения, например в Международных единицах (IU) без заявленной неопределенности, которые могут привести к недооцениванию применяемых MU.
6.6 Смещение (при измерении)
Производители IVD несут ответственность за то, чтобы их методики измерения для конечных пользователей демонстрировали минимальное, приемлемое с медицинской точки зрения смещение относительно соответствующего эталона. Лаборатории должны регулярно отслеживать смещение измерений, по возможности участвуя в соответствующей схеме EQA [21].
Следует учитывать, как результаты используют с медицинской точки зрения для данной измеряемой величины, так как это может помочь определить, насколько всеобъемлющими должны быть оценки MU. Если результаты предназначены для мониторинга изменений у отдельного человека с течением времени или интерпретируются относительно установленных в лаборатории опорных интервалов, то поправка на смещение может быть излишней для соответствующей медицинской интерпретации. Если результаты интерпретируются относительно установленных извне биологических образцов сравнения или пределов принятия решений, то устранение значимого с медицинской точки зрения смещения является существенным для обеспечения надлежащей медицинской интерпретации.
Любая вариабельность результата из-за небольших изменений смещения, которая может возникнуть в лабораторных условиях с течением времени, будет зафиксирована uRw. Если текущая EQA указывает на появление значимого с медицинской точки зрения смещения, производитель IVD или лаборатория в случае разработанных лабораторией методик измерения должны принять немедленные корректирующие меры. Если производитель не может исправить неприемлемое смещение, лаборатория может, если это разрешено национальным законодательством, управлять таким смещением путем применения поправочного коэффициента к результатам или путем повторного присвоения значения калибратора. Поправка на смещение по сути своей несовершенна, потому что оценки значения смещения имеют неопределенность ubias. Когда лаборатория вводит поправку на значимое с медицинской точки зрения смещение, лаборатория должна оценивать и учитывать ubias при оценке и(у). Данное обстоятельство рассмотрено в С.5 и С.6.
22
ГОСТ Р 70413—2022
Примечание — Некоторые национальные правила требуют, чтобы методики измерений были выполнены точно в соответствии с инструкциями производителя и, таким образом, могут запрещать корректировку значений калибратора конечного пользователя или использование поправочных коэффициентов с целью устранения значимого с медицинской точки зрения смещения.
6.7 Обзор процесса оценивания неопределенности измерения
Объединение понятий, представленных в 6.1—6.6, обеспечивает пошаговую процедуру оценивания MU, как показано на рисунке 3.
6.8 Повторная оценка неопределенности измерения
Помимо обновления промежуточных оценок отсутствует и необходимость повторно оценивать MU, если показатели IQC и EQA остаются в пределах спецификаций. Повторная оценка MU должна быть предпринята, если произошли значительные изменения в измерительной системе или введена новая методика измерения.
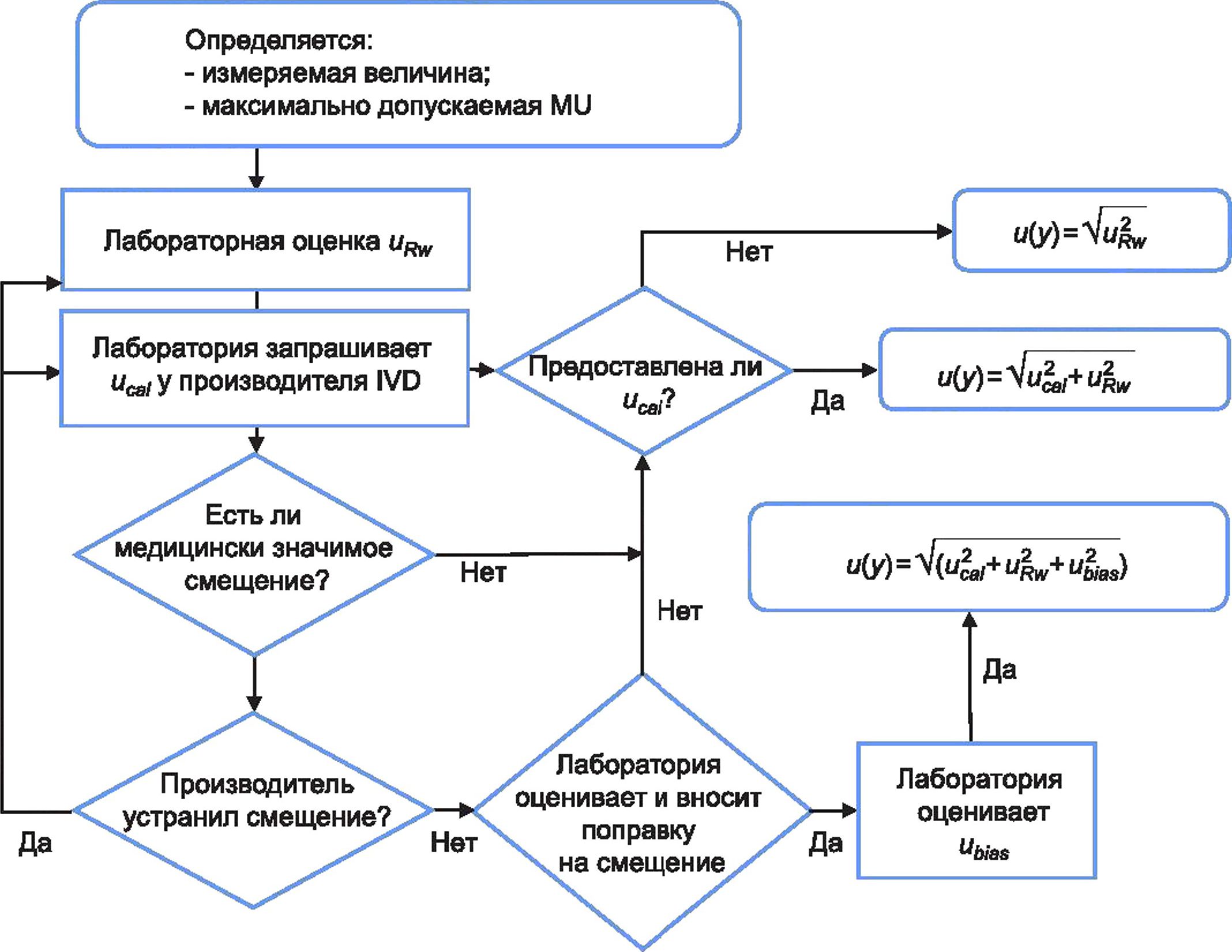
Рисунок 3 — Типичный способ оценки неопределенности измерения
6.9 Качественные результаты, основанные на численных результатах
Некоторые методики измерения включают этап измерения, который выдает измеренное значение, сравниваемое с пороговым значением, результат которого представлен в виде текста, например: скорость образования флуоресцентного продукта биологическим образцом человека по сравнению с показателем индекса калибратора, выраженного в виде отношения, для определения того, является ли образец положительным или отрицательным по поверхностному антигену гепатита В в сыворотке. Для оценки непрецизионности uRw шага измерения выходные данные, сгенерированные соответствующим IQC, обрабатывают точно так же, как и описано для тех процедур, которые обеспечивают количественные результаты. Рассчитанные расширенные неопределенности могут быть использованы для определения зон неопределенности вокруг отрицательных/положительных пороговых значений, например отрицательное, вероятно отрицательное, вероятно положительное, положительное. В этих случаях оценка неопределенности при значениях измерительного сигнала, отличных от тех, которые близки к пределам принятия решения, не требуется.
23
ГОСТ Р 70413—2022
6.10 Неопределенность подсчета единиц
Подсчет объектов — это измерение (см. [9], 2.1, примечание 2). Таким образом, следует оценивать MU, связанную с подсчетом объектов, например счетную концентрацию отдельных типов клеток крови в объеме крови, количество тканевых клеток на количество образца.
Пример — Если микроскоп со счетной камерой используют для ручного выполнения дифференциального подсчета лейкоцитов в окрашенном мазке крови, полученные подсчеты могут соответствовать распределению Пуассона, а не Гаусса, если клетки данного типа составляют малую долю (обычно <10 %) от общего числа пересчитанных клеток. В подобных случаях пересчитанные клетки случайным образом распределяются по счетным квадратам, поэтому предполагается, что каждый подсчет определенного типа клеток происходит случайным образом в пространстве и во времени и отсутствует их взаимодействие друг с другом, например агрегация. Для распределения Пуассона дисперсия подсчета равна количеству, следовательно, SD = ^count.
6.11 Ограничения оценок неопределенности измерений
Значение оцененной MU и(у) для результатов, полученных с помощью данной измерительной системы, может быть недооценена из-за неполной информации. Известно, что заниженная величина и(у) может быть использована для сравнения результатов, полученных с помощью этой конкретной измерительной системы, но не для сравнения результатов, полученных разными измерительными системами для одной и той же измеряемой величины.
24
ГОСТ Р 70413—2022
Приложение А (справочное)
Примеры оценивания неопределенности измерения
А.1 Введение
Следующие примеры оценивания неопределенности измерения (MU) для методик измерений медицинские лаборатории, как правило, применены по целому ряду медицинских лабораторных дисциплин и представлены в настоящем стандарте, потому что они иллюстрируют наиболее часто встречающиеся вопросы, возникающие при выполнении расчетов по оценке неопределенности измерения в медицинских лабораториях. Приведенные примеры не предназначены и не могут в рамках настоящего стандарта обеспечить всесторонний обзор расчетов MU по всему спектру медицинских лабораторных дисциплин и технологий. Согласованность понятий, рассматриваемых в разделе 6 и рабочих примерах, приведенных в приложениях А и С, показана на рисунке А.1.
Согласно 5.4 округление должно быть выполнено только по окончательным рассчитанным оценкам и не допускается в промежуточных расчетах значений, которые содержат входные величины для последующих и окончательных расчетов. Все окончательные проценты (оценки относительной неопределенности и оценки относительной расширенной неопределенности), представленные в последующих рабочих примерах, вычислены с использованием неокругленных значений. Из-за округления окончательных процентов могут возникнуть расхождения между суммами компонентов и итоговыми значениями, указанными для итоговой относительной неопределенности. Для того чтобы наглядно проиллюстрировать правильное вычисление компонентов в рабочих примерах, составляющие неопределенности указаны в таблицах с дополнительными десятичными знаками в той степени, которая необходима для устранения влияния промежуточного округления на окончательные вычисления неопределенности.
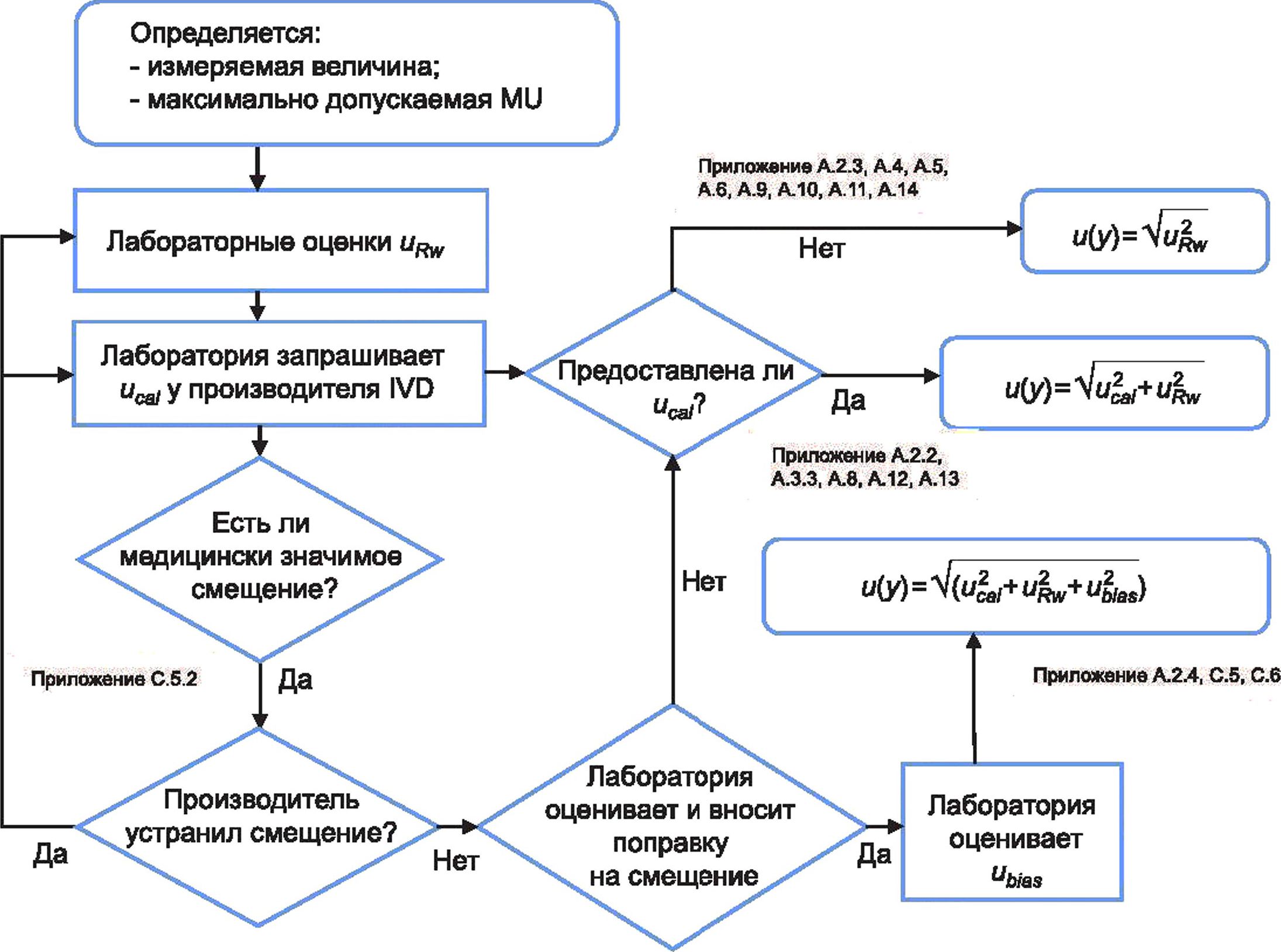
Рисунок А.1 — Обзор типичного пути оценивания неопределенности измерений со ссылкой на конкретные примеры в приложениях А и С
Следует отметить, что для обеспечения согласованного подхода все примеры начинаются с получения основного параметра — стандартной неопределенности измерения и без знака.
Как указано в 5.5, пользователи могут посчитать более практичным выполнение вычислений MU путем непосредственного использования относительной стандартной неопределенности иге/для каждой составляющей стандартной неопределенности (см. рабочие примеры А.7—А.9 и С.7).
25
ГОСТ Р 70413—2022
Оценка расширенной неопределенности U обеспечивает интервал возможных значений измеряемой величины, центрированный относительно фактического результата измерения и основанный на имеющейся информации об аналитических характеристиках используемой методики измерения. Оценки необходимо сопровождать установленным уровнем доверия, равным обычно «приблизительно 95 %», при к = 2. Считается, что возможные значения распределяются по Гауссу, поэтому предполагается, что результат измерения имеет наибольшую вероятность представления значения измеряемой величины, а другие значения в интервале имеют более низкие вероятности, хотя любое из них может быть правильным. Неопределенности могут быть недооценены, если требуемая информация является неполной.
Следующие пункты иллюстрируют основные статистические требования для оценивания неопределенностей и их применение в различных часто встречающихся медицинских лабораторных случаях. Невозможно охватить все комбинации источников неопределенности, которые возникают в медицинских лабораториях, однако принципы, показанные ниже, могут применяться по мере необходимости.
Следует отметить, что обоснованное сравнение результатов, полученных по разным методикам измерений для одной и той же измеряемой величины, может оказаться невозможным из-за различий в метрологической прослеживаемости значений, представленных для проб пациентов для этих разных методик измерений.
А.2 Основные расчеты
А.2.1 Стандартное отклонение и дисперсия (см. 3.36, 3.40)
Дисперсия о2 — это мера разброса между числовыми значениями в множестве данных, указывающая, насколько далеко каждое из них находится от среднего значения. Рассчитывают о2 путем взятия разности между каждым значением и средним значением набора данных, возведением каждой разности в квадрат (чтобы сделать их положительными), а затем делением суммы квадратов на количество значений в множестве минус 1 (степени свободы).
Квадратный корень дисперсии SD имеет практическое преимущество в том, что имеет такую же единицу измерения, как и данные, используемые для его расчета. SD не могут складываться, вычитаться, делиться или умножаться друг на друга, поэтому SD2 (дисперсия о2) является необходимым вычислением при объединении различных компонентов MU.
Дисперсию вычисляют по формуле
2 2 [ш-л2]
SD2 = о2 = , (А. 1)
л-1
где п — размер выборки (количество значений в серии измерений);
х — среднее значение выборки;
Xj — индивидуальное значение х в множестве данных;
о2 — дисперсия;
£ — сумма всех значений в серии измерений.
Дисперсия «0» показывает, что все значения в множестве данных идентичны, в то время как большая дисперсия означает, что некоторые из отдельных значений далеки от среднего значения данных и друг от друга. Использование дисперсии ограничено из-за того, что единица, связанная с дисперсией, является квадратом единицы измерения данных. Однако статистическое преимущество дисперсий состоит в том, что их можно совместно складывать, вычитать, делить и умножать.
А.2.2 Пример — Вычисление uRw в условиях долговременной прецизионности
Данная методика измерения, выполненная в соответствии с требованиями производителя, с использованием одних и тех же партий реагента и калибратора, дала 342 значения за несколько месяцев для одной и той же партии материала IQC. Продемонстрировав, что материал IQC ведет себя подобно типичным клиническим образцам в методике измерения, возникает заинтересованность в количественном определении дисперсии 342 результатов, полученных путем многократного измерения одной и той же партии материала IQC в условиях долговременной прецизионности. Поскольку лаборатория имеет доказательства того, что измеряемая величина в клинических образцах и измеряемая величина в материале IQC ведут себя схожим образом в применяемой методике измерения, SD, вычисленная для значений IQC, может быть обоснованно принята как неопределенность измерения и результатов, полученных для типичных клинических образцов. Расчет и, который будет применен к результатам исследования образцов биологического материала человека, представлен в таблице А.1.
Примечание — SD используют для результатов IQC как меру неопределенности, ожидаемую для клинических образцов.
Таблица А.1 — Пример вычисления и в условиях долговременной прецизионности
Компонент (аналит) | Натрий |
Измеряемая величина | Количество натрия в сыворотке, плазме, моче |
Единица измерения | ммоль/л |
26
Окончание таблицы А. 1
ГОСТ Р 70413—2022
Компонент (аналит) | Натрий | ||
Метод измерения | Натрийселективный электрод (непрямой) | ||
Методика измерения | Модель Р2, расходуемые материалы: X Pty Ltd. См. руководство по качеству | ||
Прослеживаемость калибратора | Прослеживаемость к СИ — SRM 919b | ||
Неопределенность калибратора ucai | 0,71 ммоль/л | ||
Смещение | Оценивают с помощью EQA— коммутативный материал с целевым значением, установленным в референтной лаборатории, аккредитованной на соответствие ИСО 15195; среднее смещение не имеет медицинской значимости | ||
Промежуточная прецизионность | Плазма IQC. Уровень 1 Lot 576 | Плазма IQC. Уровень 2 Lot 586 | Моча IQC Lot 884 |
Период сбора данных | 2012—02—09 до 2013—05—13 | 2012—02—09 до 2013—05—13 | 2012—02—09 до 2013—05—13 |
N | 342 | 338 | 122 |
Среднее значение, ммоль/л | 134,8 | 149,8 | 86,4 |
uRw(Na), ммоль/л | 0,85 | 0,87 | 0,99 |
u(Na) = ^u^w + U^, ммоль/л | Vo,852 +O,712 =1,11 | Vo,872+O,712 =1,12 | ^0,992+0,712 =1,22 |
L/(Na); k = 2; ммоль/л | 2,22 | 2,24 | 2,44 |
%^e/(Na) | 1,6% | 1,6% | 2,8 % |
Применительно к результатам пациентов (= 95 %-ный уровень доверия) | ±1,6% | ±1,6% | ±2,8 % |
А.2.3 Пример — Вычисление иг(у) в условиях повторяемости
Медицинское применение для оценивания иг в условиях повторяемости представлено в таблице А.2. Для интраоперационного (т. е. внутри одной операции по удалению паращитовидной железы) сравнения результатов измерений паратиреоидного гормона (РТН) у пациентов, перенесших паратиреоидэктомию, результаты для одного и того же пациента на последовательных независимых образцах можно сравнить в рамках одного и того же аналитического цикла. Три различных концентрации материала IQC измеряют для получения иг в условиях повторяемости. Оценка смещения не требуется для сравнения результатов одного и того же пациента, полученного в одном и том же аналитическом цикле.
Оценены 20 аликвот каждого из трех уровней IQC материала, подходящего по матрице. Среднее значение и SD для 20 значений IQC рассчитаны для каждого уровня ЮС. Значение SD используют в качестве стандартной неопределенности в условиях повторяемости иг (РТН) для каждого уровня. Лаборатория использует оцененное значение для иг (РТН) для таких же интервалов значений РТН, как и диапазоны измеряемых величин, контролируемые соответствующими уровнями IQC.
Таблица А.2 — Пример вычисления и^у} в условиях повторяемости для новой методики измерения гормона околощитовидной железы
Компонент (аналит) | Паратирин интактный (паратиреоидный гормон, РТН) |
Измеряемая величина | Количество концентрации интактного паратирина в сыворотке |
Единица измерения | пмоль/л |
Метод измерения | Иммунохемилюминесцентный анализ методом «сэндвич» |
Методика измерения | Производитель Z Ltd; Instrument АВ, производитель Z Ltd. Информацию о специфичности антител см. в руководстве по процедуре |
Прослеживаемость калибратора | Приписанное значение прослеживается до ВОЗ 1-го IRP 95/646 |
27
ГОСТ Р 70413—2022
Окончание таблицы А. 2
Компонент (аналит) | Паратирин интактный (паратиреоидный гормон, РТН) | ||
Неопределенность калибратора иса/ | Не требуется для сравнения нескольких результатов одного и того же пациента, полученных в одном и том же аналитическом цикле | ||
Смещение | Не значимо с медицинской точки зрения на основании показателей EQA | ||
Исследование повторяемости: сыворотку человека IQC измеряли в одном и том же аналитическом цикле | |||
Уровень 1 | Уровень 2 | Уровень 3 | |
Интервал мониторинга IQC: пмоль/л | <10,0 | От 10 до <50,0 | >50,0 |
Л/ | 20 | 20 | 20 |
Среднее значение: пмоль/л | 2,1 | 21,4 | 122.0 |
ф(РТН), пмоль/л | 0,044 | 0,40 | 3,15 |
ф(РТН) пмоль/л; к = 2 | 0,088 | 0,80 | 6,30 |
%Ure/(PTH);k = 2 | 4,2 % | 3,7 % | 5,2 % |
Применительно к результату пациента (=95 %-ный уровень доверия) | ±4,2 % | ±3,7 % | ±5,2 % |
Стандартная неопределенность повторяемости иг обеспечивает необходимые предварительные указания при оценивании итоговой MU, если измерительная система подойдет для более широкого медицинского применения. Поскольку значение MU в условиях повторяемости не включает изменчивость от дополнительных ожидаемых источников вариабельности при рутинном использовании, и(у), оцененная в этом примере, не применима к неопределенности в условиях долговременной прецизионности для других медицинских применений значений РТН.
А.2.4 Объединение независимых стандартных неопределенностей измерения
Два или более различных источника неопределенности в пределах процесса измерения могут внести значительный вклад в общий результат MU. Таким образом, может потребоваться суммировать две или более стандартных неопределенности для оценки полной (суммарной) неопределенности результата измерения.
SDs (и) не могут суммироваться, вычитаться, умножаться или делиться. Для суммирования стандартных неопределенностей, возникающих от различных составляющих всего процесса измерения, стандартные неопределенности каждого вклада должны быть в первую очередь преобразованы в дисперсии, где дисперсия равна SD2{u2). Следует отметить, что значения и всегда положительны.
Стандартные неопределенности измерений суммируют в соответствии с одним из двух правил в зависимости от того, как выполняемые измерения соотносятся друг с другом в формуле, по которой вычисляют ожидаемый результат.
Правило 1. Суммирование независимо оцененных абсолютных стандартных неопределенностей
Суммарную неопределенность вычисляют как квадратный корень из суммы вкладов дисперсий.
Пример 1 — Расчет суммарной стандартной неопределенности и(у) для измеряемой величины Y, включающий неопределенности, определенные для калибратора ucai, поправки на смещение ubjas, и непрецизионность в условиях долговременной прецизионности uRw. Вклады неопределенностей сначала выражают в виде дисперсий до их суммирования по формуле
и (У) = ^L^iZ^L)’ (А.2)
где и(у) — полная стандартная неопределенность измерения;
иса1 — неопределенность значения, приписанного калибратору;
ubias — неопределенность какой-либо поправки на смещение;
uRw — непрецизионность методики измерения в условиях долговременной прецизионности.
Для данной методики измерения принимают: иса/ = 0,11; ubias = 0,090; uRw = 0,43 ммоль/л. Вычисляют по формуле
и {у) = ^0,112 + 0,0902 + 0,432).
и (у) = ^0,0121 + 0,0081 + 0,849) = ^0,2051.
и(у) = 0,45 ммоль/л.
28
ГОСТ Р 70413—2022
Пример 2 — Стандартная неопределенность значения измеряемой величины, вычисленная путем сложения и/или вычитания нескольких значений измеряемых величин, например анионный интервал плазмы (AG), где AG вычисляют по формуле
AG ммоль/л = ([Na^ ммоль/л + [К*] ммоль/л) - ([СГ] ммоль/л +[НСО3~] ммоль/л). (А.З)
Пусть плазма:
- [Na^ = 143 ммоль/л;
- [^1 =4,0 ммоль/л;
• [СГ] = 104 ммоль/л;
- [НСО3~] = 22 ммоль/л;
AG = (143 + 4,0) - (104 + 22) = 21 ммоль/л.
Принимают:
- и [Na+] = 0,90 ммоль/л;
- и [К+] = 0,040 ммоль/л;
- и [С1~] = 0,78 ммоль/л;
- и [НСО3~] = 1,22 ммоль/л.
Примечание — Значение и для каждого электролита должно включать uRw, иса/ и ubias, при необходимости.
Шаг 1. Каждое вносящее свой вклад значение и сначала выражают как дисперсию и2.
u2[Na+] = 0,81; и2[К+] = 0,0016; и2[С1~] = 0,608; и2[НСО3~] = 1,4884.
Шаг 2. Дисперсии складывают вместе независимо от того, добавлены или вычтены абсолютные измеряемые значения в вычислении AG. Сумма дисперсий дает суммарную дисперсию для вычисленного AG.
Шаг 3. Квадратный корень суммарной дисперсии дает общее значение и для вычисленного анионного интервала u(AG).
и (AG) = ^(0,81 + 0,0016 + 0,6084 +1,4884) = ^2,9084 = 1,7054 ммоль/л.
Шаг 4. Если выбран коэффициент охвата к = 2, тогда расширенную неопределенность (=95 %-ный уровень доверия) определяют как U(AG) = 2 ■ 1,7054 = 3,41 ммоль/л.
Применяют к результатам пациентов: U = ±3,41 ммоль/л = ±16,2 % к AG = 21 ммоль/л.
Результат: AG = (21 ± 3,41) ммоль/л или ±16,2 % =(21- 3,41 до 21 + 3,41) = (17,59 до 24,24) =(18 до 24) (к = 2; =95 %-ный уровень доверия).
Пример 3 — Вычислена осмоляльность плазмы (Osmo), где осмоляльность плазмы вычисляют по формуле
Osmo/л = [2 ■ Na+ ммоль/л] + [мочевина ммоль/л] + [глюкоза ммоль/л] + 9 (MOsmo/л). (А.4)
Измеряемые величины и значения стандартных MU (и) для каждого компонента в человеческой пробе А:
- плазма Na = 130 ммоль/л, u(Na) = 0,98 ммоль/л; плазма мочевины = 6,5 ммоль/л, и(мочевины) = = 0,19 ммоль/л; плазма глюкозы = 5,2 ммоль/л, и(глюкозы) = 0,90 ммоль/л;
- плазма Osmocaic = (2 • 130) + 6,5 + 5,2 + 9 = 281 MOsmo/л.
Составляющие MU для каждого измеряемого компонента распространяются до итоговых измеренных значений, а вычисления Osmo выполняют в соответствии с математическим соотношением в формуле для вычисленных результатов. Расчет u(Osmo)
Шаг 1. Преобразовать каждый компонент и в дисперсию и2, где u2(Na) = 0,982 = 0,9604;
и2(мочевина) = 0,192 = 0,0361;
и2(глюкоза) = 0,0902 = 0,0081.
Шаг 2. При расчете осмоляльности плазмы по формуле (3) концентрация натрия умножается на 2 для того, чтобы учесть соответствующие анионы, но дисперсия для натрия не обрабатывается аналогичным образом, поскольку концентрация натрия не может быть независимой от самой себя, и, следовательно, дисперсия u2(Na) умножается на 22. Предполагается, что дополнительный фактор 9 не имеет неопределенности. Таким образом, u(Osmocaic) вычисляют по формуле
и (Osmocaic) = ^22 - и2 (Na)} + и2 (urea) + и2 (glu)}
и (Osmocalc) = ^22 0,9604} + 0,0361 + 0,008l} = ^3,8858 = 1,9712 Osmo/л (А.5)
U(Osmocaic) = 3,94 MOsmo/л (k = 2; =95 7о-ный уровень доверия)
%Urel (Osmocalc) = (3,94/280,7) ■ 100 = 1,4 %.
Биологическая проба человека A: Osmocaic = (280,7 ± 3,94) MOsmo/л или ±1,4 °/0 = (280,7-3,94 до 280,7 + + 3,94) = (276,76 до 284,64) = (277 к 285) (к = 2; =95 7о-ный уровень доверия).
29
ГОСТ Р 70413—2022
Правило 2. Суммирование независимо оцененных абсолютных стандартных неопределенностей в том случае, когда формула расчета требует, чтобы составляющие неопределенности были умножены или разделены.
Если формула расчета предписывает умножение или деление независимых составляющих стандартных неопределенностей, то составляющие неопределенностей должны быть выражены как относительные стандартные неопределенности до применения правила 1.
Примечание 1 — Когда у пользователей есть возможность эффективно суммировать вклады стандартных неопределенностей для получения суммарной неопределенности, такие вычисления могут быть упрощены путем непосредственного использования относительной стандартной неопределенности для каждого вклада стандартных неопределенностей (см. рабочий пример А.9).
Пример 1 — Вычисление стандартной неопределенности, включающее деление (отношение) двух независимых значений измеряемых величин.
Отношение кальция к креатинину в разовой порции мочи вычисляют по формуле
отношение кальция в моче к креатинину в моче = [Uca]/[Ucrea], (А.6)
где [Uca] — молярная концентрация кальция в моче, ммоль/л;
Wcreal — молярная концентрация креатинина в моче, ммоль/л.
Параметры пробы пациента: [Uca] = 6,40 ммоль/л; [Ucrea] = 2,30 ммоль/л, [Uca]/[Ucrea] = 2,78.
Поскольку вычисление включает в себя деление, два вклада неопределенности выражают в %urei: Допустим:
- u[Uca] = 0,040 ммоль/л (вычислено для среднего значения концентрации IQC 2,71 ммоль/л);
- %urei Weal = (UWса^саИ ■ ЮО = (0,0400/2,71) ■ 100 = 1,4760 % = 1,5 %;
- u[Ucrea] = 0,150 ммоль/л (вычислено для среднего значения концентрации IQC 6,17 ммоль/л);
- %UreiWcrea] = (^crea№crea]) ' ЮО = (0,150/6,17) ■ 100 = 2,4311 % = 2,4 %;
- %urei [Uca ] / [Ucrea ] = ^(1,46702 + 2,43112) = 2,8394 % = 2,8 %;
- 7oUrel [Uca]/[Ucrea] = (2,8394 %) ■ 2 = ±5,7 %, k = 2 (=95 7о-ный уровень доверия).
Для результата параметра пробы человека расширенная неопределенность 7о U выражена в процентах, для Uca/Ucrea = (2,78 ±5,7)% (=95 7о-ный уровень доверия) или, если требуется значение абсолютной расширенной неопределенности, перевод из %urel[Uca]/[Ucrea] в u[Uca]/[Ucl.ea] выполняют следующим образом:
• u[Uca]/[Ucrea] = ((%urel[Uca]/[Ucrea^ ■ [Uca]/[Ucrea] для параметра пробы человека = (2,8394/100) х *2,78 = 0,07894;
- U[Uca]/[Ucrea]; k = 2, = 0,07894 ■ 2 = 0,1579 = 0,158;
- результат параметра пробы человека: U[Uca]/[Ucrea] = (2,78 ± 0,158) (=95 7о-ный уровень доверия);
- 7oUrel [Uca]/[Ucrea] = (0,158/2,78) ■ 100 = 5,683 = 5,7% (=95 %-ный уровень доверия).
Пример 2 — Расчет суммарной стандартной неопределенности, включающий умножение и деление независимых вкладов неопределенностей.
Клиренс креатинина вычисляют по измерениям концентраций креатинина в сыворотке/плазме и моче, собранной за определенное время (обычно 24 ч) по формуле
Клиренс креатинина (С1сгеа) мл/мин. (А.7)
Were а ] ‘ *
Допустим:
■ Wcreal = 146 ммоль/л;
■ Wcreal = 2900 ммоль/л;
-Uvol = 2421 мл;
-1 = 24 ч ■ 60 мин = 1440 мин;
„ 2900 2421 „ л
- С1сгеа = = 33 >4 МЛ/MUH.
146 1440
Шаг 1. Вычисление клиренса креатинина включает умножение и деление измеренных значений; стандартные неопределенности измеренных значений сначала должны быть выражены как относительные стандартные неопределенности urel.
Предположим, что стандартная неопределенность и исходя из данных IQC для каждого измеренного значения равна:
Р
сгеа
- и(Рсгеа) = 1,438 ммоль/л для среднего значения IQC 70 ммоль/л; % urei(Pcrea) = (1,438/70) ■ 100 = 2,05 %;
^crea'
- u(Ucrea) = 138,0 ммоль/л для среднего значения IQC 6060 ммоль/л; %ure/(Ucrea) = (138,0/6060) ■ 100 = = 2,28 %;
30
ГОСТ Р 70413—2022
- погрешность измерения субъективно оценивает лаборатория как (2421 ± 100) мл.
Приведенная выше оценка погрешности объема ±100 мл (диапазон из 200 возможных значений) является профессиональной лабораторной «оценкой», а не стандартной неопределенностью эксперимента. Поэтому необходимо принять решение относительно того, может ли фактически измеряемый объем:
- иметь любое значение между минус 100 мл и плюс 100 мл от измеренного значения (прямоугольное распределение), или
- с большей вероятностью, быть близким к заявленному измеренному значению (треугольное распределение).
Более полное рассмотрение прямоугольного и треугольного распределений представлено в [16].
Лаборатория считает первый вариант более правдоподобным.
SD прямоугольного распределения = (диапазон возможных значений/2) 4з
u(Uvol) = (200/2)/43 = 57,7 мл; %urel(Uvol) = 57,7/2421 = 2,40 %
(если треугольное распределение считается более вероятным, вычисление будет (200/2)/^6
t (время): погрешность, оцененная лабораторией как (24 ± 0,5) ч, предполагает прямоугольное распределение:
0,5 ч = 30 мин, диапазон = 60 мин u(t) = (60/2)/43 =17,32 мин;
%urej(t) = 17,32/1440 = 1,20 %;
ural(Clcraa) = ^ (Pcraa) + u*,(Ucraa) + ^ (Uv0,) + 4, (t) = ^05^28^72/40^/20^ = 4,0744 % =
= 4,1 %;
%Urel(Clcrea) = 8,1488 % = 8,1 %, k = 2;
U(Clcrea) = 33>4 ' (8,1488/100) = 2,7217 мл/мин = 2,72 мл/мин.
Результат пациента — (33,4 ± 2,72) мл/мин (=95 %-ный уровень доверия).
А.З Неопределенность измерения при изменении условий измерения
А.3.1 Основные подходы к вычислению
Для сбора надлежащих данных IQC в условиях долговременной прецизионности, вероятно, что одна или несколько партий реагента, калибратора и ЮС закончились и введены новые партии. Важно, чтобы оценки неопределенности учитывали влияние таких изменений на условия измерения.
Лаборатории с большой рабочей нагрузкой могут использовать две или более идентичных измерительных системы для одной и той же измеряемой величины, чтобы клинические образцы можно было анализировать в любой системе. В таких ситуациях полезно оценить MU, которая применима ко всем результатам, независимо оттого, какую измерительную систему используют.
Изменение условий измерения, которое приводит к значительной вариации измерений относительно значений, полученных в предыдущих условиях, и которое также не наблюдается для клинических образцов, может ненадлежащим образом увеличить SD, если значения ЮС рассмотрены как одна выборка.
Когда вводят новую партию ЮС, ее среднее значение может отличаться от предыдущего. Поэтому при смене партий ЮС данные ЮС должны быть собраны, вычислены и оценены по отдельности до того, как объединят данные с предыдущими данными партий ЮС.
Когда вводят новую партию реагентов, следует проверить, что изменения в значениях ЮС сопровождаются аналогичными по величине изменениями значений, полученных для группы типичных клинических образцов. Если значения как для ЮС, так и для группы клинических образцов изменились не существенно или показывают одинаковую величину сдвига значений, то значения ЮС, полученные для старой и новой партий реагентов, можно рассматривать как единый набор данных. Однако если существенное изменение показывают только значения ЮС, то необходимо собрать старые и новые значения ЮС и вычислить SD отдельно, прежде чем определять, как следует объединять данные.
Ожидается, что введение новой партии калибратора вызовет лишь небольшие изменения в результатах измерений для образцов как биологического материала человека, так и ЮС — в пределах указанного интервала. Следовательно, отдельный сбор и обработка данных ЮС не требуются, если только производитель калибратора не внесет значительного изменения в абсолютные значения для клинических образцов через процесс повторного соотнесения значения калибратора с эталоном. Обработка данных ЮС как единичного набора при смене партии калибратора будет учитывать в качестве случайной погрешности изменчивость результатов клинических образцов, вызванных изменениями калибратора.
Поэтому необходимо:
- определить для каждого отдельного условия измерения, требуют ли значения ЮС отдельной обработки;
- вычислить среднее значение и SD для каждого отдельного набора данных ЮС, если значения ЮС среди различных условий измерения требуют отдельной обработки;
31
ГОСТ Р 70413—2022
- вычислить SD (uRw) либо с использованием одного набора данных, состоящего из всех значений IQC, либо вычислением SD (uRw) путем объединения отдельных SD из данных IQC для каждого условия для того, чтобы получить среднее значение uRw, если значения IQC в различных условиях измерения не требуют отдельной обработки.
Пример
В течение времени в измерительной системе произошли две смены партии IQC и одна смена партии реагента, что привело к изменению измеренных значений для IQC, но не для клинических образцов. Смена партии калибратора и профилактическое обслуживание измерительной системы не повлияли на значения IQC или клинических образцов. Таким образом, было внесено в общей сложности пять изменений в условия измерения, три из которых потребовали отдельного сбора данных IQC.
Допустим:
- IQC партия 1 = и^
- IQC партия 2 = и2;
- смена партии реагента = и3;
- смена партии калибратора, сохранение.
Если количества значений IQC, полученных для каждого условия измерения (п^ п2, п3), достаточно одинаковые (сбалансированные), то среднюю стандартную неопределенность при изменении условий измерения вычисляют по формуле
Объединенное среднее uRw =
(А.8)
Если существуют значительные различия в количестве данных IQC (п) между различными условиями измерения (например, среди нескольких инструментов, среди нескольких партий IQC, среди нескольких партий реагентов и т. д.), вычисление объединенного среднего uRw может быть выполнено с весовым коэффициентом «п» для каждой логической подгруппы данных. В этом случае можно применять альтернативные подходы.
А.3.2 Оценка и(у) с использованием нескольких партий реагента, когда наблюдаются сдвиги внутреннего контроля качества без соответствующего сдвига в значениях пациента
Пример
Иммуноферментный набор для интактного паратиреоидного гормона (iPTH) оценивали перед вводом каждой новой партии реагентов, используя как набор клинических образцов, так и материалы IQC, включая и расходуемые, и новые партии реагентов. При каждой смене партии реагентов обнаружено, что результаты для наборов пациентов существенно не изменялись, но иногда значительно изменялись значения IQC. Во избежание получения вводящей в заблуждение оценки SD IQC путем анализа в виде единого набора данных IQC по всем партиям реагентов, данные IQC собраны и проанализированы отдельно для каждой партии реагентов, как показано в таблице А.З. Поскольку количество точек данных IQC п, полученных для каждой партии реагентов, было одинаковым, вклад каждого набора данных IQC в объединенную среднюю дисперсию обрабатывался одинаково (сбалансированно) при вычислении uRw без учета весового коэффициента для п и вычислялся в соответствии с формулой (А.8).
Таблица А.З — Оценивание данных IQC среди нескольких партий реагентов без существенных изменений в данных пациентов
Компонент(аналит) | Паратирин интактный (паратиреоидный гормон, iPTH) | ||
Измеряемая величина | Количество концентрации iPTH в сыворотке | ||
Единица измерения | пмоль/л | ||
Метод измерения | Иммунохемилюминисцентный анализ по методу «сэндвич» | ||
Методика измерения | Производитель Z Pty Ltd. См. руководство по процедуре для определения селективности антител и ограничений | ||
Калибровочная прослеживаемость | Приписанные значения, прослеживаемые к WHO, 1-й IRP 95/646 | ||
Неопределенность калибровки (%Uca/),k = 2 | 2,1% | ||
Смещение | Не значимо с медицинской точки зрения относительно группы экспертов EQA | ||
Матрица IQC: сыворотка крови человека | Уровень 1 | Уровень 2 | Уровень 3 |
Исследуемый интервал IQC, пмоль/л | <10,0 | 10,0 —<50,0 | >50,0 |
32
Окончание таблицы А.З
ГОСТ Р 70413—2022
Компонент(аналит) | Паратирин интактный (паратиреоидный гормон, iPTH) | |||
Партия реагента Ns 66 | Сбор информации: 5/03/15-29/11/15 | |||
Л/ | 138 | 118 | 106 | |
Среднее, пмоль/л | 2,13 | 16,85 | 58,45 | |
uRw (66) пмоль/л | 0,094 | 0,504 | 1,726 | |
Партия реагента № 67 | Сбор информации: 22/05/16-03/09/16 | |||
Л/ | 142 | 139 | 142 | |
Среднее, пмоль/л | 2,11 | 18,08 | 62,00 | |
URw (67), пмоль/л | 0,088 | 0,558 | 2,033 | |
Партия реагента Ns 68 | Сбор информации: 22/05/16-03/09/16 | |||
N | 129 | 126 | 120 | |
Среднее, пмоль/л | 2,17 | 18,69 | 64,26 | |
URw (68) пмоль/л | 0,092 | 0,643 | 2,157 | |
В среднем uRw (РТН), пмоль/л | Уровень 1: ^(0,09402+0.08802+ 0,09202] | /з] =0,09137 = 0,0914. = 0,5712 = 0,571. = 1,9803 = 1,980. | ||
Уровень 2: ^(о,5О42 + 0,5582 + 0,6432) / 3 | ||||
Уровень 3: ^ (17262+2,0332 +2,1572)/3 | ||||
uRw, пмоль/л, к = 2 (=95 %-ный уровень доверия) = 2-uRw | 0,18274 = 0,183 | 1,1424= 1142 | 3,9606 = 3,961 | |
°^uRw' ^ = 2, =95 %-ный уровень доверия = (uRwfxavg) ■ 100 | 8,5525 % = 8,6 % | 6,3916 % = 6,4 % | 6,4327 % = 6,4 % | |
%ЦРТН), к =2, =95 %-ный уро-веньдоверия= ^%U^a/ + %URw^ | ||||
^(2,12 +8,55252) 8,8065 % = 8,8 % | ^(2,12+6,39162 6,7277 % = 8,8 °/ | 0 | ^2,12+6,43272) 6,7668 % = 6,8 % | |
А.3.3 Основной подход к оцениванию uRWc использованием нескольких партий внутреннего контроля качества
Общий подход к расчету uRw в том случае, когда данные IQC накоплены по нескольким партиям материала IQC и количество результатов для каждой партии примерно одинаковое, является таким же, как описано в А.3.1.
Пример вычисления изданного типа приведен ниже.
IQC уровень 1: партия 47: февраль—май: л = 168, х = 4,32 ммоль/л, uRw = 0,230 ммоль/л;
партия 48: июнь—сентябрь: л = 186, х = 4,43 ммоль/л, uRw = 0,270 ммоль/л;
партия 49: октябрь—март: л = 172, х = 3,96 ммоль/л, uRw = 0,210 ммоль/л.
Среднее х: 4,24 ммоль/л
uRw (партии 47,48,49) =
0,2302+0,2702+0,2102
3
= 0,23797759 ммоль/л = 0,238 ммоль/л.
URw (партии 47, 48, 49) = 2- uRw = 0,47595518 = 0,476 ммоль/л; к = 2, =95 %-ный уровень доверия.
%URw= (URw/xavg)A00 = (0,47595518/4,2367) ■ 100 = 11,2341 % = 11,2; k = 2, =95 %-ный уровень доверия.
Объединенное среднее значение uRw может быть объединено с оценкой стандартной неопределенности для присвоенного калибратором значения uRw, при наличии, для вычисления расширенной U и о/оиге/.
33
ГОСТ Р 70413—2022
А.4 Суммарная средняя стандартная неопределенность по нескольким идентичным измерительным системам, учитывающая различие в средних значениях при внутреннем контроле качества
Лаборатории с большими рабочими загрузками могут использовать несколько экземпляров одной и той же измерительной системы для одной и той же измеряемой величины для того, чтобы клинический образец можно было проанализировать с помощью любой конкретной измерительной системы. В таких ситуациях полезно оценить единственное значение и(у), которое может быть обоснованно применено к результатам, полученным посредством любой из нескольких измерительных систем.
Несколько измерительных систем обычно контролируются одной и той же партией IQC одновременно. Значение uRw вычисляют отдельно для каждой измерительной системы. Существует возможность получения разных средних значений IQC с помощью любой из измерительных систем для одной и той же партии IQC. Следовательно, стандартная неопределенность средних значений для партии IQC по нескольким измерительным системам должна быть вычислена и включена в вычисление суммарной средней неопределенности.
Пример — IQC уровень 1 партии 50 одновременно используют в трех идентичных измерительных системах А, В, С. Предполагается, что смещение измерений для клинических образцов между тремя системами является незначимым с медицинской точки зрения, будучи отслеживаемым путем регулярных проверок с использованием панели типичных клинических образцов, a IQC и клинические образцы имеют одинаковую непрецизионность в нескольких измерительных системах.
Шаг 1. Для данных IQC, полученных в условиях долговременной прецизионности, вычисляют для каждой измерительной системы средние значения х(А), х(В), х(С) и uRw(A), uRw(B), uRw(C) из значений IQC при использовании каждой из трех систем. Для каждой измерительной системы (А, В, С) следует записать в таблицу среднее значение IQC х, число собранных данных п и значения SD uRw, как показано в таблице А.4.
Таблица А.4 — Пример матрицы для табулирования данных внутреннего контроля качества среди нескольких идентичных измерительных систем
Измерительная система | А | В | С |
п | ПА | ЛВ | пс |
X | *А | ||
SD | uRw(^ | URv№ | uRw^ |
Шаг 2. Из SD, основанных на данных, полученных для IQC партии 50 для каждой измерительной системы (А, В, С), вычисляют дисперсию [u2Rw (A), u2Rw (В), u2Rw (С)] для каждой системы (А, В, С).
Шаг 3. Вычисляют дисперсии и2(А, В, С) из трех средних значений для трех измерительных систем (А, В, С) для IQC партии 50.
Шаг 4. Суммируют дисперсии трех средних значений и2 (А, В, С) с объединенной средней дисперсией непрецизионности u2Rw (А, В, С),
где объединенная средняя суммарная дисперсия = и2(А, В, С) + u2Rw (А, В, С) и
и (объединенная) = [и2(А, В, С) + u2Rw (А, В, С)]
и (объединенная) объединяется с соответствующим значением иса/для вычисления суммарной и(у).
Рабочий пример — Объединенная средняя стандартная неопределенность по нескольким идентичным измерительным системам, учитывающая различные средние значения внутреннего контроля качества.
Шаги 1 и 2. Данные матрицы и вычисленные дисперсии представлены в таблице А.5.
Таблица А.5 — Рабочий пример. Таблица данных и вычисленные дисперсии (шаги 1 и 2) — объединенная усредненная стандартная неопределенность по нескольким измерительным системам, учитывающая различия в средних IQC
QC уровень 1, партия 50 | |||
Измерительная система: | А | В | С |
п | 280 | 190 | 400 |
х, ммоль/л | 5,15 | 4,93 | 5,28 |
SD | 0,160 | 0,190 | 0,200 |
и2 и Rw | 0,0256 | 0,0361 | 0,0400 |
34
ГОСТ Р 70413—2022
Шаг 3. Вычисляют по перечислению а) дисперсии различий между измерительными системами в средних значениях и по перечислению Ь) объединенную среднюю дисперсию непрецизионности.
а) Вычисляют дисперсию и2 (А, В, С) среди средних значений (5,15; 4,93; 5,28 ммоль/л) трех измерительных систем (А, В, С) для IQC партии 50 следующим образом:
- х(А, В, С) = (5,15 + 4,93 + 5,28)/3 = 5,12;
- SD(A, В, С) = ^[f(x^)^b1 = ^£p5J5^Zl277(^^ = 0,176918 =
= 0,177 ммоль/л = u(A, В, С);
- и2(А, В, С) = (0.176918)2 = 0,0313.
Ь) Вычисляют дисперсию u^w(A, В, С) для объединенной средней непрецизионности в измерительной системе следующим образом:
- uRw (А, В, С) = ^[о, 1602 + 0,1902 + 0,2002) / 3 = 76^034 =0,18412 ммоль/л;
- u2Rw (А, В, С) = 0.184122 = 0,0339.
Шаг 4. Суммируют дисперсии трех средних значений трех измерительных систем и2(А, В, С) с суммированной средней дисперсией непрецизионности u2Rw(A, В, С).
Вычисляют суммированную дисперсию следующим образом:
- и (объединенная) = ,^р2"(АГвГс)+"й^^ = ^(0,0313 + 0,0339) = 0,255343 = 0,255 ммоль/л;
- %urei (объединенная) = [и (объединенная)/ х(А, В, С)] 100 = (0,255343/5,12) • 100 = 4,9872 % = 5,0 %;
- %Urel (объединенная) = 2 • %иге1 (объединенная) = 9,9743 % = 10,0 %; к = 2, =95 %-ный уровень доверия.
Для оценивания итоговой неопределенности и (объединенная) может быть суммирована с иса/ и ubias (если это уместно), и такую оценку применяют к наблюдаемым результатам, соответствующим уровню IQC 1, независимо от того, на какой измерительной системе А, В или С они измерены.
А.5 Неопределенность результатов анионного интервала (AG), использующая данные внутреннего контроля качества
Альтернативой объединению составляющих неопределенностей, проиллюстрированному ранее (А.2.4, пример 2), является использование значений электролита IQC, полученных в условиях долгосрочной прецизионности для расчета AG таким же способом, как и для клинических образцов, которые могут точнее отражать неопределенность результатов AG, заявляемую медицинской лабораторией.
Шаг 1. Данные ЮС накапливаются для сывороточных/плазменных электролитов (натрия, калия, хлорида, общего СО2) за период времени, достаточный для учета всех изменений в условиях измерения.
Шаг 2. Выбранную лабораторией формулу для расчета AG и все наборы значений электролита IQC заносят в соответствующую электронную таблицу, позволяющую вычислить результаты AG по значениям электролита IQC.
В приведенной ниже электронной таблице образцов (см. таблицу А.6) показаны первые шесть из 1374 записей для значений электролита IQC уровня 1 и формула, используемая системой лабораторных информационных технологий (IT) для вычисления анионных интервалов в биологическом образце. Этот подход будет включать, например, небольшие неопределенности, вносимые автоматическим округлением значений с помощью лабораторной ИТ-системы.
Таблица А.6 — Первые шесть из 1374 записей IQC данных электролита 1 -го уровня для вычисленных значений AG
№ | Дата | Сера QC. Уровень 1 | ||||
Na | К | CI | нсо3 | anion gap | ||
1 | 28/07/2014 | 123,3 | 4,09 | 85,9 | 18,4 | 23,09 |
2 | 29/07/2014 | 125,6 | 4,17 | 86,6 | 16,9 | 26,27 |
3 | 29/07/2014 | 124,0 | 4,11 | 86,2 | 16,5 | 25,41 |
4 | 31/07/2014 | 123,3 | 4,09 | 85,9 | 16,4 | 25,09 |
5 | 29/07/2014 | 123,1 | 4,08 | 85,9 | 16,5 | 24,78 |
6 | 30/07/2014 | 124,2 | 4,13 | 86,2 | 17,2 | 24,93 |
Шаг 3. Вычисляют среднее значение и непрецизионность последовательных значений AG для материала IQC.
Последовательные значения AG, представленные в таблице А.6, столбец Н, использованы для вычисления средней и непрецизионной неопределенности uRw (AG). Полученные вычисленные параметры представлены в таблице А.7.
35
ГОСТ Р 70413—2022
Таблица А.7 — Среднее значение анионного интервала uRw (AG) и U(AG) для внутреннего контроля качества 1-го уровня
Временной период | 28/07/14-21/08/15 |
IQC уровень 1 | |
Л/ | 1374 |
Среднее значение AG, ммоль/л | 25,8 |
uRw (AG), ммоль/л | 1,45 |
U(AG); к = 2, ммоль/л | 3,0 |
Расширенная неопределенность L/для результата AG составляет ±3 ммоль/л.
А.6 Неопределенность результатов при оценивании скорости клубочковой фильтрации eGFR
Оценка клубочковой фильтрации eGFR, вычисленная с использованием формулы оценивания концентрации креатинина в сыворотке/плазме, информации о возрасте, поле и расовой принадлежности (европеоидная или негроидная), может помочь в определении бессимптомной хронической почечной недостаточности (ХПН). Существующие формулы CKD-EPI для вычисления eGFR [28], используемые лабораторными вычислительными системами, приведены в таблице А.8.
Таблица А.8 — CKD-EPI формулы для вычисления eGFR
Расовая принадлежность | Пол | Креатинин сыворотки Scr ммоль/л (мг/дл) | eGFR формула Sc. мг/дл), мл/мин в пересчете на 1,7373 м2 |
Негроидная | ж | < 62 (< 0,7) | 166 • (Sc/0,7)-°-329 • (0,993^е |
Негроидная | ж | > 62 (> 0,7) | 166 • (Sc/O,7)-1-209 • (0,993)^е |
Негроидная | м | < 80 (< 0,9) | 163 • (Sc/0,9)-°-411 • (0,993)^e |
Негроидная | м | > 80 (> 0,9) | 163 • (Sc/O,9)"1’209 • (0,993^ |
Европеоидная или др. | ж | < 62 (< 0,7) | 144 • (Sc//0,7)-°-329 • (0,993^ |
Европеоидная или др. | ж | > 62 (> 0,7) | 144 • (Sc/O,7)-1’209 • (0,993/^ |
Европеоидная или др. | м | < 80 (< 0,9) | 141 • (Sc/0,9)-°-411 • (0,993)л9е |
Европеоидная или др. | м | > 80 (> 0,9) | 141 • (Sc/O,9)"1-209 • (0,993/^ |
А.6.1 Оценка неопределенности расчетной скорости клубочковой фильтрации u(eGFR)
Неопределенность результатов eGFR, u(eGFR), определяемая по любой из приведенных формул для оценки, обусловлена преимущественно измерением сывороточного/плазменного креатинина. Поэтому медицинские лаборатории могут выбрать оценку u(eGFR) объединением неопределенностей для uRw(crea) и ura/(crea). В качестве альтернативы лаборатории могут выбрать прямую оценку u(eGFR), вычисленную и представленную в отчете, для того, чтобы отразить ожидаемую изменчивость результатов eGFR, заявляемую лабораторией. Для данного подхода будет необходимо, чтобы значения IQC для измерений креатинина в сыворотке или плазме были сначала преобразованы в значения eGFR. Это позволит получить представление как о неопределенности измерения креатинина в условиях долговременной прецизионности uRw(crea), так и о неопределенности значений, присвоенных калибратору креатинина uRw(crea), а также получить представление о любых неопределенностях, вызванных результатами математических расчетов и того, каким образом IT-системы лаборатории проводят округление чисел.
Оценка вклада лабораторных измерений в u(eGFR) может быть достигнута с использованием данных IQC креатинина сыворотки/плазмы, примененных к гипотетическому субъекту. Оценка u(eGFR) может быть получена путем:
- выбора одной из приведенных выше формул eGFR (см. таблицу А.8) и случайного гипотетического субъекта вне зависимости от его расовой принадлежности, пола и возраста;
- внесения выбранной формулы и параметров данного субъекта в соответствующую электронную таблицу;
- копирования из записи IQC достаточного количества значений креатинина в сыворотке/плазме, полученных для выбранного уровня IQC в условиях долговременной прецизионности;
- вычисления eGFR для всех значений IQC в сыворотке/плазме креатинина;
- вычисления среднего и SD значений eGFR, принимая SD как MeGFR);
- объединения uRw(eGFR) с uca/(crea) обычным способом.
36
ГОСТ Р 70413—2022
Данный подход не учитывает вклады неопределенностей, связанные с заданием формулы eGFR, такие как возраст объекта и влияние множителей, применяемых в формуле eGFR. Формулы для расчета eGFR также имеют неопределенность для конкретного результата по отношению к измеренному eGFR, которая является дополнением к неопределенности измерения креатинина в медицинской лаборатории. Проверка данных для измеренных значений GFR отдельных субъектов, используемых для оценки функции наиболее точного приближения для вычисления eGFR, выявляет значительный разброс, поэтому практикующим врачам следует учитывать, что для отдельных людей эти значения eGFR могут составлять приблизительно до ±30 % от измеренного значения GFR. Следовательно, неопределенность eGFR вклада лабораторных измерений в данное значение eGFR для отдельного субъекта недооценивает общую неопределенность в том смысле, что она не учитывает неопределенность формулы для оценивания.
А.6.2 Примеры формул для оценки GFR в формате, подходящем при работе со стандартной электронной таблицей
Для сложного расчета u(eGFR) этот процесс следует проводить с использованием стандартной электронной таблицы, пример которой приведен в таблице А.9. Конкретные столбцы таблицы, на которые имеются ссылки в приведенных ниже примерах, также см. в таблице А.9.
Формула eGFR для женщин (европеоидной расы):
IF(C2< 63,144 ■ (С2 • 0,011 3/0,7)Л-0.329 • 0,993л40,144 • (С2 • 0,011 3/0,7)л- 1,209 • 0,993л40). (А.9)
По формуле (А.9) вычисляют eGFR для женщины европеоидной расы в возрасте 40 лет, где установленные концентрации креатинина IQC в сыворотке/плазме составляют <62 мкмоль/л, и отдельно вычисляют eGFR для набора концентраций креатинина IQC в сыворотке/плазме >62 мкмоль/л (первую часть каждой формулы применяют, если концентрация креатинина менее указанного значения; в противном случае активируют вторую часть формулы).
Формула eGFR для мужчин (европеоидной расы):
IF(C2 < 81,141 • (С2 ■ 0,011 3/0,9)л- 0,411 ■ 0,993л40,141 • (С2 ■ 0,011 3/0,9)л-1,209 • 0,993л40) (А.10)
По формуле (А.10) вычисляют eGFR для мужчины европеоидной расы в возрасте 40 лет, где набор концентраций креатинина IQC в сыворотке/плазме составляет <80 мкмоль/л, и отдельно вычисляют для набора концентраций креатинина IQC в плазме/сыворотке >80 мкмоль/л (первую часть каждой формулы применяют, если концентрация креатинина менее указанного значения; в противном случае активируют вторую часть формулы).
Пояснительные примечания (см. таблицу А.9):
а) если концентрация креатинина/плазмы указана:
- в мкмоль/л, применяют формулы (А.9), (А.10), как представлено в настоящем стандарте,
- мг/дл, пренебрегают коэффициентом 0,011 3 из формулы (А.9) и (А.10);
b) С20.0113 = корректировка значений креатинина IQC, мкмоль/л, расположенных в каждой ячейке столбца С, с коэффициентом 0,0113 для выражения значения креатинина в мг/дл для использования с другими компонентами формулы;
с) формула, приведенная в С2, определяет ячейку данных, которая содержит первый результат набора концентраций креатинина сыворотки/плазмы IQC, мкмоль/л;
d) графа С: таблица настроена для вычисления eGFR для каждого из 1699 значений креатинина 1 уровня IQC, собранных примерно за один год для «некой» женщины в возрасте 40 лет с креатинином в сыворотке/плазме крови >63 мкмоль/л;
е) графа D: показаны вычисленные eGFR для первых пяти значений креатинина IQC;
f) графа Е: формула заменена (не показано) формулой для мужчин (европеоидной расы) в возрасте 40 лет, и eGFR вычислена для того же набора данных IQC;
д) графа G: 1741 значение для 2-го уровня креатинина IQC в сыворотке/плазме крови;
h) графа Н: значения eGFR, вычисленные с использованием такой же формулы, как и для графы D;
i) графа I: значения eGFR, вычисленные с использованием такой же формулы, как и для графы Е.
Таблица А.9 — Пример электронной таблицы для расчета u(eGFR)
№ | Дата | IQC сыворотка креатинина. Уровень 1 | eGFR женщины >62 сСг | eGFR мужчины >80 сСг | IQC сыворотка креатинина Уровень 2 | eGFR женщины >62 сСг | eGFR мужчины >80 сСг |
1 | 28/07/2014 | 79,9 | 79,9 | 106,3 | 552,4 | 7,7 | 10,2 |
2 | 29/07/2017 | 82,3 | 77,1 | 102,3 | 537.0 | 8,0 | 10,6 |
3 | 29/07/2014 | 82,2 | 77,2 | 102,5 | 540,2 | 7.9 | 10,5 |
4 | 29/07/2017 | 82,9 | 76,4 | 101,4 | 542,5 | 7.9 | 10,5 |
5 | 29/07/2017 | 80,9 | 78,7 | 105,8 | 540,1 | 7.9 | 10,5 |
37
ГОСТ Р 70413—2022
В таблице А.10 приведены средние значения креатинина в сыворотке/плазме крови и средние значения eGFR, вычисленные, как указано выше, из 1699 оценок 1-го уровня креатинина IQC и 1741 оценки 2-го уровня креатинина IQC, полученных в условиях долговременной прецизионности в течение одного года.
Таблица А.10 — Средние значения креатинина и средние значения eGFR для IQC 1-го и 2-го уровней, со связанными неопределенностями
IQC 1-го уровня | IQC 2-го уровня | |||||
Период | 28 июля 2014 г. — 21 августа 2015 г. | |||||
Л/ | 1699 | 1741 | ||||
Концентрация креатинина в плазме крови | eGFR женщины, 40 лет | eGFR мужчины, 40 лет | Концентрация креатинина в плазме крови | eGFR женщины, 40 лет | eGFR мужчины, 40 лет | |
Средние значения | 82,0 мкмоль/л | 77,5 мл/мин в пересчете на 1,73 м2 | 103,0 мл/мин в пересчете на 1,73 м2 | 533,9 мкмоль/л | 8,0 мл/мин в пересчете на 1,73 м2 | 10,7 мл/мин в пересчете на 1,73 м2 |
URw | 1,80 мкмоль/л | 2,00 мл/мин в пересчете на 1,73 м2 | 2,70 мл/мин в пересчете на 1,73 м2 | 9,10 мкмоль/л | 0,20 мл/мин в пересчете на 1,73 м2 | 0,20 мл/мин в пересчете на 1,73 м2 |
^RW(eGFR) мл/мин в пересчете на 1,73 м2; к = 2, =95 %-ный уровень доверия | 4,00 | 5,00 | 0,40 | 0,40 | ||
% urei | 2,00/77,5-100 = = 2,580 65 % = = 2,6 % | 2,7/103,0-100 = = 2,621 36 % = 2,6 % | 0,20/8,0-100 = = 2,500 00 % = = 2,5 % | 0,20/10,7-100 = = 1,869 16 % = = 1,9% | ||
%URe/(eGFR) мл/мин в пересчете на 1,73 м2; к = 2, =95 %-ный уровень доверия | 5,161 13 % = = 5,2 % | 5,242 72 % = 5,2 % | 5,000 00 % = = 5,0 % | 3,738 31 % = = 3,7 % | ||
Результаты примера перечислены ниже.
Пациент (женщина, европеоидной расы).
Результаты eGFR = 80 мл/мин в пересчете на 1,73 м2.
L/(eGFR)= 80 • 5,1613/100 = ±4,1290 мл/мин в пересчете на 1,73 м2 = ±4,13 мл/мин в пересчете на 1,73 м2 (к = 2; =95 %-ный уровень доверия).
Пациент (мужчина, европеоидной расы).
Результаты eGFR = 11 мл/мин в пересчете на 1,73 м2.
U(eGFR) = 11 • 3,73831/100 = ±0,4112 мл/мин в пересчете на 1,73 м2 = ±0,41 мл/мин в пересчете на 1,73 м2 (к = 2; = 95 %-ный уровень доверия).
Как указано выше, данная оценка неопределенности представляет только вклад лабораторных измерений и не включает неопределенность параметров формулы, полученных на основе большой популяции, которая могла бы внести значительный вклад дополнительной неопределенности при применении к отдельному субъекту. Оценивание и(у) для eGFR на основе только значений IQC для креатинина является малым компонентом общей неопределенности eGFR, используемой в медицинских лабораториях.
А.7 Оценивание расширенной неопределенности для счетной концентрации лейкоцитов в цельной крови
В таблице А. 11 представлен рабочий пример для вычисления оценки неопределенности содержания количества лейкоцитов в цельной крови.
Таблица А. 11 — Рабочий пример. Неопределенность количества лейкоцитов
Компонент(аналит) | Лейкоциты (WBC) |
Измеряемая величина | Счетная концентрация лейкоцитов в цельной крови |
Единица измерения | 109/л |
38
ГОСТ Р 70413—2022
Продолжение таблицы А. 11
Компонент (аналит) | Лейкоциты (WBC) | |||
Метод измерения | Импеданс | |||
Методика измерения | Инструмент 2; производитель TY, см. руководство пользователя | |||
Прослеживаемость калибратора | Референтная методика измерения, рекомендованная ICSH | |||
Неопределенность калибратора иса/ | 0,038-109/л (представлено производителем) | |||
Смещение | По оценке EQA: среднее смещение в пределах целевого | |||
Долговременная прецизионность | ||||
Материал IQC | Стабилизированные лейкоциты, поставляемые производителем XYZ IVD | |||
Уровень 1 | Уровень 2 | Уровень 3 | ||
Период | Август 2015 г. | |||
Лот IQC | 880200 | 870100 | 868800 | |
Л/ | 66 | 62 | 60 | |
Среднее; 109/л | 9,1 | 19,7 | 3,8 | |
uRw, 109/л | 0,105 | 0,280 | 0,115 | |
u(WBC) = ,^al+u2Rw | , 109/л | 0,1166 = 0,112 | 0,28257 = 0,283 | 0,12112 = 0,121 |
Период | Сентябрь 2015 г. | |||
Лот IQC | 880800 | 870700 | 869100 | |
N | 64 | 66 | 69 | |
Среднее; 109/л | 9,0 | 21,2 | 3,5 | |
0,125 | 0,275 | 0,130 | ||
u(WBC)^^u2al+u^w | , 109/л | 0,13066 = 0,131 | 0,277613 = 0,278 | 0,13544 = 0,135 |
Период | Октябрь 2015 г. | |||
Лот IQC | 889900 | 879700 | 869700 | |
Л/ | 63 | 68 | 65 | |
Среднее; 109/л | 9,2 | 20,4 | 3,5 | |
uRw, 109/л | 0,130 | 0,255 | 0,115 | |
u№BC) = ^(u2al+u%w | , 109/л | 0,13544 = 0,135 | 0,25782 = 0,258 | 0,12111 = 0,121 |
Объединенная средняя неопределенность (невзвешенная) | ||||
u(WBC): август, сентябрь, октябрь — 109/л | 0,112, 0,131, 0,135 | 0,283, 0,278, 0,258 | 0,121, 0,135, 0,121 | |
Компонент (аналит) | Лейкоциты (WBC) | |||
Вариация = u2(WBC) | 0,012465 0,017072 0,018344 | 0,079846 0,077069 0,066471 | 0,014670 0,018344 0,014668 | |
Сумма вариаций | 0,047884 | 0,223386 | 0,047682 | |
Средняя вариация | 0,015961 | 0,074462 | 0,015894 | |
39
ГОСТ Р 70413—2022
Окончание таблицы А. 11
Компонент(аналит) | Лейкоциты (WBC) | ||
Объединенная вариация t/(WBC) = = ^/средней вариации | 0,12634-109/л | 0,27288 ■ 109/л | 0,12507 • 109/л |
%urei IQC между партиями (п = 3); средние значения — 9,1; 20,4 и 3,6 | (0,12634/9,1) • 100 = = 1,38835 = 1,4 % | (0,27288/20,4) • 100 = = 1,33764 = 1,3 % | (0,12607/3,6) • 100 = = 3,50198 = 3,5% |
Допустимые ure/(WBC), основанные на индивидуальной внутренней биологической вариации (CVW) < 12,0 % | Соответствует оптимальным характеристикам <3,0 % | Соответствует оптимальным характеристикам <3,0 % | Соответствует оптимальным характеристикам <6,0 % |
Объединенная U, к = 2 | 0,12634-2 = 0,25268 = = 0,253 | 0,27288-2 = 0,54576 = = 0,546 | 0,12607-2 = 0,25214 = = 0,252 |
%Urei', к = 2, ~5 %-ный уровень доверия | 1,38835-2 = 2,7767 = = 2,8 % | 1,33764-2 = 2,67528 = = 2,7 % | 3,50198-2 = 7,00396 = = 7,0 % |
Результаты, применяемые к пациенту | ±2,8 % | ±2,7 % | ±7,0 % |
А.8 Оценивание неопределенности молярной концентрации альбумина в сыворотке/плазме крови.
Сравнение относительных и стандартных неопределенностей
Следует соблюдать осторожность при суммировании стандартных неопределенностей в тех случаях, когда молярная концентрация существенно отличается для вкладов неопределенностей, которые суммируются. Как проиллюстрировано в А.8.1, таблице А. 12 и А.8.2, таблице А. 13, различные оценки неопределенностей %Ure/для измерения альбумина в сыворотке/плазме крови получают при вычислении неопределенности путем суммирования стандартных неопределенностей по сравнению с суммированием относительных неопределенностей. Различия в оцененных %Ureiособенно заметны для альбумина >35,0 г/л (±4,7 % при использовании стандартной неопределенности против ±6,2 % в случае относительных неопределенностей).
В данном примере значение, приписанное калибратору (==24 г/л) намного ближе к 1-му уровню IQC (=28 г/л), чем ко 2-му уровню IQC (=42 г/дл). При суммировании стандартных неопределенностей (см. таблицу А. 12) вместо относительных неопределенностей (см. таблицу А.13) та же абсолютная стандартная неопределенность, связанная с калибратором (=0,58 г/л), суммируется со стандартной неопределенностью для каждого из двух уровней IQC, даже если молярная концентрация другая. При суммировании стандартных неопределенностей различных компонентов неопределенности для существенно разных концентраций вещества предполагается, что абсолютные вариации приблизительно постоянны во всем диапазоне концентраций. При суммировании относительных неопределенностей — относительные вариации приблизительно постоянны. Применяя оценки относительной неопределенности, как показано в таблице А.13, достигается наиболее точная оценка общей неопределенности, поскольку urei(Rw) одинакова (0,020 и 0,019 г/л соответственно) на обоих уровнях IQC, что позволяет предположить, что методика измерения показывает постоянное значение CV. При применении метода стандартной неопределенности (см. таблицу А. 12) с постоянным абсолютным изменением при всех концентрациях недооценивается вклад неопределенности калибратора при более высоких концентрациях альбумина, что приводит к недооценке %Ure/ для альбумина >35,0 г/л.
А.8.1 Неопределенность молярной концентрации альбумина в сыворотке/плазме крови, вычисленная с использованием стандартных неопределенностей
В таблице А.12 представлен метод оценивания %Urel для молярной концентрации альбумина в сыворотке/ плазме крови с использованием стандартных неопределенностей и.
Таблица А.12 — Оценивание %Ure/ для альбумина сыворотки/плазмы с использованием стандартной неопределенности и
Компонент (аналит) | Альбумин |
Измеряемая величина | Количество концентрации альбумина в сыворотке/плазме |
Единица измерения | г/л |
Метод измерения | Колориметрия: спектрофотометрия конечной точки титрования с бромкрезоловым пурпурным |
Методика измерения | Инструмент 2 и коммерческий комплект от производителя Y |
Прослеживаемость калибратора | ERM-DA470k/IFCC |
40
Окончание таблицы А. 12
ГОСТ Р 70413—2022
Компонент(аналит) | Альбумин | ||||||
Смещение | Оценивают ЕОАс использованием коммутативного материала с целевым значением, установленным аккредитованной референтной лабораторией: среднее отклонение в пределах целевого (<0,2 г/л): коррекция не требуется | ||||||
Долговременная прецизионность | |||||||
Период | Февраль 2014 г. — март 2015 г. | ||||||
Партия калибратора; концентрация | 4570; 23,7 г/л | ||||||
Неопределенность калибратора иса/ | 0,583 г/л (от производителя) | ||||||
IQC | Уровень 1 | Уровень 2 | |||||
Исследуемый интервал, г/л | <35,0 | >35,0 | |||||
Партия IQC | 6792 | 5389 | |||||
А/ | 1390 | 1414 | |||||
Среднее значение альбумина, г/л | 28,32 | 42,16 | |||||
URW’ г/л | 0,586 | 0,780 | |||||
^W^/u^ai+U2Rw | , г/л | ^(0,5832+0,5862 = 0,827 | = 0,82661 = | ^0,5832 + 0,7802 = 0,974 | = 0,97380 = | ||
Период | Апрель 2015 г. — март 2016 г. | ||||||
Партия калибратора; концентрация | 4779; 23,8 г/л | ||||||
Неопределенность калибратора иса1 | 0,574 г/л (от производителя) | ||||||
Партия ЮС | 6913 | 5876 | |||||
А/ | 1216 | 1290 | |||||
Среднее значение альбумина, г/л | 27,14 | 41,22 | |||||
URW’ г/л | 0,624 | 0,811 | |||||
u(Mb) = ^u2al+u2Rw | , г/л | ^0,5742+0,6242J = 0,848 | = 0,84785 = | ^0,5742 + 0,8112 = 0,994 | = 0,99358 = | ||
Объединенная средняя неопределенность u(Alb) — невзвешенная | |||||||
Объединенное среднее u(Alb), г/л | |||||||
^(о,826612+О,847852 = 0,83730 = 0,837 | /2 = | ^0,973802 + 0.993582 = 0,98374 = 0,984 | /2 = | ||||
%urei среднее значение ЮС | (0,83730/27,7) • 100 = 3,02274 = = 3,0 % | (0,98374/41,69) • 100 = 2,35965 = = 2,4 % | |||||
Допустимая %t/re/(Alb) на основе <75 % индивидуальной внутренней биологической вариации (СЦ) <3,2 % = <2,4 % | Неприемлема | Приемлема на границе | |||||
°/oUrel, к = 2, =95 %-ный уровень доверия | 3,02274 -2 = 6,04548 = 6,0 % | 2,35965-2 = 4,71930 = 4,7 % | |||||
Применяется к результатам пациентов | ±6,0 % | ±4,7 % | |||||
41
ГОСТ Р 70413—2022
А.8.2 Неопределенность молярной концентрации альбумина в сыворотке/плазме крови, вычисленная с использованием относительных стандартных неопределенностей иге/
В таблице А.13 представлен метод оценивания %Ure/для молярной концентрации альбумина в сыворотке или плазме крови с использованием относительных стандартных неопределенностей иге/.
Таблица А.13 — Оценивание %иге/ для альбумина сыворотки/плазмы с использованием относительной стандартной неопределенности и
Компонент(аналит) | Альбумин | |
Измеряемая величина | Количество концентрации альбумина в сыворотке/плазме крови | |
Единица измерения | г/л | |
Метод измерения | Колориметрия: спектрофотометрия конечной точки титрования с бромкрезоловым пурпурным | |
Методика измерения | Инструмент 2 и коммерческий комплект от производителя Y | |
Прослеживаемость калибратора | ERM-DA470k/IFCC референтный препарат | |
Смещение | Оценивают EQA с использованием коммутативного материала с целевым значением, установленным аккредитованной референтной лабораторией; среднее отклонение в пределах цели (<0,2 г/л); внесения поправки не требуется | |
Долговременная прецизионность | ||
IQC | Уровень 1 | Уровень 2 |
Исследуемый интервал, г/л | <35,0 | >35,0 |
Период | Февраль 2014 г. — март 2015 г. | |
Партия калибратора; концентрация | 4570; 23,7 г/л | |
Неопределенность калибратора иса/ | 0,583 г/л (от производителя) | |
Относительная стандартная неопределенность калибратора игецсаГ) | 0,583/23,7 = 0,024599 = 0,0246 | |
Партия IQC | 6792 | 5389 |
п | 1390 | 1414 |
Среднее значение альбумина, г/л | 28,32 | 42,16 |
URW’ г/л | 0,586 | 0,780 |
Относительная стандартная неопределенность urel(Rw} | 0,586/28,32 = 0,020692 = 0,0207 | 0,780/42,16 = 0,018501= 0,0185 |
^ге! (А'Ь) — ^иrepeal) + urel(Rw) | 7о,О245992 +0,0206922 = 0,032145 = = 0,0321 | 70,0245992 +0,0185012 =0,0307798 = = 0,0308 |
Период | Апрель 2015 г. — март 2016 г. | |
Партия калибратора; концентрация | 4779; 23,8 г/л | |
Неопределенность калибратора ucai | 0,574 г/л (от производителя) | |
Относительная стандартная неопределенность калибратора иге^саГ) | 0,574/23,8 = 0,024118 = 0,0241 | |
Партия IQC | 6913 | 5876 |
п | 1216 | 1290 |
Среднее значение альбумина, г/л | 27,14 | 41,22 |
42
Окончание таблицы А. 13
ГОСТ Р 70413—2022
Компонент (аналит) | Альбумин | |
URW’ г/л | 0,624 | 0,811 |
Относительная стандартная неопределенность ure/(Rw) | 0,624/27,14 = 0,022992 = 0,0230 | 0,811/41,22 = 0,019675 = 0,0197 |
ure/(^^) - ^urel(cal) + urel(Rw) | Vo,O241182 +O,O229922 = = 0,033321 = 0,0333 | V0,0241182 + 0,0196752 = 0,031125 = = 0,0311 |
Объединенная средняя неопределенность ure/(Alb) — невзвешенная | ||
Объединенное среднее значение %ure/(Alb) | ||
7(0,0321452+0,0333212)/2 = = 0,032738 100 = 3,2738 = 3,3 % | 7(0,03077982 +0,0311252)/2 = = 0,0309529 -100 = 3,09529 = 3,1 % | |
Допустимая %ure/(Alb) на основе <75 % индивидуальной внутренней биологической вариации (СЦ) <3,2 % = <2,4 % | Неприемлема | Неприемлема |
°/oUrei, к = 2, =95 %-ный уровень доверия | 6,5476 = 6,5 % | 6,1906 = 6,2 % |
Применяется к результатам пациентов | ±6,5 % | ±6,2 % |
А.9 Вычисление 7оиге/для Международного нормализованного отношения (INR)
Рабочий пример для вычисления %Ц.е/для измерений Международного нормализованного отношения (INR) приведен в таблице А.14. Для примера, приведенного в таблице А.14, применяют следующие обозначения:
- INR = (протромбиновое время образца/среднее нормальное протромбиновое время)131-;
- ^INR^^ISI2}^^^^
- относительная стандартная неопределенность: ure/(INR) = jm^(MNCT) + u^el^Rw^j (см. A.2.4, правило 2).
Таблица А.14 — Рабочий пример. °/oUrei для измерений INR
Компонент (аналит) | Биологическая активность факторов свертывания крови VII, X, V, II, фибриногена | |
Измеряемая величина | Индуцированное тканевым фактором относительное время образования сгустка в цитратной плазме | |
Единица измерения | с | |
Метод измерения | Механическое обнаружение сгустков | |
Методика измерения | Инструмент 1; коммерческий комплект от производителя Т | |
Допустимая стандартная неопределенность измерения, полученная из протромбинового времени (РТ) индивидуальной внутренней биологической вариации у взрослых | Минимум < % CV) технические характеристики <2,4% | |
Прослеживаемость калибратора | Человеческий рекомбинантный тромбопластин, 4-й выпуск ВОЗ 2009 г. | |
Период | Июль 2013 г. — январь 2014 г. | |
Номер партии тромбопластина | 1112 | 1113 |
Международный индекс чувствительности (ISI) | 1,31 | |
Смещение | Получено EQA: в пределах допустимой спецификации (не требуется исключения) | |
43
ГОСТ Р 70413—2022
Продолжение таблицы А. 14
Компонент (аналит) | Биологическая активность факторов свертывания крови VII, X, V, II, фибриногена | |
Среднее нормальное время свертывания (MNCT), с | л = 20 13,3 | |
u(MNCT), с | 0.53 | |
%ure/(MNCT) | (0,53/13,3) • 100 = 3,98496 = 4,0 % | |
Долговременная прецизионность | ||
IQC | Уровень 1 | Уровень 2 |
Исследуемый интервал, с | <20 | >20 |
Партия IQC | 3167 | 3168 |
п | 1682 | 1671 |
Среднее время РТ, с | 13,2 | 25,3 |
uRw(pT), с | 0,30 | 0,48 |
°/oUrel(Rw) (РТ) Цель: <2,4 % | (0,30/13,2) • 100 = 2,27273 = = 2,27 %. Приемлема | (0,48/25,3) -100 = 1,89723 = = 1,90 %. Приемлема |
U2e,(INR)=ISI2.[u2e,(MNCT)+U2eJ | 1,312 • (3,984962 + 2,272732) = = 36,11568 | 1,312 • (3,984962 + 1,897232) = = 33,42858 |
%«fe/(INR) | ^36,11568 = 6,00963 % = 6,0 % | 733,42858 = 5,78175 = 5,8 % |
%U(INR), к=2 | 12,00193 = 12,0 % | 11,56350 = 11,6 % |
Применяется к результатам пациентов | ±12,0 % | ±11,6 % |
Период | Февраль 2014 г. — март 2015 г. | |
Номер партии тромбопластина | 1245 | 1246 |
Международный индекс чувствительности (ISI) | 1,26 | |
Смещение | Получено EQA: в пределах допустимой спецификации (действия отсутствуют) | |
Среднее нормальное время свертывания (MNCT), с | л = 20 13,0 | |
u(MNCT), с | 0,51 | |
%ure/(MNCT) | (0,51/13,0) ■ 100 = 3,92308 = 3,92 % | |
Долговременная прецизионность | ||
IQC | Уровень 1 | Уровень 2 |
Исследуемый интервал, с | <20 | >20 |
Партия IQC | 3336 | 3338 |
п | 2865 | 2854 |
Среднее время РТ, с | 13,1 | 25,0 |
UrJPTXc | 0,32 | 0,51 |
%urel(Rw} (РТ)’ % | (0,32/13,1) • 100 = 2,44275 = 2,44 %. Приемлема на границе | (0512/25,0) • 100 = 2,04000 = 2,04 %. Приемлема |
44
Окончание таблицы А.14
ГОСТ Р 70413—2022
Компонент (аналит) | Биологическая активность факторов свертывания крови VII, X, V, II, фибриногена | |
4(INR) = ISI2 . [и2еДММСТ)+ u2^ | 1,262 • (3,923082 + 2,442752) = = 33,90730 | 1,262 • (3,923082 + 2.040002) = = 31,04100 |
ure,(INR)% = ,/l4(INR) | ^33,90730 = 5,82300 = 5,8 % | 731,04100 = 5,57145 = 5,6 % |
%U(INR), k = 2 | 11,64600 = 11,6 % | 11,14290 % = 11,1 % |
Применяется к результатам пациентов | ±11,6 % | ±11,1 % |
А.10 Неопределенность измерения вируса иммунодефицита человека 1-го типа вирусной нагрузки (HIV-1)
В таблице А. 15 представлен рабочий пример для вычисления оценки неопределенности измерений вируса иммунодефицита человека 1-го типа вирусной нагрузки (HIV-1).
Таблица А. 15 — Рабочий пример. Неопределенность (HIV-1) измерения вирусной нагрузки
Компонент (аналит) | РНК вируса иммунодефицита человека 1-го типа (HIV-1) | ||
Измеряемая величина | Количество копий РНК ВИЧ-1, концентрация в плазме | ||
Единица измерения | Log10 HIV-1 РНК копий/мл | ||
Метод измерения | cDNA PCR-амплификация cDNA и количественный анализ путем детекции по интенсивности флуоресцентного излучения | ||
Методика измерения | HIV-1. Тест, D диагностики Pty Ltd. | ||
Допускаемая стандартная неопределенность измерения | Менее ±0,5 log10 (результат) | ||
Прослеживаемость калибратора | WHO 1st — Международный эталон для HIV-1 РНК для методов на основе нуклеиновых кислот (NIBSC 97/656) | ||
Неопределенность калибратора иса1 | Не установлена | ||
Смещение | <0,25 1од10 — средневзвешенное значение каждой группы EQA (приемлемо) | ||
Записанные значения | Целое число | ||
Референтные значения | <1,6041 (40 копий/мл) (не обнаружено); 1,6021 до 1,00 • 107 (40 копий — 10 млн копий/мл) значение записанного результата; >1,00 • 107 (10 млн копий/мл) записано как >10 млн копий/мл | ||
Долговременная прецизионность | |||
Номер партии IQC | 443 | 453 | 463 |
Л/ | 34 | 73 | 19 |
Среднее 1од10 копий/мл Копии/мл | 2,66 457 | 3,18 1514 | 4,21 16218 |
Log10u | 0,120 | 0,160 | 0,230 |
Logw^rel | 0,120/2,66 = 0,045 | 0,160/3,18 = 0,050 | 0,230/4,21 = 0,055 |
U, 1од10 копий/мл; к = 2, = 95 %-ный уровень доверия U, копии/мл | 0,120 • 2 = 0,240 (2,66 ± 0,240) = = 2,42-2,90 263 - 794 | 0,160-2 = 0,320 (3,18 ±0,320) = = 2,86-3,50 724-3162 | 0,23 • 2 = 0,46 (4,21 ± 0,460) = = 3,75-4,67 5,623 - 46774 |
45
ГОСТ Р 70413—2022
Окончание таблицы А. 15
Компонент (аналит) | РНК вируса иммунодефицита человека 1-го типа (HIV-1) | ||
Допустимая U: менее ±0,5 1од10 от среднего IQC. Спектр 1од10 копий/мл Копии/мл | (2,66 ± 0,5) 2,16-3,16 145-1445 | (3,18 ±0,5) 2,68-3,68 479-4786 | (4,21 ±0,5) 3,71 -4,71 5129-51286 |
Пригодность для цели | Пригодна | Пригодна | Пригодна |
А.11 Неопределенность измерения BCR-ABL1 с использованием одной партии материалов для внутреннего контроля качества
BCR-ABL1 — результат аномального слияния генов, белковым продуктом которого является активированная тирозинкиназа, вызывающая хроническую миелоидную лейкимию. Измерение уровня транскрипта РНК BCR-ABL1 во время лечения имеет медицинское значение для результата лечения пациента, а уровень BCR-ABL1 используют для изменения решений о лечении.
Следующий рабочий пример оценивания MU (см. таблицу А. 16) касается измерения содержания транскрипта гибридного гена BCR-ABL1 с помощью qRT-PC по шкале международных стандартов (IS). Методика измерения включает выделение РНК, конвертацию РНК в комплементарную ДНК (кДНК) с использованием обратной транскрипции и количественную полимеразную цепную реакцию (qRT-PCR). РНК BCR-ABL1 выделяют из лейкоцитов периферической крови или костного мозга. Транскрипты BCR-ABL1 быстро деградируют, и стабилизация РНК необходима для предотвращения деградации после отбора образца.
Содержание транскриптов BCR-ABL1 представляют в форме процентного отношения ко второму транскрипту, называемому контрольным геном. Контрольный ген измеряют для компенсации различий на уровне деградации между образцами и в процессе обратной транскрипции. Образцы IQC подвергают всем процессам, необходимым для получения достоверного значения BCR-ABL1, за исключением лизиса эритроцитов, который не применяют, так как использованы клетки, предварительно стабилизированные в растворе для стабилизации РНК. Тем не менее основные источники вариабельности, связанные с определением параметров, потенциальной неоднородностью между единичными объектами и потенциальной деградацией во время транспортирования и длительного хранения, суммированы для оценки относительной расширенной неопределенности %Urei (k = 2) и зафиксированы путем включения QC в каждую партию.
Таблица А. 16 — Рабочий пример. Неопределенность BCR-ABL1 транскрипта гибридного гена
Компонент(аналит) | Транскрипты гибридного гена BCR-ABL1 (РНК) |
Измеряемая величина | Процент отношения содержания транскриптов гибридного гена BCR-ABL1 к содержанию транскрипта контрольного гена (ABL1) в периферической крови или костном мозге |
Единица измерения | Процент отношения по шкале международных стандартов (IS) |
Метод измерения | Обратная транскрипция с последующей количественной ПЦР в реальном времени кДНК с детекцией на основе флуоресценции |
Методика измерения | Производитель X набора для анализа BCR-ABL1 |
Допустимая стандартная неопределенность измерения: BCR-ABL1 на основе биологических вариаций | < двукратно на значимом с медицинской точки зрения уровне 0,1 % IS, что является основным молекулярным откликом; <5 раз — на более низких уровнях |
Прослеживаемость калибратора | Аттестованные эталоны: ERM®-AD623a, ERM®-AD623b, ERM®-AD623c, ERM®-AD623d, ERM®-AD623e, ERM®-AD623f |
Неопределенность калибратора, копий/мкл | He применяется. Калибратор содержит последовательность для обоих генов для измерения исходных значений транскрипта. Неопределенность калибратора не может быть выражена в виде отношения и учтена при вычислении неопределенности измерения |
Смещение | Скорректировано в IS производителем набора и прослеживается к 1-й Международной генетической референтной группе ВОЗ для количественного определения транслокации BCR-ABL с помощью ОТ-кПЦР (код NIBSC:09/138WHO) |
46
Окончание таблицы А. 16
ГОСТ Р 70413—2022
Компонент (аналит) | Транскрипты гибридного гена BCR-ABL1 (РНК) | |
Сообщаемые значения | Глубокие молекулярные отклики в соответствии с рекомендуемыми пороговыми значениями контрольного гена [29] | |
Референтные значения | Динамический диапазон IS составляет 10 % от IS и ниже. В соответствии с международными рекомендациями значения ниже 10 % IS, 1 % IS и 0,1 % IS через 3, 6 и 12 мес терапии ингибиторами тирозинкиназы указывают на оптимальный отклик, и изменение терапии не требуется | |
IQC | Уровень контроля 1 низкий | Уровень контроля 2 высокий |
Период | 1/12/12 по 9/6/13 | |
Номер партии | L/11 | Н/11 |
Л/ | 150 | 150 |
Среднее (BCR-ABL1/ABL1, % IS) | 0,06 | 15,00 |
u(BCR-ABL1/ABL1, % IS) | 0,012 | 2,200 |
U(BCR-ABL1/ABL1, % IS) k = 2, 95 %-ный уровень доверия | 0,024 | 4,400 |
^ % | 20,0 | 14,7 |
Пригодность для цели | Пригодна | Пригодна |
А.12 Неопределенность измерения антител IgG к краснухе
Для измерения антител IgG к краснухе значения, полученные для каждой последующей партии IQC, были раздельно собраны для вычисления uRw(Rub).
Полный рабочий пример и вычисления для неопределенностей приведены в таблице А. 17.
Таблица А. 17 — Рабочий пример. Оценка неопределенности измерения антител к краснухе IgG
Компонент(аналит) | IgG антитела к вирусу краснухи |
Измеряемая величина | Активность антител IgG в плазме/сыворотке к антигену вируса краснухи |
Метод измерения | Иммуноферментный анализ по методу «сэндвич» с детектированием прямой хемилюминесценцией |
Методика измерения | Производитель Е в соответствии с инструкциями производителя (см. руководство) |
Единица измерения | кМЕ/л — условные единицы |
Прослеживаемость калибратора | Первый международный стандарт ВОЗ для иммуноглобулина против краснухи (RUBI-1-94) |
Смещение | 0,28 кМЕ/л [оценивают относительно среднего значения экспертной группы EQA (цикл 1/01/15-30/06/15)]. Приемлемо (не требует корректировки) |
Референтные значения | <5,0 кМЕ/мл — не обнаружено; 5,0—9,9 кМЕ/мл — сомнительно; >10,0 кМЕ/мл — обнаружено |
Допустимая максимальная стандартная неопределенность измерения | В пределах 20 % для экспертной группы сверстников EQA |
Долговременная прецизионность | |
Период | 11/12/15-14/03/16 |
Партия калибратора 378 Партия реагента 640 | Калибратор 1: 7,0, Ucal = 0,188 кМЕ/л; к = 2; %Ucal= 2,68571 = 2,7 %. Калибратор 2: 400, Uca/ = 5,607 кМЕ/л; к = 2; %Ucal = 1,40175= 1,1 % |
47
ГОСТ Р 70413—2022
Окончание таблицы А.17
Компонент(аналит) | IgG антитела к вирусу краснухи | ||
IQC | Уровень 1 | Уровень 2 | Уровень 3 |
Исследуемые диапазоны | 5,0—9,9 кМЕ/мл | 10,0—50,0 кМЕ/мл | >50,0 кМЕ/мл |
Партия IQC | 51 333 | 53 655 | 54 778 |
Л/ | 68 | 68 | 68 |
Среднее, кМЕ/мл | 8,11 | 19,97 | 122,33 |
u^Rub), кМЕ/мл | 0,610 | 1,440 | 8,440 |
^к = 2 | 1,220 | 2,880 | 16,880 |
™Rw | (1,22/8,11) • 100 = = 15,04316 = 15,0 % | (2,88/19,97) • 100 = = 14,42163 = 14,4 % | (16,88/122,33) - 100 = = 13,79874 = 13,8 % |
%URw(Rub) = | |||
^2,685712 +15,043162) = = 15,28100 = 15,3 % | ^2,685712 +14,421632) = = 14,66958 = 14,7 % | ^(l,401752 + 13,798742) = = 13,86976 = 13,9 % | |
= yl(%uL^^w^ 95 %-ный уровень доверия | |||
Период | 15 марта 2016 г. — 13 июня 2016 г. | ||
Партия калибратора 413 Партия реагента 765 | Калибратор 1: 7,4, Ucal= 0,198 кМЕ/мл; к = 2; %Uca/= 2,67568 = 2,7 %. Калибратор 2: 3574, Ucal = 5,311 кМЕ/мл; к = 2; %Ucal = 1,48768 = 1,5 % | ||
Партия IQC | 52 661 | 53 690 | 54 394 |
Л/ | 85 | 85 | 76 |
Среднее, кМЕ/мл | 7,5 | 21,3 | 118,9 |
uRw(Rub), кМЕ/мл | 0,53 | 1,75 | 10,36 |
^rw^ = 2 | 1,06 | 3,50 | 20,72 |
™Rw | (1,06/7,5)- 100 = 14,13333 = = 14,1 % | (3,5/21,3)-100 = 16,43192 = = 16,4 % | (20,72/118,9) • 100 = = 17,42641 = 17,4 % |
%URw(Rub) = | |||
^2,675682+14,133332^ = = 14,38438 = 14,4 % | ^2,675682 +16,431922) = = 16,64834 = 16,6 % | ^(l,487682+17,426412) = = 17,48980 = 17,5 % | |
■ ^[%ulll+%u^] 95 %-ный уровень доверия | |||
Объединенная %U для двух партий реагента % U(Rub) | |||
^(15,281 ОО2+ 14,384382)/2j = = 14,83946 = 14,8 % | Jjl 4,669582 +16,648342) / 2j = = 15,69018 = 15,7 % | ^|l 3,869762 +17,489802) / 2j = = 15,78391 = 15,8 % | |
Применяется к результатам пациентов3 | ±14,8 % | ±15,7 % | ±15,8 % |
а Применяют выбранное значение %U в зависимости от результата пациента относительно интервала IQC. | |||
Примечание — Статистическая обработка иса/ является сложной, если калибровочная кривая основана на более чем одном значении калибратора. Для практических целей, как и в приведенном выше случае, можно сделать профессиональную оценку по выбору калибратора, который считается наиболее подходящим для каждого уровня IQC. Это показывает, что ucai вносит незначительный вклад в %U(Rub).
А.13 Неопределенность измерения поверхностного антигена гепатита В
В данной автоматизированной методике измерения поверхностного антигена гепатита В (HBsAg) используют согласованные партии калибраторов и реагентов, которые в зависимости от рабочей нагрузки меняются с интервалами от 2 до 4 мес. В данном рабочем примере (см. таблицу А.18) одно изменение партии IQC осуществляют
48
ГОСТ Р 70413—2022
для каждого уровня, что требует раздельного сбора и вычисления значений IQC. Если бы одна и та же партия IQC использовалась как для партии калибратора, так и для реагента, данные IQC можно было бы рассматривать как единый набор данных.
Таблица А.18 — Рабочий пример. Оценка неопределенности измерения поверхностного антигена гепатита В
Компонент (аналит) | HBsAg | |
Измеряемая величина | Активность антител IgG в плазме/сыворотке к поверхностному вирусу гепатита В | |
Единица измерения | Отношение выборки/отсечки (S/Co) = значение индекса | |
Метод измерения | Иммуноферментный анализ по методу «сэндвич» с детектированием прямой хемилюминесценцией | |
Методика измерения | Производитель F | |
Прослеживаемость калибратора | Прослеживаемость к WHO IRS 00/588 | |
Смещение, значение индекса | 0,17 — оценено относительно среднего значения экспертной группы EQA (цикл 1/03/15-30/11/15): приемлемо (никаких действий) | |
Опорные значения | S/Co < 1 — негативные От >1 до < 50 — положительные | |
Допустимая стандартная неопределенность измерения | В пределах 20 % для экспертной группы сверстников EQA | |
Долговременная прецизионность | ||
Период | 9 марта 2015 г. — 15 июня 2015 г. | |
Партия калибратора 431 Партия реагента 431 | %Uca/= 4,0 %; к= 2 | |
IQC | Уровень 1 | Уровень 2 |
Номер партии | 327 | 337 |
N | 73 | 73 |
Среднее значение индекса | 1,38 | 5,48 |
WHBsAg) | 0,080 | 0,360 |
0,160 | 0,720 | |
™RW | (0,160/1,38) • 100 = 11,59420 = 11,6 % | (0,720/5,48) • 100 = 13,13869 = 13,1 % |
%U(HBsAg) = ^(%U^al+%U^ = = 95 %-ный уровень доверия | 7(4,02 +11,594202 ) = 12,26481 = = 12,3 % | 7(4,02 +13,138692) = 13,73409 = 13,7 % |
Период | 16 июня 2015 г. — 15 сентября 2015 г. | |
Партия калибратора 501 Партия реагента 501 | %С/са| = 3,9 %; к=2 | |
IQC | Уровень 1 | Уровень 2 |
Номер партии | 378 | 388 |
Л/ | 81 | 81 |
Среднее значение индекса | 1,40 | 5,37 |
WHBsA9) | 0,100 | 0,310 |
Urw^ = 2 | 0,200 | 0,620 |
°^Rw | (0,200/1,40) • 100 = 14,28571 = 14,3 % | (0,620/5,37) • 100 = 11,54562 = 11,5 % |
49
ГОСТ Р 70413—2022
Окончание таблицы А. 18
Компонент(аналит) | HBsAg | |
%U(HBsAg) = ^/M^+VM^) = = 95 %-ный уровень доверия | ^(з,92+ 14,285712) =14,80849 = = 14,8 % | ^(3,92 +11,545622) = 12,18652 = = 12,2 % |
Объединенная %U для двух партий реагента; %L/(HBsAg) | ||
^[l2,264812 + 14,808492|/2] = = 13,59627 = 13,6 % | ^[(13,734092 +12,1865221/ 2^ = = 12,98338 = 13,0 % | |
Применяют к результатам пациентов | ±13,6 % | ±13,0 % |
А.14 Неопределенность счетной концентрации эритроцитов и общего содержания лейкоцитов в моче при использовании ручного метода
Подсчет количества клеток в моче в ручном режиме может проводить один оператор и более. Так как надежность процедур ручного подсчета зависит от навыков оператора, следует оценить неопределенность между операторами [30], [31].
Как показано в таблице А. 19, 12 операторов в течение дня выполнили подсчет эритроцитов и общего количества лейкоцитов в каждом из двух анализов мочи и общий подсчет лейкоцитов в третьем анализе мочи. Каждый оператор загружал в счетную сетку образец, случайным образом использовал один из пяти микроскопов и не знал о результатах, полученных другими операторами. Оценка между операторами общего количества эритроцитов или концентраций лейкоцитов в моче соответствуют распределению по Гауссу, поэтому неопределенность измерения и вычисляют обычным образом.
Таблица А.19 — Пример с решением — Оценка неопределенности количества эритроцитов в моче (RBC) и количества лейкоцитов (WBC)
Оператор | Моча 1 | Моча 2 | Моча 3 | ||
RBC/мкл | WBC/мкл | RBC/мкл | WBC/мкл | WBC/мкл | |
1 | 11 | 13 | 116 | 96 | 250 |
2 | 13 | 23 | 77 | 88 | 153 |
3 | 26 | 20 | 119 | 101 | 137 |
4 | 27 | 22 | 113 | 113 | 348 |
5 | 28 | 30 | 108 | 118 | 290 |
6 | 28 | 18 | 103 | 110 | 230 |
7 | 16 | 10 | 155 | 128 | 240 |
8 | 13 | 16 | 121 | 117 | 280 |
9 | 14 | 9 | 130 | 118 | 248 |
10 | 12 | 15 | 175 | 130 | 297 |
11 | 25 | 10 | 130 | 95 | 255 |
12 | 13 | 10 | 110 | 118 | 230 |
Среднее значение клеток/мкл | 18,83333= 18,8 | 16,33333 = 16,3 | 121,41667 = 121,4 | 111,00000 = 111,0 | 246,50000 = 246,5 |
и (между операторами), клетки/мкл | 7,17107 = 7,17 | 6,51339 = 6,51 | 2499985 = 25,00 | 13,30755 = 13,31 | 58,21043 = 58,21 |
U, к = 2, клетки/мкл, = 95 %-ный уровень доверия | 14,34214 = 14,34 | 13,02678 = 13,03 | 49,99970 = 50,00 | 26,61510 = 26,62 | 116,42086 = 116,42 |
%4el | 76,15296 = = 76,2 % | 79,75581 = = 76,8 % | 41,18026 = = 41,2 % | 23,97757 = = 24,0 % | 47,22956 = = 47,2 % |
50
ГОСТ Р 70413—2022
Неопределенность, обусловленная оператором, также должна оцениваться каждым, кто выполняет измерение в течение короткого периода времени (исследование воспроизводимости), путем подготовки и подсчета 10 или более проб из одного и того же анализа мочи.
В этом случае суммарную неопределенность для каждого отдельного оператора и вычисляют по формуле
^и2 (между операторами) + и2 (оператора)J.
и =
Примечание — Предельно изменяющаяся неопределенность при подсчете небольшого количества клеток предполагает, что единообразный отбор анализа мочи является основным ограничением, которое может повлиять на медицинскую интерпретацию результатов.
51
ГОСТ Р 70413—2022
Приложение В (справочное)
Пример применения неопределенности измерения к интерпретации результата
Когда результаты клинических образцов близки к пределам медицинских решений или изменения в результатах исследуемого объекта относительно малы во времени, рассмотрение MU можно применить в интерпретации результата.
Пример 1 — Определение того, превышает ли измеренное значение предел медицинского решения.
Клинический образец С. Концентрация простат-специфического антигена (PSA) в сыворотке = = 4,3 мкг/л.
Вопрос медицинской интерпретации: существует ли уровень доверия >95 °/о тому, что результат значительно превышает предел медицинского решения, равного 4,0 мкг/л для пациента в возрасте 61 год?
u(PSA) оценена как 0,14 мкг/л на основании просуммированных неопределенностей для иса1 (приведенной производителем) и uRw, полученных для среднего значения IQC 3,6 мкг/л.
Если измерение клинического образца С выполнено много раз в условиях повторяемости, будут ли >5 % результатов ниже 4,0 мкг/л? Это называется односторонним распределением, для которого уровень доверия =95 7о требует г-показателя 1,65 (см. [32]).
Лаборатория будет иметь уровень доверия =95 7о в том случае, если результат будет ощутимо выше 4,0 мкг/л, при результате >4,0 + (1,65 ■ 0,14) = >4,23 мкг/л. Для обеспечения достоверности >95 7о неопределенность округляют до следующей значащей цифры, т. е. 4,23 округляют до 4,3. Методика измерения PSA позволяет надежно различать измеренные значения 4,0 (предел медицинского решения) и >4,3 мкг/л.
Примечание — В данном примере рассмотрена только неопределенность измеренных значений. При определении того, являются ли два значения физиологически разными (см. ниже), также необходимо учитывать индивидуальную внутреннюю биологическую вариацию.
Пример 2— Определение, отличаются ли значения последовательных измерений одного пациента.
Два результата PSA с разницей в один год пациента С были равны 4,4 и 4,8 мкг/л. Можно ли с уровнем доверия >95 7о утверждать, что эти два измеренных значения PSA различаются?
Примечание — В данном примере рассмотрена только неопределенность измеренных значений. При определении того, являются ли два последовательных значения для одного и того же субъекта физиологически разными, также необходимо учитывать индивидуальную внутреннюю биологическую вариацию (см. пример 3).
Повторно измеренное значение имеет равную вероятность изменения вверх или вниз, поэтому распределение других возможных значений для каждого результата является двунаправленным. Z — показатель для двунаправленного распределения с уровнем доверия =95 7о, составляет 1,96. Так как u(PSA) для каждого результата одинакова, два измеренных результата будут разными (уровень доверия =95 %), если их значения отличаются >z ■ 4? u(PSA). См. [32] для дополнительной информации.
Как и в примере 1, u(PSA) оценена как 0,14 мкг/л.
Решение формулы: [z- 4? ■ u(PSA)] = 1,96 -4? 0,14 мкг/л = 0,39 мкг/л.
Таким образом, второй результат должен быть > 4,4 + 0,39 = >4,79 мкг/л, чтобы заметно отличаться от первого значения. Два результата заметно различаются (уровень доверия =95 %).
Пример 3 — Суммирование неопределенностей, полученных в процессе измерения и до измерения.
Для некоторых измеряемых величин для оптимальной интерпретации результата следует учитывать как MU, так и индивидуальную внутреннюю биологическую вариацию. Для этой цели и(у) суммируют (см. А.2.4) с SD индивидуальной внутренней биологической вариации (CVj).
Концентрация PSA в сыворотке пациента С 4,3 мкг/л. Принимая во внимание и MU, и индивидуальную внутреннюю биологическую вариацию, является ли результат достоверно выше верхнего контрольного предела, равного 4,0 мкг/л для уровня доверия =95 7о?
uMU(PSA)= 0,14 мкг/л при средней концентрации IQC 3,6 мкг/л,
где uMU(PSA) является только MU.
Средняя индивидуальная внутренняя биологическая вариация CVW(PSA): 18,1 %;
SDW результата концентрации образца пациента С: 4,3 ■ 18,1/100 = 0,7783 = 0,78 мкг/л.
uTO7{PSA): ^(0,142 + 0,77832^ = 0,7908 = 0,79 мкг/л,
где uT01(PSA) — это полная суммарная неопределенность, включая и MU, и биологические неопределенности.
Как и в примере 1, уровень доверия =95 7о требует z-показателя 1,65. Чтобы результат при =95 7о-ной вероятности был как измеримым, так и биологически более высоким (однонаправленное
52
ГОСТ Р 70413—2022
распределение), чем верхний предел принятия решения, равный 4,0 мкг/л, результат клинического образца должен быть >(1,65 • 0,79) + 4,0 = >5,3 мкг/л. Значение 4,3 мкг/л не превосходит аналитически и физиологически предел принятия решения. Как и в данном примере, индивидуальная внутренняя биологическая вариация зачастую является преобладающей неопределенностью при интерпретации результата.
Для двух результатов PSA от одного и того же человека с вероятностью ~95 %, отличающихся больше, чем может быть объяснено суммарным эффектом от MU и индивидуальной внутренней биологической вариации (двунаправленное распределение) на результат каждого пациента, z-показатель равен 2,77 (1,96 ■ 42 ). Таким образом, два результата должны отличаться как минимум на 2,77 ■ суммарная неопределенность 0,79 мкг/л = 2,2 мкг/л. Это отличие представляет собой минимальное статистическое разделение, необходимое для того, чтобы два результата различались больше, чем может быть объяснено суммарным эффектом MU и индивидуальной внутренней вариации. Для примера 2 результаты PSA пациента С для образцов, взятых с интервалом в один год, составили 4,4 и 4,8 мкг/л; концентрация PSA увеличилась на 0,4 мкг/л. Второй результат увеличен намного менее, чем на 2,2 мкг/л, и, следовательно, не отличается ни с биологической точки зрения, ни с точки зрения измерения от первого результата при уровне доверия ^95 %.
53
ГОСТ Р 70413—2022
Приложение С (справочное)
Дополнительная информация по некоторым аспектам неопределенности
С.1 GUM и неопределенность измерения для медицинских лабораторий
Количественная методика измерения сравнивает значение сигнала, создаваемого измеряемым свойством вещества, тела или явления (величиной), с соответствующей основой для сравнения, выражая результирующее отношение в виде числового значения по отношению к соответствующей единице измерения. Во всех областях измерения многократные измерения одного и того же образца при предположительно идентичных условиях измерения будут, как правило, давать различные числовые значения для измеряемой величины. Различные значения включают в себя различные величины погрешности измерения, поэтому существует неопределенность в отношении значения измеряемой величины.
Понятия истинного значения, смещения и погрешности измерения теоретически значимы, но на практике их значения не могут быть точно установлены, так как смещение и непрецизионность влияют на все измерения, включая, но не ограничиваясь, теми, которые предназначены для присвоения значений сертифицированным стандартным образцам, калибраторам для методик измерения в медицинских лабораториях и результатам измерения параметров клинических образцов, полученных в медицинских целях.
Руководство GUM является основополагающим справочным документом высокого уровня и, в основном, касается измерений четко определенных величин, таких как температура, масса, длина, радиоактивность. GUM требует установления источников неопределенности, оценки их значений, а также математической модели их взаимодействия для статистической оценки неопределенности результатов измерений.
Метод моделирования GUM непросто применять в медицинских лабораториях в связи с тем, что,
- пригодные с медицинской точки зрения аналиты могут быть физически и химически недостаточно определены;
- методики измерений могут иметь недостаточную аналитическую селективность;
- стандартные образцы и/или референтные методики измерений, подходящие для оценивания смещения, могут быть недоступны;
- измерительные системы могут быть «закрыты» и не поддаваться статистическому оцениванию отдельных источников неопределенности.
С.2 Практический подход к неопределенности измерения в медицинских лабораториях
Некоторыми основными концепциями подхода GUM, применяемыми в данном руководстве, являются:
- определение величины, подлежащей измерению (измеряемая величина);
- истинное значение измеряемой величины — «истинное» считается избыточным и является теоретическим значением; предпочтительнее использовать термин «значение измеряемой величины»;
- признание того, что измеренное значение является оценкой значения измеряемой величины вследствие эффектов от непрецизионности, неполной поправки на смещение и неидеальной аналитической селективности;
- устранение действующих значимых, с медицинской точки зрения смещений;
- оценивание систематических и случайных неопределенностей статистически одинаковым образом;
- использование данных внутреннего контроля качества IQC для оценивания неопределенности измерения MU;
- выражение неопределенности измерения в виде стандартного отклонения SD или относительного SD-,
- оценка MU, позволяющая определить множество возможных значений, которые, как предполагается, включают с установленной вероятностью значение измеряемой величины.
С.З Значение измеряемой величины
Так как значения погрешностей измерений не могут быть точно установлены, то и значения измеряемых величин не могут быть точно известны, следовательно, все измеренные значения являются оценками. Оцененные значения не имеют практической пользы без некоторой количественной информации относительно их качества. Для конкретной измеряемой величины оценка MU может быть использована для определения интервала возможных значений данной величины (интервал охвата) с заданным уровнем доверия. Большинство медицинских лабораторных измерений параметров клинических проб выполняют однократно, и, следовательно, измеренное значение считается приемлемой оценкой значения измеряемой величины, а соответствующая оценка неопределенности является количественной мерой неопределенности относительно достоверности результата.
Более одного типа методики измерений может быть доступно для одной и той же измеряемой величины, поэтому наиболее точная оценка значения измеряемой величины и ширина интервала охвата могут различаться между различными методиками измерений в зависимости от метрологической прослеживаемости калибратора конечного пользователя, а также в зависимости от аналитических характеристик каждой из методик измерения. Такие различия могут быть относительно небольшими, если результаты, полученные с помощью разных методик измерения, имеют метрологическую прослеживаемость к одной и той же единице измерения СИ. Но большие различия могут возникать, если прослеживаемость результата ограничена прослеживаемостью к условным произвольным
54
ГОСТ Р 70413—2022
единицам измерения, или внутренними методиками производителя, или в том случае, если коммутативность стандартного образца отсутствует. Поэтому при определении измеряемой величины следует указывать методику измерения, которая будет применена.
С.4 Неопределенность значений, присвоенных калибраторам конечного пользователя, иса/
Значения измеряемой величины, приписанные калибраторам для методик измерений, реализуемых конечным пользователем, прослеживаются к определенному стандартному образцу или к референтной методике измерения. Одни из этих основ для сравнения метрологически прослеживаемы к единицам измерения СИ, имеющим наивысший метрологический уровень, а другие — к общепризнанным стандартным образцам метрологически более низкого уровня (не единицам СИ) или к общепринятым референтным методикам измерений. Так как в настоящее время не для всех измеряемых величин существуют подобные основы для сравнения, калибраторам присваивают значения с помощью внутренних методик производителя, для которых может отсутствовать дальнейшая (до следующего метрологического уровня) прослеживаемость. Однако все приписанные значения калибратора конечного пользователя имеют неопределенность, которая дает вклад в общую неопределенность результата измерения.
Приписывание значений калибраторам конечного пользователя требует передачи правильности от соответствующего стандартного образца или референтной методики измерений с помощью одной или более промежуточных методик измерений (калибровочная иерархия), каждый шаг которой требует калибровки и присвоения значения (см. рисунок С.1). Такие иерархии могут состоять из нескольких шагов, если основа для сравнения наиболее высокого уровня прослеживается к СИ, или из меньшего количества шагов, если значения калибратора приписывает производитель, использующий внутренние методики. Присвоенные значения даже стандартных образцов наивысшего уровня имеют соответствующие неопределенности, в которые каждый промежуточный калибровочный шаг вносит дополнительную неопределенность. Полное описание требований для метрологической прослеживаемости значений, приписанных калибраторам конечного пользователя, приведено в [4].
Материалы
Передача правильности измерения
Приписанное значение
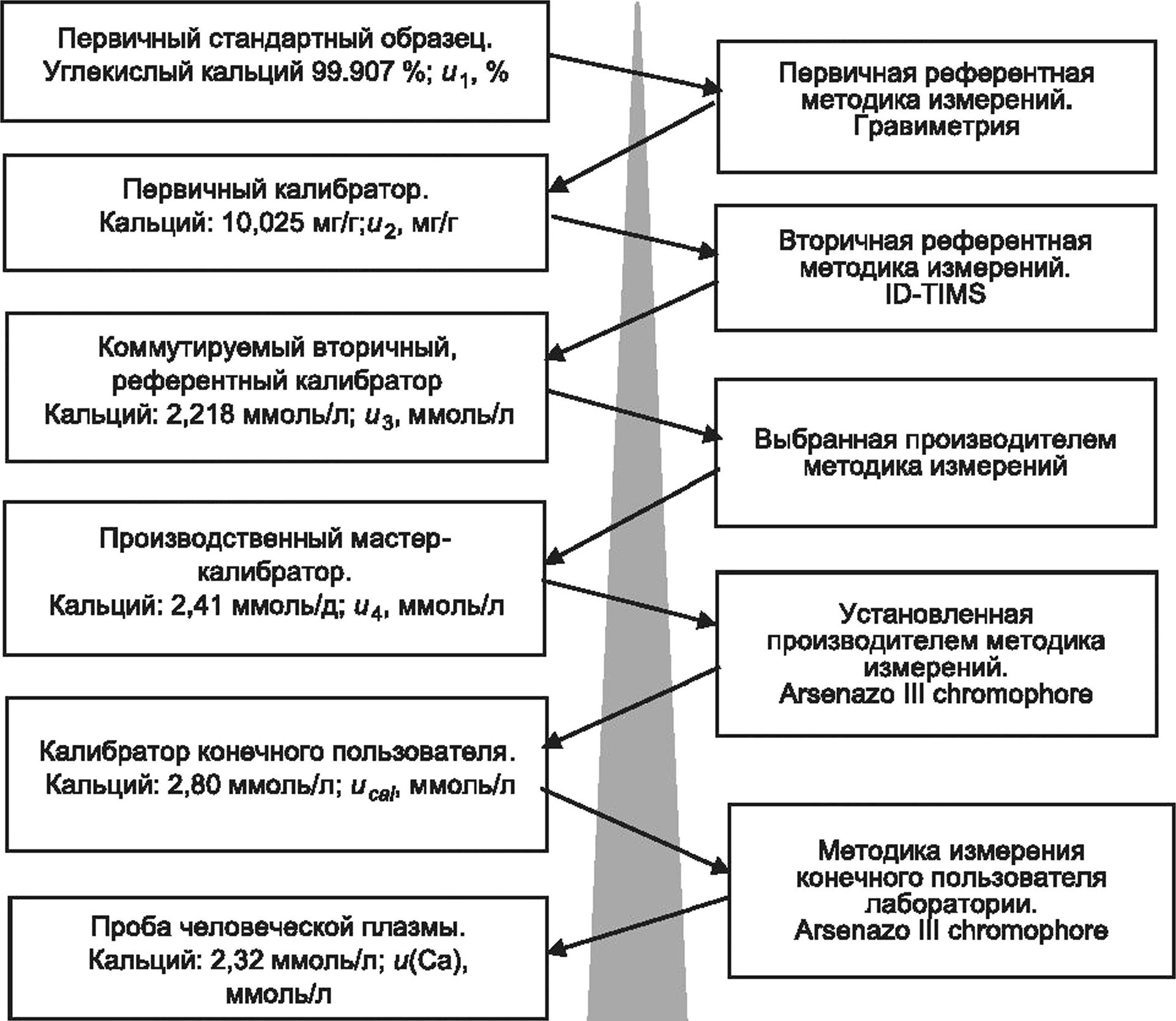
Ответственность
4
। ।
। Метрологические институты/ референтные
■ измерительные
[ (калибровочные) лаборатории
।
4
4
Производители калибраторов конечного пользователя и измерительных систем
▼
4 i
। Медицинские
{ лаборатории
*
Метрологическая прослеживаемость
Увеличение неопределенности приписанного значения
Рисунок С.1 — Пример калибровочной иерархии для измеряемой величины с полной метрологической прослеживаемостью к единице СИ
55
ГОСТ Р 70413—2022
Рисунок С.1 показывает типовые источники неопределенности в тех случаях, когда приписанное значение измеряемой величины калибратора конечного пользователя прослеживается к единицам СИ. Калибровочная иерархия состоит из первичных эталонов твердых кристаллических материалов с прослеживаемым к СИ значением массовой доли для карбоната кальция и с соответствующей неопределенностью измерений и, обусловленной первичными аналитическими химическими методами для определения ее тождественности и чистоты и^ Первичный калибратор содержит первичный стандартный 10 %-ный раствор азотной кислоты, а последующие калибраторы являются матрично-подобранными биологическим пробам (человеческой плазме). Каждый следующий шаг калибровки/присвоения значения в иерархии вносит дополнительную неопределенность в значение, окончательно присвоенное калибратору конечного пользователя и^. Если основа для сравнения высшего уровня недоступна, производитель может приписать значения калибратора, используя внутренние методики измерения, в этом случае калибровочная иерархия, как правило, сокращается.
С.5 Оценка неопределенности поправки на смещение ubjas
С.5.1 Обзор ключевых концепций и процессов
Когда медицинская лаборатория вносит поправку на установленное смещение (если это допустимо по национальным нормативным актам), вычисление оценки суммарной MU должно учитывать неопределенность поправки “bias (см- 6-6)-
Неопределенность поправки на смещение ubias состоит:
- из неопределенности опорного значения uref (из сертификата на стандартный образец) для стандартного образца, используемого медицинской лабораторией для оценки смещения;
- SD стандартного отклонения (неопределенности) среднего значения для стандартного образца, полученного в условиях повторяемости по методике лаборатории SDmean
Если бы исследование в условиях повторяемости было проведено много раз, то, как правило, были бы получены незначительно отличающиеся средние значения для стандартного образца; следовательно, среднее значение содержит неопределенность. Это необходимо для количественного определения неопределенности как SD, то есть ожидаемой дисперсии среднего значения. Вместо проведения такого непрактичного исследования стандартная неопределенность среднего опорного значения SDmean может быть определена с помощью единичного исследования повторяемости и вычислена по формуле
$Dmean = SD<Jn, (С.1)
где SD — стандартное отклонение повторных измерений стандартного образца;
п — количество полученных значений.
Затем неопределенность смещения ubias вычисляют суммированием дисперсий двух составляющих неопределенности по формуле
ubias = ^rel + ^^теап ’ (С.2)
где uref— неопределенность опорного значения, полученная из сертификата на стандартный образец.
В целом, процесс оценивания ubias приведен на рисунках С.2 и С.З.
Рисунок С.2 иллюстрирует отношение между приписанным значением измеряемой величины в стандартном образце и средним значением, полученным в условиях прецизионности, для измеряемой величины данного стандартного образца с применением лабораторной методики измерения конечного пользователя.
xmf - ^mf

Единицы измерения —^-^^—*
56
xmf xiab 4...............1
Значительное смещение
Рисунок С.2 — Оценивание неопределенности поправки на смещение: оценивание смещения urefn SDmean стандартного образца
ГОСТ Р 70413—2022
Примечание к рисунку С.2
xref, uref—установленные значения измеряемой величины и соответствующая и для стандартного образца;
x/ab, SDmean — среднее значение и стандартное отклонение средних значений измеряемой величины для стандартного образца, полученные в условиях прецизионности с применением лабораторной методики измерения конечного пользователя.
Bias = xref-x/ab;
SDmean ~ SD^fn I П
где SD — стандартное отклонение повторяемости данных;
п — количество значений повторяемости.
На рисунке С.З показано, каким образом вычисляют ubias после того, как определено скорректированное значение хсогг стандартного образца.
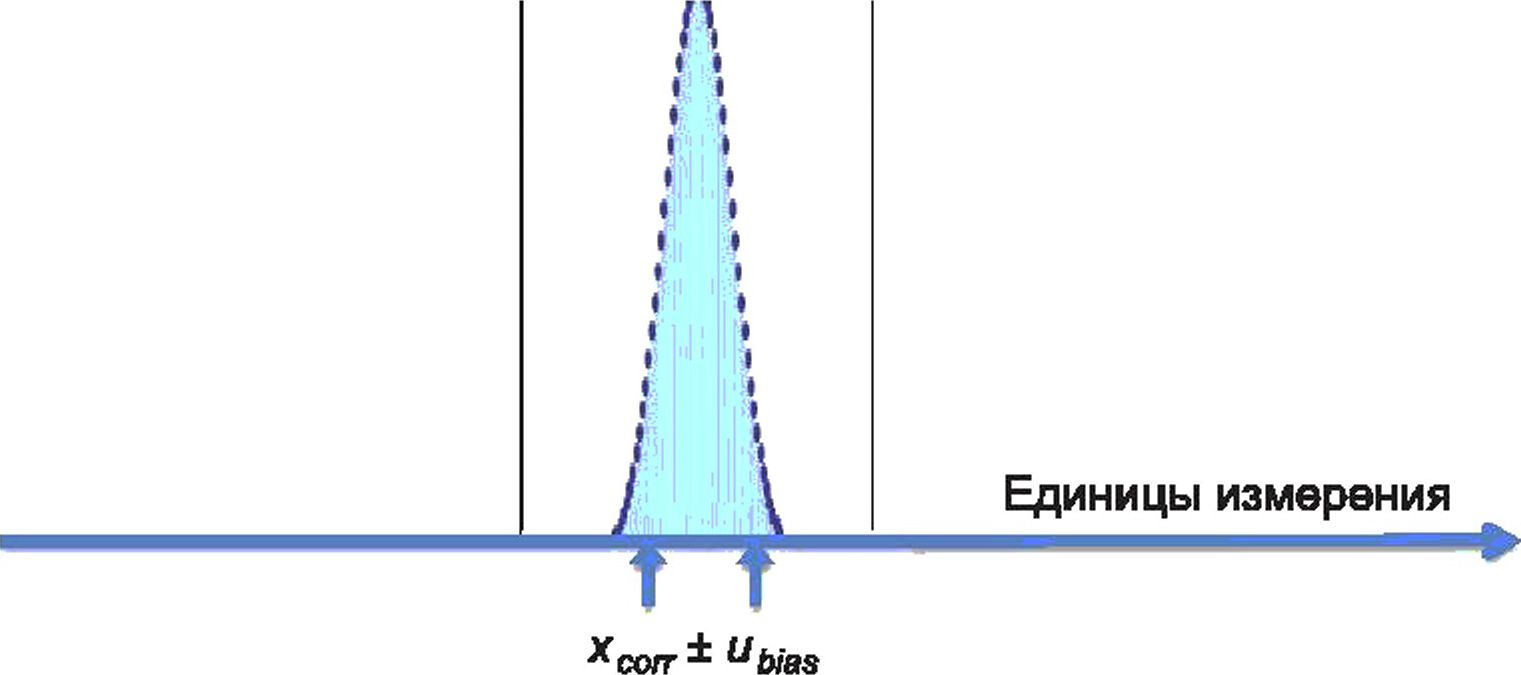
Рисунок С.З — Оценивание неопределенности поправки на смещение: вычисление ubjas для скорректированного значения стандартного образца
Примечание к рисунку С.З
хсогг— пересмотренное значение х/аЬ после введения поправки на значимое смещение;
uref— получено из сертификата производителя на стандартный образец;
SDmean— определено, как описано выше.
Примечание 1 — Там, где смещение должно быть оценено с использованием стандартных образцов, отличных от стандартных образцов более высокого уровня, например в схеме EQA, могут быть доступны не все данные, необходимые для полноценной оценки ubjas.
Примечание 2 — Согласно некоторым национальным правилам методики измерений должны быть выполнены точно в соответствии с инструкциями производителя, следовательно медицинским лабораториям может быть запрещено уточнение значений калибратора конечного пользователя или использование поправочных коэффициентов с целью устранения значимых с медицинской точки зрения смещений измерений.
С.5.2 Принятие решений, если оцененное смещение значимо
Должна ли поправка на известное смещение быть учтена для оценки неопределенности измерения, в целом, начинается с определения статистической значимости наблюдаемого смещения. Даже если смещение является статистически значимым, конечная оценка значимости какой-либо поправки на смещение должна быть основана на ее влиянии на медицинскую интерпретацию результатов измерений.
Оценку смещения считают статистически значимой, если выполнено условие
^xref xlab\ > 2 ' ubias’
(С.З)
где xref — опорное значение аналита У для конкретного клинического образца s-, xiab — среднее значение для аналита У в клинических образцах s^ применением лабораторной измерительной системы;
ubias — неопределенность оцененного смещения между xrefw xlab.
Пример — Коммутативный сертифицированный стандартный образец (CRM) использован для оценки смещения измерительной системы в одиночной лаборатории для оценивания молярной концентрации аналита Y в плазме.
57
ГОСТ Р 70413—2022
Приписанное значение CRM аналита Y:4,15 ммоль/л
и ге^У)'0,040 ммоль/л.
Значение иге^у) получено из сертификата производителя материала CRM. Следует отметить, что сертификаты CRM обычно указывают неопределенность как расширенную неопределенность U, в этом случае значение из сертификата необходимо разделить на значение, указанное для к.
По лабораторной методике CRM измеряют 10 раз (т. е. п = 10) для аналита Y в условиях повторяемости следующим образом:
- CRM среднее значение (х/аЬ) = 3,72 ммоль/л;
‘ uiab = 9’^ ммоль/л (где и1аЬ — стандартное отклонение измерительной системы в условиях повторяемости с количеством п = 10 повторных измерений);
- SDmean -utab4n = 0,11>/l0 = 0,034785 = 0,035 ммоль/л (см. 3.3 7)
Стандартную неопределенность оцененной поправки на смещение ubjas вычисляют путем объединения двух компонентов неопределенности uref = 0,040 и SDmean = 0,035, выраженных как дисперсия по формуле
ubias “ ^^ref (у) + S^mean^’ (С.4)
ubias = ^(о,О42 + 0,0347852) = 0,053009 = 0,053 ммоль/л.
Смещение, равное xref-Xiab = 4,15 - 3,72 = 0,43 ммоль/л (к = 2 =95 %-ный уровень доверия)
Исследование: статистически значимые смещения присутствуют, когда xrel - xlab > 2ubjas = = 2 ■ 0,53 ммоль/л или >0,11 ммоль/л.
Смещение, равное xrel - х1аЬ = 0,43 ммоль/л, то есть > 0,11 ммоль/л, в таком случае является статистически значимым:
- %> смещение =(0,43 ммоль/л/4,15 ммоль/л) ■ 100 = 10,4 %>;
°/oUbias = (0,053009 ммоль/л/0,43 ммоль/л) ■ 100 = 12,32767 = 12,3 %.
Основываясь на статистической значимости поправки на смещение, Ubjas должна быть учтена для внутрилабораторной оценки и(у) и вычислена по формуле
U(у) = ^ubias + ucal + uRw > (С.5)
где u2bias(°’053009)2 = 0,002810;
иса1 — предоставлена производителем калибратора, используемого для лабораторной измерительной системы для аналита Y;
uRw — определена лабораторией на основании долгосрочных данных IQC.
Как ранее установлено, окончательное определение значимости какого-либо компонента неопределенности и решение в отношении их включения в лабораторную оценку и(у) должны быть основаны на результате влияния компонента неопределенности на медицинскую интерпретацию итоговых результатов измерений.
С.5.3 Неполные данные для оценивания ubjas
Для некоторых доступных стандартных образцов приписанные значения не обеспечены заявленными неопределенностями. В таких случаях ubjas может быть ограничена неопределенностью среднего значения стандартного образца, полученного лабораторией в условиях повторяемости, и, следовательно, ubias является заниженной.
С.5.4 Неопределенность значений измеряемой величины с учетом поправки на смещение и(усогг)
Если абсолютное значение применяют как поправочный коэффициент на интервале измерения, тогда и(Усогг) — у^и (у) + ubias^-
Если применяют пропорциональный поправочный коэффициент смещения, тогда относительные стандартные неопределенности должны быть применены для вычисления и(усогг).
С.6 Рабочие примеры поправок на смещения ub!as
С.6.1 Пример 1 — Оценивание ublas при поправке на смещение с использованием коммутативного сертифицированного стандартного образца (CRM)
Наличие недопустимого с медицинской точки зрения смещения обнаружено с помощью отчетов EQA. Следовательно, смещение методики измерения оценивают путем измерения коммутативного CRM в условиях повторяемости. Среднее значение смещения по отношению к приписанному значению CRM (среднее смещение, равное xCRM~^iab^ будет иметь неопределенность ubjas, включающую неопределенность xCRM, т. е. U (полученную по CRM сертификата), и стандартную погрешность среднего (SDmean)Xiab (см. С.5.1). В таблице С.1 представлены детальный анализ и вычисления для данного примера.
Примечание — Эксперимент, описанный в данном примере, может быть выполнен только тогда, когда известно, что CRM коммутативен с биологическими пробами.
58
ГОСТ Р 70413—2022
Таблица С.1 — Оценка ubias при введении поправки на смещение с CRM
Компонент (аналит) | Натрий |
Измеряемая величина | Молярная концентрация натрия в сыворотке/плазме/моче |
Метод измерения | Натрий селективный электрод (ISE) — непрямой анализ ISE |
Методика измерения | Оборудование, реагент, калибратор: производитель X Pty Ltd. |
Единица измерения | ммоль/л |
Вторичный референтный калибратор | Сертифицированный стандартный образец CRM —X метрологического института |
Прослеживаемость калибратора конечного использования | Прослеживаемость к СИ — заявление производителя |
Приписанное значение CRM ± U (erm) | (141,8 ± 0,90) ммоль/л (к = 2;~ 95 %-ный уровень доверия) |
u(crm) | 0,90/2 = 0,45000 ммоль/л |
иса/(от производителя калибратора) | 0,63 ммоль/л |
uRw (из лабораторного IQC при длительном исследовании) | 0,85 ммоль/л |
Оценка смещения | |
Повторные измерения CRM (условия повторяемости) | л = 10 |
*lab * SD | 143,4 ± 0,65 ммоль/л |
Смещение \XcRM~^iab\’ % смещение | |141,8 - 143,4| = 1,6 ммоль/л; (1,6/141,8) • 100 = 1,128 35 = 1,1 % |
RD mean | О,65л/7о = 0,20555 = 0,206 ммоль/л |
ubias ~ ^ (егт) + SDmean | Ць/as = Vo>45OOO2 + 0.205552 =0,49472 = 0,49 ммоль/л |
Расширенная неопределенность смещения Ubias, к = 2 | 0,49472 • 2 = 0,98945 = ±0,99 ммоль/л |
Значение смещения ± Ubias | (1,6 ± 0,99) ммоль/л (к = 2; =95 %-ный уровень доверия) |
Значение смещения (1,6 ммоль/л) больше, чем Ubias (0,99 ммоль/л), из чего следует, что лаборатория приняла решение скорректировать результаты на -1,1 % с помощью программного обеспечения оборудования.
Тогда u(Na) = ^^са\ + ubias + uRwj = ^/(0,632 + 0,494722 + 0,852) = 1,16797 = 1,2 ммоль/л; и
U(Na) = 2,33593 = 2,3 ммоль/л (к = 2; =95 %-ный уровень доверия).
%U(Na) = (2,33593/141,8) • 100 = 1,647 34 = 1,6 %; /г = 2; =95 %-ный уровень доверия.
Соответствующий стандартный образец или референтная методика зачастую недоступны для оценивания смещений, в таких случаях введение поправки не представляется возможным.
Примечание — Когда стандартный образец доступен с приписанным значением в произвольных единицах, например в Международных единицах, но без указания неопределенности и если значимое смещение определено и скорректировано, то неопределенность поправки на смещение может быть вычислена лишь частично. Доступная информация обычно ограничена стандартной погрешностью среднего значения SDmean стандартного образца, полученного лабораторией, проводящей исследование с собственной измерительной системой в условиях повторяемости, в этом случае оценка ubias может быть занижена. При этом рекомендуется соблюдать осторожность, так как коммутативность некоторых стандартных образцов не доказана.
С.6.2 Пример 2 — Оценивание неопределенности, включающей поправку на смещение и долгосрочную прецизионность по двум партиям материала IQC
В данном примере по отчетам EQA по окончанию цикла предположили, что методика измерений имела постоянное недопустимое с медицинской точки зрения смещение. Данное смещение подтверждено исследованием
59
ГОСТ Р 70413—2022
повторяемости с использованием коммутативного CRM с подходящей матрицей, по результатам которого получены оценка смещения и неопределенность значения смещения ubias и введен коэффициент пропорциональной коррекции °/oUbias. Долговременная прецизионность включала одну смену партий калибратора и реагентов (обоих) и одно изменение в партии IQC.
Замена партии калибратора: изменение приписанного значения было в пределах спецификации, и то же значение иса/было предоставлено для старой и новой партий. Эти условия позволили обработать данные IQC при замене как единую выборку, поэтому небольшие изменения в значениях IQC обрабатывают как случайную погрешность.
Замена партии реагента: до ввода в эксплуатацию новой партии реагентов лаборатория продемонстрировала, что для группы параметров биологических проб и для двух уровней IQC, полученных с использованием старой и новой партий реагентов, результаты существенно не изменились, что позволяет обрабатывать данные IQC как единую выборку.
Замена партии IQC: так как среднее значение двух партий значительно отличается, необходимо, чтобы изменение абсолютных значений не учитывалось при вычислении SD. Поэтому данные IQC следует обрабатывать отдельно для каждой партии IQC с целью суммирования их индивидуальных неопределенностей.
В таблице С.2 приведены детальный анализ и вычисления для данного примера.
Таблица С.2 — Оценка неопределенности, включающая поправки на смещение и долговременную прецизионность в условиях двух партий материала IQC [33]
Компонент(аналит) | Креатинин | |
Измеряемая величина | Молярная концентрация натрия в сыворотке/плазме/моче | |
Метод измерения | Ферментативное превращение креатинина с образованием хромогена | |
Методика измерения | Реагенты, калибратор, измерительные приборы: производитель X Pty Ltd. | |
Единица измерения | ммоль/л | |
Прослеживаемость калибратора | Прослеживаемость к СИ | |
Приписанное значение калибратора ±U | (345,0 ± 3,24) ммоль/л {к = 2\~ 95 %-ный уровень доверия) | |
ucal | 3,24/2 = 1,62 ммоль/л | |
Оценка смещения | ||
Матрично-подходящий CRM (CRM 365, NMI) в условиях повторяемости | ||
Значение CRM ±U (сертификат поставщика) | (72,9 ±1,61) ммоль/л; к = 2; = 95 %-ный уровень доверия | |
u(crm) | 1,61/2 = 0,805 ммоль/л | |
Исследование повторяемости CRM | ||
Л/ | 10 | |
*lab’ ±SD | 80,1; 1,10 ммоль/л | |
mean | 1,1 7l0 = 0,34785 = 0,35 ммоль/л | |
Смещение | 80,1 - 72,9 = 7,2 ммоль/л; (7,2/72,9) | ■ 100 = 9,87654 = 9,9 % |
ubias ~ ^ (erm) + SDmean | Vo,8O52+O,347852 = 0,87694 = 0,88 ммоль/л | |
Ubias’k = 2 | 1,75388 = 1,75 ммоль/л; (1,7388/72,9) ■ 100 = 2,405 87 = 2,4 % | |
Оценка значения смещения и ubias | (7,2 ± 1,75) ммоль/л; к = 2; 95 %-ный уровень доверия Смещение » 2 ■ Ubias (значимое с точки зрения статистики и медицины). Действие: применить поправочный коэффициент — 9,9 % к результатам. Включить ubias в вычисление суммарной %L/(crea), применяемой к биологическим образцам человека | |
Долгосрочная прецизионность | ||
ЮС | Уровень 1 | Уровень 2 |
Наблюдаемый интервал, ммоль/л | <250,0 | >250,0 |
IQC партия 1 | 22 января 2015 г. — 9 августа 2016 г. | 22 января 2015 г. — 9 августа 2016 г. |
60
Окончание таблицы 0.2
ГОСТ Р 70413—2022
Компонент (аналит) | Креатинин | |
N | 2478 | 2473 |
Среднее, ммоль/л | 70,2 | 517,1 |
uRw, ммоль/л | 1,44 | 5,87 |
и(crea) = ^ulias + Uca/ + uRw^, ммоль/л | = Vo>876942 +1,622 +1,442 = = 2,33817 = 2,34 | = ^0,876Э42 +1,622 + 5,872 = = 6,15226 = 6,15 |
Vou^crea) | (2,33817/70,2) ■ 100 = 3,33073 = 3,3 % | (6,15226/517,1) • 100 = 1,18976 = 1,2 % |
IQC партия 2 | 9 августа 2016 г. — 14 апреля 2017 г. | 9 августа 2016 г. — 14 апреля 2017 г. |
N | 1761 | 1764 |
Среднее, ммоль/л | 79,7 | 569,6 |
uRw, ммоль/л | 1,39 | 5,25 |
u(crea) = ^ulias + u^i + uRw^, ммоль/л | = Jo,876942 + 1,622+1,392 = = 2,30771 = 2,31 | = Vo,876942+1,622+5,252 = = 5,56380 = 5,56 |
% urel(crea) | (2,30771/79,72) -100 = 2,89477 = 2,9 % | (5,56380/569,6) ■ 100 = 0,97679 = 0,98 % |
Объединенная средняя неопределенность (невзвешенная) | ||
Объединенная средняя стандартная неопределенность и(сгеа) = | ||
^2,338172+2,307712|/2] и(сгеа) = 2,322 99 = 2,3 ммоль/л | ^(6,152262 + 5,563802) / 2^ и(сгеа) = 5,865 41 = 5,9 ммоль/л | |
^и2 (сгеа)партия lj + [u2(crea)партия 2/2 j | ||
%ure/(crea) | ||
^[3,ЗЗО732 +2,894772)/2] = | ^(1,189762+0,976792)/2] = | |
= 3,12037 = 3,1 % | = 1,08850 = 1,1 % | |
Допустимый максимум %i/re| (сгеа), основанный на 6 % внутрииндивидуаль-ного биологического изменения (%С^) для креатинина сыворотки крови | Предполагаемая характеристика (спецификация) = 0,5 • % CVW= <3 %. Оптимальная характеристика (спецификация): <1,5 % | |
Замечания об оцененной неопределенности | иге/(сгеа) на границе, если сравнивалось с установленной в лаборатории неопределенности | urei(crea) в пределах оптимальной спецификации качества |
%U(crea), к = 2, =95 %-ный уровень доверия | 3,120 37 % • 2 = 6,240 75 = 6,2 % | 1,088 50 % ■ 2 = 2,177 00 = 2,2 % |
Применение к результатам пациентов | ±6,2 % (=95 %-ный уровень доверия) | ±2,2 % (=95 %-ный уровень доверия) |
С.7 Пример прямого вычисления оцененной относительной неопределенности
Пример для вычисления молярной концентрации измеряемой величины по поглощающей способности в том случае, когда поглощающая способность пропорциональна концентрации в интервале измерения, показан ниже.
При измерении молярной концентрации отклик измерительной системы может быть пропорционален концентрации измеряемой величины, например согласно закону Бугера—Ламберта—Бера для светопоглощения.
Простое определение концентрации С выполняют при сравнении поглощающей способности А калибратора и пробы. Два набора измерений выполняют с пропорциональностью между концентрацией и поглощающей способностью, например: две формулы, в которых применен к в качестве фактора пропорциональности
А = к ■ С ^sample n ^sample’ ^са/~ ' ^caf
Концентрация пробы в таком случае может быть вычислена по формуле
61
ГОСТ Р 70413—2022
^sample ^са! ^sample^^cal^' (^-®)
В данном мультипликативном выражении концентрация калибратора может быть рассмотрена как независимая от определений отклика, что делает возможным разделение соответствующих дисперсий при вычислении неопределенности. Однако присутствует значительная ковариация между независимыми определениями для проб и калибраторов, которые не могут быть легко разделены.
Таким образом, соответствующие вклады в неопределенность могут быть легко разделены по формуле (С.7), поскольку формула (1) является мультипликативной
urel
^sample) yurel(^cal) + urel
(^sample 1 Acai} >
(C.7)
где urei(Ccai) — относительная неопределенность значения, установленного калибратором, вычисленная как ure^ca)= u^ca№cai- Производитель калибратора обычно приводит расширенную неопределенность калибратора U(Ccal), а также коэффициент охвата к, позволяющий найти и(Сса1) из U(Ccal) = k-u(Ccaly
unsample!A caj) — относительная неопределенность отношения значения отклика пробы к значению отклика калибратора. Если материалы IQC, используемые для методики измерения, могут быть репрезентативными для характеристик биологических проб (то есть коммутативными материалами), то относительная промежуточная прецизионность материалов IQC ufe/(IQC) может быть использована непосредственно для оценки (и, следовательно, для замены) члена urei(Asampif/Acai) в формуле (С.7). Следовательно, вычисление относительной неопределенности концентрации пробы становится количественно определяемым по формуле
urel (СSampie) y^rel^cal)2+чге1(юс)2.
(С.8)
Таким образом, абсолютная неопределенность может быть вычислена путем умножения относительной неопределенности на измеренную концентрацию: u(Csamp/e) = Csample • urel(Csample).
В таблице С.З представлено заключение о компонентах относительной неопределенности и их соответствующих математических выражений для использования при вычислении суммарной относительной неопределенности в простой методике измерения поглощения.
Таблица С.З — Относительные вклады неопределенности в простой методике измерения поглощения
Компоненты относительной неопределенности и соответствующие математические выражения | |
Относительная неопределенность калибратора | urel^cal^ |
Относительная неопределенность отклика, оцененная как относительная промежуточная прецизионность для измерений IQC | urel(A sample/A caj) _ фе/(ЮС) |
Суммарная относительная неопределенность | ^(С^)2 + и„,(ЮС)2) |
62
ГОСТ Р 70413—2022
Библиография
[1]
IEC 60050-300:2001
[2]
[3]
[4]
ISO/IEC 80000-1:2009
ISO 15189:2012
ISO 17511:2003’
[5]
ISO/TS 21748:2010
International Electrotechnical Vocabulary — Electrical and electronic measurements and measuring instruments — Part 311: General terms relating to measurements — Part 312: General terms relating to electrical measurements — Part 313: Types of electrical measuring instruments — Part 314: Specific terms according to the type of instrument
Quantities and units — Part 1: General
Medical laboratories — Requirements for quality and competence
In vitro diagnostic medical devices — Measurement of quantities in biological samples — Metrological traceability of values assigned to calibrators and control materials
Guidance for the use of repeatability, reproducibility and trueness estimates in measurement uncertainty estimation
[6] IFCC-IUPAC coding system for nomenclature, properties and units (C-NPU). International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) in collaboration with International Union of Pure and Applied Chemistry (IUPAC). http://www.npu-terminology.org/npu-database/(last update April 2018)
[71 International Union of Pure and Applied Chemistry (IUPAC) Compendium of Chemical Terminology, (Gold Book) Version 2.3.3 2014-02-24
[8] JCGM 100:2008, Evaluation of measurement data — Guide to the expression of uncertainty in measurement
[9] JCGM 200:2012 International vocabulary of metrology — Basic and general concepts and associated terms (VIM)
[10] CLSI C24, Statistical Quality Control for Quantitative Measurement Procedures: Principles and Definitions. Approved Guideline, Wayne, PA, Fourth Edition, 2016
[11] CLSI EP05, Evaluation of Precision Performance of Quantitative Measurement Methods. Approved Guideline, CLSI, Wayne, PA, Third Edition, 2014
[12] CLSI EP09c. Measurement Procedure Comparison and Bias Estimation Using Patient Samples, Approved Guideline, CLSI, Wayne, PA, Third Edition, 2018
[13] CLSI EP15. User Verification of Performance for Precision and Trueness; Approved Guideline, CLSI, Wayne, PA, Third Edition, 2014
[14] CLSI EP26-A. User Evaluation of Between-Reagent Lot Variation, Approved Guideline. CLSI: Wayne, PA, Approved Guideline, 2013
[15] CLSI EP29-A. Expression of Measurement Uncertainty in Laboratory Medicine, CLSI, Wayne, PA Approved Guideline, 2012
[16] EURACHEM/CITAC Guide CG 4, Quantifying uncertainty in analytical measurement, Third Edition, 2012. www.eu-rachem.org (accessed 15/10/13)
[17] Eurolab Technical Report NO. 1 /2006 Guide to the evaluation of measurement uncertainty for quantitative test results. August2006.www.eurolab.org/documents (Accessed 16-09-16)
[18] National Pathology Accreditation Advisory Council (NPAAC) Requirements for the Estimation of Measurement Uncertainty, 2007 Edition), www.health.gov.au
[19] Infusino I., Panteghini M. Measurement uncertainty: Friend or foe? // Clin Biochem, Feb 2 2018
[20] Braga F., Pasqualetti S., Panteghini M. The role of external quality assessment in the verification of in vitro medical diagnostics in the traceability era // Clin Biochem, Feb 9 2018
[21] Miller W. G., Jones G. R., Horowitz G. L., Weykamp C. Proficiency testing/external quality assessment: current challenges and future directions // Clin Chern, vol. 57, no. 12, pp. 1670—80, Dec 2011
[22] Sandberg S. et al. Defining analytical performance specifications: Consensus Statement from the 1st Strategic Conference of the European Federation of Clinical Chemistry and Laboratory Medicine // Clin Chern Lab Med, vol. 53, no. 6, pp. 833—5, May 2015
* Заменен на ISO 17511:2020 «Изделия медицинские для диагностики in vitro. Требования к установлению метрологической прослеживаемости значений, приписанных калибраторам, контрольным материалам правильности и образцам биологического материала человека».
** Заменен на ISO 21748:2017 «Статистические методы. Руководство по использованию оценок повторяемости, воспроизводимости и правильности при оценке неопределенности измерений».
63
ГОСТ Р 70413—2022
[23] Altman D. G., Gore S. M., Gardner M. J., Pocock S. J. Statistical guidelines for contributors to medical journals // Br Med J (Clin Res Ed), vol. 286, no. 6376, pp. 1489—93, May 7 1983
[24] Harris G. L. Selected Laboratory and Measurement Practices and Procedures to Support Basic Mass Calibrations // GLP 9, NISTIR 6969(2018 Ed). National Institute of Standards and Technology, 2018. Available: https: //doi. org/10.6028/NIST.IR. 6969—2018
[25] (Nov 5, 2018). United Nations Statistics Division, Policy on Rounding of Numbers. Available: https: //unstats.un.org/ unsd/dnss/docViewer.aspx?doclD = 134 #start
[26] Braga F., Infusino I., Panteghini M. Performance criteria for combined uncertainty budget in the implementation of metrological traceability // Clin Chern Lab Med, vol. 53, no. 6, pp. 905—12, May 2015
[27] Miller W. G., Erek A., Cunningham T. D., Oladipo O., Scott M. G., Johnson R. E. Commutability limitations influence quality control results with different reagent lots // Clin Chern, vol. 57, no. 1, pp. 76—83, Jan 2011
[28] Levey A. S. et al. A new equation to estimate glomerular filtration rate,» Ann Intern Med, vol. 150, no. 9, pp. 604—12, May 5 2009
[29] Cross N. C. et al. Laboratory recommendations for scoring deep molecular responses following treatment for chronic myeloid leukemia // Leukemia, vol. 29, no. 5, pp. 999—1003, May 2015
[30] Fuentes-Arderiu X., Dot-Bach D. Measurement uncertainty in manual differential leukocyte counting // Clin Chern Lab Med, vol. 47, no. 1, pp. 112—5, 2009
[31] G.-P. M. Fuentes-Arderiu X, Dot-Bach D. Between-examiner reproducibility in manual differential leukocyte counting //Accred Qual Assur, vol. 12, pp. 643—645, 2007
[32] F. CG, Biological variation: From principles to practice. Washington USA: AACC Press 2001
[33] Pasqualetti S., Infusino I., Carnevale A., Szoke D., Panteghini M. The calibrator value assignment protocol of the Abbott enzymatic creatinine assay is inadequate for ensuring suitable quality of serum measurements // Clin Chim Acta, vol. 450, pp. 125-6, Oct 23 2015
[34] Barwick V. Evaluating measurement uncertainty in clinical chemistry, case studies. 2012. www.nmschembio.org.uk/ PublicationListing.accessed 23/09/13
[35] Bell S. A Beginner’s Guide to Uncertainty of Measurement. Measurement Good Practice Guide No. 11 (Issue 2), 2001, National Physical Laboratory, Teddington, UK. www.npl.co.uk
[36] Ceriotti F. et al. EFLM Task and Finish Group on Allocation of laboratory tests to different models for performance specifications (TFG-DM). Criteria for assigning laboratory measurands to models for analytical performance specifications defined in the 1st EFLM Strategic Conference. Clin Chern Lab Med 2017, 55 pp. 189—94
[37] Dimech W. et al. Calculating uncertainty of measurement for serology assays by use of precision and bias. Clin Chern. 2006, 52 pp. 526—529
[38] Fuentes-Arderiu X. Description of examinations and their results and ISO standard 15189, Clin Chern Lab Med. 2006, 44 pp. 1164—1167
[39] Infusino I. et al. Is the accuracy of serum albumin measurements suitable for clinical application of the test? Clin Chim Acta. 2011,412 pp. 791—792
[40] Kristiansen J. Description of a Generally Applicable Model for the Evaluation of Uncertainty of Measurement in Clinical Chemistry. Clin Chern Lab Med. 2001, 39 pp. 920—931
[41] Kristiansen J. Counterpoint The Guide to Expression of Uncertainty in Measurement Approach for Estimating Uncertainty: An Appraisal. Clin Chern. 2003, 49 pp. 1822—1829
[42] Miller W.G. Time to Pay Attention to Reagent and Calibrator Lots for Proficiency Testing. Clin Chern. 2016, 62 pp. 666—667
[43] O’Donnell G.E., Hibbert D.B. Treatment of bias in estimating uncertainty. Analyst. 2005, 130 pp. 721—729
[44] White G.H. Basics of estimating measurement uncertainty. Clin Biochem Rev. 2008, 29 Suppl (i) pp. S53—60
64
ГОСТ Р 70413—2022
УДК 001.891.53:006.354
ОКС 11.100.01
Ключевые слова: медицинские лаборатории, практическое руководство, оценивание неопределенности измерений, медицинская лаборатория, неопределенность в медицинской лаборатории
Редактор fl.С. Зимилова
Технический редактор В.Н. Прусакова
Корректор М.В. Бучная
Компьютерная верстка Е.О. Асташина
Сдано в набор 24.10.2022. Подписано в печать 10.11.2022. Формат 60x847s. Гарнитура Ариал.
Усл. печ. л. 7,90. Уч.-изд. л. 7,12.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «РСТ» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.
