ГОСТ Р 53469-2024
(ИСО 8600-1:2015)
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Оптика и фотоника
ЭНДОСКОПЫ И ПРИБОРЫ ЭНДОТЕРАПЕВТИЧЕСКИЕ МЕДИЦИНСКИЕ
Часть 1
Общие требования
Optics and photonics. Endoscopes and medical endotherapy devices. Part 1. General requirements
ОКС 11.040.55
Дата введения 2025-01-01
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью "Лазеры и оптические системы" (ООО "ЛОС") и Акционерным обществом "ЛОМО" (АО "ЛОМО") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 296 "Оптика и фотоника"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 12 сентября 2024 г. № 1208-ст
4 Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 8600-1:2015* "Эндоскопы. Медицинские эндоскопы и устройства, относящиеся к области эндотерапии. Часть 1. Общие требования" (ISO 8600-1:2015 "Endoscopes - Medical endoscopes and endotherapy devices - Part 1: General requirements", MOD) путем изменения отдельных фраз (слов, ссылок), которые выделены в тексте курсивом**, исключения из библиографии информации о документах, ссылки на которые не использованы при изложении настоящего стандарта.
Внесение указанных технических отклонений направлено на учет потребностей национальной экономики Российской Федерации и особенностей объекта стандартизации, характерных для Российской Федерации.
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5-2012 (пункт 3.5).
Сведения о соответствии ссылочных межгосударственных и национальных стандартов международным стандартам, использованным в качестве ссылочных в примененном международном стандарте, приведены в дополнительном приложении ДА
5 ВЗАМЕН ГОСТ Р 53469-2009 (ИСО 8600-1:2005)
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ "О стандартизации в Российской Федерации"**. Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
1 Область применения
Настоящий стандарт распространяется на эндоскопы и эндотерапевтические приборы, применяемые в практической медицине, и устанавливает общие требования, предъявляемые к эндоскопам и эндотерапевтическим приборам, и методы их испытаний.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 31508** Изделия медицинские. Классификация в зависимости от потенциального риска применения. Общие требования
ГОСТ ISO 10993-1 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска
ГОСТ ISO 14971-2021 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
ГОСТ Р 50444-2020 Приборы, аппараты и оборудование медицинские. Общие технические требования
ГОСТ Р 55037 Оптика и оптические приборы. Эндоскопы и приборы эндотерапевтические медицинские. Частные технические требования. Методы испытаний параметров
ГОСТ Р 58936** Оптика и фотоника. Эндоскопы и приборы эндотерапевтические медицинские. Общие технические требования и методы испытаний
ГОСТ Р ИСО 8600-6** Оптика и оптические приборы. Эндоскопы и приборы эндотерапевтические медицинские. Часть 6. Термины и определения
ГОСТ Р ИСО 15223-1** Изделия медицинские. Символы, применяемые для передачи информации, предоставляемой изготовителем. Часть 1. Основные требования
ГОСТ Р МЭК 60601-1** Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик
ГОСТ Р МЭК 60601-2-18 Изделия медицинские электрические. Часть 2-18. Частные требования безопасности с учетом основных функциональных характеристик к эндоскопической аппаратуре
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 эндоскоп (endoscope): Медицинский прибор, имеющий устройство для наблюдения, содержащее или не содержащее оптические элементы, вводимый во внутренние полости и органы человека через естественные или созданные хирургическим способом каналы для проведения обследования, диагностики или лечения.
Примечания
1 Различают жесткие и гибкие эндоскопы; все типы могут иметь различные системы получения изображения (например, с помощью линз или ультразвуковых датчиков) и различные системы передачи изображения (например, оптические линзовые или волоконно-оптические системы, или электрическим способом).
2 Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.2 эндотерапевтический прибор (endotherapy device): Медицинское устройство, предназначенное для ввода через один с эндоскопом канал или через отдельный естественный или созданный хирургическим способом канал во время проведения эндоскопических процедур обследования, диагностики или лечения.
Примечания
1 Эндотерапевтические приборы содержат устройство, через которое вводят эндоскоп или сам эндотерапевтический прибор в виде направляющей трубки, троакара или скользящей трубки и др. В число эндотерапевтических приборов входят устройства, вводимые не в те каналы, в которые вводят эндоскоп, для обеспечения безопасности при предполагаемом их использовании в условиях эндоскопического наблюдения.
2 Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.3 жесткий эндоскоп (эндотерапевтический прибор) [rigid endoscope (endotherapy device)]: Эндоскоп (эндотерапевтический прибор), рабочая часть которого не подвергается изгибу в естественных или созданных хирургическим способом каналах в организме человека или в инструментальных каналах.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.4 гибкий эндоскоп (эндотерапевтический прибор) [flexible endoscope (endotherapy device)]: Эндоскоп (эндотерапевтический прибор), рабочая часть которого подвержена изгибу в естественных или созданных хирургическим способом каналах в организме человека или в инструментальных каналах.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
где u - периметр поперечного сечения, мм.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.6 дистальный конец (distal end): Участок управляемой части эндоскопа или эндотерапевтического прибора с оптическими элементами, расположенный от оператора дальше некоторой опорной точки.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.7 проксимальная часть (proximal portion): Часть эндоскопа или эндотерапевтического прибора, расположенная от оператора ближе некоторой опорной точки.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.8 инструментальный канал (instrument channel): Участок эндоскопа или эндотерапевтического прибора, на прохождение через который рассчитан эндоскоп или эндотерапевтический прибор.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.9 рабочая часть (insertion portion): Часть эндоскопа или эндотерапевтического прибора, предназначенная для введения в естественный или созданный хирургическим способом канал в организме человека или введения в инструментальный канал эндоскопа или эндотерапевтического прибора.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.10 максимальная ширина рабочей части (maximum insertion portion width): Максимальная наружная ширина эндоскопа или эндотерапевтического прибора по всей длине рабочей части.
Примечания
1 Максимальную ширину любого расширяемого или трансформируемого участка вводимой части (например, увеличивающиеся в размере управляемые элементы, а также шарниры и иные подобные элементы, ширина вводимых участков которых может быть изменена) не рассматривают как максимальную ширину рабочей части.
2 Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.11 минимальная ширина инструментального канала (minimum instrument channel width): Минимальная внутренняя ширина инструментального канала.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.12 рабочая длина (working length): Длина рабочей части, указанная в эксплуатационной документации.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.13 поле зрения (field of view): Такое поле зрения эндоскопа, снабженного оптическими элементами, которое соответствует указанному в эксплуатационной документации.
Примечания
1 Понятие "поле зрения" неприменимо, если эндоскоп предназначен для работы в контакте с объектом.
2 Если изображения имеют некруглую форму, то величина поля зрения определяется как диаметр описанной окружности.
3 См. рисунок 1.
4 Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
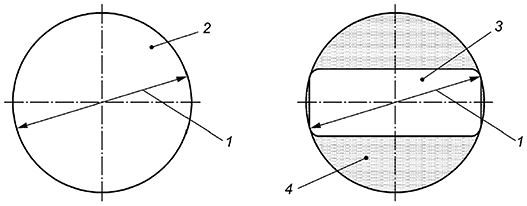 |
1 - размер поля зрения в пространстве предметов; 2 - поле зрения круглого изображения; 3 - видимое поле зрения некруглого изображения; 4 - участки изображения, недоступные для наблюдения
Рисунок 1 - Поле зрения
3.14 направление наблюдения (direction of view): Положение центра поля предмета относительно нормальной оси эндоскопа, выраженное в виде угла, в градусах, между нормальной осью эндоскопа (0°) и центральной осью поля зрения (см. рисунок 2).
1 - нормальная ось эндоскопа; 2 - направление наблюдения; 3 - центральная ось поля зрения
Рисунок 2 - Направление наблюдения
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.15 управляемая часть (controllable portion): Участок рабочей части эндоскопа или эндотерапевтического прибора, движением которой оператор может управлять дистанционно.
Примечание - Дополнительная информация содержится в ГОСТ Р ИСО 8600-6.
3.16 коннектор [соединительный элемент] для жидких или газообразных сред (fitting [connector] for liquid or gaseous media): Соединительный элемент, предназначенный для ввода/инжекции или вывода/аспирации жидких или газообразных сред при работе с эндоскопом или эндотерапевтическим прибором.
Рисунок 3 - Угол изгиба дистального конца
4 Общие требования
4.1 Общие положения
4.1.1 Общие требования, предъявляемые к медицинским эндоскопам и эндотерапевтическим приборам, должны соответствовать требованиям, изложенным в настоящем разделе. Медицинские эндоскопы с волоконными световодами должны соответствовать общим техническим требованиям по ГОСТ Р 58936.
4.1.2 Дизайн и конструкция эндоскопов или эндотерапевтических приборов должны соответствовать требованиям, указанным в 4.2-4.9.
4.2 Требования к поверхности и краям
4.2.1 Эндоскопы и эндотерапевтические приборы необходимо конструировать таким образом, чтобы их предполагаемое применение не привело к непредусмотренным травмам. Разработчик обязан соблюдать общие требования по ГОСТ 31508.
4.2.2 На поверхностях эндоскопов и эндотерапевтических приборов не допускаются поры, трещины и остатки обрабатывающих средств.
4.3 Требования к максимальной ширине рабочей части
Максимальная ширина рабочей части не должна превышать значения, указанного в эксплуатационной документации, предоставляемой изготовителем [см. раздел 7, перечисление е), позиция третья].
4.4 Требования к минимальной ширине инструментального канала
Минимальная ширина инструментального канала не должна быть меньше значений, указанных в эксплуатационной документации, предоставляемой изготовителем [см. раздел 7, перечисление e), позиция четвертая].
4.5 Требования к полю зрения
Отклонение значения поля зрения эндоскопа, содержащего оптические элементы, от номинального значения, установленного изготовителем в нормативной документации на конкретный тип эндоскопа, должно быть не более 15%.
4.6 Требования к направлению наблюдения
Отклонение направления наблюдения жесткого эндоскопа, содержащего оптические элементы, от номинального значения, установленного изготовителем в эксплуатационной документации, должно быть не более 10° [см. раздел 7, перечисление е), позиция первая].
4.7 Требования к безопасности
Эндоскопы и эндотерапевтические приборы должны соответствовать общим требованиям безопасности по ГОСТ Р МЭК 60601-1 и частным требованиям - по ГОСТ Р МЭК 60601-2-18.
4.8 Требования к биологической совместимости
Материалы, имеющие непосредственный контакт с пациентом, должны обеспечивать выполнение требований, предъявляемых к эндоскопам и эндотерапевтическим приборам согласно ГОСТ ISO 10993-1.
4.9 Требования к коннекторам/соединительным элементам и подключению
4.9.1 В зависимости от типа применяемые эндоскопы и эндотерапевтические приборы необходимо снабжать коннекторами, обеспечивающими инжекцию/аспирацию жидких или газообразных сред. Изготовитель эндоскопов и эндотерапевтических приборов обязан проводить процедуру менеджмента риска в соответствии с ГОСТ ISO 14971. Эта процедура проводится в целях установления вероятности ненадлежащего подсоединения медицинских устройств, обеспечивающих связь эндоскопов или эндотерапевтических приборов, чтобы учесть вероятность неправильного подключения медицинских изделий, предназначенных для подключения к эндоскопам или эндотерапевтическим приборам, к неэндоскопическим соединителям, связанным с пациентом (например, для внутривенного введения).
4.9.2 Целью процедуры менеджмента риска является оценка:
- физической возможности неправильного подключения медицинских изделий к неэндоскопическим соединителям, связанным с пациентом, в частности к соединителям по Люэру (см. [1]);
- вероятности возникновения неправильного подключения, что может стать потенциальной возможностью нанесения вреда пациенту.
4.9.3 В случае наличия соответствующих нормативных документов на коннекторы, которые соответствуют предполагаемому применению эндоскопа, эндотерапевтического прибора или медицинского изделия, предназначенного для подключения к эндоскопам или эндотерапевтическим приборам, данные требования следует применять, если они не противопоказаны процедурой менеджмента риска.
4.9.4 Руководящие указания по применению менеджмента риска к коннекторам эндоскопов, эндотерапевтических приборов и медицинских изделий приведены в приложении A.
4.10 Требования к устройству дистанционного управления изгибом управляемой части
4.10.1 Общие положения
Если эндоскоп снабжен устройством дистанционного управления изгибом управляемой части и при этом элемент(ы) ручного управления расположен(ы) на правой стороне проксимальной части (с точки зрения пользователя), то система управления изгибом удовлетворяет условиям, приведенным в 4.10.2-4.10.5.
Если эндоскоп снабжен таким устройством дистанционного управления изгибом управляемой части, которое отличается от устройства, рассмотренного ниже, то на эндоскоп наносят маркировку служащую для указания того, в каком направлении должен будет отклоняться дистальный конец управляемой части в случае вращения элемента управления в данном направлении.
Примечание - Под рассматриваемым здесь устройством управления изгибом подразумевается такое устройство, в котором в качестве элемента ручного управления используется рукоятка, которую пользователь вращает рукой.
4.10.2 Требования к изгибу управляемой части в направлениях "вверх" и "вниз"
При изменении угла изгиба управляемой части в направлении "вверх" и "вниз" в ходе вращения соответствующей рукоятки против часовой стрелки дистальный конец управляемой части должен изгибаться вверх, при вращении рукоятки по часовой стрелке - отклоняться вниз (см. рисунок 4).
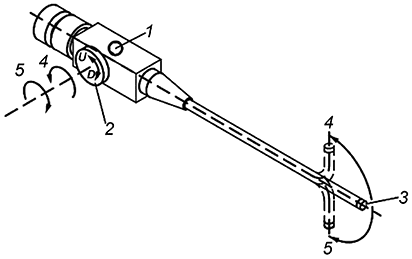 |
1 - проксимальная часть; 2 - элемент ручного управления; 3 - управляемая часть в неизогнутом направлении; 4 - направление вращения против часовой стрелки и изменение угла изгиба вверх; 5 - направление вращения по часовой стрелке и изменение угла изгиба вниз; U - вверх; D - вниз
Рисунок 4 - Управление изгибом управляемой части в направлениях "вверх" и "вниз"
4.10.3 Требования к изгибу управляемой части "влево" и "вправо"
При изменении угла изгиба дистального конца в направлении "влево" и "вправо" в ходе вращения соответствующей рукоятки против часовой стрелки дистальный конец управляемой части должен изгибаться вправо, при вращении рукоятки по часовой стрелке - отклоняться влево (см. рисунок 5).
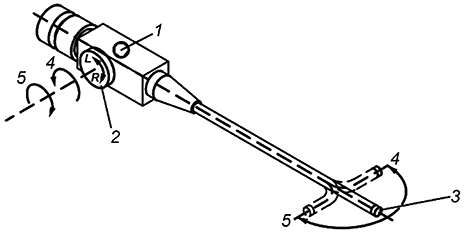 |
1 - проксимальная часть; 2 - элемент ручного управления; 3 - управляемая часть в неизогнутом направлении; 4 - направление вращения против часовой стрелки и изменение угла изгиба вправо; 5 - направление вращения по часовой стрелке и изменение угла изгиба лево; L - влево; R - вправо
Рисунок 5 - Управление изгибом управляемой части в направлениях "влево" и "вправо"
4.10.4 Требования к расположению элементов ручного управления
Если элементы ручного управления (рукоятки), служащие для изменения угла изгиба в направлениях "вверх" и "вниз" и для изменения угла изгиба в направлениях "влево" и "вправо", расположены на общей оси, то элемент управления, применяемый для осуществления отклонения "влево" - "вправо", должен отстоять от корпуса проксимальной части дальше, чем от него отстоит элемент управления, служащий для выполнения отклонения "вверх" - "вниз" (см. рисунок 6).
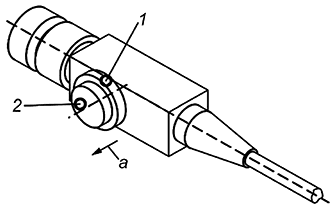 |
1 - элемент управления "вверх" - "вниз"; 2 - элемент управления "влево" - "вправо"; а - сторона, на которой расположены элементы ручного управления
Рисунок 6 - Расположение элементов управления изгибом
4.10.5 Требования к максимальному отклонению угла изгиба управляемой части
Значение максимального угла изгиба дистального конца управляемой части с помощью устройства дистанционного управления от первоначального прямолинейного состояния должно соответствовать указанному в эксплуатационной документации. Не допускается отклонение более 15°.
5 Методы испытания
5.1 Общие положения
Все испытания, представленные в настоящем стандарте, являются едиными для эндоскопов и эндотерапевтических приборов.
5.2 Проверка поверхности и краев
Соответствие прибора требованиям 4.2 оценивают визуальным и субъективным методами без применения увеличительных средств и при достаточном освещении.
5.3 Проверка максимальной ширины рабочей части
Максимальную ширину рабочей части по 4.3 определяют в соответствии с ГОСТ Р 55037.
5.4 Проверка минимальной ширины инструментального канала
При определении минимальной ширины инструментального канала по 4.4 следует пользоваться средствами контроля, погрешность которых не превышает 0,01 мм.
5.5 Проверка поля зрения
Поле зрения эндоскопа по 4.5, содержащего оптические элементы, определяют по ГОСТ Р 55037.
5.6 Проверка направления наблюдения
Направление наблюдения жесткого эндоскопа по 4.6, содержащего оптические элементы, определяют по ГОСТ Р 55037.
6 Требования к маркировке
6.1 Маркировка эндоскопов и эндотерапевтических приборов должна соответствовать требованиям ГОСТ Р 50444-2020 (раздел 11) с дополнениями и уточнениями, изложенными в настоящем разделе.
6.2 Каждый эндоскоп и эндотерапевтический прибор должны иметь следующую минимальную маркировку:
a) номер по каталогу и/или иное обозначение, достаточное для идентификации прибора и его изготовителя;
b) максимальную ширину рабочей части, минимальную ширину инструментального канала, длину рабочей части, поле зрения и/или направление наблюдения, если такая идентификация необходима для предполагаемого использования эндоскопа или эндотерапевтического прибора. Ширину рабочей части и ширину инструментального канала выражают в миллиметрах. Ширину рабочей части и ширину инструментального канала допускается также обозначать по французской мере по 3.5, идентифицированной размером Fr, или числом в круге;
c) приборы и съемные компоненты или съемные не полностью собранные компоненты по возможности идентифицируют по номеру партии или заводскому номеру.
6.3 Маркировка должна быть несмываемой, разборчивой во время использования, чистки, дезинфекции, стерилизации и хранения прибора, осуществляемых в соответствии с эксплуатационной документацией изготовителя.
6.4 Если на приборы, съемные компоненты или съемные не полностью собранные компоненты маркировку нанести нельзя из-за их размеров или конфигурации, то необходимую маркировку наносят на этикетку, упаковку или указывают в эксплуатационной документации.
6.5 Символы, применяемые при маркировке эндоскопов и эндотерапевтических приборов, в документации изготовителя должны соответствовать требованиям ГОСТ Р ИСО 15223-1.
7 Требования к эксплуатационной документации
Изготовитель эндоскопов или эндотерапевтических приборов обязан предоставить пользователю эксплуатационную документацию, содержащую следующую информацию:
a) идентификацию изготовителя, поставщика и модели устройства:
1) наименование и адрес изготовителя или поставщика;
2) номер по каталогу и/или наименование прибора;
b) указание предполагаемого использования прибора;
c) инструкцию по функциям и надлежащему использованию прибора;
d) изображение прибора с пояснениями, чтобы дать пользователю возможность идентифицировать соответствующие части и характеристики прибора, на которые дается ссылка в эксплуатационной документации;
e) описание и технические данные прибора, включая:
1) направление наблюдения,
2) поле зрения (если величина этого параметра задана),
3) максимальную ширину рабочей части и рабочую длину; в случае необходимости в эксплуатационную документацию включают следующее предупреждение: "Если при выборе устройств учитывались исключительно максимальная ширина вводимой части и рабочая длина, то мы не гарантируем, что эти устройства окажутся пригодными при условии их применения в сочетаниях с медицинскими изделиями",
4) минимальную ширину инструментального канала каждого прибора; в случае необходимости в эксплуатационную документацию включают следующее предупреждение: "Не гарантируется, что приборы, выбранные только с учетом указанной минимальной ширины инструментального канала, будут взаимозаменяемы в сочетаниях с медицинскими изделиями";
f) описание устройства дистанционного управления и связанных с ними положений управляемой части;
g) описание сборки прибора до начала его использования, а также описание, в котором указана как разборка, так и повторная сборка прибора после чистки, дезинфекции и/или стерилизации;
h) меры предосторожности и эксплуатационная документация по предусмотренному использованию прибора, в том числе в части электрических, электронных, электронно-оптических, электромедицинских или электроакустических узлов, предназначенных для совместного использования с данным прибором и отвечающих требованиям ГОСТ Р МЭК 60601-1 и ГОСТ Р МЭК 60601-2-18:
1) наличие или отсутствие жидкостей, предназначенных для использования вместе с эндоскопом, например контрастной среды, антисклерозантов, смазочных материалов и анестезирующих средств, а также предупреждений, касающихся жидкостей, не перечисленных выше,
2) меры предосторожности по использованию медицинских изделий в горючей среде;
i) инструкции по проведению осмотра в целях проверки работоспособности медицинских изделий;
j) инструкции по чистке медицинских изделий многократного использования с указанием специальных чистящих приспособлений или оборудования;
k) инструкции по особым условиям дезинфекции и стерилизации, которые прибор может выдержать;
I) рекомендуемые методики по хранению медицинских изделий перед использованием, а для медицинских изделий многократного использования - между периодами применения;
m) перечисление тех элементов приборов, которые могут быть заменены самим пользователем, и указания, касающиеся осуществления замены таких элементов;
n) адреса мастерских техобслуживания фирмы-изготовителя, в которые могут обращаться пользователи устройств.
8 Требования к упаковке, транспортированию и хранению
8.1 Требования к упаковке, транспортированию и хранению эндоскопов и эндотерапевтических приборов приведены в ГОСТ Р 50444.
8.2 Изготовитель обязан упаковать эндоскоп и эндотерапевтические приборы таким образом, чтобы защитить их от неблагоприятных воздействий окружающей среды.
Приложение А
(справочное)
Руководящие указания по применению менеджмента риска для соединителей эндоскопов, эндотерапевтических приборов и медицинских изделий
А.1 Данное приложение содержит руководящие указания для изготовителей эндоскопов, эндотерапевтических приборов и медицинских изделий, предназначенных для подключения к эндоскопам или эндотерапевтическим приборам при оценке уровня риска, связанного с соединителями, в отношении их предполагаемого использования, если специальные соединители не предусмотрены соответствующими стандартами.
В 4.9 приведена информация о том, что изготовитель эндоскопов или эндотерапевтических приборов обязан осуществлять процедуру управления рисками в соответствии с теми указаниями, которые содержатся в ГОСТ ISO 14971. Эта процедура проводится в целях установления вероятности ненадлежащего подсоединения медицинских устройств, обеспечивающих связь эндоскопов или эндотерапевтических приборов с теми точками на теле пациента, прямое подсоединение эндоскопов или эндотерапевтических приборов к которым не представляется возможным. Указанные медицинские устройства применяют, например, при проведении внутривенного исследования.
Основная цель осуществления процедуры управления рисками заключается в оценке того, насколько велика вероятность при проведении медицинских осмотров осуществления неправильного подсоединения вышеуказанных медицинских устройств к тем точкам на теле пациента, подсоединение эндоскопов или эндотерапевтических приборов к которым исключено. При этом заслуживает внимания применение соединительных элементов Люэра, указания к которым приведены в [1]. Другая цель проведения процедуры управления рисками заключается в оценке вероятности возникновения соединения, которое может обусловить причинение вреда пациенту. При условии наличия стандартов, относящихся к соединительным элементам, которые обеспечивают согласованное функционирование эндоскопа, эндотерапевтического прибора и медицинского устройства, подсоединяемого к эндоскопам или эндотерапевтическим приборам, данные указания рекомендуется применять до тех пор, пока в результате проведения процедуры управления рисками не поступит указание касательно прекращения их применения.
В данном приложении содержатся рекомендации касательно того, каким образом следует осуществлять оценку уровня риска, обусловленного предполагаемым применением соединительных элементов, входящих в состав эндоскопических систем, применительно к тем случаям, когда соединительные элементы особого типа, исходя из текстов соответствующих стандартов, просто не существуют. Приведенные здесь рекомендации представляют интерес для изготовителей эндоскопов, эндотерапевтических приборов и таких медицинских устройств, которые предназначены для подсоединения к эндоскопам и эндотерапевтическим приборам.
А.2 В соответствии с ГОСТ ISO 14971-2021 (приложение C) оценку уровня риска для медицинских изделий проводят путем комбинирования двух компонентов:
- вероятности возникновения вреда (как часто может возникать вред);
- последствий вреда (степень тяжести нанесения вреда).
Оценку вероятности возникновения вреда основывают на количественных данных, но если таких данных нет, применяют качественный подход, который включает прогнозирование вероятности возникновения вреда с использованием аналитических или имитирующих методов и/или с учетом мнения эксперта.
Обычно бывает проще количественно ранжировать степень тяжести нанесения вреда, распределив ее на три или четыре уровня.
Приемлемость риска, как правило, подразделяют на три категории:
a) в целом приемлемый;
b) разумно низкий допустимый риск;
c) неприемлемый.
А.3 При рассмотрении соединителей анализ рисков изготовителя должен включать рассмотрение вероятности и тяжести следующих факторов:
a) перекрестных соединений;
b) неправильного подключения к соединителям, не связанным с пациентом;
c) неправильного подключения к соединителям, не связанным с медицинским оборудованием;
d) надежности соединений в нормальных условиях и при одиночной неисправности;
e) предусмотренного использования соединителя (например, специальный или универсальный);
f) доработки соединителей многократного использования.
При оценке вероятности возникновения таких факторов также следует учитывать другие факторы, включая следующие:
- предусмотренное или ожидаемое место использования (например, использование в отделении интенсивной терапии, где количество соединений, предназначенных для пациента, может представлять более высокие риски неправильного соединения, чем при использовании в эндоскопическом отделении);
- принято ли то, что соединения, связанные с пациентом, закрыты/спрятаны от прямого наблюдения при проведении предусмотренной процедуры;
- наличие тесного соседства соединений эндоскопической системы с другими возможными соединениями, связанными с пациентом;
- использование соединителя внутри или снаружи непосредственного окружения пациента;
- сохранение соединений с пациентом, задействованных во время проведения эндоскопической процедуры, после завершения процедуры;
- возможность дотянуть соединитель до пациента в условиях нормального использования или при единичной неисправности;
- нормальный уровень надзора/кадрового обеспечения в связи с процедурой.
В отношении медицинских изделий многократного использования также следует оценивать риски, возникающие при изменении существующего состояния, включая переходные меры, которые могут стать необходимыми, если предполагают, что оборудование с "новыми" соединителями должно безопасно использоваться в комбинации с оборудованием, имеющим "старые" соединители.
Если, выполняя требования по применению менеджмента риска в соответствии с ГОСТ ISO 14971, изготовитель решает использовать соединитель по Люэру (см. [1]), то рекомендуется представить полное обоснование такого решения в протоколе управления рисками, так как неправильное соединение линий, питающих эндоскоп (например, для вдувания газа, отсоса, промывающей жидкости), и веществ, вводимых через шприц (например, воздух, вода, контрастные среды, вещества для местного обезболивания, антисклерозанты, вещества для окрашивания слизистой и т.д.), может привести к тяжелым последствиям при неправильном подключении к неэндоскопическим входам пациента (например, вдувание газа под высоким давлением в сосудистую систему).
Приложение ДА
(справочное)
Сведения о соответствии ссылочных национальных и межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененном международном стандарте
Таблица ДА.1
Обозначение ссылочного национального, межгосударственного стандарта | Степень соответствия | Обозначение и наименование ссылочного международного стандарта |
IDT | ISO 10993-1:2018 "Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска" | |
IDT | ISO 14971:2019 "Изделия медицинские. Применение менеджмента риска к медицинским изделиям" | |
MOD | ISO 8600-2:2002 "Оптика и оптические приборы. Медицинские эндоскопы и эндотерапевтические приборы. Часть 2. Частные требования к жестким бронхоскопам"; ISO 8600-3:2003 "Оптика и оптические приборы. Медицинские эндоскопы и эндотерапевтические приборы. Часть 3. Определение поля зрения и направления наблюдения эндоскопов с оптическими компонентами"; ISO 8600-4:1997 "Оптика и оптические приборы. Медицинские эндоскопы и эндотерапевтические приборы. Часть 4. Определение наибольшей ширины вводимой части"; ISO 8600-5:2005 "Оптика и оптические приборы. Медицинские эндоскопы и эндотерапевтические приборы. Часть 5. Определение оптического разрешения жестких эндоскопов с оптикой" | |
IDT | IEC 60601-2-18:2009 "Изделия медицинские электрические. Часть 2-18. Частные требования безопасности с учетом основных функциональных характеристик к эндоскопической аппаратуре" | |
Примечание - В настоящей таблице использованы следующие условные обозначения степени соответствия стандартов: - IDT - идентичные стандарты; - MOD - модифицированный стандарт. | ||
Библиография
[1] | ИСО 80369-7:2021 | Соединители малого диаметра для жидкостей и газов, используемые в здравоохранении. Часть 7. Соединители для внутрисосудистых или подкожных применений |
УДК 681.784.84:006.354 | ОКС 11.040.55 |
Ключевые слова: оптика и фотоника, эндоскопы и приборы эндотерапевтические медицинские, общие требования | |
