ГОСТ Р МЭК 62366-2013
Группа Р20
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ
Проектирование медицинских изделий с учетом эксплуатационной пригодности
Medical devices. Application of usability engineering to medical devices
ОКС 11.040
ОКП 94 0000
Дата введения 2015-01-01
Предисловие
1 ПОДГОТОВЛЕН Закрытым акционерным обществом "МЕДИТЕСТ" на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 436 "Управление качеством медицинских изделий"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 28 октября 2013 г. N 1224-ст
4 Настоящий стандарт идентичен международному стандарту МЭК 62366:2007* "Медицинские изделия. Проектирование медицинских изделий с учетом эксплуатационной пригодности" (IEC 62366:2007 "Medical devices - Application of usability engineering to medical devices").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Настоящий стандарт является прямым применением международного стандарта МЭК 62366:2007 "Изделия медицинские. Проектирование медицинских изделий с учетом эксплуатационной пригодности", подготовленного рабочей группой подкомитета 62А "Общие параметры электрического медицинского оборудования, используемого в медицинской практике" Технического комитета 62 "Электрическое медицинское оборудование в медицинской практике" и Техническим комитетом ИСО 210 "Управление качеством медицинских изделий".
В медицинской практике все чаще используются МЕДИЦИНСКИЕ ИЗДЕЛИЯ для наблюдения и лечения ПАЦИЕНТОВ. Все больший повод для беспокойства вызывают ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, вызванные недостаточной ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ МЕДИЦИНСКОГО ИЗДЕЛИЯ. Многие МЕДИЦИНСКИЕ ИЗДЕЛИЯ, разработанные без использования ПРОЦЕССОВ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, являются не интуитивными, сложными для изучения и использования. Область здравоохранения развивается, в настоящее время все менее компетентные ПОЛЬЗОВАТЕЛИ, включая самих ПАЦИЕНТОВ, используют МЕДИЦИНСКИЕ ИЗДЕЛИЯ, а сами МЕДИЦИНСКИЕ ИЗДЕЛИЯ становятся все более сложными. В простых случаях ПОЛЬЗОВАТЕЛИ МЕДИЦИНСКИХ ИЗДЕЛИЙ могут справиться с неоднозначным, сложным для использования ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ. Разработка пригодных МЕДИЦИНСКИХ ИЗДЕЛИЙ требует приложения значительных усилий, кроме того, многие организации занимаются ею на основании "здравого смысла". Разработка ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА для достижения достаточного (безопасного) уровня ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ требует более высокого уровня квалификации, чем техническая реализация данного интерфейса.
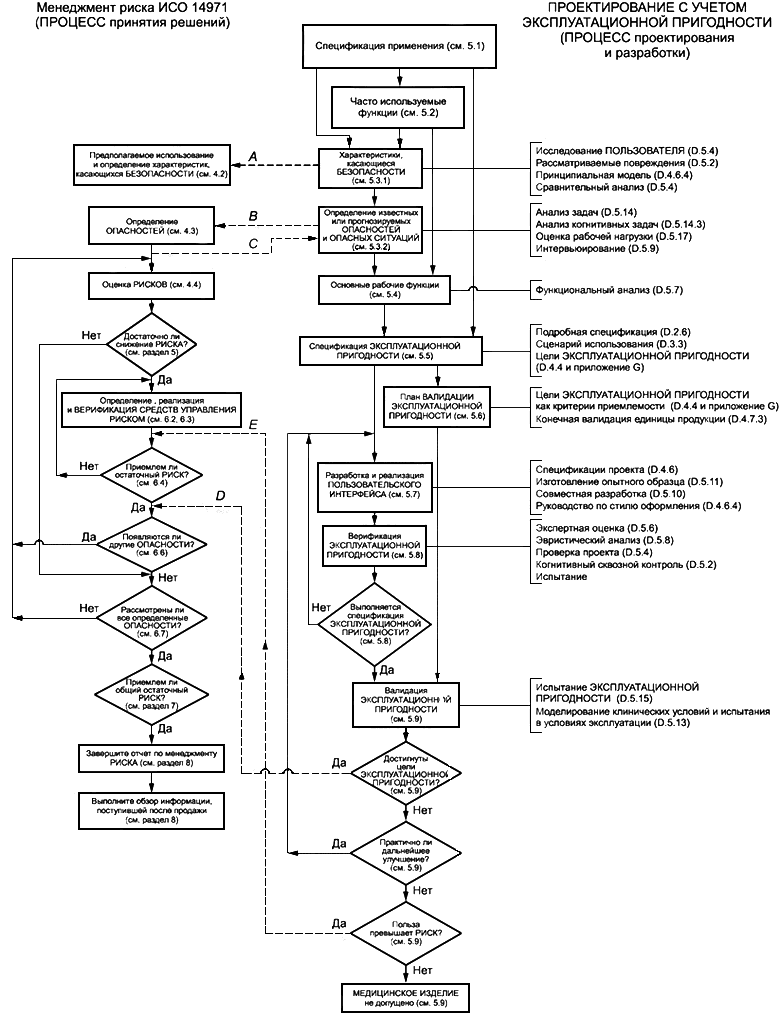
ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ предназначены для достижения разумного уровня ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, который в свою очередь предназначен для минимизации пользовательских ошибок и минимизации РИСКОВ, связанных с использованием. Некоторые, но не все, виды некорректного использования, поддаются контролю со стороны ИЗГОТОВИТЕЛЯ. Процедуры ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ связаны с процедурами МЕНЕДЖМЕНТА РИСКА, как указано на рисунке А.1 приложения А.
Настоящий стандарт описывает процедуры ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и представляет собой руководство по применению и реализации процедур для обеспечения БЕЗОПАСНОСТИ МЕДИЦИНСКИХ ИЗДЕЛИЙ. Предполагается, что он будет полезен не только для ИЗГОТОВИТЕЛЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ, но и для технических комитетов, ответственных за подготовку специальных стандартов на МЕДИЦИНСКИЕ ИЗДЕЛИЯ.
Пункты и подпункты, которые рассмотрены в приложении А, отмечены (*).
1* Область применения
Настоящий стандарт устанавливает ПРОЦЕСС, выполняемый ИЗГОТОВИТЕЛЕМ для анализа, определения, разработки, ВЕРИФИКАЦИИ и ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в части, имеющей отношение к БЕЗОПАСНОСТИ МЕДИЦИНСКИХ ИЗДЕЛИЙ. ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ направлен на оценку и снижение рисков, вызванных проблемами с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ и связанных с КОРРЕКТНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ и ОШИБКАМИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, т.е. с НОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ. Настоящий стандарт может применяться для определения, но не оценки и снижения РИСКОВ, связанных с НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ.
Примечание - В рамках настоящего стандарта ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ (см. 3.17) ограничена характеристиками ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
Если выполняется ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, подробно описанный в настоящем стандарте, и достигается соответствие критериям приемлемости, зафиксированным в плане по ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (см. 5.9), то ОСТАТОЧНЫЙ РИСК в соответствии с определением по ИСО 14971, связанный с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ МЕДИЦИНСКИХ ИЗДЕЛИЙ, считается приемлемым, если не будет приведено ОБЪЕКТИВНЫХ СВИДЕТЕЛЬСТВ обратного (см. 4.1.2).
Настоящий стандарт не применяется для принятия клинических решений, касающихся использования МЕДИЦИНСКИХ ИЗДЕЛИЙ.
2 Нормативные ссылки
В настоящем стандарте использована нормативная ссылка на следующий стандарт*.
________________
* Таблицу соответствия национального стандарта международному см. по ссылке. - .
Примечание - Ссылки для справок приведены в библиографии.
ИСО 14971:2007 Изделия медицинские. Применение менеджмента риска к медицинским изделиям (ISO 14971:2007, Medical devices - Application of risk management to medical devices)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 14971, а также следующие термины с соответствующими определениями.
Примечание - Алфавитный указатель терминов приведен в конце настоящего стандарта.
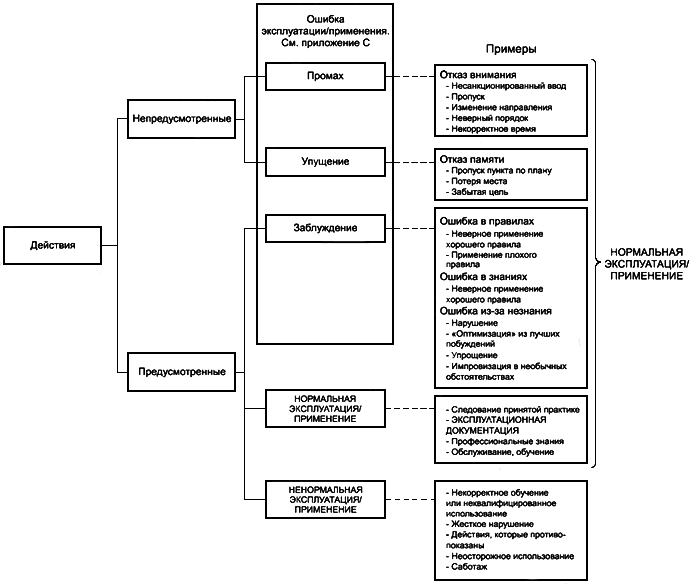
3.1 НЕНОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ (ABNORMAL USE): Преднамеренное действие или непреднамеренное бездействие ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ или ПОЛЬЗОВАТЕЛЯ МЕДИЦИНСКОГО ИЗДЕЛИЯ, приводящее к невозможности принятия дальнейших рациональных мер по УПРАВЛЕНИЮ РИСКОМ, предусмотренных ИЗГОТОВИТЕЛЕМ.
Примечание 1 - См. также 4.1.3 и приложение В. Примеры приведены в приложении С.
Примечание 2 - ПАЦИЕНТ также может быть ПОЛЬЗОВАТЕЛЕМ, например, если МЕДИЦИНСКОЕ ИЗДЕЛИЕ используется ПАЦИЕНТОМ дома.
3.2 ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ (ACCOMPANYING DOCUMENT): Документ, прилагаемый к МЕДИЦИНСКОМУ ИЗДЕЛИЮ и содержащий информацию для лиц, ответственных за установку, применение и техническое обслуживание МЕДИЦИНСКОГО ИЗДЕЛИЯ, или ПОЛЬЗОВАТЕЛЯ, особенно в отношении БЕЗОПАСНОСТИ.
[ИСО 14971:2007, определение 2.1 ]
3.3 ПРЕДЕЛ СРАБАТЫВАНИЯ СИГНАЛИЗАЦИИ (ALARM LIMIT): Предел, используемый в СИСТЕМЕ СИГНАЛИЗАЦИИ для определения условий СРАБАТЫВАНИЯ СИГНАЛИЗАЦИИ.
[МЭК 60601-1-8:2006, определение 3.3]
Примечание - Данный термин используется только в примечаниях и справочных приложениях.
3.4 ОТКЛЮЧЕНИЕ СИГНАЛИЗАЦИИ (ALARM OFF): Состояние с определенной продолжительностью, при котором СИСТЕМА СИГНАЛИЗАЦИИ или часть СИСТЕМЫ СИГНАЛИЗАЦИИ не производят АВАРИЙНОГО СИГНАЛА.
[МЭК 60601-1-8:2006, определение 3.4]
Примечание - Данный термин используется только в примечаниях и справочных приложениях.
3.5 АВАРИЙНЫЙ СИГНАЛ (ALARM SIGNAL): Тип сигнала, производимого СИСТЕМОЙ СИГНАЛИЗАЦИИ для указания на наличие (или возникновение) аварийных условий.
[МЭК 60601-1-8:2006, определение 3.9]
Примечание - Данный термин используется только в примечаниях и справочных приложениях.
3.6 СИСТЕМА СИГНАЛИЗАЦИИ (ALARM SYSTEM): Части МЕДИЦИНСКОГО ИЗДЕЛИЯ, которые определяют аварийные условия и, если применимо, производят АВАРИЙНЫЙ СИГНАЛ.
[МЭК 60601-1-8:2006, определение 3.11]
Примечание - Данный термин используется только в примечаниях и справочных приложениях.
3.7 КОРРЕКТНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ (CORRECT USE): НОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ БЕЗ ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
3.8 РЕЗУЛЬТАТИВНОСТЬ (EFFECTIVENESS): Степень точности и полноты, с которой ПОЛЬЗОВАТЕЛИ достигают определенных целей.
[ИСО 9241-11:1998, определение 3.2]
Примечание - "ЭФФЕКТИВНОСТЬ" и "клиническая ЭФФЕКТИВНОСТЬ" являются разными понятиями.
3.9 ЭФФЕКТИВНОСТЬ (EFFICIENCY): РЕЗУЛЬТАТИВНОСТЬ с учетом затраченных ресурсов.
3.10 ИНФОРМАЦИОННЫЙ СИГНАЛ (INFORMATION SIGNAL): Любой сигнал, который не является АВАРИЙНЫМ СИГНАЛОМ или напоминающим сигналом.
Пример 1 - Сигнал ЭКГ.
Пример 2 - Уровень SpO2.
Пример 3 - Индикатор включения рентгеновской установки.
[МЭК 60601-1-8:2006, определение 3.23]
Примечание - Данный термин используется только в примечаниях и справочных приложениях.
3.11 МЕДИЦИНСКОЕ ИЗДЕЛИЕ (MEDICAL DEVICE): Любой инструмент, аппарат, прибор, принадлежность, приспособление, имплантат, in vitro реагент или калибратор, программное обеспечение, материал или другие подобные или сопутствующие средства, предназначенные ИЗГОТОВИТЕЛЕМ для применения к человеку по отдельности или в сочетании друг с другом с целью (целями):
- профилактики, диагностики, мониторинга, лечения или облегчения заболеваний;
- диагностики, мониторинга, лечения, облегчения или компенсации последствий травмы;
- исследования, замещения, изменения или поддержания анатомического строения или физиологических ПРОЦЕССОВ;
- поддержания жизненно важных функций организма;
- управления зачатием;
- дезинфекции МЕДИЦИНСКИХ ИЗДЕЛИЙ;
- получения информации медицинского назначения посредством исследования in vitro проб, взятых из организма человека, при условии, что их основное воздействие на организм человека не реализуется за счет фармакологических, иммунологических или метаболических средств, но их функционирование может поддерживаться такими средствами.
[ИСО 13485:2003, определение 3.7]
3.12* НОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ (NORMAL USE): Функционирование, включая текущий осмотр и оценку ПОЛЬЗОВАТЕЛЕМ, и подготовка в соответствии с инструкцией по эксплуатации или в соответствии с общепризнанной практикой для МЕДИЦИНСКИХ ИЗДЕЛИЙ, поставляемых без инструкции по эксплуатации.
[МЭК 60601-1:2005, определение 3.71]
Примечание 1 - При НОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИИ могут возникать ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
Примечание 2 - МЕДИЦИНСКИЕ ИЗДЕЛИЯ, которые могут быть безопасно использованы без инструкции по эксплуатации, освобождены от необходимости иметь инструкцию по эксплуатации некоторыми полномочными органами с приведением обоснования.
3.13 ПАЦИЕНТ (PATIENT): Живое существо (человек), подвергающееся медицинской, хирургической или стоматологической процедуре.
[МЭК 60601-1:2005, определение 3.76]
3.14 ОСНОВНАЯ РАБОЧАЯ ФУНКЦИЯ (PRIMARY OPERATING FUNCTION): Функция, которая предполагает вмешательство пользователя и которая либо часто используется, либо относится к БЕЗОПАСНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ.
3.15 НАПОМИНАЮЩИЙ СИГНАЛ (REMINDER SIGNAL): Периодический сигнал, который напоминает ПОЛЬЗОВАТЕЛЮ, что АВАРИЙНЫЙ СИГНАЛ находится в состоянии инактивации.
[МЭК 60601-1 -8:2006, определение 3.34]
Примечание - Данный термин используется только в примечаниях и справочных приложениях.
3.16 ОТВЕТСТВЕННАЯ ОРГАНИЗАЦИЯ (RESPONSIBLE ORGANIZATION): Организация, ответственная за использование и обслуживание МЕДИЦИНСКОГО ИЗДЕЛИЯ или комбинации МЕДИЦИНСКИХ ИЗДЕЛИЙ.
Примечание 1 - ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИЕЙ может быть, например, клиника, конкретный врач или неспециалист. При домашнем использовании ПАЦИЕНТОМ, ПОЛЬЗОВАТЕЛЕМ и ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИЕЙ может быть одно и то же лицо.
Примечание 2 - Обучение и инструктаж включены в понятие "использование".
3.17* ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ (USABILITY): Характеристика ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, которая определяет РЕЗУЛЬТАТИВНОСТЬ, ЭФФЕКТИВНОСТЬ, простоту обучения пользователя и степень удовлетворенности ПОЛЬЗОВАТЕЛЯ.
3.18 ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (USABILITY ENGINEERING): Применение знаний о поведении, возможностях, ограничениях человека и других характеристиках, относящихся к конструкции инструментов, изделий, системам, задачам, операциям и окружающей среде, для достижения достаточной ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
3.19 ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (USABILITY ENGINEERING FILE): Комплект ЗАПИСЕЙ и других документов, созданных в ПРОЦЕССЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
3.20 СПЕЦИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (USABILITY SPECIFICATION): Документация, определяющая требования к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ, касающиеся ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
3.21 ОШИБКА ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ (USE ERROR): Выполнение или невыполнение действия, приводящее к функционированию МЕДИЦИНСКОГО ИЗДЕЛИЯ, отличающемуся от предусмотренного ИЗГОТОВИТЕЛЕМ или ожидаемого ПОЛЬЗОВАТЕЛЕМ.
Примечание 1 - К ОШИБКАМ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ относят промахи, упущения и заблуждения.
Примечание 2 - См. также приложения С и D, D.1.3.
Примечание 3 - Неадекватную физиологическую реакцию ПАЦИЕНТА саму по себе не относят к ОШИБКЕ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
3.22 СЦЕНАРИЙ ИСПОЛЬЗОВАНИЯ (USE SCENARIO): Определенная последовательность событий и задач, выполняемых определенным ПОЛЬЗОВАТЕЛЕМ в определенной среде.
3.23* ПОЛЬЗОВАТЕЛЬ (USER): Лицо, использующее МЕДИЦИНСКОЕ ИЗДЕЛИЕ, например, осуществляющее его эксплуатацию или обслуживание.
Примечание 1 - Термин включает, по крайней мере, персонал, осуществляющий чистку, обслуживание и установку.
Примечание 2 - ПАЦИЕНТЫ и другие неспециалисты также могут быть ПОЛЬЗОВАТЕЛЯМИ.
3.24* ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС (USER INTERFACE): Средства, с помощью которых происходит взаимодействие ПОЛЬЗОВАТЕЛЯ и МЕДИЦИНСКОГО ИЗДЕЛИЯ.
[ANSI/AAMI/HE 74:2001, определение 3.24]
Примечание - ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ считается частью МЕДИЦИНСКОГО ИЗДЕЛИЯ и его ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
3.25 ПРОФИЛЬ ПОЛЬЗОВАТЕЛЯ (USER PROFILE): Сводка данных об умственных, физических и демографических особенностях предполагаемой популяции ПОЛЬЗОВАТЕЛЕЙ, а также любых специальных характеристиках, которые могут повлиять на проектное решение, таких как профессиональные навыки и должностные требования.
3.26 ВАЛИДАЦИЯ (VALIDATION): Подтверждение посредством представления ОБЪЕКТИВНЫХ СВИДЕТЕЛЬСТВ того, что требования, предназначенные для конкретного использования или применения, выполнены.
Примечание 1 - Термин "ВАЛИДИРОВАН" используют для обозначения соответствующего статуса.
Примечание 2 - Условия применения могут быть реальными или смоделированными.
[ИСО 9000:2008, определение 3.8.5]
4* Основные положения
4.1 Общие требования
4.1.1* ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен разработать, задокументировать и поддерживать ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для обеспечения БЕЗОПАСНОСТИ ПАЦИЕНТА, ПОЛЬЗОВАТЕЛЯ и других лиц, связанной с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ. Процессы должны касаться взаимодействия ПОЛЬЗОВАТЕЛЯ с МЕДИЦИНСКИМ ИЗДЕЛИЕМ в соответствии с ЭКСПЛУАТАЦИОННЫМ ДОКУМЕНТОМ, включая, но не ограничиваясь, следующими:
- * транспортирование;
- * хранение;
- установка;
- эксплуатация;
- обслуживание и восстановление и
- утилизация.
Примечание - См. также приложение D, D.3.1.
Соответствие требованиям настоящего раздела достигается, если выполняются критерии соответствующих проверок и испытаний, предусмотренных настоящим стандартом.
4.1.2 Остаточный РИСК
Если применяются ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, описанные в настоящем стандарте, и достигается соответствие критериям приемлемости, описанным в плане ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (см. 5.9), тогда в рамках ИСО 14971 ОСТАТОЧНЫЙ РИСК, связанный с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ МЕДИЦИНСКОГО ИЗДЕЛИЯ, должен считаться приемлемым, если не будет приведено ОБЪЕКТИВНЫХ СВИДЕТЕЛЬСТВ обратного.
Примечание 1 - Подобные ОБЪЕКТИВНЫЕ СВИДЕТЕЛЬСТВА могут быть получены позже на основании послепродажного наблюдения за МЕДИЦИНСКИМ ИЗДЕЛИЕМ.
Примечание 2 - В ИСО 14971, подраздел 6.6, требуется, чтобы были пересмотрены результаты изменения проекта в отношении ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для определения, не возникают ли новые ОПАСНОСТИ И ОПАСНЫЕ СИТУАЦИИ.
Примечание 3 - В ИСО 14971, раздел 7, требуется, чтобы все ОПАСНЫЕ СИТУАЦИИ были учтены при оценке полного ОСТАТОЧНОГО РИСКА МЕДИЦИНСКОГО ИЗДЕЛИЯ, включая ОПАСНЫЕ СИТУАЦИИ, связанные с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
4.1.3 Информация, касающаяся БЕЗОПАСНОСТИ
Если как средство УПРАВЛЕНИЯ РИСКАМИ используется информация, касающаяся БЕЗОПАСНОСТИ, ИЗГОТОВИТЕЛЬ должен использовать эту информацию в ПРОЦЕССЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Пример 1 - Предупреждения или ограничения использования, указанные в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ.
Пример 2 - Маркировки.
Игнорирование данной информации, касающейся БЕЗОПАСНОСТИ, должно быть учтено любыми дальнейшими разумными средствами УПРАВЛЕНИЯ РИСКОМ. См. также приложение В.
Примечание 1 - Информация, касающаяся БЕЗОПАСНОСТИ, является одним из элементов в иерархическом подходе к УПРАВЛЕНИЮ РИСКОМ, при котором ИЗГОТОВИТЕЛЬ использует одно или несколько действий, указанных ниже в порядке уменьшения приоритетности (см. ИСО 14971, подраздел 6.2):
a) внутреннюю БЕЗОПАСНОСТЬ, обеспечиваемую конструкцией;
b) средства защиты, имеющиеся в самом МЕДИЦИНСКОМ ИЗДЕЛИИ, или защитные меры, предусмотренные в ПРОЦЕССЕ его изготовления, например АВАРИЙНАЯ СИГНАЛИЗАЦИЯ;
c) информацию по БЕЗОПАСНОСТИ, например предупреждения в инструкции по эксплуатации, отображение контролируемых переменных, обучение и обучающие материалы, обслуживание элементов.
Примечание 2 - Информация, касающаяся БЕЗОПАСНОСТИ, которую необходимо учитывать, может являться входом в ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (например, приведенная в некоторых других стандартах) или обнаруживаться во время ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА и ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
4.2* ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Результаты выполнения ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Записи и другие документы, формирующие ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, могут являться частью других документов и ФАЙЛОВ.
Пример 1 - ФАЙЛ ИЗГОТОВИТЕЛЯ, касающийся конструкции изделия.
Пример 2 - ФАЙЛ МЕНЕДЖМЕНТА РИСКА.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
4.3 Изменение объема ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут отличаться по виду и объему работ, основываясь на природе МЕДИЦИНСКОГО ИЗДЕЛИЯ, его предполагаемого ПОЛЬЗОВАТЕЛЯ и его предполагаемого использования (см. приложение D, D.3.2). В случае изменения конструкции МЕДИЦИНСКОГО ИЗДЕЛИЯ, ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут быть расширены или уменьшены, основываясь на существенности изменений, определенной на основании результатов анализа РИСКОВ (см. приложение D, D.3.2.2).
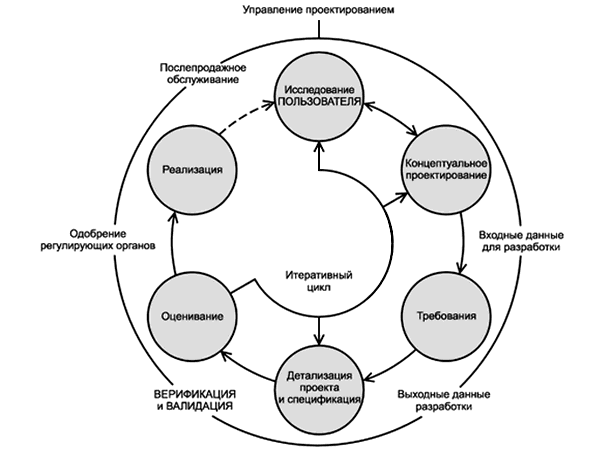
Примечание 1 - ИЗГОТОВИТЕЛЬ может придерживаться итеративных методов разработки и развития. ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, включая ВАЛИДАЦИЮ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, должно быть начато как можно раньше и продолжаться в течение всего жизненного цикла разработки и развития МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Примечание 2 - В связи с итеративным характером процедур ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ действия, описанные в разделе 5, могут проводиться в любом удобном порядке (см. приложение D, D.2).
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5* ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
5.1* Спецификация применения
ИЗГОТОВИТЕЛЬ должен определить применение МЕДИЦИНСКОГО ИЗДЕЛИЯ в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Эта спецификация должна включать:
- предполагаемые медицинские показания.
Пример 1 - Обнаруживаемое, контролируемое, подвергающееся лечению, диагностике или предотвращению условие (условия) или заболевание (заболевания);
- предполагаемую популяцию ПАЦИЕНТОВ.
Пример 2 - Возраст.
Пример 3 - Вес.
Пример 4 - Состояние здоровья.
Пример 5 - Условия;
- предполагаемую часть тела или тип тканей, с которыми МЕДИЦИНСКОЕ ИЗДЕЛИЕ применяется или взаимодействует;
- предполагаемый профиль ПОЛЬЗОВАТЕЛЯ;
- предполагаемые условия использования.
Пример 6 - Окружающая среда, включая требования к гигиене.
Пример 7 - Частота использования.
Пример 8 - Положение.
Пример 9 - Мобильность;
- * принципы работы.
Примечание - Требования к отображению сводки по спецификации применения МЕДИЦИНСКОГО ИЗДЕЛИЯ в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ приведены в разделе 6.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.2* Часто используемые функции
ИЗГОТОВИТЕЛЬ должен определить часто используемые функции, которые включают взаимодействие ПОЛЬЗОВАТЕЛЯ с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, и зафиксировать их в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.3* Идентификация ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ
5.3.1 Идентификация характеристик, относящихся к БЕЗОПАСНОСТИ
Идентификация характеристик, относящихся к БЕЗОПАСНОСТИ (часть анализа РИСКОВ), касающаяся ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, должна быть проведена в соответствии с ИСО 14971, подраздел 4.2.
При идентификации характеристик, относящихся к БЕЗОПАСНОСТИ, следует учитывать следующее:
- спецификацию применения, включая профиль ПОЛЬЗОВАТЕЛЯ (ПОЛЬЗОВАТЕЛЕЙ) (см. 5.1) и
- часто используемые функции (см. 5.2).
Результаты данного определения характеристик, относящихся к БЕЗОПАСНОСТИ, должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 - См. также D.4.3, D.4.6.4, D.5.2 и D.5.4 приложения D на предмет обсуждения методов, которые могут быть полезными при определении характеристик, относящихся к БЕЗОПАСНОСТИ.
Примечание 2 - См. 4.3 на предмет изменения объема ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.3.2* Идентификация известных или прогнозируемых ОПАСНОСТЕЙ или ОПАСНЫХ СИТУАЦИЙ
ИЗГОТОВИТЕЛЬ должен идентифицировать известные или прогнозируемые ОПАСНОСТИ (как часть анализа рисков), относящиеся к ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в соответствии с ИСО 14971, подраздел 4.3. Идентификация ОПАСНОСТЕЙ должна учитывать ОПАСНОСТИ для ПАЦИЕНТА, ПОЛЬЗОВАТЕЛЯ и других лиц (см. приложения Е и F).
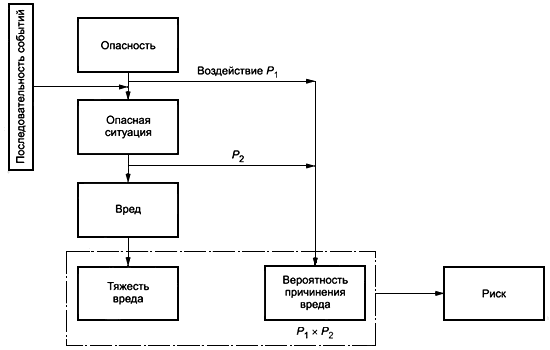
Должны быть идентифицированы логично предсказуемые последовательности или комбинации событий, затрагивающие ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС, которые могут привести к ОПАСНЫМ СИТУАЦИЯМ, связанным с МЕДИЦИНСКИМ ИЗДЕЛИЕМ. Должна быть определена ТЯЖЕСТЬ последующего возможного ВРЕДА.
При идентификации ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ необходимо учитывать следующее:
- спецификацию применения, включая профиль ПОЛЬЗОВАТЕЛЯ(ЕЙ) (см. 5.1);
- * требования, относящиеся к поставленным задачам;
- * условия применения;
- информацию по ОПАСНОСТЯМ и ОПАСНЫМ СИТУАЦИЯМ, известную для существующих ОПАСНОСТЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ сходного типа, если доступна;
- предварительный сценарий применения;
- возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ (см. С.2 приложения С на предмет некоторых примеров вероятных ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ);
- * ситуации, когда некорректная модель восприятия функционирования МЕДИЦИНСКОГО ИЗДЕЛИЯ может вызвать ОШИБКУ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, приводящую к ОПАСНЫМ СИТУАЦИЯМ;
- * результаты обзора ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА (см. С.4 приложения С и D.2.2 приложения D).
Результаты идентификации ОПАСНОСТЕЙ, ОПАСНЫХ СИТУАЦИЙ и ТЯЖЕСТИ вреда должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 - См. также D.5.9, D.5.14, D.5.17 приложения D на предмет обсуждения методов, которые могут быть полезными при идентификации известных и прогнозируемых ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ.
Примечание 2 - Идентификация ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ для МЕДИЦИНСКИХ ИЗДЕЛИЙ или для общего типа изделий является входными данными для спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, как требуется для ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 3 - При идентификации ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ могут быть идентифицированы условия НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. См. также В.1 приложения В.
Примечание 4 - Оценка постпроизводственной информации (послепродажное наблюдение) должна включать ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ (см. ИСО 14971, раздел 9).
Примечание 5 - См. 4.3 на предмет изменения объема ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.4 ОСНОВНАЯ РАБОЧАЯ ФУНКЦИЯ
ИЗГОТОВИТЕЛЬ должен определить ОСНОВНЫЕ РАБОЧИЕ ФУНКЦИИ и зарегистрировать их в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Входные параметры ОСНОВНЫХ РАБОЧИХ ФУНКЦИЙ должны учитывать следующее:
- часто используемые функции (см. 5.2) и
- функции, относящиеся к БЕЗОПАСНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Примечание 1 - См. также D.5.7 приложения D на предмет обсуждения методов, которые могут быть полезными при определении ОСНОВНЫХ РАБОЧИХ ФУНКЦИЙ.
Примечание 2 - См. Н.2.2 приложения Н на предмет примеров ОСНОВНЫХ РАБОЧИХ ФУНКЦИЙ для гипотетического медицинского изделия.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.5* Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен разработать спецификацию ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна содержать:
- контролируемые требования для ВЕРИФИКАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ;
- контролируемые требования для ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ, включая критерии определения достаточности УПРАВЛЕНИЯ РИСКАМИ, достигаемые при выполнении процедур ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 - Контролируемые требования для ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ могут быть выражены как цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Например, см. таблицы D.5 и D.6 приложения D и приложение G.
Примечание 2 - Критерии определения достаточности соответствуют критериям приемлемости РИСКА по ИСО 14971, подраздел 3.4, перечисление d).
Примечание 3 - Руководство по оценке достаточности средств УПРАВЛЕНИЯ РИСКАМИ можно найти в ИСО 14971, раздел D.4 приложения D.
Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна быть зарегистрирована в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может быть включена в другие спецификации.
Входные данные для спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны включать следующее:
- спецификацию применения (см. 5.1);
- ОСНОВНУЮ РАБОЧУЮ ФУНКЦИЮ (см. 5.4);
- ОПАСНОСТИ и ОПАСНЫЕ СИТУАЦИИ, относящиеся к ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (см. 5.3);
- известные или прогнозируемые ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, связанные с МЕДИЦИНСКИМ ИЗДЕЛИЕМ.
Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна описывать по крайней мере:
a) сценарии использования, относящиеся к ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ, включая:
1) * частые сценарии использования;
2) разумно ожидаемый худший случай сценария использования;
b) требования к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ для ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ, включая снижающие РИСК;
c) требования для определения, является ли ОСНОВНАЯ РАБОЧАЯ ФУНКЦИЯ легко понимаемой для ПОЛЬЗОВАТЕЛЯ.
Примечание 4 - См. также D.2.6, D.3.3 и D.4.4 приложения D на предмет руководства по подготовке спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 5 - Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна описывать контекст использования (см. обоснование в 5.3 и D.4.1.2.4 приложения D).
Примечание 6 - См. приложение I на предмет примеров спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для гипотетического МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Примечание 7 - См. 4.3 на предмет изменения объема ПРОЕКТИРОВАНИЯ с УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.6 План ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен подготовить и придерживаться плана ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. План ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должен предусматривать:
- любые методы, используемые для ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ;
- критерии определения успешности ВАЛИДАЦИИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ, основываясь на спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 - Контролируемые требования для ВАЛИДАЦИИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ соответствуют критериям приемлемости РИСКА по ИСО 14971, подраздел 3.4, перечисление d);
- участие представителей предполагаемых ПОЛЬЗОВАТЕЛЕЙ.
Методы ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут быть количественными и качественными. ВАЛИДАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может быть проведена в лабораторных условиях, в моделируемой окружающей среде или в реальной среде использования.
Примечание 2 - См. также D.4.4 и D.4.7.3 приложения D на предмет руководства по подготовке плана ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 3 - ИЗГОТОВИТЕЛЬ должен использовать один или более методов ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ МЕДИЦИНСКОГО ИЗДЕЛИЯ в зависимости от предполагаемого использования. Примеры этих методов можно найти в D.5.
Примечание 4 - Выводы, основанные на одном методе, могут быть недостаточными, например при клинической оценке может быть невозможно исследовать некоторые ситуации с высоким РИСКОМ.
План ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должен рассматривать:
- частые сценарии использования и
- разумно ожидаемый худший случай сценария использования, которые определены в спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 5 - См. 4.3 на предмет изменения объема ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
План ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должен быть зарегистрирован в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.7* Разработка и внедрение ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
ИЗГОТОВИТЕЛЬ должен разработать и внедрить ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС, как описано в спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, используя, если необходимо, методы и техники ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 - См. также D.4 и D.5 приложения D на предмет руководства по подготовке разработки и внедрения ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
Примечание 2 - ИЗГОТОВИТЕЛЬ должен придерживаться итеративных методов проектирования и разработки. Проектирование и разработка с учетом ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, включая ВАЛИДАЦИЮ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, должны быть начаты как можно раньше и продолжаться в течение всего жизненного цикла разработки и развития МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Примечание 3 - При рассмотрении параметров УПРАВЛЕНИЯ РИСКАМИ по ИСО 14971, подраздел 6.2, требуется, чтобы ИЗГОТОВИТЕЛЬ использовал одно или несколько действий, указанных ниже в порядке уменьшения приоритетности:
a) внутреннюю БЕЗОПАСНОСТЬ, обеспечиваемую конструкцией;
b) средства защиты, присутствующие в самом МЕДИЦИНСКОМ ИЗДЕЛИИ, или защитные меры, предусмотренные в ПРОЦЕССЕ его изготовления, например АВАРИЙНУЮ СИГНАЛИЗАЦИЮ;
c) информацию по БЕЗОПАСНОСТИ, например предупреждения в инструкции по эксплуатации, отображение контролируемых переменных, обучение и обучающие материалы, обслуживание элементов.
Соответствие требованиям данного подраздела следует рассмотреть при выполнении требований 5.8 и 5.9.
5.8* ВЕРИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен ВЕРИФИЦИРОВАТЬ внедрение ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ как часть ПРОЦЕССА ВЕРИФИКАЦИИ проекта МЕДИЦИНСКОГО ИЗДЕЛИЯ в соответствии с требованиями спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Результаты ВЕРИФИКАЦИИ должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 - См. также D.5.2, D.5.4, D.5.6, D.5.8 и D.5.15 приложения D на предмет руководства по ВЕРИФИКАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 2 - См. 4.3 на предмет изменения ОБЪЕМА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
5.9* ВАЛИДАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ИЗГОТОВИТЕЛЬ должен ВАЛИДИРОВАТЬ ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ МЕДИЦИНСКОГО ИЗДЕЛИЯ в соответствии с планом ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Результаты должны быть зарегистрированы в ФАЙЛЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 1 - См. также D.5.13 и D.5.15 приложения D на предмет руководства по проведению ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 2 - ИСО 14971, подраздел 6.6, требует, чтобы были рассмотрены изменения проекта, связанные с ПРОЦЕССОМ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, на предмет возникновения других ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ.
Примечание 3 - Эксплуатационный документ является частью ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ, и на него направлены действия по ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Примечание 4 - К ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны быть привлечены лица, которые не были непосредственно ответственны за проектирование ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
Если не выполняются критерии допустимости, документированные в плане ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ:
- должны быть проведены дальнейшие действия по разработке и внедрению ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА (см. 5.6); или
- если дальнейшее улучшение не представляется практически осуществимым, ИЗГОТОВИТЕЛЬ может собрать и проанализировать данные и литературу, чтобы установить, превышает ли ожидаемая медицинская польза при ПРЕДУСМОТРЕННОМ ПРИМЕНЕНИИ РИСКИ, вытекающие из проблем с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ. Если собранные доказательства не свидетельствуют о том, что медицинская польза превышает РИСК, то РИСК является недопустимым.
Примечание 5 - Для выполнения данного этапа изготовитель должен оценить РИСК от проблем с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ.
Примечание 6 - Результаты ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ следует использовать при оценке ОСТАТОЧНОГО РИСКА (см. ИСО 14971, подраздел 6.4).
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
6* ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ
При наличии ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА он должен содержать основную информацию по спецификации применения МЕДИЦИНСКОГО ИЗДЕЛИЯ (см. 5.1).
Примечание 1 - Основная информация по спецификации применения МЕДИЦИНСКОГО ИЗДЕЛИЯ в некоторых нормативных документах называется "заявление о предполагаемом применении".
При наличии ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА он должен включать краткое описание МЕДИЦИНСКОГО ИЗДЕЛИЯ, которое содержит, если это применимо:
-принцип работы;
- существенные физические характеристики;
- существенные рабочие характеристики;
- предполагаемый профиль ПОЛЬЗОВАТЕЛЯ.
Примечание 2 - Важной целью данного описания является помощь ПОЛЬЗОВАТЕЛЮ в получении корректного понимания МЕДИЦИНСКОГО ИЗДЕЛИЯ (см. обоснование 5.3.2 и D.5.14.3 приложения D).
При наличии ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА он должен быть написан на уровне, соответствующем ПРОФИЛЮ ПОЛЬЗОВАТЕЛЯ.
Эксплуатационный документ может быть приведен в электронном виде. Если ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ приведен в электронном виде, ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должен включать рассмотрение вопроса, какая информация также должна быть выполнена на бумажном носителе или в качестве маркировки на самом МЕДИЦИНСКОМ ИЗДЕЛИИ.
Пример - Информация, относящаяся к работе в аварийных условиях.
Соответствие требованиям проверяют путем экспертизы ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
7* Обучение и обучающие материалы
Если для безопасного и эффективного использования ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ предполагаемым ПОЛЬЗОВАТЕЛЕМ требуется обучение на данном МЕДИЦИНСКОМ ИЗДЕЛИИ, ИЗГОТОВИТЕЛЬ должен сделать, по крайней мере, одно из следующего:
- предоставить материалы, необходимые для обучения;
- убедиться, что материалы, необходимые для обучения, доступны или
- обеспечить обучение.
Если требуется такое обучение, в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ должны быть описаны параметры обучения и включены предполагаемая продолжительность и частота подобного обучения.
Если требуется такое обучение, обучение и обучающие материалы должны быть основаны на предполагаемом использовании и ПРОФИЛЕ(ПРОФИЛЯХ) ПОЛЬЗОВАТЕЛЕЙ.
Примечание 1 - Обучение на конкретном МЕДИЦИНСКОМ ИЗДЕЛИИ может использоваться для обеспечения знаний и навыков, необходимых для безопасного и эффективного использования МЕДИЦИНСКОГО ИЗДЕЛИЯ, выходящих за пределы знаний и навыков, определенных для предполагаемого ПРОФИЛЯ (ПРОФИЛЕЙ) ПОЛЬЗОВАТЕЛЕЙ.
Примечание 2 - См. МЭК 61258 [3].
Соответствие требованиям проверяют путем экспертизы ЭКСПЛУАТАЦИОННОЙ ДОКУМЕНТАЦИИ и ФАЙЛА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Приложение А
(справочное)
Общее руководство и обоснование
А.1 Введение
В настоящем приложении приведено обоснование требований настоящего стандарта. Его целью является обеспечение эффективного применения настоящего стандарта за счет объяснения причин требований и определений и обеспечение дополнительных руководящих указаний, если необходимо.
А.2 Обоснование требований отдельных разделов и подразделов
Раздел 1 - Область применения
Настоящий стандарт относится главным образом к ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ. ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ обычно включает такие параметры, как удовлетворенность ПОЛЬЗОВАТЕЛЯ и ЭФФЕКТИВНОСТЬ, которые напрямую не связаны с ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ МЕДИЦИНСКОГО ИЗДЕЛИЯ и его БЕЗОПАСНОСТЬЮ и не рассматриваются в настоящем стандарте. Примеры не рассматриваемых свойств изделия могут включать эстетичность изделия или значение потребляемой энергии.
В настоящем стандарте используется понятие ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Термин был выбран из более общеупотребительных терминов "ошибка пользователя" или "человеческая ошибка", т.к. не все ошибки, связанные с использованием МЕДИЦИНСКОГО ИЗДЕЛИЯ, являются результатом недосмотра или невнимательности со стороны ПОЛЬЗОВАТЕЛЯ МЕДИЦИНСКОГО ИЗДЕЛИЯ. Намного чаще ошибка применения является прямым следствием недостаточной разработки ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
Некоторые проекты ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА приводят к ОШИБКАМ ЭКСПЛУАТАЦИИ/ ПРИМЕНЕНИЯ из-за того, что они используют неинтуитивное или нелогичное отображение или управление. Последствия таких недостатков проекта часто проявляются только в аварийных или стрессовых ситуациях, в состоянии усталости или при редком использовании.
Область применения настоящего стандарта распространяется на использование МЕДИЦИНСКОГО ИЗДЕЛИЯ только в соответствии с инструкцией по эксплуатации, т. е. на нормальное применение. ПОЛЬЗОВАТЕЛЬ может совершать ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ (т. е. промахи, упущения и заблуждения) при попытке применения МЕДИЦИНСКОГО ИЗДЕЛИЯ в соответствии с инструкцией по эксплуатации. Так как ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ могут возникнуть при нормальном применении, в настоящем стандарте введены новое понятие и термин КОРРЕКТНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ для описания ситуации, когда ПОЛЬЗОВАТЕЛЬ следует инструкции по эксплуатации, не совершая ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
МЕДИЦИНСКОЕ ИЗДЕЛИЕ может применяться таким образом, который не соответствует описанному в инструкции по эксплуатации. В рамках настоящего стандарта такое применение описывается как НЕНОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ. Хотя ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут быть использованы для определения НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, в настоящем стандарте не требуется, чтобы ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ применялись для оценки или снижения РИСКОВ, связанных с НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ.
Область применения настоящего стандарта не включает принятие клинических решений, касающихся применения МЕДИЦИНСКОГО ИЗДЕЛИЯ. Решение о применении МЕДИЦИНСКОГО ИЗДЕЛИЯ в рамках конкретной клинической процедуры требует, чтобы ОПАСНЫЕ СИТУАЦИИ были уравновешены предполагаемой пользой от выполнения процедуры. Такие решения должны учитывать предполагаемое применение, рабочие характеристики и РИСКИ, связанные с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, а также РИСКИ и пользу, связанные с клинической процедурой или деталями применения. Некоторые из этих решений могут быть приняты только квалифицированным медицинским персоналом, обладающим знаниями о состоянии здоровья конкретного ПАЦИЕНТА или собственном мнении ПАЦИЕНТА.
Определение 3.12 - НОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ
НОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ отличается от КОРРЕКТНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, т.к. ошибки ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ (т.е. промахи, упущения и заблуждения) могут возникать при попытке использования МЕДИЦИНСКОГО ИЗДЕЛИЯ в соответствии с его инструкцией по эксплуатации.
Нормальное применение включает все предполагаемые действия ПОЛЬЗОВАТЕЛЯ при работе ПОЛЬЗОВАТЕЛЯ с МЕДИЦИНСКИМ ИЗДЕЛИЕМ в соответствии с предполагаемым использованием данного изделия согласно заявлению ИЗГОТОВИТЕЛЯ. Оно специально исключает НЕНОРМАЛЬНУЮ ЭКСПЛУАТАЦИЮ/ ПРИМЕНЕНИЕ. См. также рисунок В.1 приложения В. НОРМАЛЬНОЕ ПРИМЕНЕНИЕ - это то, что ожидается от ПОЛЬЗОВАТЕЛЯ при нормальных условиях применения, оно включает действия, которые либо корректны, либо ошибочны, но не противоречат целям проекта, предусмотренным ИЗГОТОВИТЕЛЕМ.
Существуют МЕДИЦИНСКИЕ ИЗДЕЛИЯ, которые могут быть безопасно использованы без инструкции по эксплуатации, например щипцы, скальпели. Для таких изделий нормальное применение устанавливается как применение в соответствии с общепринятой практикой.
Определение 3.13 - ПАЦИЕНТ
Определение МЭК 60601-1 включает животных. Для гармонизации с определением МЕДИЦИНСКОГО ИЗДЕЛИЯ в ИСО 13485 животные были исключены из определения ПАЦИЕНТА.
Определение 3.14 - ОСНОВНАЯ РАБОЧАЯ ФУНКЦИЯ
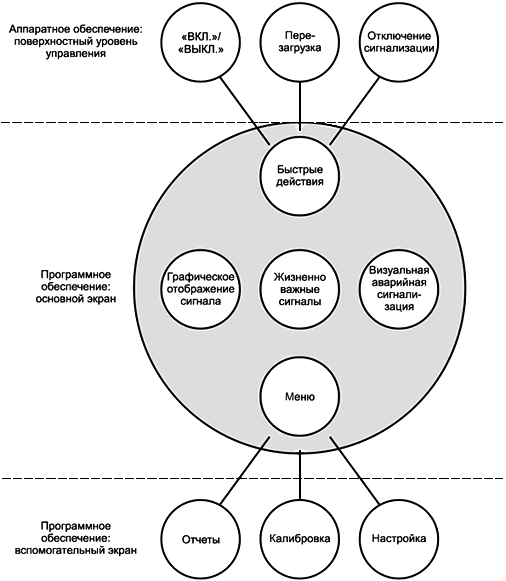
В рамках настоящего стандарта ОСНОВНАЯ РАБОЧАЯ ФУНКЦИЯ - это функция, которая непосредственно касается БЕЗОПАСНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ, или функция, которая часто используется. Примеры ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ, касающейся непосредственно БЕЗОПАСНОСТИ, включают:
- инактивацию СИСТЕМЫ СИГНАЛИЗАЦИИ (временную или постоянную);
- настройку ПРЕДЕЛОВ СРАБАТЫВАНИЯ СИГНАЛИЗАЦИИ;
- настройку параметров воздействия рентгена (например, , мА);
- настройку параметров введения (например, скорость потока);
- настройку скорости потока газов и концентрации анестезирующих веществ в испарителе.
Часто используемые функции включены в ОСНОВНУЮ РАБОЧУЮ ФУНКЦИЮ, т.к. некорректная ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ часто используемых функций приводит к дополнительной нагрузке на ПОЛЬЗОВАТЕЛЯ и может быть источником неудовлетворенности, увеличивающей вероятность ОШИБОК ПРИМЕНЕНИЯ, влияющих на функции, относящиеся к БЕЗОПАСНОСТИ.
Определение 3.17 - ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ
ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ является мерой результативности, ЭФФЕКТИВНОСТИ и удовлетворения, с которыми определенный ПОЛЬЗОВАТЕЛЬ достигает определенных целей в конкретной окружающей среде в рамках предполагаемого применения МЕДИЦИНСКОГО ИЗДЕЛИЯ. Многие из этих факторов могут в различной степени влиять на БЕЗОПАСНОСТЬ.
Время, необходимое для ознакомления с МЕДИЦИНСКИМ ИЗДЕЛИЕМ и его работой, называется "изучаемостью" (см. ИСО 9241-11, таблица В.2). Отсутствие дискомфорта и положительное отношение при использовании МЕДИЦИНСКОГО ИЗДЕЛИЯ называются "удовлетворением" (см. ИСО 9241-11, определение 3.4).
Примечание - Насколько легко запомнить подробности работы МЕДИЦИНСКОГО ИЗДЕЛИЯ, можно считать "запоминаемостью" [29]. Запоминаемость становится важной, если конкретное МЕДИЦИНСКОЕ ИЗДЕЛИЕ используется ПОЛЬЗОВАТЕЛЕМ нечасто.
Для определения, проявляет ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ достаточную ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ, требуется определение следующих влияющих факторов:
- ПОЛЬЗОВАТЕЛЬ;
- задачи/цели;
- условия и настройки, при которых ПОЛЬЗОВАТЕЛЬ взаимодействует с МЕДИЦИНСКИМ ИЗДЕЛИЕМ.
Это связано с тем, что изменения одного фактора могут существенно изменить ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ.
Пример - Монитор ЭКГ, питающийся от цепи переменного тока (батарейки), отлично работающий в относительно защищенных условиях палаты интенсивной терапии, может показывать наличие существенных недостатков ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ при применении на улице ночью. Это связано с изменениями в условиях применения и настройках. Если для его применения используется новое местоположение, то влияющие факторы зависят:
- от необходимости питания/предварительной проверки;
- внешнего освещения (ночь, яркое солнце), бликов;
- требований к обслуживанию, транспортированию, массе.
Определение 3.19 - ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ часто является частью ФАЙЛА МЕНЕДЖМЕНТА РИСКА. Не требуется, чтобы ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ являлся отдельным от ФАЙЛА МЕНЕДЖМЕНТА РИСКА ФАЙЛОМ. Нет необходимости, чтобы ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ непосредственно включал все ЗАПИСИ и другие документы, полученные в ПРОЦЕССЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Однако он должен содержать, по меньшей мере, ссылки или указания на все требуемые документы.
Определение 3.23 - ПОЛЬЗОВАТЕЛЬ
ПОЛЬЗОВАТЕЛЬ - это часто используемый термин в проектировании с учетом ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для любых лиц, которые могут обслуживать, работать или взаимодействовать с изделием другим образом. Для любого конкретного изделия может существовать широкий диапазон таких лиц: монтажники, инженеры, техники, врачи, ПАЦИЕНТЫ, медсестры, уборщики, продавцы, распространители и т. д. ПОЛЬЗОВАТЕЛИ взаимодействуют с МЕДИЦИНСКИМ ИЗДЕЛИЕМ посредством его ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА. ПОЛЬЗОВАТЕЛЬ отличается от организации, называемой ответственной организацией. ПОЛЬЗОВАТЕЛИ могут быть членами ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ.
Тем не менее в рамках настоящего стандарта требуется термин и определение, включающее всех лиц, которые работают с МЕДИЦИНСКИМ ИЗДЕЛИЕМ или обслуживают его. Как отмечено выше, в других стандартах глагол "взаимодействовать" используется в дополнение к понятиям "работать" или "обслуживать". ПАЦИЕНТ взаимодействует с МЕДИЦИНСКИМ ИЗДЕЛИЕМ посредством получения индивидуального лечения, мониторинга или диагностики. Это взаимодействие может не зависеть от работы и обслуживания МЕДИЦИНСКОГО ИЗДЕЛИЯ. Тем не менее существуют ситуации, когда ПАЦИЕНТ является ПОЛЬЗОВАТЕЛЕМ, например для домашних глюкометров.
Во многих ситуациях лицо, работающее с МЕДИЦИНСКИМ ИЗДЕЛИЕМ или обслуживающее его, выполняет задачи, не связанные с лечением, контролем или диагностикой ПАЦИЕНТА, например при монтаже, чистке, перемещении, обслуживании.
Определение 3.24 - ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС
ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС включает все способы взаимодействия между МЕДИЦИНСКИМ ИЗДЕЛИЕМ и ПОЛЬЗОВАТЕЛЕМ. Эти способы включают следующее, но не ограничиваясь им:
- ручное управление;
- ручки;
- маркировка и ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ;
- световые индикаторы;
- видеодисплеи;
- кнопки;
- сенсорные экраны;
- звуковые и визуальные ИНФОРМАЦИОННЫЕ СИГНАЛЫ;
- АВАРИЙНЫЕ СИГНАЛЫ;
- вибрационные сигналы;
- речь, например распознавание речи, синтез речи;
- клавиатура и мышь и
- тактильное управление.
Раздел 4 - Основные положения
В настоящем стандарте определены требования, касающиеся РИСКОВ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ.
В дополнение к общему сценарию использования, включающему монтаж, работу и обслуживание, на БЕЗОПАСНОСТЬ МЕДИЦИНСКОГО ИЗДЕЛИЯ может негативно влиять множество различных взаимодействий, включающих транспортирование и хранение.
Подраздел 4.1.1 - Процедуры ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Транспортирование
Во время транспортирования ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, обусловленные проектированием, могут привести к повреждению МЕДИЦИНСКОГО ИЗДЕЛИЯ за счет, например, ненадлежащего использования во время транспортирования ручек для переноски. Другим примером ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, обусловленной проектированием, служит упаковка перед транспортированием МЕДИЦИНСКОГО ИЗДЕЛИЯ в ненадлежащем положении, что приводит к повреждению при транспортировании.
Хранение
Аналогично могут привести к повреждению ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, связанные с ненадлежащей конфигурацией при хранении МЕДИЦИНСКОГО ИЗДЕЛИЯ. Например, проект может привести к тому, что ПОЛЬЗОВАТЕЛЬ сложит МЕДИЦИНСКИЕ ИЗДЕЛИЯ так, что это приведет к их повреждению. Ошибки использования, обусловленные проектированием, могут также привести к тому, что ПОЛЬЗОВАТЕЛЬ будет хранить МЕДИЦИНСКОЕ ИЗДЕЛИЕ в ненадлежащих условиях, например при открытых дверях, что может вызвать повреждения.
Подраздел 4.2 - ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
В настоящем стандарте применен термин ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, чтобы показать, где ИЗГОТОВИТЕЛЬ может найти или установить местоположение всех ЗАПИСЕЙ и других документов, примененных при проектировании с учетом ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Это облегчает ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и позволяет более эффективно проверять соответствие настоящему стандарту. Прослеживаемость необходима для демонстрации того, что применялся ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Раздел 5 - ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Всеобъемлющий ПРОЦЕСС МЕНЕДЖМЕНТА РИСКА, как это определено в ИСО 14971, требует, чтобы ИЗГОТОВИТЕЛЬ идентифицировал, документировал и поддерживал ПРОЦЕСС определения ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ, связанных с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, оценки и анализа связанных с ними РИСКОВ, УПРАВЛЕНИЯ этими РИСКАМИ и мониторинга результативности управления на протяжении всего жизненного цикла. Такой ПРОЦЕСС включает в себя следующие элементы:
- АНАЛИЗ РИСКА;
- ОЦЕНИВАНИЕ РИСКА;
- УПРАВЛЕНИЕ РИСКОМ и
- информацию по производству и постпроизводству.
При применении всеобъемлющего ПРОЦЕССА МЕНЕДЖМЕНТА РИСКА к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ оценка РИСКА для каждой ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ является проблематичной, особенно потому, что, насколько известно, не существует ВАЛИДИРОВАННЫХ методик предсказания вероятности совершения человеком ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Тем не менее настоящий стандарт предусматривает ПРОЦЕСС, который ИЗГОТОВИТЕЛЬ может использовать для анализа, определения, разработки, ВЕРИФИКАЦИИ и ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ. Использование этого ПРОЦЕССА и соответствие целям ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, установленным в начале этого ПРОЦЕССА, позволяет ИЗГОТОВИТЕЛЮ учитывать непредсказуемость ПОЛЬЗОВАТЕЛЯ и минимизировать ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Эти процедуры помогают ИЗГОТОВИТЕЛЮ достигать этих целей посредством:
- обнаружения ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ, связанных с ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ;
- разработки и внедрения средств УПРАВЛЕНИЯ РИСКАМИ, связанными с ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ и
- ВЕРИФИКАЦИИ и ВАЛИДАЦИИ средств УПРАВЛЕНИЯ РИСКАМИ.
Другая польза от ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может включать увеличение степени удовлетворенности заказчика, однако эти аспекты находятся вне области применения настоящего стандарта.
На рисунке А.1 приведен обзор ПРОЦЕССА МЕНЕДЖМЕНТА РИСКА в ИСО 14971 и ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ настоящего стандарта. При сравнении двух ПРОЦЕССОВ важно понимать различие между ПРОЦЕССОМ МЕНЕДЖМЕНТА РИСКА в ИСО 14971 и ПРОЦЕССОМ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в настоящем стандарте. МЕНЕДЖМЕНТ РИСКА - это ПРОЦЕСС принятия решения для определения приемлемого РИСКА, в то время как ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ - это ПРОЦЕСС проектирования и разработки ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, который также затрагивает РИСКИ, связанные с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ.
Примечание - ,
,
,
,
представляют информационные потоки между двумя ПРОЦЕССАМИ. Более толстые пунктирные линии (
,
и
) представляют информационные потоки, требуемые настоящим стандартом. Светлые пунктирные линии (
и
) представляют информационные потоки, когда необходимо официальное соответствие ИСО 14971.
- идентифицированные задачи, ПОЛЬЗОВАТЕЛИ и окружающая среда (см. 5.3.1);
- информация, необходимая для определения ОПАСНОСТЕЙ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ (см. 5.3.2);
- идентифицированные ОПАСНОСТИ как входные параметры для идентификации ОПАСНЫХ СИТУАЦИЙ (см. 5.3.2);
- изменения конструкции, которые могут привести к новым ОПАСНОСТЯМ или ОПАСНЫМ СИТУАЦИЯМ (см. 5.9, примечание 2);
- оценка ОСТАТОЧНОГО РИСКА, связанного с тем, что цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ не были достигнуты (см. 5.9, примечание 6)
Рисунок А.1 - Сравнение ПРОЦЕССА МЕНЕДЖМЕНТА РИСКА (ИСО 14971) и ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Когда ИЗГОТОВИТЕЛЬ определяет характеристики, касающиеся БЕЗОПАСНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ в соответствии с ИСО 14971, подраздел 4.2, ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может обеспечивать подробностями, необходимыми (см. 5.3.1) для выполнения данного этапа для ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Далее, когда ИЗГОТОВИТЕЛЬ формирует перечень известных или прогнозируемых ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ, связанных с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, в соответствии с требованиями ИСО 14971, подраздел 4.3, ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ определяет список пунктов, которым необходимо следовать (см. 5.3.2) для того, чтобы выполнить данный этап для ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ. В настоящем стандарте также определены методы, которые может использовать ИЗГОТОВИТЕЛЬ для разработки данного списка.
В ИСО 14971 требуется, чтобы были определены (см. ИСО 14971, подраздел 4.4) и оценивались (см. ИСО 14971, раздел 5) РИСКИ, связанные с каждой идентифицированной ОПАСНОЙ СИТУАЦИЕЙ. Если РИСК неприемлем в соответствии с критериями приемлемости РИСКА, определенными ИЗГОТОВИТЕЛЕМ, требуется, чтобы ИЗГОТОВИТЕЛЬ определил средство(а) УПРАВЛЕНИЯ РИСКОМ, подходящее(ие) для снижения РИСКА(ОВ) до приемлемого уровня (см. ИСО 14971, подраздел 6.2). В таком случае требуется, чтобы ИЗГОТОВИТЕЛЬ реализовал определенные средства УПРАВЛЕНИЯ РИСКОМ и ВЕРИФИЦИРОВАЛ их на предмет ЭФФЕКТИВНОСТИ при снижении РИСКА до приемлемого уровня (см. ИСО 14971, подраздел 6.3).
В ПРОЦЕССЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ требуется, чтобы при подготовке спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ были учтены все известные или прогнозируемые ОПАСНОСТИ и ОПАСНЫЕ СИТУАЦИИ, касающиеся ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ, а не только ситуации с недопустимым РИСКОМ.
В настоящем стандарте параметры УПРАВЛЕНИЯ РИСКОМ, связанным с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ, определяются в ПРОЦЕССЕ разработки спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ с требованиями, подлежащими испытаниям (см. 5.5).
Требования к разработке и реализации параметров, выбранных для соответствия спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для данных ОПАСНЫХ СИТУАЦИЙ, описаны в 5.6, ВЕРИФИЦИРОВАНЫ в 5.8 и ВАЛИДИРОВАНЫ в 5.9. ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС ВЕРИФИЦИРУЕТСЯ в соответствии со спецификацией ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ВАЛИДИРУЕТСЯ, если план ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ включает критерии приемлемости. Этот этап достигает тех же целей, как и в ИСО 14971, подразделы 4.4-6.4.
Даже если ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС соответствует спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, ИЗГОТОВИТЕЛЬ должен проводить оценку для определения, не приводит ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ к новым ОПАСНОСТЯМ и ОПАСНЫМ СИТУАЦИЯМ, как требуется в ИСО 14971, подраздел 6.6. Если данный ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС не соответствует спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, ИЗГОТОВИТЕЛЬ должен проводить оценку ОСТАТОЧНОГО РИСКА, как требуется в ИСО 14971, подраздел 6.4.
Подраздел 5.1 - Спецификация применения
ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, описанный в настоящем стандарте, начинается с определения наиболее важных характеристик, относящихся к применению МЕДИЦИНСКОГО ИЗДЕЛИЯ. Эти характеристики определяются ИЗГОТОВИТЕЛЕМ и основываются на таких факторах, как предполагаемые медицинские показания, предполагаемая популяция ПАЦИЕНТОВ и принципы работы, и являются существенными для функционирования МЕДИЦИНСКОГО ИЗДЕЛИЯ. Эта информация фиксируется в спецификации применения МЕДИЦИНСКОГО ИЗДЕЛИЯ. Эти параметры являются основной входной информацией при проектировании для идентификации известных и прогнозируемых ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ, связанных с ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ. Спецификация применения МЕДИЦИНСКОГО ИЗДЕЛИЯ является основой для идентификации спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Перечень характеристик, связанных со спецификацией применения, является частью определения предполагаемого применения, как установлено в ИСО 14971.
Предполагаемые медицинские показания
Предполагаемые медицинские показания могут быть очень широкими или совершенно узкими. ИЗГОТОВИТЕЛЮ важно четко определить и указать в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ предполагаемые медицинские показания. ПОЛЬЗОВАТЕЛЬ должен понимать предполагаемые медицинские показания для того, чтобы определить, подходит ли данное МЕДИЦИНСКОЕ ИЗДЕЛИЕ данному ПАЦИЕНТУ.
Некоторые МЕДИЦИНСКИЕ ИЗДЕЛИЯ предназначены для широкого спектра медицинских показаний.
Пример 1 - Безопасный шприц: показан для внутримышечного и подкожного введения лекарств ПАЦИЕНТУ.
Пример 2 - Монитор для нескольких параметров ПАЦИЕНТА: показан в любых случаях, когда существует необходимость контроля физиологических параметров ПАЦИЕНТА.
Другие МЕДИЦИНСКИЕ ИЗДЕЛИЯ предназначены для очень узкого круга медицинских показаний.
Пример 3 - Септостомический катетер: показан для катетеризации при ангиографии сердечнососудистого русла или камер.
Пример 4 - Манометр для жидкости: показан для измерения давления спинномозговой жидкости во время процедуры люмбальной пункции.
Предполагаемый ПРОФИЛЬ ПОЛЬЗОВАТЕЛЯ
Важно, чтобы конструкция МЕДИЦИНСКОГО ИЗДЕЛИЯ подходила предполагаемому ПОЛЬЗОВАТЕЛЮ(ЯМ). Факторы, которые необходимо учитывать при разработке ПРОФИЛЯ ПОЛЬЗОВАТЕЛЯ, включают возраст, пол, лингвистический и культурный уровень, уровень образования и профессиональную компетентность. Следует учитывать возможные ограничения ПОЛЬЗОВАТЕЛЕЙ в выполнении определенных действий. Например, для МЕДИЦИНСКИХ ИЗДЕЛИЙ, предназначенных для использования диабетиками, необходимо учитывать, что они часто плохо видят и имеют пониженную чувствительность пальцев.
См. Н.2.1.2.4 приложения Н на предмет примеров ПРОФИЛЕЙ ПОЛЬЗОВАТЕЛЕЙ.
Предполагаемые условия применения
Предполагаемые условия применения - это показатели важных параметров применения рассматриваемого конкретного МЕДИЦИНСКОГО ИЗДЕЛИЯ. Они могут включать такие параметры, как:
- стерильное или нестерильное;
- одноразового или многоразового использования;
- использование у одного ПАЦИЕНТА или у нескольких ПАЦИЕНТОВ;
- для больничного или домашнего использования;
- использование в машинах скорой помощи, при транспортировании в пределах клиники или прикрепленным к стене;
- использование в общих палатах или в операционной;
- постоянная имплантация или контакт менее часа.
Принципы работы
Принципы работы МЕДИЦИНСКОГО ИЗДЕЛИЯ включают описание:
- физических методов, используемых для реализации его предполагаемого применения.
Пример 1 - Скальпель, использующий сильно сфокусированную энергию лазера.
Пример 2 - Скальпель с заточенным лезвием из коррозионно-стойкой стали.
Пример 3 - Скальпель, использующий высокоэнергетические коротковолновые электромагнитные поля;
- механизмов, за счет которых он работает.
Пример 4 - Внутривенный инфузионный насос, доставляющий лекарства через капельницу, соединенную с катетером ПАЦИЕНТА, за счет механизма перистальтики, использующий ролики и механические пальцы, которые сжимают и прогоняют жидкость по пластиковым трубкам.
Пример 5 - Внутривенный инфузионный насос, доставляющий лекарства через капельницу, соединенную с катетером ПАЦИЕНТА, за счет волюметрического насоса, который имеет поршни, соединенные с диафрагмой, на кассетном механизме, соединенном с трубками ПАЦИЕНТА, проводящий жидкость из внутривенного резервуара за счет создания вакуума в пределах кассетного механизма.
Подраздел 5.2 - Часто используемые функции
Идентификация часто используемых функций является важным входным параметром для ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Недостаточная ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ часто используемых функций может оказать негативное влияние на БЕЗОПАСНОСТЬ за счет увеличения вероятности ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Набор даже относительно незначительных недостатков конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА может увеличить вероятность ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ и их последствий, особенно, когда они включают часто используемые функции. Примеры таких недостатков включают маркировку низкого качества (плохую), неоднозначную взаимосвязь между управлением и отображением на дисплее, сложные для считывания индикаторы, соединители с недостаточным кодированием соответствующей формы, непоследовательные методы навигации в программном обеспечении и т.д. Как минимум эти недостатки могут увеличить время, необходимое для выполнения часто используемых задач (из-за общего увеличения умственной и физической рабочей нагрузки). В худшем случае эти недостатки могут привести к ОШИБКАМ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, т.к. ПОЛЬЗОВАТЕЛИ вынуждены фокусировать внимание на работе МЕДИЦИНСКОГО ИЗДЕЛИЯ, не обращая внимания на параметры более высокого уровня, связанные непосредственно с БЕЗОПАСНОСТЬЮ ПАЦИЕНТА.
Так как увеличивается рабочая нагрузка, следовательно, увеличивается вероятность ошибок различного рода. Становится меньше времени для проверки работы, меньше времени для рассмотрения всех изменяющихся параметров и увеличивается вероятность неточностей и ошибок, связанных со спешкой. Недовольство ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ может привести к тому, что ПОЛЬЗОВАТЕЛЬ будет использовать упрощенные методы, импровизировать или из лучших побуждений использовать "оптимизацию" (т.е. совершать ошибки по незнанию), что в свою очередь может оказать негативное влияние на БЕЗОПАСНОСТЬ. Поэтому имеет смысл пересмотреть все функции, особенно часто используемые, а также нечасто используемые функции, которые могут использоваться в аварийных ситуациях, и определить, могут ли проблемы, связанные с эффектом накопления недостатков ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, негативно повлиять на БЕЗОПАСНОСТЬ.
Пункт 5.3.2 - Идентификация известных или прогнозируемых ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ
Требования, относящиеся к поставленным задачам
Требования, относящиеся к поставленным задачам, формируются на основании анализа задач (см. D.5.14 приложения D) и обычно определяются как входные параметры для спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (см. Н.2.3.4 приложения Н). Примерами требований, относящихся к поставленным задачам, служат:
- внешняя поверхность должна облегчать чистку;
- маркировка должна быть читаемой в условиях низкой освещенности;
- МЕДИЦИНСКОЕ ИЗДЕЛИЕ должно иметь возможность транспортирования одной рукой.
Условия применения
Условия применения оказывают существенное влияние на ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА МЕДИЦИНСКОГО ИЗДЕЛИЯ. По причинам, связанным с БЕЗОПАСНОСТЬЮ, условия применения должны быть анализированы и учтены ИЗГОТОВИТЕЛЕМ. Если МЕДИЦИНСКОЕ ИЗДЕЛИЕ используется в комбинации с другими МЕДИЦИНСКИМИ ИЗДЕЛИЯМИ, условия применения должны учитывать параметры других элементов системы. См. также D.2.2 и D.4.1.2.4 приложения D.
Примеры различных влияющих факторов, которые необходимо учитывать, включают:
a) пространственные условия:
1) архитектура: тип здания и положение в здании, например: клиника (например, общая палата, операционная, палата интенсивной терапии), офис, кинотеатр, дом;
2) улица;
3) транспортирование ПАЦИЕНТА (например, самолет, корабль, машина скорой помощи, автомобиль);
4) ровность и наклон пола;
5) положение чрезвычайного происшествия или аварии;
b) социальные условия:
1) организация;
2) передача обязанностей (например, требования к получению/первым входным данным/выходным данным МЕДИЦИНСКОГО ИЗДЕЛИЯ при смене ПОЛЬЗОВАТЕЛЕЙ);
3) присутствие: детей без сопровождения; необученных или любопытных взрослых;
4) ответственность (например, совместная, на одного человека);
c) технологические условия:
1) другие технические устройства, которые требуются для использования МЕДИЦИНСКОГО ИЗДЕЛИЯ;
2) другие технические устройства, которые могут влиять на использование МЕДИЦИНСКОГО ИЗДЕЛИЯ;
3) другие технические устройства, на которые влияет использование МЕДИЦИНСКОГО ИЗДЕЛИЯ;
4) влияние других устройств на МЕДИЦИНСКОЕ ИЗДЕЛИЕ;
гигиенические условия:
- требования к чистоте, условиям стерильности;
- средства очистки;
- средства утилизации отходов;
физические условия:
- климатические условия (например, высота над уровнем моря, внешнее давление, температура, влажность, осадки, ветер);
- ускорение, изменение системы отсчета (например, машины, судна);
- уровень освещенности;
- уровень внешнего шума;
- условия активности:
- отвлечение внимания;
- другие задачи, которые могут препятствовать работе МЕДИЦИНСКОГО ИЗДЕЛИЯ;
- неожиданность (неожиданное событие)/эффект испуга;
- напряжение и стресс;
- влияние производственной среды (например, невозможность общения с ПАЦИЕНТОМ из-за шума оборудования МРТ);
- изменения производственной среды, которые могут вызывать другие МЕДИЦИНСКИЕ ИЗДЕЛИЯ (например, низкий уровень общего освещения при офтальмологических операциях);
- нагрузки и усталость (например, влияние посменной работы, такое как снижение познавательной активности, на выполнение задач).
Некорректная модель восприятия
Модель восприятия - это принципиальная модель представления ПОЛЬЗОВАТЕЛЯ о том, как работает МЕДИЦИНСКОЕ ИЗДЕЛИЕ и о его структуре. Если модель восприятия ПОЛЬЗОВАТЕЛЯ основана на знаниях о том, как работает МЕДИЦИНСКОЕ ИЗДЕЛИЕ в данной ситуации, она является структурной моделью и позволяет ПОЛЬЗОВАТЕЛЮ решать проблемы, которые могут возникнуть при использовании МЕДИЦИНСКОГО ИЗДЕЛИЯ. В идеале модель восприятия ПОЛЬЗОВАТЕЛЯ может быть легко выстроена на основании взаимодействия с МЕДИЦИНСКИМ ИЗДЕЛИЕМ или может быть получена на основании объяснений при обучении или в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ. Лучшая модель восприятия является очевидной и не требует объяснений.
Модель восприятия того, как термостат управляет системой обогрева ПАЦИЕНТА, может включать два возможных варианта:
- это простой выключатель, который срабатывает под управлением устройства на основе термопары для поддержания требуемой температуры;
- это вентиль, который контролирует скорость потока горячего воздуха таким образом, чтобы настройки на более высокую температуру позволяли проходить большему объему воздуха, который позволяет более быстро обогреть ПАЦИЕНТА.
Корректная модель восприятия типичной системы обогрева ПАЦИЕНТА подразумевает, что это - термостат с простым выключателем, а не вентиль для контроля скорости потока воздуха. Последствиями наличия некорректной модели восприятия является некорректное использование энергии для достижения необходимой температуры ПАЦИЕНТА. Если ПОЛЬЗОВАТЕЛЬ имеет некорректную модель восприятия вентиля вместо термостата, он непродуктивно выставит термостат сначала на слишком высокую, а затем на слишком низкую температуру, чтобы попытаться добиться быстрого достижения необходимой стабильной температуры. См. также обоснование раздела 6.
Обзор ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
Важно помнить, что ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ является итеративным (см. 5.6). ИЗГОТОВИТЕЛЬ должен возвращаться к этому этапу в ПРОЦЕССЕ разработки ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, чтобы убедиться, что все известные или прогнозируемые ОПАСНОСТИ учтены и не возникает новых ОПАСНОСТЕЙ.
Подраздел 5.5 - Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Целью ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, описанного в настоящем стандарте, является обеспечение БЕЗОПАСНОСТИ ПАЦИЕНТА, ПОЛЬЗОВАТЕЛЯ и других лиц, связанных с ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ. Для достижения этой цели ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ снижает РИСК, вызванный проблемами с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ, связанными с правильным применением и ОШИБКАМИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, т.е. с нормальным применением. Достижение этой цели демонстрируется ВЕРИФИКАЦИЕЙ и ВАЛИДАЦИЕЙ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ ОСНОВНОЙ РАБОЧЕЙ ФУНКЦИИ в соответствии с критериями приемлемости, установленными в спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Следовательно, при определении этих критериев приемлемости, ИЗГОТОВИТЕЛЬ учитывает факторы (например, состояние науки, опыт с аналогичными МЕДИЦИНСКИМИ ИЗДЕЛИЯМИ, отчеты по послепродажному наблюдению), необходимые для установления критериев таким образом, чтобы при соответствии этим критериям ОСТАТОЧНЫЙ РИСК, связанный с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ, управлялся до приемлемого уровня. ИЗГОТОВИТЕЛЬ может использовать критерии приемлемости, определенные в соответствии с ИСО 14971, подраздел 3.4, перечисление d).
Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ описывает два типа сценариев применения: те сценарии применения, которые встречаются часто, и те, которые представляют собой логично ожидаемый худший случай. При определении этих сценариев использования, ИЗГОТОВИТЕЛЬ должен фокусироваться:
- на облегчении специальных задач, которые предполагаются ИЗГОТОВИТЕЛЕМ для выполнения ПОЛЬЗОВАТЕЛЕМ и ответственной организацией;
- минимизации РИСКОВ, которые могут возникнуть, если предполагаемый ПОЛЬЗОВАТЕЛЬ или ОТВЕТСТВЕННАЯ ОРГАНИЗАЦИЯ попытаются выполнить другие задачи, не предусмотренные ИЗГОТОВИТЕЛЕМ.
Часто используемые сценарии ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ
Предварительные сценарии ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ представляют собой реальные задачи, которые будут выполнять ПОЛЬЗОВАТЕЛЬ и ОТВЕТСТВЕННАЯ ОРГАНИЗАЦИЯ с МЕДИЦИНСКИМ ИЗДЕЛИЕМ. Они включают конечный результат задачи, который пытаются достичь, причину выполнения задачи, функциональное состояние МЕДИЦИНСКОГО ИЗДЕЛИЯ, когда начинается выполнение задачи, и показания дисплеев и распечатки, наблюдаемые ПОЛЬЗОВАТЕЛЕМ при выполнении задачи. Сценарий ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ должен включать как общие текущие задачи, так и редко используемые задачи, которые могут быть выполнены в аварийных ситуациях.
Подраздел 5.7 - Проектирование и разработка ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
Разработка ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА должна быть направлена на нужды и требования ПОЛЬЗОВАТЕЛЯ. Для разработки ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА требуется междисциплинарный командный подход. Эта команда может включать реальных ПОЛЬЗОВАТЕЛЕЙ, инженеров, специалистов по ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ, психологов, программистов мультимедиа, инженеров ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, персонал, ответственный за продажи и обучение. См. также D.1.1 приложения D.
Подраздел 5.8 - ВЕРИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Целью ВЕРИФИКАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ является проверка того, что МЕДИЦИНСКОЕ ИЗДЕЛИЕ соответствует спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Учитывая итеративный характер ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, ВЕРИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может:
- направлять развитие частей МЕДИЦИНСКОГО ИЗДЕЛИЯ, таких как ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ и обучение, и,
- если необходимо, порождать/вызывать корректировки в ПОЛЬЗОВАТЕЛЬСКОМ ИНТЕРФЕЙСЕ.
ВЕРИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может быть проведена путем экспертизы реализованного ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА или путем процедур наблюдения и сбора данных у предполагаемых ПОЛЬЗОВАТЕЛЕЙ во время их взаимодействия либо с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, либо (с высокой степенью достоверности) прототипом МЕДИЦИНСКОГО ИЗДЕЛИЯ в предполагаемой или моделируемой среде применения.
ВЕРИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ проверяет ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС для определения, соответствует ли он своей спецификации, в то время как ВАЛИДАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ подтверждает, соответствует ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ требованиям ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для определенного применения или предполагаемого использования. См. также обоснование 5.9 и D.4.7.2 приложения D.
Подраздел 5.9 - ВАЛИДАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Конечным этапом ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ является ВАЛИДАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. ВАЛИДАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ предназначена для того, чтобы убедиться, что разработан надлежащий продукт. Для ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА ВАЛИДАЦИЯ важна, так как может возникать непредвиденное взаимодействие между МЕДИЦИНСКИМ ИЗДЕЛИЕМ и ПОЛЬЗОВАТЕЛЕМ, которое может быть обнаружено только при ВАЛИДАЦИИ.
Действия по ВАЛИДАЦИИ следует выполнять на протяжении всей разработки МЕДИЦИНСКОГО ИЗДЕЛИЯ, начиная с ранних этапов разработки концептуальной модели (см. D.4.7 приложения D).
Раздел 6 - ЭКСПЛУАТАЦИОННЫЙ ДОКУМЕНТ
Для ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ и ПОЛЬЗОВАТЕЛЯ важно иметь четкое понимание работы МЕДИЦИНСКОГО ИЗДЕЛИЯ. Хорошая модель восприятия МЕДИЦИНСКОГО ИЗДЕЛИЯ помогает обеспечить больший уровень БЕЗОПАСНОСТИ, т. к. ПОЛЬЗОВАТЕЛЬ лучше понимает преимущества и ограничения МЕДИЦИНСКОГО ИЗДЕЛИЯ, что может уменьшить число ошибок и избежать появления неисправностей. Перечисленные пункты считаются необходимыми для помощи ПОЛЬЗОВАТЕЛЮ в построении такой модели восприятия. См. также обоснование 5.3.2 (некорректная модель восприятия).
Раздел 7 - Обучение и обучающие материалы
Некоторые МЕДИЦИНСКИЕ ИЗДЕЛИЯ являются комплексными с большим количеством функций. Для помощи в обеспечении безопасного применения, как средство УПРАВЛЕНИЯ РИСКАМИ может использоваться специальное обучение. Такое обучение и обучающие материалы, предоставляемые с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, должны учитывать ПРОФИЛЬ ПОЛЬЗОВАТЕЛЯ и иметь достаточную ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ. Средства обучения могут включать инструкции, карточки, видео, интерактивное компьютерное обучение и лекции. ИЗГОТОВИТЕЛЬ или третья сторона должны предоставить эти материалы или обеспечить это обучение.
Приложение В
(справочное)
Категории действий ПОЛЬЗОВАТЕЛЯ
В рамках настоящего стандарта действия или бездействие ПОЛЬЗОВАТЕЛЯ могут быть в целом разделены на те, которые являются прогнозируемыми, и те, которые не являются прогнозируемыми. Очевидно, что те действия или бездействие ПОЛЬЗОВАТЕЛЯ, которые являются непредсказуемыми, не могут быть рассмотрены в настоящем или любом другом стандарте. В настоящем стандарте описаны процедуры, которые учитывают те действия или бездействие ПОЛЬЗОВАТЕЛЯ, которые можно спрогнозировать. Эти прогнозируемые события в дальнейшем могут быть разделены на предусмотренные или непредусмотренные действия или бездействие ПОЛЬЗОВАТЕЛЯ (см. рисунок В.1).
На рисунке В.1 предусмотренные действия или бездействие ПОЛЬЗОВАТЕЛЯ, которые выполняются при нормальном использовании, могут быть ответом, который предусмотрен ИЗГОТОВИТЕЛЕМ и ожидается ПОЛЬЗОВАТЕЛЕМ, т.е. корректным использованием. С другой стороны, предусмотренные действия или бездействие могут привести к ошибке или к срабатыванию дополнительных средств ИЗГОТОВИТЕЛЯ по УПРАВЛЕНИЮ РИСКОМ, т.е. являться НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ. Это не обязательно означает, что НЕНОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ приводит к неблагоприятным последствиям для ПАЦИЕНТА. Часто клиническим решением ПОЛЬЗОВАТЕЛЬ показывает, что такое применение соответствует интересам ПАЦИЕНТА. В рамках настоящего стандарта непредусмотренные действия или бездействие также классифицируются как промах или упущение.
Примечание 1 - На данном рисунке, действия могут быть результатом:
- выбора ПОЛЬЗОВАТЕЛЕМ сделать что-то или
- отказа ПОЛЬЗОВАТЕЛЯ сделать что-то.
Примечание 2 - См. приложение С на предмет списка вероятных ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ и НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ и их причин.
Примечание 3 - Незнание рассматривают в контексте отсутствия знаний о негативных последствиях действий, требующих определенного уровня знаний.
Рисунок В.1 - Категории прогнозируемых действий ПОЛЬЗОВАТЕЛЯ
Промах, упущение или заблуждение - это все рассматриваемые формы ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. В ПРОЦЕССЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, полезно различать эти категории при определении основных причин конкретной ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, чтобы облегчить определение тех ошибок, которые могут быть смягчены проектом.
Упущения и промахи - это ошибки, которые возникают из-за отказа в части последовательности действий на этапах исполнения и/или хранения, независимо от того, был ли руководящий ими план достаточным для достижения цели. В то время как промах, вероятно, можно наблюдать как выполнение действия не так, как запланировано (оговорка, описка, неверное действие), термин "упущение" обычно используется для более скрытых видов ошибок, в основном включающих отказ памяти, которые не обязательно обнаруживаются при текущих действиях и могут быть видны только для лица, имеющего опыт в этой области.
Ошибки могут быть определены как недостатки или отказ в процедурах анализа на основании здравого смысла и/или логики в ходе отбора свидетельств того, соответствуют ли действия, проводимые по данной схеме принятия решения, плану или нет.
Приложение С
(справочное)
Примеры ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ и возможных причин
С.1 Исходные данные
Следующие примеры ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ и НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ основаны на отчетах о неблагоприятных событиях, собранных несколькими контролирующими органами [13]. Эти примеры являются сокращенным описанием реальных событий и были изменены для освещения разницы между НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ и ОШИБКОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Неблагоприятные события классифицируются, как указано ниже, на основании оценки проекта и ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА затрагиваемого МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Признается, что отличие ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ от НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ не всегда легко определить и поэтому часто требуется детальное исследование, анализ и документирование. Детальное исследование может включать анализ тренда и основных причин в качестве метода классификации событий.
Список возможных причин ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ был взят из ИСО 14971, таблица 2.
С.2 ОШИБКА ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ
Ниже приведено краткое описание, основанное на реальных событиях, которые были определены на тот момент как пример ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ:
- ПОЛЬЗОВАТЕЛЬ перепутал две кнопки и нажал не ту кнопку;
- ПОЛЬЗОВАТЕЛЬ неправильно интерпретировал иконку и выбрал неверную функцию;
- ПОЛЬЗОВАТЕЛЬ ввел неправильную комбинацию и произошел отказ в начале вливания;
- ПОЛЬЗОВАТЕЛЬ не определил опасное увеличение частоты сердечных сокращений из-за того, что аварийный предел ошибочно был установлен на очень высокое значение, а ПОЛЬЗОВАТЕЛЬ излишне надеялся на СИСТЕМУ СИГНАЛИЗАЦИИ;
- ПОЛЬЗОВАТЕЛЬ сломал соединитель катетера при затягивании или ослаблении соединителя;
- центробежный насос очищен с использованием спирта. Известно, что он изготавливается из материала, несовместимого со спиртом. Разумно можно спрогнозировать, что спирт может использоваться для чистки насоса, т.к. спирт в готовом состоянии доступен в больнице и нет четких и ясных предупреждений;
- непредусмотренное использование дозатора за пределами калиброванного диапазона;
- анализатор размещен под прямыми солнечными лучами, что вызывает повышение температуры реакции выше определенного уровня;
- техник внес кислородный баллон из стали в область с магнитным полем от системы МРТ, перемещаясь с ним по комнате в пределах магнитного поля;
- ПОЛЬЗОВАТЕЛЬ сознательно использует сокращение процедур или предварительной подготовки и т.д., тем самым пропуская важные этапы. Это не значит, что сокращения являются опасными;
- ПОЛЬЗОВАТЕЛЬ случайно пропускает важные этапы в слишком длинных или сложных процедурах или предварительной подготовке.
С.3 НЕНОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ
ИЗГОТОВИТЕЛЬ ответственен за применение всех разумных средств УПРАВЛЕНИЯ РИСКОМ. Они могут включать информацию о БЕЗОПАСНОСТИ, которая является одним из элементов в иерархическом подходе к УПРАВЛЕНИЮ РИСКОМ. Следуя процедурам ИСО 14971, ИЗГОТОВИТЕЛЬ использует один или более пунктов из следующих в порядке перечисления:
- внутреннюю БЕЗОПАСНОСТЬ, обеспечиваемую конструкцией;
- средства защиты, присутствующие в самом МЕДИЦИНСКОМ ИЗДЕЛИИ, или защитные меры, предусмотренные в ПРОЦЕССЕ его изготовления, например аварийную сигнализацию;
- информацию по БЕЗОПАСНОСТИ, например предупреждения в инструкции по эксплуатации, отображение контролируемых переменных, обучение и обучающие материалы, обслуживание элементов.
Если, несмотря на то, что ИЗГОТОВИТЕЛЬ предоставил ВАЛИДИРОВАННУЮ информацию, касающуюся БЕЗОПАСНОСТИ (см. 4.1.3), ПОЛЬЗОВАТЕЛЬ действует противоположно данной информации, касающейся БЕЗОПАСНОСТИ, НЕКОРРЕКТНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ классифицируется как НЕНОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ.
Ниже приведено краткое описание отчетов о недостатках, взятых из [13] (приложение А) документа рабочей группы по глобальной гармонизации по фиксированию ошибок применения. Эти примеры основаны на реальных событиях, которые были определены на тот момент как примеры НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИИ/ ПРИМЕНЕНИЯ. В каждом случае было определено, что ИЗГОТОВИТЕЛЬ учитывал соответствующие РИСКИ, используя соответствующие средства УПРАВЛЕНИЯ РИСКОМ. Они включают соответствующий проект, соответствующее обучение, информацию, касающуюся БЕЗОПАСНОСТИ, и описание КОРРЕКТНОЙ ЭКСПЛУАТАЦИИ/ ПРИМЕНЕНИЯ в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ:
- преднамеренное нарушение ВАЛИДИРОВАННОГО, простого определенного в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ контрольного списка проверки БЕЗОПАСНОСТИ перед использованием;
- отказ от прекращения использования рентгеновской трубки, игнорируя заметный предупреждающий световой индикатор, указывающий, что трубка перегрелась. Рентгеновское МЕДИЦИНСКОЕ ИЗДЕЛИЕ впоследствии останавливает работу или происходит отказ и это откладывает или делает невозможным завершение терапевтической процедуры;
- использование диагностического ультразвукового МЕДИЦИНСКОГО ИЗДЕЛИЯ до завершения установки в соответствии с ЭКСПЛУАТАЦИОННОЙ ДОКУМЕНТАЦИЕЙ;
- продолжение использования МЕДИЦИНСКОГО ИЗДЕЛИЯ за пределами предписанного интервала профилактического обслуживания, четко определенного в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ, из-за отказа ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ обеспечить профилактическое обслуживание;
- игнорируя требования ЭКСПЛУАТАЦИОННОГО ДОКУМЕНТА, МЕДИЦИНСКОЕ ИЗДЕЛИЕ не стерилизуется перед использованием;
- использование электрохирургического устройства у ПАЦИЕНТА с кардиостимулятором, сознательно проигнорировав четкое предупреждение в ЭКСПЛУАТАЦИОННОМ ДОКУМЕНТЕ о необходимости принятия соответствующих мер предосторожности, что привело к необходимости перепрограммирования кардиостимулятора и его замены;
- ПАЦИЕНТУ был нанесен ВРЕД из-за того, что ОТВЕТСТВЕННАЯ ОРГАНИЗАЦИЯ позволила необученным ПОЛЬЗОВАТЕЛЯМ применять МЕДИЦИНСКОЕ ИЗДЕЛИЕ. Медицинское изделие работало в соответствии со своей спецификацией;
- во время замены кардиостимулятора необученный врач проколол сердце;
- этикетки на центробежном насосе четко указывают, что он предназначен для применения при операциях шунтирования, длящихся менее 6 ч. Не найдя другого насоса, врач решил использовать насос в процедуре экстракорпоральной мембранной оксигенации у ребенка, длящейся несколько дней. Насос вышел из строя из-за усталостного разрушения, и у ПАЦИЕНТА возникло кровотечение, приведшее к летальному исходу;
- ПОЛЬЗОВАТЕЛЬ уронил инфузионный насос, видимо повредив его. ПОЛЬЗОВАТЕЛЬ все равно использовал насос, нанеся повреждения ПАЦИЕНТУ;
- известно, что центробежный насос изготовлен из материала, несовместимого со спиртом. ПОЛЬЗОВАТЕЛЬ чистит насос со спиртом, несмотря на четкие и ясные предупреждения на насосе, что не следует использовать спирт;
- несмотря на предупреждения о правилах очистки, ОТВЕТСТВЕННАЯ ОРГАНИЗАЦИЯ или ПОЛЬЗОВАТЕЛЬ повреждают блокировку, обеспечивающую БЕЗОПАСНОСТЬ, на медицинском лазере;
- несмотря на предупреждения о правилах очистки, фильтр удаляется и преднамеренно не заменяется, что приводит к загрязнению твердыми частицами и последующему отказу диагностического МЕДИЦИНСКОГО ИЗДЕЛИЯ in vitro;
- использование автоматического анализатора без проверочной калибровки, нарушая заметные предупреждения на экране о том, что необходима калибровка;
- ПАЦИЕНТ с кардиостимулятором помещен в систему МРТ, хотя врач знал, что использование МРТ противопоказано;
- ПОЛЬЗОВАТЕЛЬ инактивировал СИСТЕМУ СИГНАЛИЗАЦИИ и не контролировал соответствующим образом условия ПАЦИЕНТА, тем самым воспрепятствовав определению ухудшения состояния ПАЦИЕНТА;
- система сигнализации системы искусственной вентиляции легких была умышленно отключена, тем самым воспрепятствовав определению ОПАСНЫХ СИТУАЦИЙ;
- родственники ПАЦИЕНТОВ умышленно изменили параметры инфузионного насоса так, чтобы у ПАЦИЕНТА произошла передозировка вводимого лекарства;
- работник, ухаживающий на дому за ПАЦИЕНТОМ, использовал поручни кровати и матрас для удушения ПАЦИЕНТА.
Примечание - Существует разница между преднамеренной и злоумышленной НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ. Как показывают примеры, НЕНОРМАЛЬНАЯ ЭКСПЛУАТАЦИЯ/ПРИМЕНЕНИЕ часто хорошо осознается (т.е. ПОЛЬЗОВАТЕЛЬ допускает определенный РИСК для ожидаемой пользы для ПАЦИЕНТА), но он может зайти так далеко, что будет присутствовать явный криминал. Есть различие с ситуацией, когда ПОЛЬЗОВАТЕЛЬ недооценивает РИСКИ, связанные с его действием/бездействием, т.к. РИСКИ не четко указаны и данное событие может считаться ОШИБКОЙ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
С.4 Возможные причины ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ
Далее приведены примеры нарушения эвристических правил при разработке ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, что может привести к ОШИБКЕ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ:
- сложная или непонятная система управления;
- неоднозначное или нечеткое состояние МЕДИЦИНСКОГО ИЗДЕЛИЯ;
- неоднозначное или нечеткое представление настроек, измерений или другой информации;
- искаженное отображение результатов;
- недостаточная видимость, слышимость или тактильные параметры;
- недостаточное отображение действий по управлению или несоответствие отображаемой информации реальному состоянию;
- неоднозначные режимы или отображение.
См. также таблицу D.1 приложения D для определенных недостатков проекта и соответствующих ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
Приложение D
(справочное)
Руководство по ПРОЦЕССАМ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
D.1 Введение в ПРОЦЕССЫ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
D.1.1 Общие положения
В настоящем приложении приведено вводное руководство по применению ПРОЦЕССОВ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, необходимых для соответствия требованиям к конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА при разработке МЕДИЦИНСКОГО ИЗДЕЛИЯ, включая аппаратное обеспечение, программное обеспечение и документирование. Данное приложение получено на основании [11].
Настоящее приложение не предусмотрено для использования в качестве единственного источника руководящих указаний по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ или для замены экспертизы ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Скорее оно предназначено для того, чтобы облегчить общее понимание того, как проводить работу по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ эффективным образом, основываясь в значительной степени на соответствующей документации (см. библиографию).
Настоящее приложение включает обзор ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (ПРОЕКТИРОВАНИЕ С УЧЕТОМ человеческого фактора), обсуждение пользы ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, анализ ПРОЦЕССОВ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и связанных с ними методов анализа и разработки. Приложение также включает список применимых документов и ссылки на литературу по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
В рамках данного приложения ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС включает все параметры МЕДИЦИНСКОГО ИЗДЕЛИЯ, с помощью которых ПОЛЬЗОВАТЕЛЬ взаимодействует с работающим МЕДИЦИНСКИМ ИЗДЕЛИЕМ. Эксплуатационная документация и маркировка МЕДИЦИНСКОГО ИЗДЕЛИЯ являются неотъемлемыми частями ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА. Считается, что ПОЛЬЗОВАТЕЛИ включают лиц, проводящих профилактические работы, очистку, и другой обслуживающий персонал, работающий с МЕДИЦИНСКИМ ИЗДЕЛИЕМ. ПОЛЬЗОВАТЕЛЕМ может быть лицо, осуществляющее уход (например, лицо, использующее дома аппарат для диализа), ПАЦИЕНТ (например, диабетики, измеряющие свой уровень глюкозы) или любое лицо, осуществляющее поддержку либо лица, осуществляющего уход, либо ПАЦИЕНТА (например, специалист по ультразвуковой диагностике). Лицом, осуществляющим уход, может быть обученный врач или неспециалист (например, член семьи).
Настоящее приложение затрагивает нужды различных групп профессионалов, проводящих планирование, финансирование, управление и выполняющих действия по исследованию, разработке и испытанию, касающиеся БЕЗОПАСНОСТИ и ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ, включая:
- менеджеров компании, отдела, проекта и продукта;
- профессионалов в области разработки и проектирования (например, инженеров по ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, промышленных дизайнеров, разработчиков документации, разработчиков информационного обеспечения, разработчиков программного обеспечения, механиков, электриков, разработчиков упаковки);
- исследователей в области медицины и других заинтересованных врачей;
- маркетологов и других бизнес-профессионалов в медицинской промышленности.
Следует отметить, что практики ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ сильно отличаются. Это различие частично обусловлено разнообразием их применения лицами, обладающими исходными данными в различных областях, таких как инженерия, психология или конструирование. Практики также различаются из-за большого разнообразия и сложности МЕДИЦИНСКИХ ИЗДЕЛИЙ, которые находятся в диапазоне от цифровых термометров до систем визуализации и могут использоваться в больницах, клиниках, дома и других областях различными профессионалами и неспециалистами.
Учитывая это, невозможно заранее описать единый набор методов ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, которые будут оптимальными для всех проектов. Вместо этого в настоящем стандарте изложен ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, который требует дальнейшего изменения формы и значений для конкретного исполнителя, опыта и философии разработки и исследований, а также спецификаций проекта. Основной задачей документа является обеспечение того, что ИЗГОТОВИТЕЛЬ использует разработку ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА точным и эффективным образом.
D.1.2 Польза ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Основной целью ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для МЕДИЦИНСКИХ ИЗДЕЛИЙ должно быть изготовление МЕДИЦИНСКОГО ИЗДЕЛИЯ более безопасным, эффективным и простым для использования. Существуют установленные средства и методы ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для анализа, разработки, испытания и оценки как простых, так и сложных систем. Эти методы успешно применяются в течение многих лет в таких различных областях, как потребительские товары, товары военного назначения, авиационные МЕДИЦИНСКИЕ ИЗДЕЛИЯ и системы атомной энергетики. Комплексная и структурированная программа ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может помочь разработчикам сделать их МЕДИЦИНСКОЕ ИЗДЕЛИЕ более безопасным и простым в использовании.
D.1.3 Избегание ошибок, связанных с конструкцией
Ошибки, связанные с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, обычно возникают из-за нескольких взаимосвязанных факторов. Отчеты о неблагоприятных событиях подтверждают, что МЕДИЦИНСКОЕ ИЗДЕЛИЕ само по себе часто способствует ошибкам использования, наиболее часто из-за недостатков конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА. В таблице D.1 приведены примеры недостатков конструкции и связанных с ними ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Оптимальная конструкция должна не только снижать вероятность ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, но также, если возникают ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, увеличивать вероятность их обнаружения и корректировки и увеличивать возможность смягчения их последствий.
Таблица D.1 - Примеры недостатков конструкции и связанных с ними ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ
Примеры недостатков конструкции | Возможные последовавшие ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ |
Кнопки на панели управления расположены слишком близко | ПОЛЬЗОВАТЕЛЬ нажимает неправильную кнопку |
Две иконки на экране программного обеспечения выглядят слишком похоже | ПОЛЬЗОВАТЕЛЬ неправильно интерпретирует иконку и выбирает неправильную функцию |
ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС требует сложной, длинной и нелогичной последовательности нажатия кнопок для начала инфузии | ПОЛЬЗОВАТЕЛЬ вводит некорректную последовательность и происходит отказ начала инфузии |
Инфузионный насос показывает вводящее в заблуждение сообщение "Откройте дверцу - Перезагрузите" при наличии воздуха в линии инфузии | ПОЛЬЗОВАТЕЛЬ повторяет открытие дверцы и нажатие кнопки перезагрузки вместо удаления воздуха из линии инфузии |
Слишком высокие и низкие ПРЕДЕЛЫ СРАБАТЫВАНИЯ СИГНАЛИЗАЦИИ на мониторе частоты сердечных сокращений, регулируемые ПОЛЬЗОВАТЕЛЕМ, не отображаются постоянно | ПОЛЬЗОВАТЕЛЬ не определяет опасное увеличение частоты сердечных сокращений, т. к. предел СРАБАТЫВАНИЯ СИГНАЛИЗАЦИИ установлен на слишком высокое значение и ПОЛЬЗОВАТЕЛЬ излишне доверяет СИСТЕМЕ СИГНАЛИЗАЦИИ |
Сила, прикладываемая типичным ПОЛЬЗОВАТЕЛЕМ, превышает силу разрушения соединителей катетеров | ПОЛЬЗОВАТЕЛЬ разламывает соединитель катетера при затягивании |
Систематическое применение принципов ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, подкрепленное испытаниями с участием ПОЛЬЗОВАТЕЛЕЙ, является эффективным средством обнаружения и устранения подобных недостатков конструкции. Например, соответствие установленным стандартам на конструкцию, определяющим минимальное расстояние между управляющими элементами, помогает устранить случайную активацию ПОЛЬЗОВАТЕЛЕМ элементов настройки. За счет понимания особенностей среды эксплуатации МЕДИЦИНСКОГО ИЗДЕЛИЯ после выезда на место, опроса на месте эксплуатации и испытаний ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (проведенных в лаборатории или на месте) можно избежать других недостатков конструкции, которые приводят к ОШИБКАМ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Наблюдения на месте, проведенные на ранних этапах ПРОЦЕССА разработки, могут обнаружить вероятные проблемы взаимодействия с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, например, вероятные некорректные, возможно опасные соединения трубок из-за совпадения по внешнему виду и форме. Испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ с использованием макета или модели МЕДИЦИНСКОГО ИЗДЕЛИЯ могут обнаружить вероятные некорректные соединения трубок из-за совпадения по внешнему виду и форме, неоправданно сложную последовательность входных параметров или неоднозначные сообщения.
D.1.4 Улучшение ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
ПОЛЬЗОВАТЕЛИ МЕДИЦИНСКИХ ИЗДЕЛИЙ (например, врачи, медсестры, терапевты, техники, ПАЦИЕНТЫ и обслуживающий персонал) считают ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ одной из наиболее важных характеристик МЕДИЦИНСКОГО ИЗДЕЛИЯ. Они понимают, что МЕДИЦИНСКОЕ ИЗДЕЛИЕ с хорошей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ, вероятно, снижает время, необходимое для обучения, и увеличивает производительность. Для МЕДИЦИНСКИХ ИЗДЕЛИЙ, предназначенных для применения ПАЦИЕНТОМ (например, домашние глюкометры для диабетиков), простота применения может в целом влиять на возможность применения ПАЦИЕНТОМ МЕДИЦИНСКОГО ИЗДЕЛИЯ. ИЗГОТОВИТЕЛЮ МЕДИЦИНСКОГО ИЗДЕЛИЯ требуется вкладывать большие инвестиции в необходимые источники улучшения ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. С точки зрения бизнеса возможная выгода от инвестиций в улучшение ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может включать:
- более быстрый выход на рынок (за счет избегания проблем с ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ в конце цикла разработки);
- более простое руководство ПОЛЬЗОВАТЕЛЯ и связанные с ним обучающие средства;
- улучшенный маркетинг за счет заслуживающих доверия заявлений об ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ и связанное с ним увеличение производительности;
- увеличение продаж (связанное с удовлетворенностью потребителей);
- снижение требований к обучению и поддержке;
- увеличенный срок службы на рынке;
- точное соответствие нормативным требованиям;
- снижение подверженности претензиям по качеству продукта;
- увеличение удовлетворенности ПОЛЬЗОВАТЕЛЯ.
D.2 Обзор ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
D.2.1 Общие положения
Независимо от того, разработан ли революционно новый продукт или внесены незначительные изменения в существующий продукт, связанный с ним ПРОЦЕСС ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ неизменно включает несколько специальных элементов и этапов ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. На рисунке D.1 отображены параметры проектирования МЕДИЦИНСКОГО ИЗДЕЛИЯ с учетом ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ как циклические этапы. Это не означает, что все проектные усилия требуют следования жестким, заранее описанным действиям по разработке. Напротив, специальные действия по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ на каждом этапе цикла (и соответствующие время, усилия и требуемые расходы) меняются для каждой разработки.
Примечание 1 - Входные данные ПОЛЬЗОВАТЕЛЯ обычно получают почти на каждом этапе цикла.
Примечание 2 - В таблице D.2 приведено соответствие элементов рисунка D.1 настоящему стандарту.
Рисунок D.1 - Цикл разработки ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
Таблица D.2 - Соответствие элементов рисунка D.1 подразделам настоящего стандарта
Элемент цикла разработки | Подраздел настоящего стандарта |
Исследование ПОЛЬЗОВАТЕЛЯ/Концептуальное проектирование | 5.1 Спецификация применения |
Требования и критерии разработки | 5.4 ОСНОВНАЯ РАБОЧАЯ ФУНКЦИЯ |
Детализация проекта и спецификация | 5.7 Разработка и реализация ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА |
Оценивание | 5.8 ВЕРИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ |
Для каждого этапа цикла команда по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ использует свидетельства, обоснования и опыт, определенные при соответствующих действиях и усилиях ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
Одни и те же средства и методы ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут быть успешно применены на различных этапах цикла ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Например, анализ задач, выполняемых ПОЛЬЗОВАТЕЛЕМ при взаимодействии с МЕДИЦИНСКИМ ИЗДЕЛИЕМ (т е. анализ задач), может быть одинаково применим при ранней концептуальной разработке МЕДИЦИНСКОГО ИЗДЕЛИЯ, при разработке требований/критериев к конкретному МЕДИЦИНСКОМУ ИЗДЕЛИЮ и при оценке полного функционального прототипа. Тем не менее тип применяемого анализа задач и методы, которыми он проводится, с большой степенью вероятности изменяются для обеспечения соответствия специальным целям ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ на каждом из этих этапов.
D.2.2 Итеративный характер цикла ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Те, кто знаком с системами проектирования, по достоинству оценят сходство между указанной циклической процедурой ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и другими типами ПРОЦЕССА или циклов разработки продукта. Основным принципом является то, что продукт на протяжении всего своего срока службы проходит много таких циклов. Что касается МЕДИЦИНСКИХ ИЗДЕЛИЙ, особенно если рассматривать не только действия по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, но и другие процедуры МЕНЕДЖМЕНТА РИСКА и управления проектированием, каждый этап цикла затрагивается по крайней мере один раз в любом ПРОЦЕССЕ разработки МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Кроме того, цикл ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, отображенный на рисунке D.1, подчеркивает итеративный характер ПРОЦЕССА разработки. Не только результаты (или выходные параметры) одного этапа загружаются (или служат входными параметрами) для следующего этапа, но и некоторые выходные данные этапов используются для предыдущих этапов. Например, при оценке МЕДИЦИНСКОГО ИЗДЕЛИЯ, вопросы, поднятые во время действий по ВЕРИФИКАЦИИ конструкции (т.е. при подтверждении того, что конструкция МЕДИЦИНСКОГО ИЗДЕЛИЯ соответствует предварительно определенным требованиям к конструкции), часто приводят к изменению конструкции. Аналогично вопросы, поднятые во время действий по ВАЛИДАЦИИ конструкции (т.е. при подтверждении того, что в МЕДИЦИНСКОМ ИЗДЕЛИИ адекватно учтены установленные нужды ПОЛЬЗОВАТЕЛЯ), могут также приводить к последующему изменению требований к конструкции или даже концепции МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Описание процедур ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ как пошаговый цикл может давать неверное представление, что разработка ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА всегда является последовательным ПРОЦЕССОМ. Фактически многие из этих действий обычно проводятся параллельно. Взаимодействие между этапами происходит часто, быстро и нередко без последствий. Например, при разработке программного обеспечения участники ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут пройти этапы разработки критериев/требований к конструкции (например, цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ), разработки МЕДИЦИНСКОГО ИЗДЕЛИЯ (например, быстрое создание прототипа) и ВЕРИФИКАЦИИ конструкции (например, испытание ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ) одновременно.
На рисунке D.1 предполагается, что цикл разработки обычно начинается с концептуальной разработки на основании данных о ПОЛЬЗОВАТЕЛЕ (взаимно соединенные этапы в правом верхнем углу). Независимо от того, рассматривается ли революционно новое МЕДИЦИНСКОЕ ИЗДЕЛИЕ или модификация существующего МЕДИЦИНСКОГО ИЗДЕЛИЯ, концептуальная разработка может быть основана не только на идеях или нуждах ПОЛЬЗОВАТЕЛЯ, но также предпринимательских идеях или даже новых технологиях, которые считается полезным применить. На практике тем не менее цикл ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может начинаться с любого этапа. Например, разработка нового, более выгодного ПРОЦЕССА производства может привести к предполагаемым изменениям конструкции МЕДИЦИНСКОГО ИЗДЕЛИЯ, что повлияет на разработку спецификации ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА. По этим причинам, вероятно, будет затронут каждый этап цикла ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, возможно некоторые этапы более подробно, чем остальные.
D.2.3 Исследование ПОЛЬЗОВАТЕЛЯ
Крайне важно учитывать ПОЛЬЗОВАТЕЛЕЙ на ранних этапах разработки МЕДИЦИНСКОГО ИЗДЕЛИЯ. Например, человек с ограниченными возможностями, использующий МЕДИЦИНСКОЕ ИЗДЕЛИЕ у себя дома, имеет специальные требования, которые можно полностью выяснить после тщательного исследования ПОЛЬЗОВАТЕЛЕЙ. Нужды ПОЛЬЗОВАТЕЛЕЙ должны быть основной движущей силой как при концептуальной разработке нового продукта, так и при улучшении существующего продукта.
Входные параметры ПОЛЬЗОВАТЕЛЯ могут быть получены различными путями, и ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ включает много структурных средств и методов результативного получения этой критической информации. Системный подход к разработке МЕДИЦИНСКОГО ИЗДЕЛИЯ, приведенный в настоящем стандарте, требует понимания того, как ПОЛЬЗОВАТЕЛЬ взаимодействует с МЕДИЦИНСКИМ ИЗДЕЛИЕМ в реальной среде применения.
Это понимание может быть получено только на основании входных данных и наблюдений за ПОЛЬЗОВАТЕЛЕМ. Формальное исследование ПОЛЬЗОВАТЕЛЯ в реальных или моделируемых условиях обычно является неотъемлемой частью ПРОЦЕССА разработки МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Исследовательская работа по изучению ПОЛЬЗОВАТЕЛЕЙ может быть включена в действия по исследованию рынка. Тем не менее исследования рынка часто фокусируются на более широком наборе вопросов, таких как выгода от альтернативного набора параметров, сравнительная стоимость и сервисное обслуживание. Кроме того, большинство действий, ориентированных на рынок, определяющих предпочтения ПОЛЬЗОВАТЕЛЕЙ (например, фокусных групп), не могут заменить разработанные соответствующим образом испытания и оценку ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Тем не менее маркетинговые группы могут содействовать в установлении связей между предполагаемыми ПОЛЬЗОВАТЕЛЯМИ, конструкторами и инженерами.
D.2.4 Концептуальная разработка конструкции (концептуальное проектирование)
Концепция МЕДИЦИНСКОГО ИЗДЕЛИЯ может быть получена различными путями. Наиболее часто определяются клинические нужды, и это приводит к разработке новых или изменению существующих МЕДИЦИНСКИХ ИЗДЕЛИЙ для соответствия этим нуждам. Во многих случаях определяется широкий спектр нужд и затем затрачиваются значительное время и усилия для разработки на основании этого концепции, которую можно развить в коммерчески выгодное МЕДИЦИНСКОЕ ИЗДЕЛИЕ.
Во время ранних этапов разработки важно определить нужды ПОЛЬЗОВАТЕЛЯ настолько четко и определенно, насколько возможно, что часто является сложной задачей. ПОЛЬЗОВАТЕЛИ могут с трудом объяснить свои потребности и иногда они действительно не знают, что им нужно. Результаты интервьюирования фокусных групп и ПОЛЬЗОВАТЕЛЕЙ могут быть ошибочными, заставляя конструкторов решать ошибочные проблемы и следовать пожеланиям, противоположным реальным нуждам. Следовательно, при ВАЛИДАЦИИ указанных нужд ПОЛЬЗОВАТЕЛЕЙ до разработки являются полезными другие методы оценки нужд, такие как наблюдение за использованием прототипных систем в рабочей среде.
D.2.5 Разработка требований/критериев к конструкции
Разработку требований/критериев к конструкции можно начать после четкого определения нужд ПОЛЬЗОВАТЕЛЕЙ и соответствующей концепции МЕДИЦИНСКОГО ИЗДЕЛИЯ. Требования/критерии конструкции определяют предполагаемые рабочие условия, характеристики ПОЛЬЗОВАТЕЛЯ, функции и вероятные ОПАСНЫЕ СИТУАЦИИ. Обычно требования/критерии конструкции, отражающие входные параметры для разработки, претерпевают существенные изменения и уточнения при доработке конструкции МЕДИЦИНСКОГО ИЗДЕЛИЯ, проходя путь от достаточно общих утверждений до сильно специфичных и технических требований.
Разработка требований/критериев конструкции требует качественного анализа того, насколько оптимально возможная конструкция решает рассматриваемые нужды ПОЛЬЗОВАТЕЛЯ, анализа технических и производственных ограничений и условий рынка. Команда по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ одновременно интерпретирует входные параметры ПОЛЬЗОВАТЕЛЯ, разрабатывает требования к ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и обеспечивает данные для других инженеров по влиянию ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ на конструктивное решение. Команда по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна играть ключевую роль при принятии решений, касающихся свойств и параметров ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
D.2.6 Детализация проекта и спецификация
Требования к конструкции на момент начала данного этапа обеспечивают достаточно деталей, чтобы позволить разработчикам аппаратного и программного обеспечения создать ожидаемый продукт. Также важно, что требования включают набор измеряемых испытательных критериев, которые можно использовать, чтобы убедиться, что конечный продукт соответствует предполагаемым нуждам ПОЛЬЗОВАТЕЛЯ. Таким образом, при проведении ПРОЦЕССА разработки жесткие заявления о параметрах ожидаемого МЕДИЦИНСКОГО ИЗДЕЛИЯ переводятся в инженерные спецификации или спецификации программного обеспечения, что позволяет реализовать эти параметры сначала в прототипе и обязательно - после оценивания конструкции - в конечном продукте. На протяжении данной процедуры команда по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна работать в тесном сотрудничестве с инженерами, промышленными конструкторами и разработчиками обучающих средств. См. таблицу D.3 на предмет примеров требований к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ.
Таблица D.3 - Примеры требований к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ
Категория | Пример |
Общие | Убедитесь, что дисплей, предназначенный только для чтения, визуально отличается от дисплея, позволяющего пользователю редактировать данные |
Текст только для чтения отображается в виде черного текста на белом фоне дисплея, в то время как текст, который можно редактировать, отображается как белый текст на черном фоне дисплея | |
Списки | Выбранный пункт в списке подсвечивается для обеспечения четкого отличия от других пунктов |
Дисплей списков содержит по крайней мере четыре варианта без необходимости прокручивания вверх или вниз | |
Все меню имеют заголовки | |
Меню | Пункты меню выровнены по левому краю |
Верхний левый угол экрана зарезервирован для индикатора выключения сигнализации | |
Дисплей | Яркость подсветки дисплея превышает 35 кд/м |
Управляющие устройства | Кнопки панели управления представляют собой квадрат со стороной 1,5 см, и расстояние между центрами кнопок составляет 2 см |
Клавиатура регулируется по высоте в диапазоне (измерения от пола) от 945 до 1190 мм |
Важной задачей членов команды по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ является применение технической информации по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для соответствующих вопросов, касающихся ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, которые неизбежно возникают при доработке конструкции. При выполнении этого участники ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ основываются на опубликованных исследованиях или собирают новые данные по возможностям, ограничениям и тенденциям в поведении человека как физическим (например, антропометрическим или биомеханическим), так и психическим (например, допуски ошибок, время реакции).
D.2.7 Оценивание конструкции
Только структурное оценивание готовой конструкции МЕДИЦИНСКОГО ИЗДЕЛИЯ может дать уверенность в том, что конструкция технически исправна, а также соответствует требованиям ПОЛЬЗОВАТЕЛЯ. Первую задачу, подтверждающую, что готовая конструкция соответствует входным требованиям, часто называют ВЕРИФИКАЦИЕЙ конструкции. Вторую задачу, подтверждающую, что готовая конструкция изделия соответствует нуждам ПОЛЬЗОВАТЕЛЯ и предполагаемому использованию, часто называют ВАЛИДАЦИЕЙ. Следовательно, все изменения конструкции проходят этап оценки конструкции для того, чтобы обеспечить выполнение требуемых действий по ВЕРИФИКАЦИИ и ВАЛИДАЦИИ. В сущности, ВЕРИФИКАЦИЯ и ВАЛИДАЦИЯ конструкции выполняют функцию приемочного контроля оптимальной конструкции.
Действия как по ВАЛИДАЦИИ, так и по ВЕРИФИКАЦИИ должны начинаться на ранних этапах цикла разработки. Например, АНАЛИЗ РИСКА первоначально должен проводиться при концептуальной разработке, повторяться (или уточняться) при проведении разработки и заканчиваться при ВАЛИДАЦИИ конструкции. Другие действия по ВАЛИДАЦИИ конструкции обычно требуют обязательного вовлечения ПОЛЬЗОВАТЕЛЯ.
Маркировка МЕДИЦИНСКОГО ИЗДЕЛИЯ и ЭКСПЛУАТАЦИОННАЯ ДОКУМЕНТАЦИЯ считаются частью МЕДИЦИНСКОГО ИЗДЕЛИЯ и поэтому должны подвергаться такой же жесткой оценке, как и другие элементы ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
D.2.8 Осуществление проекта и внедрение
Единственный этап цикла, который является не только частью разработки, это осуществление проекта и внедрение МЕДИЦИНСКОГО ИЗДЕЛИЯ. Этот этап включает производство, маркетинг, продажи, одобрение регулирующих органов и обучение ПОЛЬЗОВАТЕЛЕЙ. Передача проекта означает использование конечной спецификации для производства (и получения разрешения на продажу) МЕДИЦИНСКОГО ИЗДЕЛИЯ. Изменения проекта, возникшие после передачи проекта, отличающиеся от проектной спецификации, требуют повторного прохождения всего цикла разработки.
Оценка конструкции не прекращается после продажи МЕДИЦИНСКОГО ИЗДЕЛИЯ. Наблюдение за продукцией после выхода ее в обращение и отчеты по претензиям к качеству продукта представляют критические данные, касающиеся сильных и слабых сторон конструкции. Анализ этих отчетов, а также других типов отклика ПОЛЬЗОВАТЕЛЕЙ представляет данные, касающиеся всего цикла разработки МЕДИЦИНСКОГО ИЗДЕЛИЯ при ПРОЕКТИРОВАНИИ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Результатом этого является пересмотр конструкции МЕДИЦИНСКОГО ИЗДЕЛИЯ, а также идеи для новых МЕДИЦИНСКИХ ИЗДЕЛИЙ, учитывающие затронутые вопросы.
D.2.9 Исследование ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ на конкретном примере: общедоступные дефибрилляторы
D.2.9.1 Содержание исследования
Следующее исследование на конкретном примере общедоступного автоматического внешнего дефибриллятора (АВД) является примером выгоды от исследования ПОЛЬЗОВАТЕЛЯ, концептуального проектирования и оценивания устройства, разработанного для неквалифицированных ПОЛЬЗОВАТЕЛЕЙ.
D.2.9.2 Концептуальное проектирование и исследование ПОЛЬЗОВАТЕЛЯ
Несмотря на увеличение применения непрямого массажа сердца и сердечно-легочной реанимации, большинство людей, подвергшихся приступу аритмии, угрожающему жизни, вне клиники не выживают. Полагается, что ранняя дефибрилляция является ключевым вмешательством, способным повысить выживаемость. Таким образом, была разработана концепция общедоступного автоматического внешнего дефибриллятора (АВД).
При разработке АВД были использованы методы ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, такие как наблюдения с учетом условий применения, создание прототипов и анализ ошибок. Первые прототипы были разработаны с использованием наблюдений дефибрилляторов, используемых в условиях пожарных станций. Хранение и доступ были определены как ключевые моменты и были учтены как первая итерация в требованиях к конструкции.
D.2.9.3 Разработка критериев/требований к конструкции
Посредством исследований, персонал, проводящий ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, определил, что АВД должны быть легкими и портативными (размером с чемоданчик), простыми для применения при минимальном обучении и подходить для применения в общественных местах (самолеты, казино, отели и т.д.).
D.2.9.4 Оценивание проектного решения
Входные данные ПОЛЬЗОВАТЕЛЯ и наблюдения ранних прототипов обнаружили проблемы, такие как неверное размещение контактных площадок электродов и ненужную дефибрилляцию. Люди проводили реанимационные мероприятия с различными моделями и марками (поведенческое определение прототипов). Было обнаружено, что маркировка шагов 1-2-3 улучшает рабочие характеристики. Анализ ошибок привел к стратегии минимизации ошибок, таких как невключение МЕДИЦИНСКОГО ИЗДЕЛИЯ по забывчивости или неполное подсоединение электродов. Ожидается, что послепродажные исследования проданных МЕДИЦИНСКИХ ИЗДЕЛИЙ определят дальнейшие улучшения конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, учитывая наблюдаемые трудности.
D.2.9.5 Осуществление проекта и внедрение
С момента выпуска АВД в обращение десятки тысяч единиц изделий было куплено аэропортами, отделениями полиции, отелями, казино, школами и клиниками. Тем не менее около четверти покупателей - это физические лица, использующие их или имеющие их дома [13]. Двенадцатилетние дети могут использовать коммерческие АВД успешно примерно почти так же быстро, как персонал скорой помощи; 90 с для детей против 67 с для профессионально обученных взрослых [21]. Тем не менее некоторые АВД показали более простое и быстрое применение в конкретных условиях, т.к. разработчики следовали процедурам ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
D.3 Планирование ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
D.3.1 Обеспечение достаточной вовлеченности команды по разработке в ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Профессионалы в области ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны быть вовлечены в создание проекта с самого начала, хотя команда и ее роль может формироваться во время ПРОЦЕССА проектирования и разработки. В начале ПРОЦЕССА проектирования, когда определена начальная концепция, может быть определен и идентифицирован диапазон необходимого опыта ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и набран персонал. Усилия по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ меняются в зависимости от типа МЕДИЦИНСКОГО ИЗДЕЛИЯ, требований по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ от организационной структуры и культуры ИЗГОТОВИТЕЛЯ. В некоторых случаях команда по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может состоять из одного опытного практика, одновременно занятого в ряде проектов. В других случаях несколько участников ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ являются частью междисциплинарной команды по разработке. Участники ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут быть работниками организации или внешними консультантами. Некоторые участники ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ являются автономными, в то время как другие являются членами других отделов, таких как маркетинговый, инженерный, отдел промышленного дизайна или программного обеспечения.
Успех действий по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ требует уверенного руководства для поддержания принципов ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ во время разработки и для управления соответствующими усилиями по проектированию. В частности, должен быть признанный лидер по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, одобренный руководством и способный результативно сотрудничать с другими разработчиками по достижению улучшения ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
Кроме экспертов по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, команда по разработке обычно дополняется ранее вовлеченными лицами, которые:
- ответственны за разработку обучающих средств, которые встроены в МЕДИЦИНСКОЕ ИЗДЕЛИЕ или дополняют его, таких как встроенная справочная система, руководства ПОЛЬЗОВАТЕЛЯ и краткое руководство;
- ответственны за разработку обучающих курсов и материалов;
- могут создать (или руководить созданием) компьютерный прототип ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА;
- могут общаться с инженерами и разработчиками по техническим вопросам;
- могут эффективно общаться с соответствующей популяцией(ями) ПОЛЬЗОВАТЕЛЕЙ.
D.3.2 Изменение объема ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
D.3.2.1 Общее руководство
Аналогично другим элементам любых инженерных ПРОЦЕССОВ или процедур разработки, ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ допускает изменение объема. Во всех случаях целью является осуществление ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в достаточной мере и прослеживаемым образом так, чтобы конечный продукт имел достаточную БЕЗОПАСНОСТЬ и ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ.
Более активные действия по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут быть показаны, если:
- разрабатывается новое МЕДИЦИНСКОЕ ИЗДЕЛИЕ, а не вносятся незначительные изменения в существующую конструкцию;
- разрабатывается новое МЕДИЦИНСКОЕ ИЗДЕЛИЕ, требующее объемного или сложного взаимодействия с ПОЛЬЗОВАТЕЛЕМ в отличие от простого МЕДИЦИНСКОГО ИЗДЕЛИЯ, требующего простого взаимодействия с ПОЛЬЗОВАТЕЛЕМ;
- разрабатывается новое МЕДИЦИНСКОЕ ИЗДЕЛИЕ, реализующее критическую жизнеобеспечивающую функцию, в отличие от изделия, реализующего менее критическую функцию;
- вводится новая технология или метод, который не знаком ПОЛЬЗОВАТЕЛЯМ, в отличие от методов, для которых уже наработан опыт.
Наоборот, если продукт требует ограниченного взаимодействия с ПОЛЬЗОВАТЕЛЕМ, может потребоваться существенно меньшая работа по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. При начале работ по эволюционной разработке (т. е. изменению или улучшению существующего МЕДИЦИНСКОГО ИЗДЕЛИЯ) может быть целесообразным использование прошлых действий по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, например, результатов испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ или послепродажного наблюдения. Например, предположив, что не было сделано изменений в СИСТЕМЕ СИГНАЛИЗАЦИИ МЕДИЦИНСКОГО ИЗДЕЛИЯ, изменений в типе ПОЛЬЗОВАТЕЛЕЙ и сценариев использования, можно обоснованно ВЕРИФИЦИРОВАТЬ параметры нового МЕДИЦИНСКОГО ИЗДЕЛИЯ, сделав ссылку на прошлые работы по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (например, перед испытанием ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ). Тем не менее несравнимые изменения конструкции могут потребовать оценки ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Использование прошлых работ по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ применимо, однако следует взвешивать разницу между возможной экономией и дополнительными усилиями, которые необходимо приложить для обоснования и документирования решения.
Некоторые МЕДИЦИНСКИЕ ИЗДЕЛИЯ реализуют новую медицинскую функцию, комбинацию функций в отличие от уже существующих МЕДИЦИНСКИХ ИЗДЕЛИЙ или автоматическую в отличие от реализуемой ранее ручной функции. Внутренняя сложность нового МЕДИЦИНСКОГО ИЗДЕЛИЯ может потребовать относительно большего объема усилий по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Как правило, усилия по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для продуктов с новыми технологиями гораздо более объемные, чем усилия, необходимые для измененных МЕДИЦИНСКИХ ИЗДЕЛИЙ - от начальных исследований до создания концепции с использованием ВАЛИДАЦИИ. Также обычно существует относительно мало данных (например, о неблагоприятных событиях или информации об анализе РИСКА), на основании которых можно установить исходные условия.
Следующее исследование на конкретном примере показывает изменение объема ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
D.3.2.2 Исследование на конкретном примере: незначительные изменения относительно простого МЕДИЦИНСКОГО ИЗДЕЛИЯ с использованием известных технологий
Рассмотрим незначительные изменения конструкции шприцевого насоса с использованием известных технологий. В дополнение к обязательным задачам по созданию реальной конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, регулируемая программа ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может также включать следующие действия:
- проведение структурированного опроса (группового или индивидуального) с типичными ПОЛЬЗОВАТЕЛЯМИ, касающегося данного МЕДИЦИНСКОГО ИЗДЕЛИЯ ИЗГОТОВИТЕЛЯ, а также некоторых конкурирующих МЕДИЦИНСКИХ ИЗДЕЛИЙ;
- обзор отчетов о неблагоприятных событиях для обнаружения РИСКОВ, связанных с ОШИБКАМИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, и пересмотр анализа РИСКА. Затем следует убедиться, что предполагаемая конструкция учитывает эти ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ;
- применение установленных принципов/руководств по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в ПРОЦЕССЕ проектирования с последующим аудитом (проверкой) соответствия ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ;
- проведение испытаний ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ на более ранних прототипах (компьютерные или рабочие модели) для определения, соответствует ли прототип целям БЕЗОПАСНОСТИ и ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, и для обнаружения возможностей улучшения конструкции;
- проведение второго, сокращенного испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для ВАЛИДАЦИИ уточненной конструкции, приближенной к конечной.
Следует обратить внимание, что основным мотивом этих действий является раннее и непрерывное вовлечение типичных ПОЛЬЗОВАТЕЛЕЙ, хотя реальное число вовлеченных ПОЛЬЗОВАТЕЛЕЙ может быть ограничено, по крайней мере, в случае относительно простого устройства. Также следует отметить, что МЕДИЦИНСКОЕ ИЗДЕЛИЕ, такое как шприцевой насос, может быть менее сложным по параметрам его электромеханической работы, чем система введения контрастного вещества (см. D.3.2.3). Тем не менее некоторые взаимодействия ПОЛЬЗОВАТЕЛЯ со шприцевым насосом в реальности могут быть более сложными в соответствии с такими показателями, как число этапов и когнитивные ПРОЦЕССЫ, тем самым представляя более высокий РИСК ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. В таких случаях могут потребоваться несколько более активные действия по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, чем описанные выше.
D.3.2.3 Исследование на конкретном примере: начальная разработка сложного МЕДИЦИНСКОГО ИЗДЕЛИЯ, включающая новые технологии
Рассмотрим разработку системы введения контрастного вещества для компьютерной томографии. Такие системы содержат инжектор, который механически проводит поршень по шприцу, одноразовый шприц, устройство заполнения шприца конкретным веществом и электронный экран для управления и контроля введения.
Разработка такой системы может включать следующие этапы:
- выполнение действий по тщательной разработке требований, включая соответствующие исследования (например, анализ задач) рабочих характеристик МЕДИЦИНСКОГО ИЗДЕЛИЯ, популяции ПОЛЬЗОВАТЕЛЕЙ, рабочей среды, параметров надежности и БЕЗОПАСНОСТИ. Лица из популяции, определенной в предполагаемом использовании (техники, ПАЦИЕНТЫ и врачи), должны быть вовлечены в данную деятельность, а также во все последующие испытания. Если возможно, опросы и наблюдения следует проводить в предполагаемой среде использования. Также необходимо учитывать взаимосвязь с другими МЕДИЦИНСКИМИ ИЗДЕЛИЯМИ. На данном этапе участники или команда по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна иметь подробную спецификацию требований к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ и предварительный пошаговый план процедур, которые необходимо осуществить;
- определение распределения функций между ПОЛЬЗОВАТЕЛЕМ и МЕДИЦИНСКИМ ИЗДЕЛИЕМ для проверки того, что разделение на ручные и автоматические задачи соответствует как возможностям человека, так и возможностям машины. В примере инъекционной системы важно определить, какие параметры введения будут автоматическими, где необходимо ручное управление, какой тип ответной реакции требуется ПОЛЬЗОВАТЕЛЮ на каждом этапе ПРОЦЕССА и т.д. Результатом может быть список функций, снабженный спецификацией того, как контролируется каждая функция, и какой тип информации предоставляется на каждом этапе различных ПРОЦЕССОВ;
- проведение полного анализа РИСКА, который включает ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ и разработку конструктивных решений для предотвращения или смягчения определенных РИСКОВ. Разумно предположить, что каждая возможная ошибка применения будет совершена неким ПОЛЬЗОВАТЕЛЕМ в некий момент времени. Этот анализ должен дополняться на протяжении ПРОЦЕССА разработки;
- проведение полномасштабных действий по проектированию и разработке с использованием методов проектирования и анализа, описанных в D.5. Они включают моделирование, проведение анализа задач, создание прототипов и проведение испытаний ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Использование итеративного проектирования и моделирования может предотвратить дорогостоящее усовершенствование в дальнейшем. Для исследования альтернативных концепций конструкции при проведении работ по определению концепции и на начальном этапе разработки обычно используются приблизительные модели. При дальнейшей разработке экономически целесообразно использование прототипов повышенного качества для оценивания конструкции;
- в данном примере инъекционной системы можно изначально провести моделирование ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА со статическим экраном и упрощенной физической моделью инжектора и шприцев. Оценка на ранних этапах может включать гипотетическую отработку с ПОЛЬЗОВАТЕЛЕМ в среде, определенной для предполагаемого применения. Тем не менее после уточнения конструкции различных компонентов и создания более реалистичных прототипов исследования с целью ВЕРИФИКАЦИИ должны развиваться в сторону более реальных испытаний ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. На данном этапе технику может быть дано задание выполнить ряд задач на сенсорном экране прототипа и/или рабочей модели инжектора. Результаты всех оценок должны быть включены в следующую итерацию разработки, так, чтобы были устранены эти ошибки и ПОЛЬЗОВАТЕЛЯМ требовалось меньше инструкций;
- компьютерные прототипы особенно полезны при испытании альтернативных конструкций ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА до изготовления рабочих моделей. Обычно предпочитают использовать средства быстрого создания прототипов для улучшения программного обеспечения ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА. Чем быстрее прототип может быть создан и изменен, тем вероятнее, что результаты испытания ПОЛЬЗОВАТЕЛЕМ окажут реальное влияние на конструкцию устройства;
- если доступен высококачественный прототип или ранняя производственная модель, проводят испытания с целью ВАЛИДАЦИИ для проверки того, что МЕДИЦИНСКОЕ ИЗДЕЛИЕ соответствует нуждам ПОЛЬЗОВАТЕЛЕЙ и ПАЦИЕНТОВ. На данном этапе ПОЛЬЗОВАТЕЛИ должны быть способны безопасно и эффективно выполнить каждый требуемый шаг: заполнение одноразового шприца, помещение его в инжектор, выбор протокола введения на экране блока управления, активация и контроль введения и т.д.
D.3.3 Документирование действий по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Документация ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должна четко устанавливать требования, которым необходимо следовать, и быть написана на языке и с использованием стиля, наиболее соответствующих спецификации конечных ПОЛЬЗОВАТЕЛЕЙ, которыми часто являются инженеры и разработчики программного обеспечения.
ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должно быть включено в соответствующие ПРОЦЕССЫ управления проектированием и учитываться в рамках спецификации, проектирования, документирования и МЕНЕДЖМЕНТА РИСКА, если применимо. Документация должна создаваться и поддерживаться в соответствии с применимыми стандартами, такими как ИСО 13485 [8] и ИСО 14971.
В начале проектирования должен быть разработан и задокументирован план ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. План должен дополняться по мере необходимости на протяжении проектирования. Типичный план ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ может включать:
- область применения;
- фундаментальный подход к разработке ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА;
- планируемый анализ и исследования при проектировании С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ;
- ПРОЦЕСС проектирования ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА и планируемое использование средств и методов ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (например, исследования с использованием наблюдений, испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, анализ проекта);
- использование национальных, международных или корпоративных стандартов и руководящих принципов для интерфейса человек-машина (например, ANSI/AAMI НЕ 48 [10]);
- метод отслеживания и решения вопросов ПРИ ПРОЕКТИРОВАНИИ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ;
- результаты ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (см. таблицу D.4);
- график и этапы;
- персонал и требуемые ресурсы.
Таблица D.4 - Типичные результаты
Компонент управления разработкой | Этап ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Примеры результатов |
Концептуальное проектирование | Исследование ПОЛЬЗОВАТЕЛЯ | ПРОФИЛЬ ПОЛЬЗОВАТЕЛЯ, анализ задач, описание среды применения. |
Разработка концепции конструкции | Требования (цели) ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. | |
Входные данные для проектирования | Разработка критериев/требований к конструкции | Анализ ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ |
Компонент управления разработкой | Этап ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Примеры результатов |
Выходные данные проектирования | Проект МЕДИЦИНСКОГО ИЗДЕЛИЯ/уточнение | Модели ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, спецификации конструкций прототипов ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА |
План ВАЛИДАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | ||
ВЕРИФИКАЦИЯ и ВАЛИДАЦИЯ проекта | Оценивание конструкции | Отчет об испытаниях ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ |
Разработка и внедрение МЕДИЦИНСКОГО ИЗДЕЛИЯ | Входные параметры для необходимых изменений конструкции, полученные при ПРОЕКТИРОВАНИИ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ |
D.4 Процедуры ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
D.4.1 Системный подход
D.4.1.1 Введение
В процедурах ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ подразумевается, что каждое МЕДИЦИНСКОЕ ИЗДЕЛИЕ является элементом большого комплекса. Как минимум этот комплекс включает физическую среду, в которой используется МЕДИЦИНСКОЕ ИЗДЕЛИЕ, ПОЛЬЗОВАТЕЛЕЙ (т. е. врачей, медсестер, терапевтов или техников, которые управляют работой устройствами или функциями машины), ПАЦИЕНТА и другие МЕДИЦИНСКИЕ ИЗДЕЛИЯ. Полное понимание комплекса, частью которого является МЕДИЦИНСКОЕ ИЗДЕЛИЕ, важно для ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Взаимосвязи между элементами, рассматриваемые в начале ПРОЦЕССА проектирования, важны для планирования последующих действий по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, особенно для оценивания конструкции.
В начале ПРОЦЕССА ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны быть определены различные элементы комплекса, которые будут учтены при разработке. Более широкое определение комплекса приводит к производству МЕДИЦИНСКОГО ИЗДЕЛИЯ, которое лучше удовлетворяет реальные нужды. Также более широкое описание более вероятно приведет к созданию МЕДИЦИНСКОГО ИЗДЕЛИЯ, которое является революционным, а не эволюционным. Тем не менее для многих разрабатываемых проектов широкое определение может быть непрактичным или не является необходимым.
По сути ПРОЦЕСС ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ является ПРОЦЕССОМ, ориентированным на ПОЛЬЗОВАТЕЛЯ. То есть это обусловлено реальными нуждами ПОЛЬЗОВАТЕЛЕЙ и основано на предположении, что ПОЛЬЗОВАТЕЛЬ является критичным элементом системы. Как минимум исследования должны оценивать, как люди применяют или могут применять МЕДИЦИНСКОЕ ИЗДЕЛИЕ в определенных клинических условиях, включая традиционные условия ухода, такие как кабинет врача или отделение неотложной помощи, включая машины скорой помощи, городской транспорт и, например, людей в домашних условиях. Исследования должны оценивать предполагаемую среду применения, например когда лечение проводит лицо, осуществляющее уход, когда МЕДИЦИНСКОЕ ИЗДЕЛИЕ обслуживается, когда обслуживающий персонал взаимодействует с МЕДИЦИНСКИМ ИЗДЕЛИЕМ (например, при перевозке в лифте) или когда ПАЦИЕНТ использует МЕДИЦИНСКОЕ ИЗДЕЛИЕ.
Должны быть проведены согласованные действия для рассмотрения множества областей применения, насколько это возможно. Важно учитывать диапазон областей применения, которые можно встретить на протяжении срока службы продукта. Учитывая дополнительные области применения, ИЗГОТОВИТЕЛЬ может снизить необходимость дорогой повторной разработки, увеличить конкурентоспособность и достичь существенной долгосрочной экономии. Например, многие МЕДИЦИНСКИЕ ИЗДЕЛИЯ, разработанные для применения в условиях клиник, в настоящее время также используются дома, часто без ведома ИЗГОТОВИТЕЛЯ или при отсутствии его намерений. Если МЕДИЦИНСКОЕ ИЗДЕЛИЕ применяется таким образом, что его использование выходит за область применения исходной конструкции, БЕЗОПАСНОСТЬ и ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ могут серьезно пострадать.
D.4.1.2 Исследование при проектировании С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
D.4.1.2.1 Обзор
Исследование при проектировании С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ - это метод разработки требований 5.1, который обычно рассматривает один или более из следующих вопросов.
D.4.1.2.2 Функция
Какую функцию(и) выполняет МЕДИЦИНСКОЕ ИЗДЕЛИЕ (например, каким образом данное МЕДИЦИНСКОЕ ИЗДЕЛИЕ расширяет возможности лица, осуществляющего уход, при уходе за ПАЦИЕНТОМ)?
D.4.1.2.3 ПОЛЬЗОВАТЕЛИ
Кто будет использовать МЕДИЦИНСКОЕ ИЗДЕЛИЕ и/или его данные (как напрямую, так и не напрямую)? Этот пункт включает культурные, социологические характеристики потенциальных ПОЛЬЗОВАТЕЛЕЙ, а также характеристики образования и опыта. Если МЕДИЦИНСКОЕ ИЗДЕЛИЕ используется командой ПОЛЬЗОВАТЕЛЕЙ, вопросы включают влияние на работу и обучение команды.
D.4.1.2.4 Контекст применения
В какой клинической среде применения будет применяться МЕДИЦИНСКОЕ ИЗДЕЛИЕ? Каковы характеристики каждой возможной среды применения (например, дом, центр неотложной помощи, общая больничная палата, операционная и т.д.)? Какие другие МЕДИЦИНСКИЕ ИЗДЕЛИЯ обычно используются в данной клинической среде и как применение данного МЕДИЦИНСКОГО ИЗДЕЛИЯ может повлиять на использование других МЕДИЦИНСКИХ ИЗДЕЛИЙ? См. также обоснование 5.3.2.
D.4.1.2.5 Рабочая нагрузка
Какие психические и/или физические усилия связаны с использованием МЕДИЦИНСКОГО ИЗДЕЛИЯ?
D.4.1.2.6 БЕЗОПАСНОСТЬ
Какие параметры МЕДИЦИНСКОГО ИЗДЕЛИЯ могут поставить под угрозу БЕЗОПАСНОСТЬ применения? Какие другие элементы в рамках системы влияют на БЕЗОПАСНОСТЬ?
D.4.1.2.7 Правильное применение и ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ
Какие параметры МЕДИЦИНСКОГО ИЗДЕЛИЯ предупреждают ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, дают руководящие указания и позволяют просто и безопасно проводить корректировку, если возникает ошибка применения?
D.4.2 Практический пример: инфузионный насос
Инфузионный насос регулирует объем и скорость жидких лекарств, доставляемых ПАЦИЕНТУ, и предупреждает лицо, осуществляющее процедуру, о событиях или проблемах при проведении процедуры. В зависимости от того, где очерчены границы системы, другие элементы системы могут включать лиц, осуществляющих уход, использующих МЕДИЦИНСКОЕ ИЗДЕЛИЕ, ПАЦИЕНТОВ, посетителей ПАЦИЕНТОВ, других ПАЦИЕНТОВ, связанные МЕДИЦИНСКИЕ ИЗДЕЛИЯ (например, наборы трубок), другие МЕДИЦИНСКИЕ ИЗДЕЛИЯ, такие как физиологические мониторы ПАЦИЕНТА и физическую среду (если это соответствует конструкции МЕДИЦИНСКОГО ИЗДЕЛИЯ с учетом таких вопросов, как освещенность или уровень шума). Если разрабатывается эволюционный инфузионный насос (например, с измененным управлением, дисплеями или функциями), такое широкое определение системы может быть непрактичным и не являться необходимым. Тем не менее МЕДИЦИНСКОЕ ИЗДЕЛИЕ, которое будет революционным среди систем доставки жидких лекарств в клиниках, потребует полного исследования всех элементов системы, которые могут включать больничную фармацевтическую практику, маркировку лекарств и даже методы распределения лекарств.
По этим причинам границы системы могут включать предписание врача, фармацевтов, операторов, другой персонал клиники (например, ассистентов, биоинженеров, обслуживающий персонал, техников), больничные административные процедуры, социальную и культурную среду людей в системе, и культурную среду клиники. Могут быть включены другие ИЗГОТОВИТЕЛИ МЕДИЦИНСКИХ ИЗДЕЛИЙ и предоставляемые ими услуги, посетители ПАЦИЕНТОВ и ИЗГОТОВИТЕЛИ лекарств, т. к. их продукты и действия могут оказать влияние на элементы системы или определяют их.
D.4.3 Исследование ПОЛЬЗОВАТЕЛЯ
D.4.3.1 Входные параметры ПОЛЬЗОВАТЕЛЯ
Входные параметры ПОЛЬЗОВАТЕЛЯ являются частью итеративного ПРОЦЕССА, который начинается на ранних этапах разработки и совершенствуется на протяжении всего цикла разработки. Рассмотрение входных параметров ПОЛЬЗОВАТЕЛЯ в начале ПРОЦЕССА разработки может предотвратить дорогостоящие ошибки проектирования. Степень вовлечения ПОЛЬЗОВАТЕЛЯ должна включать ПОЛЬЗОВАТЕЛЕЙ и обслуживающий персонал, если необходимо. Субъективные данные ПОЛЬЗОВАТЕЛЯ должны включать его идеи по параметрам и оформлению, а также представления о том, как можно сделать МЕДИЦИНСКОЕ ИЗДЕЛИЕ более безопасным, эффективным и с большей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ. Следует выявлять как положительные, так и отрицательные мнения о МЕДИЦИНСКОМ ИЗДЕЛИИ. Объективные данные обычно лучше, чем единичные мнения, т.к. они облегчают дальнейшие испытания, проверку улучшенной конструкции. Примерами объективных (т.е. измеряемых) входных параметров ПОЛЬЗОВАТЕЛЯ служат проблемы ПОЛЬЗОВАТЕЛЯ при работе, вопросы, определенные специалистами по эксплуатации или персоналом по обслуживанию клиентов, зафиксированные случаи ошибок и результаты лабораторных испытаний параметров работы ПОЛЬЗОВАТЕЛЯ.
Точное понимание характеристик, возможностей, нужд и предпочтений ПОЛЬЗОВАТЕЛЕЙ является ключевым при разработке более безопасного и эффективного использования. Существует много путей сбора данной информации, включая:
- сбор информации и мнений, касающихся ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА;
- ненавязчивое наблюдение за людьми, выполняющими соответствующие задачи, связанные с МЕДИЦИНСКИМ ИЗДЕЛИЕМ или использованием аналогичного МЕДИЦИНСКОГО ИЗДЕЛИЯ;
- обсуждение вопросов, касающихся конструкции, с малой группой ПОЛЬЗОВАТЕЛЕЙ с целью формирования идей или достижения согласия;
- проведение формальных исследований ПОЛЬЗОВАТЕЛЕЙ, выполняющих соответствующие задачи в реальных или моделируемых условиях;
- обзор технической информации по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ.
D.4.3.2 Отбор ПОЛЬЗОВАТЕЛЕЙ
Действия по исследованию ПОЛЬЗОВАТЕЛЕЙ должны вовлекать людей, которые точно представляют популяцию ПОЛЬЗОВАТЕЛЕЙ. Например, группа разработчиков, изменяющая существующий аппарат искусственной вентиляции легких, может собрать входные параметры для разработки у медсестер, пульмонологов и врачей, лечащих ПАЦИЕНТОВ на искусственной вентиляции легких. Популяция ПОЛЬЗОВАТЕЛЕЙ обычно изменчива по многим направлениям, таким как возраст, пол, физические возможности, опыт, ожидания, а также социальный статус и географическое положение. Следовательно, применяя соответствующие стратегии отбора, результаты для данной популяции, вероятно, можно будет обобщить на популяцию(и) конечных ПОЛЬЗОВАТЕЛЕЙ. Соответствующее число субъектов зависит от исследования, а также разнородности популяции ПОЛЬЗОВАТЕЛЕЙ, сложности рассматриваемых параметров и ожидаемого уровня достоверности выводов.
D.4.3.3 Протоколы исследования и информированное согласие
Цели исследования ПОЛЬЗОВАТЕЛЕЙ обуславливают методы исследования. Исследование ПОЛЬЗОВАТЕЛЕЙ может представлять объемные процедуры сбора информации, целевой мозговой штурм, проблемно ориентированные совещания по данной проблеме или подходы, основанные на более жестких гипотезах. Независимо от подхода, использование письменных форм или других структурированных руководящих документов обеспечивает единообразие процедур и увеличивает качество итоговых данных. Протокол исследования обычно является желательным, а в некоторых случаях требуется нормативно. В протоколе обычно приведено обоснование исследования, характер популяции субъектов, используемые методы и как анализируются и интерпретируются полученные данные.
Должно быть получено согласие субъекта, если существуют какие-либо риски, если исследования занимают существенное время или другим образом приводят к неудобствам субъекта, или если результаты могут появиться в публикациях сравнительных исследований.
D.4.4 Разработка требований/критериев к проектированию
Анализ выходных параметров ПОЛЬЗОВАТЕЛЯ, наблюдения и исследования могут установить нужды ПОЛЬЗОВАТЕЛЯ. Мало того, что точная оценка нужд критична для успешной разработки критериев/требований к конструкции, но в конечном итоге она влияет на коммерческий успех. Установление требований к конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА помогает поместить соображения ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ на один уровень с другими инженерными соображениями, т.к. зафиксированные цели имеют большее значение. Кроме того, они помогают сфокусировать процедуры разработки, облегчают согласование с другими соображениями, касающимися конструкции (например, механические, электрические инженерные требования и требования к программному обеспечению), и помогают устанавливать критерии приемлемости конструкции.
В начале требования к конструкции могут быть представлены в виде широких и общих утверждений, но с усовершенствованием конструкции, требования становятся более подробными и специфичными. Итеративное уточнение требований к конструкции позволяет оценивать конструкцию. Некоторые требования могут быть выражены как цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, как простота использования и легкость изучения (см. таблицы D.5 и D.6), в то время как другие могут учитывать более подробные компоненты конструкции, такие как яркость дисплея, портативность или долговечность. Ниже приведены примеры подробных требований к конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА:
- дисплей должен быть виден на расстоянии 1 м трем людям, стоящим бок о бок, так, что все могут распознать цвета и прочитать текст;
- МЕДИЦИНСКОЕ ИЗДЕЛИЕ не должно иметь кромок, углов или выступов, цепляющихся за одежду при его использовании;
- МЕДИЦИНСКОЕ ИЗДЕЛИЕ должно быть способно производить звуковой АВАРИЙНЫЙ СИГНАЛ с уровнем звукового давления, регулирующимся в диапазоне 45-80 дБ, измеренным на расстоянии 1 м перед МЕДИЦИНСКИМ ИЗДЕЛИЕМ;
- стилус (указатель) должен активировать программное обеспечение для управления на экране при использовании под углом между 20° и 90°.
Таблица D.5 - Примеры объективных целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Объективные цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ |
80% ПОЛЬЗОВАТЕЛЕЙ должны успешно калибровать МЕДИЦИНСКОЕ ИЗДЕЛИЕ в течение 5 мин с первой попытки |
После прочтения краткого руководства 90% ПОЛЬЗОВАТЕЛЕЙ должны быть способны задать параметры дисплея так, чтобы он корректно отображал две кривые ЭКГ с первой попытки |
Таблица D.6 - Примеры субъективных целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Субъективные цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ |
Две трети ПОЛЬЗОВАТЕЛЕЙ должны предпочитать следующее поколение инфузионных насосов существующему при программировании инфузии в один канал |
В среднем 80% ПОЛЬЗОВАТЕЛЕЙ должны оценивать дисплей монитора как 5 или лучше по шкале от 1 (очень сложный для считывания) до 7 (очень простой для считывания) |
Требования к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ обязательно выражаются в виде подробной спецификации конструкции, которая может включать субъективные и объективные рабочие параметры (см. таблицу D.3). Подробные требования к ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны быть измеримыми и основываться на параметрах, которые важны для ПОЛЬЗОВАТЕЛЕЙ и БЕЗОПАСНОСТИ. Для того чтобы требования были реалистичными и надежными, рабочие критерии должны быть основаны на результатах испытания контрольных показателей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ сравнимых продуктов, подробной оценке, основанной на экспериментах, или рабочих гипотезах. Тем не менее требования, основанные на оценках или гипотезах, изменяются соответствующим образом при проведении итеративной разработки и оценивания, а также принимая во внимание реальные нужды ПОЛЬЗОВАТЕЛЕЙ в окружающей среде, определенной для предназначенного применения.
D.4.5 Проектирование МЕДИЦИНСКОГО ИЗДЕЛИЯ
D.4.5.1 Общее руководство
Не существует единственного лучшего метода перехода от разработки требований к конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА к получению эффективного проектного решения. Многое зависит от возможностей проектировщика или проектной группы, а также от типа МЕДИЦИНСКОГО ИЗДЕЛИЯ. Кроме того, проект ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА содержит творческий аспект, который невозможно четко определить и контролировать.
Во время этапа разработки могут потребоваться исследования для принятия информированного решения по поводу отдельных элементов конструкции. Например, может быть необходимо сравнить устройства позиционирования курсора для выбора лучшего для использования совместно с ультразвуковой рабочей станцией. Другим примером является проведение исследований с целью сравнения рукояток хирургических инструментов для определения наиболее удобной или позволяющей осуществлять более точное движение.
D.4.5.2 Структурирование методов проектирования
Эффективные проектные группы следуют структурированным методам. Элементы, типичные для данных методов, включают:
- Рассмотрение нескольких альтернативных конструкций. Например, проектная группа может начать с десятка или более принципиальных схем конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, выбрать около пяти концепций для более детального рассмотрения и провести моделирование двух или трех концепций перед тем, как прийти к конечной, предпочтительной конструкции. Начальное рассмотрение нескольких альтернативных конструкций, включая некоторые, считающиеся достаточно радикальными, является ключевым для инноваций, особенно при разработке МЕДИЦИНСКИХ ИЗДЕЛИЙ следующего поколения.
- Разработку простой концептуальной модели элементов ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА и взаимодействия с ПОЛЬЗОВАТЕЛЬСКИМ ИНТЕРФЕЙСОМ. Такие модели дают разработчикам принципиальные точки сравнения, которые помогают ограничить сложность конструкции. Например, на рисунке D.2 показано, как может быть смоделирован ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС при таком высочайшем уровне, как пять основных элементов, включающих три основные функции, систему меню и набор быстрых действий.
Рисунок D.2 - Пузырьковая диаграмма концептуальной модели физиологического монитора
- Применение установленных принципов и методов разработки с ориентацией на будущее (см. ANSI/AAMI YT 48 [10]), если применимо. Предотвратить недостатки конструкции проще и практичнее, чем исправлять недостатки, которые не были обнаружены при ретроспективном анализе конструкции.
- Рассмотрение частоты, актуальности и критичности задач как основы для распределения задач на ручные/машинные и задач аппаратного/программного обеспечения, а также принятие решения об организации и внешнем виде дисплеев и управляющих элементов. Эти решения требуют полного понимания того, как реально будет использоваться МЕДИЦИНСКОЕ ИЗДЕЛИЕ.
- Приведение коэффициентов значимости качества ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА при согласовании с другими инженерными целями.
- Создание модели ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА (см. D.5.4.3) как интерактивного прототипа для возможности проведения реалистичных испытаний ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и других оценок, вовлекающих ПОЛЬЗОВАТЕЛЕЙ.
- Использование итеративных испытаний для выбора предпочтительной концепции конструкции и ее последующего уточнения.
- Вовлечение ПОЛЬЗОВАТЕЛЕЙ на протяжении всего ПРОЦЕССА разработки.
D.4.5.3 Моделирование ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
Очень важно моделировать ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС с различными уровнями достоверности постепенно во время этапов проектирования (см. таблицу D.7).
Таблица D.7 - Примеры методов моделирования ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
Метод | Описание |
Пузырьковая диаграмма | Иллюстрация концептуальной модели ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА с пузырьками, представляющими функции МЕДИЦИНСКОГО ИЗДЕЛИЯ, и соединяющими линиями, иллюстрирующими взаимосвязи |
Блок-модель | Упрощенная физическая модель с низкой стоимостью, обычно выполненная из однородного материала (например, пенопласт с высокой плотностью), с небольшим числом деталей |
Модель внешнего вида | Нефункциональная физическая модель МЕДИЦИНСКОГО ИЗДЕЛИЯ, которая выглядит и ощущается как настоящая |
Раскадровка | Набор распечаток экрана, иллюстрирующий один или более сценариев использования |
Прототип ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА | Функциональная компьютерная модель ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, позволяющая характерным ПОЛЬЗОВАТЕЛЯМ выполнять практические задачи |
Рабочая модель | Функциональная физическая модель продукта, которая может соответствовать или не соответствовать конечной конструкции, которая позволяет типичным ПОЛЬЗОВАТЕЛЯМ выполнять практические прикладные задачи |
Прототип МЕДИЦИНСКОГО ИЗДЕЛИЯ | Рабочая версия МЕДИЦИНСКОГО ИЗДЕЛИЯ, приближенная к конечной, которая может использоваться для предполагаемого применения |
Модели должны быть созданы в начале и в течение всего ПРОЦЕССА проектирования как основа для сбора откликов ПОЛЬЗОВАТЕЛЕЙ и оценки успешности проектирования. В начале ПРОЦЕССА разработки обычно достаточно эскизов, простых блок-моделей, компьютерного представления или интерактивной модели низкого качества (также называемых прототипами). Далее в ПРОЦЕССЕ разработки может быть необходимо работать с уточненными представлениями, моделями внешнего вида или рабочими моделями и компьютерными моделями высокого качества.
При моделировании программного обеспечения ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА полезно начинать с плана испытаний ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, который определяет, наравне с другими факторами, тип ожидаемой реакции ПОЛЬЗОВАТЕЛЯ (см. таблицу D.8). Например, может быть наиболее интересно, насколько хорошо будущий ПОЛЬЗОВАТЕЛЬ выполняет ряд неотложных или частых задач. В данном случае может быть наиболее выгодно создать частичный функциональный прототип, который позволяет ПОЛЬЗОВАТЕЛЯМ выполнять только те задачи, которые представляют интерес.
Таблица D.8 - Характеристики типичных испытаний ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Содержание плана испытания | Организация работы | Действия | Данные |
Цель. | Испытательная комната (лаборатория). | Ориентирование. | Время выполнения задач. |
Оценка комбинированных МЕДИЦИНСКИХ ИЗДЕЛИЙ, имеющих как компоненты аппаратного, так и программного обеспечения, может потребовать создания физической модели внешнего вида (т.е. реалистично выглядящей трехмерной модели МЕДИЦИНСКОГО ИЗДЕЛИЯ), а также интерактивной компьютерной модели.
D.4.6 Спецификация проекта
D.4.6.1 Общее руководство
Полная и подробная спецификация ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА помогает обеспечивать качество ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА за счет снижения вероятности того, что члены команды по разработке неправильно интерпретируют требования к проекту. Спецификация ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА должна контролироваться и регулироваться так же тщательно, как и другие виды инженерных спецификаций.
Команда по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ проводит тщательный анализ предлагаемых изменений конструкции, связанных с ограничениями проектирования и производства, для определения их потенциального влияния на ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ и БЕЗОПАСНОСТЬ. Если возникают существенные вопросы, касающиеся ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, соответствующие лица, ответственные за принятие решений, должны откровенно обсудить эти вопросы и прийти к согласию перед тем, как будут сделаны любые изменения.
Все более широко применяется дополнение традиционных письменных спецификаций физическим моделированием ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, такого как модели внешнего вида и/или компьютерные модели. МЕДИЦИНСКИЕ ИЗДЕЛИЯ, управляемые микропроцессорами, особенно нуждаются в использовании функциональных прототипов. В данном случае интерактивная реализация МЕДИЦИНСКОГО ИЗДЕЛИЯ может включать как компьютерную модель ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, использующего экран, так и физические детали ожидаемого МЕДИЦИНСКОГО ИЗДЕЛИЯ (например, шприцевой механизм введения для инфузионного насоса). Полезно использовать средства программного обеспечения, которые облегчают быстрое создание прототипов, позволяя вносить изменения, сохраняя низкую стоимость.
D.4.6.2 Аппаратное обеспечение ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
При разработке аппаратного обеспечения ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА спецификации могут включать:
- чертежи внешнего вида панелей управления, которые показывают внешний вид и расположение дисплеев и блоков управления МЕДИЦИНСКОГО ИЗДЕЛИЯ. Эти чертежи обычно дополняются письменным обоснованием, которое охватывает такие темы, как функциональные группировки, защита от случайной активации управления и используемый угол наблюдения;
- антропометрический анализ диаграмм (графический анализ физических взаимосвязей между МЕДИЦИНСКИМ ИЗДЕЛИЕМ и лицами с различными антропометрическими данными, который устанавливает физическое соответствие конструкции предполагаемой популяции ПОЛЬЗОВАТЕЛЕЙ);
- описание ожидаемого взаимодействия ПОЛЬЗОВАТЕЛЯ с дисплеями и элементами управления (например, как элементы управления и дисплеи изменяются в ответ на внутренние события МЕДИЦИНСКОГО ИЗДЕЛИЯ и действия ПОЛЬЗОВАТЕЛЯ).
D.4.6.3 Программное обеспечение ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
При разработке программного обеспечения ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА спецификации могут включать:
- внешний вид всех экранов и окон, включая маркировку, шрифты, используемые цвета и графику;
- внешний вид и поведение всех элементов управления на экране;
- все диалоги, включая звуковые события;
- создание всех отчетов на твердом носителе;
- описание ожидаемого взаимодействия ПОЛЬЗОВАТЕЛЯ с дисплеями и элементами управления (например, как элементы управления и дисплеи изменяются в ответ на внутренние события МЕДИЦИНСКОГО ИЗДЕЛИЯ и действия ПОЛЬЗОВАТЕЛЯ).
D.4.6.4 Другие полезные средства ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
При определении конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА также может быть полезно создать:
- диаграмму концептуальной модели, которая иллюстрирует высокий уровень структуры ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА (см. рисунок D.2);
- схемы ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА - иллюстрация (обычно блок-схема), показывающая взаимосвязи между различными экранами;
- маску экрана - общий внешний вид компьютерного экрана;
- раскадровку - набор распечаток экрана программного обеспечения, которые могут иметь перекрестные ссылки на маску и письменное описание;
- руководство по стилю - набор письменных правил, которые обеспечивают согласованность за счет управления графическим наполнением экрана и средствами взаимодействия.
D.4.7 Оценивание проектного решения
D.4.7.1 Общее руководство
Продукт каждого вида деятельности по разработке оценивается на протяжении всего цикла разработки. Эти действия являются итеративными и кумулятивными и должны быть проведены для всех типов ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА (программного обеспечения, аппаратного обеспечения, документации и т.д.), для всех типов ПОЛЬЗОВАТЕЛЕЙ (обслуживающий персонал, установщики и т.д.). Результатом является рабочая модель, которая подвергается исследованиям при конечной ВАЛИДАЦИИ. Различие между ВЕРИФИКАЦИЕЙ и ВАЛИДАЦИЕЙ состоит в том, что ВЕРИФИКАЦИЯ подтверждает, что проект соответствует требованиям к проекту, в то время как ВАЛИДАЦИЯ подтверждает, что конечная модель продукта учитывает нужды предполагаемого ПОЛЬЗОВАТЕЛЯ.
Требуется, чтобы полное оценивание проекта было завершено до окончания разработки. Обычно приходится "заморозить" проект до детального проектирования и создания кода программного обеспечения. Так как проект "заморожен", существенные изменения конструкции являются деструктивными, затратными по времени и дорогими. Например, если не обнаруживается серьезных ОПАСНЫХ СИТУАЦИЙ, ИЗГОТОВИТЕЛЮ будет сложно обосновать стоимость существенных изменений панели управления, таких как перестановка или добавление кнопок, после проведения дорогостоящей обработки. Более вероятно, что определенная конструкция останется замороженной и будут рассматриваться другие возможности модификации параметров ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, такие как специальная маркировка, комментарии в документации ПОЛЬЗОВАТЕЛЯ или дополнительное обучение. Однако такие действия часто являются не эффективными и всегда менее желательными, чем однократное изменение конструкции.
D.4.7.2 ВЕРИФИКАЦИЯ проекта
Рабочие продукты и другие наглядные материалы, характеризующие конструкцию, должны быть испытаны по критериям, полученным на основании требований к проекту. Эти продукты, которые могут включать чертежи, описания задач, модели и динамические компьютерные представления, служат средствами для анализа задач, раскадровок и эвристического анализа, обзора моделей и испытаний ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Определенные вероятные ошибки и/или отказы МЕДИЦИНСКОГО ИЗДЕЛИЯ включены в АНАЛИЗ РИСКА.
Без повторного оценивания в ходе разработки, эмпирические аспекты разработки не являются отбраковывающими факторами вплоть до ВАЛИДАЦИИ продукции (см. D.4.7.3). Недостаточное внимание к ВЕРИФИКАЦИИ может сказаться при испытании образцов в виде небезопасной, неэффективной установки и работы МЕДИЦИНСКОГО ИЗДЕЛИЯ (т.е. критических ошибок, проблем с рабочими характеристиками и медленным выполнением задач). Стоимость исправления проблем, определенных во время ВЕРИФИКАЦИИ, существенно ниже, чем стоимость переделывания рабочих моделей.
По-видимому, незначительные изменения проекта могут существенно влиять на конечные рабочие характеристики МЕДИЦИНСКОГО ИЗДЕЛИЯ. Любые существенные изменения конструкции должны быть включены в уточненный анализ РИСКОВ для обеспечения того, что эти изменения не приведут к дополнительным ОПАСНОСТЯМ или ОПАСНЫМ СИТУАЦИЯМ.
Результаты этих оценок часто приводят к уточнению требований к конструкции и облегчают принятие обоснованного проектного решения, включающего такие вопросы, как:
- распределение функций между ПОЛЬЗОВАТЕЛЯМИ, программным обеспечением и аппаратным обеспечением;
- логичность, последовательность и интуитивность этапов задач данного программного/аппаратного обеспечения ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА;
- любые характеристики конструкции, которые могут разрешить или вызвать ошибки;
- возможные ОПАСНЫЕ СИТУАЦИИ и альтернативные проектные решения;
- задачи, которые требуют слишком больших временных затрат;
- маркировки или отображаемая информация, сложные для понимания или допускающие возможность неверной интерпретации;
- защита от разумно прогнозируемого неправильного применения.
D.4.7.3 ВАЛИДАЦИЯ промышленных образцов
При оценивании промышленных образцов используют методы, обеспечивающие подтверждение соответствия МЕДИЦИНСКОГО ИЗДЕЛИЯ нуждам ПОЛЬЗОВАТЕЛЯ и предполагаемому применению (т.е. ВАЛИДАЦИЮ проекта). Испытания могут быть проведены в реальных или моделируемых условиях. Получаемые данные (например, время, затраченное на задачу, ошибки, наблюдаемые проблемы) должны напрямую относиться к безопасному эффективному применению. Обычно МЕДИЦИНСКОЕ ИЗДЕЛИЕ оценивается перед реальным применением ПАЦИЕНТАМИ, хотя дополнительные данные могут быть получены во время клинических исследований. Позднее послепродажные исследования выпущенного на рынок МЕДИЦИНСКОГО ИЗДЕЛИЯ могут предоставить полезную информацию о сильных и слабых сторонах конструкции.
Во время ВАЛИДАЦИИ внимательно рассматриваются функции в целом, а не отдельные функции и связанные с ними параметры ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА. Проведение полной ВЕРИФИКАЦИИ проекта ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА обычно подтверждается во время конечной ВАЛИДАЦИИ. Тем не менее, особенности работы, которые не были выявлены во время ВЕРИФИКАЦИИ, могут проявиться при конечных исследованиях. При ПРОЕКТИРОВАНИИ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, основанном на структурированном подходе, проблемы, обнаруживаемые во время ВАЛИДАЦИИ, обычно относительно незначительны и требуемые изменения конструкции несущественны.
D.5 Методы и приемы, используемые в ПРОЦЕССЕ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
D.5.1 Общие положения
Было разработано много приемов, средств и методик для помощи участникам ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ при разработке безопасного МЕДИЦИНСКОГО ИЗДЕЛИЯ с большей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ. Не существует единственного метода, который является лучшим во всех ситуациях, и при разработке конструкции обычно используются несколько различных методов. Решение о том, какой метод следует использовать на каком этапе цикла разработки, основывается на особенностях конструкции при ПРОЕКТИРОВАНИИ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и лучше всего может быть принято профессионалами в области ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Предпочтительны методы, обеспечивающие объективные, проверяемые данные. Тем не менее для полного понимания успешных и менее успешных параметров конструкции важны как объективные, так и субъективные данные. Независимо от метода, результаты заслуживают доверия только в том случае, если участники исследования являются характерными представителями людей, выполняющих оцениваемую(ые) задачу(и). В следующих пунктах кратко описаны основные приемы и методы ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Для более подробной информации - см. ссылки в библиографии. Эти подходы могут быть использованы в дополнение к полученным соответствующим данным из технической литературы, следует грамотно применять их к данной проблеме.
D.5.2 Подробный когнитивный анализ
Подробный когнитивный анализ включает структурированный обзор требований ПОЛЬЗОВАТЕЛЯ к рабочим характеристикам последовательности заранее определенных задач. Подробный когнитивный анализ в начале ПРОЦЕССА разработки позволяет оценить различные предварительные концепции конструкции. Подробный когнитивный анализ может оставаться продуктивным и позднее в ПРОЦЕССЕ разработки, когда конструкция становится более определенной [29].
D.5.3 Изучение и наблюдения в реальных условиях
Изучение в реальных условиях обычно включает ненавязчивое наблюдение за ПОЛЬЗОВАТЕЛЯМИ, выполняющими соответствующие задачи, связанные с МЕДИЦИНСКИМ ИЗДЕЛИЕМ или аналогичным МЕДИЦИНСКИМ ИЗДЕЛИЕМ в реальной среде применения [14], [23]. Наблюдение и работа с ПОЛЬЗОВАТЕЛЯМИ в их обычной среде позволяет лучше понять соответствующие задачи и последовательность действий. Этот метод обычно используется в начале ПРОЦЕССА разработки (во время определения проблем, анализа требований и концептуального проектирования МЕДИЦИНСКОГО ИЗДЕЛИЯ) для понимания ПОЛЬЗОВАТЕЛЕЙ и их задач. Эти методы обычно не раскрывают когнитивные ПРОЦЕССЫ, точки зрения и мнения.
D.5.4 Аудит проектирования
При аудите проектирования ожидаемые параметры и компоненты ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА сравниваются с перечнем требований признанных практик лучшего проектирования. В перечне перечислены характеристики, которыми должен обладать ПОЛЬЗОВАТЕЛЬСКИЙ ИНТЕРФЕЙС наряду с видами ЗАПИСИ о соответствии интерфейса соответствующим стандартам. Аудит проектирования является относительно быстрым и рентабельным, но может обеспечить только поверхностное понимание особенностей ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА.
D.5.5 Сравнение и функциональный анализ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Можно сравнить альтернативные МЕДИЦИНСКИЕ ИЗДЕЛИЯ или альтернативные концепции МЕДИЦИНСКИХ ИЗДЕЛИЙ, составив список МЕДИЦИНСКИХ ИЗДЕЛИЙ и их параметров в виде таблицы. Параметры каждого альтернативного варианта оцениваются по классам или выставляется оценка по ряду критериев. Такое сравнение может быть полезным для понимания того, какой тип конструкции лучше удовлетворяет нужды ПОЛЬЗОВАТЕЛЯ. Например, можно составить таблицу физических параметров нескольких сравниваемых МЕДИЦИНСКИХ ИЗДЕЛИЙ (например, масса, размеры, структура и т.д.) для облегчения сравнения МЕДИЦИНСКИХ ИЗДЕЛИЙ.
D.5.6 Экспертный анализ
Экспертный анализ зависит от знаний и опыта специалистов по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ при определении сильных и слабых сторон конструкции и рекомендации возможных путей улучшения. Экспертный обзор может проводиться на основании концептуальной схемы конструкции, также как и на рабочем прототипе. Многие серьезные недостатки конструкции можно обнаружить на ранних этапах без дорогостоящих испытаний. Однако, если эти методы используются изолированно друг от друга, маловероятно, что они выявят все недостатки конструкции.
D.5.7 Функциональный анализ
Функциональный анализ дает представление о функциях и событиях, необходимых для соответствия целям системы. Например, важной функцией близкофокусной лучевой терапии является клиническая оценка ПАЦИЕНТА, подготовка ПАЦИЕНТА, планирование лечения, проведение лечения, снятие МЕДИЦИНСКОГО ИЗДЕЛИЯ после лечения, общение, фиксация ЗАПИСЕЙ, обеспечение качества и профилактическое обслуживание [15]. Этот тип анализа используется для определения соответствующего распределения функций между человеком и машиной. Существует большое число типов функционального анализа, включая рабочие диаграммы и методы системного функционального анализа, а также компьютерное моделирование и методы моделирования, такие как системный анализ комплексной группы задач [26], [34].
D.5.8 Эвристический анализ
Эвристический анализ - это оценка клиническими экспертами или экспертами по ПРОЕКТИРОВАНИЮ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ или системы посредством оценки того, насколько оно соответствует принятым правилам проектирования интерфейса человек-машина [29]. Он очень полезен в начале ПРОЦЕССА разработки для обнаружения проблемных параметров ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА. Кроме того, он полезен для сравнения возможных конструкций ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, т.к. можно сравнить оценку выполнения каждого правила во всех продуктах. Этот метод обычно является быстрым и недорогим. Ценность эвристического анализа в общем случае ограничивается, если он используется не в реальной среде применения и в оценку не включены типичные ПОЛЬЗОВАТЕЛИ. Эвристический анализ часто обеспечивает отличные проектные решения в начале ПРОЦЕССА разработки. Эвристический анализ следует использовать совместно с другими методами, которые получают входные данные от ПОЛЬЗОВАТЕЛЕЙ, особенно при дальнейшем использовании в ПРОЦЕССЕ разработки.
D.5.9 Опросы
Часто бывает полезным обсудить особенности конструкции с небольшой группой ПОЛЬЗОВАТЕЛЕЙ, особенно если целью является появление новых идей или достижение согласия. Опросы также могут быть проведены индивидуально. Данный метод предназначен для сбора, а не анализа информации. Структурированный (или направленный) опрос полезен в случаях, когда целью является нахождение ответов на определенные вопросы, часто тогда, когда разработчики хорошо разбираются в ПРОЦЕССЕ разработки. Неструктурированный опрос, с другой стороны, полезен при сборе начальных мнений о конструкции в условиях, когда разработчики хотят избежать отклонения ответов опрашиваемых в любом конкретном направлении [17], [35].
D.5.10 Совместная разработка
Совместная разработка включает обеспечение возможных ПОЛЬЗОВАТЕЛЕЙ средствами, которые позволяют им стать членами проектной группы. Доступны примеры множества средств [33], включая 3D модели компонентов, которые ПОЛЬЗОВАТЕЛИ могут расположить в предпочтительной конфигурации, или 2D представления, которые ПОЛЬЗОВАТЕЛИ располагают для отображения их идей о конструкции продукта. Аналогично можно попросить ПОЛЬЗОВАТЕЛЕЙ нарисовать их идеи или использовать возможности управления на экране компьютера.
D.5.11 Создание прототипов
Создание прототипов включает создание модели МЕДИЦИНСКОГО ИЗДЕЛИЯ, которая может использоваться при различном оценивании деятельности. Модели могут отличаться от прототипов, "выглядящих как, работающих как" МЕДИЦИНСКОЕ ИЗДЕЛИЕ с высокой степенью соответствия конечному продукту до грубых моделей с низкой степенью достоверности, которые только демонстрируют определенный набор параметров МЕДИЦИНСКОГО ИЗДЕЛИЯ. Примеры методов моделирования и создания прототипов включают моделирование на экране, средства создания прототипов программного обеспечения, физические модели, связанные с компьютером, и физические модели со встроенными микропроцессорами [19], [36].
D.5.12 Вопросники и анкеты
Информация и мнения, касающиеся интерфейса человек-машина, часто собираются по телефону, Интернету или в письменном виде [28]. Единственной выгодой данного метода является то, что данные могут быть легко и экономически выгодно собраны от многих ПОЛЬЗОВАТЕЛЕЙ. Эти методы могут использоваться в начале разработки для масштабных исследований ПОЛЬЗОВАТЕЛЕЙ, во время других испытаний для получения субъективной информации и позднее для сбора оценок о выпущенном продукте.
D.5.13 Моделирование клинических условий и испытания в условиях эксплуатации
Моделирование клинических условий позволяет проводить оценивание в управляемых условиях, содержащих все или некоторые существенные признаки реальной клинической среды, для которой разработано МЕДИЦИНСКОЕ ИЗДЕЛИЕ. Моделирование облегчает создание худшего случая сценария применения и сложных отказов. Медицинские изделия с высоким РИСКОМ или включающие более сложные задачи могут быть испытаны в моделируемых условиях с большей степенью соответствия, например, в моделируемой операционной с функциональным манекеном. Моделирование с высокой степенью соответствия позволяет испытательной команде оценить динамические взаимодействия многих МЕДИЦИНСКИХ ИЗДЕЛИЙ, персонала и специальных задач.
Каждое МЕДИЦИНСКОЕ ИЗДЕЛИЕ в конечном счете обязательно проходит "полевые испытания", когда оно продано. Тем не менее вопросы ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, поднимаемые на данном этапе, могут негативно влиять на коммерческий успех. Испытания прототипов в условиях эксплуатации или опытных образцов в реальных условиях, несмотря на меньшую контролируемость, обычно являются информативными. Также испытания в условиях эксплуатации могут быть более ценными для сложных МЕДИЦИНСКИХ ИЗДЕЛИЙ, которые активно взаимодействуют со многими пользователями и другими элементами системы. Испытания в условиях эксплуатации даже относительно простых МЕДИЦИНСКИХ ИЗДЕЛИЙ могут обнаруживать неожиданные взаимодействия, параметры ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и ОШИБКИ ЭКСПЛУАТАЦИИ/ ПРИМЕНЕНИЯ [19], [36].
D.5.14 Анализ задач
D.5.14.1 Общие положения по анализу задач
Анализ задач - это совокупность систематических методов, которые обеспечивают подробное описание последовательных и одновременных ручных и интеллектуальных действий персонала, работающего, обслуживающего или управляющего МЕДИЦИНСКИМ ИЗДЕЛИЕМ или системой. Анализ задач может предоставлять информацию о знаниях, умениях, возможностях и ОПАСНЫХ СИТУАЦИЯХ, связанных с выполнением соответствующих задач. Анализ задач может использоваться на таких ранних этапах, как концептуальное проектирование для облегчения понимания и последующего изменения всего ПРОЦЕССА. Позднее в цикле разработки анализ задач может использоваться для оценки прототипов МЕДИЦИНСКОГО ИЗДЕЛИЯ в реальной или моделируемой среде применения. Ограничения анализа задач сводятся к тому, что он требует временных затрат, а большой объем данных, которые могут быть получены, иногда сложно анализировать и интерпретировать [20], [22].
D.5.14.2 Исследование ПРОЦЕССА во времени
Один из наиболее ранних методов ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ - исследование ПРОЦЕССА во времени, фиксирует дискретные действия людей во времени. Метод может быть использован для обнаружения мешающих взаимодействий и возможностей для совершенствования, для определения возможности завершения действия в течение определенных временных рамок или для исследования влияния использования МЕДИЦИНСКОГО ИЗДЕЛИЯ на ПРОЦЕССЫ и процедуры [24], [27], [28].
D.5.14.3 Когнитивный анализ задач
Когнитивный анализ задач фокусируется на когнитивных ПРОЦЕССАХ ПОЛЬЗОВАТЕЛЯ, таких как их модель восприятия работы МЕДИЦИНСКОГО ИЗДЕЛИЯ или системы [16], [25]. Данный метод обеспечивает формальное оценивание когнитивных (познавательных) требований к ПОЛЬЗОВАТЕЛЯМ при выполнении ими задач, которые заменяет, поддерживает или требует МЕДИЦИНСКОЕ ИЗДЕЛИЕ. Когнитивный анализ задач может также использоваться для оценки того, как улучшение МЕДИЦИНСКОГО ИЗДЕЛИЯ изменяет восприятие ПОЛЬЗОВАТЕЛЯ вовлеченных ПРОЦЕССОВ. В связанном методе когнитивного моделирования рабочие характеристики задачи определяются на основании анализа основных требований задачи, возможностей лица, выполняющего задачу, доступных методов выполнения задачи и ПРОЦЕССОВ, с помощью которых ПОЛЬЗОВАТЕЛЬ будет выбирать один из доступных методов.
D.5.15 Испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
В испытаниях ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ реальные ПОЛЬЗОВАТЕЛИ взаимодействуют с одной или более моделью, прототипами или промышленным образцом МЕДИЦИНСКОГО ИЗДЕЛИЯ для оценки легкости обучения, простоты использования, ЭФФЕКТИВНОСТИ, легкости для запоминания и/или обращения ПОЛЬЗОВАТЕЛЯ [29]. Испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут проводиться в лабораторных условиях, в моделируемых условиях или в реальных условиях предполагаемого применения. Испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, особенно при проведении в условиях эксплуатации, могут выявлять ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Тем не менее, т.к. популяция субъектов мала, ошибки с низкой вероятностью возникновения могут быть не обнаружены. По этой причине важно использовать дополнительные методы, такие как АНАЛИЗ РИСКА.
D.5.16 Анализ ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ
Конструкция ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА должна оцениваться на протяжении разработки МЕДИЦИНСКОГО ИЗДЕЛИЯ для определения вероятности специфических ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ, которые могут нанести ВРЕД. Анализ может включать обзор соответствующих отчетов о наблюдениях и оповещении, отчетов о происшествиях, отчетов о неблагоприятных событиях, жалоб потребителей, данных медицинского наблюдения, данных об удовлетворенных исках, данных по послепродажному надзору (например, САРА - корректирующие и предупреждающие действия; ИСО 9001, пункты 8.5.2 и 8.5.3) [6], анализ прототипов, или использование методов анализа критических инцидентов. Для моделирования и анализа ошибок существует несколько эмпирических и компьютерных методов. Как Rouse [31], так и Reason [30] обсуждают анализ ОШИБОК ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ более подробно.
D.5.17 Оценка рабочей нагрузки
Производительность ПОЛЬЗОВАТЕЛЯ может быть ухудшена чрезмерно высокой или низкой рабочей нагрузкой. Использование МЕДИЦИНСКОГО ИЗДЕЛИЯ может влиять на рабочую нагрузку, а рабочая нагрузка может влиять на взаимодействие ПОЛЬЗОВАТЕЛЯ с МЕДИЦИНСКИМ ИЗДЕЛИЕМ [27], [37]. Оценка рабочей нагрузки помогает оценить или предсказать когнитивную способность работников в отношении дополнительных задач. Рабочая нагрузка может быть измерена с использованием психологических (например, субъективная оценка, полученная возможно с использованием вопросников), процедурных (например, влияние на стандартизированные показатели рабочих характеристик) или физиологических (например, изменение частоты сердечных сокращений) методов. Методы оценки рабочей нагрузки обычно требуют ВАЛИДАЦИИ и могут быть технически сложными и сложными для анализа.
Приложение Е
(справочное)
Вопросы, которые можно использовать для определения характеристик МЕДИЦИНСКОГО ИЗДЕЛИЯ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ, и которые могут оказать влияние на БЕЗОПАСНОСТЬ
Е.1 Общие положения
В подразделе 5.1 требуется, чтобы ИЗГОТОВИТЕЛЬ определял характеристики, связанные с применением МЕДИЦИНСКОГО ИЗДЕЛИЯ. Рассмотрение этих характеристик является важным этапом определения ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ, как требуется в 5.3. Одним из методов выполнения этого является ответ на серию вопросов, касающихся производства, применения и обязательной утилизации МЕДИЦИНСКОГО ИЗДЕЛИЯ. Если на эти вопросы отвечают с точек зрения всех вовлеченных лиц (например, ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ, обслуживающего персонала, ПАЦИЕНТОВ и т.д.), может быть получена более полная картина, показывающая, где можно обнаружить вероятные ОПАСНЫЕ СИТУАЦИИ. Следующие вопросы могут помочь читателям в определении всех характеристик ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ, которые могут повлиять на БЕЗОПАСНОСТЬ.
Этот список не является исчерпывающим или характерным для всех МЕДИЦИНСКИХ ИЗДЕЛИЙ, и читатель предупреждается о необходимости добавления вопросов, которые могут быть применены для конкретного МЕДИЦИНСКОГО ИЗДЕЛИЯ, и пропуска вопросов, которые не соответствуют конкретному МЕДИЦИНСКОМУ ИЗДЕЛИЮ. Читатель также предупреждается о необходимости рассмотрения не только каждого вопроса в отдельности, но также в связи друг с другом.
Е.2 Вопросы
Е.2.1 Стерильно ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ или оно предназначено для стерилизации ПОЛЬЗОВАТЕЛЕМ, или необходимы другие виды микробиологической обработки?
Факторы, которые необходимо рассмотреть, включают:
- предназначено ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ для однократного или многократного применения, а также
- любую упаковку и любые ограничения числа циклов повторных применений, или
- способ используемого ПРОЦЕССА стерилизации.
Маркировано ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ соответствующим образом для информирования ПОЛЬЗОВАТЕЛЯ о том, предназначено ли оно для однократного или многократного применения? Указаны ли четко на упаковке любые ограничения по обращению или сроку службы? В ЭКСПЛУАТАЦИОННОЙ ДОКУМЕНТАЦИИ должны быть четко указаны соответствующие методы и средства для очистки или стерилизации, приведена информация по частоте уборки.
Особый интерес для будущей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ вызывает простота разборки/повторной сборки и любые связанные с этим ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ.
Е.2.2 Выполняются ли измерения?
Факторы, которые необходимо рассмотреть, включают измеряемые переменные, а также достоверность и точность результатов измерения. Также ПОЛЬЗОВАТЕЛИ должны быть осведомлены о частоте, с которой необходимо проводить измерения, параметрах, влияющих на результат, необходимых расходных материалах, о том, как обращаться с результатами и интерпретировать их. Стандартными вопросами являются разборчивость и точность отображения. Пренебрежение текущим профилактическим обслуживанием также может привести к ошибочным результатам.
Е.2.3 Предназначено ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ для использования совместно с медикаментами или другими медицинскими технологиями?
Факторы, которые необходимо рассмотреть, включают определение любых медикаментов или других медицинских технологий, которые могут быть вовлечены во взаимодействие, и возможных проблем, связанных с таким взаимодействием, а также реакцию ПАЦИЕНТА на проводимое лечение.
Е.2.4 Происходит ли нежелательное выделение энергии или веществ?
Факторы, касающиеся энергии, которые необходимо рассмотреть, включают шум и вибрацию, тепло, излучение (в том числе ионизирующее, неионизирующее и ультрафиолетовое/видимое/инфракрасное излучение), температуру на контактных поверхностях, токи утечки и электрические и/или магнитные поля, а также негативное влияние шума, вибрации, тепла и отходов (например, выпускаемых газов) на физиологию и психологию ПАЦИЕНТОВ и третьих лиц.
Е.2.5 Чувствительно ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ к воздействию окружающей среды?
Факторы, которые необходимо рассмотреть, включают производственную среду, транспортные средства и условия хранения. Факторы включают экстремальные параметры при транспортировании - удар, вибрацию, давление, температуру и влажность, а также освещенность, утечки, чувствительность к изменениям в энергоснабжении и охлаждении, электромагнитные помехи.
В ЭКСПЛУАТАЦИОННОЙ ДОКУМЕНТАЦИИ необходимо четко информировать об ограничениях среды, в которой может использоваться МЕДИЦИНСКОЕ ИЗДЕЛИЕ. Необходимо тщательно рассмотреть эргономичность МЕДИЦИНСКОГО ИЗДЕЛИЯ (массу, конструкцию ручек, остроту кромок).
Е.2.6 Имеются ли специальные расходные материалы или принадлежности, связанные с МЕДИЦИНСКИМ ИЗДЕЛИЕМ?
Факторы, которые необходимо рассмотреть, включают технические требования к расходным материалам или принадлежностям и любые ограничения для ОТВЕТСТВЕННОЙ ОРГАНИЗАЦИИ или ПОЛЬЗОВАТЕЛЕЙ при их выборе.
ПОЛЬЗОВАТЕЛЬ должен быть осведомлен о необходимости использования корректных расходных материалов, их достаточном количестве, могут ли с МЕДИЦИНСКИМ ИЗДЕЛИЕМ использоваться принадлежности, как их собирать и как проверять корректность их функционирования.
Е.2.7 Необходимо ли техническое обслуживание и/или калибровка?
Факторы, которые необходимо рассмотреть, включают сведения о том, проводится ли профилактическое обслуживание и/или калибровка ПОЛЬЗОВАТЕЛЕМ или ответственной организацией, или специалистом. Необходимы ли для надлежащего обслуживания и/или калибровки специальные вещества или оборудование?
Е.2.8 Имеет ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ ограниченный срок хранения?
Факторы, которые необходимо рассмотреть, включают соответствующую маркировку или индикаторы и способы утилизации МЕДИЦИНСКОГО ИЗДЕЛИЯ.
Е.2.9 Существуют ли отсроченные и/или длительные последствия от использования?
Факторы, которые необходимо рассмотреть, включают эргономические и накопительные эффекты. Необходимо учитывать длительное воздействие вибрации, шума, тепла, газов, а также недостаточной эргономичности (износ суставов, мышц и нервов и т.д.).
Е.2.10 Какие механические силы могут воздействовать на МЕДИЦИНСКОЕ ИЗДЕЛИЕ?
Факторы, которые необходимо рассмотреть, включают сведения о том, управляет ли механическими силами, оказывающими воздействие на МЕДИЦИНСКОЕ ИЗДЕЛИЕ, ОТВЕТСТВЕННАЯ ОРГАНИЗАЦИЯ, ПОЛЬЗОВАТЕЛЬ или оно управляется ПОЛЬЗОВАТЕЛЕМ во взаимодействии с другими лицами. Примеры включают: мгновенное размыкание фиксаторов (подголовник кровати), управление механическим перемещением лицом, находящимся на расстоянии от движущегося оборудования (дистанционное управление операционного стола), а также расположение ручек на мобильном оборудовании.
Е.2.11 Предназначено ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ для одноразового использования?
Факторы, которые необходимо рассмотреть, включают, является ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ саморазрушающимся после использования? Очевидно ли, что МЕДИЦИНСКОЕ ИЗДЕЛИЕ было использовано?
Е.2.12 Требует ли установка или использование МЕДИЦИНСКОГО ИЗДЕЛИЯ специального обучения или специальных умений?
Факторы, которые необходимо рассмотреть, включают новизну МЕДИЦИНСКОГО ИЗДЕЛИЯ и вероятные умения и обучение лица, устанавливающего МЕДИЦИНСКОЕ ИЗДЕЛИЕ.
Е.2.13 Какая информация по безопасному применению будет предоставлена ПОЛЬЗОВАТЕЛЮ?
Факторы, которые необходимо рассмотреть, включают:
- будет ли информация предоставлена ПОЛЬЗОВАТЕЛЮ непосредственно ИЗГОТОВИТЕЛЕМ или будут задействованы третьи лица, такие, как специалисты по монтажу/установке, лица, осуществляющие уход, профессионалы в области здравоохранения или фармацевты и подразумевается ли обучение;
- ввод в эксплуатацию и передачу ПОЛЬЗОВАТЕЛЮ и целесообразность/возможность проведения монтажа лицами, не имеющими специальных навыков.
Е.2.14 Могут ли особенности конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА привести к ОШИБКАМ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ?
Факторами, которые необходимо рассмотреть, являются особенности конструкции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА, которые могут привести к ОШИБКАМ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ. Примеры особенностей конструкции интерфейса включают: элементы управления и индикаторы, используемые символы, эргономические свойства, физическую конструкцию и внешний вид, иерархию операций, меню программного обеспечения, управляющего МЕДИЦИНСКИМ ИЗДЕЛИЕМ, наглядность предупреждений, слышимость сигналов тревоги, стандартизацию цветового кодирования.
Е.2.15 Используется ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ в среде с большим количеством отвлекающих факторов?
Элементы должны быть разработаны таким образом, чтобы их нельзя было некорректно использовать занятым ПОЛЬЗОВАТЕЛЕМ в среде с большим количеством отвлекающих факторов.
Е.12.16 Имеет ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ соединительные части или принадлежности?
Факторы, которые необходимо рассмотреть, включают вероятность некорректного подключения, дифференциацию, сходство с соединениями в других изделиях, силу соединения, отклики ПОЛЬЗОВАТЕЛЕЙ о целостности соединения, чрезмерном или недостаточном соединении.
Е.12.17 Имеет ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ управляющий интерфейс?
Факторы, которые необходимо рассмотреть, включают пространственное распределение элементов управления, их кодирование, группировку, взаимное расположение, виды откликов, грубые ошибки, упущения, дифференциацию управления, качество изображений, дискретность или непрерывность функционирования элементов управления и обратимость настроек или действий.
Е.12.18 Каким образом отображается информация на МЕДИЦИНСКОМ ИЗДЕЛИИ?
Факторы, которые необходимо рассмотреть, включают различные условия, ориентацию, зрительные возможности ПОЛЬЗОВАТЕЛЯ, популяции, четкость представленной информации, блоки, цветовое кодирование и доступность критической информации.
Е.12.19 Управляется ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ с использованием меню?
Факторы, которые необходимо рассмотреть, включают сложность и число уровней меню, достаточность информации о состоянии меню, расположение настроек, метод навигации, число шагов в одном действии, четкость последовательности и проблемы с запоминанием, соотношение важности и доступности функций управления.
Е.2.20 Будет ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ использоваться лицами со специальными потребностями?
Факторы, которые необходимо рассмотреть, включают предполагаемых ПОЛЬЗОВАТЕЛЕЙ, умственные и физические возможности, навыки и обучение ПОЛЬЗОВАТЕЛЕЙ, вопросы эргономичности, среду, в которой будет применяться МЕДИЦИНСКОЕ ИЗДЕЛИЕ, кем оно будет устанавливаться и может ли ПАЦИЕНТ управлять или влиять на применение МЕДИЦИНСКОГО ИЗДЕЛИЯ. Особое внимание следует уделить предполагаемым ПОЛЬЗОВАТЕЛЯМ со специфическими потребностями, таким как лица с психическими или физическими недостатками, пожилые люди и дети. Их специальные нужды могут включать помощь других лиц с целью сделать возможным применение МЕДИЦИНСКОГО ИЗДЕЛИЯ. Предназначено ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ для использования лицами с различным уровнем навыков и различным культурным уровнем?
Е.2.21 Каким образом МЕДИЦИНСКОЕ ИЗДЕЛИЕ может быть преднамеренно использовано некорректно?
Факторы, которые необходимо рассмотреть: некорректное использование соединителей, отключение элементов БЕЗОПАСНОСТИ или систем сигнализации, пренебрежение рекомендациями ИЗГОТОВИТЕЛЯ по техническому обслуживанию.
Даже если такие действия считаются НЕНОРМАЛЬНОЙ ЭКСПЛУАТАЦИЕЙ/ПРИМЕНЕНИЕМ, поощряется, если ИЗГОТОВИТЕЛЬ исследует возможную преднамеренную НЕКОРРЕКТНУЮ ЭКСПЛУАТАЦИЮ/ПРИМЕНЕНИЕ и, если это достаточно практично, смягчает связанные РИСКИ.
Е.2.22 Предназначено ли МЕДИЦИНСКОЕ ИЗДЕЛИЕ для применения как мобильное или портативное?
Факторами, которые необходимо рассмотреть, являются необходимые зажимы, рукоятки, колеса, тормоза, механическая устойчивость и долговечность.
Приложение F
(справочное)
Примеры возможных ОПАСНЫХ СИТУАЦИЙ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ
В подразделе 5.3 требуется, чтобы ИЗГОТОВИТЕЛЬ составлял список прогнозируемых ОПАСНОСТЕЙ и ОПАСНЫХ СИТУАЦИЙ, связанных с применением МЕДИЦИНСКОГО ИЗДЕЛИЯ, и предсказуемых последовательностей событий и способствующих факторов, которые могут привести к ОПАСНЫМ СИТУАЦИЯМ. Опасность не может привести к ВРЕДУ, если последовательность событий, способствующие факторы или обстоятельства (включая нормальное применение) не приводят к ОПАСНЫМ СИТУАЦИЯМ.
Для полного анализа РИСКОВ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ ИЗГОТОВИТЕЛЬ должен тщательно рассмотреть весь диапазон сценариев применения и связанных факторов, которые могут привести к ВРЕДУ. Для успешного анализа этих факторов важно понимать значения терминов, указанных в таблице F.1, и их взаимосвязь, показанную на рисунке F.1. Для оцениваемых МЕДИЦИНСКИХ ИЗДЕЛИЙ многие ОПАСНОСТИ никогда не приведут к ВРЕДУ и могут быть исключены из дальнейшего рассмотрения.
Таблица F.1 - Словарь соответствующих терминов МЕНЕДЖМЕНТА РИСКА
Термин | Значение из ИСО 14971 |
ВРЕД | Физическая травма или ущерб здоровью людей, или имуществу, или окружающей среде |
ОПАСНОСТЬ | Потенциальный источник ВРЕДА |
ОПАСНАЯ СИТУАЦИЯ | Обстоятельства, при которых люди, имущество или окружающая среда подвержены одной или нескольким ОПАСНОСТЯМ |
РИСК | Сочетание вероятности причинения ВРЕДА и ТЯЖЕСТИ этого ВРЕДА |
ТЯЖЕСТЬ | Мера возможных последствий ОПАСНОСТИ |
Примечание 1 - - это вероятность возникновения опасной ситуации.
Примечание 2 - - это вероятность того, что ОПАСНАЯ СИТУАЦИЯ приведет к ВРЕДУ.
Рисунок F.1 - Графическое представление взаимосвязи между ОПАСНОСТЬЮ, последовательностью событий, ОПАСНОЙ СИТУАЦИЕЙ и ВРЕДОМ
В таблице F.2 приведены характерные примеры возможных ОПАСНОСТЕЙ, связанной с ними последовательности событий и последующего ВРЕДА. Кроме того, в таблице F.2 предложены возможные средства УПРАВЛЕНИЯ РИСКАМИ ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА или стратегии смягчения РИСКА.
Таблица F.2 - Примеры ВРЕДА из-за ОПАСНОСТЕЙ, связанных с ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТЬЮ
Опасность | Описание сценария | ВРЕД | Средства УПРАВЛЕНИЯ РИСКАМИ ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА |
Лазерное излучение класса 4 | ПОЛЬЗОВАТЕЛЬ случайно активирует незащищенную систему запуска лазерного излучения. | Ожог | Размещение системы запуска лазерного излучения за откидной крышкой |
Игла | После извлечения внутривенного катетера ПОЛЬЗОВАТЕЛЬ кладет незащищенную иглу на простыню больничной койки. ПОЛЬЗОВАТЕЛЬ забывает выбросить иглу. | Прокол кожи | Механизм защиты от укола иглой |
Жесткий пол | Сложный механизм фиксации поручней больничной койки. ПОЛЬЗОВАТЕЛЬ не распознал, что поручни не полностью зафиксированы. | Перелом бедра | Легкие для использования механизмы поручней. |
Избыточное давление в легких | Техники некорректно собрали систему дыхательных трубок до помещения в корпус. | Пневмоторакс, который привел к повреждению мозга за счет гипоксии | Соединители дыхательных систем, предотвращающие небезопасное некорректное подсоединение. |
Гипоксическая (с низким содержанием кислорода) смесь газов | Отказ центральной системы поставки кислорода. | Повреждение мозга за счет гипоксии | Четкое отображение состояния измерения монитора. |
Лекарство (морфин) | ПАЦИЕНТУ в экстремальных условиях экстренной помощи при низком уровне внешнего освещения был введен большой объем морфина. | Остановка дыхания | Программное обеспечение инфузионного насоса, предупреждающее ПОЛЬЗОВАТЕЛЯ о выходе за пределы значений концентрации или дозы |
Лекарство (инсулин) | ПАЦИЕНТ (ПОЛЬЗОВАТЕЛЬ) имеет слабое зрение. На глюкометре не были четко обозначены единицы измерения. Плохое внешнее освещение дома у ПАЦИЕНТА. | Кома | Реализация предупреждений программного обеспечения о том, что введенные единицы измерения уровня глюкозы в крови не совместимы с определенной страной использования |
| |||
Приложение G
(справочное)
Цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Наглядный пример для домашнего парентерального инфузионного насоса
G.1 Исходные данные для примера домашнего парентерального инфузионного насоса
Настоящее приложение было выделено из проекта отчета по техническим данным AAMI, который был разработан совместными усилиями представителей изготовителей, работающих с AdvaMed и Центром по контролю над оборудованием и радиационной БЕЗОПАСНОСТЬЮ управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
G.2 Общие положения
В настоящем приложении обсуждается важность целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в обеспечении лучшей практики проектирования ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА и приводится наглядный пример для одного класса МЕДИЦИНСКИХ ИЗДЕЛИЙ, домашнего парентерального инфузионного насоса. Оно также содержит информацию о рассматриваемых моментах во время разработки этих целей.
Как правило, определение и применение целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ во время ПРОЦЕССА разработки МЕДИЦИНСКОГО ИЗДЕЛИЯ улучшает БЕЗОПАСНОСТЬ и ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ. Если конструкция достигает целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, ее основные операции могут безопасно выполняться предполагаемым ПОЛЬЗОВАТЕЛЕМ. Для получения конструкции МЕДИЦИНСКОГО ИЗДЕЛИЯ, которая бы удовлетворяла разработанным целям ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, требуется использовать принятые процедуры управления проектированием. Эти процедуры включают методы разработки, учитывающие человеческие факторы, такие как испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и АНАЛИЗ РИСКА, фокусирующийся на ошибках применения.
Сценарии применения и цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, приведенные в данном приложении, в первую очередь фокусируются на использовании парентерального инфузионного насоса в среде домашнего применения ПОЛЬЗОВАТЕЛЯМИ-неспециалистами, прошедшими минимальное обучение. Предполагается, что они будут скорее показательными, а не характерными для данного класса МЕДИЦИНСКИХ ИЗДЕЛИЙ. Для получения соответствующих целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для МЕДИЦИНСКОГО ИЗДЕЛИЯ с учетом его предполагаемого применения и популяции ПОЛЬЗОВАТЕЛЕЙ, ИЗГОТОВИТЕЛЬ проходит процедуры ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Например, цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, приведенные в данном приложении, не обязательно подойдут для парентерального инфузионного насоса, используемого опытным ПОЛЬЗОВАТЕЛЕМ - врачом, работающим в среде с высоким РИСКОМ и высокой степенью напряженности, такой как операционные, отделения неотложной помощи или палаты интенсивной терапии.
Цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ представляют желаемый уровень качества взаимодействия ПОЛЬЗОВАТЕЛЬ - МЕДИЦИНСКОЕ ИЗДЕЛИЕ, который может быть выражен в письменном виде и который обуславливает конкретные параметры ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ (например, долю успешно выполненных задач, долю приемлемых ошибок, скорость выполнения задач) и обеспечивает измеримые критерии рабочих характеристик (например, число секунд).
Цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ рекомендуются в нормативных документах по принятым практикам, касающимся МЕДИЦИНСКИХ ИЗДЕЛИЙ, в национальных и международных стандартах [1], [2]. Они должны использоваться при планировании продукта в начале цикла разработки и для установки критериев приемлемости на более поздних этапах испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ обычно определяются основными рабочими функциями и задачами, которые должно выполнять МЕДИЦИНСКОЕ ИЗДЕЛИЕ, и согласуются с соответствующими стандартами для обеспечения соответствия и технически возможной степени согласованности работы между различными ИЗГОТОВИТЕЛЯМИ.
Способом измерения соответствия МЕДИЦИНСКОГО ИЗДЕЛИЯ целям его ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ является проведение испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в соответствии с критериями приемлемости. Испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ являются процедурами определения, достижимы ли цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ могут проводиться в лабораторных условиях, в моделируемой среде или в реальной среде предполагаемого применения. Испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ обычно включают индивидуальные исследования представителей ПОЛЬЗОВАТЕЛЕЙ, выполняющих реалистичные задачи с модельной или реально работающей версией МЕДИЦИНСКОГО ИЗДЕЛИЯ, в то время как их поведение систематически наблюдается, записывается и анализируется.
Существует множество источников с советами по планированию и проведению испытаний ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ МЕДИЦИНСКОГО ИЗДЕЛИЯ [18], [32].
G.3 Допущения примера
При разработке целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ для домашнего парентерального инфузионного насоса были сделаны следующие допущения:
- Подразумеваются все типы парентеральных инфузионных насосов, включая насосы общего назначения, амбулаторные насосы и насосы, управляемые самим ПАЦИЕНТОМ. При этом внутренние и имплантируемые насосы исключены.
- ПОЛЬЗОВАТЕЛИ-неспециалисты включают ПАЦИЕНТОВ и лиц, осуществляющих уход на дому. Также рассматриваются ПОЛЬЗОВАТЕЛИ-врачи, т. к. они могут программировать и запускать или выявлять неисправности.
- Программирование (ПОЛЬЗОВАТЕЛЯМИ-неспециалистами) ограничивается основными этапами, т.к. предполагается, что большая часть инфузионных насосов, предназначенных для домашнего применения, предварительно программируется ПОЛЬЗОВАТЕЛЯМИ-врачами, если это необходимо. Каждый ИЗГОТОВИТЕЛЬ определяет основные операции для своего изделия.
- Обученные ПОЛЬЗОВАТЕЛИ-врачи выполняют предварительное программирование инфузионного насоса, следуя медицинскому порядку или предварительному описанию. Эти лица выполняют скрининг или оценку вероятных ПАЦИЕНТОВ на предмет их способности использовать инфузионный насос в домашних условиях.
- Описаны возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ для каждой специальной задачи, которую должен выполнять инфузионный насос.
- Типичные цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ установлены как выполнение первоочередных задач минимально обученными ПОЛЬЗОВАТЕЛЯМИ со значениями успеха в диапазоне от 80% до 90%. Ожидается, что с увеличением опыта или с прохождением дополнительного обучения ПОЛЬЗОВАТЕЛИ-неспециалисты (а также ПОЛЬЗОВАТЕЛИ-врачи) достигнут значений выполнения, приближающихся к 100%.
При разработке и применении целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ во время ПРОЦЕССА разработки ИЗГОТОВИТЕЛЬ должен учитывать специальные характеристики профиля предполагаемых ПОЛЬЗОВАТЕЛЕЙ. Они могут включать ПОЛЬЗОВАТЕЛЕЙ с ограниченными возможностями (например, сниженным зрением, слухом или тактильной чувствительностью). ИЗГОТОВИТЕЛЬ также рассматривает связанные ОПАСНОСТИ и РИСКИ. Эти факторы могут изменять выбор типа специальных целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. При определенных обстоятельствах некоторые цели могут не применяться. ИЗГОТОВИТЕЛЬ должен ВАЛИДИРОВАТЬ цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, основываясь на конкретных ПОЛЬЗОВАТЕЛЯХ и информации, поступающей с рынка.
G.4 Введение к примеру
G.4.1 Категории операций
Рассматриваются цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и соображения, касающиеся разработки, для трех категорий операций или основных рабочих функций домашнего инфузионного насоса. Операции перечислены в порядке приоритетности для эффективного применения этих изделий. Соображения, касающиеся разработки, описывают возможные области, на которых следует сфокусироваться для облегчения достижения соответствия конструкции целям ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Они не предназначены для непосредственного измерения во всех случаях.
Эти три категории:
- основные операции;
- обслуживание;
- инструкция по эксплуатации.
G.4.2 Основные операции
Основные рабочие функции для основных операций включают:
- включение/выключение (см. таблицу G.1);
- программирование насоса (см. таблицу G.2);
- старт и остановку инфузии (см. таблицу G.3);
- контроль статуса инфузии (см. таблицу G.4);
- установку и изменение настроек (см. таблицу G.5);
- заправку (см. таблицу G.6);
- реакцию на АВАРИЙНЫЕ СИГНАЛЫ и их инактивацию (см. таблицу G.7);
- блокировку (см. таблицу G.8).
G.4.3 Профилактическое обслуживание
Основные рабочие функции для обслуживания включают:
a) управление электропитанием (см. таблицу G.9):
1) установку/замену батарей;
2) проверку наличия питания от электросети;
b) профилактическое и текущее обслуживание (см. таблицу G.10):
1) калибровку;
2) чистку;
3) выявление неполадок.
G.4.4 Инструкция по эксплуатации
Основные рабочие функции для инструкции по эксплуатации включают понимание:
- основных операций (см. таблицу G.11);
- предварительно определенных функций (только для ПОЛЬЗОВАТЕЛЕЙ-врачей) (см. таблицу G.12).
G.5 Подробный пример целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и соображения, касающиеся разработки
В таблицах G.1-G.12 приведены примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и связанные информационные материалы для домашних парентеральных инфузионных насосов. Таблицы включают специальные задачи ПОЛЬЗОВАТЕЛЯ, наглядные количественные цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, относящиеся к прототипам (со свидетельствами), возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ и параметры конструкции, которые необходимо рассмотреть. Эти цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ были разработаны группой промышленных экспертов с целями, описанными во введении, и не были точно ВАЛИДИРОВАНЫ с ПОЛЬЗОВАТЕЛЯМИ. Они не предназначены для применения к реальному изделию без использования квалифицированных процедур ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, как определено в настоящем стандарте. К тому же они применяются в первую очередь ПОЛЬЗОВАТЕЛЯМИ, прошедшими минимальное обучение, предполагая, что при получении опыта и обучения рабочие характеристики, такие как часть успешно выполненных задач, достигнут 100%. Эти цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ не следует интерпретировать как долгосрочные установившиеся цели. Испытания ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ должны интерпретироваться на основании наблюдения за тем, как ПОЛЬЗОВАТЕЛЬ выполняет реальные задачи с МЕДИЦИНСКИМ ИЗДЕЛИЕМ, ЗАПИСИ того, что они делают, анализа результатов и рекомендаций любых соответствующих изменений.
Ниже приведено объяснение структуры таблиц G.1-G.12:
- пункты, перечисленные в колонке задач, - это специальные типы задач и подзадач, выполняемых ПОЛЬЗОВАТЕЛЕМ при проведении указанных основных рабочих функций;
- пункты, перечисленные в колонке целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ, - это утверждения, описывающие количественные показатели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ в таких терминах, как процентиль популяции и реальные значения, описывающие поведение, такие как процент выполнения, время и процент ошибок;
- пункты, перечисленные в колонке возможных ОШИБОК ИСПОЛЬЗОВАНИЯ, - это возможные прогнозируемые ошибки, совершенные ПОЛЬЗОВАТЕЛЕМ во время взаимодействия с домашним парентеральным инфузионным насосом;
- пункты, перечисленные в колонке параметров конструкции, которые необходимо рассмотреть, - это возможные области, на которые следует обратить внимание, чтобы облегчить разработку для соответствия целям ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Они не предназначены для непосредственного измерения во всех случаях.
Таблица G.1 - Включение/выключение
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Включение насоса | 90% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Средства обеспечения того, что включение питания является видимым, легко находится, легко активируется и четко маркировано. Пример: использование соответствующего символа (см. МЭК 60601-1, пункт 7.4.1), снабженного текстом "ON". |
Выключение насоса | 90% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Конструкция, препятствующая случайному выключению. Она может включать следующие варианты, как примеры: кнопка выключения является видимой, легко находится, легко активируется и четко маркирована. Пример: использование соответствующего символа (см. МЭК 60601-1, пункт 7.4.1), снабженного текстом "OFF". |
Таблица G.2 - Программирование насоса
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Основные параметры программы, такие, как мл/час | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | Запрограммирована ошибочная скорость, что приводит к избыточной или недостаточной доставке. | Конструкция ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА четкая, простая для навигации, простая для корректировки и соответствует входным параметрам программирования. |
________________ * Текст документа соответствует оригиналу. - . | |||
Проверка того, что предварительно запрограммированная лекарственная терапия осуществляется корректно | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Конструкция ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА четкая, простая для навигации, простая для корректировки и соответствует входным параметрам программирования. |
Программирование предварительно определенной терапии | 80% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ-врачи неверно программируют дозу и временные интервалы заранее определенных терапий, что приводит к недостаточной или избыточной доставке лекарств. | Насосы должны быть разработаны таким образом, чтобы позволять предварительное программирование предварительно определенных терапий, которые сохраняются для последующей активации ПОЛЬЗОВАТЕЛЯМИ- |
| |||
Таблица G.3 - Старт/остановка инфузии
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Старт инфузии | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Время между моментом физического старта инфузии и моментом активации ПРОЦЕССА инфузии пользователем включено в цели ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. |
Остановка инфузии | 90% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Кнопка остановки должна быть красного цвета и использовать символ восьмиугольника, если возможно. |
Таблица G.4 - Контроль статуса инфузии
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Проверка того, что инфузия находится в ПРОЦЕССЕ выполнения | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Для отображения того, что инфузия находится в ПРОЦЕССЕ выполнения, должен использоваться визуальный индикатор. Звуковые отметки могут быть также полезными для усиления отображения состояния. |
Проверка того, что инфузия приостановлена | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Визуальная индикация того, что инфузия приостановлена, должна быть легкой для обнаружения и понимания. Звуковые отметки могут быть также полезными для усиления отображения состояния. |
Проверка того, что инфузия завершена | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Визуальная индикация того, что инфузия завершена, должна быть легкой для обнаружения и понимания. Звуковые отметки могут быть также полезными для усиления отображения состояния. |
Проверка того, что был введен предварительно заданный объем | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Визуальный дисплей или экран с краткой информацией о доставке должен быть легким для чтения и понимания |
Таблица G.5 - Установка и изменение настроек
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Установка настроек введения | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ-неспециалисты ошибаются при установке корректных настроек и ошибаются при решении проблемы, что приводит к задержке терапии или неточной или обратной инфузии | Насос должен обеспечивать очень четкий отклик, что настройки установлены корректно, и должен быть снабжен средствами перехода к техническим условиям СРАБАТЫВАНИЯ СИГНАЛИЗАЦИИ, показывающим, если они установлены некорректно. |
Удаление настроек введения | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Насос должен обеспечивать очень четкий отклик, что настройки могут быть безопасно удалены из насоса. |
| |||
Таблица G.6 - Заправка
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Заправка системы введения до удаления воздуха из линии | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Заправка должна быть простой, а ПРОЦЕСС не склонным к ошибкам и простым для изучения |
Таблица G.7 - Реакция на аварийные сигналы и их инактивация
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Определить наличие аварийных условий | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Система сигнализации разрабатывается в соответствии с МЭК 606061-1-8. Также, учитывая предполагаемую среду использования, должны задаваться звуковые АВАРИЙНЫЕ СИГНАЛЫ для аварийных условий с низким приоритетом и расстояние для визуального АВАРИЙНОГО СИГНАЛА (для нахождения оборудования). |
Понимание значимости и значения аварийных условий | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Система сигнализации разрабатывается в соответствии с МЭК 60601-1-8. Особое внимание необходимо уделить: |
Сброс сигнализации | 90% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Использование графических символов совместно с объясняющим текстом на соответствующем языке, которые были испытаны на ЭКСПЛУАТАЦИОННУЮ ПРИГОДНОСТЬ. |
_______________
См. МЭК 60601-1-8 [2] на предмет описания аварийных условий и приоритетности аварийных условий.
Таблица G.8 - Блокировка
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Активация блокировки | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Конструкция параметров блокировки достаточно простая и легкая для активации и сложная для инактивации ПОЛЬЗОВАТЕЛЯМИ- |
ПОЛЬЗОВАТЕЛИ- | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Конструкция параметров деактивации блокировки достаточно простая и понятная без ущерба БЕЗОПАСНОСТИ |
ПОЛЬЗОВАТЕЛИ- | 100% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Насос должен явно отображать состояние блокировки |
Таблица G.9 - Управление электропитанием
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Установка/ | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Насос должен четко отображать состояние батареек и обеспечивать достаточное предупреждение, когда батарейки необходимо заменить. |
Проверка наличия питания от электросети (если применимо) | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | Батарейки "садятся" и насос останавливает работу, что вызывает задержку или незавершение терапии | Присоединить шнур питания или преобразователь мощности к устройству для предотвращения потери или случайного отсоединения |
Контроль уровня заряда батареи | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | Терапия откладывается или прерывается, если ПОЛЬЗОВАТЕЛЬ- | Оборудование, которое использует внутренние источники электропитания либо как основное, либо как вспомогательное питание должно быть снабжено средствами переключения технической аварийной сигнализации, отображающей, что осталось менее 30 мин до прекращения доставки, связанным с истощением внутреннего источника электропитания. |
| |||
Таблица G.10 - Профилактическое и текущее обслуживание
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
Проверка того, что насос приемлемо откалиброван | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Калибровка и необходимость повторной калибровки должны автоматически проверяться после запуска, а результат отображаться. Должна обеспечиваться и визуальная, и звуковая сигнализация, если проверка показывает отказ. |
Чистка изделия без повреждений | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | Используемые чистящие материалы повреждают компоненты устройства; например, делают дисплей нечитаемым | Предписывание использования материалов, структура и/или свойства которых не изменяются под воздействием общедоступных чистящих средств (например, отбеливателя) |
Выявление некорректной работы | 85% минимально обученных ПОЛЬЗОВАТЕЛЕЙ- | ПОЛЬЗОВАТЕЛИ- | Визуальное сообщение аварийной сигнализации о технических аварийных условиях (сообщения об ошибке) должно давать четкое и понятное описание проблемы и простые инструкции по ее исправлению. |
Таблица G.11 - Основные операции
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
ПОЛЬЗОВАТЕЛИ- | Показатель удобочитаемости более 65. | ПОЛЬЗОВАТЕЛИ- | Инструкции по эксплуатации должны быть представлены в четком, полном и однозначном виде. |
| |||
Таблица G.12 - Предварительно определенные функции
Задача | Примеры целей ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | Возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ | Параметры конструкции, которые необходимо рассмотреть |
ПОЛЬЗОВАТЕЛИ- | Показатель удобочитаемости более 60. | Обычные ПОЛЬЗОВАТЕЛИ-врачи не могут определить, какие действия необходимы для их устройства и не могут корректно использовать устройство | Инструкции по эксплуатации должны быть представлены в четком, полном и однозначном виде. |
Примеры предварительно определенных функций включают, но не ограничиваются, аварийные пределы, параметры блокировки, соответствие предварительно запрограммированным параметрам. | |||
| |||
Приложение Н
(справочное)
Образец спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и ее входных данных
Н.1 Введение к образцу спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Ниже приведен образец спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ и ее входных данных, используемых для ее установления для гипотетического МЕДИЦИНСКОГО ИЗДЕЛИЯ. Образец приведен для иллюстрации некоторых факторов, которые необходимо рассмотреть при разработке спецификации ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ. Указанные ОПАСНОСТИ и ОПАСНЫЕ СИТУАЦИИ, и требования могут быть нереалистичными и не соответствовать никакому реальному МЕДИЦИНСКОМУ ИЗДЕЛИЮ.
МЕДИЦИНСКОЕ ИЗДЕЛИЕ: электронный термометр с числовым дисплеем, тип 5 GW
Н.2 Входные данные для СПЕЦИФИКАЦИИ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Н.2.1 Спецификация ПРЕДПОЛАГАЕМОГО ИСПОЛЬЗОВАНИЯ
Н.2.1.1 Описание
Электронный термометр, который дает звуковой ИНФОРМАЦИОННЫЙ СИГНАЛ, когда он определяет, что достигнуто стабильное значение показаний.
Н.2.1.2 Сводка спецификации применения МЕДИЦИНСКОГО ИЗДЕЛИЯ
Н.2.1.2.1 Медицинское назначение
a) Измерение температуры человеческого тела во рту или ректально, не при сильной гипотермии (т е. для температур тела более 30°С);
b) Обнаруживаемые, контролируемые, подвергаемые лечению или диагностируемые условия или заболевания:
1) жар (не обязательно известного происхождения);
2) гипотермия.
Н.2.1.2.2 Популяция ПАЦИЕНТОВ
a) Возраст: от новорожденных до престарелых;
b) Масса: более 2,5 кг;
c) Состояние здоровья: не важно;
d) Национальность: любая;
e) Состояние ПАЦИЕНТА:
- ПАЦИЕНТ является ПОЛЬЗОВАТЕЛЕМ: бдительный, психически здоровый;
- ПАЦИЕНТ не является ПОЛЬЗОВАТЕЛЕМ: не важно, если только ПАЦИЕНТ не возбужден.
Н.2.1.2.3 Часть тела или тип тканей, к которым применяется или с которыми взаимодействует
a) Область измерения:
- Ротовая полость;
- Прямая кишка;
b) Условия: контакт с кожей в пределах или вокруг входных отверстий.
Н.2.1.2.4 Предполагаемый ПОЛЬЗОВАТЕЛЬ
a) Образование:
- как минимум от пяти до 11 лет интенсивного опыта чтения (школа);
- максимум не ограничен;
b) Знания:
1) минимум:
- чтение и понимание арабских цифр при их написании шрифтом Arial;
- различает ротовую полость, нос, уши, прямую кишку;
- знает нормы гигиены;
2) максимум не ограничен;
c) Понимание языка:
- языки, определенные в маркетинговом плане для электронного термометра с числовым дисплеем, тип 5 GW;
d) Опыт:
1) минимум:
- дети до 15 лет: обучение под контролем;
- другие: не требуется специального опыта;
- максимум не ограничен;
e) Допустимые недостатки:
- умеренное снижение остроты зрения или зрение, скорректированное до log MAR 0,2 (6/10 или 20/32);
- одна рука/протез руки, способный направлять и держать устройство;
- средняя степень ухудшения кратковременной памяти, связанного с возрастом;
- утрата 40% слуха, приводящая к 60% от нормального слуха в диапазоне от 500 Гц до 2 кГц.
Н.2.1.2.5 Применение
a) Среда:
1) Общие положения:
- домашнее применение, не предназначен для профессионального применения;
- использование только внутри помещения;
- не для использования в душе, ванне или раковине;
- может быть "потерян" в кровати, ПАЦИЕНТ может лежать или сидеть на нем; не ожидается, что он в любом случае будет работать;
- может быть уронен на пол, ПАЦИЕНТ может на него наступить; не ожидается, что он в любом случае будет работать;
- если он работает, он должен поддерживать свою калибровку/точность;
2) Условия видимости:
- диапазон внешнего освещения: от 100 до 1500 лк;
- дистанция наблюдения: от 20 до 40 см;
- угол наблюдения: перпендикулярно к дисплею ±20°;
3) Физические факторы:
- диапазон температур: от 10°С до 30°С;
- диапазон относительной влажности: от 20% до 95%, без образования конденсата;
- диапазон внешнего давления: от 500 до 1200 кПа;
- уровень звукового давления окружающей среды: менее 70 дБ в диапазоне от 100 Гц до 8 кГц;
b) Частота использования:
- от одного раза в год до 10 раз в день;
c) Мобильность:
- портативное МЕДИЦИНСКОЕ ИЗДЕЛИЕ, используемое на ПАЦИЕНТАХ в состоянии покоя.
Н.2.2 Основные рабочие функции
Н.2.2.1 Часто используемые функции:
a) удаление защитного чехла;
b) помещение устройства в корректное положение в ротовой полости или прямой кишке;
c) определение информационного сигнала завершения измерения;
d) считывание дисплея;
e) очистка;
f) захват/удержание устройства;
g) удаление устройства;
h) включение;
i) выключение;
j) одевание защитного чехла;
k) хранение.
Н.2.2.2 Функции, связанные с БЕЗОПАСНОСТЬЮ:
a) удаление защитного чехла;
b) помещение устройства в корректное положение в ротовой полости или прямой кишке;
c) определение информационного сигнала завершения измерения;
d) считывание дисплея;
е) очистка;
f) замена батарей.
Н.2.3 АНАЛИЗ РИСКА
Н.2.3.1 Предполагаемое использование
См. Н.2.1.
Н.2.3.2 ПРОФИЛЬ ПОЛЬЗОВАТЕЛЯ
См. Н.2.1.2.4 на предмет образования, знаний, опыта и допустимых недостатков предполагаемых ПОЛЬЗОВАТЕЛЕЙ.
Н.2.3.3 Что не может выйти из строя
Источники: литература, ФАЙЛЫ жалоб, эксперты среди обслуживающего персонала, АНАЛИЗ РИСКА.
a) Во время нормального применения:
1) села/разрядилась батарейка нет показаний;
b) Ошибки применения:
1) установка неправильного типа батареек;
2) измерение температуры еды (например, кипящей воды, варящейся и жарящейся еды);
3) прикладывание излишней нагрузки;
4) падение;
5) механическое напряжение (сидение, лежание или наступание на термометр);
6) удаление до завершения измерений;
7) выключение до завершения измерений;
c) Окружающая среда:
1) перегрев отказ дисплея
отсутствие/ошибочные показания;
2) шумная среда преждевременное прерывание измерения, связанное с тем, что ПОЛЬЗОВАТЕЛЬ никогда не слышит ИНФОРМАЦИОННЫЙ СИГНАЛ о завершении измерения;
3) высокая температура отказ дисплея/электроники;
4) вода/влажность отказ дисплея/электроники;
d) ПАЦИЕНТ:
1) укол об устройство;
2) прокол тканей;
3) измерение в неверной области (например, нос, ухо, подмышки и т.д.);
4) считывание показаний:
- удержание в перевернутом состоянии во время считывания показаний некорректное считывание показаний;
- неверные единицы измерения (°С вместо °F);
- общее неверное считывание значений (например, считывание как единица вместо семерки);
e) Гигиена:
1) перекрестное загрязнение между ПАЦИЕНТАМИ;
2) перекрестное загрязнение между областями измерения одного ПАЦИЕНТА;
f) Применение:
1) недостаточно глубокая область измерения;
2) время измерения слишком мало для установления температурного равновесия;
3) область измерения не находится в температурном равновесии (например, ПАЦИЕНТ проглотил холодную жидкость перед измерением).
Н.2.3.4 Требования к задачам:
a) легкое удаление защитного чехла;
b) легко распознаваемая область захвата и измеряющая часть;
c) нескользящая поверхность области захвата;
d) гладкая поверхность части, вводимой в тело;
e) легко распознаваемая кнопка включения со звуковым и визуальным отображением того, что термометр готов к использованию;
f) четкий ИНФОРМАЦИОННЫЙ СИГНАЛ о завершении измерения;
g) четкое отображение измеренного значения;
h) ручное или автоматическое отключение;
i) легкая чистка устройства;
j) легкая идентификация загрязненных поверхностей;
k) маркировка максимальной глубины введения;
I) физические средства защиты от слишком глубокого введения;
m) легкая чистка защитного чехла.
Н.2.3.5 Условия использования
См. Н.2.1.2.5.
Н.2.3.6 Информация об ОПАСНЫХ СИТУАЦИЯХ, возникновение которых известно для сходных устройств
Включено в Н.2.3.3.
Н.2.3.7 Получаемые ОПАСНЫЕ СИТУАЦИИ и ВРЕД
a) Нет показаний отложенная терапия.
b) Некорректные показания отложенная или некорректная терапия.
c) Прокол тканей травма, кровотечение, инфекция и т.д.
d) Поглощение токсичных материалов с дисплея отравление.
е) Введение загрязнения в тело инфекция.
Н.2.3.8 Предварительный обзор концепции ПОЛЬЗОВАТЕЛЬСКОГО ИНТЕРФЕЙСА
Примечание - Этот обзор может быть проведен с использованием комбинации подробного когнитивного анализа, испытания модели раннего прототипа.
a) Удаление защитного чехла:
1) защитный чехол удаляется без проблем.
Заключение: нет проблем.
b) Включение:
1) кнопку включения/выключения сложно нажать ПАЦИЕНТАМ с большими руками.
Заключение: размеры/углубление под кнопку включения/выключения необходимо пересмотреть.
c) Размещение устройства в корректное положение в ротовой полости или прямой кишке:
1) область захвата и измеряющая часть должны быть четко маркированы;
2) гладкая поверхность части, вводимой в тело;
3) максимальная глубина четко маркирована;
4) нет физических средств, препятствующих слишком глубокому введению;
5) в ЭКСПЛУАТАЦИОННОЙ ДОКУМЕНТАЦИИ нет никаких картинок, показывающих корректное размещение.
Заключение: конструкция очень понятная, за исключением того, что возможен слишком глубокий ввод, т.к. нет физических средств, предотвращающих слишком глубокий ввод.
Рассмотреть возможность добавления физических средств и добавления картинок в ЭКСПЛУАТАЦИОННУЮ ДОКУМЕНТАЦИЮ.
d) Дисплей с показаниями:
1) размер шрифта на дисплее четко различим при log MAR 0,2;
2) однозначное отображение измеренного значения.
Заключение: нет проблем.
e) Чистка:
1) могут использоваться все типичные неабразивные чистящие средства, доступные в домашнем хозяйстве (например, спирт, средство для посудомоечных машин, мыло, косметические средства, ацетон, бензин и т.п.);
2) инструкции по чистке включены в ЭКСПЛУАТАЦИОННУЮ ДОКУМЕНТАЦИЮ;
3) нет окружающих выступов или щелей;
4) простая визуальная идентификация загрязненных поверхностей.
Заключение: нет проблем.
f) Замена батареи:
1) необходимо вспомогательное приспособление для открытия дверцы отсека для батарейки;
2) маркировка типа и полярности на батарее не очень четкая;
3) маркировка типа и полярности на термометре четкая;
4) тип батарейки общедоступный, который можно быстро найти.
Заключение: рассмотреть вопрос об изменении конструкции отсека для батареек и дверцы отсека.
g) Захват/удержание устройства:
1) материал поверхности приятен при тактильном контакте;
2) в области захвата нескользкая поверхность.
Заключение: нет проблем.
h) Слышимость информационного сигнала о завершении измерения:
1) звуковой ИНФОРМАЦИОННЫЙ СИГНАЛ о завершении измерения может быть скрыт окружающим шумом.
Заключение: изменить амплитуду и частоту определенного звука так, чтобы его было слышно на фоне окружающего шума.
i) Удаление устройства из ПАЦИЕНТА:
1) удаляется легко.
Заключение: нет проблем.
j) Выключение:
1) ручное выключение: см. Н.3.3, перечисление j);
2) автоматическое выключение после выполнения измерения.
Заключение: размеры/углубление под кнопку включения/выключения необходимо пересмотреть.
k) Хранение:
1) защитный чехол сконструирован так, чтобы его было легко чистить, если он вступает в контакт с возможно загрязненной рабочей частью.
Заключение: изменить конструкцию защитного контейнера для хранения.
Н.3 Спецификация ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ
Н.3.1 Общие положения
a) МЕДИЦИНСКОЕ ИЗДЕЛИЕ:
Электронный термометр с числовым дисплеем, тип 5 GW
b) Исходные данные:
1) предполагаемое применение - см. Н.2.1;
2) возможные ОШИБКИ ЭКСПЛУАТАЦИИ/ПРИМЕНЕНИЯ - см. Н.2.3.3;
3) опасные ситуации или ВРЕД, связанные с применением - см. Н.2.3.7;
4) условия применения:
- окружающий шум от улицы;
- применение смазки на измеряющей части;
5) предварительно определенные сценарии применения:
- поиски термометра в прикроватной тумбочке;
- удаление защитного чехла с устройства;
- введение термометра в область измерения.
Н.3.2 Сценарии использования
Худший случай сценария применения, служащий основой для ВАЛИДАЦИИ с ПАЦИЕНТОМ-ПОЛЬЗОВАТЕЛЕМ:
a) Ректальное измерение в кровати:
- ПОЛЬЗОВАТЕЛЬ/ПАЦИЕНТ - взрослый;
- сильный жар 40,5°С, потливость, сонное состояние;
- одет в одежду для сна;
- дома один в спальне;
- лежит в кровати;
- корректирующие линзы находятся вне пределов досягаемости;
- низкая внешняя освещенность (маленькая лампочка на 40 Вт рядом с кроватью);
- телевизор включен с высоким уровнем громкости;
- измерение начинается;
- прерывается телефонным звонком (отвлекается внимание, заглушается звуковой ИНФОРМАЦИОННЫЙ СИГНАЛ);
- дожидается информационного сигнала об окончании измерения;
- удаляет термометр из области измерения;
- очищает термометр;
- считывает результат;
- выключает;
- очищает еще раз;
- одевает защитный чехол;
- убирает термометр в прикроватную тумбочку.
b) Использование не в кровати:
- ПАЦИЕНТ является ПОЛЬЗОВАТЕЛЕМ:
Не рассматривается (не считается худшим случаем сценария использования).
c) Использование в кровати:
- ПАЦИЕНТ не является ПОЛЬЗОВАТЕЛЕМ.
Не рассматривается (не считается худшим случаем сценария использования).
d) Использование не в кровати:
- ПАЦИЕНТ не является ПОЛЬЗОВАТЕЛЕМ.
Не рассматривается (не считается худшим случаем сценария использования).
e) Использование не в кровати:
- ПАЦИЕНТ является ПОЛЬЗОВАТЕЛЕМ-ребенком;
- некорректные условия измерения (время, положение и т.д.);
- ребенок самостоятельно проводит измерения, поместив термометр в промежуточное положение, не указанное в инструкции по эксплуатации и изменив положение через 10 с.
Н.3.3 Действия ПОЛЬЗОВАТЕЛЯ, связанные с основной рабочей функцией
a) удаление защитного чехла с устройства;
b) включение устройства;
c) помещение устройства в корректную область измерения;
d) считывание результата с дисплея;
e) очистка устройства после использования;
f) замена батареек, если необходимо;
g) захват/удержание устройства при его использовании;
h) определение на слух информационного сигнала завершения измерения;
i) удаление устройства из области измерения;
j) выключение устройства после использования;
k) одевание защитного чехла;
I) хранение устройства, пока оно не используется.
Н.3.4 Требования к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ для основных рабочих функций
a) Удаление защитного чехла:
- легкое удаление и одевание одной рукой;
b) Включение и выключение (кнопка включения/выключения):
- легкое определение на ощупь положения кнопки;
- утопленное положение для предотвращения случайного срабатывания;
- отсутствие щелей вокруг кнопки для облегчения чистки;
- автоматическое выключение;
- нажатие кнопки в течение более 3 с необходимо для предотвращения случайного выключения во время измерения;
c) Дисплей для отображения показаний (дисплей):
1) дисплей четко различим при условиях видимости, см. Н.2.1.2.5, перечисление а);
2) дисплей утоплен на 2 мм для защиты от поломки и разбивания;
3) четыре цифры - ХХХ.у и единицы измерения:
- XXX - целые числа: высота 8 мм;
- у - десятичный знак: высота 5 мм;
- единица измерения: высота 2 мм для "°" и 8 мм для "С" или "F";
4) символ для отображения на дисплее низкого уровня заряда батареи;
5) символ для отображения на дисплее низкой температуры;
6) переворачивание должно быть четко различимо за счет использования, например шрифта Arial и не 7-сегментного отображения;
d) Захват/удержание устройства.
Примечание - Эти требования очень близки к требованиям, касающимся корректного расположения устройства в корректной области в ротовой полости или прямой кишке, и к чистке и удалению устройства.
e) Поверхность и материал:
1) достаточно прочный, чтобы выдерживать:
2) силу разрушения в 135 Н (сесть/лечь/встать на термометр);
3) падение с 1,5 м на твердый пол;
4) светлый цвет поверхности для легкого распознавания загрязненных областей;
5) текстура для надежного удержания поверхностей захвата;
f) Область захвата:
1) толщина: от 8 до 10 мм;
2) высота: от 13 до 15 мм;
3) длина: от 60 до 65 мм;
g) Участок измерения:
1) цилиндрическая форма с закругленными краями;
2) диаметр: от 3 до 5 мм;
3) длина: от 50 до 55 мм;
4) закругленные края;
5) отсутствие щелей для облегчения очистки;
6) гладкая поверхность;
7) маркировка максимальной глубины введения - 45 мм;
h) Звуковой ИНФОРМАЦИОННЫЙ СИГНАЛ "измерение завершено":
1) частота: от 750 до 850 Гц;
2) уровень давления звука от 70 до 76 дБА на расстоянии 1 м;
i) Замена батареек (отсек для батарейки):
1) четкая индикация соответствующей полярности и соответствующего типа батареи;
2) внутренняя БЕЗОПАСНОСТЬ: некорректная установка батарейки не разрушает устройство;
3) легкая замена батареек людьми со сниженной тонкой моторикой рук и пальцев;
j) Чистка:
1) отсутствие окружающих выступов или щелей для легкой очистки;
2) может использоваться сравнение со всеми типичными чистящими веществами;
k) Хранение:
1) не требуется специальных условий;
I) Эксплуатационная документация - рассматриваемые вопросы:
1) перегрев (воздействие солнца, кипятка и т.д.) перегрев отказ дисплея
отсутствие/некорректные показания;
2) вода/влажность отказ дисплея/электроники;
3) давление отказ дисплея;
4) разбивание устройства;
5) прокол тканей;
6) неверная область измерения (например, нос);
7) перекрестное загрязнение между ПАЦИЕНТАМИ;
8) перекрестное загрязнение на/в одном ПАЦИЕНТЕ;
9) измеряющая область расположена недостаточно глубоко;
10) слишком глубокое введение;
11) достижение равновесия измеряемой температуры;
12) тип батареек и инструкции по замене батареек;
13) удаление до звучания информационного сигнала завершения измерения.
Н.3.5 Требования к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ для сценариев использования, которые часто используются или касаются БЕЗОПАСНОСТИ
a) Должно быть легко выполнить всю процедуру измерения после прочтения ЭКСПЛУАТАЦИОННОЙ ДОКУМЕНТАЦИИ:
1) процедура измерения, включая следующие функции:
- извлечение устройства из коробки для хранения;
- удаление защитного чехла;
- включение устройства;
- помещение устройства в корректную область в ротовой полости или прямой кишке;
- определение на слух информационного сигнала завершения измерения;
- удаление устройства из области измерения;
- считывание результата с дисплея;
- выключение устройства после использования;
- очистка устройства после использования;
- помещение устройства обратно в коробку для хранения;
b) Процедура замены батареек должна быть простой для выполнения с использованием инструкций, включенных в ЭКСПЛУАТАЦИОННУЮ ДОКУМЕНТАЦИЮ;
c) Текстовая версия: язык предполагаемого ПОЛЬЗОВАТЕЛЯ;
d) Размер шрифта минимум 12 пунктов;
e) Ясные для понимания рисунки для ПОЛЬЗОВАТЕЛЕЙ, не понимающих язык приведенной версии;
f) Использование только тех символов, для которых доказано, что они интуитивно понятны предполагаемым ПОЛЬЗОВАТЕЛЯМ.
Н.3.6 Требования для определения, являются ли основные рабочие функции простыми для понимания ПОЛЬЗОВАТЕЛЕМ
a) Распаковка:
- нет дополнительных требований к ПОЛЬЗОВАТЕЛЬСКОМУ ИНТЕРФЕЙСУ, см. Н.3.4;
b) Включение:
- маркировка кнопки включения/выключения хорошо видна;
- кнопка так расположена, что ее легко найти;
c) Расположение устройства в корректном положении в ротовой полости или прямой кишке:
- нет дополнительных требований, см. Н.3.4;
d) Считывание показаний дисплея:
- нет дополнительных требований, см. Н.3.4;
e) Очистка:
- нет дополнительных требований, см. Н.3.4;
f) Замена батареек:
- нет дополнительных требований, см. Н.3.4;
g) Захват/удержание устройства:
- нет дополнительных требований, см. Н.3.4;
h) Определение на слух информационного сигнала окончания измерения:
- нет дополнительных требований, см. Н.3.4;
i) Удаление устройства:
- нет дополнительных требований, см. Н.3.4;
j) Выключение:
- нет дополнительных требований, см. Н.3.4;
k) Хранение:
- нет дополнительных требований, см. Н.3.4.
Окончание спецификации.
Приложение I
(справочное)
Рекомендуемый список литературы
I.1 Введение
В настоящем приложении приведен расширенный список литературы, в котором представлена наиболее важная доступная литература в данной области. Не ожидается, что ПОЛЬЗОВАТЕЛИ настоящего стандарта прочитают все эти публикации, однако они включены, т.к. они полезны для тех, кто работает в данной области. Книги, отмеченные звездочкой (*), считаются более полезными для прочтения в качестве вводных для новичков в данной области.
I.2 Общие темы при проектировании с учетом человеческого фактора
BEYER, Н. & HOLTZBLATT, K. (1998) Contextual Design - Defining Customer-Centered Systems. Morgan Kauffamann
CARROLL, J.M. (1995). Scenario-Based Design: Envisioning Work and Technology in System Development. New York: John Wiley and Sons. A collection of papers on the nature of use-oriented design representations (i.e., scenarios) and the contributions they can make in development of usable computer applications and systems
DRURY, С.G., PRABHU.P., and GRAMOPADHYE, A. (1990). Task analysis of aircraft inspection activities: Methods and findings. Proceedings of the Human Factors Society 34th. Annual Meeting. Santa Monica, CA: Human Factors and Ergonomics Society, pp.1131-1185
FLEISHMAN, E.A., and QUAINTANCE, M.K. (1994). Taxonomies of human performance: The description of human tasks. Orlando: Academic Press
HACKOS, J.T. & REDISH, J.С. (1993) User and Task Analysis for Interface Design. John Wiley & Sons, Inc
* HORTON, W., K. (1994). Designing and Writing Online Documentation: Helpfiles to Hypertext. New York: John Wiley and Sons, Inc. A primer on online documentation, including the question as to whether documentation should or should not be online, and a style guide for effective human-computer dialogs if online documentation proves to be appropriate
JONASSEN., D.L., HANNUM, W.H., and TESSMER, M. (1999). Handbook of Task Analysis Procedures, Westport: Greenwood Publishing Group
KLEIN, G.A., ORASANU, J., CALDERWOOD, R., and ZSAMBOK, С.E. (1993). Decision Making in Action: Models and Methods. Norwood. New Jersey: Ablex Publishing Corp
LAUGHERY, K.R. Sr., and LAUGHERY, K.R. Jr. (1987). Analytic techniques for function analysis. In G. Salvendy (Ed.), Handbook of Human Factors. New York: Wiley, pp.330-354. This chapter reviews analytic techniques such as flow analysis, time-line analysis, and network analysis, which are used to understand and model complex systems. It focuses on Interactions among system components including people and the flow of materials or information
MEISTER, D. (1985). Behavioral Analysis and Measurement Methods. New York: John Wiley & Sons. Provides descriptions and critical analyses of pragmatic approaches to behavioral analysis in the design of human-machine systems and of measurement systems in the evaluation of prototype and fielded human-machine systems
* NORMAN: D. (1983). The Design of Everyday Things. New York: Basic Books. Provides numerous examples of the frustrations associated with the operation of everyday things, offering user-centered design as a remedy to the poor designs that are the source of the problem
ROUSE, W.B. (1980). Systems Engineering Models of Human-Machine Interaction. New York: North Holland. Basic tutorials on mathematical models used by human factors engineering to describe human-machine interaction. Models discussed include estimation theory, control theory, queueing theory, fuzzy set theory, production systems, pattern recognition, and Markov chains
ROUSE, W.B. (1991). Design for Success: A human-centered approach to designing successful products and systems. New York: Wiley-lnterscience. Provides a comprehensive methodological framework for human-centered design of products and systems that covers the entire product life cycle
SALVENDY, G. (Ed.) (1997). Handbook of Human Factors and Ergonomics: Second Edition. New York: John Wiley and Sons. A comprehensive compilation of papers covering theoretical and practical issues of a wide range of human factors topics, including from the fundamentals of human factors, job design, environmental design, performance modeling, system evaluation, and human-computer interaction
* SANDERS, M.S. and McCORMICK: E.J. (1993). Human Factors in Engineering and Design: Seventh Edition. New York: McGraw-Hill. A basic human factors text providing integrative summaries of the systems perspective, human factors research methodologies, aspects of the interfaces between humans and the system of which they are a part (e.g., displays, controls, anthropometric considerations, and environmental factors), and various applications of human factors
SCHULER, D. and NAMIOKA, A. (1993) Participatory Design: Principles and Practices. Hillsdale, NJ: Lawrence Erlbaum Associates. Describes methods such as model building that involve users directly in the design process
SHARIT, J. (1997). Allocation of functions. In G. Salvendy (Ed.), Handbook of Human Factors and Ergonomics [2nd edition], (pp.301-339). New York: Wiley. This chapter examines the assignment of system functions to human and machine agents. It summarizes a number of analytic techniques, noting the relationship between static and dynamic function allocation for each
SINCLAIR, M.A. (1990). Subjective assessment. In J.R. Wilson and E.N. Corlett (Eds.), Evaluation of human work. London: Taylor & Francis, pp. 58-88
* WICKENS, С. (1992). Engineering psychology and human performance (2nd Ed.). Columbus, Ohio: Harper Collins Publishers. A basic human factors text that summarizes a wide range of topics from theoretical psychology and human factors research
WIENER, E.L., and Nagel, D.С. (Eds.). (1988). Human factors in aviation. San Diego: Academic Press WOODSON, W.E., Tilman. В., & Tilman, P. (1992). Human factors design handbook: information and guidelines for the design of systems, facilities, medical device, and products for human use. (2nd edition). New York: McGraw Hill. An application-oriented guide to human factors design (organized by system domains such as architecture, transportation, space and Industrial) that provides recommendations and guidelines for designers
I.3 Человеческая ошибка
CASEY, S.E. (1993). Set Phasers on Stun (and other true tales of design, technology, and human error). San Barbara, CA: Aegean Publishing Company. A compilation of stories about system failures that result from incompatibilities between the way things are designed and the way people actually perceive, think, and act
* REASON, J. (1990). Human Error. Cambridge, England: Cambridge University Press. Offers theoretical ground for a systems approach to human error and relates the theory to practical issues, system failures, and reducing the human error risk
REASON, J. (1997). Managing the Risks of Organizational Accidents. Hampshire: England: Ashgate. A systems approach to the assessment and control of risk, system defences, error management, and safety
ROUSE, W.B. (1990). Designing for human error: Concepts for error tolerant systems. In H. R. Booher (Ed.), MANPRINT: An approach to system integration. New York: Van Nostrand Reinhold. Rouse discusses an error classification scheme developed through the analysis of error data from several large-scale industries and, in turn, the use of this scheme to design and incorporate error-tolerant mechanisms in the associated systems
SWAIN, A.D., and GUTTMANN, H.E. (1983). Handbook of Human Reliability Analysis with Emphasis on Nuclear Power Plant Applications (NUREG/CR-1273). Washington. DC: Nuclear Regulatory Commission. Presents technique for predicting human error probabilities in connection with medical device functioning, operational procedures, and other factors that shape human performance
KOHN, L.T., CORRIGAN, J.M., DONALDSON, M.S. (2000). To Err is Human: Building a Safer Health System. Washington, DC: National Academy Press. This book summarizes the work of a committee sponsored by the Institute of Medicine (part of National Research Council) to investigate medical errors and suggest solutions, it provides broad and, occasionally, controversial guidance, including many specific suggestions about nationwide reporting systems and additional accountability measures. It contains many useful references and discussions about errors related to medical device design and the role of the FDA
I.4 Взаимодействие компьютера и человека
BROWN, C.M. (1989). Human-Computer Interface Design Guidelines. Norwood, NJ: Ablex Publishing Company. Practical guidelines and rules of thumb to aid software designers in developing user-oriented human-computer interfaces
CONSTANTINE, L.L. and LOCKWOOD, L.A.D. Software for Use: A Practical Guide to the Models and Methods of Usage-Centered Design. ACM Press: New York, NY. 1999. Guides the reader through a structured user interface design process and also provides concrete advice on window layout, menu design, user assistance, icons, and controls
COOKE, N.J. Varieties of knowledge elicitation techniques. Int'l J Human-Computer Studies. 1994:41, pp.801-849
DIX. A., FINLAY J., ABOWD G., and BEALE, R. (1993) Human-Computer Interaction. New York: Prentice-Hall. Provides detailed information about humans abilities, computer's abilities, and the different ways that they can interact, includes multimedia and web information
ELLIS, S.R.t BEGAULT, D.R., and WENZEL E.M. (1997). Virtual environments as human-computer interfaces. In M.G.Helander, Т.K.Landauer, and P.V.Prabhu (Eds.), Handbook of human-computer interaction. Amsterdam: Elsevier, pp.163-201
HELANDER. M.G., LANDAUER, Т.K., and PRABHU, P.V., Eds. (1997). Handbook of Human-Computer Interaction (2nd ed). Amsterdam: North-Holland. Summarizes HCI research and provides recommendations that can be generalized across all domains and for all applications
HOLTZBLATT, K., and JONES, S. (1993). Contextual inquiry: Principles and practice. In D.Schulerand A.Namioka (Eds.), Participatory Design: Principles and Practice. Hillsdale, NJ: Erlbaum
JACKO, J.A. and SEARS, A. (Eds.). (2002): Handbook of Human Computer Interaction in Interactive Systems. Mahwah: NJ: L.Erlbaum
PREECE, J., ROGERS, Y., SHARP, H., BENYON, D. (1994) Human-Computer Interaction. New York: Addison-Wesley. Provides an introduction into HCI, covers the human aspects, the technology aspects, interaction design, design methods, how to support the design, and evaluation methods
* SHNEIDERMAN, В. (1998). Designing the User Interface: Strategies for Effective Human Computer Interaction (third edition). Reading, MA: Addison Wesley Longman. Information and practical applications for both practitioners as well as researchers. Includes information about multimedia and World Wide Web design
I.5 ЭКСПЛУАТАЦИОННАЯ ПРИГОДНОСТЬ
* BIAS, R.: and MAYHEW, D. (1994). Cost Justifying Usability. Cambridge, MA: Academic Press. Edited chapters covering topics related to the financial costs of the usability engineering process and justifying those costs
* DUMAS, J., and REDISH. J.С. (1999). A Practical Guide to Usability Testing Revised Edition. Intellect Books: Norwood, NJ. Explains the methods of usability engineering and reviews many techniques for assessing and assuring usability throughout the development process. Presents all the steps in planning and conducting a usability test, analyzing data, and using the results to improve both products and services
KIRWAN, B. and AINSWORTH, L.K. (1992) A Guide to Task Analysis. London, UK: Taylor & Francis. Provides a compendium of task analysis techniques and detailed case studies. Techniques described in this book include: charting and network analysis, decomposition, hierarchical task analysis, link analysis, operational sequence diagrams, and time-line analysis
MAYHEW, D. The Usability Engineering Lifecycle: A Practitioner's Handbook for User Interface Design. Morgan Kaufmann: San Francisco, CA, 1999. This is a detailed blueprint of the USABILITY ENGINEERING life cycle and contains a wealth of practical advice. Each chapter discusses usability engineering tasks, roles, resources, levels of effort, short cuts (quick and dirty techniques to use when a rigorous approach isn't possible), web notes, and sample work products and templates
* NIELSEN, J. (1993). Usability engineering. San Diego: Academic Press, Inc. An introduction to usability engineering that contains a description of the usability engineering lifecycle, as well as various usability assessment and testing methods, pp.155, 296
RUBIN, J. (1994). Handbook of Usability Testing: How to Plan, Design, and Conduct Effective Tests. New York: John Wiley & Sons, Inc. Presents a step-by-step approach to usability testing in an industrial production environment
WIKLUND, M.E. (Ed.). (1994). Usability in practice - how companies develop user-friendly products. Cambridge, MA:- Academic Press. A guide to the human factors design of user-centered products. This edited book examines how 17 different companies are ensuring usability in the design of their products
I.6 Человеческий фактор в медицине
ALLAN, Е. and BARKER, К. (1990). Fundamentals of medication error research. Am. J. of Hosp. Pharm. 47:555-571. A review of the types of human errors found with medication and methods of error detection
BERGEUR, R. (1999). Surgery and Ergonomics: Arch. Surg. 134:1011-1016. This paper considers the ergonomic issues associated with the performance of surgery, including the design and use of surgical instruments
BOGNER, M.S. (Ed.). (1994). Human Error in Medicine. Hillsdale, NJ: Lawrence Erlbaum Associates. A compilation of papers, authored by leading authorities on the analysis of human error, that cover theoretical and practical issues of human error in medicine
BOGNER, M.S. (Ed.). (2003): Misadventures in Health Care: Inside Stories
BOGNER, M.S.: Human Error in Health Care: A Handbook of Issues and Indications. Mahwah, NJ: Lawrence Erlbaum Associates (in Press)
BOTNEY, R. and GABA, D.M. (1995). Human factors issues in monitoring. In: Blitt. CD and Hines, RL. editors. Monitoring In Anesthesia and Critical Care Medicine. 3rd edition. Churchill Livingstone: New York, NY. pp.23-54. A general discussion of information processing in monitoring, and basic design principles and HF considerations for displays, controls, and alarms
BRIDGER, R.S., & POUTA, M.A. (1993): Ergonomics: Introducing the human factor into the clinical setting. Journal of Clinical Engineering May/June, 180-188. A general discussion of the Issues involved and the importance of applying human factors engineering to the clinical setting
BROWN, D. (1996). The challenges of user-based design in a medical device market. In D. Wixon and Ramey (Eds,), Field Methods Casebook for Software Design. New York: Wiley pp.157-176. Case study of field research methods applied to user-centered design of medical device
CARAYON, P. (Ed) Handbook of Human Factors and Ergonomics in Healthcare and Patient Safety, Lawrence Erlbaum (in press, 2006)
CUMMINS, R.O., CHESEMORE, K., WHITE, R.D., and the FDA Defibrillator Working Group. (1990). Defibrillator failures: Causes and problems and recommendations for improvement. Journal of the American Medical Association. 264(8). 1019-1025. Discusses a cooperative effort between health care and industry professionals to alert defibrillator users of likely errors and describes the development of a pre-use checklist related to defibrillator readiness and maintenance
HENRIKSEN, K., KAYE, R.D., JONES, R., MORISSEAU, D. S., and SERIG, D.I. (1995). Human factors evaluation of teletherapy. (NUREG/CR-6277, Volumes 1-5) Washington, D.C.: U.S. Nuclear Regulatory Commission. Describes a systematic evaluation of the system for teletherapy identifies human factors problems in teletherapy (i.e., tasks that humans within the teletherapy system are not likely to perform to the level required by that system), and identifies and evaluates approaches for addressing those problems
GABA, D.M. (1994). Human work environment and simulators. In R. D. Miller (Ed.), Anesthesia (Fourth Edition). New York: Churchill Livingstone, pp.2635-2680. An overview of performance shaping factors in anesthesia care and of the use of realistic clinical simulators for testing of critical care medical devices
GOPHER, D., OLIN, M., BADIHI, Y., COHEN, G., DONCHIN, Y, BIESKI, M., and COTEV, S. (1989). The nature and causes of human errors in a medical intensive care unit. Proceedings of the Human Factors Society 33rd Annual Meeting (pp.956-960). Santa Monica, CA: Human Factors Society. Describes the results of a two-year study conducted in a respiratory intensive care unit, in which errors were recorded and analyzed
GOSBEE, J.W. (1997). The discovery phase of medical device design: A blend of intuition, creativity, and science. Medical Device & Diagnostic Industry, Vol. 19, pp.79-S2*. Using human factors methods in the early stages of device development enables designers to meet the needs of end-users
________________
* Текст документа соответствует оригиналу. - .
GOSBEE, J.W., and Ritchie, E.M. (1997). Human-Computer Interaction and Medical Software Development. Interactions. Vol. 4, no. 4, New York: ACM Press pp.13-15. Describes and gives examples of the unique methods, resources, and considerations for doing human factors engineering in a medical setting
GURUSHANTHAIAH, K.; WEINGER, M.В., and ENGLUND, С.E. (1995). Visual display format affects the ability of anesthesiologists to detect acute physiological changes. Anesthesiology 83:1184-1193. Describes a scientific laboratory based approach to the evaluation of a clinical display. Demonstrates the importance of studying actual users (e.g., anesthesiologists) who yielded different results than educated non-clinicians
JOHNSON, С.Ed. (1999). Proceedings of the First Workshop in Human Error and Clinical Systems (HECS 99) (Glasgow Accident Analysis Group Technical Report G99-1). Glasgow, Scotland: Department of Computer Science, University of Glasgow. Proceedings of a conference held April 15-17, 1999. Includes papers on medical incident reporting, diagnosis and treatment support tools, medical risk analysis, and human error in the medical workplace
LEAPE, L.L., BRENNAN, T.A., LAIRD, N., LAWTHERS, A.G., LOCALIO, A.R., BARNES, B.A., HERBERT, L., NEWHOUSE, J.P., WEILER, P.C., and HIATT, H. (1991). The nature of adverse events in hospitalized PATIENTS: Results of the Harvard Medical Practice Study II. New England Journal of Medicine, 324 (6):377-331. This study looks in detail at the incidence of hospital-based medication errors
LE COCQ, D. (1937). Application of human factors engineering in medical product design. Journal of Clinical Engineering, 12 (4):271-277. Description of the HFE design process utilizing applications to a family of infusion devices to illustrate the methodologies
LOEB, R., WEINGER, M.В., and ENGLUND, С.E. (1993). Ergonomics of the anesthesia workspace. EHRENWERTH, J. and EISENKRAFT, J.В., editors. Anesthesia Medical device: Principles and Applications. Mosby Year Book, Malvern, PA. pp.385-404. A general review of HFE issues in the anesthesia work domain
VOORHORST, F., OVERBEEKE, C., and SMETS, G. (1998). Spatial perception during laparoscopy: implementing action-perception coupling. In Proceedings of Medicine Meets VR-5, San Diego, CA, Jan. 22-25, 379-386. A summary of some of the HFE issues associated with laparoscopic instruments
WEBSTER, J.G., (Ed.) (1997). Design of Pulse Oximeters. Institute of Physics Publishing, Philadelphia, PA. Describes the equations, methods, hardware, and software needed to make a pulse oximeter, which provides early information on problems with the delivery of oxygen to tissue
WEINGER, M.В., HERNDON, O.W., and GABA, D.M. (1997). The effect of electronic record keeping and transesophageal echocardiography on task distribution, workload, and vigilance during cardiac anesthesia. Anesthesiology 87:144-155. Describes the use of objective HFE techniques (including time-motion analysis, workload analysis, and secondary task probing) to study in the actual work domain the effects of the introduction of new medical technologies on users' clinical performance
* WIKLUND, M.E. (1995). Medical device and medical device design: Usability Engineering and Ergonomics. Englewood, Colorado: Interpharm Press Inc. Practical guidance on how to incorporate human factors engineering principles into the design of medical devices and medical device, including the software, hardware, and paper-based components. It also serves as a primer on an assortment of design and evaluation techniques, such as task analysis, user interface design, rapid prototyping, and usability
* WIKLUND, M.E. and WILCOX, S.B. (2005) (Eds) Designing Usability into Medical Products, CRC Press
WRIGHT, J.G., McGEER, A.J., CHYATTE, D., RANSOHOFF, D.F. (1991). Mechanisms of glove tears and sharp injuries among surgical personnel. Journal of the American Medical Association, 266. 1668-1671. Describes the ways in which glove tears and sharp injuries occur as a prelude to design improvements
I.7 Международные публикации
Association for the Advancement of Medical Instrumentation. (1993). Human factors engineering guidelines and preferred practices for the design of medical devices. ANSI/AAM HE 48-1993. Arlington, VA: AAMI. This is the previous version of the current AAMI HFE 48:2000. The information is still relevant but has been expanded in the current version
American National Standards Institute. (1988). American National Standard for human factors engineering of visual display terminal workstations. ANSI/HFS 100-1938. New York: ANS The ANSI version of the first nine parts of ISO 9241, this standard provides ergonomic guidance and requirements for the design of video display terminals, including visual displays, keyboards and other input devices, and workstation/computing environments
International Organization for Standardization. (1996). Ergonomic requirements for office work with visual display terminals (VDTs) - Parts 10-17. ISO 9241 series. Geneva, Switzerland. This standard provides detailed user interface design guidance for office systems software. The individual parts cover dialogue boxes, form filling, menus, command, and direct manipulation dialogues, presentation of information, and user guidance
National Committee for Clinical Laboratory Standards. (1996) Laboratory instruments and data management systems: Design of software user interfaces and user software systems validation, operation, and monitoring. NCCLS GP-19-P. Villanova, PA: NCCLS. Describes software design principles that will facilitate the safe, efficient use of clinical laboratory diagnostic medical device
U.S. Department of Defense. (1996). Department of Defense design criteria standard. MIL-STD-1472F. Washington, D.C.: DOD. A general guidelines document pertinent to systems design of military systems, although not directly applicable to medical systems
U.S. Department of Defense. (1998). Human engineering design guidelines. MIL-HDBK-759C. Washington, D.C.: DOD. A handbook covering the general area of human factors. As in MIL-STD-1472F, this is a handbook, designed to provide guidelines, not standards
U.S. Department of Defense. (1998). Human engineering program processes and procedures, MIL-HDBK-46S55A. Washington D.C.: DOD. A general guideline on human engineering program processes and procedures
BACKINGER, C., and KINGSLEY, P. (1993). Write it right: Recommendations for developing user instruction manuals for medical devices used in home health care, (HHS Pub. FDA 93-4258). Rockville, MD.: U.S. Department of Health and Human Services, Food and Drug Administration. A brief document that provides FDA recommendations for writing instruction manuals for home-use medical devices
KAY, R. and CROWLEY, J. (2000). Medical Device Use - Safety: Incorporating Human Factors Engineering into Risk Management. Washington. D.C.: U.S. Health and Human Services, Food and Drug Administration. A guidance document that describes the human factors process in the risk management context and makes recommendations for relevant materials for inclusion in pre-market submissions
SAWYER, D. (1996). Do It By Design: An Introduction to Human Factors in Medical Devices. Washington DC: U.S. Health and Human Services, Food and Drug Administration. A primer that discusses user interface problems, design rules-of-thumb, and human factors process in medical devices based upon the experiences of the FDA staff
ISO 13407:1999, Human-centred design processes for interactive systems
ISO 13529:2000, Ergonomics - Ergonomics of human-system interaction - Human-centred lifecycle process descriptions
I.8 Интернет-ресурсы
U.S. Food and Drug Administration - http://www.fda.gov/cdrh/humanfactors
Human Factors and Ergonomics Society - http://www.hfes.org
Association for Computing Machinery, Special Interest Group on Computer-Human Interaction - http://www.acm.org/sigchi
Приложение J
(справочное)
Ссылки на основные принципы
Настоящий стандарт подготовлен для поддержки основных принципов БЕЗОПАСНОСТИ и рабочих характеристик МЕДИЦИНСКИХ ИЗДЕЛИЙ в соответствии с ИСО/ТО 16142. Согласно своему предназначению, настоящий стандарт подходит для целей оценки соответствия.
Соответствие настоящему стандарту обеспечивает один способ демонстрации соответствия специальным основным принципам ИСО/ТО 16142. Возможны другие способы. В таблице J.1 приведено соответствие разделов и подразделов настоящего стандарта основным принципам ИСО/ТО 16142.
Таблица J.1 - Соответствие между настоящим стандартом и основными принципами
Раздел(ы)/подраздел(ы) настоящего стандарта | Соответствующий основной принцип | Комментарии |
Все | А.1, А.2, А.3, А.9.2, А.10.2, А.12.8 | - |
4.1.3, раздел 6 | А.13 | - |
5.9 | А.6 | - |
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 14971:2007 | IDT | ГОСТ ISO 14971-2011 "Изделия медицинские. Применение менеджмента риска к медицинским изделиям" |
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: | ||
Библиография
[1] | МЭК 60601-1:2005 | Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик |
IEC 60601-1:2005 | Medical electrical equipment - Part 1: General requirements for basic safety and essential performance | |
[2] | МЭК 60601-1-3:2005 | Изделия медицинские электрические. Часть 1-3. Общие требования безопасности. Вспомогательный стандарт. Общие требования, испытания и руководство для систем извещения в медицинском электрооборудовании и медицинских электрических системах |
IEC 60601-1-3:2006 | Medical electrical equipment - Part 1-3: General requirements for safety - Collateral standard: General requirements, tests and guidance for alarm systems in medical electrical equipment and medical electrical systems | |
[3] | МЭК/ТО 61258:1994 | Руководство по разработке и использованию учебных материалов по медицинскому электрооборудованию |
IEC/TR 61258:1994 | Guidelines for the development and use of medical electrical equipment educational materials | |
[4] | ИСО/МЭК Руководство 51:1999 | Аспекты безопасности. Руководящие указания по включению их в стандарты |
ISO/IEC Guide 51:1999 | Safety aspects - Guidelines for the inclusion in standards | |
[5] | ИСО 9000:2005 | Системы менеджмента качества. Определения и словарь |
ISO 9000:2005 | Quality management systems - Fundamentals and vocabulary | |
[6] | ИСО 9001:2000 | Системы менеджмента качества. Требования |
ISO 9001:2000 | Quality management systems - Requirements | |
[7] | ИСО 9241-11:1998 | Эргономические требования, связанные с использованием видеотерминалов для учрежденческих работ. Часть 11. Руководство по определению и измерению используемости |
ISO 9241-11:1998 | Ergonomic requirements for office work with visual display terminals (VDTs) - Part 11: Guidance on usability | |
[8] | ИСО 13485:2003 | Медицинские изделия. Системы менеджмента качества. Системные требования для целей регулирования |
ISO 13485:2003 | Medical devices - Quality management systems - Requirements for regulatory purposes | |
[9] | ИСО/ТО 16142:2006 | Изделия медицинские. Руководство по выбору стандартов, поддерживающих важнейшие принципы обеспечения безопасности и эксплуатационных характеристик медицинских изделий |
ISO/TR 16142:2006 | Medical devices - Guidance on the selection of standards in support of recognized essential principles of safety and performance of medical devices | |
[10] | ANSI/AAMI НЕ 48:1993 | Руководящие принципы и предпочтительные практики при проектировании медицинских изделий с учетом человеческого фактора |
ANSI/AAMI НЕ 48:1993 | Human factors engineering guidelines and preferred practices for the design of medical devices | |
[11] | ANSI/AAMI НЕ 74:2001 | Человеческие факторы при проектировании медицинских изделий |
ANSI/AAMI НЕ 74:2001 | Human factors design process for medical devices | |
[12] | ЕН 1041:1998 | Информация, поставляемая изготовителем совместно с медицинскими изделиями |
EN 1041:1998 | Information supplied by the manufacturer with medical devices | |
[13] | GHTF SG2N31R3:2003 | Медицинские изделия. Постпродажное наблюдение. Предложение отчетности по ошибкам при использовании медицинских изделий производителем или уполномоченным представителем |
GHTF SG2N31R3:2003, | Medical Devices: Post Market Surveillance: Proposal for Reporting of Use Errors with Medical Devices by their Manufacturer or Authorized Representative | |
[14] | Браун Д. Нью-Йорк: Вайли, | Проблемы дизайна, связанные с использованием на рынке медицинских изделий. Д.Виксон и Реми (ред.). Полевые методы. Справочное пособие для разработки программного обеспечения |
(Brown D. New York: Wiley, | The challenges of user-based design in a medical medical device market. In D.Wixon and Ramey (Eds.), Field Methods Casebook for Software Design | |
[15] | Калан Д.Р, Келли Р.Т., | Оценка человеческих факторов после брахитерапии. (NUREG/CR-6125, тома 1-3), Вашингтон, округ Колумбия\США, Комиссия по ядерному регулированию) |
Callan, J.R., Kelly, R.Т., | Human factors evaluation of remote after loading Brach therapy. (NUREG/CR-6125, Volumes 1-3) Washington, D. C.\U.S. Nuclear Regulatory Commission) | |
[16] | Кук Н.Дж. 1994, с.349-801 | Многообразие методов техники познания. Первая Международная группа исследований человек/компьютер. |
Cooke, N.J. 1994:41, pp.349-801) | Varieties of knowledge elicitation techniques. Int'l 1 Human-Computer Studies | |
[17] | Драри С.Г., Прабу П.И., | Целевой анализ деятельности инспекции самолета. Методы и результаты. Материалы 34-го ежегодного собрания Общества человеческого фактора |
Drury С.G., Prabhu Р., and | Task analysis of aircraft inspection activities: Methods and findings. Proceedings of the Human Factors Society 34th Annual Meeting | |
[18] | Дамес Дж. и Редиш Дж. | Практическое руководство по тестированию эксплуатационной пригодности (пересмотренное издание), Эксетер, Великобритания, Интеллект, 1999 |
Dumas, J. and Redish, J. | A Practical Guide to Usability Testing (Revised Edition), Exeter, UK, Intellect, 1999 | |
[19] | Эллис С. P., Биго Д.P. | Виртуальные среды интерфейсов человек-компьютер. В редакции М.Г.Хеландер, Т.К.Ландауэра, П.В.Прабху. Справочник взаимодействия человека с компьютером. Амстердам:. 1997, с.163-201 |
Ellis S.R., Begault D.R., and Wenzel E.M. | Virtual environments as human-computer interfaces. In M.G.Helander, Т.K. Landauer, and P.V.PRABHU (Eds.), Handbook of human-computer interaction. Amsterdam: Elsevier. 1997, pp.163-201 | |
[20] | Фляйшман E.А. и | Таксономии деятельности человека. Описание задач для человека. Орландо: Академ Пресс; 1984 |
Fleishman Е.A., | Taxonomies of human performance: The description of human tasks. Orlando: Academic Pressr; 1984 | |
[21] | Джандри Дж.В., Камес К.А., Дерок Ф.А., Ергенсон Д., Бреди Дж.Н. | Сравнение шестиклассников с подготовленными специалистами в использовании автоматизированных внешних дефибрилляторов. 14 ноября 2000; 102 (20): Е166 |
Gundry J.W., Comess K.A., Derook F.A., Jorgenson D., Brady G.H. | Comparison of naive sixth-grade children with trained professionals in the use of an automated external defibrillator Circulation. 2000 Nov 14; 102(20): E166 | |
[22] | Кирван Б. и Эйнсворт Л.К. | Руководство по анализу задач. Лондон, Великобритания: Taylor & Francis, 1992 |
Kirwan В. and Ainswor L.K. | A Guide to Task Analysis. London, UK: Taylor & Francis, 1992 | |
[23] | Хольцблатт К. и Джонс С. | Контекстная справка. Принципы и практика. В редакции Д.Шулер и А.Намиока. Участие в проектировании. Принципы и практика., Нью-Джерси; (1993) |
(Holtzblatt K., and Jones S.) | Contextual inquiry: Principles and practice. In D. Schuler and A. Namioka (Eds.), Participatory Design: Principles and Practice. Hillsdale, NJ: Erlbaum; (1993) | |
[24] | Джонссен Д.Л., Ханнум В.А. и Тессмер М. | Руководство по процедурам анализа задач; 1989 |
Jonassen D.L., Hannum W.Н. and Tessmer M. | Handbook of Task Analysis Procedures. Westport: Greenwood Publishing Group; 1989 | |
[25] | Кляйн Дж.А., Орасану Дж., Калдервуд Р. и Цамбок С.Е. | Принятие решений в действии. Модели и методы. Норвуд, Нью-Джерси; 1993 |
Klein G.A., Orasanu J., Calderwood R., and Zsambok С.E. | Decision Making in Action: Models and Methods. Norwood, New Jersey: Ablex Publishing Corp; 1993 | |
[26] | Логхери К.P. (ст.) и Логхери К.Р. (мл.) | Аналитические методы функционального анализа. В редакции Г.Салвенди. Справочник по человеческому фактору. М.: Мир, 1987, стр.330-354 |
Laughery K.R. Sr. and Laughery K.R. Jr. | Analytic techniques for function analysis. In G.Salvendy (Ed.), Handbook of Human Factors. New York: Wiley, 1987, pp.330-354 | |
[27] | Лоеб Р., Выйнгер М. Б. и Енгланд С. Е. | Эргономика рабочего пространства анестезиолога. Медицинские изделия для анестезии. Принципы и приложения. Малверн, Пенсильвания; 1993 с.385-404 |
Loeb R., Weinger М. В., and Englund С. Е | Ergonomics of the anesthesia workspace. Ehrenwerth J. and Eisenkraft J. В., editors. Anesthesia Medical device: Principles and Applications. Mosby Year Book, Malvern, PA; 1993, pp.385-404 | |
[28] | Майстер Д. | Поведенческий анализ и методы измерения; 1985 |
Meister D. | Behavioral Analysis and Measurement Methods. New York: John Wiley & Sons; 1985 | |
[29] | Нильсен Дж. | Инженерия эксплуатационной пригодности. Сан-Диего; 1993 |
Nielsen J. | Usability Engineering. San Diego: Academic Press, Inc; 1993 | |
[30] | Ризон Дж. | Человеческая ошибка. Кембридж, Англия: Изд. Кембриджский университет; 1990 |
Reason J. | Human Error. Cambridge, England: Cambridge University Press; 1990 | |
[31] | Роуз У.Б. Нью-Йорк, Ван Ностранд Рейнхолд, 1990 | Проектирование человеческой ошибки. Понятия ошибок толерантных систем. В редакции Н.Р.Бухер, Подход к системной интеграции |
Rouse W.В. New York: Nostrand Reinhold, 1990 | New Designing for human error: Concepts for error tolerant systems. Van In H.R.Booher (Ed.), An approach to system integration | |
[32] | Рубин Дж. | Справочник по тестированию эксплуатационной пригодности: Как планировать, проектировать и проводить эффективные тесты, Нью-Йорк, штат Нью-Йорк; 1994 |
Rubin J. | Handbook of Usability Testing: How to Plan, Design, and Conduct Effective Tests, New York, NY, Wiley; 1994 | |
[33] | Шулер Д. и Намиока А. | Участие в проектировании: Принципы и практика. Нью-Джерси; 1993 |
Schuler D. and Namioka А. | Participatory Design: Principles and Practices. HILLSDALET NJ: Lawrence Erlbaum Associates; 1993 | |
[34] | Шарит Дж. | Распределение функций. В редакции Г.Салвенди. Справочник по человеческому фактору и эргономике, 2-е издание, Нью-Йорк. М., 1997, с.301-339 |
Sharit J. | Allocation of functions. In G.Salvendy (Ed.), Handbook of Human Factors and Ergonomics, 2nd edition, New York: Wiley, 1997, pp.301-339. | |
[35] | Синклар М.А. | Субъективные оценки. Д.P.Уифсон и И.Н.Корлетт (ред.), Оценка человеческого труда. Лондон: 1990, с.53-88 |
Sinclair М.А. | Subjective assessment. In J.R.Wifson and E.N.Corlett (Eds.), Evaluation of human work. London: Taylor & Francis. 1990, pp.53-88. | |
[36] | Вайнер Е.Л. и Нейджел Д.С. (ред.) | Человеческий фактор в авиации. Сан-Диего, Академическое издательство; 1988 |
Wiener Е.L, and Nagel D.С. (Eds.) | Human factors in aviation. San Diego: Academic Press; 1988 | |
[37] | Ейнджер М.Б., Херндон О.В. и Габа Д.М. | Влияние электронного учета чрезпищеводной эхокардиографии на задачу распределения рабочей нагрузки и бдительность при сердечной анестезии. Анестезиология; 1997, 37:144-155 |
Einger М.В., Herndon О.W., and Gaba D.М. | The effect of electronic record keeping and transesophageal echocardiography on task distribution, workload, and vigilance during cardiac anesthesia. Anesthesiology 1997, 37:144-155 |
Алфавитный указатель терминов
АНАЛИЗ РИСКА | ИСО 14971:2007, 2.17 |
БЕЗОПАСНОСТЬ | ИСО 14971:2007, 2.24 |
ВАЛИДАЦИЯ | 3.26 |
ВЕРИФИКАЦИЯ | ИСО 14971:2007, 2.28 |
ВРЕД | ИСО 14971:2007, 2.2 |
ДОКУМЕНТАЦИЯ ЭКСПЛУАТАЦИОННАЯ | 3.2 |
ЗАПИСЬ | ИСО 14971:2007, 2.14 |
ИЗГОТОВИТЕЛЬ | ИСО 14971:2007, 2.8 |
ИНТЕРФЕЙС ПОЛЬЗОВАТЕЛЬСКИЙ | 3.24 |
ИСПОЛЬЗОВАНИЕ КОРРЕКТНОЕ | 3.7 |
ИСПОЛЬЗОВАНИЕ НЕНОРМАЛЬНОЕ | 3.1 |
ИСПОЛЬЗОВАНИЕ НОРМАЛЬНОЕ | 3.12 |
ИСПОЛЬЗОВАНИЕ ПРЕДПОЛАГАЕМОЕ | ИСО 14971:2007, 2.5 |
МЕДИЦИНСКОЕ ИЗДЕЛИЕ | 3.11 |
МЕНЕДЖМЕНТ РИСКА | ИСО 14971:2007, 2.22 |
ОПАСНОСТЬ | ИСО 14971:2007, 2.3 |
ОРГАНИЗАЦИЯ ОТВЕТСТВЕННАЯ | 3.16 |
ОТКЛЮЧЕНИЕ СИГНАЛИЗАЦИИ | 3.4 |
ОЦЕНКА РИСКА | ИСО 14971:2007, 2.21 |
ОШИБКА ИСПОЛЬЗОВАНИЯ | 3.21 |
ПАЦИЕНТ | 3.13 |
ПОЛЬЗОВАТЕЛЬ | 3.23 |
ПРЕДЕЛ СРАБАТЫВАНИЯ СИГНАЛИЗАЦИИ | 3.3 |
ПРИГОДНОСТЬ ЭКСПЛУАТАЦИОННАЯ | 3.17 |
ПРОДУКТИВНОСТЬ | 3.9 |
ПРОЕКТИРОВАНИЕ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | 3.18 |
ПРОФИЛЬ ПОЛЬЗОВАТЕЛЯ | 3.25 |
ПРОЦЕСС | ИСО 14971:2007, 2.13 |
РИСК | ИСО 14971:2007, 2.16 |
РИСК ОСТАТОЧНЫЙ | ИСО 14971:2007, 2.15 |
СВИДЕТЕЛЬСТВО ОБЪЕКТИВНОЕ | ИСО 14971:2007, 2.10 |
СИГНАЛ АВАРИЙНЫЙ | 3.5 |
СИГНАЛ ИНФОРМАЦИОННЫЙ | 3.10 |
СИГНАЛ НАПОМИНАЮЩИЙ | 3.15 |
СИСТЕМА СИГНАЛИЗАЦИИ | 3.6 |
СИТУАЦИЯ ОПАСНАЯ | ИСО 14971:2007, 2.4 |
СПЕЦИФИКАЦИЯ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | 3.20 |
СЦЕНАРИЙ ИСПОЛЬЗОВАНИЯ | 3.22 |
ТЯЖЕСТЬ | ИСО 14971:2007, 2.25 |
УПРАВЛЕНИЕ РИСКОМ | ИСО 14971:2007, 2.19 |
ФАЙЛ МЕНЕДЖМЕНТА РИСКА | ИСО 14971:2007, 2.23 |
ФАЙЛ ПРОЕКТИРОВАНИЯ С УЧЕТОМ ЭКСПЛУАТАЦИОННОЙ ПРИГОДНОСТИ | 3.19 |
ФУНКЦИЯ ОСНОВНАЯ РАБОЧАЯ | 3.14 |
ЭФФЕКТИВНОСТЬ | 3.8 |
УДК 615.47:006.354 | ОКС 11.040 | Р20 | ОКП 94 0000 |
Ключевые слова: эксплуатационная пригодность, проектирование, система менеджмента качества, изготовитель, медицинское изделие | |||
Электронный текст документа
и сверен по:
, 2015