ГОСТ Р 51352-99
Группа Р24
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
НАБОРЫ РЕАГЕНТОВ ДЛЯ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
Методы испытаний
Kits of reagents for clinical laboratory diagnostics. Test methods
ОКС 11.100
ОКСТУ 9398
Дата введения 2000-07-01
Предисловие
1 РАЗРАБОТАН И ВНЕСЕН Техническим комитетом по стандартизации ТК 380 "Клинические лабораторные исследования и диагностические тест-системы in vitro" и Комитетом по новой медицинской технике Минздрава России
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 11 ноября 1999 года N 402-ст
3 ВВЕДЕН ВПЕРВЫЕ
1 Область применения
Настоящий стандарт распространяется на наборы реагентов для клинической лабораторной диагностики (далее - наборы) природного или искусственного происхождения, предназначенные для применения в медицинской и научно-исследовательской практике и используемые в клинико-диагностических, биохимических, иммунологических и генодиагностических лабораториях медицинских учреждений при проведении любых диагностических исследований in vitro, а также на составные части этих наборов, имеющие функциональное медицинское назначение и изготовляемые отдельно.
Стандарт не распространяется на медицинские иммунобиологические препараты, предназначенные для специфической профилактики, диагностики и лечения инфекционных, паразитарных заболеваний и аллергических состояний: вакцины бактерийные и вирусные, анатоксины, иммуноглобулины нормальные и специфические, сыворотки диагностические и антитоксические лечебные, бактериофаги диагностические и лечебно-профилактические, препараты нормфлоры (бифидумбактерин, споробактерин, бактисубтил и др.), интерфероны, цитокины и другие биологические иммуномодуляторы для стимуляции антиинфекционного иммунитета, аллергены бактериальные, грибковые, пищевые, бытовые, пыльцевые и другие, диагностические тест-системы для иммуноферментного анализа инфекционных и паразитарных заболеваний, диагностикумы антигенные, антительные, питательные среды (бактериальные, вирусологические).
Настоящий стандарт устанавливает методы испытаний наборов.
Технические требования к наборам - по ГОСТ Р 51088.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 8.315-97 Государственная система обеспечения единства измерений. Стандартные образцы состава и свойств веществ и материалов. Основные положения
ГОСТ Р 51088-97 Наборы реагентов для клинической лабораторной диагностики. Общие технические условия
3 Определения
В настоящем стандарте применяют следующие термины с соответствующими определениями:
набор: Комплект специально подобранных реагентов (реактивов), составных частей и инструкций по проведению анализа, предназначенный для определения in vitro одного конкретного вещества (или активности фермента), нескольких конкретных веществ (или суммарной активности ферментов), а также для детекции участка генома (ГОСТ Р 51088).
компоненты набора: Реагенты (реактивы) и составные части (планшеты, стрипы, пробирки и т.п.), используемые при проведении анализа (ГОСТ Р 51088).
эксплуатационная документация на наборы: Инструкция по применению набора, паспорт (ГОСТ Р 51088).
иммунохимический анализ: Метод анализа, основанный на обратимом и нековалентном связывании антигена с антителом. С помощью иммунохимического анализа идентифицируют, а также качественно, полуколичественно или количественно определяют антигены и антитела (ГОСТ Р 51088).
антиген: Вещество, которое обратимо и нековалентно связывается со специфическими центрами антител (ГОСТ Р 51088).
антитела: Белки, продуцируемые лимфоцитами В, которые используют для связывания, обнаружения или определения антигена (ГОСТ Р 51088).
радиоиммунологический анализ: Метод анализа, основанный на иммунохимической реакции антигена со специфическим антителом, проводимой in vitro в присутствии меченного радионуклидом антигена или антитела (ГОСТ Р 51088).
иммуноферментный анализ: Метод анализа, основанный на иммунохимической реакции антигена со специфическим антителом, проводимой in vitro в присутствии меченного ферментом соединения или ферментзависимого субстрата (ГОСТ Р 51088).
иммунофлуоресцентный анализ: Метод анализа, основанный на иммунохимической реакции антигена со специфическим антителом, проводимой in vitro в присутствии флуоресцентной метки (ГОСТ Р 51088).
иммунохемилюминесцентный анализ: Метод анализа, основанный на иммунохимической реакции антигена со специфическим антителом, проводимой in vitro в присутствии хемилюминесцентной метки (ГОСТ Р 51088).
иммунохроматографический анализ: Метод анализа, основанный на конкуренции определяемого вещества и конъюгата аналога определяемого вещества за субстрат на полоске хроматографической бумаги (ГОСТ Р 51088).
микроанализ нуклеотидных последовательностей: Метод анализа, основанный или на процессе специфического умножения количества исследуемых участков дезоксирибонуклеиновой кислоты (ДНК) или рибонуклеиновой кислоты (РНК), в том числе методом полимеразной цепной реакции (ПЦР) с последующей детекцией сигнала, или на прямой детекции сигналов, возникающих при гибридизации с синтетическими зондами (ГОСТ Р 51088).
фотометрический анализ: Метод анализа, основанный на избирательном поглощении инфракрасного, видимого или ультрафиолетового излучения молекулами определяемого вещества или его соединения с соответствующим реагентом (ГОСТ Р 51088).
коагулометрический анализ: Метод анализа системы свертывания крови, основанный на регистрации времени фибринообразования (ГОСТ Р 51088).
чувствительность: Наименьшее количество анализируемого вещества (или активности фермента, или копий участка генома), определяемое с помощью данного набора.
специфичность: Способность данной аналитической системы (набора) определять только то вещество (или активность фермента, или участок генома), для которого эта система (набор) предназначена.
"линейность": Отклонение значения концентрации определяемого вещества (или активности фермента) от теоретического в диапазоне рабочих концентраций.
"открытие": Проверка соответствия значения определяемой концентрации вещества (или активности фермента) расчетной величине, полученной путем смешивания равных объемов контрольных растворов (калибровочных проб, контрольных сывороток или биологического материала) с установленной концентрацией (или активностью).
коэффициент вариации: Показатель воспроизводимости результатов определения, рассчитанный как отношение значения среднего квадратического отклонения к среднему арифметическому значению.
интерсепт: Концентрация анализируемого вещества, которая соответствует определенной точке на калибровочном графике.
4 Методы испытаний
4.1 Проверка комплектности и составных частей набора
При получении набора необходимо проверить:
- комплектность набора в соответствии с эксплуатационной документацией;
- внешний вид и состояние упаковки набора и его компонентов;
- наличие маркировки набора и его компонентов и соответствие маркировки требованиям нормативной документации.
Компоненты набора должны быть подвергнуты визуальному контролю.
Осмотр компонентов набора заключается в установлении соответствия показателей внешнего вида требованиям нормативной документации на наборы конкретных видов:
- агрегатное состояние (таблетка, порошок, аморфная масса, жидкость и т.п.);
- окраска;
- прозрачность (для жидкостей);
- наличие или отсутствие осадка или хлопьев (для жидкостей);
- консистенция.
4.2 Экспериментальная проверка качества наборов
Экспериментальная проверка качества наборов должна быть основана на контроле качества системы определения анализируемого соединения в целом применительно к набору конкретного вида.
Измерительная аппаратура, лабораторная посуда, дозирующие устройства, весы и другие принадлежности, используемые при испытаниях, должны быть поверены в соответствии с требованиями, предъявляемыми к лабораторному оборудованию.
В случае, если отклонения значений рН растворов, входящих в состав набора, от заданных могут повлиять на правильность анализа, необходимо проводить контроль рН растворов.
Образцы наборов представляют на испытания в количестве, необходимом для проведения трех полных анализов в соответствии с требованиями нормативной документации на наборы конкретного вида.
4.2.1 Наборы для иммунохимического анализа
4.2.1.1 Наборы для радиоиммунологического анализа
Общая радиоактивность меченого компонента
Значение общей радиоактивности компонента, меченного радионуклидом ( или
), является основанием для расчета некоторых других показателей. Кроме того, определение общей радиоактивности позволяет проконтролировать количество поставляемого меченого вещества.
Радиоактивность компонента , килобеккерели (кБк), меченного
, определяют на день паспортизации набора по формуле
![]() , (1)
, (1)
где - скорость счета пробы меченого компонента, имп/мин;
- общий объем меченого компонента в наборе, см
;
- объем пробы меченого компонента, взятой для измерения скорости счета, см
;
- эффективность счета гамма-счетчика, доли единицы;
![]() - коэффициент перевода импульсов в минуту в килобеккерели.
- коэффициент перевода импульсов в минуту в килобеккерели.
Радиоактивность компонента , кБк, меченного
, определяют на день паспортизации набора по формуле
![]() , (2)
, (2)
где - скорость счета пробы меченого компонента, имп/мин;
- общий объем меченого компонента в наборе, см
;
- объем пробы меченого компонента, взятой для измерения скорости счета, см
;
- эффективность счета бета-счетчика, доли единицы;
![]() - коэффициент перевода импульсов в минуту в килобеккерели;
- коэффициент перевода импульсов в минуту в килобеккерели;
- коэффициент поправки на гашение (определяют экспериментально путем измерения скорости счета образцового радиоактивного раствора трития в соответствующей сцинтилляционной жидкости до и после внесения в нее определенного количества растворенного меченого компонента и компонента, не содержащего меченое соединение).
Тотальная (общая) радиоактивность, внесенная в анализируемую пробирку
Для расчета ряда показателей качества набора необходимо определить тотальную (общую) радиоактивность (), внесенную в анализируемую пробирку. Значение
определяют как числовой результат скорости счета радиоактивности, внесенной в каждую аналитическую пробирку.
Для определения в пробирки вносят компонент, содержащий радионуклид, в объеме, указанном в инструкции по применению набора, после чего добавляют в пробирки все компоненты инкубационной среды в объеме, указанном в инструкции по применению набора; центрифугирование не производят.
Радиометрию каждой пробирки проводят в отдельности и определяют среднее арифметическое значение и значение коэффициента вариации. Достоверность сосчитанных импульсов должна быть в пределах 1-2%, коэффициент вариации счета -проб не должен превышать 3%, интенсивность счета
должна быть не менее 10000 имп/мин для получения достоверности счета с погрешностью менее 1%.
Специфически связанная радиоактивность (специфическое связывание)
Специфическое связывание определяют с помощью нулевой калибровочной пробы, т.е. при нулевой концентрации определяемого вещества.
Значение специфического связывания (применяют также термин "максимальное связывание") выражают в процентах как отношение значения радиоактивности образца с нулевой концентрацией, из которого исключено значение неспецифически связанной радиоактивности, к общей радиоактивности образца:
![]() , (3)
, (3)
где - скорость счета в пробирке, содержащей нулевую калибровочную пробу, имп/мин;
- скорость счета тотальной радиоактивности, внесенной в аналитическую пробирку, имп/мин.
Значение специфического связывания дает основную информацию о протекании иммунохимической реакции между антителами и меченым антигеном в данной системе для радиоиммунологического анализа. Его изменения могут быть обусловлены прежде всего изменениями концентраций обоих компонентов в реакционной смеси и их свойств, особенно сродства и емкости связи антител, удельной активности радиоиндикатора и его повреждением, а также изменениями, происходящими во время хранения или при инкубации. Кроме того, на значение специфического связывания могут оказать влияние и другие компоненты реакционной смеси, условия инкубации, а также правильность выполнения процедур сепарации. Любое заметное отклонение значения ![]() (более чем на 5%) от обычно получаемых значений при данной методике должно служить сигналом о нарушении стандартных условий определения и качества составных частей набора, а также должно послужить основанием к дополнительной проверке набора.
(более чем на 5%) от обычно получаемых значений при данной методике должно служить сигналом о нарушении стандартных условий определения и качества составных частей набора, а также должно послужить основанием к дополнительной проверке набора.
Значение специфического связывания определяют следующим образом: в пробирки (8-10 шт.) вносят нулевую калибровочную пробу и все компоненты реакционной смеси, после чего проводят все процедуры, предусмотренные инструкцией по применению набора.
В идеале значение специфического связывания должно быть близко к 50%. Чем ниже этот показатель, тем меньше разрешающая способность калибровочной кривой набора, поскольку калибровочная кривая будет более пологой. При высоком значении ![]() чувствительность набора увеличивается, но "рабочий" отрезок калибровочной кривой уменьшается.
чувствительность набора увеличивается, но "рабочий" отрезок калибровочной кривой уменьшается.
Неспецифически связанная радиоактивность (неспецифическое связывание)
Неспецифическое связывание - это неспецифически связанная радиоактивность в образце при отсутствии специфических антител.
Определение значения неспецифического связывания дает прежде всего информацию об эффективности используемого метода сепарации свободной и связанной фракций и о неспецифическом захвате свободного радиоиндикатора в связанной фракции. Причиной неспецифического связывания прежде всего является неспецифическая сорбция свободного радиоиндикатора на стенках пробирок, на поверхности осадка и сорбентов. Кроме того, неспецифическое связывание - это влияние перекрестных реакций в присутствии эндогенных антител в анализируемых образцах и воздействие некоторых неспецифических факторов вследствие их присутствия в анализируемых образцах.
Поскольку неспецифическое связывание - одна из основных проблем радиоиммунологического анализа, его исследование и контроль важны и необходимы. При этом значение неспецифического связывания необходимо вычитать из значений полученных радиоактивностей для всех калибровочных проб.
Неспецифическое связывание определяют следующим образом: в пробирки (8-10 шт.) вносят нулевую калибровочную пробу (или любую калибровочную пробу, или сыворотку крови человека) и все компоненты набора, предусмотренные инструкцией по его применению, за исключением антисыворотки (антител). Затем проводят все процедуры, предусмотренные инструкцией по применению набора.
Значение неспецифического связывания , %, рассчитывают по формуле
![]() , (4)
, (4)
где - среднее арифметическое значение скорости счета в отдельных пробирках, имп/мин;
- среднее арифметическое значение тотальной радиоактивности, имп/мин.
Значение неспецифического связывания должно быть не более 5%.
При использовании твердофазного метода значение неспецифического связывания не определяют.
Соотношение скоростей счета калибровочных проб
Для оценки правильности работы системы для радиоиммунологического анализа необходимо проводить определение соотношения скоростей счета (имп/мин) калибровочных проб. Значения скоростей счета калибровочных проб могут иметь прямую зависимость от концентрации анализируемого антигена (или антител): ![]() (сэндвич-вариант), или обратную:
(сэндвич-вариант), или обратную: ![]() (метод конкурентного связывания).
(метод конкурентного связывания).
Соотношение скоростей счета калибровочных проб с максимальным и минимальным содержанием антигена (антител) и калибровочной пробы, не содержащей антиген (антитела)
Наклон калибровочной кривой в данной точке является одним из факторов, который определяет разрешающую способность и точность системы для измерения соответствующей концентрации анализируемого антигена. Значение соотношения скоростей счета калибровочной пробы с минимальным содержанием антигена и калибровочной пробы, не содержащей антиген ![]() , может влиять на значение чувствительности системы для радиоиммунологического анализа. Соотношение же скоростей счета калибровочной пробы с максимальным содержанием антигена и калибровочной пробы, не содержащей антиген
, может влиять на значение чувствительности системы для радиоиммунологического анализа. Соотношение же скоростей счета калибровочной пробы с максимальным содержанием антигена и калибровочной пробы, не содержащей антиген ![]() , хотя и не отражает разрешающую способность отдельных участков калибровочного графика, однако является одним из показателей стабильности системы для радиоиммунологического анализа при сравнении разных наборов одной серии и наборов разных серий.
, хотя и не отражает разрешающую способность отдельных участков калибровочного графика, однако является одним из показателей стабильности системы для радиоиммунологического анализа при сравнении разных наборов одной серии и наборов разных серий.
Допускается определять соотношение скоростей счета калибровочной пробы с минимальным содержанием антигена и калибровочной пробы с максимальным содержанием антигена ![]() и соотношение скоростей счета предпоследней калибровочной пробы (
и соотношение скоростей счета предпоследней калибровочной пробы () и калибровочной пробы с максимальным содержанием антигена
![]() .
.
Чувствительность
Значение чувствительности определяют следующим образом: в пробирки (8-10 шт.) вносят нулевую калибровочную пробу и все компоненты набора, предусмотренные инструкцией по его применению, после чего проводят все процедуры определения. На основании полученных данных вычисляют среднее квадратическое отклонение по формуле
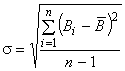 , (5)
, (5)
где - значение скорости счета меченого соединения каждого измерения в пробирках с нулевой калибровочной пробой, имп/мин;
- среднее арифметическое значение скорости счета меченого соединения в пробирках с нулевой калибровочной пробой, имп/мин;
- знак суммирования;
- число определений.
На оси ординат калибровочного графика откладывают значение (![]() ) - если применяют принцип конкурентного связывания, или (
) - если применяют принцип конкурентного связывания, или (![]() ) - если используют сэндвич-вариант; из полученной точки проводят прямую, параллельную оси абсцисс, до пересечения с калибровочным графиком; из точки пересечения опускают перпендикуляр на ось абсцисс.
) - если используют сэндвич-вариант; из полученной точки проводят прямую, параллельную оси абсцисс, до пересечения с калибровочным графиком; из точки пересечения опускают перпендикуляр на ось абсцисс.
Соответствующая этому значению концентрация характеризует чувствительность, которую следует выражать в значениях концентрации анализируемого вещества.
Значение чувствительности зависит от крутизны калибровочного графика в области низких концентраций, от точности определения нулевой калибровочной пробы, от константы ассоциации специфических антител (чем больше константа ассоциации, тем чувствительнее система для радиоиммуноанализа), а также от значения соотношения скоростей счета калибровочной пробы с минимальным содержанием определяемого антигена и нулевой калибровочной пробы.
Тест на "открытие"
При постановке теста на "открытие" смешивают, как правило, равные объемы контрольной сыворотки (плазмы) и калибровочной пробы. Вместо контрольной сыворотки (плазмы) можно использовать калибровочную пробу с минимальной концентрацией определяемого вещества.
Тест на "открытие" , %, проводят в восьми-десяти повторностях. В исследуемой пробе определяют концентрацию анализируемого антигена и сравнивают ее значение с расчетным по формуле
![]() , (6)
, (6)
где - полученное по калибровочному графику (практическое) значение концентрации анализируемого антигена в исследуемой пробе;
- расчетное (теоретическое) значение концентрации антигена в исследуемой пробе.
Значение "открытия" должно находиться в пределах 90-110%.
Тест на "открытие" является одним из основных для решения вопроса о специфичности и правильности проведения анализа. Важность данного теста заключается также и в том, что при его постановке сравнивают, как взаимодействуют анализируемый антиген, находящийся в исследуемой пробе (например, в контрольной сыворотке или плазме), и анализируемый антиген, находящийся в калибровочной пробе, с антителом. Если они взаимодействуют по-разному, что называется "матриксным эффектом", то появляются систематические ошибки и непостоянство результатов определения.
В случае экспериментальной проверки качества наборов, предназначенных для определения антигена (антител) в сухих пятнах крови, тест на "открытие" не проводят.
Тест на "линейность"
Этот тест заключается в последовательных разведениях калибровочной пробы с максимальной концентрацией антигена или контрольной сыворотки (плазмы) с высокой концентрацией этого антигена в 2, 4, 8 и т.д. раз (возможны и другие пропорции разведения) с последующим сравнением полученных результатов с ожидаемыми при этих разведениях концентрациями анализируемого антигена. Разведения должны быть выполнены с таким расчетом, чтобы тест охватывал все участки калибровочного графика, поэтому наряду с максимальной калибровочной пробой можно использовать калибровочные пробы со средней и даже низкой концентрацией анализируемого вещества. Для разведения следует использовать нулевую калибровочную пробу или сыворотку (плазму) крови, не содержащую исследуемый антиген.
Тест на "линейность" , %, проводят в восьми-десяти повторностях. В анализируемых образцах определяют концентрацию исследуемого антигена, умножают на коэффициент разведения и сравнивают ее значение с расчетным по формуле
![]() , (7)
, (7)
где - полученное по калибровочному графику (практическое) значение концентрации анализируемого антигена в исследуемых пробах;
- расчетное (теоретическое) значение концентрации анализируемого антигена в исследуемых пробах.
Значение "линейности" должно находиться в пределах 90-110%.
Тест на "линейность" важен тем, что позволяет проконтролировать, насколько правильно калиброваны калибровочные пробы относительно друг друга. При разведении одной калибровочной пробы идет сравнение этой пробы с калибровочными пробами, близкими по концентрации к полученным результатам.
Тест на "линейность" позволяет устранить систематические ошибки, связанные с различной специфичностью анализа, на каждой стадии калибровки, а также позволяет оценить правильность работы системы для радиоиммунологического анализа на всех участках калибровочного графика.
В случае экспериментальной проверки качества наборов, предназначенных для определения антигена (антител) в сухих пятнах крови, тест на "линейность" не проводят.
Коэффициент вариации
При определении коэффициента вариации следует использовать аттестованные контрольные сыворотки (плазмы, сухие пятна крови) с низким, средним или высоким содержанием анализируемого антигена. Контроль воспроизводимости проводят в восьми-десяти повторностях. Воспроизводимость проверяют как для одного набора, так и для разных наборов одной серии и наборов разных серий.
Значение коэффициента вариации , %, определяют по формуле
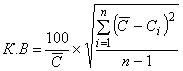 , (8)
, (8)
где - значение каждого измерения концентрации анализируемого антигена в контрольной сыворотке;
- среднее арифметическое значение концентрации анализируемого антигена в контрольной сыворотке;
- знак суммирования;
- число определений.
Воспроизводимость результатов считают удовлетворительной, если значение не превышает 8% при проведении анализа в биологических жидкостях и 15% - при проведении анализа в сухих пятнах биологических жидкостей.
Интерсепт
Значение интерсепта определяют по калибровочному графику, построенному в координатах logit-log (на оси ординат откладывают значение соотношения скоростей счета калибровочных проб - и нулевой калибровочной пробы -
, а на оси абсцисс - значение концентрации антигена в логарифмическом масштабе). Если работа набора основана на принципе конкурентного связывания, то используют соотношение
![]() , если на принципе сэндвич-варианта - соотношение
, если на принципе сэндвич-варианта - соотношение ![]() . Значение интерсепта выражают в тех же единицах, что и значение концентрации анализируемого антигена.
. Значение интерсепта выражают в тех же единицах, что и значение концентрации анализируемого антигена.
При контроле качества наборов для радиоиммунологического анализа обычно пользуются тремя значениями интерсепта - 20% (25%), 50% и 80% (75%), хотя допускаются и другие варианты. Отрезок калибровочного графика, ограниченный значениями 20% и 80% интерсепта, - это "рабочий" отрезок калибровочного графика, являющийся наиболее чувствительной его частью. Значение 50% интерсепта должно лежать на самой крутой части калибровочного графика и должно соответствовать одной и той же средней концентрации анализируемого антигена в пределах установленных колебаний.
Значения интерсепта отражают стабильность концентрации антигена в анализируемой пробе в течение длительного времени; эти значения не должны в большой степени варьировать от набора к набору по наборам конкретного вида, так как от этого зависит достоверность получаемых в клинической практике результатов при использовании наборов разных серий.
Концентрация анализируемого антигена в контрольной сыворотке (плазме, сухом пятне крови)
Для проверки правильности (достоверности) определения указанной концентрации используют метод, основанный на применении контрольных сывороток (плазм, сухих пятен крови) с известной концентрацией анализируемого антигена, которые по составу и остальным свойствам должны быть наиболее близки к образцам анализируемого материала (во избежание "матриксного эффекта"). Наборы для радиоиммунологического анализа, как правило, комплектуют контрольными сыворотками с известным содержанием анализируемого антигена. Сравнение полученной в результате определения и указанной в паспорте на набор концентрации позволяет оценить достоверность (правильность) ее определения конкретным набором для радиоиммунологического анализа.
4.2.1.1.1 Наборы для иммунорадиометрического анализа
Экспериментальная проверка качества этих наборов включает в себя определение следующих показателей: общая радиоактивность меченого компонента - по формуле (1) или по формуле (2); тотальная (общая) радиоактивность; соотношение скоростей счета калибровочных проб: ![]() ; скорость счета в калибровочной пробе, не содержащей антиген (антитела); отношение скорости счета в калибровочной пробе с максимальным содержанием антигена к тотальной (общей) радиоактивности; "открытие" - по формуле (6); "линейность" - по формуле (7); коэффициент вариации - по формуле (8); интерсепт; концентрация анализируемого антигена (антител) в контрольной сыворотке (плазме). При определении чувствительности рассчитывают значение среднего квадратического отклонения (
; скорость счета в калибровочной пробе, не содержащей антиген (антитела); отношение скорости счета в калибровочной пробе с максимальным содержанием антигена к тотальной (общей) радиоактивности; "открытие" - по формуле (6); "линейность" - по формуле (7); коэффициент вариации - по формуле (8); интерсепт; концентрация анализируемого антигена (антител) в контрольной сыворотке (плазме). При определении чувствительности рассчитывают значение среднего квадратического отклонения () - по формуле (5), после чего на оси ординат калибровочного графика откладывают значение (
![]() ) и из этой точки проводят прямую, параллельную оси абсцисс, до пересечения с калибровочным графиком; из точки пересечения опускают перпендикуляр на ось абсцисс - соответствующая этому значению концентрация характеризует чувствительность.
) и из этой точки проводят прямую, параллельную оси абсцисс, до пересечения с калибровочным графиком; из точки пересечения опускают перпендикуляр на ось абсцисс - соответствующая этому значению концентрация характеризует чувствительность.
4.2.1.2 Наборы для иммуноферментного анализа
Экспериментальная проверка качества этих наборов включает в себя определение следующих показателей: соотношение оптических плотностей () калибровочных проб: (
![]() при использовании метода конкурентного связывания,
при использовании метода конкурентного связывания, ![]() - при сэндвич-варианте); соотношение
- при сэндвич-варианте); соотношение калибровочной пробы с минимальным содержанием антигена и нулевой калибровочной пробы (
![]() ); соотношение
); соотношение калибровочной пробы с максимальным содержанием антигена и нулевой калибровочной пробы (
![]() ); значение
); значение в калибровочной пробе с максимальным значением
; чувствительность - определяют значение
по формуле (5), после чего остальные расчеты ведут так, как указано в 4.2.1.1; "открытие" - по формуле (6); "линейность" - по формуле (7); коэффициент вариации - по формуле (8); интерсепт; концентрация анализируемого антигена в контрольной сыворотке (плазме). Допускается определять соотношение
калибровочной пробы с минимальным содержанием антигена и калибровочной пробы с максимальным содержанием антигена (
![]() ) и соотношение
) и соотношение предпоследней калибровочной пробы и калибровочной пробы с максимальным содержанием антигена (
![]() ).
).
4.2.1.3 Наборы для иммунофлуоресцентного анализа
Экспериментальная проверка качества этих наборов включает в себя определение следующих показателей: соотношение интенсивностей флуоресценции () калибровочных проб: (
![]() при использовании метода конкурентного связывания,
при использовании метода конкурентного связывания, ![]() - при сэндвич-варианте); соотношение
- при сэндвич-варианте); соотношение калибровочной пробы с минимальным содержанием антигена и нулевой калибровочной пробы (
![]() ); соотношение
); соотношение калибровочной пробы с максимальным содержанием антигена и нулевой калибровочной пробы (
![]() ); значение
); значение в калибровочной пробе с максимальным значением антигена; чувствительность - определяют значение
по формуле (5), после чего остальные расчеты ведут так, как указано в 4.2.1.1; "открытие" - по формуле (6); "линейность" - по формуле (7); коэффициент вариации - по формуле (8); интерсепт; концентрация анализируемого антигена в контрольной сыворотке (плазме, сухом пятне крови). Допускается определять соотношение
калибровочной пробы с минимальным содержанием антигена и калибровочной пробы с максимальным содержанием антигена (
![]() ) и соотношение
) и соотношение предпоследней калибровочной пробы (
![]() ) и калибровочной пробы с максимальным содержанием антигена (
) и калибровочной пробы с максимальным содержанием антигена (![]() ).
).
4.2.1.4 Наборы для иммунохемилюминесцентного анализа
Экспериментальная проверка качества этих наборов включает в себя определение тех же показателей, которые используют для проверки качества наборов для иммуноферментного анализа (см. 4.2.1.2); при этом определяют значение аналитического сигнала калибровочных и других исследуемых проб.
4.2.1.5 Наборы для других видов иммунохимического анализа
Экспериментальная проверка качества этих наборов (основанных на использовании методов иммунотурбидиметрии, иммунодиффузии и др.) включает в себя определение тех же показателей, которые используют для проверки качества наборов для иммуноферментного анализа (см. 4.2.1.2).
Описанные выше методы экспериментальной проверки качества наборов для различных вариантов иммунохимического анализа относятся к наборам для выполнения количественных анализов (исследований).
При проверке качества наборов для качественного или полуколичественного определения особое значение имеет расчет соотношения значений оптических плотностей (или скоростей счета, или интенсивности флуоресценции, или аналитического сигнала) положительного и отрицательного контрольных образцов, входящих в состав набора. При этом используют следующие варианты:
а) разница значений оптических плотностей отрицательного и положительного контрольных образцов должна быть не более какого-либо заданного значения или же должна находиться в каких-либо заданных пределах;
б) различие в значениях соотношения оптических плотностей отрицательного и положительного контрольных образцов должно быть не менее какого-либо заданного значения или же должно находиться в каких-либо заданных пределах;
в) различие в значениях оптических плотностей отрицательного и положительного контрольных образцов должно быть статистически достоверным (метод контроля основан на вычислении среднего арифметического значения плюс 3).
Поскольку при качественном или полуколичественном иммунохимическом анализе часто используют визуальную оценку результатов, то, наряду с указанными выше методами проверки качества наборов, основным критерием при выборе метода контроля должно быть заметное различие в интенсивности окраски положительного и отрицательного контрольных образцов.
Экспериментальная проверка качества наборов, использующих латекс-агглютинацию, если они предназначены для качественного определения анализируемого вещества, включает в себя определение чувствительности, образования агглютинации с латексным реагентом, положительного контроля и отрицательного контроля. В случае полуколичественного определения анализируемого вещества экспериментальная проверка качества этих наборов, наряду с определением чувствительности, образования агглютинации с латексным реагентом, положительного контроля и отрицательного контроля, включает в себя также определение титра анализируемого вещества.
4.2.1.6 Наборы для иммунохроматографического анализа
Указанные наборы, как правило, предназначены для качественного определения анализируемого вещества.
Экспериментальная проверка качества этих наборов включает в себя определение следующих показателей: чувствительность, положительный контроль, отрицательный контроль и время достижения устойчивых показателей теста. При проверке качества этих наборов обязательным является использование международных стандартных образцов, национальных стандартных образцов (ГОСТ 8.315) или образцов исследуемого биоматериала с точно установленным содержанием анализируемого вещества и гарантированно документированных.
4.2.2 Наборы для микроанализа нуклеотидных последовательностей
Экспериментальная проверка качества этих наборов включает в себя определение следующих показателей: положительный контрольный образец ДНК (или РНК) и отрицательный контрольный образец. Допускается также использовать маркеры молекулярного веса ДНК (или РНК) и внутренний контроль.
4.2.3 Наборы для фотометрического анализа
Растворимость компонентов
В том случае, когда реагенты, входящие в состав набора, поставляют в сухом состоянии, необходимо проверять их растворимость: в дистиллированной (бидистиллированной) воде или другом реагенте набора, поставляемом в жидком виде, отметив время растворения.
Чувствительность
Для определения чувствительности используют контрольные лабораторные растворы с точным содержанием анализируемого вещества (активности фермента). В качестве контрольных лабораторных растворов используют растворы чистого анализируемого вещества с определенной концентрацией (в случае ферментов предпочтительнее сыворотка или плазма крови человека с известной активностью фермента).
Значение чувствительности определяют следующим образом. В пробирки (8-10 шт.) вносят контрольный лабораторный раствор анализируемого вещества (сыворотку или плазму крови с известной активностью фермента) и все компоненты набора, предусмотренные инструкцией по его применению, после чего проводят все процедуры определения. Одновременно проводят все процедуры определения калибратора, входящего в состав набора. После этого измеряют оптическую плотность () в каждой пробирке с контрольным лабораторным раствором и с калибратором против холостой пробы (раствор сравнения, состоящий, как правило, из дистиллированной воды или смеси реагентов, входящих в набор, за исключением калибратора).
Среднее арифметическое значение
, единицы оптической плотности (ед. опт. плотн.), контрольного лабораторного раствора и калибратора определяют по формуле
![]() , (9)
, (9)
где - значение
каждого измерения, ед. опт. плотн.;
- знак суммирования;
- число определений.
Концентрацию анализируемого вещества (активность фермента) в контрольном лабораторном растворе определяют по формуле
![]() , (10)
, (10)
где - среднее арифметическое значение
контрольного лабораторного раствора, ед. опт. плотн.;
- среднее арифметическое значение
калибратора, ед. опт. плотн.;
- концентрация анализируемого вещества (активность фермента) в калибраторе.
В ряде случаев, если это предусмотрено инструкцией по применению набора, допускается определять концентрацию анализируемого вещества (активность фермента) по калибровочному графику.
Для определения активности фермента кинетическим методом по фактору в измерительную кювету спектрофотометра вносят сыворотку (плазму) крови и все компоненты набора, предусмотренные инструкцией по его применению, преинкубируют (в случае необходимости) в течение указанного в инструкции времени. После этого определяют (согласно инструкции) изменение анализируемой пробы во времени.
Изменение (
![]() ) определяют по формуле
) определяют по формуле
![]() , (11)
, (11)
где - изменение
пробы, ед. опт. плотн.;
- интервал времени между определениями, мин.
Определение чувствительности в одной и той же пробе сыворотки (плазмы) крови проводят 5 раз.
Среднее арифметическое значение изменения анализируемой пробы рассчитывают по формуле (9).
Активность фермента определяют по формуле
![]() , (12)
, (12)
где ![]() - среднее арифметическое значение изменения
- среднее арифметическое значение изменения пробы в минуту;
- фактор пересчета,
/дм
.
Фактор пересчета определяют по формуле
![]() , (13)
, (13)
где - конечный объем измеряемой пробы, см
;
- объем добавленной пробы сыворотки крови, см
;
- коэффициент молярной экстинкции NADH в условиях определения, см
ммоль
;
- коэффициент пересчета для выражения активности фермента в
/дм
, -
и указывают в паспорте на набор.
Полученное значение характеризует чувствительность, которую следует выражать в значениях концентрации анализируемого вещества (активности фермента).
Экспериментально установлено, что обычно значение чувствительности в наборах для фотометрического анализа равно среднему арифметическому значению холостой пробы плюс 3.
Соответствие калибратора контрольному лабораторному раствору
В том случае, когда в комплект набора включен калибратор, не являющийся отдельным коммерческим продуктом, для проверки калибратора необходимо проведение теста на соответствие калибратора контрольному лабораторному раствору анализируемого вещества с концентрацией, равной концентрации калибратора.
В один ряд пробирок (по 5-7 шт.) вносят контрольный лабораторный раствор анализируемого вещества, в другой ряд пробирок (по 5-7 шт.) - калибратор, после чего добавляют все компоненты набора, предусмотренные инструкцией по его применению, и проводят все необходимые процедуры определения в соответствии с инструкцией. После этого измеряют значение в каждой пробирке с контрольным лабораторным раствором и с калибратором против холостой пробы. Среднее арифметическое значение
контрольного лабораторного раствора и калибратора определяют по формуле (9). Концентрацию анализируемого вещества определяют по формуле (10). Относительное расхождение между концентрацией анализируемого вещества в контрольном лабораторном растворе
и в калибраторе
, %, определяют по формуле
![]() . (14)
. (14)
Это расхождение не должно быть более указанного в нормативной документации на наборы конкретного вида.
Тест на "открытие"
При постановке теста на "открытие" смешивают, как правило, равные объемы контрольной сыворотки (плазмы) и контрольного лабораторного раствора анализируемого вещества с известной концентрацией или же равные объемы контрольных лабораторных растворов определяемого вещества с известными концентрациями. В случае определения активности ферментов, как правило, смешивают равные объемы сывороток (плазм) крови человека с известными активностями ферментов.
Тест на "открытие" проводят в восьми-десяти повторностях. В анализируемой пробе определяют концентрацию исследуемого вещества (активность фермента) в соответствии с инструкцией по применению набора и сравнивают ее значение с расчетным по формуле (6).
Расхождение не должно быть более указанного в нормативной документации на наборы конкретного вида.
Тест на "линейность"
При проведении этого теста определяют анализируемое вещество (активность фермента) в контрольных лабораторных растворах анализируемого вещества с концентрациями, охватывающими всю область линейного определения, после чего сравнивают полученные значения с теоретическими значениями анализируемого вещества (активности фермента).
Тест на "линейность" проводят в восьми-десяти повторностях по каждому контрольному лабораторному раствору. В анализируемых образцах определяют концентрацию исследуемого вещества (активность фермента) в соответствии с инструкцией по применению набора и сравнивают ее значения с теоретическими значениями по формуле (7).
Расхождение не должно превышать значения, указанного в нормативной документации на наборы конкретного вида.
Коэффициент вариации
Для определения коэффициента вариации можно использовать аттестованные контрольные сыворотки (плазмы) с низкой, средней или высокой концентрацией анализируемого вещества (активностью фермента), контрольные лабораторные растворы с известной концентрацией анализируемого вещества (активностью фермента) или образцы биоматериала человека с гарантированно документированной точной концентрацией определяемого вещества (активностью фермента). Определение коэффициента вариации проводят в восьми-десяти повторностях по двум-трем различным концентрациям анализируемого вещества (активностям ферментов). Воспроизводимость проверяют как для одного набора, так и для наборов одной серии и наборов разных серий. Значение коэффициента вариации определяют по формуле (8).
Коэффициент вариации не должен быть более указанного в нормативной документации на наборы конкретного вида.
Допустимый разброс результатов при параллельных определениях одной пробы разными наборами одной серии
Для определения разброса результатов можно использовать аттестованные контрольные сыворотки (плазмы) с низкой, средней или высокой концентрацией анализируемого вещества (активностью фермента), контрольные лабораторные растворы с известной концентрацией анализируемого вещества (активностью ферментов) или образцы биоматериала человека с гарантированно документированной точной концентрацией определяемого вещества (активностью фермента).
Тест проводят в восьми-десяти повторностях по каждому отдельному набору с использованием реагентов и калибратора соответствующего набора. Концентрацию анализируемого вещества (активность фермента) определяют по формуле (10). Разброс результатов, %, при параллельных определениях одной пробы разными наборами одной серии вычисляют по формулам:
![]() (между наборами N 1 и 2);
(между наборами N 1 и 2);
![]() (между наборами N 1 и 3); (15)
(между наборами N 1 и 3); (15)
![]() (между наборами N 2 и 3),
(между наборами N 2 и 3),
где ,
и
- средние арифметические значения концентрации анализируемого вещества (активности фермента), полученные при использовании наборов N 1, 2 и 3 соответственно.
Допустимый разброс не должен быть более указанного в нормативной документации на наборы конкретного вида.
Оптическая плотность цветообразующего раствора
Этот тест используют при экспериментальной проверке качества наборов, принцип определения которых основан на образовании окрашенного соединения, подвергаемого фотометрированию.
При выполнении этого теста (в пяти-семи повторностях) измеряют цветообразующего раствора в соответствии с инструкцией по применению набора. Среднее арифметическое значение
определяют по формуле (9).
Значение не должно превышать значения, указанного в нормативной документации на наборы конкретного вида.
Время достижения устойчивых значений оптической плотности при проведении цветной реакции
Этот тест используют при экспериментальной проверке качества наборов, принцип определения которых основан на образовании окрашенного соединения, подвергаемого фотометрированию.
При проведении этого теста после завершения всех процедур по определению анализируемого вещества (активности фермента), предусмотренных инструкцией по применению набора, определяют значение окрашенного продукта реакции, включают секундомер и далее измеряют значения
через равные промежутки в течение заданного времени до момента достижения постоянного значения
. Определение следует повторить не менее трех раз и рассчитать среднее арифметическое значение.
Время достижения устойчивых значений не должно быть более указанного в нормативной документации на наборы конкретного вида.
Изменение оптической плотности рабочего раствора реагентов
Этот тест используют при экспериментальной проверке качества наборов, принцип определения которых основан на кинетическом измерении уменьшения значения в неокрашенных образцах.
При проведении этого теста, характеризующего скорость автоокисления, измеряют рабочего раствора реагентов при комнатной температуре (18-25 °С) при длине волны и кювете с длиной оптического пути, предусмотренных инструкцией по применению набора, сразу после приготовления указанного раствора и три раза с интервалом в 30 мин. Определяют среднее арифметическое значение уменьшения
в час при комнатной температуре.
Значение изменения не должно превышать значения, указанного в нормативной документации на наборы конкретного вида.
Межфлаконная вариация
В том случае, если в состав набора включены компоненты с одинаковым содержанием анализируемого вещества (например, 3 флакона контрольного образца анализируемого вещества или 3 флакона контрольной сыворотки), необходимо определить межфлаконную вариацию содержания анализируемого вещества с использованием адекватной методики количественного определения исследуемого вещества (активности фермента). Определение проводят в пяти-семи повторностях в каждом флаконе для каждого анализируемого вещества (активности фермента), после чего рассчитывают средние арифметические значения для каждого флакона по каждому определяемому соединению.
Значение межфлаконной вариации по каждому определяемому соединению не должно превышать значения, указанного в нормативной документации на наборы конкретного вида.
Описанные выше методы экспериментальной проверки качества наборов для фотометрического анализа относятся к наборам для выполнения количественных анализов (исследований).
При проверке качества наборов для качественного или полуколичественного анализа (это, как правило, наборы индикаторных полосок) используют следующие показатели: чувствительность сенсорного элемента индикаторных полосок; время достижения стабильной окраски сенсорного элемента; правильность определения анализируемого вещества; помехоустойчивость определения анализируемого вещества к наличию других интерферирующих соединений. Для проведения тестов используют контрольные лабораторные растворы с различными известными концентрациями исследуемого вещества, а также контрольные лабораторные растворы, содержащие известные концентрации исследуемого вещества и интерферирующих соединений. Сравнивают окраску сенсорного элемента индикаторных полосок с полями цветовой шкалы, соответствующими определенному содержанию анализируемого вещества.
4.2.4 Наборы для коагулометрического анализа
Наборы для коагулометрического анализа используют для определения различных параметров свертывающей, противосвертывающей и фибринолитической систем.
Экспериментальная проверка качества этих наборов включает в себя определение следующих показателей: растворимость компонентов, количественное определение анализируемого параметра, отклонение значений анализируемого параметра от аттестованного значения этого показателя, чувствительность, "открытие", "линейность", коэффициент вариации, допустимый разброс результатов при параллельных определениях одной пробы разными наборами одной серии.
Для проведения этих тестов используют контрольные лабораторные растворы с известным значением исследуемого параметра и контрольную плазму с аттестованным значением в нормальной области. Определение проводят в трех-пяти повторностях. Расчетные формулы в основном не отличаются от таковых, применяемых при экспериментальной проверке качества наборов для фотометрического анализа.
Значения определяемых параметров системы гемостаза не должны превышать по каждому анализируемому параметру значений, указанных в нормативной документации на наборы конкретного вида.
УДК 616-071.3:006.354 | ОКС 11.100 | Р24 | ОКСТУ 9398 |
Ключевые слова: наборы реагентов, клиническая лабораторная диагностика, исследования in vitro, методы испытаний | |||
Электронный текст документа
и сверен по:
М.: ИПК Издательство стандартов, 2000
